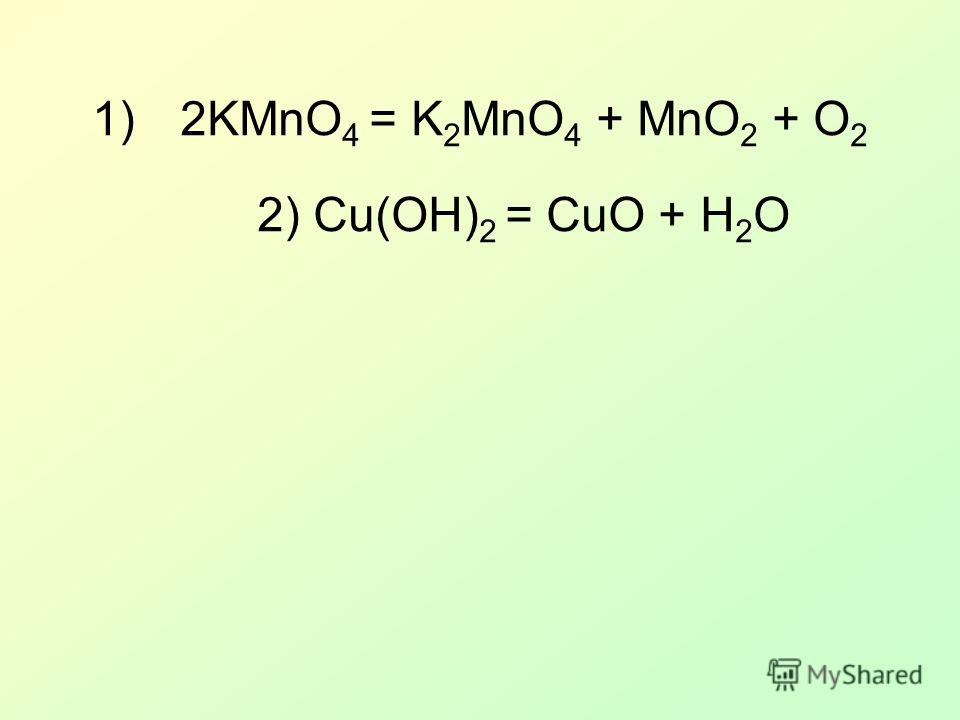Помогите, пожалуйста, расписать цепочку превращений Cu(OH)2 →CuO→CuSO4
Василиса
Химия
Андрей
Химия
Привет! Могу помочь с составлением уравнений:
Cu(OH)2 (t) = CuO + h3O;
CuO + h3SO4= CuSO4 + h3O;
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4;
Cu(OH)2 + 2HCl = 2h3O + CuCl2.

Маргарита
Химия
Здравствуйте! Гидроксид меди (I) – это неорганическое вещество, желтого цвета и не растворимое в воде. Он является, небезопасным, как и остальное большинство соединений меди. Получить можно путем взаимодействия хлорида меди (I) и щелочи, при низкой температуре:
CuCl + KOH → CuOH + KCl
Что касается гидроксида меди (II) – то это голубое кристаллическое вещество, которое практически нерастворимо в воде.
Его можно получить путем воздействия на холоде растворимых гидроксидов на растворимые соли, например:
Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3;
CuSO4 +2KOH →Cu(OH)2 + K2SO4.
Роджер
Химия
Здравствуйте! Гидроксид меди (I) участвует в следующих реакциях:
Разлагается при постепенном нагревании или кипячении: 2CuOH→Cu2O +h3O;
Растворяется в аммиаке, с образованием синего раствора:
CuOH + xNh4 × h3O → Cu(Nh4)x(OH)+ xh3O.

Получение и химические реакции меди
Нахождение в природе.
Медь встречается главным образом в виде сульфидных соединений. Наиболее важные минералы — медный блеск Cu2S, медный колчедан (халькопирит) CuFeS2 и борнит Cu3FeS2 входят в состав так называемых полиметаллических сульфидных руд. Реже встречаются кислородсодержащие соединения: малахит (основной карбонат меди) СuСО3 • Сu(ОН)2, азурит 2СuСО3 • Сu(ОН)2 и куприт СuO2.
Физические свойства.
Медь — металл красного цвета, плавится при температуре 1083°С, кипит при 2877°С. Чистая медь довольно мягка, легко поддается прокатке и вытягиванию. Примеси увеличивают твердость меди. Медь отличается очень высокой электро- и теплопроводностью. Примеси мышьяка и сурьмы значительно уменьшают электропроводность меди.
Химические свойства.
Медь относится к числу малоактивных металлов. На холоду она очень слабо взаимодействует с кислородом воздуха, покрываясь пленкой оксида, которая препятствует дальнейшему окислению меди. При нагревании медь окисляется полностью:
2Cu + O2 = 2СuО
Сухой хлор на холоду не взаимодействует с медью, однако в присутствии влаги реакция проходит довольно энергично:
Сu + Сl2 = СuС12.
При нагревании медь довольно энергично взаимодействует с серой:
Си + S = CuS.
Медь может растворятся только в кислотах-окислителях. В концентрированной серной кислоте она растворяется только при нагреваний, a в азотной — и на холоду:
Сu+ 2H2SO4 = CuSO4 + SO2 + 2Н2O,
ЗСu + 8HNO3(Разбавл.) = 3Cu(NO3)2 + 2NO + 4Н2O,
Сu + 4HNO3(Конц .) = Cu(NO3)2+ 2NO + 2Н2O.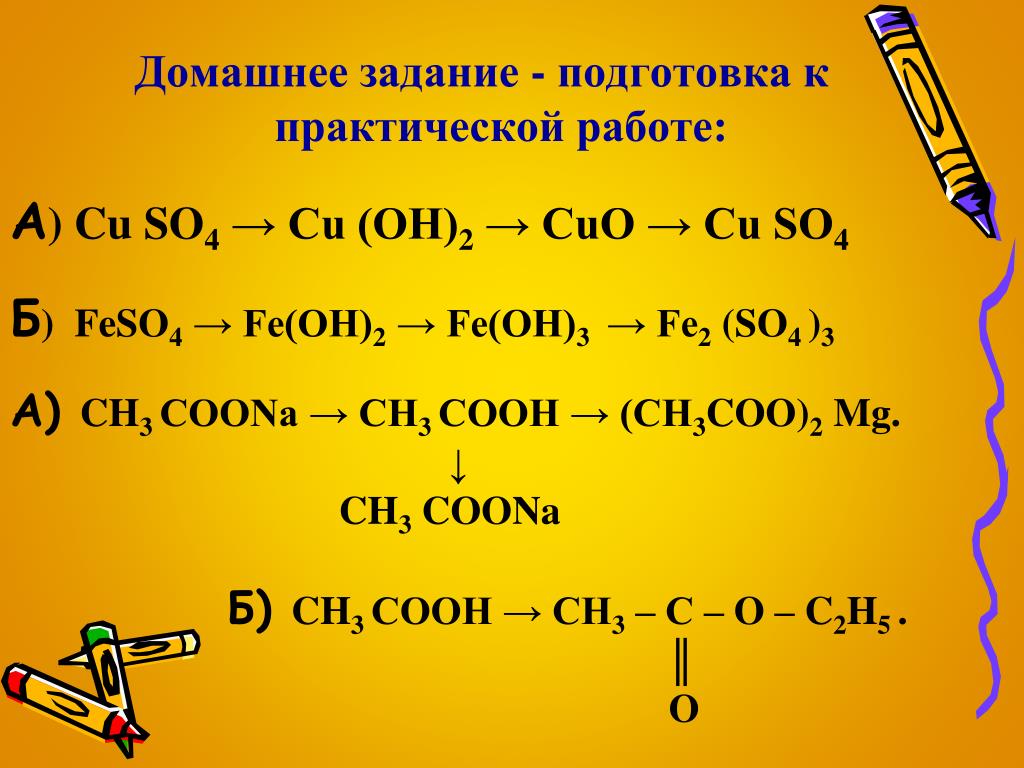
Получение.
Процесс получения меди состоит из нескольких стадий. Сначала сульфидную руду обжигают. При этом часть меди превращается в оксид:
4CuFeS2 + 13O2 = 4CuO + 2Fe203 + 8SO2.
Затем проводят плавку на штейн и получают сульфид меди (I). При этом к огарку прибавляют кокс и песок для образования шлака:
2CuO + FeS + С + SiO2 = Cu2S + FeSi03 + СО
или
CuO + FeO + CuS + С + SiO 2 = Cu2S + FeSiO3+ CO.
Далее штейн подвергают конвертерной плавке:
9Cu2 S + 3O2 = 2Cu2 O + 2SO2 ,
2CuO2 + Cu2 S = 6Cu + SO2 .
Получаемая медь называется черновой.
Очищают медь рафинированием. Электролитом служит раствор сульфата меди, анодом — медные болванки ,катодом — пластинка чистой меди. При пропускании электрического тока через электролит медь анода растворяется, а на катоде выделяется чистая медь.
Оксид меди
Обладает основными свойствами. Он может взаимодействовать с кислотами и кислотными оксидами:
CuO + H2SО4 = CuSО4 + Н2О,
CuO + SО3 = CuSО4.
Оксид меди не растворим в воде. При нагревании оксида меди и присутствии восстановителя довольно легко происходит его восстановление:
CuO + Н2 = Сu + Н2O,
СuО + СО = Сu + СO2.
Оксид меди получают окислением меди при нагревании или прокаливанием гидроксида меди:
2Сu + O2 = 2СuО,
Cu(OH)2 = CuO + Н2O.
Оксид меди встречается в природе в продуктах выветривания некоторых медных руд. Он используется в производстве стекла и эмалей как зеленый и синий красители (медно-рубиновое стекло), как окислитель в органическом анализе и в медицине.
Гидроксид меди
Гидроксид меди Сu(ОН)2. Выпадает в виде осадка при действии на растворы солей меди (II) растворов щелочей (но не аммиака):
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4.
При действии аммиака на соли меди (II) сначала выпадает гидроксид меди, который очень легко растворяется в избытке аммиака с образованием аммиаката меди:
Cu(OH)2 + 4NH4OH = [Cu(NH3)4](OH)2 + 4Н2O
или
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2.
Аммиакат меди окрашен в интенсивный сине-фиолетовый цвет, Поэтому он позволяет обнаружить малые количества ионов меди (П) в растворе. Эта реакция применяется в аналитической химии.
Гидроксид меди обладает очень слабо выраженными амфотерными свойствами. В кислотах он растворяется легко, в концентрированных растворах щелочей — с большим трудом. В первом случае образуются соли меди, во втором — гидроксокупраты:
Сu(ОH)2 + 2NaOH = Na2[Cu(OH)4].
Гидроксид меди может восстанавливаться до гемиоксида меди при нагревании С различными не очень сильными восстановителями: альдегидами, сахарами, гидразином, гидроксиламином и др. :
:
2Cu(OH)2 + R—СНО → Cu2O + R—COOH + 2H2O.
Гемиоксид, или оксид меди (I)
Гемиоксид, или оксид меди (I), Си20. Обладает только основными свойствами. Часть солей меди (I) хорошо растворима, но довольно неустойчива и легко окисляется кислородом воздуха. Устойчивыми соединениями меди (I) являются, как правило, либо нерастворимые соединения (Cu2S, Cu2O, Cu2I2), либо комплексные соединения (Cu(NH3)+2 и др.). Гемиоксид меди применяется для изготовления купроксных выпрямителей переменного тока.
При растворении гемиоксида меди в кислородсодержащих кислотах, например серной, образуются соли меди (II) и медь:
Cu2O + H2SO4 = CuSO4 + Сu + Н2O,
а при растворении в галогеноводородных кислотах — соли меди (I):
Cu20 + 2НС1 = 2СuС1 + Н2O.
Многие соли меди (II) хорошо растворимы в воде, но подвержены гидролизу, поэтому в растворе всегда должен быть небольшой избыток кислоты.
Под действием восстановителей соли меди (II) в кислом растворе могут восстанавливаться до солей меди (I):
2CuSO4 + 4KI = 2K2SO4 + Cu2I2 + I2
Аммиачные растворы солей меди (I) могут взаимодействовать с ацетиленом, образуя ацетиленид меди;
СН≡СН + 2CuCl = Cu2C2 + 2НС1.
Литература [3]
Рассчитайте массу Cu(OH)2, оставшуюся после неполного нагревания, в г?
Химия Моль Стехиометрия
Вопрос задан 02.05.2012,07 г CuSO4*5h3O вводят в реакцию с достаточным количеством NaOH для полного осаждения Cu(OH)2. Cu(OH)2 нагревается недостаточно долго, поэтому ровно 35,27% Cu(OH)2 превращается в CuO.
Сколько Cu(OH)2 осталось после прослушивания??
, если кто-нибудь может помочь объяснить или помочь мне начать решение этой проблемы?
Подписаться І 1
Подробнее
Отчет
1 ответ эксперта
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
Айрин Л. ответил 03.05.20
ответил 03.05.20
Репетитор
5,0 (140)
Калифорнийский университет в Лос-Анджелесе, доктор философии. в Стэнфорде для репетиторов по химии
Смотрите таких репетиторов
Смотрите таких репетиторов
Этот вопрос состоит из нескольких частей, так что давайте разберем его.
Сначала задача говорит вам, что CuSO4*5h3O реагирует с NaOH до тех пор, пока весь сульфат меди не выпадет в осадок в Cu(OH)2. Это означает, что лимитирующим реагентом должен быть сульфат меди, а если мы найдем моли сульфата меди, то это будут моли Cu(OH)2. Итак, чтобы найти количество молей из приведенной информации (12,07 г), нам нужно вычислить молярную массу.
Cu = 63,55, S = 32,06, 4O = 4(16,00), 10H = 10(1,01), 5O = 5(16,00). Общая молярная масса составляет 249,71 г/моль.
Теперь, чтобы найти количество молей, разделите 12,07 г на 249,71 г/моль.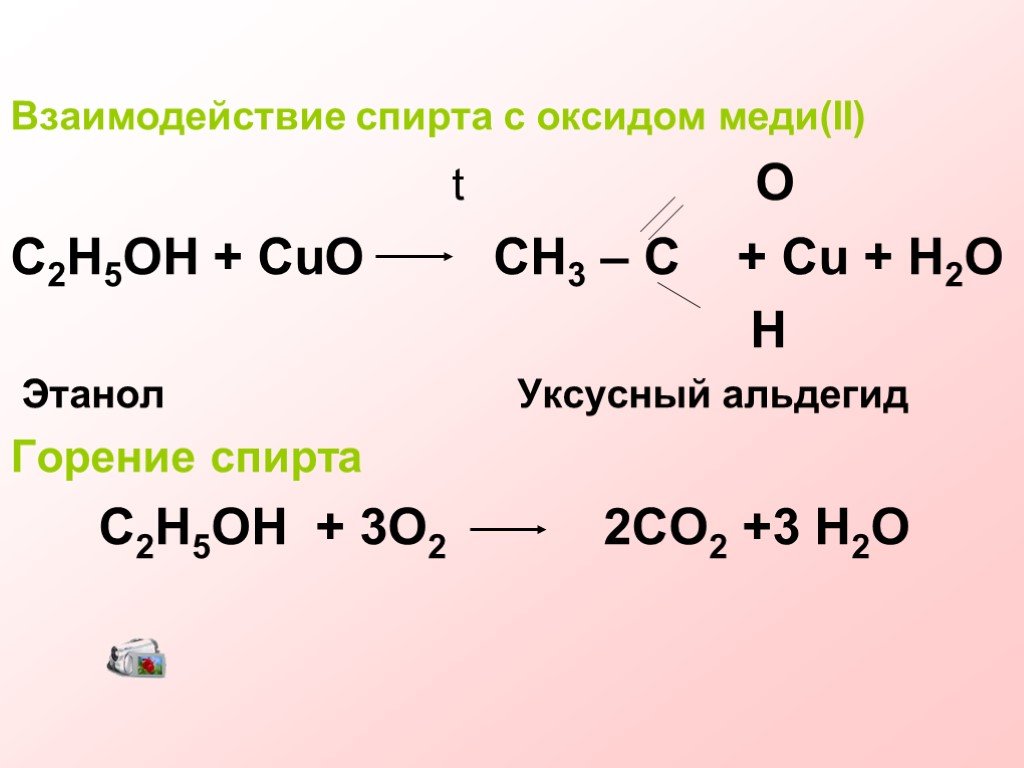 Это отменит граммы и оставит моли наверху, что является единицей, которую мы хотим. 12,07/249,71 = 0,04834 моль. Поскольку соотношение CuSO4 и Cu(OH)2 должно быть один к одному, вычисленное нами значение также является числом молей Cu(OH)2.
Это отменит граммы и оставит моли наверху, что является единицей, которую мы хотим. 12,07/249,71 = 0,04834 моль. Поскольку соотношение CuSO4 и Cu(OH)2 должно быть один к одному, вычисленное нами значение также является числом молей Cu(OH)2.
Теперь задача говорит о том, что 35,27 % Cu(OH)2 превратилось в CuO, что означает, что 64,73 % остались позади или остались непрореагировавшими. Чтобы получить количество оставшихся родинок, нужно умножить десятичную дробь на количество начальных родинок. 0,04834*0,6473 = 0,03129мол. Предположительно, вопрос потребует ответа в граммах, поэтому все, что вам нужно сделать сейчас, это умножить молярную массу Cu(OH)2 на 0,03129 моль. Это отменит родинки и оставит граммы сверху.
Голосовать за 0 голос против
Подробнее
Отчет
Все еще ищете помощи? Получите правильный ответ, быстро.
Задайте вопрос бесплатно
Получите бесплатный ответ на быстрый вопрос.
Ответы на большинство вопросов в течение 4 часов.
ИЛИ
Найдите онлайн-репетитора сейчас
Выберите эксперта и встретьтесь онлайн. Никаких пакетов или подписок, платите только за то время, которое вам нужно.
Комплексы [CuO]+ и [CuOH]2+: интермедиаты в окислительном катализе?
1. Соломон Э.И., Хеппнер Д.Е., Джонстон Э.М., Гинсбах Дж.В., Сирера Дж., Кайюм М., Кибер-Эммонс М.Т., Кьяргаард К.Х., Хадт Р.Г., Тиан Л. Активные центры меди в биологии. хим. 2014; 114:3659–3853. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. (a) Ryland BL, Stahl SS. Практическое аэробное окисление спиртов и аминов гомогенными системами медь/TEMPO и родственными каталитическими системами. Ангью. хим., межд. Эд. 2014; 53:8824–8838. [Бесплатная статья PMC] [PubMed] [Google Scholar] (b) Вендландт А. Е., Зюсс А.М., Шталь СС. Катализируемая медью аэробная окислительная функционализация C-H: тенденции и понимание механизмов. Ангью. хим., межд. Эд. 2011;50:11062–11087. [PubMed] [Google Scholar] (c) Диас-Рекехо М.М., Перес П.Дж. Чеканка металлов, катализируемая функционализацией углеводородов связью C – H. хим. 2008; 108:3379–3394. [PubMed] [Google Scholar]
Е., Зюсс А.М., Шталь СС. Катализируемая медью аэробная окислительная функционализация C-H: тенденции и понимание механизмов. Ангью. хим., межд. Эд. 2011;50:11062–11087. [PubMed] [Google Scholar] (c) Диас-Рекехо М.М., Перес П.Дж. Чеканка металлов, катализируемая функционализацией углеводородов связью C – H. хим. 2008; 108:3379–3394. [PubMed] [Google Scholar]
3. (a) Mirica LM, Ottenwaelder X, Stack TDP. Строение и спектроскопия комплексов меди с кислородом. хим. 2004; 104:1013–1045. [PubMed] [Академия Google] (b) Льюис Э.А., Толман В.Б. Реакционная способность медно-кислородных систем. хим. 2004; 104:1047–1076. [PubMed] [Google Scholar] (c) Хаймс Р.А., Карлин К.Д. Оксигенация С-Н-связи, опосредованная комплексом медь-дикислород: актуальность для метанмонооксигеназы твердых частиц (pMMO) Curr. мнение хим. биол. 2009; 13:119–131. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Solomon EI, Augustine AJ, Yoon J. O 2 Восстановление до H 2 O оксидазами мультимеди. Далтон Транс. 2008:3921–3932. [Бесплатная статья PMC] [PubMed] [Google Scholar]
O 2 Восстановление до H 2 O оксидазами мультимеди. Далтон Транс. 2008:3921–3932. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. (a) Cramer CJ, Tolman WB. Моноядерный Cu-O 2 Комплексы: геометрия, спектроскопические свойства, электронная структура и реакционная способность. Акк. хим. Рез. 2007; 40: 601–608. [Бесплатная статья PMC] [PubMed] [Google Scholar] (b) Ginsbach JW, Peterson RL, Cowley RE, Karlin KD, Solomon EI. Корреляция электронного и геометрического строения моноядерных комплексов супероксида меди (RIII). неорг. хим. 2013;52:12872–12874. [Бесплатная статья PMC] [PubMed] [Google Scholar] (c) Kim S, Lee JY, Cowley RE, Ginsbach JW, Siegler MA, Solomon EI, Karlin KD. AN 3 S (тиоэфир) — Лигированный Cu II — Супероксо с повышенной реакционной способностью. Варенье. хим. соц. 2015;137:2796–2799. и ссылки в нем. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Klinman JP. Механизмы, посредством которых мононуклеарные белки меди функционализируют органические субстраты. хим. Ред. 1996; 96: 2541–2561. [PubMed] [Google Scholar]
Klinman JP. Механизмы, посредством которых мононуклеарные белки меди функционализируют органические субстраты. хим. Ред. 1996; 96: 2541–2561. [PubMed] [Google Scholar]
7. Петерсон Р.Л., Хаймс Р.А., Котани Х., Суэнобу Т., Тиан Л., Зиглер М.А., Соломон Э.И., Фукузуми С., Карлин К.Д. Медная супероксо-опосредованная межмолекулярная химия активации C – H. Варенье. хим. соц. 2011; 133:1702–1705. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Баласубраманян Р., Розенцвейг А. Структурное и механистическое понимание окисления метана монооксигеназой метана в виде твердых частиц. Акк. хим. Рез. 2007; 40: 573–580. [PubMed] [Google Scholar]
9. (a) Sono M, Roach MP, Dawson JH. Гемсодержащие оксигеназы. хим. Ред. 1996; 96: 2841–2887. [PubMed] [Google Scholar] (b) Абу-Омар М.М., Лоайза А., Хонцеас Н. Механизмы реакции мононуклеарных негемовых железооксигеназ. хим. 2005; 105:2227–2252. [PubMed] [Академия Google] (c) Костас М. , Мен М.П., Дженсен М.П., Куэ Л., мл. Активация кислородом в активных сайтах мононуклеарного негемового железа: ферменты, модели и промежуточные соединения. хим. 2004; 104:939–986. [PubMed] [Google Scholar] (d) Кребс С., Галоник Д.Ф., Фухимори Д., Уолш С., Боллинджер Дж. Негемовые Fe(IV)-оксо-промежуточные соединения. Акк. хим. Рез. 2007; 40:484–492. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Мен М.П., Дженсен М.П., Куэ Л., мл. Активация кислородом в активных сайтах мононуклеарного негемового железа: ферменты, модели и промежуточные соединения. хим. 2004; 104:939–986. [PubMed] [Google Scholar] (d) Кребс С., Галоник Д.Ф., Фухимори Д., Уолш С., Боллинджер Дж. Негемовые Fe(IV)-оксо-промежуточные соединения. Акк. хим. Рез. 2007; 40:484–492. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. McDonald AR, Que L., Jr Высоковалентные негемовые комплексы железо-оксо: синтез, структура и спектроскопия. Координ. хим. 2013; 257:414–428. [Академия Google]
11. Наглядные примеры:
Reinaud O, Capdevielle P, Maumy M. CoppeRII) опосредованное ароматическое гидроксилирование N-оксидом триметиламина. Дж. Хим. соц., хим. коммун. 1990: 566–568. [Google ученый]
Блейн И., Джорджи М., Ригги И.Д., Реглие М. Подход, связывающий субстрат с лигандом, в химическом моделировании медьсодержащих монооксигеназ, 1. Внутримолекулярное стереоселективное внедрение атома кислорода в неактивированную связь С–Н. Евро. Дж. Неорг. хим. 2000: 393–398. [Google ученый]
Кунишита А., Ишимару Х., Накашима С., Огура Т., Ито С. Реакционная способность мононуклеарного комплекса алкилпероксо-меди (RII). Расщепление связи O–O и активация связи C–H. Варенье. хим. соц. 2008; 130:4244–4245. [PubMed] [Академия Google]
Майти Д., Ли Д.Х., Гаутченова К., Вюртеле С., Хольтхаузен М.С., Сарджант А.А.Н., Сандермейер Дж., Шиндлер С., Карлин К.Д. Реакции комплекса CoppeRII) Superoxo приводят к оксигенации субстрата C-H и O-H: моделирование гидроксилирования CH-монооксигеназы меди. Ангью. хим., межд. Эд. 2008; 47:82–85. [PubMed] [Академия Google]
Майти Д., Нардуччи Сарджант А.А., Карлин К.Д. Медь-гидропероксо-опосредованная химия N-дебензилирования, имитирующая аспекты монооксигеназ меди. неорг. хим. 2008; 47: 8736–8747. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Евро. Дж. Неорг. хим. 2000: 393–398. [Google ученый]
Кунишита А., Ишимару Х., Накашима С., Огура Т., Ито С. Реакционная способность мононуклеарного комплекса алкилпероксо-меди (RII). Расщепление связи O–O и активация связи C–H. Варенье. хим. соц. 2008; 130:4244–4245. [PubMed] [Академия Google]
Майти Д., Ли Д.Х., Гаутченова К., Вюртеле С., Хольтхаузен М.С., Сарджант А.А.Н., Сандермейер Дж., Шиндлер С., Карлин К.Д. Реакции комплекса CoppeRII) Superoxo приводят к оксигенации субстрата C-H и O-H: моделирование гидроксилирования CH-монооксигеназы меди. Ангью. хим., межд. Эд. 2008; 47:82–85. [PubMed] [Академия Google]
Майти Д., Нардуччи Сарджант А.А., Карлин К.Д. Медь-гидропероксо-опосредованная химия N-дебензилирования, имитирующая аспекты монооксигеназ меди. неорг. хим. 2008; 47: 8736–8747. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. (a) Dietl N, van der Linde C, Schlangen M, Beyer MK, Schwarz H. Двухатомный [CuO] + и его роль в спин-селективных переносах атомов водорода и кислорода в Термическая активация метана. Ангью. хим., межд. Эд. 2011;50:4966–4969. [PubMed] [Google Scholar] (b) Schröder D, Holthausen MC, Schwarz H. Радикальная активация алканов лигированным катионом оксида меди (фенантролин) CuO + J. Phys. хим. Б. 2004; 108:14407–14416. [Академия Google]
Ангью. хим., межд. Эд. 2011;50:4966–4969. [PubMed] [Google Scholar] (b) Schröder D, Holthausen MC, Schwarz H. Радикальная активация алканов лигированным катионом оксида меди (фенантролин) CuO + J. Phys. хим. Б. 2004; 108:14407–14416. [Академия Google]
13. Yoshizawa K, Kihara N, Kamachi T, Shiota Y. Каталитический механизм дофамин-β-монооксигеназы, опосредованный Cu(III)-оксо. неорг. хим. 2006;45:3034–3041. [PubMed] [Google Scholar]
14. (a) Декер А., Соломон Э.И. Активация кислорода ферментами меди, гема и негема железа: сравнение электронных структур и реакционной способности. Курс. мнение хим. биол. 2005; 9: 152–163. [PubMed] [Google Scholar] (b) Креспо А., Марти М.А., Ройтберг А.Е., Амзель Л.М., Эстрин Д.А. Каталитический механизм пептидилглицин-α-гидроксилирующей монооксигеназы, исследованный с помощью компьютерного моделирования. Варенье. хим. соц. 2006; 128:12817–12828. [PubMed] [Академия Google]
15. Ким С., Стольберг Дж., Сандгрен М. Квантово-механические расчеты предполагают, что литические полисахаридмонооксигеназы используют медь-оксил, механизм отскока кислорода. проц. Натл. акад. науч. США 2014;111:149–154. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ким С., Стольберг Дж., Сандгрен М. Квантово-механические расчеты предполагают, что литические полисахаридмонооксигеназы используют медь-оксил, механизм отскока кислорода. проц. Натл. акад. науч. США 2014;111:149–154. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Гупта А., Толман В.Б. Химия меди / α-кетокарбоксилата с пералкилированными диаминами на носителе: реакционная способность комплексов меди (RI) и промежуточных соединений меди и кислорода. неорг. хим. 2010;49:3531–3539. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. (a) Махадеван В., Дюбуа Дж.Л., Хедман Б., Ходжсон К.О., Stack TDP. Экзогенная реактивность субстрата с ядром [Cu(III) 2 O 2 ] 2+ : структурные последствия. Варенье. хим. соц. 1999; 121:5583–5584. [Google Scholar] (b) Махадеван В., Хенсон М.Дж., Соломон Э.И., Stack TDP. Дифференциальная реакционная способность между взаимопревращающимися пероксо- и бис-μ-оксодимедными изомерами с использованием пералкилированных диаминовых лигандов. Варенье. хим. соц. 2000;122:10249–10250. [Академия Google]
Варенье. хим. соц. 2000;122:10249–10250. [Академия Google]
18. Хонг С., Хубер С.М., Гальярди Л., Крамер К.С., Толман В.Б. МедьRI)-α-кетокарбоксилатные комплексы: характеристика и реакции O 2 с образованием промежуточных медь-кислородных соединений, способных гидроксилировать арены. Варенье. хим. соц. 2007; 129:14190–14192. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Хубер С.М., Эртем М.З., Аквиланте Ф., Гальярди Л., Толман В.Б., Крамер С.Дж. Получение соединений Cu II -Оксил/Cu III -Оксо из Cu I -α-кетокарбоксилатных комплексов и O 2 : Исследования in silico эффектов лиганда и реакционной способности CH-активации. Хим.—Евр. Дж. 2009; 15:4886–4895. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Comba P, Knoppe S, Martin B, Rajaraman G, Rolli C, Shapiro B, Stork T. CoppeRII)-опосредованное ароматическое орто--гидроксилирование: гибрид DFT и Ab Initio Exploration. Хим.—Евр. Дж. 2008; 14:344–357. [PubMed] [Google Scholar]
Дж. 2008; 14:344–357. [PubMed] [Google Scholar]
21. Хонг С., Гупта А.К., Толман В.Б. Интермедиаты в реакциях комплексов меди с N-оксидами: от образования устойчивых аддуктов к оксопереносу. неорг. хим. 2009 г.;48:6323–6325. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Spencer DJE, Aboelella NW, Reynolds AM, Holland PL, Tolman WB. Структурные эффекты основной цепи β-дикетимината-лиганда на Cu(I)/O 2 Реакционная способность: уникальные комплексы медь-супероксо и бис(μ-оксо). Варенье. хим. соц. 2002; 124:2108–2809. [PubMed] [Google Scholar]
23. (a) Левасон В., доктор медицины, Спайсер, доктор медицины. Химия меди и серебра в их высших степенях окисления. Координ. хим. 1987; 76:45–120. [Академия Google] (b) Anson FC, Collins TJ, Richmond TG, Santarsiero BD, Toth JE, Treco BGRT. Высокостабилизированные комплексы меди (RIII). Варенье. хим. соц. 1987; 109: 2974–2979. [Google Scholar]
24. Huang D, Holm RH. Реакции концевой группы Ni II -ОН в замещении и электрофильные реакции с углекислым газом и другими субстратами: структурное определение мод связывания во внутримолекулярном сайте Ni II ⋯ Fe II . Варенье. хим. соц. 2010; 132:4693–4701. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Реакции концевой группы Ni II -ОН в замещении и электрофильные реакции с углекислым газом и другими субстратами: структурное определение мод связывания во внутримолекулярном сайте Ni II ⋯ Fe II . Варенье. хим. соц. 2010; 132:4693–4701. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Донохью П.Дж., Тегеранчи Дж., Крамер К.Дж., Саранджи Р., Соломон Э.И., Толман В.Б. Быстрая активация связи C–H комплексом мономедь(III)–гидроксид. Варенье. хим. соц. 2011; 133:17602–17605. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Tehranchi J, Donoghue PJ, Cramer CJ, Tolman WB. Реакционная способность комплексов (дикарбоксамид)M II -OH (M = Cu, Ni). Реакция с ацетонитрилом с образованием M II -цианометидов. Евро. Дж. Неорг. хим. 2013; 2013: 4077–4084. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Xue G, Geng C, Ye S, Fiedler A, Neese F, Que L., Jr Влияние водородных связей на реакционную способность X-Fe III -O-Fe IV =O комплексов по отношению к C– Расщепление Н-связи. неорг. хим. 2013;52:3976–3984. [Бесплатная статья PMC] [PubMed] [Google Scholar]
неорг. хим. 2013;52:3976–3984. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Кунду С., Ван Кирк Томпсон Дж., Шен Л.К., Миллс М.Р., Броминаар Э.Л., Рябов А.Д., Коллинз Т.Дж. Активационные параметры как механистические зонды в TAML железо(V)-оксо окислении углеводородов. Хим.—Евр. Дж. 2015; 21:1803–1810. [PubMed] [Академия Google]
29. Уоррен Дж.Дж., Троник Т.А., Майер Дж.М. Термохимия реагентов переноса электрона с протонной связью и ее значение. хим. 2010; 110:6961–7001. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Dhar D, Tolman WB. Отщепление атома водорода от углеводородов комплексом меди (RIII)-гидроксид. Варенье. хим. соц. 2015; 137:1322–1329. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Баррон Д., Барбоза Дж. Кислотно-основное поведение замещенных фенольных веществ и разрешение кислотной силы в тетрагидрофуране. Аналитик. Чим. Акта. 2000;403:339–347. [Google Scholar]
32. Yosca TH, Rittle J, Krest CM, Onderko EL, Silakov A, Calixto JC, Behan RK, Green MT. Гидроксид железа (IV) pKa и роль лигирования тиолатов в активации связи CH цитохромом P450. Наука. 2013; 342: 825–829. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Гидроксид железа (IV) pKa и роль лигирования тиолатов в активации связи CH цитохромом P450. Наука. 2013; 342: 825–829. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Wang X, Ullrich R, Hofrichter M, Groves JT. Гем-тиолат феррил ароматической пероксигеназы является основным и реактивным. проц. Натл. акад. науч. США 2015;112:3686–3691. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Прокоп К.А., де Виссер С.П., Гольдберг Д.П. Беспрецедентное повышение скорости переноса атома водорода на комплекс марганец(V)-оксокорролазин. Ангью. хим., межд. Эд. 2010;49:5091–5095. [PubMed] [Google Scholar]
35. (а) Боровик А.С. Роль комплексов металл–оксо в разрыве связей С–Н. хим. соц. 2011; 40:1870–1874. [Бесплатная статья PMC] [PubMed] [Google Scholar] (b) Боровик А. Мотивы биоинспирированных водородных связей в дизайне лигандов: роль нековалентных взаимодействий в активации кислорода, опосредованной ионами металлов. Акк. хим.