физические и химические свойства, получение и история открытия
Фосфин (Ph4)
Способы получения фосфина
Прямым синтезом Ph4 получить нельзя.
- Фосфин получают путем водного или кислотного гидролиза фосфидов:
Ca3P2 + 6h3O → 3Са(ОН)2 + 2Ph4↑
Mg3P2 + 6HCl → 3MgCl2 + 2Ph4↑
- Реакция диспропорционирования фосфора в щелочах:
4P + 3KOH + 3h3O → 3Kh3PO2 + Ph4↑
- Разложение солей фосфония (Температура выше 80ºС):
P4I ↔ HI+ Ph4↑
Физические свойства фосфина
При нормальной температуре фосфин является бесцветным газом с резким чесночным запахом. В воде малорастворим, хорошо растворим в органических растворителях
Фосфин — Яд!
Химические свойства фосфина
- PH3не реагирует с водой, щелочами, аммиаком.

Ph4— Проявляет свойства сильного восстановителя.
- Вступает в реакции с кислотами – окислителями:
Ph4 + 8h3SO4(конц) = h4PO4 + 8SO2↑ + 3h3O
Ph4 + 8HNO3(конц. гор) = h4PO4 + 8NO2↑ + 4h3O
- С безводными кислотами образует соли:
HI+ Ph4↑ = P4I
- Окисляется кислородом. При Т ~ 150ºС самовозгорается:
РН3 + 2О2 = P2O5 + h3O (Н3РО4)
Практического значения фосфин не имеет.
Фосфиды
Способы получения
Взаимодействие фосфора с металлами:
2P + 3Mg → Mg3P2
2P + 3Ca → Ca3P2
P + 3Na → Na3P
Физические свойства, строение фосфидов
Фосфиды – представляют собой продукты взаимодействия фосфора с металлами.
Фосфиды щелочных и щелочноземельных металлов имеют ионное строение.
Химические свойства фосфидов
Фосфиды крайне неустойчивы и легко подвергаются необратимому гидролизу с образованием РН3:
Ca3P2 + 6h3O → 3Са(ОН)2 + 2Ph4↑
Mg3P2 + 6HCl → 3MgCl2 + 2Ph4↑
Оксид фосфора (III), триоксид фосфора (P2O3)
Способы получения оксида фосфора (III)
- Р2О3 образуется при горении фосфора в недостатке кислорода или его медленном окислении:
4Р + 3О2 = 2Р2О3
Физические свойства оксида фосфора (III)
При комнатной температуре Р2О3 — белая воскообразная масса с неприятным запахом. Легко испаряется, его Тпл = 23,5°С
Легко испаряется, его Тпл = 23,5°С
Пары существует в виде димеров Р4О6.
!Очень ядовит
Химические свойства оксида фосфора (III)
- Р2О3 как кислотный оксид при взаимодействии с водой образует фосфористую кислоту:
Р2О3 + ЗН2О =2h4PO3
- Реакция диспропорционирования происходит очень бурно при растворении Р2О3вгорячей воде:
2Р2О3 + 6Н2О = РН3 + Зh4PO4
- При взаимодействии Р2О3 с щелочами образуются соли фосфористой кислоты:
Р2О3 + 4NaOH = 2Na2HPO3 + Н2О
- При взаимодействии с окислителями P2O3 проявляет восстановительные свойства:
Окисление кислородом воздуха:
Р2О3 + О2 = Р2О5
Окисление галогенами:
Р2О3 + 2Cl2 + 5Н2О = 4HCl + 2h4PO4
Получение
Для получения ортофосфорной кислоты применяются в основном два метода: метод влажного травления и термальный метод. Первый метод является наиболее востребованным для синтеза больших количеств кислоты, он заключается в обработке природных фосфатов минеральными кислотами, в основном серной (азотная и соляная кислоты используются значительно реже). Получаемая таким методом кислота называется влажной фосфатной кислотой.
Первый метод является наиболее востребованным для синтеза больших количеств кислоты, он заключается в обработке природных фосфатов минеральными кислотами, в основном серной (азотная и соляная кислоты используются значительно реже). Получаемая таким методом кислота называется влажной фосфатной кислотой.
Производство кислоты с термальным методом происходит путем окисления фосфора, получаемого из фосфатов, до оксида P 4 O 10 и последующей гидратацией.
Метод влажного травления
Несмотря на то, что принцип пищеварения фосфатов был разработан еще в 1880-х годах, его активное применение началось только после окончания Второй мировой войны — в ответ на стремительный рост спроса на минеральные удобрения.
В качестве основного сырья для пищеварения применяется апатит, который является весьма распространенным минералом:
(x = 0,1 … 2,2)
Для лучшего отделения малорастворимого гидрата сульфата кальция, реакцию обычно проводят в двух температурных режимах: при 70-80 ° C осадок выделяется преимущественно в форме дигидрата CaSO 4 · 2H 2 O, а при 80-90 ° C — в форме гемигидрата CaSO 4 · 0 , 5H 2 O. Вне этих температурных диапазонов осаждения происходит неэффективно.
Вне этих температурных диапазонов осаждения происходит неэффективно.
Дигидратний процесс
Для проведения осаждения за дигидратним методом выходной фосфат размалывают до размера частиц в 150 мкм (не менее 75% гранулометрического состава). Концентрация конечного раствора кислоту варьируется в пределах 28-31% P 2 O 5.
Дигидратний процесс имеет большее применение, поскольку проводится по меньшей температуры, помогает снизить износ оборудования и коррозионные процессы. Также процесс позволяет использование в пищеварении большего количества фосфатных пород. К недостаткам этого способа относят сравнительно невысокую концентрацию раствора кислоты и относительно большие потери оксида (до 4-6%).
Гемигидратний процесс
Гемигидратний процесс значительно дороже в производстве, но позволяет получать растворы с концентрацией 40-50% P 2 O 5. В основном гемигидратний процесс проводится в комплексе с дигидратним. Один из первых Двухстадийная процессов был разработан в Японии, где остро стоял вопрос получения сверхчистого сульфата кальция для производства строительных материалов (в Японии отсутствуют природные залежи гипса).
В зависимости от порядка проведения осаждения за дигидратним (ДГ) и гемигидратним (ГГ) методами, различают:
- ГГ процесс:
концентрация конечного раствора — 40-48% P 2 O 5 одностадийная фильтрация осадок — CaSO 4 · 0,5H 2 O (с примесями)
- ГГ / ДГ процесс без промежуточной фильтрации:
концентрация конечного раствора — 30-32% P 2 O 5 одностадийная фильтрация осадок — CaSO 4 · 2H 2 O (чистый)
- ГГ / ДГ процесс с промежуточной фильтрацией:
концентрация конечного раствора — 40-52% P 2 O 5 двухстадийная фильтрация осадок — CaSO 4 (сверхчистый)
- ДГ / ГГ процесс:
концентрация конечного раствора — 32-36% P 2 O 5 повторяющаяся фильтрация с возвращением фильтрата осадок — CaSO 4 · 0,5H 2 O (сверхчистый)
Термальный метод
Производство ортофосфорной кислоты с термальным методом проводится путем сжигания белого (желтого) фосфора в кислороде воздуха и последующим растворением в воде:
Процесс IG
По методу окисления проводится в цилиндрических реакторах, в которых сверху впрыскивается смесь кислорода и атомизованого фосфора, а внизу находится вода для поглощения образованного оксида. Поскольку сжигание фосфора происходит с большим тепловым эффектом (достигается температура свыше 2000 ° C), по внутренней стороне стенок реактора подается охлажденная фосфатный кислота, которая предотвращает чрезмерное влияния температуры на металл. Все детали реактора производятся из низкоуглеродистой стали или резины — эти материалы не подвергаются воздействию кислоты при температурах до 100 ° C.
Поскольку сжигание фосфора происходит с большим тепловым эффектом (достигается температура свыше 2000 ° C), по внутренней стороне стенок реактора подается охлажденная фосфатный кислота, которая предотвращает чрезмерное влияния температуры на металл. Все детали реактора производятся из низкоуглеродистой стали или резины — эти материалы не подвергаются воздействию кислоты при температурах до 100 ° C.
Концентрация конечной кислоты регулируется подачей воды для смешивания, а также охлаждением реакторов. Конечный продукт может иметь незначительную примесь фосфитнои кислоты (около 0,1%), которая образуется из полностью окисленного оксида фосфора (III).
Процесс TVA
(TVA) была предложена модификация термального метода: сожжение фосфора происходит в отдельной камере, дает больше времени на окисление. Твердые продукты окисления частично оседают на стенках и поглощают часть тепла, выделяемого в результате реакции, а также экранируют металл реактора от чрезмерного воздействия температуры.
Накопленный оксид фосфора растворяется в ортофосфорной кислоте с образованием полифосфатных кислот H n + 2P n O 3n + 1, которые имеют значительно большее содержание P 2 O 5. Так, по методу TVA получают раствор кислот с концентрацией 85% P 2 O 5, что соответствует концентрации ортофосфорной кислоты в 117%. При изготовлении камер для сжигания из графита, накопленный оксид фосфора (V) образует растворы кислот с концентрацией до 92% P 2 O 5.
Концентрирования
Концентрирования ортофосфорной кислоты до значений 40-55% P 2 O 5 видбуваетьcя путем испарения воды в вакууме при температурах около 120 ° C. Для достижения содержания оксида фосфора в 70% (суперфосфатная кислота), нагрев повышают до 200 ° C.
Оксид фосфора (V), пентаоксид фосфора, фосфорный ангидрид (Р2О5)
Способы получения фосфорного ангидрида
Сжигание фосфора в избытке воздуха:
4Р + 5О2 = 2Р2О5
Физические свойства фосфорного ангидрида
При комнатной температуре Р2О5 — белые стеклообразные хлопья без запаха. Существует в виде димеров Р4О10.
Существует в виде димеров Р4О10.
Очень гигроскопична, при соприкосновении с воздухом расплывается в сиропообразную жидкость (НРO3). Р2О5 — самое эффективное осушающее средство и водоотнимающий агент. Применяется для осушения нелетучих веществ и газов.
Химические свойства фосфорного ангидрида
Р2О5проявляет кислотные свойства.
Как кислотный оксид Р2О5 взаимодействует:
- с водой, с образованием различных кислот:
Р2О5 + Н2О = 2HPO3 метафосфорная
Р2О5 + 2Н2О = Н4Р2О7 пирофосфориая (дифосфорная)
Р2О5 + ЗН2О = 2h4PO4 ортофосфорная
- с основными оксидами, с образованием фосфатов
Р2О5 + ЗВаО = Ва3(PO4)2
- с щелочами, с образованием средних и кислых солей
Р2О5 + 6NaOH = 2Na3PO4 + ЗН2О
Р2О5 + 4NaOH = 2Na2HPO4 + Н2О
Р2О5 + 2NaOH = 2Nah3PO4 + Н2О
- Фосфорный ангидрид способен отнимать у других веществ не только гигроскопическую влагу, но и химически связанную воду.
 Например, он дегидратирует оксокислоты, что широко используется для получения ангидридов кислот:
Например, он дегидратирует оксокислоты, что широко используется для получения ангидридов кислот:
Р2О5 + 2HNО3 = 2HPO3 + N2О5
Р2О5 + 2НСlО4 = 2HPO3 + Сl2О7
P2O5 + h3SO4 → 2HPO3 + SO3
P2O5 + 2Ch4COOH → 2HPO3 + (Ch4CO)2O
Видеоопыт Взаимодействие оксида фосфора с водой
Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Ортофосфорная кислота |
| 102 | Другие названия | |
| 103 | Латинское название | |
| 104 | Английское название | |
| 105 | Химическая формула | h4PO4 |
| 106 | Тип | Неорганическое вещество |
| 107 | Группа | |
| 108 | Открыт | |
| 109 | Год открытия | |
| 110 | Внешний вид и пр. | |
| 111 | Происхождение | |
| 112 | Модификации | |
| 113 | Аллотропные модификации | |
| 114 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 115 | Конденсат Бозе-Эйнштейна | |
| 116 | Двумерные материалы | |
| 117 | Содержание в атмосфере и воздухе (по массе) | |
| 118 | Содержание в земной коре (по массе) | |
| 119 | Содержание в морях и океанах (по массе) | |
| 120 | Содержание во Вселенной и космосе (по массе) | |
| 121 | Содержание в Солнце (по массе) | |
| 122 | Содержание в метеоритах (по массе) | |
| 123 | Содержание в организме человека (по массе) | |
| 124 | Молярная масса |
Фосфористая кислота ( h4PO3)
Способы получения фосфористой кислоты
- Реакция Р2О3 с водой:
Р2О3 + ЗН2О =2h4PO3
- Гидролиз галогенидов фосфора (III):
PCl3 + ЗН2О = h4PO3+ 3HCl
- Окисление белого фосфора хлором:
2Р + 3Cl2 + 6Н2О = 2h4PO3+ 6HCl
Физические свойства, строение фосфористой кислоты
Для молекулы фосфористой кислоты h4PO3 известны 2 таутомерные формы. В одной из них 2 атома водорода молекулы связаны с кислородом, а один атом водорода связан непосредственно с атомом фосфора. Такой атом водорода не может быть замещен атомами металлов, поэтому кислота является двухосновной.
В одной из них 2 атома водорода молекулы связаны с кислородом, а один атом водорода связан непосредственно с атомом фосфора. Такой атом водорода не может быть замещен атомами металлов, поэтому кислота является двухосновной.
В другой таутомерной форме – все три атома водорода связаны с кислородом.
Формула фосфористой кислоты выглядит следующим образом: Н2[НРО3]
При комнатной температуре h4PO3 – кристаллическое вещество без цвета, хорошо растворимое в воде, Тпл = 74°С.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Химические свойства фосфористой кислоты
Является слабой кислотой.
- Для нее характерны все свойства кислот — взаимодействие с металлами с выделением Н2; с оксидами металлов и с щелочами. При этом образуются одно — или двухзамещенные фосфиты:
Н2[НРО3] + NaOH = NaH[HРО3] + Н2О
Н2[НРО3] + 2NaOH = Na2[HРО3] + 2Н2О
- Кислота является и окислителем и восстановителем, при нагревании вступая в реакции диспропорционирования:
h3HPO3 + h3HPO3 = h4PO4 + Ph4
Кислота и ее соли являются сильными восстановителями:
- Реагируют с сильными окислителями:
h4PO3 + Cl2 + Н2О = h4PO4 + 2HCl
5h4PO3 + 2KMnO4 + 3h3SO4 → 5h4PO4 + K2SO4 + 2MnSO4 + 3h3O
h4PO3 + HgCl2 + h3O → h4PO4 + Hg + 2HCl
- Реагируют с более слабыми окислителями:
h4PO3 + 2AgNO3 + Н2О = h4PO4 + 2Ag↓ + 2HNO3
- В реакции с сильными восстановителями, например, с щелочными и щелочно-земельными металлами, цинковой пылью, кислота восстанавливается до фосфина:
h3HPO3 + 3Zn + 3h3SO4 = 3ZnSO4 + Ph4 + 3Н2О
- При нагревании водного раствора Н3РO3окисляется до h4PO4 с выделением водорода:
h4PO3 + Н2О = h4PO4 + Н2
Кристаллические решётка:
| 300 | Кристаллическая решётка |
| 311 | Кристаллическая решётка #1 |
| 312 | Структура решётки |
| 313 | Параметры решётки |
| 314 | Отношение c/a |
| 315 | Температура Дебая |
| 316 | Название пространственной группы симметрии |
| 317 | Номер пространственной группы симметрии |
Соли фосфористой кислоты (Фосфиты)
Способы получения фосфитов
- Взаимодействие фосфористой кислоты с щелочами:
Н2[НРО3] + NaOH = NaH[HРО3] + Н2О
Н2[НРО3] + 2NaOH = Na2[HРО3] + 2Н2О
- взаимодействие фосфористой кислоты с металлами с выделением Н2
Н2[НРО3] + Ca = Ca[HРО3] + Н2
- взаимодействие фосфористой кислоты с оксидами металлов
Н2[НРО3] + CaO = Ca[HРО3] + Н2O
- диспропорционирование фосфора в горячем, концентрированном растворе щелочи:
P4 + 8NaOH(конц) + 4h3O = Na2[HРО3] + 6h3
- Взаимодействие трихлорида фосфора с разбавленным раствором щелочи:
PCl3 + 5NaOH(разб) = Na2[HРО3] + 3NaCl + 2h3O
Физические свойства фосфитов
Двухосновная фосфористая кислота образует два типа солей:
а) однозамещенные фосфиты (кислые соли), в молекулах которых атомы металлов связаны с анионами Н2РО3, например: Nah3PO3, Са(h3PO3)
б) двухзамещенные фосфиты (средние соли), в молекулах которых атомы металлов связаны с 2 или 1 анионом HPO3, например: Na2HPO3, СаHPO3.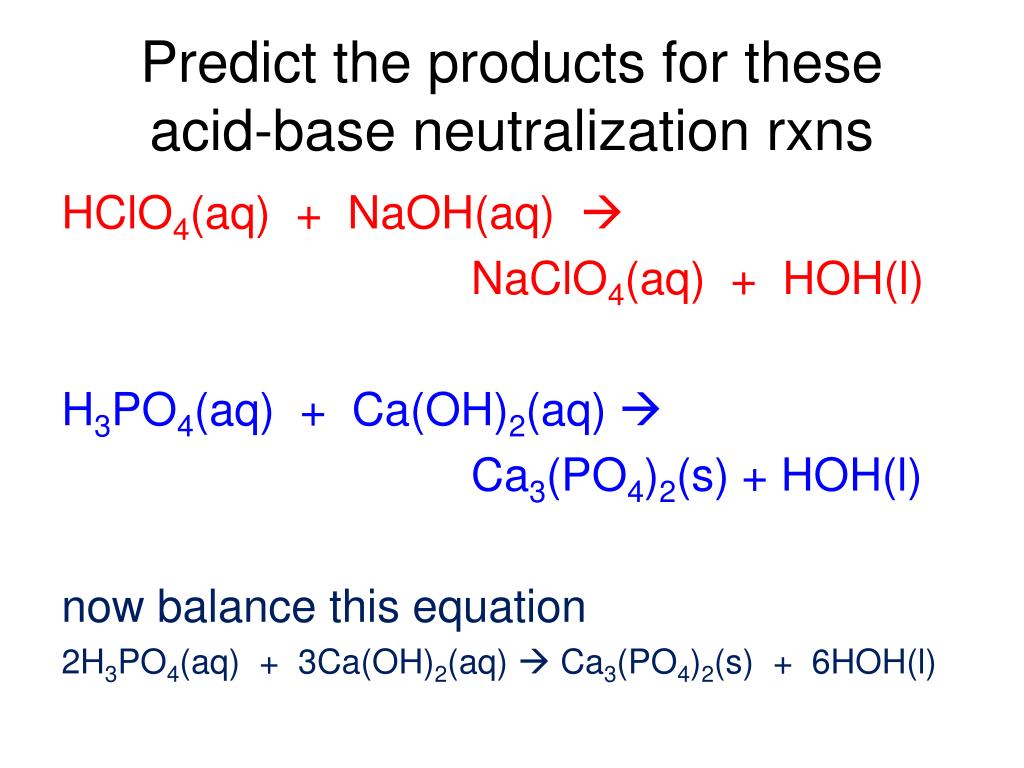
Хорошо растворимы в воде только фосфиты щелочных металлов и кальция, остальные фосфиты плохо растворимы.
Химические свойства фосфитов
Имеют химические свойства, характерные для солей
Требования к упаковке и правила обращения с веществом
На таре, в которую расфасовывается кислота, обязательно должно быть обозначение “Опасно”, “Едкая жидкость”.
Хранить и транспортировать добавку разрешено в такой упаковке:
- полиэтиленовые канистры;
- стеклянные бутыли;
- контейнеры и автоцистерны из нержавеющей стали, которая прошла специальную обработку;
- пластиковые кубы.
Сами емкости для удобства помещают в полиэтиленовые барабаны или дощатые ящики, внутри которых должен быть мягкий наполнитель во избежание повреждения упаковки.
Попадание вещества на кожу или слизистые, в глаза или в дыхательные пути может вызывать ожоги, тошноту, рвоту, головокружение и нарушение целостности тканей. В таком случае необходимо незамедлительно обратиться за врачебной помощью.
В таком случае необходимо незамедлительно обратиться за врачебной помощью.
Кислота является опасной в обращении, поэтому работать с ней можно только вдали от открытых источников огня, в хорошо вентилируемом помещении.
Обязательно наличие защитной спецодежды: перчаток, респиратора, очков, ботинок и костюма для работы с опасными веществами.
Ортофосфорная кислота, фосфорная кислота (Н3РO4)
Способы получения фосфорной кислоты
В промышленности Н3РO4 получают двумя способами:
- Разложением природного соединения – фосфата кальция Са3(РO4)2 серной кислотой:
Са3(РO4)2 + 3h3SO4 = 2Н3РO4 + 3CaSO4↓
- Доменный (термический) 3х-стадийный способ:
1 стадия — восстановление природных фосфоритов коксом
2 стадия – окисление получающихся паров свободного фосфора кислородом воздуха
3 стадия – орошение водой получающейся окиси фосфора:
Лабораторный способ
- Н3РO4 получают окислением фосфора азотной кислотой:
ЗР + 5HNO3 + 2Н2О = ЗН3РO4 + 5NO↑
- Взаимодействием фосфорного ангидрида с водой:
Р2О5 + ЗН2О = 2h4PO4
Физические свойства, строение фосфорной кислоты
При обычной температуре безводная Н3РO4 – прозрачное, легкоплавкое (Тпл = 42°С) кристаллическое вещество. Н3РO4 -очень гигроскопичное вещество и смешивается с водой в любых соотношениях. Н3РO4 с небольшим количеством воды образует сиропообразную, вязкую жидкость.
Н3РO4 -очень гигроскопичное вещество и смешивается с водой в любых соотношениях. Н3РO4 с небольшим количеством воды образует сиропообразную, вязкую жидкость.
Степень окисления фосфора в фосфорной кислоте равна +5, валентность равна V.
При нагревании орто-фосфорной кислоты выше +213 °C, она переходит в пирофосфорную h5P2O7.
При нагревании выше 700°С переходит в метафосфорную кислоту HPO3:
Качественные реакции для обнаружения фосфат-иона
Для обнаружения анионов фосфорной кислоты используют раствор AgNO3, при помощи которого также можно различить мета-, пиро- и ортофосфорные кислоты друг от друга.
При добавлении AgNO3 к кислотам образуются осадки различного цвета:
- метафосфат серебра AgPO3— белый
- пирофосфат серебра Ag4P2O7 – также белый, но он не свертывает яичного белка
- ортофосфат серебра Ag3PO4— желтый:
Н3PO4 + 3AgNO3 → Ag3PO4↓ + 3НNO3
Видео Качественная реакция на фосфат-ион
Химические свойства фосфорной кислоты
Фосфорная кислота H3PO4 – это электролит средней силы и представляет собой трехосновную кислоту.
Диссоциация протекает в основном по 1-й ступени:
Н3РO4 → Н+ + Н2РO4—
По 2-й и 3-й ступеням диссоциация протекает в ничтожно малой степени:
Н2РO4— → Н+ + НРO42-
НРO42- → Н+ + РO43-
- Н3РO4 проявляет все общие свойства кислот — взаимодействует с активными металлами:
2Н3РO4 + 6Na = 2Na3РO4 + 3h3
- с основными оксидами:
2Н3РO4 + ЗСаО = Са3(РO4)2 + ЗН2О
2h4PO4 + 3MgO = Mg3(PO4)2 + 3h3O
- с основаниями образует три ряда солей – одно-, двух- и трехзамещенные (кислые и средние соли):
Н3РO4 + NaOH = Nah3PO4 + Н2О
Н3РO4 + 2NaOH = Na2HPO4 + 2Н2О
Н3РO4 + 3NaOH = Na3PO4 + ЗН2О
- с аммиаком образует соли аммония:
Н3РO4 + Nh4 = Nh5h3PO4
Н3РO4 + 2Nh4 = (Nh5)2HPO4
- Вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также вступает в обменные реакции с солями:
Н3PO4 + 3NaHCO3 → Na3PO4 + CO2 + 3h3O
- При нагревании h4PO4 выше 200°С происходит отщепление молекулы воды с образованием пирофосфорной кислоты h3P2O7:
2h4PO4 → h3P2O7 + h3O
В отличие от аниона NO3— в азотной кислоте, анион РO43- окисляющим действием не обладает.
Глобальный рынок
Многие развивающиеся страны начали сосредотачиваться на увеличении добычи фосфатов и производства фосфатов. Правительства некоторых стран уже сотрудничали с различными поставщиками по всему миру для создания заводов по добыче минералов для производства фосфорной кислоты. В 2021 году объем мирового рынка фосфорной кислоты оценивался в 45,85 миллиарда долларов. Ожидается, что к 2027 году он достигнет более 61 миллиарда долларов, а совокупный годовой темп роста составит 3,7%.
Рынок подразделяется на Азиатско-Тихоокеанский регион, Европу, Северную Америку, Латинскую Америку, Ближний Восток и Африку. Ожидается, что в ближайшем будущем Азиатско-Тихоокеанский регион будет доминировать на мировом рынке. Рост рынка фосфорной кислоты в этих регионах будет дополнительно подпитываться развитым сельскохозяйственным сектором Индии и Китая.
Соли ортофосфорной кислоты (ортофосфаты, фосфаты)
Способы получения фосфатов
Получают кислоты с металлами, оксидами металлов, гидроксидами (см. Химические свойства ортофосфорной кислоты)
Химические свойства ортофосфорной кислоты)
Физические свойства фосфатов
Н3РO4 является 3х-основной кислотой, поэтому образует 3 типа солей:
| Анион соли | Название | Растворимость в воде | Примеры солей |
| PO43- | Фосфат (ортофосфат) | большинство нерастворимы (кроме фосфатов щелочных металлов и аммония) | Na3РO4; Са3(РO4)2 |
| HPO42- | Гидрофосфат | растворимы | Na2НРO4; СаНРО4 |
| Н2РO4— | Дигидрофосфат | очень хорошо растворимы | Nah3PO4; Са(Н2РO4)2 |
Химические свойства фосфатов
- Имеют свойства, характерные для солей.
- Соли щелочных металлов подвержены гидролизу:
Na3РO4 + Н2О = Na2HPO4 + NaOH
- Характерная особенность ортофосфатов – отношение к прокаливанию: однозамещенные соли переходят в метафосфаты, двухзамещенные – в пирофосфаты, из трехзамещенных изменяются только соли аммония:
Nah3PO4 = NaPO3 + h3O
Na2HPO4 = Na4P2O7 + h3O
(Nh5)3PO4 = 3Nh4 + h3O
Фосфорные удобрения
Фосфаты и гидрофосфаты кальция и аммония используются в качестве фосфорных удобрений.
При достаточном количестве фосфора растения быстро растут и хорошо плодоносят. Внесение фосфорных удобрений благоприятствует росту корневой системы растения и повышению урожайности. В связи с этим такие удобрения важны при выращивании овощных, зерновых и плодово-ягодных культур.
В таблице ниже приведены основные виды фосфорных удобрений.
Категории V группа (азот, фосфор), НЕОРГАНИЧЕСКАЯ ХИМИЯ
Применение кислоты в промышленности
На сегодняшний день существует как минимум семь отраслей производства, в которых используется ортофосфатная или ортофосфорная кислота.
Как антиоксидант, разрыхлитель и регулятор кислотности, кислота повсеместно применяется в приготовлении таких пищевых продуктов:
- сладких газированных напитков;
- колбас;
- плавленого сыра;
- сдобы;
- молочных продуктов;
- детского питания;
- некоторых кондитерских изделий.
Добавка придаёт пище кислинку или слегка горьковатое послевкусие.
В сфере химической промышленности вещество используется для изготовления фосфорных солей аммония, марганца и натрия, огнеупорных связующих компонентов, негорючего пенопласта.
Как элемент гидрожидкостей, кислота применяется в авиационной промышленности.
Отрасль сельского хозяйства использует добавку как составляющую минеральных удобрений.
Кроме того, Е338 – элемент производства лакокрасочных изделий, стекла и керамики, моющей продукции, активированного угля, невоспламеняющихся красок.
Медицинская сфера, особенно стоматология, ортофосфорную кислоту применяет в своих целях: для борьбы с мочекаменной болезнью, как реактив для обработки внутренней поверхностей зубных коронок перед их установкой.
Косметологическая отрасль пользуется стабилизирующим свойством кислоты: компонент упрочняет химические связи между составляющими элементами продуктов.
В домашних условиях вещество популярно как средство для удаления ржавчины с металлов.
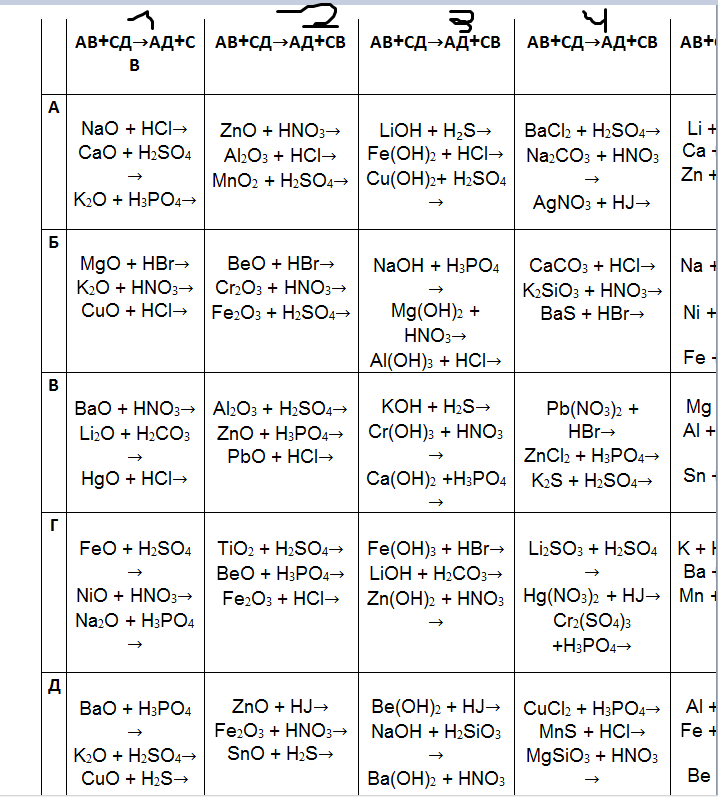
Классификация и номенклатура неорганических соединений (лекция № 2)
Похожие презентации:
Сложные эфиры. Жиры
Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Лекция № 2 Классификация и номенклатура неорганических соединений
Неорганическиевещества
Простые
Металлы
Сложные
Неметаллы
Сложные Вещества
(по составу)
Бинарные
соединения
Гидриды
Соли
Бориды
Гидроксиды
Карбиды
Кислоты
Силициды
Нитриды
Фосфиды
Оксиды
Пероксиды
Озониды
Халькогениды
Сульфиды
Селениды
Теллуриды
Галогениды
Фториды
Трехэлементные
соединения
Хлориды
Бромиды
Йодиды
Основания
Амфотерные
гидроксиды
Интерметаллические
соединения
Комплексные
соединения
Сложные вещества
(по функциональным признакам)
Оксиды
Кислоты
Основания
Соли
5.
 ОксидыОксиды – это сложные вещества, состоящие из двух элементов,
ОксидыОксиды – это сложные вещества, состоящие из двух элементов,одним из которых является кислород, причем атомы кислорода
не связаны между собой.
BaO – оксид бария
BaO2 – пероксид
бария
O
Ba = O
Ba
O
Графическая формула
Алгоритм
1.
2.
3.
4.
Определить валентность всех элементов.
Если число атомов кислорода нечетное,
записать один атом кислорода между атомами
элементов.
Дописать недостающие атомы кислорода.
Проверить правильность составления
графической формулы – число черточек должно
соответствовать валентности элемента.
Ca+2O-2
Ca = O
Na+12O-2
Na – O — Na
S+4O-22
O = S = O
Al+32O-23
O = Al – O – Al = O
O
P+52O-25
O
P – O – P
O
O
Оксиды
Солеобразующие
Основные оксиды
Оксиды щелочных
и щелочноземельных
Металлов (Na2O, CaO, BaO),
а также металлов с
переменной валентностью
в низшей степени
окисления.

Несолеобразующие
(СО, NO)
Амфотерные оксиды Кислотные оксиды
BeO, ZnO, Al2O3, Cr2O3,
а также оксиды металлов с
переменной валентностью
в промежуточной
степени окисления.
Оксиды неметаллов
(CO2, SO3, P2O5),
а также металлов с
переменной валентностью
в высшей степени
окисления.
Cr
0
+2
+3
+4
+5
+6
CrO
Cr2O3
CrO2
Cr2O5
CrO3
Основной
оксид
Амфотерные
оксиды
Кислотный
оксид
Если неметалл проявляет переменную валентность, то все его оксиды – кислотные.
9. Генетический ряд
В генетическом ряду оксиды занимают второе место послеметалла и неметалла.
Генетические ряды
Na
Al
Металл
Na2O
S
Неметалл
Амфотерный металл
Al2O3
SO3
Основной оксид
Амфотерный оксид
Кислотный оксид
NaOH
Основание
Al(OH)3
Амфотерный гидроксид
h3SO4
NaCl
AlCl3
Na2SO4
Соль
Соль
Кислота
Соль
10.
 Способы получения оксидовПолучить оксид можно из веществ его генетического ряда.
Способы получения оксидовПолучить оксид можно из веществ его генетического ряда.S
1. S + O2 SO2
2. h3SO3 SO2 + h3O
3. CaSO3 + h3SO4 CaSO4 + SO2 + h3O
SO2
h3SO3
CaSO3
1. Ca + O2 CaO
2. Ca(OH)2 CaO + h3O
3. CaCO3 CaO + CO2
Ca
CaO
Ca(OH)2
CaCO3
12. Химические свойства оксидов
Все неорганические вещества испытывают превращения двух видов:I.
Превращения внутри генетического ряда (разложение, реакция с водой, восстановление,
реакция с кислородом).
II. Взаимодействие с веществами противоположного генетического ряда.
Na
I. 1) Na2O + h3O NaOH
II. 1) Na2O + SO3 Na2SO4
2) Na2O + h3SO4 Na2SO4 + h3O
Na2O
SO3
NaOH
h3SO4
Na2CO3
CuSO4
S
13. Амфотерные оксиды Амфотерные оксиды обладают свойствами и кислотных и основных оксидов.
NaS
Al
Na2O
Al2O3
NaOH
Al(OH)3
(h4AlO3)
Na2CO3
AlCl3
(Na3AlO3)
SO3
h3SO4
CuSO4
14.
 КислотыКислоты – это сложные вещества, диссоциирующие на
КислотыКислоты – это сложные вещества, диссоциирующие накатионы водорода и анионы кислотного остатка.
Графическая формула
Алгоритм
1.
2.
3.
4.
5.
Определить валентность всех элементов.
Друг под другом записать атомы
водорода, способные замещаться на
металл.
Через
кислород
соединить
атомы
водорода
с
кислотообразующим
элементом.
Дописать недостающие атомы
кислорода.
Проверить правильность составления
графической формулы – число черточек
должно соответствовать валентности
элемента.
h3CO3
H+12C+4O-23
H – O
C = O
H — O
h4PO4
H+13P+5O-24
H – O
H – O — P = O
H — O
HMnO4
H+1Mn+7O-24
O
H – O – Mn = O
O
16. Правила наименования кислот
1.2.
3.
К корню русского названия кислотообразующего элемента
добавляется окончание «-ная», «-вая», если степень
окисления максимальна (равна номеру группы) или
окончание «-истая», если степень окисления минимальная.

НCl+1O – хлорноватистая кислота
HCl+7O4 – хлорная кислота
Если при одной степени окисления элемент образует две
кислоты, то к названию кислоты, содержащей большее
число атомов кислорода добавляется приставка «орто»,
содержащей меньшее число атомов кислорода – «мета».
h4P+5O4 – ортофосфорная кислота
HP+5O3 – метафосфорная кислота
Если в состав кислоты входит два и более
кислотообразующих элементов, то число их указывается с
помощью русского числительного.
h5P2O7 — двуфосфорная кислота
Кислоты
(по числу атомов
водорода)
(по числу атомов
кислорода)
(по силе)
(по летучести)
(по растворимости)
Одноосновные
HCl
HNO3
HF
Бескислородные
H 2S
HCl
HI
Cильные
HCl
HNO3
h3SO4
Летучие
HCl
HBr
HI
Растворимые
HCl
h3SO4
HNO3
Многоосновные
h4PO4
h3SO4
h4BO3
Кислородсодержащие
h3CO3
HNO2
Средние
h3SO3
h4PO4
Нелетучие
h4PO4
h3SO4
h3SiO3
Малорастворимые
h4BO3
h3SiO3
Слабые
H 2S
h3CO3
HNO2
18.
 Способы получения кислотКислоты входят в генетический ряд неметалла. Получить их
Способы получения кислотКислоты входят в генетический ряд неметалла. Получить ихможно из веществ своего генетического ряда.
С
1. CO2 + h3O h3CO3
2. CaCO3 + HCl CaCl2 + CO2 + h3O
CO2
h3CO3
CaCO3
1. h3 + Cl2 HCl
2. NaCl + h3SO4 HCl + Na2SO4
Сl
HCl
NaCl
20. Химические свойства кислот
NaI. 1) h3SO4 SO3 + h3O
II. 1) Na + h3SO4 Na2SO4 + h3
2) Na2O + h3SO4 Na2SO4 + h3O
3) NaOH + h3SO4 Na2SO4 + h3O
4) Na2CO3 + h3SO4 Na2SO4 + CO2 + h3O
Na2O
SO3
NaOH
h3SO4
Na2CO3
CuSO4
S
21. Основания
Основания – это сложные вещества, диссоциирующие накатионы металла и гидроксид — ионы.
Графическая формула
Алгоритм
1.
2.
3.
4.
По числу гидроксид – ионов определить
валентность металла.
Записать символ металла с числом
черточек соответствующих валентности.
Дописать гидроксид — ионы.
Проверить правильность составления
графической формулы – число черточек
должно соответствовать валентности
элемента.

NaOH
Na+1OH
Cu(OH)2
Cu+2(OH)2
Al(OH)3
Al+3(OH)3
Na – O — H
O – H
Cu
O — H
O – H
Al – O – H
O — H
Основания
(по растворимости)
(по силе)
Растворимые
(по числу
гидроксид – ионов)
(гидроксиды щелочных
и щелочноземельных
Металлов)
Сильные
(растворимые)
Однокислотные
NaOH, KOH
Нерастворимые
Слабые
Многокислотные
Fe(OH)3, Cu(OH)2
24. Способы получения оснований а) растворимые основания
Na1. Na + h3O NaOH + h3
2. Na2O + h3O NaOH
3. Na2CO3 + Ba(OH)2 NaOH + BaCO3
Na2O
NaOH
Na2CO3
25. б) нерастворимые основания
1. CuSO4 + NaOH Cu(OH)2 + Na2SO4Cu
CuO
Cu(OH)2
CuSO4
26. Химические свойства оснований а) растворимые основания
NaI. 1) NaOH Na2O + h3O
II. 1) NaOH + S Na2SO4 + Na2S + h3O
2) NaOH + SO3 Na2SO4 + h3O
3) NaOH + h3SO4 Na2SO4 + h3O
4) NaOH + CuSO4 Na2SO4 + Cu(OH)2
Na2O
SO3
NaOH
h3SO4
Na2CO3
CuSO4
S
27.
 б) нерастворимые основанияI. 1) Cu(OH)2 CuO + h3O
б) нерастворимые основанияI. 1) Cu(OH)2 CuO + h3OII. 1) Cu(OH)2 + SO3 CuSO4 + h3O
2) Cu(OH)2 + h3SO4 CuSO4 + h3O
Cu
S
CuO
SO3
Cu(OH)2
h3SO4
CuSO4
Na2SO4
28. Амфотерные гидроксиды
I. 1) Al(OH)3 Al2O3 + h3OII. 1) Al(OH)3 + SO3 Al2(SO4)3 + h3O
2) Al(OH)3 + h3SO4 Al2(SO4)3 + h3O
3) Al(OH)3 + NaOH NaAlO2 + h3O (сплавление)
4) Al(OH)3 + NaOH Na3AlO3 + h3O (в растворе)
5) Al(OH)3 + NaOH Na3[Al(OH)6] (в растворе)
Na
S
Al
Na2O
Al2O3
NaOH
Al(OH)3
(h4AlO3)
h3SO4
Na2CO3
AlCl3
(Na3AlO3)
CuSO4
SO3
Соли
Средние
Na2CO3
Кислые
NaHSO4
Основные
СuOHCl
Двойные
KAl(SO4)2
Комплексные
K3[Fe(CN)6]
Графическая формула
Алгоритм
1.
2.
3.
4.
5.
Определить валентность всех элементов.
Друг под другом записать графические
формулы кислотных остатков.
Слева дописать атомы металла.
Атомы металла соединить с кислотными
остатками с учетом валентности.

Проверить правильность составления
графической формулы – число черточек
должно соответствовать валентности
элемента.
31. Средние соли
Средние соли – это продукты полного замещения гидроксид – ионовв молекуле основания кислотными остатками, или продукты
полного замещения катионов водорода в молекуле кислоты
атомами металла.
1.
2.
3.
4.
Правила наименования
Названия солей бескислородных кислот составляется по правилам
наименования бинарных соединений.
Соли, содержащие остатки кислородсодержащих кислот называют по
следующему правилу: к корню латинского названия кислотообразующего
элемента добавляют окончание «-ат», если степень окисления
максимальна и окончание «-ит», если степень окисления ниже
максимальной.
Na2Se+6O4 – селенат натрия
Na2Se+4O3 – селенит натрия
Если в составе соли несколько кислотообразующих элементов, то число
их указывается с помощью греческого числительного.
Na2Cr2O7 – дихромат натрия
По международной номенклатуре сначала с помощью греческого
числительного называется число атомов кислорода («оксо»), затем
называют кислотообразующий элемент с окончанием «-ат» не зависимо
от степени окисления.

NaClO – оксохлорат натрия (гипохлорит натрия)
NaClO2 – диоксохлорат натрия (хлорит натрия)
NaClO3 – триоксохлорат натрия (хлорат натрия)
NaClO4 – тетраоксохлорат натрия (перхлорат натрия)
Na2CO3
Na+12C+4O-23
Fe2(SO4)3
Fe+32 (S+6O-24)3
Na – O
C = O
Na — O
O
O
Fe – O — S = O
O
O
O – S = O
Fe – O
O
O – S = O
33. Способы получения средних солей
NaNO3Na
Na2O
N2
N2O5
NaOH
HNO3
Na2CO3
Cu(NO3)2
1) Na2O + N2O5 NaNO3
2) NaOH + HNO3 NaNO3 + h3O
3) Na2CO3 + Cu(NO3)2 NaNO3 + CuCO3
4) Na2CO3 + HNO3 NaNO3 + h3CO3
5) Cu(NO3)2 + NaOH NaNO3 + Cu(OH)2
6) NaOH + N2O5 NaNO3 + h3O
7) HNO3 + Na2O NaNO3 + h3O
8) Na + HNO3 NaNO3 + N2 + h3O
9) Na + Cu(NO3)2 NaNO3 + Cu
35. Химические свойства средних солей
I. 1) CaCl2 + NaOH CaOHCl + NaClII. 1) CaCl2 + h3SO4 CaSO4 + HCl
2) CaCl2 + CuSO4 CaSO4 + CuCl2
Ca
CaO
SO3
Ca(OH)2
h3SO4
CaOHCl
Cu(HSO4)2
CaCl2
CuSO4
S
36.
 Кислые солиКислые соли – это продукты неполного замещения атомов
Кислые солиКислые соли – это продукты неполного замещения атомовводорода в молекуле кислоты атомами металла.
Правила наименования
1. По международной номенклатуре сначала с помощью греческого
числительного указывается число атомов водорода («гидро»),
затем называется анион и называется катион.
Nah3PO4 – дигидрофосфат натрия
Na2HPO4 – гидрофосфат натрия
NaHCO3
Na+1H+1C+4O-23
H – O
C = O
Na — O
H – O
O – P = O
Fe — O
O
Fe2(HPO4)3
H — O – P = O
Fe+32(H+1P+5O-24)3
O
Fe — O
O – P = O
H — O
38. Способы получения кислых солей
PP2O5
1) h4PO4 + Na Nah3PO4 + h3
2) h4PO4 + Na2O Nah3PO4 + h3O
3) h4PO4 + NaOH Nah3PO4 + h3O
4) Na3PO4 + h4PO4 Nah3PO4
h4PO4
Nah3PO4
Na3PO4
39. Химические свойства кислых солей
PP2O5
1) Nah3PO4 + h3SO4 Na2SO4 + h4PO4
2) Nah3PO4 + NaOH Na3PO4 + h3O
h4PO4
Nah3PO4
Na3PO4
40. Основные соли
Основные соли – это продукты неполного замещениягидроксид – ионов в молекуле основания кислотными
остатками.

Правила наименования
1. По международной номенклатуре сначала с помощью греческого
числительного указывается число гидроксид — ионов
(«гидроксо»), затем называется анион и называется катион.
Fe(OH)2NO3 – дигидроксонитрат железа (III)
(нитратдигидроксид железа (III) )
FeOH(NO3)2 – гидроксонитрат железа (III)
(нитратгидроксид железа (III))
CuOHCl
Cu+2O-2H+1Cl-1
H – O – Cu — Cl
(FeOH)3(PO4)2
(Fe+3O-2H+1)3(P+5O2 )
4 2
H – O – Fe – O
O – P = O
O
H – O – Fe – O
O – P = O
H – O – Fe — O
AlOHSO4
Al+3O-2H+1S+6O-24
H – O – Al – O
O
S
O
O
42. Способы получения основных солей
FeFe2O3
1) Fe(OH)3 + HCl FeOHCl2 + h3O
2) FeCl3 + NaOH FeOHCl2 + NaCl
Fe(OH)3
FeOHCl2
FeCl3
43. Химические свойства основных солей
FeFe2O3
1) FeOHCl2 + NaOH Fe(OH)3 + NaCl
2) FeOHCl2 + HCl FeCl3 + h3O
Fe(OH)3
FeOHCl2
FeCl3
Спасибо за внимание!
English Русский Правила
Реакция с несколькими элементами —
Манси Шарма
Реакция h4PO4 + NaOH является одной из важных реакций, когда дело доходит до изучения кислотно-щелочной химии. Полная информация об этой реакции и реакциях, связанных с этой комбинацией, объясняется в этой статье.
Полная информация об этой реакции и реакциях, связанных с этой комбинацией, объясняется в этой статье.
h4PO4 + NaOH в пояснительной форме представляет собой реакцию между разбавленной фосфорной кислотой и концентрированным гидроксидом натрия, которая дает трифосфат натрия в качестве основного продукта и воду в качестве побочного продукта. Важно отметить, что эта реакция является теплой, что становится очевидным после прикосновения к стакану с реакционной смесью.
Реакция h4PO4 + NaOH является кислотно-щелочной реакцией или реакцией нейтрализации. Здесь кислотой является h4PO4, а основанием – NaOH. Оба этих реагента являются сильной кислотой и основанием, где кислота теряет H+, а основание теряет OH-, что приводит к образованию побочного продукта, который снова отвечает за экзотермический характер процесса.
Подробно о каждом реагенте, участвующем в реакции h4PO4 + NaOH, тогда h4PO4 называется фосфорной кислотой. Это бесцветное неорганическое твердое вещество, на 85% состоящее из воды. Это очень распространенное соединение в производстве удобрений и пестицидов. В присутствии воды диссоциирует с образованием трипротонной кислоты. Фосфорная кислота по сравнению с другими сильными кислотами слабее, но может раздражать глаза и кожу. Его длительное употребление в любом виде может привести к остеопорозу у женщин.
Это очень распространенное соединение в производстве удобрений и пестицидов. В присутствии воды диссоциирует с образованием трипротонной кислоты. Фосфорная кислота по сравнению с другими сильными кислотами слабее, но может раздражать глаза и кожу. Его длительное употребление в любом виде может привести к остеопорозу у женщин.
Если перейти к основному компоненту реакции h4PO4 + NaOH, то гидроксид натрия, также обозначаемый как едкий натр, представляет собой неорганическое основание, состоящее из катиона Na+ и аниона OH- . Это белый твердый кристалл без специфического запаха. Он очень хорошо растворим в воде и существует в виде водного гидроксида натрия. Он используется во многих химических производствах и академических лабораториях.
Гидроксид натрия в реакции h4PO4 + NaOHСуществует много факторов, связанных с реакциями h4PO4 + NaOH, некоторые из которых обсуждаются ниже:
- Что происходит, когда h4PO4 реагирует с NaOH?
- Какова реакция h4PO4 + NaOH?
- Титрование h4PO4 + NaOH
- h4PO4 против NaOH
- Как сбалансировать h4PO4+NaOH=Na3PO4+h3O?
- Как сбалансировать h4PO4+NaOH=na2hpo4+h3O?
- h4PO4+NaOH=Na3PO4+h3O суммарное ионное уравнение
- буферный раствор h4PO4 NaOH ионное уравнение
- HCl + h4PO4 + NaOH
- h4PO4 (водн.
 )+NaOH(водн.)
)+NaOH(водн.)
Реакция h4PO4 + NaOH является очень распространенным примером реакции нейтрализации. В пояснительной форме это означает, что разбавленный раствор гидроксида натрия нейтрализует концентрированную фосфорную кислоту и приводит к образованию нейтрального соединения, имеющего рН 7 и имеющего зеленый цвет на индикаторной бумаге.
Продукт реакции h4PO4 + NaOH представляет собой водный раствор Na3PO4 и h3O. Это экзотермическая реакция, о чем свидетельствует нагретый стакан с реакционной смесью.
Какая реакция re h4PO4 + NaOH? Возможны 2 типа реакций при взаимодействии h4PO4 и NaOH. Первой и наиболее очевидной реакцией является реакция кислотно-щелочной нейтрализации. Причина, по которой это считается реакцией нейтрализации, заключается в том, что h4PO4 является кислотой, а NaOH является основанием, и их количественная реакция приводит к образованию соли. При этом в ходе реакции по механизму h4PO4 + NaOH высвобождаются ионы H+ и OH-, образующие побочную молекулу воды.
При этом в ходе реакции по механизму h4PO4 + NaOH высвобождаются ионы H+ и OH-, образующие побочную молекулу воды.
Другим типом реакции, с которой мы сталкиваемся в реакции h4PO4 + NaOH, является реакция двойного замещения. Это связано с тем, что между двумя реагентами происходит движение анионов и катионов, что приводит к тринатрийфосфату и воде.
Титрование h4PO4 + NaOHТитрование h4PO4 NaOH очень интересно. Это не похоже на любое другое кислотно-щелочное титрование, в котором используются очень сильные кислоты, такие как серная кислота и азотная кислота.
Фосфорная кислота является сравнительно слабой кислотой с pka 1 = 2,15, pka2 = 7,20 и pka 3 = 12,35. Все эти значения pka указывают на то, что кривая титрования h4PO4 + NaOH имеет две точки перегиба и может быть оттитрована как монопротонная или дипротонная кислота.
Индикаторы используются при проведении реакций титрования, так как они свидетельствуют о различных значениях pka и образовании различных кислот с выделением H+ в h4PO4 + NaOH. Математическое титрование h4PO4 + NaOH — утомительная и сложная область, которая выходит за рамки этой статьи.
Математическое титрование h4PO4 + NaOH — утомительная и сложная область, которая выходит за рамки этой статьи.
важно, когда речь идет об образовании нейтральных соединений. Обсуждая их оба, фосфорная кислота, как следует из названия, является неорганической слабой кислотой, а NaOH является сильным основанием. Они титруются вместе с возможной потерей ионов водорода из кислоты и ионов ОН или гидрокси из основания, которое формирует молекулу воды.
h4PO4, будучи кислотой, при прохождении кислотно-щелочной реакции нейтрализации сначала превращается в одноосновную кислоту с потерей одного иона H+. Будучи слабой кислотой по сравнению с другими сильными неорганическими кислотами, она не сможет завершить реакцию в одной партии, а займет от 2 до 3 оборотов и сформирует 2 точки перегиба с 3 значениями pka. Последнее значение pka является самым высоким.
Что касается NaOH, то это очень сильное основание, которое мгновенно образует нейтральную соль с потерей иона OH-. Это видно из лабораторного теста объемного титрования с использованием таких индикаторов, как метиловый оранжевый и фенолфталеин.
Как сбалансировать h4PO4+NaOH=Na3PO4+h3O?Уравновешивание химической реакции очень важно для установления равновесия реакции и обеспечения того, чтобы реагенты могли образовывать продукты. Для уравновешивания реакций h4PO4 и NaOH стехиометрические потребности реагентов должны быть равны продуктам.
Концентрация на стороне реагента должна уравновешивать концентрацию на стороне продукта. Балансировка показана на схеме ниже.
Сбалансированное уравнение h4PO4 + NaOH Как сбалансировать h4PO4+NaOH=Na2HPO4+h3O? Это еще одна реакция h4PO4 + NaOH, в результате которой образуется Na2HPO4, называемый гидрофосфатом натрия. Это белая кристаллическая гигроскопическая соль, которая существует в виде порошка. Иногда он также прозрачный.
Это белая кристаллическая гигроскопическая соль, которая существует в виде порошка. Иногда он также прозрачный.
Чистое ионное уравнение означает, что молекулы диссоциируют на отдельные связанные ионы, а затем после удаления всех ионов-наблюдателей находится итоговое уравнение. В случае h4PO4 + NaOH из приведенного выше обсуждения совершенно ясно, что фосфорная кислота является слабой кислотой, поэтому нельзя показать, что она полностью диссоциирует в одном случае.
Он частично диссоциирован, поэтому здесь после диссоциации ион фосфата не считается ионом-спектатором, и вода образуется в результате чистой ионной реакции. Из-за дополнительной доступности OH- и Na+, являющихся ионами-наблюдателями, эта реакция является исключением из концепции чистого ионного уравнения, и ее нельзя записать с ясностью.
Буферный раствор h4PO4 + NaOH отвечает за поддержание pH раствора. Во время кислотно-щелочной нейтрализации технологическая кислота теряет свой протон при каждом объемном титровании. Что касается h4PO4 + NaOH, то для полной диссоциации требуется 2 титрования, что означает наличие 2 точек перегиба.
Теперь понятно, что существует 2 типа буферов: кислотные буферы и базовые буферы. В реакции h4PO4 + NaOH есть 3 удаляемых атома водорода или протона, следовательно, реакция имеет кислый буферный раствор, который обычно является слабой кислотой.
h4PO4+NaOH=Nah3PO4+h3O результирующее ионное уравнение h4PO4 диссоциирует на 3 иона водорода и 1 ион фосфата из-за его слабых кислотных свойств. С другой стороны, NaOH диссоциирует на Na+ и OH- за один ответ. Эта реакция приводит к чистой ионной реакции, в которой присутствует один ион водорода и гидроксильный ион.
Добавление большего количества NaOH будет проблемой, так как это приведет к дальнейшей диссоциации и приведет к Na3PO4 вместо Nah3PO4.
HCl + h4PO4 + NaOHВ реакции между HCl + h4PO4 + NaOH участвуют две неорганические кислоты и одно основание. Здесь ее называют кислотной смесью из-за преобладания кислоты. Здесь HCl и NaOH — сильные неорганические кислоты и основания соответственно.
h4PO4 через неорганическую кислоту слабее по сравнению с соляной кислотой. Таким образом, реакция между 3 приводит к диссоциации одного H+ из h4PO4, что приводит к образованию двухосновной кислоты h3PO4, нейтральной соли хлорида натрия NaCl и иона гидроксония h4O. Это уже сбалансированное уравнение.
Реакция h4PO4 + NaOH с HCl h4PO4 (водн.)+NaOH (водн.) Наличие водного раствора реакции h4PO4 + NaOH не влияет на процедуру реакции. Она по-прежнему приводит к образованию водного раствора Na3PO4 и h3O, как и любая другая реакция нейтрализации.
Резюмируя статью, можно сказать, что реакция h4PO4 + NaOH является кислотно-щелочной реакцией нейтрализации с небольшой аномалией, где h4PO4 является слабой неорганической кислотой по сравнению с ее аналогами, что четко видно при объемном титровании. . Реакция h4PO4 + NaOH может привести ко многим другим продуктам в зависимости от свойств диссоциации.
Как бы вы сбалансировали: H_3PO_(4(вод)) + Ca(OH)_(2(т)) -> Ca_3(PO_4)_(2(т)) + H_2O_((л))?
В этой реакции фосфорная кислота , #»H»_3″PO»_4#, слабая кислота , будет реагировать с гидроксидом кальция , #»Ca»(«OH»)_2#, a сильное основание
Поскольку вы имеете дело с реакцией между слабой кислотой и сильным основанием, вы можете сказать, что это реакция нейтрализации.
Судя по продуктам реакции, вы имеете дело с полной нейтрализацией .


 Например, он дегидратирует оксокислоты, что широко используется для получения ангидридов кислот:
Например, он дегидратирует оксокислоты, что широко используется для получения ангидридов кислот: )+NaOH(водн.)
)+NaOH(водн.)