Гидроксид натрия: плотность и молярная масса, методы получения едкой щелочи и области применения
Гидроксид натрия, формула которого — NaOH, относится к разряду сильных щелочей, едких и опасных для человека, но несмотря на это, каждый человек встречается с гидроокисью натрия ежедневно. В косметических и фармацевтических средствах, в бытовой химии и даже в пищевых продуктах.
Содержание
Свойства едкой щелочи
Гидроокись (гидроксид) натрия называют также едким натром, едкой щёлочью (такое название обусловлено способностью вещества разъедать стекло, кожу, бумагу, вызывать сильнейшие химические ожоги) и каустической содой (каустик — от греч. kaustikos жгучий, едкий).
Физические свойства
Гидроксид натрия выпускается в виде гранул белого цвета, скользких на ощупь.
Растворение вещества в воде, происходит с выделением большого количества тепла. Гидроксид натрия является гигроскопичным веществом, т. е. он активно поглощает водяные пары из воздуха. А также каустик способен поглощать углекислый газ, образуя на воздухе NaНCO3.
А также каустик способен поглощать углекислый газ, образуя на воздухе NaНCO3.
Молярная масса NaOH равна 39,997 г/моль, плотность вещества 2,02 г/см3, растворимость в воде 108,7 г/100 мл, температуры кипения и плавления для каустической соды равны соответственно 1403 °C и 323 °C.
Молекулы гидроокиси натрия полностью диссоциируют на ионы в водных растворах, а значит едкий натр — сильное основание. Водные растворы гидроокиси натрия обладают сильнейшей щелочной реакцией (pH 1%-раствора = 13).
Химические свойства
NaOH способен вступать в реакции с кислотами (серной h3SO4, угольной h3CO3, соляной HCl и другими), в результате чего образуются соли и вода:
- 2NaOH + h3CO3 → Na2СO3 + 2h3O,
- 2NaOH + h3SO4 → Na2SO4 + 2h3O.
С кислотными оксидами в результате взаимодействия образуются соль и вода:
- SiO2 + 2NaOH → Na2SiO3 + h3O,
- 2NaOH + SO2 → Na2SO3 + h3O.

C основными оксидами реакция не идёт: MgO/ Bao /CaO + NaOH ≠.
C амфотерными оксидами гидроксид натрия также образует соли и воду: ZnO + 2NaOH + h3O → Na2[Zn (OH)4] (раствор).
C солями гидроокись натрия реагирует при условии, что в результате будет образовано нерастворимое как, например, в реакции с сульфатом меди (CuSO4 + NaOH), газообразное вещество или вода:
- Fe2 (SO4)3 + 6NaOH → 2Fe (OH)3↓ + 3Na2SO4,
- CuSO4 + 2NaOH → Cu (OH)2↓ + Na2SO4,
- CuCl2 + 2NaOH → Cu (OH)2↓ + 2NaCl.
C неметаллами:
- с фосфором 3NaOH + 4P + 3h3O → 3Nah3PO4 + Ph4,
- с серой 6NaOH + 3S → 2Na2S + Na2SO3 + 3h3O.
C металлами гидроокись натрия реагирует с цинком (Zn), алюминием (Al), титаном (Ti). C железом же и медью NaOH не взаимодействует. Примеры:
- Zn + 2NaOH + 2h3O → h3↑ + Na2[Zn (OH)4] тетрагидроксицинкат натрия,
- 2NaOH + 2Al + 6h3O → 3h3↑ + 2Na[Al (OH)4] тетрагидроксиалюминат натрия.

C жирами щёлочь реагирует с образованием мыла: (C17h45COO)3C3H5 + 3NaOH → C3H5 (OH)3 + 3C17h45COONa.
Методы получения вещества
Промышленные методы, с помощью которых можно получить едкий натр, делятся на химические и электрохимические.
Химические методы
Существует три основных химических метода.
Пиролитический метод состоит из двух стадий:
- Получение оксида натрия, разложением карбоната или гидрокарбоната при температуре: Na2CO3 = Na2O + CO2 или NaНCO3 = Na2O + 2CO2↑ + Н2О — при 1000 °C.
- Получение непосредственно гидроокиси натрия, растворением оксида: Na2O + h3O = 2NaOH.
Известковый метод: взаимодействие карбоната натрия (соды) с гашёной известью (гидроксидом кальция) при температуре (80 °C) называют каустификацией. Результатом такой реакции является раствор каустической соды и осадок карбоната кальция.
Уравнение реакции: Na2CО3 + Са (ОН)2 = CaCО3 ↓ + 2NaOH.
Ферритный метод получения может происходить двумя способами:
- Спекание кальцинированной соды с оксидом железа (III) при температуре 1100−1200 °C с образованием феррита натрия: Na2CO3 + Fe2O3 = NaFeO2 + CO2↑.
- Получение гидроокиси натрия происходит с помощью «ощелачивания» (добавления воды) феррита: 2NaFeO2 + h3O = 2NaOH + Fe2O3*h3O↓.
Серьёзными недостатками таких способов является большой расход энергии и сильная загрязнённость продукта. Такие методы получения NaOH в настоящее время почти не используются в промышленности.
Электрохимические методы
Из минерала галита, состоящего преимущественно из NaCl, с помощью электролиза получают гидроксид натрия. Помимо щёлочи в результате такой реакции, получают ещё и хлор и водород.
Записать процесс можно уравнением: 2NaCl + 2h3O → h3↑ + Cl2↑ + 2NaOH.
В лабораторных условиях щёлочь можно получить, например:
- растворением оксида в воде Na2O + h3O = 2NaOH,
- реакцией перекиси натрия с водой Na2O2 + h3O = 2NaOH+Н2О2.
Но в настоящее время химические методы получения редко используются в лаборатории, чаще используют электрохимические методы.
Области применения
Гидроокись натрия применяют в различных областях промышленности, в производстве, а также широко применяется для бытовых нужд:
- производство моющих агентов (мыла, шампуни), средства бытовой химии,
- целлюлозно-бумажная промышленность,
- химическая промышленность (в качестве катализатора или реагента, в аналитической химии для титрования, в нефтепереработке),
- оборонная промышленность использует каустик для нейтрализации отравляющих газов, как агент, очищающий воздух, вдыхаемый через дыхательный аппарат, от углекислого газа,
- текстильная промышленность (обработка хлопковых и шерстяных нитей — мерсеризация),
- пищевая промышленность (в процессе производства множества различных продуктов, таких как хлеб, различные напитки, карамель, мороженое и многое другое),
- косметология (в составах для пилинга),
- фотография (вещество используется в проявлении фотоматериалов).

Химическая опасность
Вещества, относящиеся ко второму (II) классу опасности — высокоопасные вещества — требуют применения защитных средств (химически устойчивая одежда, очки, перчатки), строгого соблюдения правил работы в лаборатории, осторожности и внимательности. Если у вас возникла тяга насладиться потрясающим сексом, вас определенно привлекут популярные индивидуалки Перми . Вы можете фильтровать шлюх по внушительному каталогу особенностей, указывая их габариты, объем груди, а также район проживания!
Едкий натр при попадании на кожу вызывает серьёзные химические ожоги, а при попадании в глаза способен вызвать серьёзные поражения зрения, вплоть до повреждения зрительного нерва и, как результат, — слепоты.
Необходимо помнить, что нейтрализовать действие каустика при попадании на слизистые или кожу можно слабыми растворами борной или уксусной кислоты. Глаза следует промывать слабым раствором борной кислоты и водой.
Почему протекают химические реакции — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. 11 класс Урок по теме Почему протекают химические реакции
11 КЛАССУРОК ПО ТЕМЕ
ПОЧЕМУ ПРОТЕКАЮТ ХИМИЧЕСКИЕ
РЕАКЦИИ
2. План урока.
1.2.
3.
4.
5.
6.
7.
Закон сохранения массы и энергии.
Тепловой эффект химической реакции.
Экзотермические и эндотермические
реакции.
Термохимия.
 Законы термохимии.
Законы термохимии.Кто он Герман Гесс?
Понятие об энтропии и энтальпии.
Выводы по теме.
3. Почему протекают химические реакции
Закон сохранения массы и энергии.Масса веществ, вступающих в реакцию
равна массе веществ, образующихся в
результате реакции.
Закон сохранения массы дает материальную
основу для составления уравнений
химических реакций и проведения расчетов
по ним.
4. Закон сохранения массы и энергии
Взаимосвязь массы иэнергии выражается
уравнением Эйнштейна:
E = mc2
где Е – энергия; m – масса;
с – скорость света в вакууме.
Тепловые эффекты химических реакций нужны
для многих технических расчетов. Представьте
себя на минуту конструктором мощной
ракеты, способной выводить на орбиту
космические корабли и другие полезные грузы
6. Тепловые эффекты химических реакций.
Химическая реакция заключается в разрывеодних и образовании других связей, поэтому
она сопровождается выделением или
поглощением энергии в виде теплоты, света,
работы расширения образовавшихся газов.
• И трещат сухие сучья,
Разгораясь жарко,
Освещая тьму ночную
Далеко и ярко!
И.Суриков
7. Классификация реакций
По признаку выделения или поглощениятеплоты реакции делятся на
эндотермические
экзотермические
Реакции, протекающие с выделением
теплоты, проявляют положительный
тепловой эффект (Q>0, ΔH<0) и
называются экзотермическими.
С(тв) + 2 h3(г) = Ch5(г) + 76 кДж/моль
Реакции, которые идут с поглощением теплоты
из окружающей среды (Q<0, Δ H>0), т.е. с
отрицательным тепловым эффектом,
являются эндотермическими.
9. Тепловой эффект химической реакции
Количество теплоты, которое выделяетсяили поглощается в результате реакций
между определенными количествами
реагентов
обычно обозначают символом Q.
Q р = Q кон.- Q исх.
Гидратация серной кислоты
10. Теплота образования соединения (Qобр)
Это тепловой эффект реакции образованияодного моля соединения из простых веществ,
устойчивых в стандартных условиях (25℃, 1 атм)
ТЕРМОХИМИЧЕСКИМИ
УРАВНЕНИЯМИ
называются
Особенность
термохимических
уравнений
заключается в том
• уравнения химических
реакций, в которых
вместе с реагентами и
продуктами записан и
тепловой эффект реакции,
• что при работе с ними можно
переносить формулы веществ
и величины тепловых
эффектов из одной части
уравнения в другую.

12. Раздел химии, занимающийся изучением превращения энергии в химических реакциях, называется ТЕРМОХИМИЕЙ.
Существует два важнейших законатермохимии.
Первый из них, закон Лавуазье–Лапласа,
формулируется следующим образом:
закон Лавуазье–Лапласа
Тепловой эффект прямой реакции
всегда равен тепловому эффекту
обратной реакции с
противоположным знаком.
Второй закон термохимии был
сформулирован в 1840 г
российским академиком Г. И.
Гессом:
Тепловой эффект реакции
зависит только от
начального и конечного
состояния веществ и не
зависит от
промежуточных стадий
процесса.
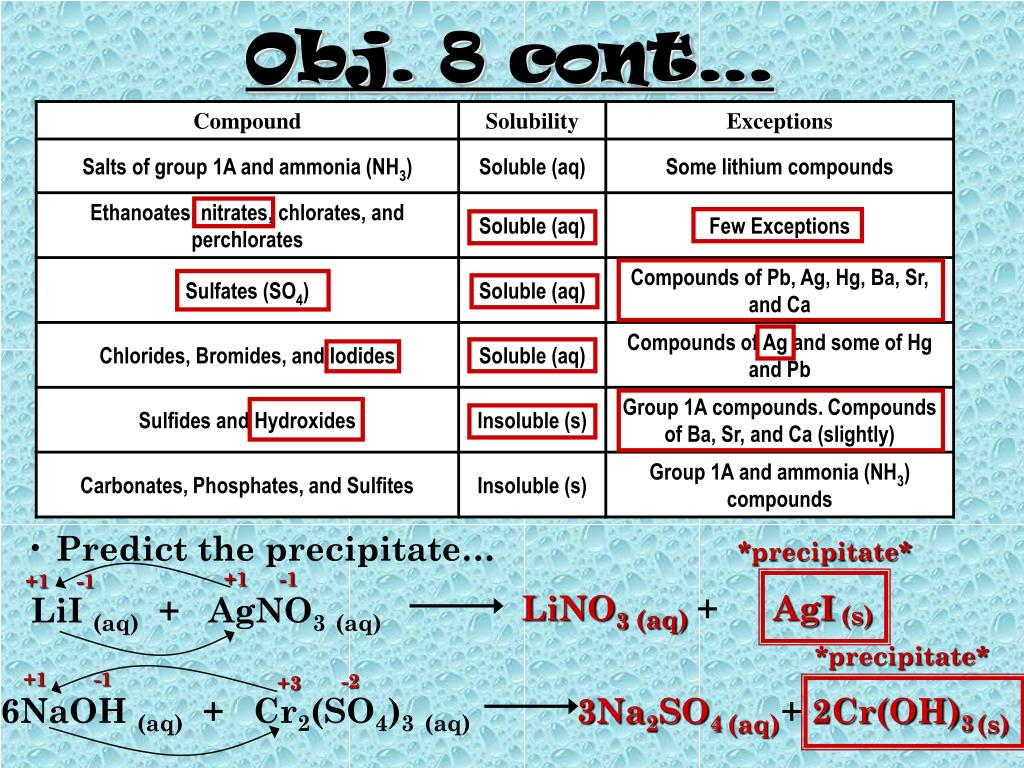
15. Сульфат натрия Na2SO4 можно получить двумя путями из едкого натра NaOH.
Сульфат натрия Na2SO4 можно получить двумяпутями из едкого натра NaOH.
Первый путь (одностадийный):
2 NaOH + h3SO4 = Na2SO4 + 2 h3O + 131 кДж;
Второй путь (двухстадийный):
а) NaOH + h3SO4 = NaНSO4 + h3O + 62 кДж
б) NaHSO4 + NaOH = Na2SO4 + h3O + 69 кДж
складывая тепловые эффекты двух
последовательных реакций в способе (2) мы
получаем тот же тепловой эффект, что и для
способа (1): 65 кДж + 69 кДж = 131 кДж
Герман Гесс считается основателем термохимии, он
дал формулировку двух фундаментальных
термохимических законов.
 Ученый сформулировал
Ученый сформулировалосновной закон термохимии —являющийся
приложением закона сохранения энергии к
химическим процессам. Этот закон назвали его
именем — закон Гесса.
И еще один необычный факт биографии: в
конце 1820-х — начале 1830-х годов Гесс учил
химии цесаревича Александра, будущего
императора Александра II. Уж не знание ли
основ устройства материи помогло Александру
стать настоящим реформатором?
17. Энтальпия
это определенное свойство вещества, оноявляется мерой энергии, накапливаемой
веществом при его образовании.
Величина, характеризующая
теплосодержание — Δ Н
18. Энтальпия и тепловой эффект противоположны по знаку
При экзотермических реакциях, когда тепловыделяется, Δ Н отрицательно.
При эндотермических реакциях (тепло
поглощается) и Δ H положительно.
19. Как вычислить тепловой эффект реакции
Тепловой эффект химической реакции равенразности суммы теплот образования
продуктов реакции и суммы теплот
образования исходных
веществ (суммирование проводится с учетом
числа молей веществ, участвующих в реакции, т.

е. стехиометрических коэффициентов в
уравнении протекающей реакции):
Δ H = Hкон.- Hисх.
20. энтропия S
Термодинамическая энтропия S, часто простоименуемая энтропия, в химии и термодинамике
является функцией состояния термодинамической
системы.
изменение энтропии это отношение общего
количества тепла к величине абсолютной
температуры
Термодинамическая система — это некая
физическая система, состоящая из большого
количества частиц, способная обмениваться с
окружающей средой энергией и веществом.
21. энтропия
Функция характеризующая степень беспорядкаΔS
Чем больше частиц в системе, тем больше в
системе беспорядка
Твердое вещество жидкость газ
Степень беспорядка увеличивается ——>
Вычислить изменения энтропии можно на
основании справочных данных по формуле:
Δ S =S кон.- Sисх.
22. Выводы
Всякая химическая реакция характеризуетсядвумя энергетическими характеристиками:
энтальпией (Δ H) и энтропией (Δ S).
1. Для самопроизвольных реакций характерно
стремление к уменьшению энергии за счет
выделения ее в окружающую среду и к
увеличению степени беспорядка.
2. При вычислении Qр необходимо учитывать
закон Гесса.
23. Задача
При соединении 18 галюминия с кислородом
выделяется 547 кДж
теплоты. Составьте
термохимическое уравнение
этой реакции.
24. Задача 5
При соединении 18 г алюминия с кислородомвыделяется 547 кДж теплоты. Составьте
термохимическое уравнение этой реакции.
Решение
Составить уравнение. 3О2 + 4Аl = 2Аl2О3 + Х кДж
Вычислить количество вещества содержащего 18 г алюминия.
n = m/M n (Аl) = 18г : 27г/моль =0,67 моль
Составить и решить пропорцию.
При окислении 0,67 моль алюминия выделяется 547 кДж
теплоты
При окислении 4 моль алюминия выделяется Х кДж теплоты
Х = 4 •547 : 0,67 = 3265,67 кДж
Составим термохимическое уравнение этой реакции.
3О2 + 4Аl = 2Аl2О3 + 2365 кДж
25.
 Решение задач 1,2,4 после параграфа 12
Решение задач 1,2,4 после параграфа 1226. Домашнее задание
Изучить материал учебника параграф12,
• выполнить задания № 5-8;
В результате реакции, термохимическое уравнение которой
2h3(г) + O2(г) = 2h3O(г) + 484 кДж,
выделилось 1479 кДж теплоты. Масса образовавшейся при этом
воды равна
1) 100 г
2) 110 г
3) 120 г
4) 130 г
Спасибо за внимание!
English Русский Правила
Водная серная кислота (h3SO4) реагирует с твердым гидроксидом натрия (NaOH) с образованием водного сульфата натрия (Na2SO4) и жидкой воды (h3O).
Алгебра 2 Исчисление Химия Предварительное исчисление Биохимия Mcat Органическая химия Химическая инженерия Математика Медицинский колледж Вступительный экзамен
Марисса Б.
спросил 06.02.22 Если 3,23 г сульфата натрия получают в результате реакции 2,9 г серной кислоты и 3,3 г гидроксида натрия, рассчитайте процентный выход сульфата натрия. Округлите ответ до 2 значащих цифр.
= ______ %
Подписаться І 2
Подробнее
Отчет
1 ответ эксперта
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
Дж. Р. С. ответил 06.02.22
Репетитор
5,0 (139)
к.т.н. кандидат биохимии — профессор университета — преподаватель химии
Об этом репетиторе ›
Об этом репетиторе ›
Это не сильно отличается от вашего предыдущего вопроса(ов). Вы действительно должны научиться делать это самостоятельно. Я не знаю, будете ли вы проверяться на это, но если да, вы не преуспеете, если не поймете процесс. Просто мои два цента. Теперь, что касается проблемы.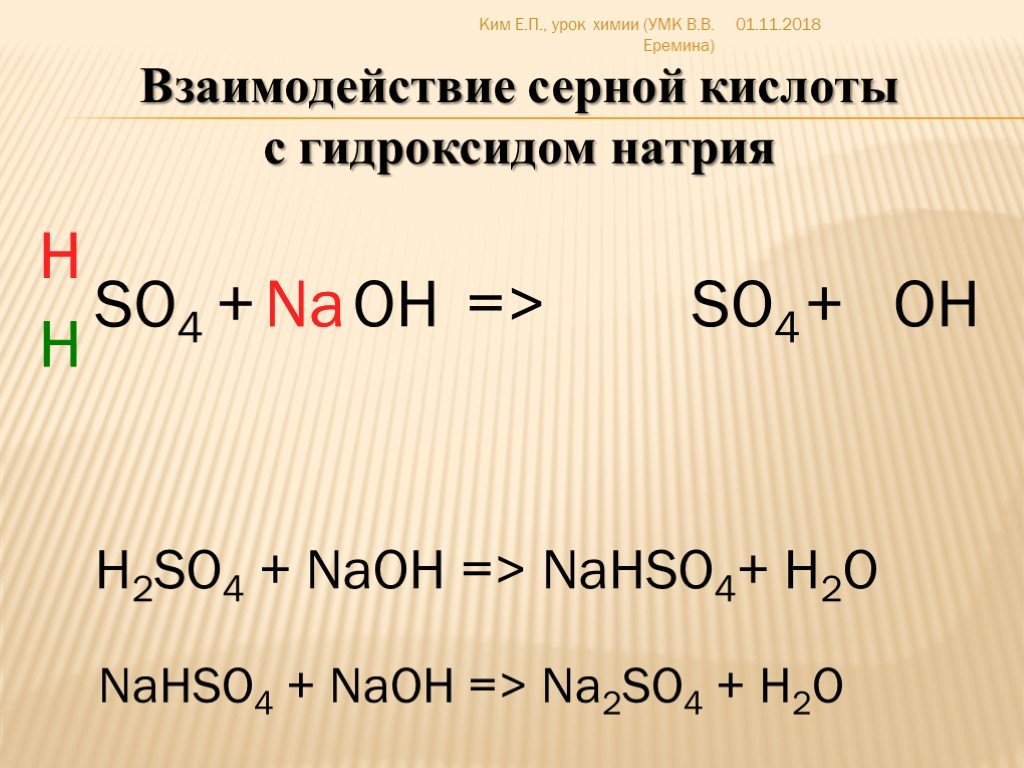
Как всегда, НЕОБХОДИМО составить правильно составленное уравнение реакции:
H 2 SO 4 + 2NaOH ==> Na 2 SO 4 + 2H 2 O … сбалансированное уравнение
Затем найдите предельный реагент. Я объяснял это ранее в своих ответах на ваши предыдущие вопросы.
2,9 г ч 2 SO 4 x 1 моль / 98 г = 0,0296 моли H 2 SO
H 2 SO 4 ограничивает количество Na 2 SO 4 , которое может образоваться.
Theoretical yield of Na 2 SO 4 :
0.0296 mols H 2 SO 4 x 1 mol Na 2 SO 4 / mol H 2 SO 4 x 142 g Na 2 SO 4 / моль = 4,20 г Na 2 SO 4
Выход Na 2 SO 4 = фактический выход / теоретический выход (x100%)
% выхода = 3,23 г / 4,20 г (x100%) = 77% выхода (2 знаковых цифры)
Голосовать за 0 голос против
Подробнее
Отчет
Все еще ищете помощи? Получите правильный ответ, быстро.
 Задайте вопрос бесплатно
Задайте вопрос бесплатно Получите бесплатный ответ на быстрый вопрос.
Ответы на большинство вопросов в течение 4 часов.
ИЛИ
Найдите онлайн-репетитора сейчас
Выберите эксперта и встретьтесь онлайн. Никаких пакетов или подписок, платите только за то время, которое вам нужно.
Извлечение кислоты и основания из сульфата натрия, содержащего карбонат лития, с использованием биполярного мембранного электродиализа
1. Мэн Ф., Макнейс Дж., Заде С.С., Гареман А. Обзор производства и извлечения лития из минералов, соляных растворов и литий-ионных аккумуляторов. Шахтер. Процесс. Доп. Металл. 2019; 42:123–141. doi: 10.1080/08827508.2019.1668387. [CrossRef] [Google Scholar]
[CrossRef] [Google Scholar]
2. Reichel S., Aubel T., Patzig A., Janneck E., Martin M. Извлечение лития из литийсодержащих слюд с использованием сероокисляющих микроорганизмов. Шахтер. англ. 2017;106:18–21. doi: 10.1016/j.mineng.2017.02.012. [Перекрестная ссылка] [Академия Google]
3. Яскула Б.В. Литий, минеральное сырье USGS. [(по состоянию на 1 января 2020 г.)]; 2020 Доступно в Интернете: https://pubs.usgs.gov/periodicals/mcs2020/mcs2020-lithium.pdf
4. Фосу А.Ю., Канари Н., Вон Дж., Чагнес А. Обзор литературы и термодинамическое моделирование процессов обжига для извлечения лития из сподумена. Металлы. 2020;10:1312. doi: 10.3390/met10101312. [CrossRef] [Google Scholar]
5. Kuang G., Liu Y., Li H., Xing S., Li F., Guo H. Экстракция лития из β-сподумена с использованием раствора сульфата натрия. Гидрометаллургия. 2018;177:49–56. doi: 10.1016/ж.гидромет.2018.02.015. [CrossRef] [Google Scholar]
6. Суэйн Б. Восстановление и переработка лития: обзор.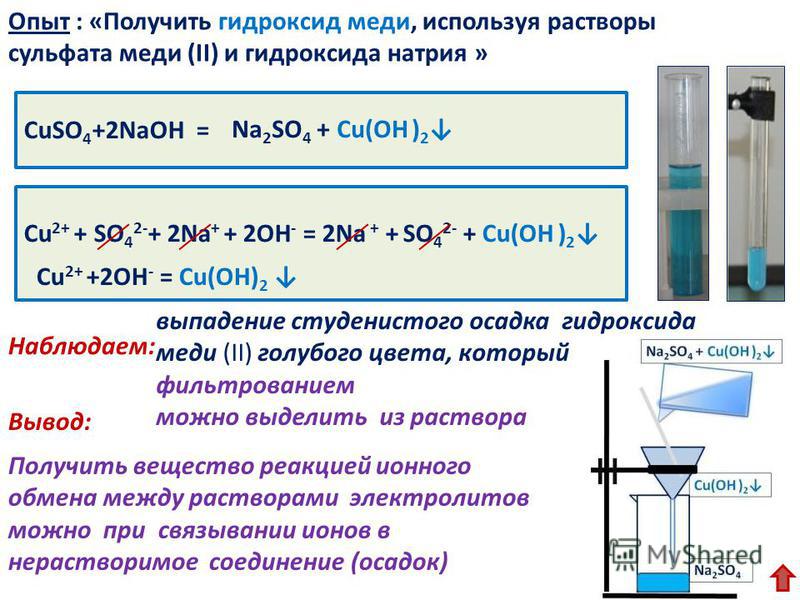
7. Барбоза Л.И., Валенте Г., Ороско Р.П., Гонсалес Х.А. Извлечение лития из β-сподумена хлорированием газообразным хлором. Шахтер. англ. 2014;56:29–34. doi: 10.1016/j.mineng.2013.10.026. [CrossRef] [Google Scholar]
8. Lajoie-Leroux F., Dessemond C., Soucy G., Laroche N., Magnan J.-F. Влияние примесей на извлечение лития из β-сподумена в сернокислотном процессе. Шахтер. англ. 2018;129: 1–8. doi: 10.1016/j.mineng.2018.09.011. [CrossRef] [Google Scholar]
9. Гизельбрехт К., Сильва А., Ван дер Брюгген Б., Буссу К., Меесхарт Б., Пиной Л. Технико-экономическое обоснование опреснения промышленного потока NaCl с помощью электродиализа с биполярной мембраной. Дж. Окружающая среда. Управление 2014; 140:69–75. doi: 10.1016/j.jenvman.2014.03.009. [PubMed] [CrossRef] [Google Scholar]
10. Ran J., Wu L., He Y., Yang Z., Wang Y., Jiang C., Ge L., Bakangura E., Xu T.
11. Huang C., Xu T. Электродиализ с биполярными мембранами для устойчивого развития. Окружающая среда. науч. Технол. 2006;40:5233–5243. doi: 10.1021/es060039p. [PubMed] [CrossRef] [Google Scholar]
12. Базине Л., Ламарш Ф., Ипперзиэль Д. Биполярно-мембранный электродиализ: Применение электродиализа в пищевой промышленности. Тенденции Food Sci. Технол. 1998; 9: 107–113. doi: 10.1016/S0924-2244(98)00026-0. [Перекрестная ссылка] [Академия Google]
13. Zaffora A., Culcasi A., Gurreri L., Cosenza A., Tamburini A., Santamaria M., Micale G. Сбор энергии путем нейтрализации отработанной кислоты/основания с помощью биполярного мембранного обратного электродиализа. Энергии. 2020;13:5510. doi: 10.3390/en13205510. [CrossRef] [Google Scholar]
14. Пярнамяэ Р., Мареев С., Никоненко В., Мельников С., Шелдешов Н., Заболоцкий В. , Хамелерс Х.В.М., Тедеско М. Биполярные мембраны: обзор принципов, последняя разработки и приложения. Дж. Член. науч. 2021; 617 doi: 10.1016/j.memsci.2020.118538. [Перекрестная ссылка] [Академия Google]
, Хамелерс Х.В.М., Тедеско М. Биполярные мембраны: обзор принципов, последняя разработки и приложения. Дж. Член. науч. 2021; 617 doi: 10.1016/j.memsci.2020.118538. [Перекрестная ссылка] [Академия Google]
15. Ярошек Х., Дайдо П. Ионообменные мембраны в химическом синтезе. Обзор. Откройте хим. 2016; 14:1–19. doi: 10.1515/chem-2016-0002. [CrossRef] [Google Scholar]
16. Wang Y., Li W., Yan H., Xu T. Удаление термостабильных солей (HSS) из отработанных алканоламиновых сточных вод с помощью электродиализа. J. Ind. Eng. хим. 2018; 57: 356–362. doi: 10.1016/j.jiec.2017.08.043. [CrossRef] [Google Scholar]
17. Yan H., Xu C., Wu Y., Mondal A.N., Wang Y., Xu T. Объединение диффузионного диализа с мембранным электролизом для извлечения гидроксида натрия из щелочного раствора метаванадата натрия. ACS Sustain. хим. англ. 2017; 5:5382–5393. doi: 10.1021/acssuschemeng.7b00688. [CrossRef] [Google Scholar]
18. Yan H., Wang Y., Wu L., Shehzad M.A., Jiang C., Fu R., Liu Z. , Xu T. Многостадийный электродиализ для концентрирования высокосоленых решения: оптимизация процессов, транспортировка воды и потребление энергии. Дж. Член. науч. 2019; 570–571: 245–257. doi: 10.1016/j.memsci.2018.10.008. [CrossRef] [Google Scholar]
, Xu T. Многостадийный электродиализ для концентрирования высокосоленых решения: оптимизация процессов, транспортировка воды и потребление энергии. Дж. Член. науч. 2019; 570–571: 245–257. doi: 10.1016/j.memsci.2018.10.008. [CrossRef] [Google Scholar]
19. Jiang C., Wang Y., Xu T. Превосходный метод получения морфолина с помощью электродиализа с биполярной мембраной. Сентябрь Пуриф. Технол. 2013; 115:100–106. doi: 10.1016/j.seppur.2013.04.053. [Перекрестная ссылка] [Академия Google]
20. Гисбрехт П.К., Фройнд М.С. Последние достижения в разработке и применении биполярных мембран. хим. Матер. 2020;32:8060–8090. doi: 10.1021/acs.chemmater.0c02829. [CrossRef] [Google Scholar]
21. Wei X., Wang Y., Yan H., Jiang C., Xu T. Устойчивое повышение ценности отходов соли неопентилгликоля, содержащих формиат натрия, посредством биполярного мембранного электродиализа. Сентябрь Пуриф. Технол. 2021; 254 doi: 10.1016/j.seppur.2020.117563. [CrossRef] [Google Scholar]
22. Линь Дж. , Е В., Хуан Дж., Рикард Б., Балтару М.-К., Грейданус Б., Балта С., Шен Дж., Влад М., Сотто А. и др. На пути к извлечению ресурсов из текстильных сточных вод: экстракция красителя, регенерация воды и основания/кислоты с использованием гибридного процесса NF-BMED. ACS Sustain. хим. англ. 2015;3:1993–2001. doi: 10.1021/acssuschemeng.5b00234. [CrossRef] [Google Scholar]
, Е В., Хуан Дж., Рикард Б., Балтару М.-К., Грейданус Б., Балта С., Шен Дж., Влад М., Сотто А. и др. На пути к извлечению ресурсов из текстильных сточных вод: экстракция красителя, регенерация воды и основания/кислоты с использованием гибридного процесса NF-BMED. ACS Sustain. хим. англ. 2015;3:1993–2001. doi: 10.1021/acssuschemeng.5b00234. [CrossRef] [Google Scholar]
23. Liu Y., Ke X., Zhu H., Chen R., Chen X., Zheng X., Jin Y., Van der Bruggen B. Обработка рафината, полученного с помощью меди гидрометаллургическая переработка руды с использованием биполярной мембранной электродиализной системы. хим. англ. J. 2020; 382 doi: 10.1016/j.cej.2019.122956. [CrossRef] [Google Scholar]
24. Zhou Y., Yan H., Wang X., Wang Y., Xu T. Замкнутый цикл производства нерастворимой в воде органической кислоты с использованием электродиализа с биполярными мембранами (BMED) J. Membr. науч. 2016; 520:345–353. doi: 10.1016/j.memsci.2016.08.011. [Перекрестная ссылка] [Академия Google]
25. Liu X., Li Q., Jiang C., Lin X., Xu T. Электродиализ с биполярной мембраной в водно-этанольной среде: производство салициловой кислоты. Дж. Член. науч. 2015; 482:76–82. doi: 10.1016/j.memsci.2015.02.030. [CrossRef] [Google Scholar]
Liu X., Li Q., Jiang C., Lin X., Xu T. Электродиализ с биполярной мембраной в водно-этанольной среде: производство салициловой кислоты. Дж. Член. науч. 2015; 482:76–82. doi: 10.1016/j.memsci.2015.02.030. [CrossRef] [Google Scholar]
26. Wei X., Wang Y., Yan H., Wu K., Xu T. Очистка метилсульфонилметана из смесей, содержащих соль, с помощью обычного электродиализа. Мембраны. 2020;10:23. doi: 10.3390/membranes10020023. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Wu X., Zhu H., Liu Y., Chen R., Qian Q., Van der Bruggen B. Восстановление Cr(III) в форме Na2CrO4 из водного раствора с использованием усовершенствованного электродиализа с биполярной мембраной. Дж. Член. науч. 2020; 604 doi: 10.1016/j.memsci.2020.118097. [CrossRef] [Google Scholar]
28. Луо Т., Абду С., Весслинг М. Селективность ионообменных мембран: обзор. Дж. Член. науч. 2018; 555:429–454. doi: 10.1016/j.memsci.2018.03.051. [CrossRef] [Google Scholar]
29. Cwirko H., Carbonell G. Теоретический анализ диализа Доннана через заряженные пористые мембраны. Дж. Член. науч. 1990;48:155–179. doi: 10.1016/0376-7388(90)85003-4. [CrossRef] [Google Scholar]
Теоретический анализ диализа Доннана через заряженные пористые мембраны. Дж. Член. науч. 1990;48:155–179. doi: 10.1016/0376-7388(90)85003-4. [CrossRef] [Google Scholar]
30. Tran ATK, Mondal P., Lin J., Meesschaert B., Pinoy L., Van der Bruggen B. Одновременная регенерация неорганической кислоты и основания из сточных вод стадии промывки металлов биполярным методом. мембранный электродиализ после предварительной обработки путем кристаллизации в реакторе с псевдоожиженным слоем. Дж. Член. науч. 2015; 473:118–127. doi: 10.1016/j.memsci.2014.09.006. [CrossRef] [Google Scholar]
31. Монат Л., Чаудхури С., Нир О. Повышение устойчивости переработки фосфогипса путем интеграции электродиализа с биполярными мембранами. ACS Sustain. хим. англ. 2020;8:2490–2497. doi: 10.1021/acssuschemeng.9b07038. [CrossRef] [Google Scholar]
32. Zhao Y., Gao C., Van der Bruggen B. Технология послойной сборки мембраны для селективного разделения одновалентных анионов и защиты от обрастания. Наномасштаб. 2019;11:2264–2274. doi: 10.1039/C8NR09086F. [PubMed] [CrossRef] [Google Scholar]
Наномасштаб. 2019;11:2264–2274. doi: 10.1039/C8NR09086F. [PubMed] [CrossRef] [Google Scholar]
33. Yang Y., Gao X., Fan A., Fu L., Gao C. Инновационное выгодное повторное использование концентрата морской воды с использованием электродиализа с биполярной мембраной. Дж. Член. науч. 2014;449: 119–126. doi: 10.1016/j.memsci.2013.07.066. [CrossRef] [Google Scholar]
34. Liu Y., Ke X., Wu X., Ke C., Chen R., Chen X., Zheng X., Jin Y., Van der Bruggen B. Одновременное удаление трехвалентного и шестивалентного хрома из почвы с использованием модифицированной биполярной мембранной электродиализной системы. Окружающая среда. науч. Технол. 2020;54:13304–13313. doi: 10.1021/acs.est.0c04105. [PubMed] [CrossRef] [Google Scholar]
35. Ye W., Huang J., Lin J., Zhang X., Shen J., Luis P., Van der Bruggen B. Экологическая оценка электродиализа с биполярной мембраной для Производство NaOH из сточных вод: преобразование NaOH в CO 2 абсорбент. Сентябрь Пуриф. Технол. 2015; 144: 206–214. doi: 10.1016/j.seppur.2015.02.031. [CrossRef] [Google Scholar]
doi: 10.1016/j.seppur.2015.02.031. [CrossRef] [Google Scholar]
36. Liu Y., Zhu H., Zhang M., Chen R., Chen X., Zheng X., Jin Y. Извлечение Cr(VI) из остатков переработки хромитовой руды с использованием усиление электрокинетического процесса биполярными мембранами. Дж. Член. науч. 2018; 566: 190–196. doi: 10.1016/j.memsci.2018.07.079. [CrossRef] [Google Scholar]
37. Yan H., Wu L., Wang Y., Irfan M., Jiang C., Xu T. Улавливание аммиака из сточных вод с высокой концентрацией аммиачного азота с помощью разделения воды и полых волокон. добыча. хим. англ. науч. 2020; 227 doi: 10.1016/j.ces.2020.115934. [CrossRef] [Google Scholar]
38. Ногучи М., Накамура Ю., Сёдзи Т., Иидзука А., Ямасаки А. Одновременное удаление и извлечение бора из сточных вод методом многоступенчатого биполярного мембранного электродиализа. J. Water Process Eng. 2018;23:299–305. doi: 10.1016/j.jwpe.2018.04.010. [CrossRef] [Google Scholar]
39. Reig M., Casas S., Gibert O., Valderrama C., Cortina J.



