Формула пероксида натрия (Na2O2), свойства, риски и использование / химия | Thpanorama
пероксид натрия представляет собой химическое соединение формулы Na2О2 которая имеет две ионные связи между двумя атомами натрия и молекулой O2. Он существует в нескольких гидратах и пероксигидратах, включая Na2О2 · 2Н2О2 · 4H2О, На2О2 · 2Н2О, На2О2 · 2Н2О2 и на2О2 · 8H2О.
Он имеет гексагональную кристаллическую структуру, однако при нагревании эта форма претерпевает переход в фазу неизвестной симметрии при 512 ° C. Его кристаллическая структура представлена на рисунке 2 (натрий: пероксид натрия, 1993-2016).
Перекись натрия можно получить в больших масштабах путем взаимодействия металлического натрия с кислородом при 130-200 ° C (Ashford, 1994), процесс, который генерирует оксид натрия, который на отдельной стадии поглощает кислород:
4 Na + O2 → На2О
2 Na2O + O2 → 2 Na2О2
Настоящий периодический процесс включает окисление натрия в моноксиде натрия сухим воздухом и последующее окисление моноксида в пероксид 90% кислородом. .
.
В 1951 году USI начала использовать первый непрерывный процесс производства пероксида натрия. Процесс уникален в одном отношении: он использует воздух вместо чистого кислорода.
В течение почти 70 лет использовались вариации периодического процесса (SCHOW, 1957), например, коммерческий продукт содержит от 90 до 95% перекиси водорода..
индекс
- 1 Физико-химические свойства пероксида натрия
- 2 Реактивность и опасности
- 3 использования
- 4 Ссылки
Перекись натрия представляет собой желтоватое гранулированное твердое вещество, которое становится желтым при контакте с атмосферой (Национальный центр биотехнологической информации, S.F.). Его внешний вид проиллюстрирован на рисунке 3.
Перекись натрия имеет молекулярную массу 77,98 г / моль и плотность 2,805 г / мл. Соединение имеет температуру плавления 460,00 ° С, где оно начинает разлагаться до оксида натрия и молекулярного кислорода в соответствии с реакцией:
2 Na2O2 → 2 Na2O + O2
Температура его кипения составляет 657 ° C (Королевское химическое общество, 2015).
Перекись натрия бурно реагирует с восстановителями, горючими материалами и легкими металлами. Реагирует экзотермически и быстро или даже взрывно с водой с образованием сильного основания (NaOH) и кислорода (O2).
Смесь с персульфатом аммония может взорваться, если она подвергается трению (дроблению в ступке), нагревается или пропускается поток газообразного диоксида углерода..
Очень бурно реагирует с газообразным сероводородом. Даже в отсутствие воздуха реакция может сопровождаться пламенем. Взрыв происходит, когда газообразный диоксид углерода пропускается через смесь пероксида натрия с порошком магния..
Смеси с уксусной кислотой или уксусным ангидридом могут взорваться, если их не хранить в холодном состоянии. Они самовозгораются при контакте с анилином, бензолом, диэтиловым эфиром или органическими материалами, такими как бумага и древесина..
Смеси с углем, глицерином, некоторыми маслами и фосфором горят или взрываются. Смесь с карбидом кальция (порошок) может загореться при воздействии влажного воздуха и взорваться при нагревании.
Разлагается, часто бурно, в присутствии каталитических количеств диоксида марганца. Смесь с монохлоридом серы приводит к бурной реакции. Может реагировать и зажигать топливо (ПЕРОКСИД НАТРИЯ, 2016).
Реактивность и опасностиПерекись натрия — это соединение, классифицируемое как сильное основание, взрывоопасный и сильный окислитель в соответствии с его активностью. Смеси с горючим материалом легко воспламеняются от трения, нагрева или контакта с влагой.
Он может интенсивно разлагаться при длительном воздействии тепла, вызывая разрушение контейнеров, в которых он находится..
Очень опасно при попадании на кожу и в глаза (раздражение), а также при проглатывании и вдыхании. Длительное воздействие может вызвать ожоги и изъязвления кожи. Передержка при вдыхании может вызвать раздражение дыхательных путей.
Воспаление глаз характеризуется покраснением, раздражением и зудом. Воспаление кожи характеризуется зудом, шелушением, покраснением или иногда волдырями.
В случае попадания в глаза, вы должны проверить, носите ли вы контактные линзы и снять их. Немедленно промойте глаза проточной водой в течение не менее 15 минут, держа веки открытыми..
При попадании на кожу осторожно и тщательно промыть загрязненную кожу проточной водой и неабразивным мылом. Вы можете использовать холодную воду. Раздраженная кожа должна быть покрыта смягчающим средством.
Если контакт с кожей серьезный, его следует промыть дезинфицирующим мылом и покрыть кожу, загрязненную антибактериальным кремом..
В случае вдыхания пострадавшему должно быть разрешено отдыхать в хорошо проветриваемом помещении..
Эвакуировать пострадавшего в безопасное место как можно скорее. Ослабьте тесную одежду, такую как воротник рубашки, ремень или галстук. Если дыхание затруднено, введите кислород. Если пострадавший не дышит, проведите реанимацию «рот в рот».
В случае проглатывания не вызывать рвоту. Если пострадавший не дышит, проведите реанимацию «рот в рот».
Во всех случаях следует немедленно обратиться к врачу (паспорт безопасности материала, пероксид натрия, 2013 г.).
приложенийПерекись натрия используется в отбеливателях для стирки, поскольку она вступает в реакцию с водой с образованием перекиси водорода, отбеливающего агента в соответствии с реакцией:
не доступно2О2 + 2 ч2O → 2 NaOH + H2О2
Помимо перекиси водорода, в результате реакции образуется гидроксид натрия (щелок), который поддерживает щелочной раствор. Горячая вода и щелочной раствор необходимы для того, чтобы перекись водорода работала лучше как отбеливатель (Field, S.F.).
Перекись натрия используется для отбеливания древесной массы для производства бумаги и текстиля. В настоящее время он в основном используется для специализированных лабораторных работ, например, для добычи полезных ископаемых. Кроме того, в химических реакциях пероксид натрия используется в качестве окислителя.
Он также используется в качестве источника кислорода путем взаимодействия его с диоксидом углерода для получения кислорода и карбоната натрия, поэтому он особенно полезен в водолазном снаряжении, подводных лодках и т. Д. (Использование пероксида натрия для очистки выбросов углекислого газа, 2014).
ссылки- Эшфорд Р. (1994). Эшфордский словарь по промышленной химии. Лондон: Publications Ltd.
- Филд С. (S.F.). Ингредиенты — перекись натрия. Получено с сайта sci-toys.com.
- Паспорт безопасности материала Перекись натрия. (2013, 21 мая). Получено с sciencelab.com.
- Национальный центр биотехнологической информации. (S.F.). База данных PubChem Compound; CID = 14803. Получено из ПабХима.
- Королевское химическое общество. (2015). Пероксид натрия Получено с chemspider.com.
- Щоу, Х. Р. (1957). История производства пероксида натрия. Достижения в химии, том 19, 118-123.
- ПЕРОКСИД НАТРИЯ. (2016). Извлечено от Cameochemicals.

- Натрий: пероксид натрия. (1993-2016). Извлечено от webelements.
- Использование перекиси натрия для очистки выбросов углекислого газа. (2014, 10 ноября). Получено из stackexchange.
Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Помогите написать уравнения реакций с помощью которых можно осуществить следующие превращения: SiO2-Si-Ca2Si-Sih5-SiO2-Si; б). ..
..
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
cr2(so4)3 h3o2 naoh=na2cro4 na2so4 h3o…
Структурная формула всех изомеров С7Н16
электронный баланс Nh4+O2=NO+h3O
Пользуйтесь нашим приложением
Видео с вопросами: Баланс химических уравнений для реакции между металлическим натрием и кислородом
Стенограмма видео
Что из следующего является
правильное сбалансированное уравнение реакции натрия с кислородом? (A) Реакция двух твердых веществ Na и газообразного O2
для получения двух твердых частиц Na2O2. (B) Реакция двух твердых веществ Na и газообразного O2
для получения четырех твердых Na2O. (C) Реакция четырех твердых веществ Na и газообразного O2
для получения двух твердых веществ NaO2. (D) Реакция четырех твердых веществ Na и газообразного O2
для получения двух твердых веществ Na2O.
Натрий может реагировать с кислородом с образованием Na2O или оксида натрия. В качестве альтернативы натрий может быть реагирует с кислородом с образованием Na2O2, перекиси натрия. NaO2, или супероксид натрия, может быть получают реакцией пероксида натрия с кислородом при высокой температуре и давление. Так что вполне возможно, что этот продукт сформирован. Мы можем выяснить, какой из уравнения верны, просматривая их по очереди и проверяя, верны ли они правильно сбалансирован.
Начнем с варианта (А). Мы можем опустить государственные символы как
они все одинаковые. Всего два элемента в
эти реакции, натрий и кислород. В этом уравнении реакции есть
только один вид реагентов, содержащий натрий. Это касается всех
опции. Имеет стехиометрический коэффициент
из двух. Таким образом, мы можем поставить счет два для
натрия в колонке реагентов. И есть только один
кислородсодержащие частицы на стороне реагента. Это газообразный кислород, и это
то же самое для всех вариантов (A) — (E). Он имеет значение нижнего индекса
два. Таким образом, мы можем подсчитать два для
кислорода в колонке реагентов. Нам не нужно менять счет
для кислорода в колонке реагентов для остальных вариантов как все варианты от (А) до
(E) иметь только один моль газообразного кислорода в качестве исходного материала.
Имеет стехиометрический коэффициент
из двух. Таким образом, мы можем поставить счет два для
натрия в колонке реагентов. И есть только один
кислородсодержащие частицы на стороне реагента. Это газообразный кислород, и это
то же самое для всех вариантов (A) — (E). Он имеет значение нижнего индекса
два. Таким образом, мы можем подсчитать два для
кислорода в колонке реагентов. Нам не нужно менять счет
для кислорода в колонке реагентов для остальных вариантов как все варианты от (А) до
(E) иметь только один моль газообразного кислорода в качестве исходного материала.
Для натрия, присутствующего в
со стороны продукта, он имеет значение нижнего индекса два и стехиометрический коэффициент
два. Если мы умножим эти значения
вместе мы получаем значение четыре. Дело обстоит так же для
кислород. Он имеет значение нижнего индекса два и
стехиометрический коэффициент два.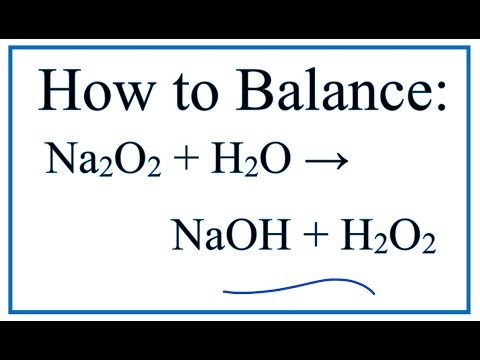 Мы можем умножить эти значения
вместе, чтобы получить значение четыре. Мы видим, что ни натрий, ни
кислород сбалансирован. Таким образом, уравнение в варианте (А) имеет вид
неправильно сбалансирован, и это не может быть ответом на этот вопрос.
Мы можем умножить эти значения
вместе, чтобы получить значение четыре. Мы видим, что ни натрий, ни
кислород сбалансирован. Таким образом, уравнение в варианте (А) имеет вид
неправильно сбалансирован, и это не может быть ответом на этот вопрос.
Вариант (B) представляет собой реакцию двух Na плюс O2
для получения четырех Na2O. Опять же, у нас есть значение два для
натрия на стороне реагента. Но со стороны продукта натрий
значение нижнего индекса два и стехиометрический коэффициент четыре. Если мы умножим эти значения
вместе мы получаем значение восемь. Таким образом, количество натрия равно восьми для
сторона продукта. Кислород не имеет индекса
значение, поэтому мы можем считать, что оно равно единице. Но он имеет стехиометрический
коэффициент четыре, так что кислород имеет счет четыре на стороне продукта. Опять же, подсчеты для кислорода и
натрий не сбалансирован.
Вариант (C) представляет собой реакцию четырех Na плюс O2 для получения двух NaO2. На этот раз у натрия есть стехиометрический коэффициент четыре для стороны реагента. Но со стороны продукта у него есть коэффициент два. Таким образом, натрий имеет только два в колонке продуктов. Кислород же, напротив, имеет значение нижнего индекса два и стехиометрический коэффициент два. Если мы умножим эти значения вместе мы получаем значение четыре. Так что опять ни натрий, ни кислород сбалансированы, и вариант (С) не может быть ответом на этот вопрос.
Вариант (D) представляет собой реакцию четырех Na плюс O2
для получения двух Na2O. Натрий на стороне реагента имеет
стехиометрический коэффициент четыре. Таким образом, мы можем сделать счет четырем для
натрия в колонке реагентов. Со стороны продукта натрий имеет
значение нижнего индекса два и стехиометрический коэффициент два. Если мы умножим эти значения
вместе мы также получаем значение четыре. Кислород на стороне продукта не
имеют значение нижнего индекса, но имеют стехиометрический коэффициент, равный двум. Таким образом, мы можем подсчитать два для
кислород на стороне продукта. Натрий имеет число четыре на
сторона реагента и сторона продукта. И кислород имеет счет два на
сторона реагента и сторона продукта. Так как и натрий, и кислород
уравновешены, то уравнение реакции должно быть уравновешено.
Со стороны продукта натрий имеет
значение нижнего индекса два и стехиометрический коэффициент два. Если мы умножим эти значения
вместе мы также получаем значение четыре. Кислород на стороне продукта не
имеют значение нижнего индекса, но имеют стехиометрический коэффициент, равный двум. Таким образом, мы можем подсчитать два для
кислород на стороне продукта. Натрий имеет число четыре на
сторона реагента и сторона продукта. И кислород имеет счет два на
сторона реагента и сторона продукта. Так как и натрий, и кислород
уравновешены, то уравнение реакции должно быть уравновешено.
Похоже, вариант (D)
ответ на этот вопрос. Но для подтверждения давайте посмотрим на
вариант (Е). Натрий на стороне реагента имеет
стехиометрический коэффициент два, как и на стороне продукта. Но кислород на стороне продукта
имеет значение нижнего индекса два и стехиометрический коэффициент два. Если вы умножите их вместе, вы
получить значение четыре. Таким образом, хотя натрий сбалансирован,
кислорода нет. Так что вариант (Е) не может быть ответом
на этот вопрос.
Если вы умножите их вместе, вы
получить значение четыре. Таким образом, хотя натрий сбалансирован,
кислорода нет. Так что вариант (Е) не может быть ответом
на этот вопрос.
Следовательно, ответ на вопрос «Какое из приведенных ниже уравнений является правильным уравнением реакции натрия с кислородом?» (D): четыре твердых вещества Na плюс газообразный O2 реагируют с образованием двух Na2O твердый.
Оксид натрия — Sciencemadness Wiki
Оксид натрия — это химическое соединение с формулой Na 2 O . Это один из трех оксидов натрия, а также пероксид натрия и супероксид натрия.
Содержание
- 1 Свойства
- 1.1 Химическая
- 1.2 Физический
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.2 Хранение
- 5.
 3 Утилизация
3 Утилизация
- 6 Каталожные номера
- 6.1 Соответствующие темы Sciencemadness
Свойства
Химический
Оксид натрия реагирует с водой с образованием гидроксида натрия. Реакция сильно экзотермична.
- Na 2 O + H 2 O → 2 NaOH
Реакция со спиртами дает соответствующие им алкоксиды.
Физический
Оксид натрия представляет собой белое твердое вещество, которое вступает в реакцию с водой и атмосферной влагой. Он плавится при 1132 °С и кипит при 1950 °С, хотя возгоняться начинает при 1275 °С.
Доступность
Оксид натрия продается поставщиками химикатов, хотя его трудно достать.
Подготовка
Оксид натрия можно получить несколькими способами.
Наиболее распространенный метод включает сжигание натрия в воздухе. В результате реакции образуются как оксид натрия, так и пероксид натрия, причем последний составляет около 20% продукта.
Реакция металлического натрия с гидроксидом натрия, перекисью натрия или нитритом натрия также дает оксид натрия.
Другой распространенный способ включает прокаливание карбоната натрия при 800–1000 °C.
- Na 2 CO 3 → Na 2 O + CO 2
Эта реакция требует постоянной высокой температуры и протекает в течение длительного периода времени.
Более низкотемпературный путь включает разложение аскорбата натрия, который можно легко получить путем взаимодействия бикарбоната натрия с аскорбиновой кислотой. Разложение начинается при 218°С с образованием оксида натрия и фуранов. [1]
При разложении нитрита натрия выделяются оксиды азота и остается оксид натрия. Разложение начинается примерно при 320 °C.
Последние три реакции дают горячий оксид натрия, который может быстро поглощать влагу и углекислый газ и снова превращаться в гидроксид/карбонат натрия. Охлаждение горячего гидроксида натрия следует проводить в инертной среде.


 03.17
03.17 3 Утилизация
3 Утилизация