Химические уравнения. 8 класс — презентация онлайн
Похожие презентации:
Химические уравнения
Закон сохранения массы веществ. Уравнения химических реакций
Уравнения химической реакции 8 класс
Химические уравнения. Типы химических реакций
Химические уравнения
Расчеты по химическим уравнениям
Расчеты по химическим уравнениям
Скорость химических реакций. Катализ. Химическое равновесие
Химическая кинетика, химическое равновесие и катализ
Химическое равновесие и химическая кинетика
Цели урока:
1. Сформировать представление о
химическом уравнении.
2. Начать формировать умение
составлять уравнения
химических реакций.
Проверка домашнего задания
1. Какие явления называются
химическими?
2. Внешние признаки химических
реакций.
3.Сформулируйте закон
сохранения массы веществ.
Работа на карточках.
Атомно-молекулярная теория
Молекулы состоят из атомов.
изменяются и не исчезают,
происходит лишь их
перегруппировка, т.е. образуются
новые вещества.
Следовательно, их общая масса
также не изменяется
Основные правила составления
химических уравнений:
1. В левой части уравнения пишутся формулы веществ,
вступающих в реакцию – исходные вещества.
2. В правой части – формулы получившихся веществ –
продукты реакции.
3. Между исходными веществами и продуктами
реакции ставится стрелка.
4. На основании закона сохранения веществ
уравниваются атомы.
5.Число атомов каждого элемента в правой части равно
числу атомов этого же элемента в левой части.
6. Уравнивание атомов производится с помощью
подбора коэффициентов перед формулами веществ.
Химическим уравнением называют
условную запись химической реакции
с помощью химических формул и
математических знаков.
При разложении воды образуются два
газообразных вещества — Н2 и О2.

h3O
h3 + O2
2h3O == 2h3 + O2
Уравнение химической реакции
Алгоритм составления уравнения
химической реакции
1. Записать формулы исходных
веществ.
2. Справа от формул исходных
веществ (после стрелки)
записать формулы продуктов
реакции.
3. Расставить коэффициенты.
Горение магния
Mg + O2
MgO
2Mg + O2 = 2MgO
Работа у доски
1. Получение углекислого газа:
С + О2
2. Разложение ртути:
HgO
3. Окисление натрия:
Na + O2
Соотношение количеств веществ,
участвующих в реакции.
Коэффициенты показывают не только
число молекул каждого вещества, но и
соотношение количеств веществ,
которые участвуют в реакции.
Например: 2Н2 + О2 = 2Н2О
Для образования воды(2 моль)
необходимо столько же моль водорода(2
моль) и в 2 раза меньше кислорода (1
Задача:
Определить количество вещества кислорода,
образующегося в результате разложения 4
моль воды.
Алгоритм решения задачи:
1.
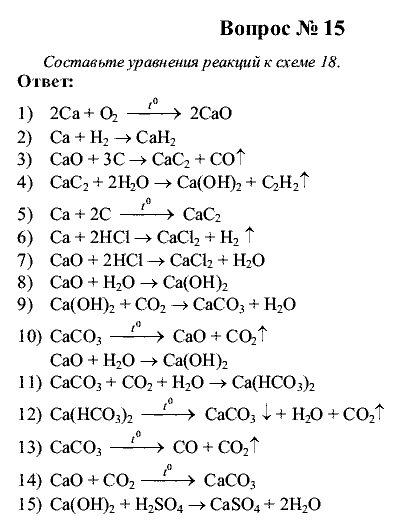 Составить уравнение реакции.
Составить уравнение реакции.2. Составить пропорцию, определив
количества веществ по уравнению реакции и
по условию, неизвестное берем за Х.
3. Составить уравнение (из пропорции).
4. Решить уравнение, найти Х.
Задача:
Какое количество кислорода
потребуется для полного сгорания
3 моль меди?
Ответ: n (О2) = 1,5 моль
Что мы узнали нового?
1. Химическим уравнением называют условную
запись химической реакции с помощью химических
формул и математических знаков.
2. В левой части уравнения пишутся формулы
веществ, вступающих в реакцию – исходные вещества.
3. В правой части – формулы получившихся веществ –
продукты реакции.
4. На основании закона сохранения веществ
уравниваются атомы.
5. Коэффициенты
показывают не только число
молекул каждого вещества, но и соотношение
количеств веществ, которые участвуют в реакции.
English Русский Правила
Формулы и калькуляторы для решения задач по химии
Ежедневно, сами того не замечая, мы на каждом шагу имеем дело с химией. Умывшись и одевшись с утра мы уже имеем дело с рядом химических продуктов и процессов. Вода, мыло, одежда — разные виды продуктов химии. Действие воды, мыла на кожу, реакция тела на теплую одежду — химические процессы. Сегодня, как и тысячи лет назад, мы едим, дышим, плачем, смеемся и независимо от нас в организме совершаются самые разные химические процессы. Химия имеет дело не с вещами, а с веществами, из них состоят вещи, животные и растительные организмы, минералы. Вещество имеет массу, вес, занимает объем, обладает как физическими, так и химическими свойствами. Химия изучает строение, свойства вещества и происходящие с ним в результате химических реакций изменения, законы, которым эти превращения подчиняются. Химию считают экспериментальной наукой. Чтобы объяснить происходящие явления, ученые осуществляли в разные времена разнообразные химические эксперименты, анализировали результаты, создавали теории, которые подтверждали новыми экспериментами. Вещества могут быть сложными и разлагаться на простые и не разлагаемыми — химическими элементами.
Умывшись и одевшись с утра мы уже имеем дело с рядом химических продуктов и процессов. Вода, мыло, одежда — разные виды продуктов химии. Действие воды, мыла на кожу, реакция тела на теплую одежду — химические процессы. Сегодня, как и тысячи лет назад, мы едим, дышим, плачем, смеемся и независимо от нас в организме совершаются самые разные химические процессы. Химия имеет дело не с вещами, а с веществами, из них состоят вещи, животные и растительные организмы, минералы. Вещество имеет массу, вес, занимает объем, обладает как физическими, так и химическими свойствами. Химия изучает строение, свойства вещества и происходящие с ним в результате химических реакций изменения, законы, которым эти превращения подчиняются. Химию считают экспериментальной наукой. Чтобы объяснить происходящие явления, ученые осуществляли в разные времена разнообразные химические эксперименты, анализировали результаты, создавали теории, которые подтверждали новыми экспериментами. Вещества могут быть сложными и разлагаться на простые и не разлагаемыми — химическими элементами.
- аналитическая химия, ее задача — качественный и количественный анализ веществ;
- физическая химия, исследующая физические явления, химические реакции и их закономерности;
- биохимия, изучающая на молекулярном уровне химические реакции, происходящие в живых организмах;
- неорганическая химия, где изучают все элементы (кроме углерода) периодической таблицы Менделеева;
- органическая химия — исследует все соединения углерода.
Не секрет, что химия многим из нас кажется наукой сложной и далеко не всем понятной. Хотя именно с химией мы ежедневно сталкиваемся на каждом шагу. Окружающий нас мир можно легко представить в виде химических элементов, химических процессов и реакций, ежесекундно происходящих в мире. Многим специалистам приходиться ежедневно решать задачки по химии. Так, врач-диетолог обсчитывает калорийность пищи, врач-косметолог уделяет огромное внимание взаимодействию разных веществ, чтобы предложенное им средство являлось максимально эффективным и безопасным для организма человека. Студентам и учащимся приходиться выполнять довольно сложные лабораторные и контрольные работы, решать многочисленные задачи по химии. Помочь в решении всевозможных задач, связанных с такой достаточно нелегкой, но весьма интересной наукой как химия, сможет предлагаемый нами онлайн калькулятор.
Хотя именно с химией мы ежедневно сталкиваемся на каждом шагу. Окружающий нас мир можно легко представить в виде химических элементов, химических процессов и реакций, ежесекундно происходящих в мире. Многим специалистам приходиться ежедневно решать задачки по химии. Так, врач-диетолог обсчитывает калорийность пищи, врач-косметолог уделяет огромное внимание взаимодействию разных веществ, чтобы предложенное им средство являлось максимально эффективным и безопасным для организма человека. Студентам и учащимся приходиться выполнять довольно сложные лабораторные и контрольные работы, решать многочисленные задачи по химии. Помочь в решении всевозможных задач, связанных с такой достаточно нелегкой, но весьма интересной наукой как химия, сможет предлагаемый нами онлайн калькулятор.
Сегодня без химии и ее знаний невозможно обойтись. Без знания химии тренер не сможет рассчитать количество калория спортсмену, диетолог — расписать рацион питания больному, фармаколог — приготовить раствор, соблюдая нужные пропорции и учитывая принципы взаимодействия веществ и т. д. С помощью онлайн калькулятора вы сможете быстро и правильно определить плотность вещества, находить химические реакции, решать разнообразные химические задачи и уравнения, выполнять различные работы и контрольные по химии, На основе уравнения можно вычислить объем, массу или количество искомых веществ.
д. С помощью онлайн калькулятора вы сможете быстро и правильно определить плотность вещества, находить химические реакции, решать разнообразные химические задачи и уравнения, выполнять различные работы и контрольные по химии, На основе уравнения можно вычислить объем, массу или количество искомых веществ.
Калькулятор и калькулятор химических уравнений — Бесплатный онлайн-калькулятор
Химия — одна из важнейших отраслей естествознания. Хотя это часто считается сложной и монотонной дисциплиной, на самом деле все обстоит иначе. Химия очень практична, логична и так или иначе ценна во всех аспектах нашей жизни. Законы химии диктуют многие природные явления, происходящие вокруг нас, будь то пылающее солнце над головой, облака, извержения вулканов, фотосинтез и даже наши собственные тела. В нашей повседневной жизни химия играет жизненно важную роль в таких областях, как уборка, приготовление пищи и медицина. Сегодня это стало еще более актуальным из-за спроса на экологически чистые продукты и процедуры.
Разве не увлекательно думать, что в нашем теле происходят миллионы химических реакций, когда мы бежим, сидим, едим или даже просто дышим? Таким образом, знание химии необходимо для студентов, стремящихся стать врачами, фармацевтами, физиками, диетологами, геологами или агрономами. Основы химии основаны на математике и логике. Таким образом, нужно быть сильным в этих областях, чтобы понимать химические реакции и свойства. Например, химические уравнения используются для представления того, как происходит химическая реакция. Эти уравнения должны быть сбалансированы, чтобы подчиняться законам сохранения массы и энергии.
Сбалансировать химическое уравнение иногда может быть довольно сложной и трудоемкой задачей. Если вы столкнулись с трудностями с тем же самым или просто не хватает времени, вы можете попробовать использовать калькулятор химических уравнений для балансировки уравнения. Вы можете положиться на него, чтобы получить быстрые и точные результаты. Давайте подробнее рассмотрим особенности этого уникального балансировщика и калькулятора химических уравнений.
Что такое химическое уравнение?
Прежде чем читать о калькуляторе химических уравнений, давайте сначала разберемся, что такое химическое уравнение. В химии уравнение — это в основном символическое представление химической реакции. По закону сохранения массы атомы не образуются и не разрушаются в ходе химической реакции. Во время химической реакции происходит перегруппировка атомов. В химическом уравнении реагенты и продукты условно показаны слева и справа от стрелки соответственно.
В соответствии с законами сохранения массы и заряда количество атомов каждого типа и общий заряд должны быть одинаковыми в обеих частях сбалансированного химического уравнения. Единственная разница в каждой части уравнения заключается в расположении атомов для образования ионов или молекул. Это связано с тем, что в реакции обычно связи реагентов разрываются, и новые связи должны давать продукты. Если количество атомов каждого вида в двух частях уравнения различно, то реакция неуравновешенная. В результате он не может правильно представить, что происходит во время реакции.
В результате он не может правильно представить, что происходит во время реакции.
Например, рассмотрим приведенный ниже пример:
CH 4 + Cl 2 → CCl 4 + HCl
Сбалансированное химическое уравнение для приведенной выше реакции: 2 → CCl 4 + 4HCl
Используя химическое уравнение, мы также можем определить константу равновесия реакции (K eq ). Он определяется как значение коэффициента реакции в состоянии химического равновесия. К экв. реакции формулируется как количество продуктов, деленное на количество реагентов. Здесь каждое количество выражено либо концентрацией, либо парциальным давлением, возведенным в степень его коэффициента в сбалансированном химическом уравнении.
Существует множество способов вручную сбалансировать химическое уравнение. Однако эти методы, как правило, требуют много времени, а иногда и сложны. Калькулятор химических уравнений очень полезен для студентов, преподавателей и ученых, которым необходимо точно и быстро сбалансировать химическое уравнение.
Что такое калькулятор химических уравнений?
Калькулятор химических уравнений — это полезный онлайн-инструмент, который может точно сбалансировать данное химическое уравнение за считанные секунды. Помимо этого, он также способен отображать химическую структуру и свойства данного вещества, а также его химическое название и формулу. Он даже может отображать для вас константу равновесия (K eq ) реакции. Этот полезный инструмент можно использовать совершенно бесплатно, и к нему можно получить доступ из любой точки мира, если у вас есть работающее подключение к Интернету.
Как пользоваться калькулятором химических уравнений?
Вы можете использовать калькулятор химических уравнений, выполнив простые шаги, указанные ниже:
- Откройте калькулятор и введите необходимое химическое уравнение в поле ввода.
- Нажмите кнопку Баланс.
В течение нескольких секунд калькулятор отобразит сбалансированное химическое уравнение в новом окне вместе с константой равновесия, химическими структурами и формулами участвующих элементов и соединений.
Калькулятор химических уравнений запрограммирован с использованием современного алгоритма, обеспечивающего получение точных результатов за короткое время. Настоятельно рекомендуется как новичкам, так и профессионалам.
Калькулятор химического уравнения — ezcalc.me
Этот онлайн-калькулятор химического уравнения находит стехиометрические коэффициенты для балансировки заданного химического уравнения, включая уравнения со свободными электронами и электрически заряженными молекулами (ионами).
Вы можете ввести химическое уравнение вручную или вставить уравнение, скопированное с веб-страницы или текстового документа (включая файл DOC или PDF). Индексы, обозначенные HTML-тегами и (например, H 2 O), а также обозначенные «крошечными» цифрами, например ₂ или ₅ (например, H₂O), поддерживаются и автоматически преобразуются в нормальную форму.
Далее следует более подробное руководство по синтаксису нашего балансировщика химических уравнений.
Балансировка химических уравнений
Химическое уравнение представляет собой символическое представление химической реакции с реагентами в левой части и продуктами в правой части уравнения.
Уравновешивание химических уравнений означает поиск стехиометрических коэффициентов для реагентов и продуктов. Это важно, потому что в химической реакции количество каждого элемента не меняется (закон сохранения массы). Таким образом, каждая часть уравнения должна представлять одинаковое количество атомов любого химического элемента. В случае ионных реакций в обеих частях уравнения должен присутствовать одинаковый электрический заряд.
Существует ряд методов балансировки химических уравнений. Но в случае сложных реакций с участием многих соединений предпочтительнее уравновешивать уравнения алгебраическими методами, основанными на решении системы линейных уравнений.
Наш калькулятор балансировки химических уравнений использует алгоритм исключения Гаусса-Жордана для решения системы линейных уравнений. Метод модифицирован для нахождения целых коэффициентов.
Метод модифицирован для нахождения целых коэффициентов.
Руководство по синтаксису
• Реагенты и продукты химической реакции разделяются знаком равенства (=). Вещества разделены знаком плюс (+).
• Формулу вещества следует вводить с использованием прописной буквы для первого символа в названии элемента и нижнего регистра для второго символа (сравните: Co – кобальт и CO – окись углерода). Перед формулой не должно быть числового коэффициента.
• Индексы следует вводить в виде обычных чисел после соответствующих элементов или групп, например. h3O для молекулы воды или (Nh5)2SO4 для сульфата аммония.
• В формулах можно использовать круглые скобки ( ), квадратные скобки [ ] и скобки (фигурные скобки) { }. Также разрешены вложенные скобки, например. [Co(Nh4)6]Cl3. Степень вложенности неограничена, но все кронштейны должны быть сбалансированы.
• Для обозначения иона укажите его заряд в фигурных скобках после соединения: {+2} или {2+}. Пример: H{+}+CO3{2-}=h3O+CO2.
• Чтобы включить электрон в химическое уравнение, используйте {-}, например. Fe{+3}+{-}=Fe.
• Не входить в состояние соединений, таких как твердые тела (s), жидкости (l) или газы (g).
Использование калькулятора Chemical Equation Balancer
При вводе химического уравнения вручную или вставке скопированного уравнения оно автоматически преобразуется в «нормальную» форму в соответствии с приведенными выше правилами. Все пробелы игнорируются, а символ → преобразуется в =. Но символы ↑ и ↓ остаются на месте.
Обратите внимание, что и индексы, и начисления могут быть обозначены в исходном документе с помощью html-тегов и , например SO 4 -2 , или обозначаются с помощью «крошечных» символов, например SO₄⁻². Они также автоматически преобразуются в «нормальную» форму.
Отдельный электрон можно обозначить как e – (e—) или e⁻ (с «крошечным» минусом).
Формат вывода
С помощью соответствующего выпадающего меню можно выбрать формат вывода для сбалансированного химического уравнения:
• Html – Сбалансированное уравнение представлено с использованием тегов html для индексов и начислений. Один электрон обозначается как e – . Нажав кнопку «Копировать в буфер обмена» ( ), вы можете скопировать результат «как есть», включая все теги, а затем вставить его на любую html-страницу. Однако, нажав Ctrl-A и Ctrl-C, вы можете скопировать результат без тегов и вставить его в документ DOC, сохранив правильно отформатированные индексы и начисления.
Один электрон обозначается как e – . Нажав кнопку «Копировать в буфер обмена» ( ), вы можете скопировать результат «как есть», включая все теги, а затем вставить его на любую html-страницу. Однако, нажав Ctrl-A и Ctrl-C, вы можете скопировать результат без тегов и вставить его в документ DOC, сохранив правильно отформатированные индексы и начисления.
• Маленькие индексы – Сбалансированное уравнение представлено с использованием «крошечных» символов для индексов и зарядов. Например, CO₃²⁻, где используются символы Юникода: ₃ = (\u2083), ² = (\u00B2), ⁻ = (\u207B). Один электрон обозначается как e⁻.
• Обычный – Сбалансированное уравнение представлено в соответствии с приведенным выше руководством по синтаксису.
Уведомления об ошибках
Имеется ряд очевидных уведомлений в случае обнаружения ошибки в ходе первоначальной проверки введенного уравнения, например Неожиданный символ или Скобки не сбалансированы . Особого внимания заслуживают следующие уведомления:
Особого внимания заслуживают следующие уведомления:
Неверное уравнение – Введенное уравнение содержит химические элементы в левой части, которые отсутствуют в правой части, или наоборот.
Невозможная реакция – Введенное уравнение представляет собой невозможную реакцию. Например, уравнение (NH 4 ) 2 SO 4 =NH 4 OH+SO 2 имеет только тривиальное решение, когда все коэффициенты равны нулю.
Несколько независимых решений – Введенное уравнение можно уравновесить бесконечным числом способов. Обычно это комбинация нескольких различных независимых реакций. Например, уравнение H+O=H 2 O+HO не имеет единственного решения, потому что, например, есть два решения: 3H+2O=H 2 O+HO и 4H+3O=H 2 O+. 2HO, которые не кратны друг другу. Уравнение можно разделить как H + O = H 2 O и H + O = HO, каждое из которых имеет единственное решение.
Иногда уравнение нельзя однозначно сбалансировать, поскольку оно содержит неизменяемые группы в химических соединениях. Например, уравнение C 6 H 5 C 2 H 5 + O 2 = C 6 H 5 OH + CO 2 + H 2 O Нель , но если мы заменим неизменяемую группу C 6 H 5 на X, то XC 2 H 5 + O 2 = XOH + CO 2 + H 2 O можно легко сбалансировать.
Например, уравнение C 6 H 5 C 2 H 5 + O 2 = C 6 H 5 OH + CO 2 + H 2 O Нель , но если мы заменим неизменяемую группу C 6 H 5 на X, то XC 2 H 5 + O 2 = XOH + CO 2 + H 2 O можно легко сбалансировать.
Примечание: Имя элемента, введенное в соответствии с приведенным выше руководством по синтаксису, не обязательно должно указывать на реальный химический элемент.
Пример химического уравнения для балансировки
Наш калькулятор химического баланса представляет собой сложный онлайн-инструмент, который позволяет легко решать даже самые сложные задачи балансировки химических уравнений.
Например, в статье в Journal of Chemical Education были приведены три естественные реакции, которые были описаны как «сложные или невероятно сложные для балансировки». Одна из этих реакций считалась невозможной для балансировки.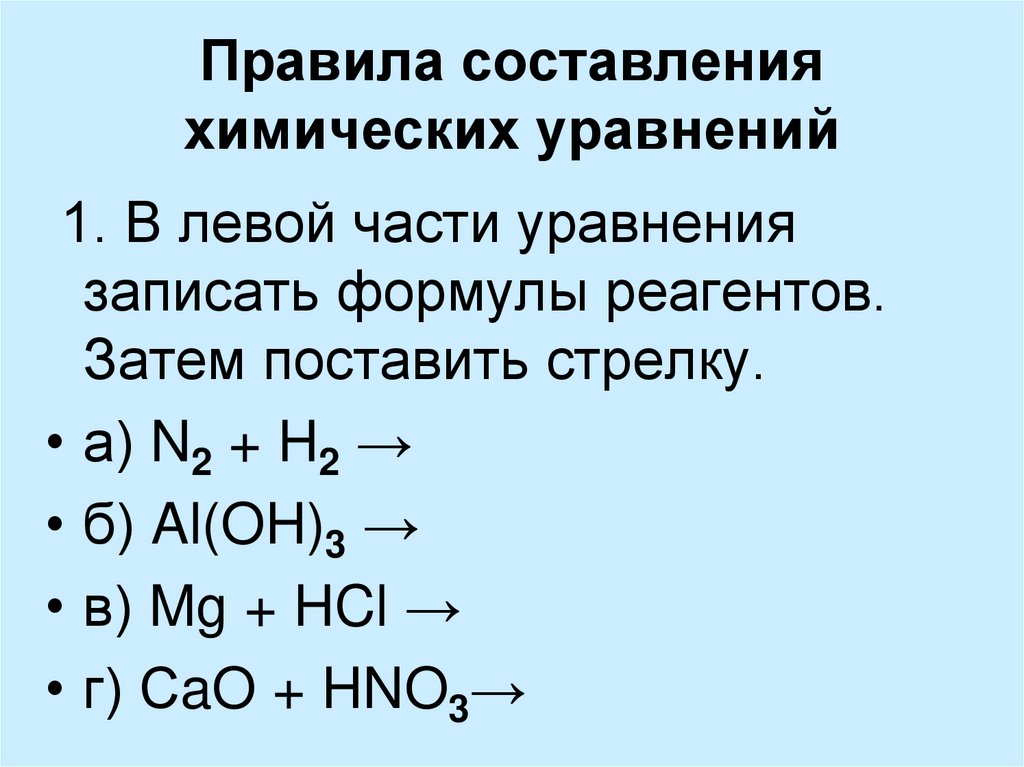 Вот оно:
Вот оно:
[CR (N 2 H 4 CO) 6 ] 4 [CR (CN) 6 ] 3 +KMNO 4 +H 2 SO 4 4 +H 2 SO 4 = K 2 SO 4 40018 +H 2 SO 4 40018 +H 2 SO 4 . 2
CR 2 O 7 +MNSO 4 +CO 2 +KNO 3 +K 2 SO 4 +H 2 O. . статьи несколько часов, чтобы сбалансировать это уравнение вручную, и еще час, чтобы проверить ответ. С нашим балансировщиком уравнений вы можете получить результат за доли секунды: 10 [Cr(N 2 H 4 CO) 6 ] 4 [Cr(CN) 6 ] 3 + 1176 KMnO 4 + 1399 H 2 SO 4 = 35 K 2 Cr 2 O 7 + 1176 MnSO 4 + 420 CO 2 + 660 KNO 3 + 223 K 2 SO 4 + 1879 H 2 O.
