Урок «Ионные уравнения» | Методическая разработка по химии (8 класс) по теме:
Муниципальное бюджетное образовательное учреждение «Школа №3»
г.Богородска Нижегородской области
8 класс
Ионные уравнения
Составитель: Попадинец Наталья Вячеславовна,
учитель химии I категории
г. Богородск, 2016г
Пояснительная записка
Предмет Химия
Класс 8
Тема Ионные уравнения
УМК 1)О.С.Габриелян Программа курса химии для 8 – 11 классов для общеобразовательных учреждений. – М.: Дрофа, 2010
2) О.С.Габриелян Химия 8 класс. – М.: Дрофа, 2010
3) О.С.Габриелян Химия. 8-9 классы: методическое пособие.- М.:Дрофа,2011
4) О.С.Габриелян, Н.П. Воскобойникова, А.В.Яшукова Химия. 8 класс. Настольная книга учителя. М.:Дрофа.
Цель формирование представлений о реакциях ионного обмена.
Задачи
Образовательные: познакомить учащихся с реакциями ионного обмена и условиями их протекания; научиться составлять ионные уравнения; закрепить умение пользоваться таблицей растворимости для прогнозирования возможных химических реакций; совершенствование химического языка учащихся;
Воспитательные: формирование тактичного и бережного отношения друг к другу, уважение мнения одноклассника и высказывание своего; формирование научной картины мира, воспитание бережного отношения к окружающей среде;
Развивающие: развитие памяти, мышления, познавательного интереса к предмету, активное включение учащихся в самостоятельный поиск знаний; проводить анализ и синтез учебного материала, делать умозаключения и выводы, развитие практических умений и навыков при выполнении лабораторных опытов, развитие умений работать в группе.
Планируемые результаты:
Личностные: понимание единства естественнонаучной картины мира, устойчивый познавательный интерес.
Метапредметные:
Регулятивные: слушать в соответствии с целевой установкой; преобразовывать практическую задачу в познавательную, планировать собственную деятельность, планировать учебную деятельность при выполнении эксперимента в рамках предложенных условий, дополнять, уточнять ответы одноклассников по существу поставленного задания, осуществлять взаимоконтроль процесса и результата выполнения задания, волевая саморегуляция в ситуации затруднения, адекватное понимание причин успеха, неуспеха в учебной деятельности.
Познавательные: осуществлять классификацию, устанавливать причинно-следственные связи, проводить наблюдение, обобщать и интерпретировать информацию, объяснять явления, выявленные в ходе эксперимента, строить логические рассуждения, делать выводы, понимать и интерпретировать информацию, представленную в схемах (аспект смыслового чтения), умение осуществлять идентификацию объектов с выделением необходимых признаков.
Коммуникативные: воспринимать на слух вопросы учителя и ответы учащихся, строить понятные для собеседника речевые высказывания, адекватно использовать устную и письменную речь, строить продуктивное взаимодействие со сверстниками, устанавливать рабочие отношения в группе, формулирование и аргументация своего мнения, учет разных мнений.
Предметные: давать определение понятиям, описывать самостоятельно проведенные эксперименты, используя язык химии, освоение алгоритма написания реакций ионного обмена.
Тип урока урок изучения нового материала.
Методы обучения: словесные (беседа), наглядные (просмотр слайдов презентации), практические (эксперимент).
Формы работы: индивидуальная, фронтальная, работа в группах.
Способы оценки: взаимооценка, оценка учителя.
Материально – техническое обеспечение:
Реактивы: растворы гидроксида калия, гидроксида натрия, соляной кислоты, серной кислоты, хлорида железа(III), карбоната натрия, хлорида натрия, сульфата меди (II), фенолфталеин.
Пробирки (ПХ-14), штатив для пробирок.
Компьютер, проектор, экран, презентация.
Таблицы «Периодическая система Д.И.Менделеева», «Растворимость кислот, оснований, солей в воде».
Технологическая карта
Этап урока | Планируемые результаты (личностные, метапредметные, предметные) | Деятельность учителя | Деятельность учеников |
1.Организационный момент 1-2 мин. | Личностные: Самоопределение. | Учитель проверяет, насколько комфортно чувствуют себя ученики, готовность рабочего места, создает ситуацию успеха: предлагает назвать любое слово из изучаемой темы и подобрать к каждой букве прилагательное, характеризующее их настроение. | Ученики готовят рабочее место, повторяют пройденный материал, настраиваются на работу. |
2.Актуализация знаний и постановка целей урока 10 мин. | Личностные: — понимать единство естественнонаучной картины мира, — понимать границы собственного знания и «незнания». Метапредметные: Регулятивные: — слушать в соответствии с целевой установкой; — преобразовывать практическую задачу в познавательную, — планировать собственную деятельность, — дополнять, уточнять ответы одноклассников по существу поставленного задания, — осуществлять взаимоконтроль процесса и результата выполнения задания. Коммуникативные: — воспринимать на слух вопросы учителя и ответы учащихся, — строить понятные для собеседника речевые высказывания. Познавательные: — обобщать понятия; — осуществлять классификацию; — устанавливать причинно-следственные связи, — проводить наблюдение. Предметные: — давать определение понятиям. | Цитирует высказывание Конфуция: «Три пути ведут к знанию: путь размышления — это самый благородный; путь подражания — это путь самый лёгкий и путь опыта — это путь самый горький». Выберите путь, по которому сегодня мы с вами пойдем? — Раздает троим ученикам карточки с заданиями, проверяющими знания по пройденному материалу (Приложение 1). — Формулирует вопросы, позволяющие возбудить мыслительную деятельность учащихся по теме: -дайте определения понятиям «Электролиты» и «Неэлектролиты» — Что такое сильные, слабые электролиты? Примеры. — Организует работу по выполнению задания (на интерактивной доске): — предлагает нескольким ученикам по очереди выходить к доске для выполнения задания: перечисленные вещества разделите на 2 столбика: в один запишите – электролиты, в другой – неэлектролиты: NaCl(раствор), NaCl(кристаллы), Ba(OH)2, h3SO4(конц.), h3SO4(раствор). — контролирует процесс выполнения задания. Задает вопрос: какой процесс происходит с электролитами в растворах или расплавах? Напишите уравнения диссоциации, выбранных вами электролитов. Вызывает одного ученика на доске выполнить это задание. Организует работу по анализу выполнения задания: — предлагает осуществить взаимопроверку; — предлагает учащимся, допустившим ошибки, установить их причины. — Проводит демонстрационный эксперимент: Что будет, если смешать растворы двух электролитов? Учитель смешивает растворы хлорида натрия и серной кислоты. Что происходит? | Учащиеся выбирают путь работы на уроке. Трое учеников работают на месте по карточкам. Остальные слушают вопросы учителя, во фронтальном режиме отвечают на вопросы учителя: вещества, растворы которых проводят электрический ток, относятся к электролитам. Вещества, растворы которых не проводят электрический ток, называют неэлектролитами. Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы. Слабые электролиты при растворении в воде почти не диссоциируют на ионы. У них степень диссоциации стремится к 0. Пример: h3СO3, водный раствор аммиака и др. Выполняют задания, контролируют правильность ответов учащихся. В первом столбике – электролиты: NaCl(раствор), Ba(OH)2, h3SO4(раствор). Во втором столбике – неэлектролиты: NaCl(кристаллы), h3SO4(конц.) Отвечают на вопросы: Электролиты в растворах или расплавах диссоциируют на ионы. Учащиеся у себя в тетради пишут уравнения диссоциации электролитов. Ученик на доске записывает уравнения диссоциации Осуществляют взаимопроверку в парах. Наблюдают и делают вывод, что реакция не прошла. Вместе с учителем ставят проблему: при каких условиях протекают ионные реакции до конца? Осознают недостаточнсть знаний по теме, формулируют тему и цель урока. |
3. 25 мин. | Личностные: — понимать значимость реакций ионного обмена для формирования целостной естественнонаучной картины мира. — понимать значимость химических знаний в практической жизни. Метапредметные: Регулятивные: — принимать и сохранять учебную задачу, — слушать в соответствии с целевой установкой; дополнять, уточнять ответы одноклассников по существу поставленного задания, — осуществлять взаимоконтроль процесса и результата выполнения задания, — планировать общие способы работы, — планировать учебную деятельность при выполнении эксперимента в рамках предложенных условий, — работа с текстом. Коммуникативные: — осознанно строить речевое высказывание, уметь слушать собеседника; адекватно использовать устную и письменную речь, — строить продуктивное взаимодействие со сверстниками, устанавливать рабочие отношения в группе. Познавательные: — обобщать и интерпретировать информацию, — объяснять явления, выявленные в ходе эксперимента, строить логические рассуждения, создавать обобщения, делать выводы, — понимать и интерпретировать информацию, представленную в схемах (аспект смыслового чтения), — умение осуществлять идентификацию объектов с выделением необходимых признаков. Предметные: — давать определение понятиям, — описывать самостоятельно проведенные эксперименты, используя язык химии, — освоение алгоритма написания реакций ионного обмена. | — Делит класс на 6 групп, дает групповые задания (Приложение 2) и алгоритм составления ионных уравнений реакций (Приложение 3). Проверяет знания ТБ при выполнении опытов, навыки и умения экспериментальной работы. Продолжительность работы групп – 7 мин. — Вызывает учащихся группы №2 и №3 записать уравнения реакции. Тем временем обращается к группе №1, задавая вопросы: что такое реакции ионного обмена? В каких случаях реакции ионного обмена практически необратимы? — Вызывает учащихся группы №2 и №3 рассказать, что наблюдали. Задает вопрос группе №1: почему наблюдаем появление газа, при образовании в продуктах реакции угольной кислоты? — Вызывает учащихся группы №4,5 записать уравнение реакции. Тем временем обращается к группе № 6, предлагая рассказать о значение реакций ионного обмена в жизни человека. — Вызывает учащихся группы №4 и №5 рассказать, что наблюдали. — Задает вопрос группе №1: что такое реакции нейтрализации? Почему в результате реакции нейтрализации раствор гидроксида натрия, окрашенный фенолфталеином в малиновый цвет, обесцветился? | Вспоминают и озвучивают правила безопасной работы в химической лаборатории. В группах изучают материал, проводят эксперимент, формулируют ответ. Делают необходимые записи. Учащиеся от группы выходят к доске, записывают уравнения реакций. Слушают вопросы учителя, во фронтальном режиме отвечают на вопросы учителя. Учащиеся от группы выходят к доске, комментируют эксперимент, делают вывод, что реакции ионного обмена протекают до конца, если образуется осадок или газ. Остальные учащиеся делают записи в тетрадь. Учащиеся группы №1 отвечают на вопрос. Учащиеся от группы №4,5 выходят к доске, записывают уравнения реакций. Учащиеся от группы №6 рассказывают о значении реакций ионного обмена. Учащиеся от группы №4 комментируют эксперимент, делают вывод, что реакции ионного обмена протекают до конца, если образуется малодиссоциирующее вещество (вода). Учащиеся делают записи в тетрадь. Учащиеся от группы №5 комментируют эксперимент. Учащиеся делают записи в тетрадь. Учащиеся группы №1 отвечают на вопрос. |
4. Закрепление знаний. 5 мин. | Личностные: — понимать значимость реакций ионного обмена для формирования целостной естественнонаучной картины мира. — понимать значимость химических знаний в практической жизни. Метапредметные: Регулятивные: — принимать и сохранять учебную задачу. — волевая саморегуляция в ситуации затруднения — самоконтроль Познавательные: — понимать и интерпретировать информацию, представленную в схемах, — осуществлять сравнение, создавать обобщения, устанавливать аналогии. Предметные: освоение алгоритма написания реакций ионного обмена. | — Предлагает учащимся самостоятельно решить разноуровневые задания на карточках (Приложение 4). Если кто-то из учеников справился раньше остальных, учитель дает дополнительные задания на карточках по данной теме. (Приложение 4). — Собирает задания на проверку. | Выбирают себе задание, соответствующего уровня, и письменно выполняют его. |
5.Рефлексия 2 мин. | Личностные: — понимать значимость реакций ионного обмена для формирования целостной естественнонаучной картины мира, — осознание ответственности за общее дело. Метапредметные: Регулятивные: — контроль и оценка процесса и результатов деятельности, — адекватное понимание причин успеха, неуспеха в учебной деятельности, Коммуникативные: — выражение своих мыслей с достаточной полнотой и точностью, — формулирование и аргументация своего мнения, учет разных мнений. | Предлагает вспомнить тему и цель урока, оценить меру своего личного продвижения к цели и успехи класса в целом: — Какой ответ на основной вопрос урока мы можем дать? Как оцените свою работу? Подводит итог урока, отмечает наиболее активных учащихся. | Определяют степень соответствия поставленной цели и результатов деятельности: называют тему и цели урока, отмечают наиболее трудные и наиболее понравившиеся эпизоды урока, высказывают оценочные суждения. Определяют степень своего продвижения к цели. |
6. Домашнее задание 1 мин. | Организует объяснение выполнения домашнего задания: 1. § 37 учебника. 2. Выполнить задания 4 или 5 (по выбору учащегося) | Слушают учителя. Записывают домашнее задание |
Карточки — задания Приложение 1.
1. | К электролитам относится | |||
1) | гидроксид бария | 3) | сульфид меди(II) | |
2) | фосфат магния | 4) | карбонат кальция | |
2. | Электрический ток не проводит | |||
1) | раствор хлороводорода | 3) | расплав красного фосфора | |
2) | раствор азотной кислоты | 4) | расплав сульфата натрия | |
3. | Электрический ток проводит | |||
1) | раствор хлороводорода | 3) | раствор глицерина | |
2) | расплав сахарозы | 4) | расплав глюкозы | |
4. | Сульфид-ион образуется при электролитической диссоциации | |||||||
1) | Na2SO4 | 2) | Н2SO4 | 3) | Na2S | 4) | Na2SO3 | |
5 | При полной диссоциации 1 моль нитрата цинка в растворе образуется | |
1) | 3 моль катионов цинка и 1 моль нитрат-ионов | |
2) | 2 моль катионов цинка и 3 моль нитрат-ионов | |
3) | 1 моль катионов цинка и 3 моль нитрат-ионов | |
4) | 1 моль катионов цинка и 2 моль нитрат-ионов | |
6. | Правой частью уравнения диссоциации сульфата натрия является | |||
1) | = Na+ + HSO | 3) | = 2Na+ + SO | |
2) | = 2Na+ + S2- | 4) | = 2Na+ + SO | |
Задания для рабочих групп Приложение 2.
Группа №1
«Теоретический центр»
Найдите ответы на вопросы:
1. Что такое реакции ионного обмена?
2. Что такое полное и сокращенное ионные уравнения?
3. В каких случаях реакции ионного обмена практически необратимы?
4.Почему наблюдаем появление газа, при образовании в продуктах реакции угольной и сернистой кислот?
5. Что такое реакции нейтрализации? Почему в результате реакции нейтрализации раствор гидроксида натрия, окрашенный фенолфталеином в малиновый цвет, обесцветится?
Группа №2
Опыт: Взаимодействие сульфата меди(II) с гидроксидом натрия.
Проделайте опыт: к 1 мл. раствору сульфата меди(II) добавьте 1 мл. раствора гидроксида натрия. Что наблюдаете? Запишите уравнение реакции. По алгоритму составьте полное и сокращенное ионные уравнения.
Группа №3
Опыт: Взаимодействие карбоната натрия с соляной кислотой.
Проделайте опыт: к 1 мл. раствору карбоната натрия добавьте 1мл. раствора соляной кислоты. Что наблюдаете? Запишите уравнение реакции. По алгоритму составьте полное и сокращенное ионные уравнения.
Группа №4
Опыт: Взаимодействие гидроксида железа(III) с соляной кислотой.
Проделайте опыт: к 1 мл. раствору хлорида железа (III) добавьте 1 мл. раствора гидроксида натрия. Что наблюдаете? Добавьте 1мл. раствора соляной кислоты. Что наблюдаете? Запишите уравнение реакции. По алгоритму составьте полное и сокращенное ионные уравнения.
Группа №5
Опыт: Взаимодействие гидроксида калия с серной кислотой.
Проделайте опыт: к 1 мл. раствору гидроксида натрия добавьте несколько капель фенолфталеина, затем 1мл. раствора соляной кислоты. Что наблюдаете? Запишите уравнение реакции. По алгоритму составьте полное и сокращенное ионные уравнения.
раствора соляной кислоты. Что наблюдаете? Запишите уравнение реакции. По алгоритму составьте полное и сокращенное ионные уравнения.
Группа №6
Значение реакций ионного обмена
Реакции ионного обмена широко распространены в живой и неживой природе, например, образование осадочных пород (гипс, известняк, другие соли), появление камней в почках животных и человека.
Широко используются реакции ионного обмена и в практических целях, например для осаждения ионов, приносящий существенный вред людям и животным. К таким относят, в первую очередь, катионы тяжелых металлов.
Тяжелые металлы – это элементы периодической системы с относительной молекулярной массой больше 40. Так сложилось, что термины «тяжелые металлы» и «токсичный металлы» стали синонимами.
На сегодняшний день безоговорочно к числу токсичных относят кадмий, ртуть, свинец, сурьму. Деятельность значительной части остальных в живых организмах можно оценить только на «отлично». Действительно, металлы в ионной форме входят в состав витаминов, гормонов, регулируют активность ферментов.
Установлено, что для белкового, углеводного и жирового обмена веществ необходимы Mo, Fe, V, Co, W, B, Mn, Ni, Zn; в синтезе белков участвуют Mg, Fe, Cu, Zn, Mn, Co; в кроветворении – Co, Cu, Mn, Ni, Zn; в дыхании – Mg, Fe, Cu, Zn, Mn,Co. Справедливо утверждение о том, что нет вредных веществ, есть вредные концентрации. Поэтому ионы меди, кобальта или даже хрома, если их содержание в живом организме не превышает естественного, можно именовать микроэлементами, если же они генеалогически связаны с заводской трубой, то это уже тяжелые металлы. Тяжелые металлы (ртуть, свинец, кадмий, цинк, мель, мышьяк) относятся к числу распространенных и весьма токсичных загрязняющих веществ. Они широко применяются в различных промышленных производствах, поэтому, не смотря на очистные мероприятия, содержания соединения тяжелых металлов в промышленных сточных водах довольно высокое. Большие массы этих соединений поступают в океан через атмосферу. Для морских биоценозов наиболее опасны ртуть, свинец и кадмий. Ртуть переносится в океан с материковым стоком и через атмосферу.
Ртуть переносится в океан с материковым стоком и через атмосферу.
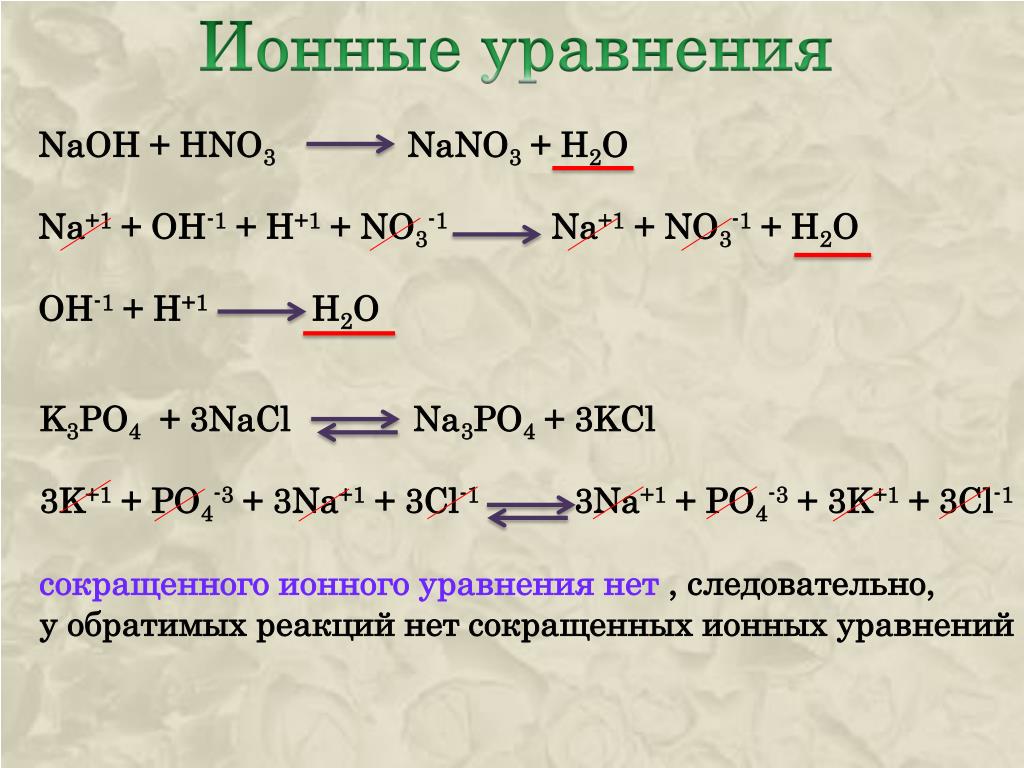
Алгоритм составления ионных уравнений реакций Приложение 3.
1. Запишите (составьте) формулы исходных веществ и продуктов реакции. Расставьте коэффициенты. | Молекулярное уравнение реакции: MgCI2+2AgNO3=Mg(NO3)2+2AgCI↓ |
2. Напишите под каждой формулой растворимого вещества ионы, на которые оно диссоциирует, учитывая коэффициенты, пользуясь таблицей растворимости. | Полное ионное уравнение реакции: Mg2+ + 2CI — +2Ag+ + 2NO3- = Mg2++2NO3- + 2AgCl↓ |
3. Зачеркните формулы одинаковых ионов (до и после реакции), которые не участвуют в реакции | Полное ионное уравнение реакции: Mg2++2CI-+2Ag++2NO3 — = Mg2++2NO3- +2AgCl↓ |
4. | Краткое (сокращенное) ионное уравнение реакции: 2Ag + +2Cl- = 2AgCl↓ или Ag + +Cl- = AgCl↓ |
5. Сделайте вывод на основе сокращенного уравнения | В реакции участвовали ионы серебра и хлорид-ионы. В результате образуется осадок хлорида серебра. |
Разноуровневые задания Приложение 4.
На оценку «3»
Напишите полное и сокращенное ионные уравнения. Назовите вещества.
Na2SO4 + BaCl2 = BaSO4↓+ 2NaCI
На оценку «4»
Допишите уравнение реакции. Напишите полное и сокращенное ионные уравнения. Назовите вещества.
Na2SiO3 + HCl =
На оценку «5»
В сточных водах животноводческих ферм отмечено повышенное содержание катионов Са2+. Предложите реактивы, с помощью которых можно очистить воду от этих ионов. Напишите уравнение реакции.
Напишите уравнение реакции.
Дополнительные задания
Вместо знака «?» вставьте формулу вещества. Укажите, к какому типу относятся реакции. Для реакций ионного обмена составьте полное и сокращённое ионные уравнения.
1) ? + HCI = CuCI2 + h3O
2) FeO + HNO3 = ? + ?
3) Mg + HBr = ? + h3
4) CaO + h4PO4 = ? + h3O
5) h3SO4 + ? = K2SO4 + ?
Тренажер задания 14 ОГЭ по химии
Тренировочные упражнения по теме «Реакции ионного обмена и условия их осуществления» в формате ОГЭ по химии (тренажер задания 14 ОГЭ по химии).
Теория по теме (теория для решения задания 14 ОГЭ по химии):
Реакции ионного обмена и условия их осуществления
61 Создан на По Admin Тренажер задания 14 ОГЭ по химии 1 / 10 Из предложенного перечня выберите названия двух веществ, взаимодействию которых в растворе соответствует сокращённое ионное уравнение реакции Ba2+ + SO42– = BaSO4 1) барий
2) оксид бария
3) гидроксид бария
4) серная кислота
5) сульфат магния
Запишите номера выбранных ответов.
2 / 10
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции
Fe3+ + 3OH– = Fe(OH)3
1) FePO4
2) H2O2
3) Fe2(SO4)3
4) Fe(OH)2
5) NaOH
6) Zn(OH)2
Запишите номера выбранных ответов.
3 / 10
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции
Fe2+ + CО32– = FeCO3
1) Fe
2) FeCl2
3) FeCl3
4) FePO4
5) CaCO3
6) K2CO3
Запишите номера выбранных ответов.
4 / 10
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции
2H+ + S2– = H2S
1) HCl
2) CuS
3) S
4) HF
5) K2S
6) Al2S3
Запишите номера выбранных ответов.
5 / 10
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции
Mg2+ + 2OH– = Mg(OH)2
1) MgSO4
2) Ba(OH)2
3) NH3
4) MgCl2
5) MgCO3
6) Fe(OH)3
Запишите номера выбранных ответов.
6 / 10
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции
CO32– + 2H+ = H2O + CО
1) Na2CO3
2) NaHCO3
3) CaCO3
4) BaCO3
5) HBr
6) HNO2
Запишите номера выбранных ответов.
7 / 10
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции
CO32– + 2H+ = H2O + CО2
1) CaCO3
2) NaHCO3
3) BaCO3
4) K2CO3
5) HNO3
6) H2SiO3
Запишите номера выбранных ответов.
8 / 10
Из предложенного перечня выберите названия двух веществ, взаимодействию которых в растворе соответствует сокращённое ионное уравнение реакции
3Li+ + PO43– = Li3PO4
1) литий
2) оксид лития
3) сульфат лития
5) оксид фосфора
6) фосфат калия
Запишите номера выбранных ответов.
9 / 10
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции
Fe3+ + 3OH– = Fe(OH)3
1) FeSO4
2) Fe2(SO4)3
3) H2O
4) LiOH
5) Mg(OH)2
6) Fe
Запишите номера выбранных ответов.
10 / 10
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции
Sr2+ + CО32– = SrCO3
1) Sr
2) SrO
3) SrSO4
4) Sr(NO3)2
5) CaCO3
6) K2CO3
Запишите номера выбранных ответов.
Ваша оценка
Средний балл 45%
| Задание 1 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции H+ + OH– = H2O 1) H2S Запишите номера выбранных ответов. | |
| Задание 2 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции CO32– + 2H+ = H2O + CО2 1) Na2CO3 Запишите номера выбранных ответов. | |
| Задание 3 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции 2H+ + S2– = H2S 1) HCl Запишите номера выбранных ответов. | |
| Задание 4 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции 3Sr2+ + 2PО43– = Sr3(PO4)2 1) Sr Запишите номера выбранных ответов. | |
| Задание 5 | |
Из предложенного перечня выберите названия двух веществ, взаимодействию которых в растворе соответствует сокращённое ионное уравнение реакции 2H+ + CO32– = CO2 + H2O 1) сероводородная кислота Запишите номера выбранных ответов. | |
| Задание 6 | |
Из предложенного перечня выберите названия двух веществ, взаимодействию которых в растворе соответствует сокращённое ионное уравнение реакции Zn2+ + S2– = ZnS 1) сероводород Запишите номера выбранных ответов. | |
| Задание 7 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции Fe2+ + CО32– = FeCO3 1) Fe Запишите номера выбранных ответов. | |
| Задание 8 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции 3Ba2+ + 2PO 1) BaSO4 Запишите номера выбранных ответов. | |
| Задание 9 | |
Из предложенного перечня выберите две формулы ионов, при взаимодействии которых выделяется газ. 1) Ba2+ Запишите номера выбранных ответов. | |
| Задание 10 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции 3Ba2+ + 2PO43– = Ba3(PO4)2 1) Ba(OH)2 Запишите номера выбранных ответов. | |
| Задание 11 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции 2H+ + S2– = H2S 1) HBr Запишите номера выбранных ответов. | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции Ca2+ + SО32– = СаSО3 1) СаО Запишите номера выбранных ответов. | |
| Задание 13 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции 3Ba2+ + 2PO43– = Ba3(PO4)2 1) BaSiO3 Запишите номера выбранных ответов. | |
| Задание 14 | |
Из предложенного перечня выберите названия двух веществ, взаимодействию которых в растворе соответствует сокращённое ионное уравнение реакции Ba2+ + SO42– = BaSO4 1) барий Запишите номера выбранных ответов. | |
| Задание 15 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции Mg2+ + 2OH– = Mg(OH)2 1) MgSO4 Запишите номера выбранных ответов. | |
| Задание 16 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции Ba2+ + CO32– = BaCO3 1) Ba(OH)2 Запишите номера выбранных ответов. | |
| Задание 17 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции S2– + 2H+ = H2S 1) Na2S Запишите номера выбранных ответов. | |
| Задание 18 | |
Из предложенного перечня выберите названия двух веществ, взаимодействию которых в растворе соответствует сокращённое ионное уравнение реакции 3Li+ + PO43– = Li3PO4 1) литий Запишите номера выбранных ответов. | |
| Задание 19 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции H+ + OH– = H2O 1) H2SO4 Запишите номера выбранных ответов. | |
| Задание 20 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции 3Ba2+ + 2PO43– = Ba3(PO4)2 1) BaSO4 Запишите номера выбранных ответов. | |
| Задание 21 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции Fe3+ + 3OH– = Fe(OH)3 1) FeCl2 Запишите номера выбранных ответов. | |
| Задание 22 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции CO32– + 2H+ = H2O + CО2 1) CaCO3 Запишите номера выбранных ответов. | |
| Задание 23 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции H+ + OH– = H2O 1) HCl Запишите номера выбранных ответов. | |
| Задание 24 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции Al3+ + 3OH– = Al(OH)3 1) KOH Запишите номера выбранных ответов. | |
| Задание 25 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции Al3+ + 3OH– = Al(OH)3 1) AlCl3 Запишите номера выбранных ответов. | |
| Задание 26 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции Fe2+ + CO32– = FeCO3 1) CaCO3 Запишите номера выбранных ответов. | |
| Задание 27 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции S2– + 2H+ = H2S 1) FeS Запишите номера выбранных ответов. | |
| Задание 28 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции Mg2+ + 2OH– = Mg(OH)2 1) MgSO4 Запишите номера выбранных ответов. | |
| Задание 29 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции 2H+ + SO32– = H2O + SO2 1) H2SO4 Запишите номера выбранных ответов. | |
| Задание 30 | |
Из предложенного перечня выберите две формулы ионов, при взаимодействии которых выпадает осадок 1) Na+ Запишите номера выбранных ответов. | |
| Задание 31 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции Sr2+ + CО32– = SrCO3 1) Sr Запишите номера выбранных ответов. | |
| Задание 32 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции 3Ba2+ + 2PО43– = Ba3(PO4)2 1) BаО Запишите номера выбранных ответов. | |
| Задание 33 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции 3Ba2+ + 2PО43– = Ba3(PO4)2 1) Ba Запишите номера выбранных ответов. | |
| Задание 34 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции CO32– + 2H+ = H2O + CО2 1) K2CO3 Запишите номера выбранных ответов. | |
| Задание 35 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции Fe2+ + CO32– = FeCO3 1) Fe(NO3)2 Запишите номера выбранных ответов. | |
| Задание 36 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции S2– + 2H+ = H2S 1) CuS Запишите номера выбранных ответов. | |
| Задание 37 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции Fe3+ + 3OH– = Fe(OH)3 1) FePO4 Запишите номера выбранных ответов. | |
| Задание 38 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции Fe2+ + CО32– = FeCO3 1) FeO Запишите номера выбранных ответов. | |
| Задание 39 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции Mg2+ + 2OH– = Mg(OH)2 1) Mg3(PO4)2 Запишите номера выбранных ответов. | |
| Задание 40 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции Fe3+ + 3OH– = Fe(OH)3 1) FeSO4 Запишите номера выбранных ответов. | |
| Задание 41 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции 3Ba2+ + 2PO43– = Ba3(PO4)2 1) BaSO4 Запишите номера выбранных ответов. | |
| Задание 42 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции NH4+ + OH– = NH3 + H2O 1) (NH4)2SO4 Запишите номера выбранных ответов. | |
| Задание 43 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции Ba2+ + CO32– = BaCO3 1) BaSO4 Запишите номера выбранных ответов. | |
| Задание 44 | |
Из предложенного перечня выберите две формулы ионов, при взаимодействии которых выпадает осадок. 1) Li+ Запишите номера выбранных ответов. | |
| Задание 45 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции Al3+ + 3OH– = Al(OH)3 1) Al2(SO4)3 Запишите номера выбранных ответов. | |
| Задание 46 | |
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции H+ + OH– = H2O 1) HF Запишите номера выбранных ответов. | |
Понравилось это:
Нравится Загрузка…
Admin4
Архив автора
Чистые ионные уравнения, домашнее задание Справка в TutorEye
Чистые ионные уравнения- Химическое уравнение представляет собой символическое представление химического изменения. Он включает молекулы реагентов и продуктов, разделенные одинарными или двойными стрелками.
- Есть несколько способов написать химическое уравнение; молекулярное уравнение, ионное уравнение, суммарное ионное уравнение.
- Молекулярное уравнение — это уравнение, в котором все молекулы реагентов и продуктов представлены в виде молекул. Физическое состояние каждого реагента и молекулы продукта должно быть упомянуто в виде нижнего индекса в скобках.
- Ионное уравнение представляет собой ионную форму всех молекул реагентов и продуктов.
 Молекулы, которые существуют в водном состоянии, должны быть записаны в их ионной форме, тогда как молекулы в твердом, жидком и газообразном состоянии останутся в своей молекулярной форме в ионном уравнении.
Молекулы, которые существуют в водном состоянии, должны быть записаны в их ионной форме, тогда как молекулы в твердом, жидком и газообразном состоянии останутся в своей молекулярной форме в ионном уравнении.
- Чистое ионное уравнение — это химическое уравнение, которое показывает только те элементы, соединения и ионы, которые непосредственно участвуют в химической реакции, и общее правило состоит в том, что если правильно сбалансировать молекулярное уравнение, то чистое ионное уравнение приходят, уравновешивая массу и заряд.
- Ионы-спектаторы не должны быть частью общего ионного уравнения. Чистое ионное уравнение используется для уравновешивания окислительно-восстановительных реакций главным образом потому, что оно дает представление об окислителях и восстановителях.
Вопрос 1: Чистое ионное уравнение выполняется с помощью _______________ Масса и заряда
A) Недосаживание
A) . 0007
0007
б) Балансировка
в) Изменение атомов
г) Увеличение заряда
Ответ: ( B)
Вопрос 2: Чистое ионное уравнение показывает эти элементы, включающие ___________ в химической реакции
(A) Комодно
(B) (A) 0004 Непосредственно
(c) Не связано с реакцией
(d) Осажденное соединение
Золь ution : Суммарное ионное уравнение показывает те элементы, которые непосредственно участвуют в химической реакции.
Ответ: (b)
Вопрос 3: Какое из следующих уравнений должно быть результирующим ионным уравнением реакции нейтрализации сильной кислоты и сильного основания?
Решение : Суммарное ионное уравнение показывает те элементы, которые непосредственно участвуют в химической реакции. Так и должно быть б) так как образовавшаяся соль и сильное кислотно-основное должны образовывать ионы и будут ионами-спекторами.
Так и должно быть б) так как образовавшаяся соль и сильное кислотно-основное должны образовывать ионы и будут ионами-спекторами.
Ответ: ( B)
Часто задаваемые вопросы Как вы пишете чистое ионическое уравнение?
- Напишите сбалансированное молекулярное уравнение
- Укажите состояние каждого вещества (твердое, жидкое, газообразное или водное)
- Разбейте растворимые ионные соединения на их ионы, запишите заряд иона
- Для представления числа ионов следует использовать коэффициенты
- Удалить ионы-наблюдатели из
Какое суммарное ионное уравнение для MG и HCl?
Магний реагирует с хлористым водородом с образованием хлористого магния и газообразного водорода.
The ionic equation can be written as
The net ionic equation can be written as-
Как составить результирующее ионное уравнение с водой?
Молекулярное уравнение реакции между водой и гидроксидом натрия можно записать в виде-
Ionic equation can be written as
Net ionic equation can be written by removing spectator ions from both sides of the reaction
Как из полного ионного уравнения записывается результирующее ионное уравнение?
Чтобы написать суммарное ионное уравнение из полного ионного уравнения, необходимо исключить ионы-спектаторы с обеих сторон реакции
Например, полное ионное уравнение для реакции между магнием и гидрохлоридом:
Take Net ионные уравнения Домашнее задание Помогите сегодня!
Net Ionic Equations — узнайте и поймите это онлайн
Когда вы идете на бейсбольный матч, множество зрителей аплодируют (или освистывают) с трибун. Они не являются частью игры, но без них она была бы другой. Реакции такие же. Некоторые реакции имеют ионов-спектаторов , которые хотя и являются частью общей реакции, но фактически не участвуют в ней напрямую. Когда нам нужна только основная реакция, мы пишем чистое ионное уравнение .
Они не являются частью игры, но без них она была бы другой. Реакции такие же. Некоторые реакции имеют ионов-спектаторов , которые хотя и являются частью общей реакции, но фактически не участвуют в ней напрямую. Когда нам нужна только основная реакция, мы пишем чистое ионное уравнение .
Если кто-то попросит вас описать бейсбольный матч, на который вы пошли, он, вероятно, будет интересоваться только реальными игроками/игрой, а не зрителями. Это та же концепция, только для химии!
В этой статье мы изучим сетевые ионные уравнения и пошагово рассмотрим, как их написать.
- Эта статья посвящена сводным ионным уравнениям.
- Мы узнаем, почему мы используем суммарные ионные уравнения и что они представляют.
- Далее мы рассмотрим, как написать чистое ионное уравнение.
- Наконец, мы научимся писать эти уравнения для жидких и газообразных продуктов.
Чистое ионное уравнение Определение
Чистое ионное уравнение — это химическое уравнение, которое показывает только те ионы, элементы и соединения, которые непосредственно участвуют в реакции.
Итак, когда мы говорим, что зритель «не участвует напрямую», что мы имеем в виду? Что ж, для таких типов реакций мы рассматриваем водные растворы. В водном растворе соединения растворены в воде, поэтому они присутствуют в виде своих ионов.
Рис. 1. Когда NaCl растворяется в воде, ионы притягиваются к молекулам воды. Na+ притягивается к кислороду, что слегка отрицательно. Cl- притягивается к водороду, что слегка положительно.
Как вы можете видеть выше, когда твердое вещество растворяется в воде, его ионы притягиваются к молекулам воды. Положительные ионы притягиваются к частично отрицательному кислороду, а отрицательные ионы притягиваются к частично положительному водороду (в этом примере они показаны соответственно натрием и хлором). Связи между ионным твердым телом разрываются, а с водой образуются новые связи. Это притяжение объясняет, почему эти твердые вещества растворимы и почему они являются ионами в растворе.
При объединении двух водных соединений продукты либо также будут водными, либо они образуют осадок (твердое вещество, не растворимое в воде). «Реакция», о которой мы говорим, — это образование твердого тела (или любых неводных частиц, как мы увидим позже). Остальные ионы просто болтаются в растворе все время, практически ничего не делая.
«Реакция», о которой мы говорим, — это образование твердого тела (или любых неводных частиц, как мы увидим позже). Остальные ионы просто болтаются в растворе все время, практически ничего не делая.
Так как же узнать, какие соединения являются растворимыми, а какие нерастворимыми? Для ионных твердых веществ мы следуем правилам растворимости . Эти правила говорят нам, растворимы ли пары ионы/ионы. Например, соединения с металлами группы I (Li + , Na + и т. д.) обычно растворимы. Кроме того, соединения с галогенидами (Cl — , Br — и т. д.) обычно растворимы, поэтому мы знаем, что NaCl растворим в воде (кроме наблюдения, конечно!).
Пример чистого ионного уравнения
Теперь, когда мы рассмотрели, что такое чистое ионное уравнение, как оно выглядит? Вот пример химической реакции и ее результирующее ионное уравнение: 9-_{(водн.)}\rightarrow AgCl_(s)$$
Изображение ниже иллюстрирует, что происходит в этой реакции.
Рис. 2 – В реакции AgNO3 и NaCl образуются NaNO3 (водный) и AgCl (твердый).
У нас есть два реагента: NaCl и AgNO 3 . Поскольку они оба водные, их ионы находятся в растворе. Когда они реагируют, они образуют NaNO 3 (водный) и AgCl (твердый). AgCl нерастворим в воде, поэтому он образует твердое вещество и, следовательно, не находится в своей ионной форме. На + и NO 3 — являются нашими ионами-спекторами, поскольку они остаются ионами все время. Чистое ионное уравнение показывает нам только реакцию, которая образует твердое тело.
Большинство галогенидных солей (Cl — , Br — и др.) растворимы в воде. Однако есть несколько исключений, а именно AgCl. При взаимодействии Ag + и Cl — в воде образуется белый порошок, представляющий собой осадок.
Сбалансированное чистое ионное уравнение
9-_{(водн.)}\rightarrow AgCl_{(s)}$$ Обратите внимание, что на последнем шаге мы поменяли местами Ag и Cl. Это было сделано для упрощения их сложения, но в этом нет необходимости. . Основываясь на приведенном выше примере, вы увидите, что для написания чистого ионного уравнения требуется всего несколько шагов. Подводя итог, это:
Это было сделано для упрощения их сложения, но в этом нет необходимости. . Основываясь на приведенном выше примере, вы увидите, что для написания чистого ионного уравнения требуется всего несколько шагов. Подводя итог, это:
- Напишите сбалансированное уравнение реакции.
- Запишите каждый водный раствор в виде их ионов.
- Устранение ионов, присутствующих с обеих сторон.
- Упростите уравнение.
HCl NaOH Чистое ионное уравнение
Чистое ионное уравнение предназначено не только для твердых тел. Если при взаимодействии двух водных растворов образуется жидкость, мы все равно можем использовать результирующее ионное уравнение. Жидкости, как и твердые тела, не находятся в ионной форме в воде. Также жидкости (например, HCl) могут быть водными. Как и в случае с твердыми телами, все зависит от того, растворимы ли они в воде. В качестве примера напишем суммарное ионное уравнение HCl + NaOH:
Сначала напишем молекулярное уравнение. 9-_{(aq)}\rightarrow H_2O_{(l)}$$
9-_{(aq)}\rightarrow H_2O_{(l)}$$
Логично, что здесь вода считается жидкостью, так как она не может раствориться сама по себе. Однако существует множество жидкостей, которые не растворяются в воде, например, октанол (C 8 H 18 O). Чистые ионные уравнения всегда фокусируются на продуктах, изготовленных из водных растворов, независимо от того, в каком состоянии они находятся (кроме водного).
Чистые ионные уравнения для газов
Наконец, мы можем использовать суммарные ионные уравнения и для газовых продуктов. Это, конечно, до тех пор, пока газ не растворяется в воде. Давайте рассмотрим пример: 9-_{(водн.)}$$
Следует отметить, что оба реагента не обязательно должны быть водными, достаточно одного из них. Главное, что есть ионы-спектаторы, которые можно нейтрализовать. Кроме того, всегда дважды проверяйте, сбалансировано ли ваше уравнение.
Практические задачи на чистые ионные уравнения
Теперь, когда мы рассмотрели каждый из трех типов, давайте поработаем над несколькими дополнительными задачами.




 У них степень диссоциации стремится к 1. Пример: все растворимые соли, h3SO4, KOH и др.
У них степень диссоциации стремится к 1. Пример: все растворимые соли, h3SO4, KOH и др. Изучение нового материала.
Изучение нового материала.






 Выпишите формулы оставшихся ионов и веществ
Выпишите формулы оставшихся ионов и веществ

















 Молекулы, которые существуют в водном состоянии, должны быть записаны в их ионной форме, тогда как молекулы в твердом, жидком и газообразном состоянии останутся в своей молекулярной форме в ионном уравнении.
Молекулы, которые существуют в водном состоянии, должны быть записаны в их ионной форме, тогда как молекулы в твердом, жидком и газообразном состоянии останутся в своей молекулярной форме в ионном уравнении.