Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Физика
| Похожие вопросы |
В вершинах правильного треугольника расположены точечные заряды +q, -q, -Q, как показано на рисунке. Как направлена результирующая сила, действующая на заряд (-Q)?
Как направлена результирующая сила, действующая на заряд (-Q)?
Решено
Термопара с сопротивлением r1 = 6 Ом
Решено
Дано уравнение гармонических колебаний: x=0…
закон Ома
Задачи по физике 9 класс
Пользуйтесь нашим приложением
Решение задач по теме «Нагревание и плавление кристаллических тел» 8 класс онлайн-подготовка на Ростелеком Лицей |
Повторение формул расчета количества теплоты и работа с таблицами тепловых характеристик веществ
На предыдущих уроках мы говорили о процессах передачи телу количества теплоты и уже знаем, что это приводит к увеличению его внутренней энергии. Это может проявляться, насколько нам пока известно, двумя способами: увеличением температуры или плавлением тела при постоянной температуре.
Повторим формулы, которые позволяют рассчитывать значения количества теплоты при упомянутых нами процессах.
Количество теплоты, необходимое для нагрева тела: .
Обозначения:
удельная теплоемкость вещества, ;
масса тела, кг;
изменение температуры тела, o;
количество теплоты, Дж.
Количество теплоты, необходимое для плавления тела: .
Обозначения:
удельная теплота плавления вещества, ;
масса тела, кг.
Для процесса, протекающего в две стадии (например, нагревание и плавление), справедлива формула: .
Уделим отдельное внимание величинам и , они характеризуют тепловые свойства веществ и являются табличными величинами, которые заранее измерили в лабораторных условиях.
Единицы измерения удельной теплоемкости вещества:
Значение для величины можно определить по таблице 1.
Табл. 1. Удельная теплоемкость некоторых веществ
Единицы измерения удельной теплоты плавления вещества:
Значение для величины можно определить по таблице 2.
Табл. 2. Удельная теплота плавления некоторых веществ
Те величины, которые мы будем использовать для решения задач в этом уроке, лучше занести в одну таблицу (табл. 3).
|
Вещество |
Удельная теплота плавления , |
Удельная теплоемкость |
Температура плавления o |
|
Лед |
2100 |
0 |
|
|
Вода |
– |
4200 |
– |
|
Медь |
400 |
1085 |
Табл. 3. Сводная таблица для решения задач
3. Сводная таблица для решения задач
Заметим, что для воды значения удельной теплоты плавления и температуры плавления не заданы, т.к. она и так находится в жидком состоянии. Температура плавления веществ указана при нормальном (атмосферном) давлении, при других значениях давления она может меняться.
Рассмотрим примеры решения задач.
Задача на расчет количества теплоты при нагревании тела с агрегатным переходом
Задача 1
Какое количество теплоты необходимо затратить, чтобы 200 г льда, взятого при температуре , превратить в воду при температуре ?
Решение:
Дано: .
Найти:
Для удобства представления процессов, происходящих при передаче тепла льду, можно изобразить график зависимости температуры нагреваемого тела от времени (рис. 4).
Рис. 4. Рисунок к задаче 1
Опишем все происходящие процессы: 1) от температуры до 0 (точка А) лед нагревается; 2) от точки А до точки В происходит процесс плавления льда при постоянной температуре ; 3) после окончания процесса плавления происходит нагревание образовавшейся изо льда воды от температуры (точка В) до .
Поскольку при расчете количества теплоты нам необходимо будет описывать процессы нагревания льда, его плавления и нагревания воды, то нам понадобятся табличные значения соответствующих этим процессам тепловых характеристик веществ. Выпишем их из указанной ранее таблицы (табл. 3): удельная теплоемкость льда , удельная теплота плавления льда , температура плавления льда , удельная теплоемкость воды .
Необходимое для совершения всех тепловых процессов количество теплоты будет являться суммой количеств теплоты, переданных телу на каждом из этапов: .
Количество теплоты, необходимое для нагревания льда от начальной температуры до температуры плавления: . Из того, что значение количества теплоты получилось положительным, можно сделать вывод, что лед получает тепло, т. е. увеличивает свою внутреннюю энергию, что логично.
Количество теплоты, необходимое для плавления льда: .
Важно понимать, что после плавления льда образуется вода такой же массы при температуре , а не сразу при температуре , до которой ее необходимо довести по условию задачи. Таким образом, еще следует рассчитать количество теплоты для нагрева образовавшейся изо льда воды.
Таким образом, еще следует рассчитать количество теплоты для нагрева образовавшейся изо льда воды.
Количество теплоты, необходимое для нагревания воды от температуры до температуры : .
Найдем общее необходимое количество теплоты: .
Замечание. Большие количества энергий удобно рассчитывать в кДж.
Ответ: .
Задача на определение вещества по его тепловым характеристикам
Задача 2
Металлический образец массой 2 кг взят при температуре плавления и полностью расплавлен, при этом было израсходовано 420 кДж теплоты. Определите, что это за вещество и чему равна температура плавления этого металла.
Решение:
Дано: .
Найти
Для определения, из какого вещества изготовлен металлический образец, определим его удельную теплоту плавления и по таблице найдем, какому веществу она соответствует, затем по той же таблице восстановим соответствующую температуру плавления.
Воспользуемся формулой количества теплоты плавления, которой нам будет достаточно, т. к. образец уже находится при температуре плавления: , что по указанной нами выше таблице (табл. 3) соответствует меди, а ее температура плавления равна .
к. образец уже находится при температуре плавления: , что по указанной нами выше таблице (табл. 3) соответствует меди, а ее температура плавления равна .
Ответ:медь; .
На следующем уроке мы подробно рассмотрим еще один процесс агрегатного превращения вещества – испарение.
Список литературы:
- Генденштейн Л.Э, Кайдалов А.Б., Кожевников В.Б. / Под ред. Орлова В.А., Ройзена И.И. Физика 8. – М.: Мнемозина.
- Перышкин А.В. Физика 8. – М.: Дрофа, 2010.
- Фадеева А.А., Засов А.В., Киселев Д.Ф. Физика 8. – М.: Просвещение.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет:
- Интернет-портал «class-fizika.narod.ru» (Источник)
- Интернет-портал «school.xvatit.com» (Источник)
- Интернет-портал «youtube.com» (Источник)
Домашнее задание:
- Стр. 39: задание № 2. Перышкин А.В. Физика 8. – М.: Дрофа, 2010.

- На сколько можно было бы нагреть 1 кг воды за счет тепла для таяния 1 кг льда при ?
- В стальном тигле массой 500 г мастер расплавил 200 г олова. Какое количество теплоты было затрачено, если начальная температура олова ?
- К находящемуся в калориметре мокрому снегу массой 500 г добавили 500 г кипятка. После установления теплового равновесия температура в калориметре достигла . Сколько воды содержалось в снегу?
термодинамика — Всегда ли лед имеет температуру 0 градусов по Цельсию? Становится ли температура льда ниже этой?
спросил
Изменено 1 год, 9 месяцев назад
Просмотрено 8к раз
$\begingroup$
Хотелось бы получить довольно простую аналогию/объяснение.
- термодинамика
- температура
- лед
$\endgroup$
0
$\begingroup$
Очень простая аналогия: температура плавления меди 1085°C. Блок меди всегда имеет температуру 1085°C или может быть ниже?
Два ваших вопроса на самом деле не об одном и том же. При атмосферном давлении вода находится в жидком состоянии от 0 до 100°С. Чуть холоднее, и он замерзнет, превратившись в лед, чуть горячее, и испарится, превратившись в пар. Ничто не мешает нам охлаждать лед до температуры ниже 0°C.
Это заблуждение может быть связано с тем, что в ледяная вода , то есть смесь льда и воды, вода всегда будет иметь температуру 0°C. Переход из твердого состояния в жидкое требует некоторого количества энергии, которую мы обычно называем скрытой теплотой. Давайте посмотрим, что происходит со льдом, когда мы добавляем к нему энергию. Если она ниже 0°C, она начнет нагреваться, пока не достигнет 0°C. В этот момент он начнет таять. Но поскольку плавление требует энергии, мы должны продолжать добавлять эту энергию в систему. Вместо дальнейшего повышения температуры вся энергия, которую мы добавляем, теперь идет на таяние льда, а температура остается неизменной. И лед, и жидкая вода (та часть, которая уже растаяла) теперь имеют температуру 0°C. Пока есть лед, добавление энергии в систему только растопит лед, но не повысит температуру. Только когда весь лед превратится в жидкость, добавление энергии снова повысит температуру выше 0°C.
Если она ниже 0°C, она начнет нагреваться, пока не достигнет 0°C. В этот момент он начнет таять. Но поскольку плавление требует энергии, мы должны продолжать добавлять эту энергию в систему. Вместо дальнейшего повышения температуры вся энергия, которую мы добавляем, теперь идет на таяние льда, а температура остается неизменной. И лед, и жидкая вода (та часть, которая уже растаяла) теперь имеют температуру 0°C. Пока есть лед, добавление энергии в систему только растопит лед, но не повысит температуру. Только когда весь лед превратится в жидкость, добавление энергии снова повысит температуру выше 0°C.
Тот же аргумент, что и в начале, касается пара. Как только вода станет газообразной, ничто не мешает нам нагревать ее дальше. Но так как вода жидкая только от 0 до 100°C, мы не можем охладить ее ниже 0 или нагреть выше 100°C без перехода в другую фазу (опять же при атмосферном давлении).
Есть некоторые исключения. Переохлажденная или перегретая вода имеют температуру ниже 0 и выше 100°C соответственно. Но они не находятся в термодинамическом равновесии, и любое существенное возмущение заставит их замерзнуть или испариться почти мгновенно. Для того, чтобы начать замерзать, воде нужны какие-то несовершенства, при которых может начаться кристаллизация. Это могут быть мелкие частицы пыли или что-то еще, плавающее в воде. Если вода и емкость действительно чистые, и нет таких мест, в которых может начаться процесс кристаллизации, то вода останется жидкой даже ниже 0°С.
Но они не находятся в термодинамическом равновесии, и любое существенное возмущение заставит их замерзнуть или испариться почти мгновенно. Для того, чтобы начать замерзать, воде нужны какие-то несовершенства, при которых может начаться кристаллизация. Это могут быть мелкие частицы пыли или что-то еще, плавающее в воде. Если вода и емкость действительно чистые, и нет таких мест, в которых может начаться процесс кристаллизации, то вода останется жидкой даже ниже 0°С.
$\endgroup$
15
$\begingroup$
Температура — это просто внутренняя энергия или средняя скорость частиц. Когда мы совершаем работу с материалом, его внутренняя энергия меняется. В большинстве случаев температура изменяется линейно с внутренней энергией. Но когда мы хотим, чтобы вода испарилась, нам нужно проделать еще больше работы, чтобы преодолеть точку кипения, потому что ей нужно избежать гравитации. Значит, нам нужно отдать еще больше энергии, чтобы вода испарилась. То же самое и с точкой замерзания. На графике это выглядит так:
Значит, нам нужно отдать еще больше энергии, чтобы вода испарилась. То же самое и с точкой замерзания. На графике это выглядит так:
А вот и ответ на ваш вопрос: лед может быть холоднее 0 °C. Так уж получилось, что при 0°С молекулы воды плотно упаковываются (мы называем это льдом), но это не мешает ей еще больше остывать, потому что молекулы во льду еще колеблются с некоторой скоростью. Мы сказали, что температура — это просто внутренняя энергия или средняя скорость частицы. При более низкой температуре частицы движутся медленнее и могут (теоретически) достигать скорости 0. Это происходит при температуре около -273,15 °C, поэтому лед может остыть до этой температуры.
По поводу второго вопроса: это зависит от определения воды. Мое определение таково: вода — это лед, жидкая вода и пар. Таким образом, вода может нагреваться выше 100 °C. Но это уже не жидкая вода, это пар. Когда жидкая вода достигает 100 °C, мы «переименовываем» ее в пар. Итак, вы частично правы, потому что жидкой воде нужно подождать, чтобы нагреться до достаточного количества тепла (график выше), чтобы перейти от точки кипения до пара. И да, пар может быть горячее 100°C.
И да, пар может быть горячее 100°C.
$\endgroup$
2
$\begingroup$
Вы можете сделать лед настолько холодным, насколько захотите, если у вас достаточно хорошая морозильная камера. Если вы настроите морозильную камеру на -1°С и нальете в нее воду, то (через достаточное время) у вас будет лед с температурой -1°С. время) имеют лед, температура которого также составляет -10°C.
Особенность 0°C заключается в том, что это точка (в нормальных условиях на большей части Земли), в которой вода может быть твердой (лед) или жидкость. Как только вода станет холоднее, она обязательно станет льдом, а когда станет теплее, она обязательно — до точки кипения, когда она превратится в газ — будет жидкой. Это ответ для большинства «обычных» ситуаций на Земле в нормальных условиях. Как указывалось в других ответах и комментариях, существуют и другие возможности, такие как переохлаждение, и атмосферное давление также имеет значение. Но поскольку вас, кажется, интересуют самые простые бытовые случаи, я думаю, что это ваш простой ответ.
Но поскольку вас, кажется, интересуют самые простые бытовые случаи, я думаю, что это ваш простой ответ.
С другой стороны, 100°C – это точка, в которой вода может быть газообразной (пар) или жидкой. Теплее и обязательно будет газ. Холоднее, и он будет — вплоть до точки замерзания — жидким. Теоретически ничто не препятствует нагреванию воды выше 100°C, хотя на практике вам придется задерживать пар, чтобы он находился достаточно близко к источнику тепла, чтобы это произошло. Опять же, это в самых обычных повседневных условиях. Существуют и другие возможные эффекты, такие как перегрев, и атмосферное давление также имеет значение для кипения.
Из двух, кстати, атмосферное давление имеет некоторые последствия для обычного человека, живущего на больших высотах, в конце кипения. Время от времени вы будете видеть инструкции по приготовлению продуктов, которые дают разные указания для людей, живущих на больших высотах. Обычно это происходит потому, что температура кипения воды там ниже (поскольку на большей высоте атмосферное давление немного ниже, чем вблизи уровня моря). При «кипячении» пищи она становится немного менее горячей, что в некоторых случаях имеет заметную разницу. Скороварка, с другой стороны, работает по-другому. Он задерживает газ в скороварке, увеличивая давление по мере повышения температуры. Это позволяет оставшейся воде в скороварке нагреться выше 100 ° C (без превращения в пар) и, таким образом, сделать «вареную» пищу более горячей, чем это было бы возможно. в обычном горшке.
При «кипячении» пищи она становится немного менее горячей, что в некоторых случаях имеет заметную разницу. Скороварка, с другой стороны, работает по-другому. Он задерживает газ в скороварке, увеличивая давление по мере повышения температуры. Это позволяет оставшейся воде в скороварке нагреться выше 100 ° C (без превращения в пар) и, таким образом, сделать «вареную» пищу более горячей, чем это было бы возможно. в обычном горшке.
$\endgroup$
0
термодинамика — Как изменяется со временем температура в ведре воды со льдом?
спросил
Изменено 8 лет, 5 месяцев назад
Просмотрено 6к раз
$\begingroup$
Мне любопытно, что происходит с температурой воды в ведре со льдом. Давайте начнем с ведра только со льдом, и мы добавим воду в комнате, которая имеет комнатную температуру. Похоже, есть две возможности. Интуитивно я предполагаю, что происходит следующее:
Давайте начнем с ведра только со льдом, и мы добавим воду в комнате, которая имеет комнатную температуру. Похоже, есть две возможности. Интуитивно я предполагаю, что происходит следующее:
- Если вода слишком горячая, то весь лед быстро растает. Температура в этот момент будет зависеть от того, сколько было льда и насколько горячей была вода. С этого момента температура будет медленно достигать равновесия с температурой в комнате.
- Если вода не слишком горячая, то лед сразу не растает. Температура воды будет становиться все ниже, а лед будет продолжать таять, вплоть до некоторой промежуточной точки равновесия . В этот момент вода не становится холоднее, но лед продолжает таять. Когда весь лед растает, температура начнет достигать равновесия с температурой в комнате.
Мой конкретный вопрос: во-первых, правильно ли вышеизложенное, и если да, то какова температура воды в этой «промежуточной точке равновесия»? Это ноль градусов? Если да, то почему часть существующей воды не превращается в лед?
- термодинамика
- вода
- температура
- равновесие
- лед
$\endgroup$
$\begingroup$
Да, ваш анализ верен.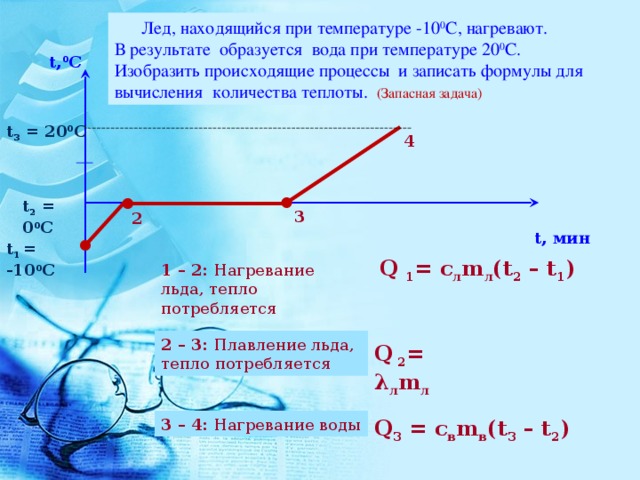 Вода, находящаяся в равновесии со льдом, имеет температуру 0 градусов С. Причина, по которой вода не превращается самопроизвольно в лед, связана со скрытой теплотой плавления воды: чтобы вода могла превратиться в лед при нуле градусов С, от него нужно отвести довольно много тепла. В случае воды/льда скрытая теплота составляет почти ровно 80 кал/г (334 Дж/г). Другой способ подумать об этом: один грамм льда при нуле C может снизить температуру 1 грамма воды с 80 C до нуля C (или 4 грамма с 20 до 0 и т. д.). Вот почему вы можете добавить в напиток несколько кусочков льда, и весь напиток остынет, не слишком разбавляясь. Добавление большего количества льда, чем необходимо, помогает ускорить процесс (поскольку площадь поверхности, соприкасающейся с жидкостью, больше), но в конце вы получите некоторое количество твердого льда, а это, в свою очередь, будет поддерживать температуру жидкости при 0°C, так как любой тепло, поглощаемое из окружающей среды, быстро пойдет на таяние льда.
Вода, находящаяся в равновесии со льдом, имеет температуру 0 градусов С. Причина, по которой вода не превращается самопроизвольно в лед, связана со скрытой теплотой плавления воды: чтобы вода могла превратиться в лед при нуле градусов С, от него нужно отвести довольно много тепла. В случае воды/льда скрытая теплота составляет почти ровно 80 кал/г (334 Дж/г). Другой способ подумать об этом: один грамм льда при нуле C может снизить температуру 1 грамма воды с 80 C до нуля C (или 4 грамма с 20 до 0 и т. д.). Вот почему вы можете добавить в напиток несколько кусочков льда, и весь напиток остынет, не слишком разбавляясь. Добавление большего количества льда, чем необходимо, помогает ускорить процесс (поскольку площадь поверхности, соприкасающейся с жидкостью, больше), но в конце вы получите некоторое количество твердого льда, а это, в свою очередь, будет поддерживать температуру жидкости при 0°C, так как любой тепло, поглощаемое из окружающей среды, быстро пойдет на таяние льда.
$\endgroup$
$\begingroup$
Если льда почти нет, вода будет остывать, когда лед прогреется до 0°C, а затем еще немного охладится, когда лед растает.

 03.14
03.14