В свойствах изотопа магния с магическим числом нейтронов обнаружили аномалии — Наука
ТАСС, 24 декабря. Американские физики впервые получили значимое количество магния-20 – сверхлегкого изотопа с магическим числом нейтронов. Он оказался значительно менее стабильным, чем предсказывает теория. Описание работы опубликовал научный журнал Physical Review Letters.
«Нам впервые удалось получить значимые количества магния-18 и магния-20 и реконструировать процесс их распада. Замеры масс-спектра этих изотопов указывают, что наличие магического числа нейтронов в магнии-20 не делает его значительно более стабильным, чем магний-18, как это предсказывает теория. Причину этого еще предстоит выяснить», — пишут ученые.
Ядра всех элементов тяжелее водорода состоят из двух частиц – положительно заряженных протонов и нейтронов, не имеющих электрического заряда. Соотношение числа этих частиц напрямую влияет на то, насколько стабилен атом. Если внутри него преобладают протоны или нейтроны, то атом становится нестабильным и пытается избавиться от лишних частиц.
Физики уже много десятилетий пытаются объяснить это, изучая элементы с так называемым магическим числом протонов и нейтронов – 2, 8, 20, 28, 50, 82 и 126. Подобные изотопы значительно стабильнее, чем их соседи, и при этом они распадаются не так, как это предсказывает классическая ядерная физика. Поэтому ученые непрерывно изучают подобные «магические» изотопы и ищут новые числа подобного рода.
Физики под руководством доцента Мичиганского университета Кайла Брауна открыли одно из первых свидетельств того, что наличие магического числа протонов или нейтронов далеко не всегда повышает стабильность атома. Ученые пришли к такому выводу в ходе опытов по синтезу сверхлегких изотопов магния, содержащих шесть (магний-18) и восемь нейтронов (магний-20).
Оба этих изотопа в природе не существуют, так как их атомы крайне нестабильны и распадаются за несколько десятков миллисекунд. По этой причине Браун и его коллеги пытались получить значимые количества магния-18 и магния-20 в ходе опытов с ускорителем частиц, который сталкивал разогнанные ионы стабильного магния-24 с мишенью из бериллия.
Периодически в результате таких столкновений ядра магния-24 распадались и формировали более легкие изотопы этого металла, содержавшие от шести до одиннадцати нейтронов. Самые нестабильные из них почти сразу же избавлялись от «лишних» протонов и превращались в более легкие элементы, за рождением атомов которых и наблюдали ученые.
Благодаря этому эксперименту физики проследили за рождением атомов магния-18 и детально изучили процесс распада магния-20, в том числе и измерили энергию атомов обоих изотопов в момент распада. Браун и его коллеги обнаружили, что магний-18 в некоторых случаях превосходил по уровню энергии его «магического» соседа по таблице изотопов, что говорит о неожиданно низкой стабильности магния-20.
Это открытие стало сюрпризом для ученых, так оно не соответствует теории магических чисел. Последующие опыты по синтезу магния-18 и наблюдения за распадами, как надеются американские исследователи, помогут им понять, связано ли это с реальным несоответствием теории и результатов эксперимента или с какими-то побочными факторами, которые они не учли при проведении измерений.
Химические свойства магния (23 полных факта) —
Каждый элемент обладает некоторыми химическими свойствами, что делает его полезным для людей несколькими способами. Поговорим о свойствах магния.
Магний является щелочноземельным металлом в периодической таблице. Он имеет блестящий серый цвет и не имеет специфического запаха. Как и другие элементы в таблице Менделеева, этот элемент также обладает некоторыми физическими и химическими свойствами, которые важно знать, чтобы знать элемент.
Давайте обсудим положение магния в периодической таблице, его вес, конфигурацию, степень окисления и многие другие связанные с этим факты в этой статье.
Символ магния
Символы используются для элементов, чтобы представить их в химических реакциях и идентифицировать в любом другом химическом обзоре. Найдем символ магния.
Компания символ магния составляет Mg. При произнесении названия этого элемента «М» и «Г» эти 2 буквы находятся под давлением, поэтому символическое обозначение элемента — Mg. Символ магния
Символ магния
Группа магния в периодической таблице
Группы представляют собой столбцы в периодической таблице. Выясним, к какой группе относится магний.
Магний находится во 2 группе периодической таблицы. В соответствии с числом электронов в последней электронной оболочке группа делится. Mg имеет 2 электрона на последней оболочке, поэтому он помещен во 2-ю группу в таблице..
Период магния в периодической таблице
Периоды таблицы — это строки, заполняющие элементы с фиксированным положением. Определим, к какому периоду относится Mg.
Магний занимает в таблице период 3. Это связано с тем, что третья электронная оболочка является последней оболочкой или валентной оболочкой элемента.
Блок магния в периодической таблице
Блок в таблице Менделеева представляет собой совокупность определенных элементов, имеющих сходные вакансии в валентной оболочке в соответствии с орбиталями. Найдем блок Mg.
Mg относится к s-блоку периодической таблицы. Поскольку его последний электрон валентной оболочки находится на s-орбитали, магний находится в s-блоке.
Атомный номер магния
Атомный номер — это количество протонов, электронов и нейтронов (ядер), присутствующих в элементе, или заряд, удерживаемый ядром. Давайте обсудим атомный номер Mg.
Атомный номер магния 12. Это означает, что он имеет 12 протонов, 12 нейтронов и 12 электронов..
Атомный вес магния
Общий вес атома представляет собой атомный вес элемента. Это почти равно общему количеству нейтронов и протонов в них. Определим то же самое для Mg.
Атомный вес Mg равен 24.312 ед. Можно заметить, что дополнительное число протона и нейтрона равно (12+12) = 24, что ближе к его атомному весу.
Электроотрицательность магния по Полингу
Электроотрицательность относится к привлечению элементов к общему электрону другими. Это обозначается X. Давайте признаем электроотрицательность Магния ниже.
По шкале Полинга установлено, что электроотрицательность магния равна 1.31.
Атомная плотность магния
Атомную плотность можно определить как плотность атомов на м3 элементов. Представим атомную плотность Mg в г/м3.
Атомная плотность магния составляет 1.74 мг/м.3. значит в 1м3 Mg, общая плотность 1.74 Mg может быть обнаружена.
Температура плавления магния
Температура плавления – это определенная температура, при которой элемент начинает плавиться из твердого состояния в жидкое. Давайте обсудим температуру плавления Mg.
Температура плавления магния составляет почти 650 ° C (923 K). Это самая низкая температура, при которой плавится элемент в периодической таблице.
Температура кипения магния
Температура кипения определяется как определенная температура, при которой периодический элемент начинает испаряться. Определим температуру кипения Mg.
Температура кипения магния составляет около 1090 ° C (1360 K). Это также самая низкая температура в диапазоне температур кипения других элементов.
Радиус Ван-дер-Ваальса магния
Ученый Ван дер Ваальс открыл особую характеристику периодического элемента, названную атомным радиусом (rw). Определим ван-дер-ваальсов радиус Mg.
Радиус Ван-дер-Ваальса магния составляет 173 пм. Это относится к радиусу воображаемой твердой сферы, созданной последней электронной оболочкой элемента.
Ионный радиус магния
Радиус одноатомных ионов, создаваемых элементом после ухода или принятия дополнительных электронов на последней оболочке, называется ионным радиусом (rион). Найдем ионный радиус Mg.
Ионный радиус Mg2+ 66 вечера. Ясно, что магний имеет огромную тенденцию восстанавливать или оставлять электроны и образовывать одноатомный катион.
Изотопы магния
Изотопы — это различные формы элементов с одинаковым атомным номером, но разным числом нуклонов. Найдем изотопы Mg ниже.
Найдем изотопы Mg ниже.
Три стабильных изотопа Mg 24мг, 25Mg и 26мг. В остальном существует 19 радиоизотопов магния, которые весьма нестабильны.
Электронная оболочка из магния
Электронные оболочки — это те пути, которые удерживают электроны в элементах так же, как солнце удерживает планеты на эллиптическом пути. Посмотрим, сколько электронных оболочек у Mg.
В одном атоме магния три электронные оболочки. Первая оболочка содержит 2 электрона, вторая оболочка содержит 8 электронов, а последняя оболочка содержит 2 электрона.
Энергия магния первой ионизации
Энергия первой ионизации может быть определена как количество энергии, необходимое для того, чтобы покинуть самый внешний электрон с последнего энергетического уровня атомов. Найдем первый ИЭ магния.
Энергия первой ионизации магния составляет 737.7 кДж/моль.
Энергия вторичной ионизации магния
Энергия второй ионизации – это та энергия, которая необходима для удаления второго валентного электрона после наличия в атоме заряда +1. Найдем второй ИЭ Mg.
Найдем второй ИЭ Mg.
Энергия второй ионизации Магния составляет 1450.7 кДж/моль.
Энергия магния третьей ионизации
Энергия третьей ионизации относится к энергии, необходимой для восстановления третьего электрона из атомов с зарядом +2. Найдем здесь третью ионизацию магния.
Энергия третьей ионизации магния составляет 7732.7 кДж/моль.
Степени окисления магния
Степень окисления относится к определенному количеству электронов, которые могут быть потеряны элементом в периодической таблице. Степень окисления магния указана ниже.
Единственная степень окисления магния +2. Mg имеет только два электрона в своей валентной оболочке, поэтому он способен оставить только 2 электрона.
Электронные конфигурации магния
Электронная конфигурация относится к расположению электронов на орбиталях. Это представлено через принцип Ауфбау. Обозначим электронную конфигурацию Магния.
Электронная конфигурация магния [Ne] 3s2 . Полная конфигурация в соответствии с принципом Ауфбау может быть представлена как 1s2 2s2 3p6 3s2. Это означает, что все электроны ограничены s- и p-орбиталями атомов Mg.
Полная конфигурация в соответствии с принципом Ауфбау может быть представлена как 1s2 2s2 3p6 3s2. Это означает, что все электроны ограничены s- и p-орбиталями атомов Mg.
Номер CAS магния
Номер CAS химических веществ относится к службам Chemical Abstracts Services, которые однозначно создают идентификацию элементов. Отметим номер CAS, принадлежащий Mg.
Номер CAS для магния: 7439-95-4. Это также называется идентификатором CAS элементов, который отличает один от другого.
Магний ChemSpider ID
ChemSpider — это химическая база данных на онлайн-платформе, к которой любой может получить свободный доступ, чтобы узнать о химических свойствах элемента. Давайте найдем идентификатор Mg в ChemSpider.
Идентификатор ChemSpider для Mg — 4575328. Используя этот идентификатор, любой может искать информацию о магнии и его свойствах в базе данных ChemSpider.
Химическая классификация магния
Химическая классификация определяет признаки, которыми обладают элементы, которые могут отличаться друг от друга. Давайте найдем эти особенности магния здесь.
Давайте найдем эти особенности магния здесь.
Магний — самый легкий щелочноземельный металл в периодической таблице. Mg очень важен в клеточной жизни как один из ключевых химических компонентов формирования клеток.
Состояние магния при комнатной температуре
Элемент может появиться при комнатной температуре в трех различных состояниях, таких как твердое, жидкое и газообразное. Определим, какое состояние Mg принимает естественно.
При комнатной температуре магний выглядит как твердый элемент блестящего серого цвета.
Является ли магний парамагнитным?
Парамагнитные элементы или соединения — это те, которые не обладают какой-либо непарной электронной конфигурацией. Выясним, является ли Mg парамагнитным или нет.
Mg идентифицируется как парамагнитный элемент, поскольку в его конфигурации нет неспаренных электронов.
Заключение
В статье выявлено более 23 химических фактов о земном металле магнии. Его существование в периодической таблице уникально, чем любые другие элементы. Элемент обладает всеми общими химическими свойствами, но по-своему.
Его существование в периодической таблице уникально, чем любые другие элементы. Элемент обладает всеми общими химическими свойствами, но по-своему.
Магний — протоны — нейтроны — электроны
Магний представляет собой блестящее серое твердое вещество, имеющее близкое физическое сходство с другими пятью элементами второй колонки (группа 2, или щелочноземельные металлы) периодической таблицы: все группы 2 элемента имеют одинаковую электронную конфигурацию во внешней электронной оболочке и сходную кристаллическую структуру.
Магний является третьим наиболее часто используемым конструкционным металлом после железа и алюминия. Основные области применения магния: алюминиевые сплавы, литье под давлением (легированное цинком), удаление серы при производстве железа и стали и производство титана в процессе Кролла. В настоящее время магний получают в основном электролизом солей магния, полученных из рассола.
Протоны и нейтроны в магнии
Магний — это химический элемент с атомным номером 12 , что означает, что в его ядре 12 протонов.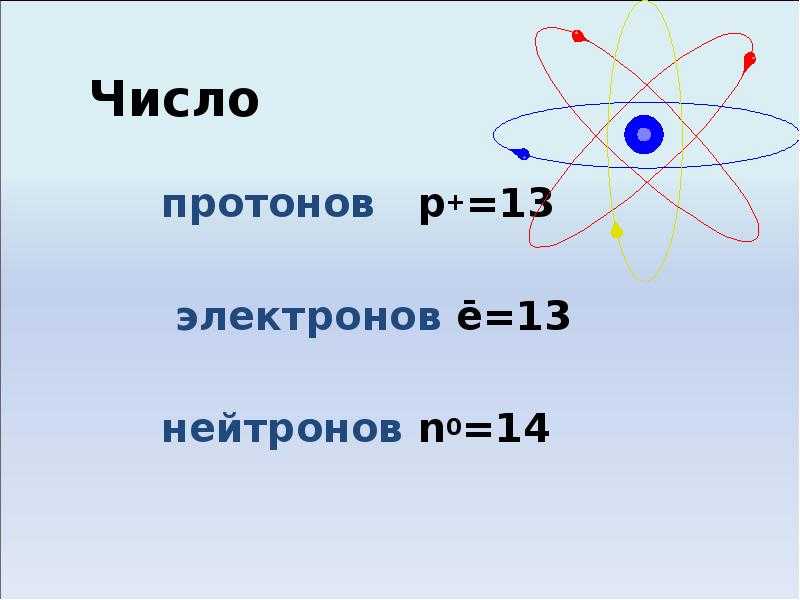 Общее количество протонов в ядре называется атомным номером атома и обозначается символом Z . Таким образом, общий электрический заряд ядра равен +Ze, где e (элементарный заряд) равен 1,602 x 10 -19 кулонов .
Общее количество протонов в ядре называется атомным номером атома и обозначается символом Z . Таким образом, общий электрический заряд ядра равен +Ze, где e (элементарный заряд) равен 1,602 x 10 -19 кулонов .
Общее число нейтронов в ядре атома называется номер нейтрона атома и обозначен символом N . Число нейтронов плюс атомный номер равняется атомному массовому числу: N+Z=A . Разница между числом нейтронов и атомным номером известна как избыток нейтронов : D = N – Z = A – 2Z.
Для стабильных элементов обычно используется множество стабильных изотопов. Изотопы — это нуклиды с одинаковым атомным номером и, следовательно, одним и тем же элементом, но различающиеся числом нейтронов. Массовые числа типичных изотопов Магний ар 24; 25 ;26.
Основные изотопы магния
Магний в природе встречается в виде трех стабильных изотопов: 24Mg, 25Mg и 26Mg. Самый долгоживущий радиоизотоп — 28Mg с периодом полураспада 20,915 часов. Более легкие изотопы в основном распадаются на изотопы натрия, а более тяжелые изотопы распадаются на изотопы алюминия.
Самый долгоживущий радиоизотоп — 28Mg с периодом полураспада 20,915 часов. Более легкие изотопы в основном распадаются на изотопы натрия, а более тяжелые изотопы распадаются на изотопы алюминия.
Магний-24 состоит из 12 протонов, 12 нейтронов и 12 электронов.
Магний-25 состоит из 12 протонов, 13 нейтронов и 12 электронов.
Магний-26 состоит из 12 протонов, 12 нейтронов и 12 электронов.
Стабильные изотопы
Типичные нестабильные изотопы
Электроны и электронная конфигурация
Количество электронов в электрически нейтральном атоме равно количеству протонов в ядре. Следовательно, число электронов в нейтральном атоме Магния равно 12. На каждый электрон действуют электрические поля, создаваемые положительным зарядом ядра и другими (Z – 1) отрицательными электронами в атоме.
Поскольку количество электронов и их расположение ответственны за химическое поведение атомов, атомный номер идентифицирует различные химические элементы. Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Электронная конфигурация Магния : [Ne] 3s2 .
Возможные степени окисления +2 .
Магний встречается в природе только в сочетании с другими элементами, где он неизменно имеет степень окисления +2. Свободный элемент (металл) можно получить искусственно, и он обладает высокой реакционной способностью (хотя в атмосфере он вскоре покрывается тонким слоем оксида, который частично подавляет реакционную способность). Свободный металл горит характерным ярко-белым светом.
Типовой сплав магния
В целом Elektron является зарегистрированным товарным знаком широкого спектра магниевых сплавов, производимых британской компанией Magnesium Elektron Limited. Elektron 21 , обозначенный UNS M12310, является одним из сплавов с превосходной коррозионной стойкостью и литейными свойствами. Литые изделия обладают мелкозернистой микроструктурой и герметичностью. Этот сплав легко поддается механической обработке. Применение включает в себя автоспорт и аэрокосмическую промышленность, поскольку обладает высокой прочностью, малым весом и отличными характеристиками гашения вибрации.
Elektron 21 , обозначенный UNS M12310, является одним из сплавов с превосходной коррозионной стойкостью и литейными свойствами. Литые изделия обладают мелкозернистой микроструктурой и герметичностью. Этот сплав легко поддается механической обработке. Применение включает в себя автоспорт и аэрокосмическую промышленность, поскольку обладает высокой прочностью, малым весом и отличными характеристиками гашения вибрации.
О протонах
Протон — это одна из субатомных частиц, составляющих материю. Во Вселенной протонов много, и они составляют примерно половины всей видимой материи. Он имеет положительный электрический заряд (+1e) и массу покоя, равную 1,67262 × 10 −27 кг ( 938,272 МэВ/с 2 ) — немного легче, чем у нейтрона, но почти в 1 836 раз больше, чем у нейтрона. раз больше, чем у электрона. Протон имеет средний квадратный радиус около 0,87 × 10 −15 м, или 0,87 фм, и это спин — ½ фермиона.
Протоны существуют в ядрах обычных атомов вместе с их нейтральными аналогами, нейтронами. Нейтроны и протоны, обычно называемые нуклонами , связаны друг с другом в атомном ядре, где они составляют 99,9% массы атома. Исследования в области физики частиц высоких энергий в 20 веке показали, что ни нейтрон, ни протон не являются мельчайшими строительными блоками материи.
О нейтронах
Нейтрон — это одна из субатомных частиц, из которых состоит материя. Во Вселенной много нейтронов, составляющих больше половины всей видимой материи. У него нет электрического заряда , а масса покоя равна 1,67493 × 10-27 кг, что немного больше, чем у протона, но почти в 1839 раз больше, чем у электрона. Нейтрон имеет средний квадратный радиус около 0,8 × 10–15 м или 0,8 фм и является фермионом со спином ½.
Атомные ядра состоят из протонов и нейтронов, которые притягиваются друг к другу ядерной силой , а протоны отталкиваются друг от друга электрической силой из-за своего положительного заряда. Эти две силы конкурируют, что приводит к различной устойчивости ядер. Существуют только определенные комбинации нейтронов и протонов, которые образуют стабильных ядер .
Эти две силы конкурируют, что приводит к различной устойчивости ядер. Существуют только определенные комбинации нейтронов и протонов, которые образуют стабильных ядер .
Нейтроны стабилизируют ядро , потому что они притягивают друг друга и протоны , что помогает компенсировать электрическое отталкивание между протонами. В результате с увеличением числа протонов для образования стабильного ядра требуется увеличивающееся отношение нейтронов к протонам . Если нейтронов слишком много или слишком мало для данного количества протонов, полученное ядро не является стабильным и подвергается радиоактивному распаду. Нестабильные изотопы распадаются по различным путям радиоактивного распада, чаще всего альфа-распад, бета-распад или захват электронов. Известно много других редких типов распада, таких как спонтанное деление или испускание нейтронов. Следует отметить, что все эти пути распада могут сопровождаться последующий выброс гамма-излучения . Чистые альфа- или бета-распады очень редки.
Чистые альфа- или бета-распады очень редки.
Об электронах и электронной конфигурации
Периодическая таблица представляет собой табличное отображение химических элементов, организованных на основе их атомных номеров, электронных конфигураций и химических свойств. Электронная конфигурация — это распределение электронов атома или молекулы (или другой физической структуры) на атомных или молекулярных орбиталях. Знание электронной конфигурации различных атомов полезно для понимания структуры периодической таблицы элементов.
Каждое твердое тело, жидкость, газ и плазма состоят из нейтральных или ионизированных атомов. Химические свойства атома определяются количеством протонов, фактически числом и расположением электронов . Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Это принцип запрета Паули , который требует, чтобы электроны в атоме занимали разные энергетические уровни вместо того, чтобы все они конденсировались в основном состоянии. Упорядочивание электронов в основном состоянии многоэлектронных атомов начинается с самого низкого энергетического состояния (основного состояния) и постепенно перемещается оттуда вверх по энергетической шкале, пока каждому из электронов атома не будет присвоен уникальный набор квантовых чисел. Этот факт имеет ключевое значение для построения периодической таблицы элементов.
Первые два столбца в левой части таблицы Менделеева занимают s подоболочки. Из-за этого первые две строки периодической таблицы помечены как блок s . Точно так же блок p представляет собой крайние правые шесть столбцов периодической таблицы, блок d представляет собой 10 средних столбцов периодической таблицы, а блок f представляет собой раздел из 14 столбцов, который обычно изображается как отделенный от основной части таблицы Менделеева. Она могла бы быть частью основной части, но тогда таблица Менделеева была бы довольно длинной и громоздкой.
Она могла бы быть частью основной части, но тогда таблица Менделеева была бы довольно длинной и громоздкой.
Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Электронная конфигурация может быть представлена как основные электроны, эквивалентные инертным газам предыдущего периода, и валентные электроны (например, [Xe] 6s2 для бария).
Степени окисления
Степени окисления обычно представляются целыми числами, которые могут быть положительными, нулевыми или отрицательными. Большинство элементов имеют более одной возможной степени окисления. Например, углерод имеет девять возможных целочисленных степеней окисления от -4 до +4.
Текущее определение степени окисления в Золотой книге ИЮПАК:
«Степень окисления атома — это заряд этого атома после ионной аппроксимации его гетероядерных связей…»
, и термин «степень окисления» является почти синонимом. Элемент, который не сочетается ни с какими другими элементами, имеет степень окисления 0. Степень окисления 0 встречается у всех элементов — это просто элемент в его элементарной форме. Атом элемента в соединении будет иметь положительную степень окисления, если у него удалены электроны. Точно так же добавление электронов приводит к отрицательной степени окисления. Мы также различаем возможные и распространенные степени окисления каждого элемента. Например, кремний имеет девять возможных целочисленных степеней окисления от -4 до +4, но только -4, 0 и +4 являются обычными степенями окисления.
Элемент, который не сочетается ни с какими другими элементами, имеет степень окисления 0. Степень окисления 0 встречается у всех элементов — это просто элемент в его элементарной форме. Атом элемента в соединении будет иметь положительную степень окисления, если у него удалены электроны. Точно так же добавление электронов приводит к отрицательной степени окисления. Мы также различаем возможные и распространенные степени окисления каждого элемента. Например, кремний имеет девять возможных целочисленных степеней окисления от -4 до +4, но только -4, 0 и +4 являются обычными степенями окисления.
Сводка
| Элемент | Магний |
| Количество протонов | 12 |
| Количество нейтронов (типичные изотопы) | 24; 25 ;26 |
| Количество электронов | 12 |
| Электронная конфигурация | [Не] 3s2 |
| Степени окисления | +2 |
Источник: www. luciteria.com
luciteria.com
Свойства других элементов
Прочие свойства магния
| 1 | Найдите число нейтронов | ||
| 2 | Найдите массу 1 моля | Н_2О | |
| 3 | Весы | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найдите массу 1 моля | Х | |
| 5 | Найдите число нейтронов | Fe | |
| 6 | Найдите число нейтронов | ТК | |
| 7 | Найдите электронную конфигурацию | Х | |
| 8 | Найдите число нейтронов | Са | |
| 9 | Весы | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найдите число нейтронов | С | |
| 11 | Найдите число протонов | Х | |
| 12 | Найдите число нейтронов | О | |
| 13 | Найдите массу 1 моля | СО_2 | |
| 14 | Весы | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найдите атомную массу | ||
| 16 | Определить, растворимо ли соединение в воде | Н_2О | |
| 17 | Найдите электронную конфигурацию | На | |
| 18 | Найдите массу отдельного атома | Х | |
| 19 | Найдите число нейтронов | № | |
| 20 | Найдите число нейтронов | Аи | |
| 21 | Найдите число нейтронов | Мн | |
| 22 | Найдите число нейтронов | Ру | |
| 23 | Найдите электронную конфигурацию | О | |
| 24 | Найдите массовые проценты | Н_2О | |
| 25 | Определить, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую/самую простую формулу | Н_2О | |
| 27 | Найдите числа окисления | Н_2О | |
| 28 | Найдите электронную конфигурацию | К | |
| 29 | Найдите электронную конфигурацию | мг | |
| 30 | Найдите электронную конфигурацию | Са | |
| 31 | Найдите число нейтронов | Rh | |
| 32 | Найдите число нейтронов | На | |
| 33 | Найдите число нейтронов | часть | |
| 34 | Найдите число нейтронов | Быть | Быть |
| 35 | Найдите число нейтронов | Кр | |
| 36 | Найдите массу 1 моля | Н_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Fe | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите число нейтронов | Медь | |
| 41 | Найдите число нейтронов | С | |
| 42 | Найти степени окисления | Х | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найдите атомную массу | О | |
| 45 | Найдите атомный номер | Х | |
| 46 | Найдите число нейтронов | Мо | |
| 47 | Найдите число нейтронов | Ос | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | О | |
| 50 | Найдите электронную конфигурацию | Fe | |
| 51 | Найдите электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | На | |
| 55 | Найдите число нейтронов | Н | |
| 56 | Найдите количество нейтронов 92О | ||
| 60 | Упростить | ч*2о | |
| 61 | Определить, растворимо ли соединение в воде | Х | |
| 62 | Определение плотности на STP | Н_2О | |
| 63 | Найти степени окисления | NaCl | |
| 64 | Найдите атомную массу | Он | Он |
| 65 | Найдите атомную массу | мг | |
| 66 | Найдите количество электронов | Х | |
| 67 | Найдите число электронов | О | |
| 68 | Найдите число электронов | С | |
| 69 | Найдите количество нейтронов | ПД | |
| 70 | Найдите число нейтронов | рт. |
