«Почему у водорода нет нейтрона?» — Яндекс Кью
Популярное
Сообщества
Мисс Элих
·
14,3 K
ОтветитьУточнитьПавел Васильев
12
Химик-аналитик, информационные технологии (на уровне любителя). · 5 янв 2021
Это обусловлено строением атома элемента. Атом любого элемента обычно состоит из протонов, нейтронов и электронов. В атоме обычного водорода содержится один протон и один электрон. Иногда ион H+ (обратите внимание, речь об ионе, а не об атоме; это разные понятия) так и называют — протон.
По одной из версий нейтрона в обычном атоме водорода действительно нет. А если он появляется, свойства очень сильно меняются, поэтому оба стабильных изотопов имеют свои названия дейтерий (один нейтрон) и тритий (2 нейтрона).
По другой версии атом обычного водорода содержит один протон, один электрон и один нейтрон. А изотопы дейтерий (2 нейтрона) и тритий (3 нейтрона) содержат ещё и 2 электрона и 2 протона; и 3 электрона и 3 протона соответственно для каждого помимо указанного для каждого числа нейтронов. Т.е. обычный ион водорода (не путайте с атомом, он всегда электрически нейтрален, т.е. заряда никогда не имеет; ион же всегда имеет какой-либо заряд («+» или «-«)) будет H+ , ион дейтерия h3+ (ион водорода с зарядом 2+), а ион трития h4+ (ион водорода с зарядом 3+). Это в корне неверная теория, она противоречит истинному строению атома водорода и его изотопов.
На основании последних исследований всё больше современных учёных и исследователей склоняются к первой версии как к наиболее верной и правильной.
Сейчас в современных источниках информации всё больше ссылок на первую версию и именно её авторы источников предлагают принять как единственно правильную и достоверную, а также всё больше и больше использовать её для изучения и различных расчётов.
В самых старых источниках информации верной и единственно правильной принято считать вторую версию. Хотя, на основании многолетних исследований атома водорода доподлинно известно, что ион обычного водорода имеет степень окисления (заряд) +1. В свете всех выше изложенных фактов первая теория выглядит всё же более состоятельнее и ближе к истине, нежели вторая.
Водород пока изучен не в полной мере. Учёные до сих пор спорят не только по поводу данных теорий, но даже о том, к какой группе в Периодической таблице (системе) химических элементов Дмитрия Ивановича Менделеева можно окончательно отнести водород: к первой или всё же к седьмой. Поэтому водород пока принадлежит к обоим группам Периодической таблицы. Это решение было принято на основании последних данных о свойствах и электронном строении атома этого загадочного элемента, а также свойствах его изотопов и данных об электронном строении атомов данных изотопов водорода, учитывая все известные особенности электронного строения и свойств и атомов, и ионов, и молекул, и самих свободных веществ как обычного водорода, так и всех его изотопов, включая нестабильные; с учётом всех физико-химических свойств этих свободных веществ, а также и целого ряда других не менее важных факторов.
Подведём итоги.
Атом любого вещества состоит из ядра и электронов (отрицательно заряженных частиц), движущихся по орбитам вокруг него. Ядро атома содержит положительно заряженные частицы — протоны, и частицы с нейтральным зарядом — нейтроны. В обычном атоме число электронов и протонов совпадает, а вот количество нейтронов может отличаться. В этом случае элементы, имеющие разное число нейтронов в ядре, называются изотопами элемента. Ион водорода имеет заряд +1, в атоме обычного водорода содержится один электрон и один протон. Его изотопы — протий, дейтерий и тритий. Слово «протий» образовано от греческого слова «первый». Этот элемент имеет лишь один протон в ядре. По сути, он представляет собой привычный нам водород. Дейтерий означает «второй». В его ядре имеется один протон и один нейтрон. А тритий переводится как «третий» и содержит в ядре опять же один протон, но два нейтрона.
Николай Семенов
5 января 2021
можно ссылку где ион водорода(не путать с атомом) обычно нейтральный, а ион трития имеет заряд т+3?
Комментировать ответ…Комментировать…
Михаил Реутин
Медицина
9,0 K
врач-педиатр · 27 мая 2018
Не совсем понял ваш вопрос. Протон вполне себе есть. Я даже больше скажу — на жаргоне ион H+ так и называется — протон.
Протон вполне себе есть. Я даже больше скажу — на жаргоне ион H+ так и называется — протон.
А вот нейтрона в обычном водороде нет. А если он появляется, свойства меняются очень сильно, поэтому оба стабильны изотопов имеют свои названия дейтерий (один нейтрон) и тритий (2 нейтрона).
ТРИКСТЕР
3 декабря 2022
А в молекуле Н2 есть ли нейтроны!?!
И что тогда обращует массу молекулы водорода, если нет нейтронов??!
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | ||
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Атомная структура
Атомная структураИз чего состоит атом? Атом состоит из тяжелого ядра протонов (положительно заряженные частицы, записываются как p + ) и нейтроны (нейтральные частиц, записываемых как n 0 ), вокруг которых вращается облако чрезвычайно легкие электроны (отрицательно заряженные частицы, записываются как е — ).
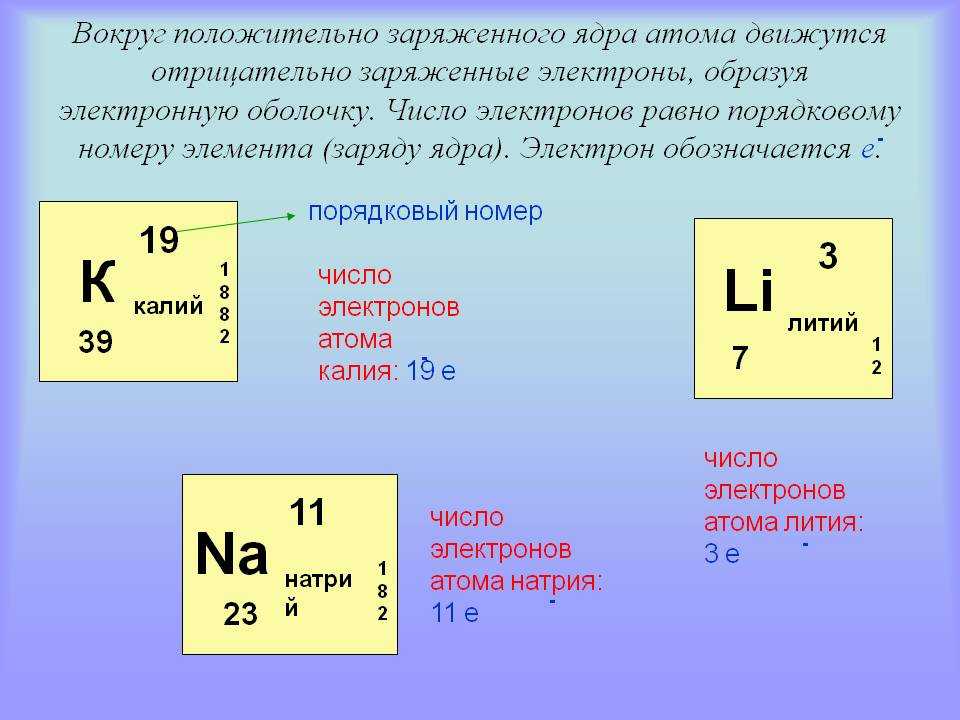
Что определяет элемент? Число протонов в ядре каждый атом.
- Атомы водорода (H) имеют 1 протон.
- Атомы водорода с 1 протоном и 1 электроном нейтральны водород ( 1 H 1 ).
- Атомы водорода с 1 протоном, 1 электроном и 1 нейтроном являются тяжелыми изотоп водорода, называемый дейтерием ( 2 H 1 ).
- Если к водороду добавить протон, мы получим другой элемент
— гелий ( 4 He 2 ).

- Номенклатура: Для каждого элемента верхний индекс обозначает количество протоны и нейтроны, а нижний индекс число протонов.
- Сколько нейтронов содержится в нейтральном углероде ( 12 C 6 )?
- Сколько нейтронов содержится в радиоактивном изотопе называется углерод-14 ( 14 C 6 )?
[НМСУ, Н. Фогт]
Как строение атома или элемента говорит нам о том, как будет выглядеть его спектр?
- Электроны существуют в стационарных состояниях внутри атомов, каждое из которых определяется дискретный, уникальный уровень энергии. Только определенные энергетические уровни, такие как орбиты с определенными радиусами.
- Свет или излучение, испускаемое или поглощаемое атомами при движении электронов из
с одного энергетического уровня на другой можно представить как поток из квантов называются фотонами.
 Каждый фотон несет энергию E = h × против . Мы определяем
эти энергетические уровни следующим образом, говоря, что электрон находится в возбужденное состояние, когда у него есть дополнительная энергия (подумайте о ребенке, отскакивающем от
стены с волнением).
Каждый фотон несет энергию E = h × против . Мы определяем
эти энергетические уровни следующим образом, говоря, что электрон находится в возбужденное состояние, когда у него есть дополнительная энергия (подумайте о ребенке, отскакивающем от
стены с волнением).[НМСУ, Н. Фогт] - Состояние заземления , самый низкий возможный уровень энергии
- Первое возбужденное состояние, следующий максимально допустимый уровень энергии
- Второе возбужденное состояние, следующий по величине разрешенный уровень энергии
- Третье возбужденное состояние, следующий по величине разрешенный уровень энергии
- …
- До точки, в которой электрон больше не связан с атомом
- Атом обычно имеет одинаковое количество протонов и электронов. Потому что
протоны имеют положительный заряд, а электроны — отрицательный, он переносит
в этом состоянии нет заряда.
 Когда атом теряет (или приобретает) электрон, мы говорим
что это ионизированное , и тогда оно несет электрический заряд.
Когда атом теряет (или приобретает) электрон, мы говорим
что это ионизированное , и тогда оно несет электрический заряд.
Энтропия говорит нам, что все вещи естественным образом тяготеют к минимально возможному энергетическое состояние:
- Бревна и вода катятся вниз по склону.
- Прыгающие мячи замедляются до полной остановки.
- Люди ложатся спать ночью и с трудом встают утром.
- Точно так же атомы водорода склонны находиться в основном состоянии.
- Большинство фотонов пролетают мимо, не взаимодействуя с атомом.
- Но фотоны только с правильной энергией поглощаются атомом.
- В данном случае справа означает, что энергия фотона соответствует
разница энергетических уровней между допускала орбит в водороде
атома, а поглотили означает, что энергия фотона будет
поглощается атомом (оставляя атом в более высоком энергетическом состоянии).

[НМСУ, Н. Фогт] - Фотон с частотой v будет поглощен атомом, если энергия фотона соответствует разнице уровней энергии между разрешенными состояний в атоме.
Что будет дальше?
- Помните, что энтропия ищет самый низкий доступный уровень энергии для всех вещи, так что электрон, поднятый на возбужденную орбиту, будет в конце концов вернуться в основное состояние.
- Сохранение энергии говорит нам, что разница в энергии
между возбужденным состоянием и основным состоянием должно появиться где-то, когда
электрон совершает переход. Он испускается атомом в виде фотона с
ту же энергию, что и исходная, которая была поглощена.
[НМГУ, Н. Фогт]
Вот схематическая диаграмма разрешенных орбит в атоме водорода. Если
вы можете ответить на вопросы, перечисленные ниже, у вас есть правильная идея!
Если
вы можете ответить на вопросы, перечисленные ниже, у вас есть правильная идея!
- Какие переходы соответствуют поглощению фотона? А и Д
- Какой переход соответствует самая высокая энергия испущенных фотонов ? С
- Какой переход соответствует самой короткой длине волны испущенных фотонов? С
- Какой переход соответствует поглощенному фотону с наименьшей энергией ? А
- Какой переход соответствует самой высокой частоте испускаемого фотона? С
| [НМГУ, Н. Фогт] |
Благодаря Майку Болте (UC Santa Cruz) за основное содержание этого слайда.
2.1 Электроны, протоны, нейтроны и атомы – физическая геология
Глава 2 Минералы
Вся материя, включая минеральные кристаллы, состоит из атомов, а все атомы состоят из трех основных частиц: протонов , нейтронов, и электронов . Как показано в таблице 2.1, протоны заряжены положительно, нейтроны не заряжены, а электроны заряжены отрицательно. Отрицательный заряд одного электрона уравновешивает положительный заряд одного протона. И протоны, и нейтроны имеют массу 1, а электроны почти не имеют массы.
Как показано в таблице 2.1, протоны заряжены положительно, нейтроны не заряжены, а электроны заряжены отрицательно. Отрицательный заряд одного электрона уравновешивает положительный заряд одного протона. И протоны, и нейтроны имеют массу 1, а электроны почти не имеют массы.
| Элементарная частица | Зарядка | Масса |
|---|---|---|
| Протон | +1 | 1 |
| Нейтрон | 0 | 1 |
| Электрон | −1 | ~0 |
Элемент водорода состоит из простейших атомов, каждый из которых имеет только один протон и один электрон. Протон образует ядро, а электрон вращается вокруг него. Все остальные элементы имеют в своем ядре нейтроны, а также протоны, например, гелий, изображенный на рис. 2.2. Положительно заряженные протоны имеют тенденцию отталкиваться друг от друга, а нейтроны помогают удерживать ядро вместе.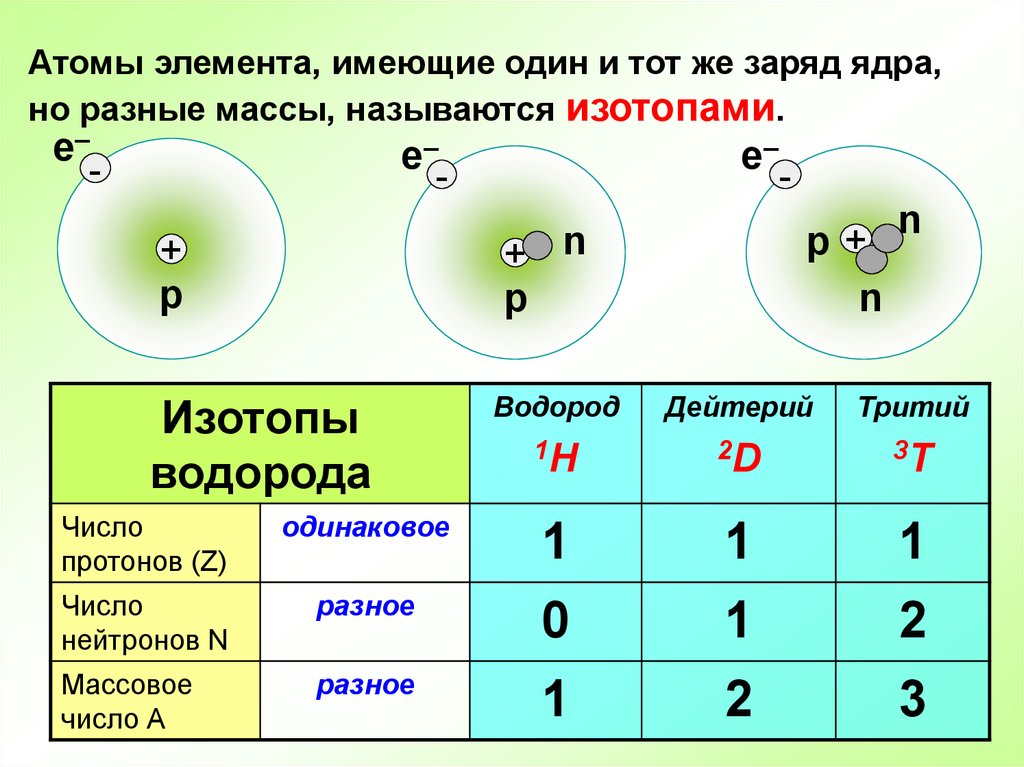 Количество протонов равно атомный номер , а количество протонов плюс нейтронов атомная масса . Для водорода атомная масса равна 1, потому что есть один протон и нет нейтронов. Для гелия это 4: два протона и два нейтрона.
Количество протонов равно атомный номер , а количество протонов плюс нейтронов атомная масса . Для водорода атомная масса равна 1, потому что есть один протон и нет нейтронов. Для гелия это 4: два протона и два нейтрона.
У большинства из 16 легчайших элементов (вплоть до кислорода) число нейтронов равно числу протонов. Для большинства остальных элементов нейтронов больше, чем протонов, потому что дополнительные нейтроны необходимы, чтобы удерживать ядро вместе, преодолевая взаимное отталкивание увеличивающегося числа протонов, сосредоточенных в очень маленьком пространстве. Например, кремний имеет 14 протонов и 14 нейтронов. Его атомный номер 14, а атомная масса 28. Наиболее распространенный изотоп урана имеет 92 протона и 146 нейтронов. Его атомный номер 92, а атомная масса 238 (92 + 146).
Рис. 2.2. Изображение атома гелия. Точка посередине — это ядро, а окружающее его облако показывает, где в любой момент могут находиться два электрона. Чем темнее оттенок, тем больше вероятность, что там будет электрон. Ангстрем (Å) равен 10 -10 м . Фемтометр (фм) равен 10 -15 м. Другими словами, электронное облако атома гелия примерно в 100 000 раз больше, чем его ядро.
Чем темнее оттенок, тем больше вероятность, что там будет электрон. Ангстрем (Å) равен 10 -10 м . Фемтометр (фм) равен 10 -15 м. Другими словами, электронное облако атома гелия примерно в 100 000 раз больше, чем его ядро.
Электроны, вращающиеся вокруг ядра атома, расположены в оболочках, также известных как «энергетические уровни». Первая оболочка может содержать только два электрона, а следующая оболочка может содержать до восьми электронов. Последующие оболочки могут содержать больше электронов, но самая внешняя оболочка любого атома содержит не более восьми электронов. Электроны на внешней оболочке играют важную роль в образовании связей между атомами. Элементы с полной внешней оболочкой являются инертными в том смысле, что они не реагируют с другими элементами с образованием соединений. Все они появляются в крайнем правом столбце периодической таблицы: гелий, неон, аргон и т. д. Для элементов, которые не имеют полной внешней оболочки, самые внешние электроны могут взаимодействовать с самыми внешними электронами соседних атомов, создавая химические связи. Конфигурации электронной оболочки для 29из первых 36 элементов перечислены в таблице 2.2.
Конфигурации электронной оболочки для 29из первых 36 элементов перечислены в таблице 2.2.
| Число электронов в каждой оболочке | ||||||
|---|---|---|---|---|---|---|
| Элемент | Символ | Атомный номер | Первый | Второй | Третий | Четвертый |
| Водород | Х | 1 | 1 | |||
| Гелий | Он | 2 | 2 | |||
| Литий | Ли | 3 | 2 | 1 | ||
| Бериллий | Быть | 4 | 2 | 2 | ||
| Бор | Б | 5 | 2 | 3 | ||
| Углерод | С | 6 | 2 | 4 | ||
| Азот | Н | 7 | 2 | 5 | ||
| Кислород | О | 8 | 2 | 6 | ||
| Фтор | Ф | 9 | 2 | 7 | ||
| Неон | Не | 10 | 2 | 8 | ||
| Натрий | Нет | 11 | 2 | 8 | 1 | |
| Магний | мг | 12 | 2 | 8 | 2 | |
| Алюминий | Ал | 13 | 2 | 8 | 3 | |
| Силикон | Си | 14 | 2 | 8 | 4 | |
| Фосфор | Р | 15 | 2 | 8 | 5 | |
| Сера | С | 16 | 2 | 8 | 6 | |
| Хлор | Кл | 17 | 2 | 8 | 7 | |
| Аргон | Ар | 18 | 2 | 8 | 8 | |
| Калий | К | 19 | 2 | 8 | 8 | 1 |
| Кальций | Са | 20 | 2 | 8 | 8 | 2 |
| Скандий | Sc | 21 | 2 | 8 | 9 | 2 |
| Титан | Ти | 22 | 2 | 8 | 10 | 2 |
| Ванадий | В | 23 | 2 | 8 | 11 | 2 |
| Хром | Кр | 24 | 2 | 8 | 13 | 1 |
| Марганец | Мн | 25 | 2 | 8 | 13 | 2 |
| Железо | Фе | 26 | 2 | 8 | 14 | 2 |
. | ||||||

 Каждый фотон несет энергию E = h × против . Мы определяем
эти энергетические уровни следующим образом, говоря, что электрон находится в возбужденное состояние, когда у него есть дополнительная энергия (подумайте о ребенке, отскакивающем от
стены с волнением).
Каждый фотон несет энергию E = h × против . Мы определяем
эти энергетические уровни следующим образом, говоря, что электрон находится в возбужденное состояние, когда у него есть дополнительная энергия (подумайте о ребенке, отскакивающем от
стены с волнением). Когда атом теряет (или приобретает) электрон, мы говорим
что это ионизированное , и тогда оно несет электрический заряд.
Когда атом теряет (или приобретает) электрон, мы говорим
что это ионизированное , и тогда оно несет электрический заряд.