| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Валентность.
 Степень окисления химических элементов
Степень окисления химических элементовВалентность химических элементов
Валентность элемента — число химических связей, которые образует один атом данного элемента в данной молекуле.
Валентные возможности атома определяются числом:
- неспаренных электронов
- неподеленных электронных пар
- вакантных валентных орбиталей
Правила определения валентности элементов в соединениях
- Валентность водорода принимают за I (единицу).
- Кислород в своих соединениях всегда проявляет валентность II.
- Высшая валентность равна номеру группы.
- Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 – № группы.
- Валентность может быть постоянной или переменной.
- Валентность простых веществ не равна нулю. Исключение VIII группа главная подгруппа (благородные газы).

Валентность элементов не имеет знака.
У металлов, находящихся в главных подгруппах, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая.
Пример
Сера (S) имеет высшую валентность VI и низшую (8 – 6), равную II.
Фосфор (P) проявляет валентности V и III.
Запомни!
В большинстве случаев валентность и степень окисления численно совпадают, хотя это разные характеристики. Но!
- СО (монооксид углерода) — валентность атома углерода равна III, а степень окисления +2
- HNO3 (азотная кислота) — валентность атома азота равна IV, а степень окисления +5
- Н2О2 (пероксид водорода) — валентность водорода равна I, валентность атома кислорода равна II, а степень окисления водорода равна +1, а степень окисления кислорода равна -1. Аналогично во всех пероксидах валентность кислорода равна II.
- N2h5 (гидразин) — валентность азота равна III, а степень окисления равна +2.

- h3 (I), N2 (III), O2 (II), F2 (I), Cl2 (I), Br2 (I), I2 (I), а степени окисления равны 0.
Степень окисления химических элементов
Степень окисления — это условный заряд атома в соединении, вычисленный в предположении, что все связи в соединении ионные (то есть все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента).
Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
Различие понятий степень окисления и валентность
Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение.
Определение степени окисления конкретного химического элемента
Степень окисления простых веществ всегда равна нулю.
Элементы с постоянной степенью окисления
Степень окисления = +№ группы
I группа главная подгруппа степень окисления +1.
II группа главная подгруппа степень окисления +2.
III группа главная подгруппа (бор, алюминий) степень окисления равна +3.
Исключения
- Водород (H) в соединениях с различными неметаллами всегда проявляет степень окисления +1, за исключением Si(+4)h5(-), B2(+3)H6(-), B(+3)h4(-), где водород принимает степень окисления -1, а в соединениях с металлами водород всегда имеет степень окисления -1: Na(+)H(-), Ca(+2)h3(-).

- Кислород в большинстве соединений имеет степень окисления -2. Однако в составе пероксидов его степень окисления равна -1 (например h3(+)O2(-), Na(2+)O(2-), Ba(+2)O2(-) и др.), а в соединениях с более электроотрицательным элементом — фтором — степень окисления кислорода положительна: O2(+)F2(-), O(+2)F2(-).
- Фтор (F) как наиболее электроотрицательный элемент во всех соединениях проявляет степень окисления -1 (хотя расположен в VII группе главной подгруппе).
- Серебро (Ag) имеет постоянную степень окисления +1 (хотя расположен в I группе
- Цинк (Zn) имеет постоянную степень окисления +2 (хотя расположен во II группе побочной подгруппе).
Элементы с переменной степенью окисления
Все остальные элементы (за исключением VIII группы главной подгруппы).
Для элементов главных подгрупп:
- Высшая степень окисления = +№ группы.
- Низшая степень окисления = +№ группы – 8.

- Промежуточная степень окисления = +№ группы – 2.
Пример
Фосфор (P)
- Высшая степень окисления = +5.
- Низшая степень окисления = -3.
- Промежуточная степень окисления = +3.
Если молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее электроотрицательный — положительную.
При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
Примеры определения степеней окисления в сложных веществах
Задание 1
Определите степени окисления всех элементов в соединение N2O5.
Решение
В молекуле N2O5 более электроотрицательным является атом кислорода, следовательно, он находится в своей низшей степени окисления -2, а атом азота имеет степень окисления +5. Полученная алгебраическая сумма степеней окисления будет равняться нулю: 2*(+5) + 5*(-2) = 0.
Полученная алгебраическая сумма степеней окисления будет равняться нулю: 2*(+5) + 5*(-2) = 0.
Задание 2
Определите степени окисления всех элементов в соединение Na2SO4.
Решение
Степень окисления натрия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Сера — это элемент VI группы главной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.
Степень окисления серы (S) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + х + 4(-2) = 0. Отсюда х = +6.
Задание 3
Определите степени окисления всех элементов в соединение K2Cr2O7.
Решение
Степень окисления калия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Хром — это элемент VI группы побочной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.Степень окисления серы (Cr) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + 2*х + 7(-2) = 0. Отсюда х = +6.
Хром — это элемент VI группы побочной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.Степень окисления серы (Cr) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + 2*х + 7(-2) = 0. Отсюда х = +6.
Полезные ссылки
Источник материала
Валентность химических элементов (видео)
Степень окисления (видео)
Валентные возможности углерода (видео)
Валентные возможности азота (видео)
Дополнительные материалы
Валентные возможности атомов химических элементов (видео)
Как определить степень окисления элемента? Степень окисления. Определение степени окисления в соединении
Во многих школьных учебниках и пособиях учат составлять формулы по валентностям, даже для соединений с ионными связями. Для упрощения процедуры составления формул это, на наш взгляд, допустимо.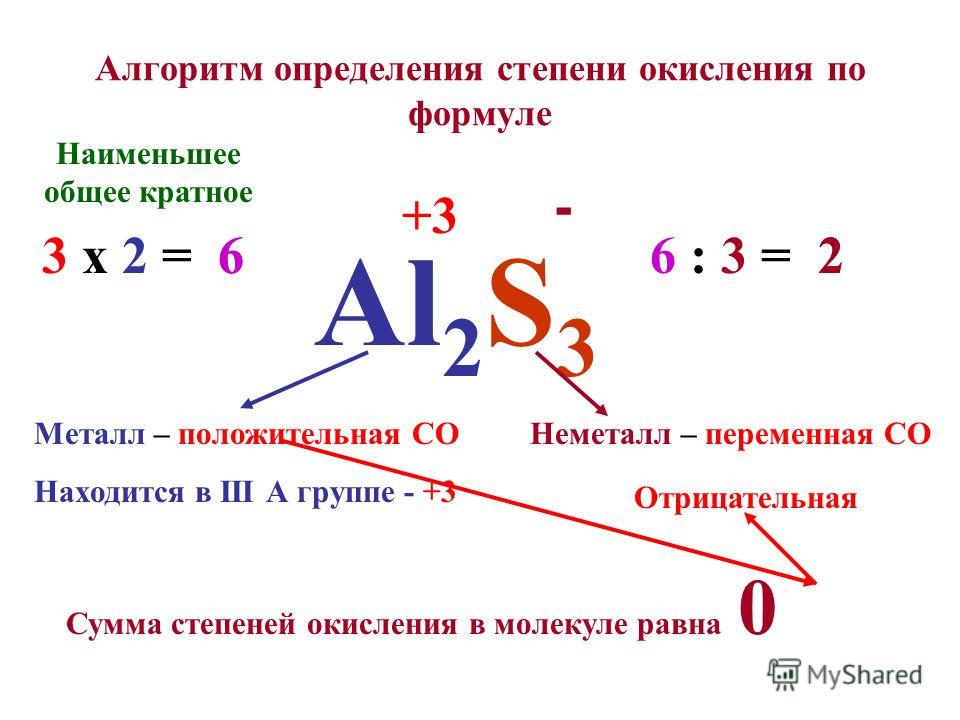 Но нужно понимать, что это не совсем корректно ввиду вышеизложенной причины.
Но нужно понимать, что это не совсем корректно ввиду вышеизложенной причины.
Более универсальным понятием является понятие о степени окисления. По значениям степеней окисления атомов так же как и по значениям валентности можно составлять химические формулы и записывать формульные единицы.
Степень окисления — это условный заряд атома в частице (молекуле, ионе, радикале), вычисленный в приближении того, что все связи в частице являются ионными.
Прежде чем определять степени окисления, необходимо сравнить электроотрицательности связуемых атомов. Атом с большим значением электроотрицательности имеет отрицательную степень окисления, а с меньшим положительную.
С целью объективного сравнения значений электроотрицательности атомов при расчёте степеней окисления, в 2013 году IUPAC дал рекомендацию использовать шкалу Аллена.
* Так, например, по шкале Аллена электроотрицательность азота 3,066, а хлора 2,869.
Проиллюстрируем данное выше определение на примерах. Составим структурную формулу молекулы воды.
Составим структурную формулу молекулы воды.
Ковалентные полярные связи O-H обозначены синим цветом.
Представим, что обе связи являются не ковалентными, а ионными. Если бы они были ионными, то с каждого атома водорода на более электроотрицательный атом кислорода перешло бы по одному электрону. Обозначим эти переходы синими стрелками.
*В этом примере, стрелка служит для наглядной иллюстрации полного перехода электронов, а не для иллюстрации индуктивного эффекта.
Легко заметить, что число стрелок показывает количество перешедших электронов, а их направление — направление перехода электронов.
На атом кислорода направлено две стрелки, это значит, что к атому кислорода переходит два электрона: 0 + (-2) = -2. На атоме кислорода образуется заряд равный -2. Это и есть степень окисления кислорода в молекуле воды.
С каждого атома водорода уходит по одному электрону: 0 — (-1) = +1. Значит, атомы водорода имеют степень окисления равную +1.
Сумма степеней окисления всегда равняется общему заряду частицы.
Например, сумма степеней окисления в молекуле воды равна: +1(2) + (-2) = 0. Молекула — электронейтральная частица.
Если мы вычисляем степени окисления в ионе, то сумма степеней окисления, соответственно, равна его заряду.
Значение степени окисления принято указывать в верхнем правом углу от символа элемента. Причём, знак пишут впереди числа . Если знак стоит после числа — то это заряд иона.
Например, S -2 — атом серы в степени окисления -2, S 2- — анион серы с зарядом -2.
S +6 O -2 4 2- — значения степеней окисления атомов в сульфат-анионе (заряд иона выделен зелёным цветом).
Теперь рассмотрим случай, когда соединение имеет смешанные связи: Na 2 SO 4 . Связь между сульфат-анионом и катионами натрия — ионная, связи между атомом серы и атомами кислорода в сульфат-ионе — ковалентные полярные. Запишем графическую формулу сульфата натрия, а стрелками укажем направление перехода электронов.
*Структурная формула отображает порядок ковалентных связей в частице (молекуле, ионе, радикале). Структурные формулы применяют только для частиц с ковалентными связями. Для частиц с ионными связями понятие структурной формулы не имеет смысла. Если в частице имеются ионные связи, то применяют графическую формулу.
Видим, что от центрального атома серы уходит шесть электронов, значит степень окисления серы 0 — (-6) = +6.
Концевые атомы кислорода принимают по два электрона, значит их степени окисления 0 + (-2) = -2
Мостиковые атомы кислорода принимают по два электрона, их степень окисления равна -2.
Определить степени окисления возможно и по структурно-графической формуле, где черточками указывают ковалентные связи, а у ионов указывают заряд.
В этой формуле мостиковые атомы кислорода уже имеют единичные отрицательные заряды и к ним дополнительно приходит по электрону от атома серы -1 + (-1) = -2, значит их степени окисления равны -2.
Степень окисления ионов натрия равна их заряду, а т. е. +1.
е. +1.
Определим степени окисления элементов в надпероксиде (супероксиде) калия. Для этого составим графическую формулу супероксида калия, стрелочкой покажем перераспределение электронов. Связь O-O является ковалентной неполярной, поэтому в ней перераспределение электронов не указывается.
* Надпероксид-анион является ион-радикалом. Формальный заряд одного атома кислорода равен -1, а другого, с неспаренным электроном, 0.
Видим, что степень окисления калия равна +1. Степень окисления атома кислорода, записанного в формуле напротив калия, равна -1. Степень окисления второго атома кислорода равна 0.
Точно также можно определить степени окисления и по структурно-графической формуле.
В кружочках указаны формальные заряды иона калия и одного из атомов кислорода. При этом значения формальных зарядов совпадают со значениями степеней окисления.
Так как оба атома кислорода в надпероксид-анионе имеют разные значения степени окисления, то можно вычислить средне-арифметическую степень окисления кислорода.
Она будет равна / 2 = — 1/2 = -0,5.
Значения среднеарифметических степеней окисления обычно указывают в брутто-формулах или формульных единицах, чтобы показать что сумма степеней окисления равна общему заряду системы.
Для случая с надпероксидом: +1 + 2(-0,5) = 0
Легко определить степени окисления используя электронно-точечные формулы, в которых указывают точками неподеленные электронные пары и электроны ковалентных связей.
Кислород — элемент VIА — группы, следовательно в его атоме 6 валентных электронов. Представим, что в молекуле воды связи ионные, в этом случае атом кислорода получил бы октет электронов.
Степень окисления кислорода соответственно равна: 6 — 8 = -2.
А атомов водорода: 1 — 0 = +1
Умение определять степени окисления по графическим формулам бесценно для понимания сущности этого понятия, так же это умение потребуется в курсе органической химии. Если же мы имеем дело с неорганическими веществами, то необходимо уметь определять степени окисления по молекулярным формулам и формульным единицам.
Для этого прежде всего нужно понять, что степени окисления бывают постоянными и переменными. Элементы, проявляющие постоянную степень окисления необходимо запомнить.
Любой химический элемент характеризуется высшей и низшей степенями окисления.
Низшая степень окисления — это заряд, который приобретает атом в результате приёма максимального количества электронов на внешний электронный слой.
Ввиду этого, низшая степень окисления имеет отрицательное значение, за исключением металлов, атомы которых электроны никогда не принимают ввиду низких значений электроотрицательности. Металлы имеют низшую степень окисления равную 0.
Большинство неметаллов главных подгрупп старается заполнить свой внешний электронный слой до восьми электронов, после этого атом приобретает устойчивую конфигурацию (правило октета ). Поэтому, чтобы определить низшую степень окисления, необходимо понять сколько атому не хватает валентных электронов до октета.
Например, азот — элемент VА группы, это значит, что в атоме азота пять валентных электронов. До октета атому азота не хватает трёх электронов. Значит низшая степень окисления азота равна: 0 + (-3) = -3
Инструкция
В результате образуется комплексное соединение – тетрахлораурат водорода. Комплексообразователем в нем является ион золота, лигандами – ионы хлора, внешней сферой – ион водорода. Как же определить степени окисления элементов в этом комплексном соединении ?
Прежде всего определите, какой из элементов, входящих в состав молекулы, самый электроотрицательный, то есть кто будет перетягивать к себе общую электронную плотность. Это, хлор, поскольку он в верхней правой части таблицы Менделеева, и по уступает только фтору и кислороду. Следовательно, его степень окисления будет со знаком «минус». А какова величина степени окисления хлора?
Хлор, как и все другие галогены, расположен в 7-й группе таблицы Менделеева, на его внешнем электронном уровне находится 7 электронов. Перетянув на этот уровень еще один электрон, он перейдет в устойчивое положение. Таким образом, его степень окисления будет равна -1. А поскольку в этом комплексном соединении четыре иона хлора, то суммарный заряд будет равняться -4.
Перетянув на этот уровень еще один электрон, он перейдет в устойчивое положение. Таким образом, его степень окисления будет равна -1. А поскольку в этом комплексном соединении четыре иона хлора, то суммарный заряд будет равняться -4.
Но сумма величин степеней окисления элементов, входящих в состав молекулы, должна быть равной нулю, ведь любая молекула электрически нейтральна. Таким образом, -4 должен быть уравновешен положительным зарядом +4, за счет водорода и золота.
Вам понадобится
- Школьный учебник по химии 8-9 класс любого автора, таблица Менделеева, таблица электроотрицательности элементов (печатаются в школьных учебниках по химии).
Инструкция
Для начала необходимо обозначить, что степень — это понятие , принимающее связи за , то есть не углубляющиеся в строение. Если элемент находится в свободном состоянии, то это самый простой случай — образуется простое вещество, а значит степень окисления его равна нулю. Так например, водород, кислород, азот, фтор и т.д.
Так например, водород, кислород, азот, фтор и т.д.
В сложных веществах все обстоит иначе: электроны между атомами распределены неравномерно, и именно степень окисления помогает определить количество отданных или принятых электронов. Степень окисления может положительной и отрицательной. При плюсе электроны отдаются, при минусе принимаются. Некоторые элементы свою степень окисления сохраняют в различных соединениях, но многие этой особенностью не отличаются. Нужно помнить немаловажное правило — сумма степеней окисления всегда равна нулю. Простейший пример, газ СО: зная, что степень окисления кислорода в преобладающем большинстве случаев равна -2 и используя вышеобозначенное правило, можно вычислить степень окисления для С. В сумме с -2 ноль дает только +2, а значит степень окисления углерода +2. Усложним задачу и возьмем для вычислений газ СО2: степень окисления кислорода по-прежнему остается -2, но молекул его в данном случае две. Следовательно, (-2) * 2 = (-4). Число, в сумме с -4 дающее ноль, +4, то есть в этом газе имеет степень окисления +4. Пример посложнее: Н2SO4 — у водорода степень окисления +1, у кислорода -2. Во взятом соединении 2 водорода и 4 кислорода, т.е. будут, соответственно, +2 и -8. Для того чтобы в сумме получить ноль, нужно добавить 6 плюсов. Значит, степень окисления серы +6.
Следовательно, (-2) * 2 = (-4). Число, в сумме с -4 дающее ноль, +4, то есть в этом газе имеет степень окисления +4. Пример посложнее: Н2SO4 — у водорода степень окисления +1, у кислорода -2. Во взятом соединении 2 водорода и 4 кислорода, т.е. будут, соответственно, +2 и -8. Для того чтобы в сумме получить ноль, нужно добавить 6 плюсов. Значит, степень окисления серы +6.
Когда в соединении сложно определить, где плюс, где минус, необходима электроотрицательности (ее несложно найти в учебнике по общей ). Металлы часто имеют положительную степень окисления , а неметаллы отрицательную. Но например, PI3 — оба элемента неметаллы. В таблице указано, что электроотрицательность йода равна 2,6, а 2,2. При сравнении выясняется, что 2,6 больше, чем 2,2, то есть электроны стягиваются в сторону йода (йод имеет отрицательную степень окисления ). Следуя приведенным несложным примерам, можно легко определить степень окисления любого элемента в соединениях.
Обратите внимание
Не нужно путать металлы и неметаллы, тогда степень окисления будет проще найти и не запутаться.
Степенью окисления называют условный заряд атома в молекуле. При этом предполагают, что все связи имеют ионный характер. Иначе говоря, окисления характеризует возможность элемента образовывать ионную связь.
Вам понадобится
- — таблица Менделеева.
Инструкция
В соединении сумма степеней атомов равна заряду этого соединения. Значит, в простом веществе, например, Na или h3, степень окисления элемента равна нулю.
Степень окисления кислорода в соединениях обычно равна -2. Например, в воде h3O два атома водорода и один атом кислорода. Действительно, -2+1+1 = 0 — в левой части выражении стоит сумма степеней окисления всех входящих в соединение атомов. В СaO кальций имеет степень окисления +2, а — -2. Исключения из этого — соединения OF2 и h3O2.
У степень окисления всегда равна -1.
Обычно максимальная положительная степень окисления элемента совпадает с номером его группы в периодической таблицы элементов Менделеева. Максимальная степень окисления равна элемента минус восемь. Пример — хлор в седьмой группе. 7-8 = -1 — степень окисления . Исключение в этом правиле составляют фтор, кислород и железо — высшая степень окисления ниже номера их группы. У элементов подгруппы меди высшая степень окисления больше 1.
Источники:
- Степень окисления элементов в 2018
Степень окисления элемента – это условный заряд атомов химического элемента в соединении, вычисленный из предположения, что соединения состоят только из ионов. Они могут иметь положительные, отрицательные, нулевые значения. У металлов степени окисления всегда положительные, у неметаллов могут быть как положительные, так и отрицательные. Это зависит от того, с каким атомом соединен атом неметалла.
Инструкция
Обратите внимание
Степень окисления может иметь дробные значения, например в магнитном железняке Fe2O3 равна +8/3.
Источники:
- «Пособие по химии», Г.П. Хомченко, 2005.
Степень окисления — часто встречающаяся в учебниках химии характеристика элементов. Существует большое количество задач, направленных на определение этой степени, и многие из них вызывают у школьников и студентов трудности. Но, следуя определенному алгоритму, эти трудности можно избежать.
Вам понадобится
- — периодическая система химических элементов (таблица Д.И. Менделеева).
Инструкция
Запомните одно общее правило: любого элемента в простом веществе равна нулю ( простых веществ: Na, Mg, Al, — т.е. вещества, состоящие из одного элемента). Для определения вещества вначале просто запишите его, не теряя индексов — цифр, стоящих в правой нижней части рядом с символом элемента. Примером будет серная — h3SO4.
Далее откройте таблицу Д.И. Менделеева и найдите степень самого левого элемента в вашем веществе — в случае данного примера. По существующему правилу его степень окисления будет всегда положительна, и записывается она со знаком «+», так как он занимает крайнее левое положение в записи формулы вещества. Чтобы определить числовое значение степени окисления, обратите внимание на расположение элемента относительно групп. Водород находится в первой группе, следовательно, его степень окисления +1, но так как в серной два атома водорода (это нам показывает индекс), то над его символом напишите +2.
Чтобы определить числовое значение степени окисления, обратите внимание на расположение элемента относительно групп. Водород находится в первой группе, следовательно, его степень окисления +1, но так как в серной два атома водорода (это нам показывает индекс), то над его символом напишите +2.
После этого определите степень окисления самого правого элемента в записи — кислорода в данном случае. Его условный (или степень окисления) будет всегда отрицателен, так как он занимает правое положение в записи вещества. Это правило справедливо во всех случаях. Числовое значение правого элемента находится в результате вычитания из номера его группы числа 8. В данном случае степень окисления кислорода равна -2 (6-8=-2), учитывая индекс — -8.
Чтобы найти условный заряд атома третьего элемента, воспользуйтесь правилом — сумма степеней окисления всех элементов должна быть равна нулю. Значит, условный заряд атома кислорода в веществе будет равен +6: (+2)+(+6)+(-8)=0. После этого запишите +6 над символом серы. 10Па) черный фосфор переходит в другое аллотропическое состояние («металлический фосфор») и начинает проводить ток. фосфора в различных веществах?
10Па) черный фосфор переходит в другое аллотропическое состояние («металлический фосфор») и начинает проводить ток. фосфора в различных веществах?
Инструкция
Вспомните, степень . Это величина, соответствующая заряду иона в молекуле, при условии, что электронные пары, осуществляющие связь, смещены в сторону более электроотрицательного элемента (расположенного в Таблице Менделеева правее и выше).
Надо также знать главное условие: сумма электрических зарядов всех ионов, входящих в состав молекулы, с учетом коэффициентов всегда должна равняться нулю.
Степень окисления далеко не всегда количественно совпадает с валентностью. Наилучший пример – углерод, который в органических всегда имеет , равную 4, а степень окисления может быть равной и -4, и 0, и +2, и +4.
Какова степень окисления в молекуле фосфина Ph4, например? С учетом всего дать на этот вопрос очень легко. Поскольку водород – самый первый элемент в Таблице Менделеева, он по определению не может располагаться там «правее и выше», чем . Следовательно, именно фосфор притянет к себе электроны водорода.
Следовательно, именно фосфор притянет к себе электроны водорода.
Каждый атом водорода, лишившись электрона, превратится в положительно заряженный ион окисления +1. Следовательно, суммарный положительный заряд равен +3. Значит, с учетом правила, гласящего, что суммарный заряд молекулы равен нулю, степень окисления фосфора в молекуле фосфина равна -3.
Ну, а какова степень окисления фосфора в оксиде P2O5? Возьмите Таблицу Менделеева. Кислород расположен в VI группе, правее фосфора, и к тому же выше, следовательно, он однозначно более электроотрицателен. То есть степень окисления кислорода в этом соединении будет со знаком «минус», а фосфора – со знаком «плюс». Каковы же эти степени, чтобы молекула в целом была нейтральна? Легко можно увидеть, что наименьшее общее кратное для чисел 2 и 5 – это 10. Следовательно, степень окисления кислорода -2, а фосфора +5.
Степень окисления – это условный заряд атома в молекуле, он получает атом в результате полного принятия электронов, его вычисляют из предположения, что все связи представляют собой ионный характер. Как определить степень окисления?
Как определить степень окисления?
Определение степени окисления
Существуют заряженные частицы ионы, положительный заряд которых равняется количеству электронов, получаемых от одного атома. Отрицательный заряд иона равняется числу электронов, принимаемых одним атомом химического элемента. К примеру, запись такого элемента как Ca2+ значит, что атомы элементов потеряли одного, двух или же трех элементов. Чтобы найти состав ионных соединений и соединений молекул нам необходимо знать, как определить степень окисления элементов. Степени окислений бывают отрицательными, положительными и нулевыми. Если учитывать числа атомов, то алгебраическая степень окисления в молекуле равна нулю.
Чтобы определить степень окисления элемента нужно руководствоваться определёнными знаниями. Например, в соединениях металлов степень окисления положительная. А высшая степень окисления соответствует номеру группы периодической системы, где и находится элемент. У металлов степени окисления могут быть положительными и отрицательными. Это будет зависеть от того фактора, каким именно атомом соединен металл. Например, если соединен с атомом металла, то тогда степень будет отрицательной, если же соединен с неметаллом, то степень будет положительная.
Это будет зависеть от того фактора, каким именно атомом соединен металл. Например, если соединен с атомом металла, то тогда степень будет отрицательной, если же соединен с неметаллом, то степень будет положительная.
Отрицательную же высшую степень окисления металла определить можно вычитанием из цифры восемь номер группы, где находится необходимый элемент. Как правило, она бывает равна числу электронов, находящихся на внешнем слое. Число этих электронов тоже соответствует номеру группы.
Как рассчитать степень окисления
В большинстве случаев степень окисления атома конкретного элемента не совпадает с числом связей, которые он образует, то есть она не равна валентности этого элемента. Наглядно это можно увидеть на примере органических соединений.
Напомню, валентность углерода в органических соединениях равняется 4 (т.е образует 4 связи), но степень окисления углерода, например, в метаноле CH 3 OH равна -2, в CO 2 +4, в Ch5 -4, в муравьиной кислоте HCOOH +2. Валентность измеряется числом ковалентных химических связей, включая те, которые возникли по донорно-акцепторному механизму.
При определении степени окисления атомов в молекулах, электроотрицательный атом, при смещении в свою сторону одной электронной пары, приобретает заряд -1, если же две электронные пары то -2 будет заряд. На степень окисления не влияет связь между одинаковыми атомами. Например:
- Связь атомов C-C равняется их нулевой степени окисления.
- Связь C-H – здесь, углероду как наиболее электроотрицательному атому будет соответствовать заряд -1.
- Связь C-O заряд углерода, как менее электроотрицательный, будет равняться +1.
Примеры определения степени окисления
- В такой молекуле как CH 3Cl три связи C-HC). Таким образом, степень окисления атома углерода в данном соединении будет равна:-3+1=-2.
- Найдем степень окисления атомов углерода в молекуле уксусного альдегида Cˉ³h4-C¹O-H. В данном соединении три связи C-H будут давать общий заряд на атоме C, который равен (Cº+3e→Cˉ³)-3. Двойная же связь C=O (здесь кислород будет забирать электроны у атома углерода, т.
 к кислород более электроотрицательный) дает заряд на атоме C, он равен +2 (Cº-2e→C²), связь же C-H заряд -1, значит общий заряд на атоме C равняется: (2-1=1)+1.
к кислород более электроотрицательный) дает заряд на атоме C, он равен +2 (Cº-2e→C²), связь же C-H заряд -1, значит общий заряд на атоме C равняется: (2-1=1)+1. - Теперь найдем степень окисления в молекуле этанола: Cˉ³H-Cˉ¹h3-OH. Здесь три связи C-H дадут общий заряд на атоме C, он равен (Cº+3e→Cˉ³)-3. Две связи C-H дадут заряд на атоме C, который будет равен -2, связь же C→O даст заряд +1, значит общий заряд на атоме C: (-2+1=-1)-1.
Теперь Вы знаете, как определить степень окисления элемента. Если Вы имеете хотя бы базовые знания по химии, то для Вас данная задача будет не проблемой.
Задача по определению степени окисления может оказаться как простой формальностью, так и сложной головоломкой. В первую очередь, это будет зависеть от формулы химического соединения, а также наличия элементарных знаний по химии и математике.
Зная основные правила и алгоритм последовательно-логичных действий, о которых пойдет речь в данной статье, при решении задач подобного типа, каждый с легкостью сможет справиться с этим заданием. А потренировавшись и научившись определять степени окисления разноплановых химических соединений, можно смело браться за уравнивание сложных окислительно-восстановительных реакций методом составления электронного баланса.
А потренировавшись и научившись определять степени окисления разноплановых химических соединений, можно смело браться за уравнивание сложных окислительно-восстановительных реакций методом составления электронного баланса.
Понятие степени окисления
Чтобы научиться определять степень окисления, для начала необходимо разобраться, что это понятие означает?
- Степень окисления применяют при записи в окислительно-восстановительных реакциях, когда происходит передача электронов от атома к атому.
- Степень окисления фиксирует количество перенесенных электронов, обозначая условный заряд атома.
- Степень окисления и валентность зачастую тождественны.
Данное обозначение пишется сверху химического элемента, в его правом углу, и представляет собой целое число со знаком «+» или «-». Нулевое значение степени окисления знака не несет.
Правила определения степени окисления
Рассмотрим основные каноны определения степени окисления:
- Простые элементарные вещества, то есть те, которые состоят из одного вида атомов, всегда будут иметь нулевую степень окисления.
 Например, Na0, H02, P04
Например, Na0, H02, P04 - Существует ряд атомов, имеющих всегда одну, постоянную, степень окисления. Приведенные в таблице значения лучше запомнить.
- Как видно, исключение бывает лишь у водорода в соединении с металлами, где он приобретает не свойственную ему степень окисления «-1».
- Кислород также принимает степень окисления «+2» в химическом соединении с фтором и «-1» в составах перекисей, надперекисей или озонидов, где атомы кислорода соединены друг с другом.
- Ионы металлов имеют несколько значений степени окисления (причем только положительные), поэтому ее определяют по соседним элементам в соединении. Например, в FeCl3, хлор имеет степень окисления «-1», у него 3 атома, значит умножаем -1 на 3, получаем «-3». Чтобы в сумме степеней окисления соединения получась «0», железо должно иметь степень окисления «+3». В формуле FeCl2, железо, соответственно, изменит свою степень на «+2».
- Математически суммируя степени окисления всех атомов в формуле (с учетом знаков), всегда должно получаться нулевое значение.
 Например, в соляной кислоте H+1Cl-1 (+1 и -1 = 0), а в сернистой кислоте h3+1S+4O3-2(+1 * 2 = +2 у водорода,+4 у серы и -2 * 3 = – 6 у кислорода; в сумме +6 и -6 дают 0).
Например, в соляной кислоте H+1Cl-1 (+1 и -1 = 0), а в сернистой кислоте h3+1S+4O3-2(+1 * 2 = +2 у водорода,+4 у серы и -2 * 3 = – 6 у кислорода; в сумме +6 и -6 дают 0). - Степень окисления одноатомного иона будет равна его заряду. Например: Na+, Ca+2.
- Наивысшая степень окисления, как правило, соотносится с номером группы в периодической системе Д.И.Менделеева.
Алгоритм действий определения степени окисления
Порядок нахождения степени окисления не сложен, но требует внимания и выполнения определенных действий.
Задача: расставить степени окисления в соединении KMnO4
- Первый элемент – калий, имеет постоянную степень окисления «+1».
Для проверки можно посмотреть в периодическую систему, где калий находится в 1 группе элементов. - Из оставшихся двух элементов, кислород, как правило, принимает степень окисления «-2».
- Получаем следующую формулу: К+1MnхO4-2. Остается определить степень окисления марганца.
Итак, х – неизвестная нам степень окисления марганца. Теперь важно обратить внимание на количество атомов в соединении.
Теперь важно обратить внимание на количество атомов в соединении.
Количество атомов калия – 1, марганца – 1, кислорода – 4.
С учетом электронейтральности молекулы, когда общий (суммарный) заряд равен нулю,
1*(+1) + 1*(х) + 4(-2) = 0,
+1+1х+(-8) = 0,
-7+1х = 0,
(при переносе меняем знак)
1х = +7, х = +7
Таким образом, степень окисления марганца в соединении равна «+7».
Задача: расставить степени окисления в соединении Fe2O3.
- Кислород, как известно, имеет степень окисления «-2» и выступает окислителем. С учетом количества атомов (3), в сумме у кислорода получается значение «-6» (-2*3= -6), т.е. умножаем степень окисления на количество атомов.
- Чтобы уравновесить формулу и привести к нулю, 2 атома железа будут иметь степень окисления «+3» (2*+3=+6).
- В сумме получаем ноль (-6 и +6 = 0).
Задача: расставить степени окисления в соединении Al(NO3)3.
- Атом алюминия – один и имеет постоянную степень окисления «+3».

- Атомов кислорода в молекуле – 9 (3*3), степень окисления кислорода, как известно «-2», значит, умножая эти значения, получаем «-18».
- Осталось уровнять отрицательные и положительные значения, определив таким образом степень окисления азота. -18 и +3, не хватает + 15. А учитывая, что имеется 3 атома азота, легко определить его степень окисления: 15 делим на 3 и получаем 5.
- Степень окисления азота «+5», а формула будет иметь вид: Al+3(N+5O-23)3
- Если сложно таким способом определять искомое значение, можно составлять и решать уравнения:
1*(+3) + 3х + 9*(-2) = 0.
+3+3х-18=0
3х=15
х=5
Итак, степень окисления – достаточно важное понятие в химии, символизирующее состояние атомов в молекуле.
Без знания определенных положений или основ, позволяющих правильно определять степень окисления, невозможно справиться с выполнением этой задачи. Следовательно, вывод один: досконально ознакомиться и изучить правила нахождения степени окисления, четко и лаконично представленные в статье, и смело двигаться дальше по нелегкой стезе химических премудростей.
Степень окисления. Определение степени окисления атома элемента по химической формуле соединения. Составление формулы соединения по известным степеням окисления атомов элементов
Степень окисления элемента — это условный заряд атома в веществе, исчисленный с предположением, что она состоит из ионов. Для определения степени окисления элементов необходимо запомнить определенные правила:
1. Степень окисления может быть положительным, отрицательным или равным нулю. Он обозначается арабской цифрой со знаком «плюс» или «минус» над символом элемента.
2. При определении степеней окисления исходят из электроотрицательности вещества: сумма степеней окисления всех атомов в соединении равна нулю.
3. Если соединение образована атомами одного элемента (в простой веществе), то степень окисления этих атомов равен нулю.
4. Атомам некоторых химических элементов обычно приписывают стали степени окисления. Например, степень окисления фтора в соединениях всегда равна -1; лития, натрия, калия, рубидия и цезия +1; магния, кальция, стронция, бария и цинка +2, алюминия +3.
5. Степень окисления водорода в большинстве соединений +1, и только в соединениях с некоторыми металлами он равен -1 (KH, Bah3).
6. Степень окисления кислорода в большинстве соединений -2, и лишь в некоторых соединениях ему приписывают степень окисления -1 (h3O2, Na2O2 или +2 (OF2).
7. Атомы многих химических элементов оказывают переменные степени окисления.
8. Степень окисления атома металла в соединениях положительный и численно равна его валентности.
9. Максимальный положительный степень окисления элемента, как правило, равна номеру группы в периодической системе, в которой находится элемент.
10. Минимальная степень окисления для металлов равна нулю. Для неметаллов в большинстве случаев ниже отрицательный степень окисления равна разнице между номером группы и цифрой восемь.
11. Степень окисления атома образует простой ион (состоит из одного атома), равна заряду этого иона.
Пользуясь приведенным правилам, определим степени окисления химических элементов в составе h3SO4. Это сложное вещество, состоящее из трех химических элементов — водорода Н, серы S и кислорода О. Отметим степени окисления тех элементов, для которых они являются постоянными. В нашем случае это водород Н и кислород О.
Это сложное вещество, состоящее из трех химических элементов — водорода Н, серы S и кислорода О. Отметим степени окисления тех элементов, для которых они являются постоянными. В нашем случае это водород Н и кислород О.
Определим неизвестный степень окисления серы. Пусть степень окисления серы в этой соединении равно х.
Составим уравнения, умножив для каждого элемента его индекс в степень окисления и добытую сумму приравняем к нулю: 2 · (+1) + x + 4 · (-2) = 0
2 + X — 8 = 0
x = +8 — 2 = +6
Следовательно, степень окисления серы равна плюс шесть.
В следующем примере выясним, как можно составить формулу соединения с известными степенями окисления атомов элементов. Составим формулу феррум (III) оксида. Слово «оксид» означает, что справа от символа железа надо записать символ кислорода: FeO.
Отметим степени окисления химических элементов над их символами. Степень окисления железа указана в названии в скобках (III), следовательно, равна +3, степень окисления кислорода в оксидах -2.
Найдем наименьшее общее кратное для чисел 3 и 2, это 6. Разделим число 6 на 3, получим число 2 — это индекс для железа. Разделим число 6 на 2, получим число 3 — это индекс для кислорода.
В следующем примере выясним, как можно составить формулу соединения с известными степенями окисления атомов элементов и зарядами ионов. Составим формулу кальций ортофосфата. Слово «ортофосфат» означает, что справа от символа Кальция надо записать кислотный остаток ортофосфатнои кислоты: CaPO4.
Отметим степень окисления кальция (правило номер четыре) и заряд кислотного остатка (по таблице растворимости).
Найдем наименьшее общее кратное для чисел 2 и 3, это 6. Разделим число 6 на 2, получим число 3 — это индекс для кальция. Разделим число 6 на 3, получим число 2 — это индекс для кислотного остатка.
Степень окисления. Определение степени окисления в соединении
Цель: Продолжить изучение валентности. Дать понятие степени окисления. Рассмотреть виды степеней окисления: положительная, отрицательная, нулевой значение. Научиться правильно, определять степени окисления атома в соединении. Научить приемам сравнения и обобщения изучаемых понятий; отработать умения и навыки в определении степени окисления по химическим формулам; продолжить развитие навыков самостоятельной работы; способствовать развитию логического мышления. Формировать чувство толерантности (терпимости и уважения к чужому мнению) взаимопомощи; осуществлять эстетическое воспитание (через оформление доски и тетрадей, при применении презентаций).
Научиться правильно, определять степени окисления атома в соединении. Научить приемам сравнения и обобщения изучаемых понятий; отработать умения и навыки в определении степени окисления по химическим формулам; продолжить развитие навыков самостоятельной работы; способствовать развитию логического мышления. Формировать чувство толерантности (терпимости и уважения к чужому мнению) взаимопомощи; осуществлять эстетическое воспитание (через оформление доски и тетрадей, при применении презентаций).
Презентация
Ход урока
I. Организационный момент
Проверка учащихся к уроку.
II. Подготовка к уроку.
К уроку понадобятся: Периодическая система Д.И.Менделеева, учебник, рабочие тетради, ручки, карандаши.
III. Проверка домашнего задания.
Фронтальный опрос, некоторые будут работать у доски по карточкам, проведение теста, и подведением данного этапа будет интеллектуальная игра.
1. Работа с карточками.
1 карточка
Определить массовые доли (%) углерода и кислорода в углекислом газе (СО2).
2 карточка
Определить тип связи в молекуле Н2S. Написать структурную и электронную формулы молекулы.
2. Фронтальный опрос
- Что называется химической связью?
- Какие виды химических связей вы знаете?
- Какая связь называется ковалентной связью?
- Какие ковалентные связи выделяют ?
- Что такое валентность?
- Как мы определяем валентность?
- Какие элементы (металлы и неметаллы) имеют изменчивую валентность?
3. Тестирование
1. В каких молекулах существует неполярная ковалентная связь?
А) J2
Б)СО2
В) О2
Г) Н2О
Д) К2О
2. У какой молекулы при образовании ковалентно-неполярной связи образуется тройная связь?
У какой молекулы при образовании ковалентно-неполярной связи образуется тройная связь?
А) СI2
Б) N2
В) О2
Г) S
3. Как называется положительно заряженные ионы?
А) катионы
Б) молекулы
В) анионы
Г) кристаллы
4. В каком ряду располагаются вещества ионного соединения?
А) СН4, NН3, Мg
Б) СI2, МgО, NаСI
В) МgF2, NаСI, СаСI2
Г) Н2S, НСI, Н2О
5. Валентность определяются по:
А) по номеру группы
Б) по числу неспаренных электронов
В) по типу химической связи
Г) по номеру периода.
4. Интеллектуальная игра «Крестики-нолики»
Найдите вещества с ковалентно-полярной связь.
КСI |
О2 |
К2О |
Н2 |
КF |
Н2S |
NаCI |
CI2 |
SO3 |
Определите атомы химических элементов, которые имеют переменчивую валентность.
Сu |
Fe |
CI2 |
Н2 |
Al |
S |
K |
Na |
Cr |
IV. Изучение нового материала
Изучение нового материала
Степень окисления является важной характеристикой состояния атома в молекуле. Валентность, определяется по числу неспаренных электронов в атоме, орбиталями с неподеленными электронными парами, только в процессе возбуждения атома. Высшая валентность элемента, как правило, равна номеру группы. Степень окисления в соединениях с разными химическими связями образуется неодинаково.
Как образуется степень окисления у молекул с разными химическими связями?
1) В соединениях с ионной связью степени окисления элементов равно зарядам ионов.
Например: приложение 1.
2) В соединениях с ковалентной неполярной связью (в молекулах простых веществ) степень окисления элементов равно 0.
Н20, СI20, F20, S0, AI0
3) У молекул с ковалентно-полярной связью степень окисления определяется подобно молекулам с ионной химической связью.
Степень окисления элемента – это условный заряд его атома, в молекуле, если считать, что молекула состоит из ионов.
Степень окисления атома в отличие от валентности имеет знак. Она может быть положительной, отрицательной и нулевой.
Валентность обозначатся римскими цифрами сверху символа элемента:
II |
I |
IV |
Fe |
Cu |
S, |
а степень окисления обозначается арабскими цифрами с зарядом над символам элемента (Мg+2, Са+2, Nа+1, CIˉ¹).
Положительная степень окисления – равна числу электронов, отданных данным атомам. Атом может отдать все валентные электроны (для главных групп это электроны внешнего уровня) соответствующее номеру группы, в котором находится элемент, проявляя при этом высшую степень окисления (исключение ОF2).Например: высшая степень окисления главной подгруппы II группы равна +2 ( Zn+2)Положительную степень проявляют как металлы и неметаллы, кроме F, He, Ne.Например: С+4 ,Na+1 , Al+3
Отрицательная степень окисления равна числу электронов, принятых данным атомом, ее проявляют только неметаллы. Атомы неметаллов присоединяют столько электронов, сколько их не хватает до завершения внешнего уровня, проявляя при этом отрицательную степень.
У элементов главных подгрупп IV-VII групп минимальная степень окисления численно равна
| Номер группы -8 = «минимальная отрицательная степень окисления» |
Например:
Значение степени окисления между высшим и низшим степенями окислений называется промежуточными:
Высшая |
Промежуточные |
Низшая |
C+4 |
С+3, С+2,С0 ,С-2 |
С-4 |
N+5 |
N+3, N0, |
N-3 |
В соединениях с ковалентной неполярной связью (в молекулах простых веществ) степень окисления элементов равно 0: Н20, СI20, F20, S0, AI0
Для определения степени окисления атома в соединении следует учитывать ряд положений:
1.
Степень окисления F во всех соединениях равна « -1». Na+1 F-1, H+1 F-1
2. Степень окисления кислорода в большинстве соединений равна (-2) исключение: ОF2, где степень окисления О+2F-1
3. Водород в большинстве соединений имеет степень окисления +1, кроме соединения с активными металлами, где степень окисления (-1) :Na+1H-1
4.Степень окисления металлов главных подгрупп I, II, III групп во всех соединениях равна +1,+2,+3.

Элементы с постоянной степенью окисления это:
А) щелочные металлы (Li, Na, K, Pb, Si, Fr) — степень окисления +1
Б) элементы II главной подгруппы группы кроме (Hg): Be, Mg, Ca, Sr, Ra, Zn, Cd — степень окисления +2
В) элемент III группы: Al — степень окисления +3
Г) F (-1)
Алгоритм составления формулы в соединениях:
1 способ
1. На первом месте пишется элемент с меньшей электроотрицательностью, на втором с большей электроотрицательностью.
2. Элемент, написанный на первом месте имеет положительный заряд «+», а на втором с отрицательным зарядом «-».
3. Указать для каждого элемента степень окисления.
4. Найти общее кратное значение степеней окисления.
5. Разделить наименьшее общее кратное на значение степеней окисления и полученные индексы приписать внизу справа после символа соответствующего элемента.
6. Если степень окисления четное – нечетное, то они становятся рядом с символом справа внизу крест – накрест без знака «+» и «-»:
7. Если степень окисления имеет четное значение, то их сначала нужно сократить на наименьшее значение степени окисления и поставить крест – накрест без знака «+» и «-»: С+4 О-2
2 способ
1. Обозначим степень окисления N через Х, указать степень окисления О: N2x O3-2
2. Определить сумму отрицательных зарядов, для этого степень окисления кислорода умножаем на индекс кислорода: 3· (-2)= -6
3.Чтобы молекула была электронейтральной нужно определить сумму положительных зарядов: Х2 = 2Х
4. Составить алгебраическое уравнение:
Составить алгебраическое уравнение:
2Х+ (-6)=0
2Х =6
Х=6:2
Х=3
N2+ 3O3–2
V. Закрепление
1) Проведение закрепления темы игрой, которое называется «Змейка».
Правила игры: учитель раздает карточки. На каждой карточке написан один вопрос и один ответ на другой вопрос.
Учитель начинает игру. Зачитает вопрос, ученик, у которого на карточке есть, ответ на мой вопрос поднимает руку и говорит ответ. Если ответ правильный, то он читает свой вопрос и у того ученика у которого есть ответ на этот вопрос поднимает руку и отвечает и т.д. Образуется змейка правильных ответов.
Вопросы:
- Как и где обозначается степень окисления у атома химического элемента?
Ответ: арабской цифрой над символом элемента с зарядом «+» и «-».
- Какие виды степеней окисления выделяют у атомов химических элементов?
Ответ: промежуточная - Какую степень проявляет металлы?
Ответ: положительная, отрицательная, нулевая. - Какую степень проявляют простые вещества или молекулы с неполярной ковалентной связью.
Ответ: положительная - Какой заряд имеют катионы и анионы?
Ответ: нулевое. - Как называется степень окисления, которая стоит между положительным и отрицательным степенями окисления.
Ответ: положительный, отрицательный
2) Написать формулы веществ состоящих из следующих элементов
- N и H
- Р и О
- Zn и Cl
3) Найти и зачеркнуть вещества, не имеющие переменчивую степень окисления.
Na, Cr, Fe, K, N, Hg, S, Al, C
VI. Итог урока.
Итог урока.
Выставление оценок с комментариями
VII. Домашнее задание
§23, стр.67-72, задание после §23-стр 72 №1-4 выполнить.
| Ответ | Будем поочередно определять степень окисления серы в каждой из предложенных схем превращений, а затем выберем верный вариант ответа.
Изменение степени окисления серы: -2 → 0, т.е. шестой вариант ответа.
Изменение степени окисления серы: 0 → +6, т.е. четвертый вариант ответа.
1×2 +x+ 3×(-2) =0; Изменение степени окисления серы: +4 → 0, т.е. третий вариант ответа. |
| Задание | Валентность III и степень окисления (-3) азот проявляет в соединении: а) N 2 H 4 ; б) NH 3 ; в) NH 4 Cl; г) N 2 O 5 |
| Решение | Для того, чтобы дать верный ответ на поставленный вопрос будем поочередно определять валентность и степень окисления азота в предложенных соединениях. а) валентность водорода всегда равна I. Общее число единиц валентности водорода равно 4-м (1×4 = 4). Разделим полученное значение на число атомов азота в молекуле: 4/2 = 2, следовательно, валентность азота равна II. Этот вариант ответа неверный. б) валентность водорода всегда равна I. Общее число единиц валентности водорода равно 3-м (1×3 = 3). Разделим полученное значение на число атомов азота в молекуле: 3/1 = 2, следовательно, валентность азота равна III. Степень окисления азота в аммиаке равна (-3): Это верный ответ. |
| Ответ | Вариант (б) |
В химии термины «окисление» и «восстановление» означает реакции, при которых атом или группа атомов теряют или, соответственно, приобретают электроны. Степень окисления — это приписываемая одному либо нескольким атомам численная величина, характеризующая количество перераспределяемых электронов и показывающая, каким образом эти электроны распределяются между атомами при реакции. Определение этой величины может быть как простой, так и довольно сложной процедурой, в зависимости от атомов и состоящих из них молекул. Более того, атомы некоторых элементов могут обладать несколькими степенями окисления. К счастью, для определения степени окисления существуют несложные однозначные правила, для уверенного пользования которыми достаточно знания основ химии и алгебры.
Более того, атомы некоторых элементов могут обладать несколькими степенями окисления. К счастью, для определения степени окисления существуют несложные однозначные правила, для уверенного пользования которыми достаточно знания основ химии и алгебры.
Шаги
Часть 1
Определение степени окисления по законам химии
Определите, является ли рассматриваемое вещество элементарным. Степень окисления атомов вне химического соединения равна нулю. Это правило справедливо как для веществ, образованных из отдельных свободных атомов, так и для таких, которые состоят из двух, либо многоатомных молекул одного элемента.
- Например, Al (s) и Cl 2 имеют степень окисления 0, поскольку оба находятся в химически несвязанном элементарном состоянии.
- Обратите внимание, что аллотропная форма серы S 8 , или октасера, несмотря на свое нетипичное строение, также характеризуется нулевой степенью окисления.
Определите, состоит ли рассматриваемое вещество из ионов.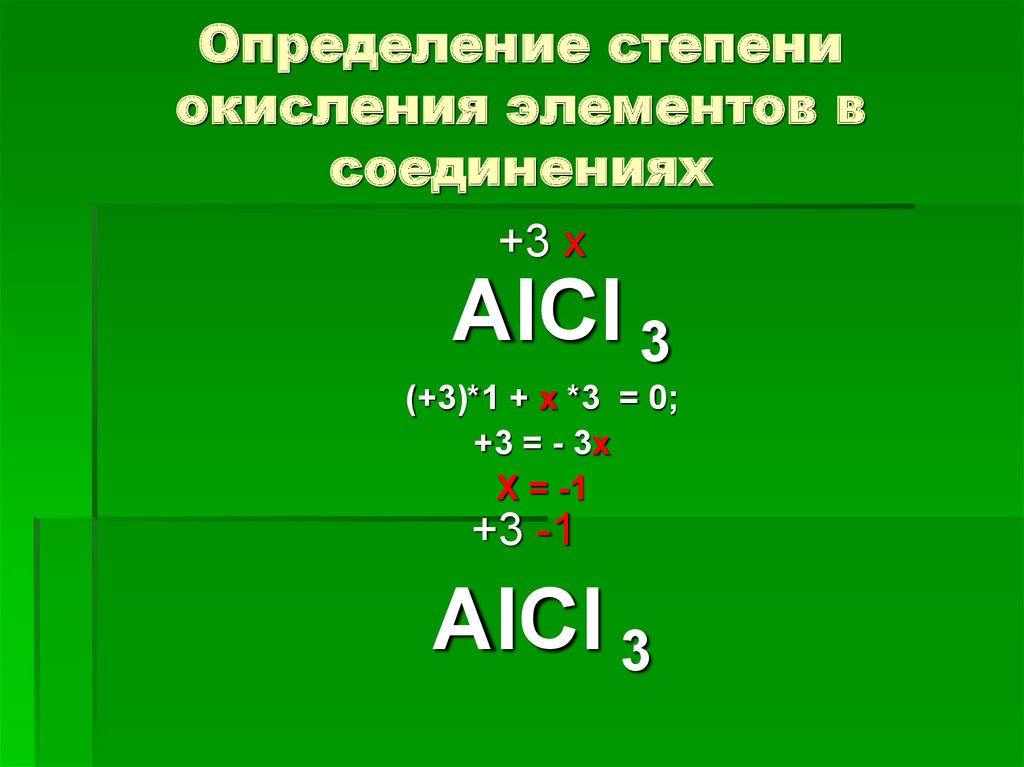 Степень окисления ионов равняется их заряду. Это справедливо как для свободных ионов, так и для тех, которые входят в состав химических соединений.
Степень окисления ионов равняется их заряду. Это справедливо как для свободных ионов, так и для тех, которые входят в состав химических соединений.
- Например, степень окисления иона Cl — равняется -1.
- Степень окисления иона Cl в составе химического соединения NaCl также равна -1. Поскольку ион Na, по определению, имеет заряд +1, мы заключаем, что заряд иона Cl -1, и таким образом степень его окисления равна -1.
Учтите, что ионы металлов могут иметь несколько степеней окисления. Атомы многих металлических элементов могут ионизироваться на разные величины. Например, заряд ионов такого металла как железо (Fe) равняется +2, либо +3. Заряд ионов металла (и их степень окисления) можно определить по зарядам ионов других элементов, с которыми данный металл входит в состав химического соединения; в тексте этот заряд обозначается римскими цифрами: так, железо (III) имеет степень окисления +3.
- В качестве примера рассмотрим соединение, содержащее ион алюминия.
 Общий заряд соединения AlCl 3 равен нулю. Поскольку нам известно, что ионы Cl — имеют заряд -1, и в соединении содержится 3 таких иона, для общей нейтральности рассматриваемого вещества ион Al должен иметь заряд +3. Таким образом, в данном случае степень окисления алюминия равна +3.
Общий заряд соединения AlCl 3 равен нулю. Поскольку нам известно, что ионы Cl — имеют заряд -1, и в соединении содержится 3 таких иона, для общей нейтральности рассматриваемого вещества ион Al должен иметь заряд +3. Таким образом, в данном случае степень окисления алюминия равна +3.
Степень окисления кислорода равна -2 (за некоторыми исключениями). Почти во всех случаях атомы кислорода имеют степень окисления -2. Есть несколько исключений из этого правила:
- Если кислород находится в элементарном состоянии (O 2), его степень окисления равна 0, как и в случае других элементарных веществ.
- Если кислород входит в состав перекиси , его степень окисления равна -1. Перекиси — это группа соединений, содержащих простую кислород-кислородную связь (то есть анион перекиси O 2 -2). К примеру, в составе молекулы H 2 O 2 (перекись водорода) кислород имеет заряд и степень окисления -1.
- В соединении с фтором кислород обладает степенью окисления +2, читайте правило для фтора ниже.

Водород характеризуется степенью окисления +1, за некоторыми исключениями. Как и для кислорода, здесь также существуют исключения. Как правило, степень окисления водорода равна +1 (если он не находится в элементарном состоянии H 2). Однако в соединениях, называемых гидридами, степень окисления водорода составляет -1.
- Например, в H 2 O степень окисления водорода равна +1, поскольку атом кислорода имеет заряд -2, и для общей нейтральности необходимы два заряда +1. Тем не менее, в составе гидрида натрия степень окисления водорода уже -1, так как ион Na несет заряд +1, и для общей электронейтральности заряд атома водорода (а тем самым и его степень окисления) должен равняться -1.
Фтор всегда имеет степень окисления -1. Как уже было отмечено, степень окисления некоторых элементов (ионы металлов, атомы кислорода в перекисях и так далее) может меняться в зависимости от ряда факторов. Степень окисления фтора, однако, неизменно составляет -1. Это объясняется тем, что данный элемент имеет наибольшую электроотрицательность — иначе говоря, атомы фтора наименее охотно расстаются с собственными электронами и наиболее активно притягивают чужие электроны. Таким образом, их заряд остается неизменным.
Это объясняется тем, что данный элемент имеет наибольшую электроотрицательность — иначе говоря, атомы фтора наименее охотно расстаются с собственными электронами и наиболее активно притягивают чужие электроны. Таким образом, их заряд остается неизменным.
Сумма степеней окисления в соединении равна его заряду. Степени окисления всех атомов, входящих в химическое соединение, в сумме должны давать заряд этого соединения. Например, если соединение нейтрально, сумма степеней окисления всех его атомов должна равняться нулю; если соединение является многоатомным ионом с зарядом -1, сумма степеней окисления равна -1, и так далее.
- Это хороший метод проверки — если сумма степеней окисления не равна общему заряду соединения, значит вы где-то ошиблись.
Часть 2
Определение степени окисления без использования законов химииНайдите атомы, не имеющие строгих правил относительно степени окисления. По отношению к некоторым элементам нет твердо установленных правил нахождения степени окисления.
 Если атом не подпадает ни под одно правило из перечисленных выше, и вы не знаете его заряда (например, атом входит в состав комплекса, и его заряд не указан), вы можете установить степень окисления такого атома методом исключения. Вначале определите заряд всех остальных атомов соединения, а затем из известного общего заряда соединения вычислите степень окисления данного атома.
Если атом не подпадает ни под одно правило из перечисленных выше, и вы не знаете его заряда (например, атом входит в состав комплекса, и его заряд не указан), вы можете установить степень окисления такого атома методом исключения. Вначале определите заряд всех остальных атомов соединения, а затем из известного общего заряда соединения вычислите степень окисления данного атома.- Например, в соединении Na 2 SO 4 неизвестен заряд атома серы (S) — мы лишь знаем, что он не нулевой, поскольку сера находится не в элементарном состоянии. Это соединение служит хорошим примером для иллюстрации алгебраического метода определения степени окисления.
Найдите степени окисления остальных элементов, входящих в соединение. С помощью описанных выше правил определите степени окисления остальных атомов соединения. Не забывайте об исключениях из правил в случае атомов O, H и так далее.
- Для Na 2 SO 4 , пользуясь нашими правилами, мы находим, что заряд (а значит и степень окисления) иона Na равен +1, а для каждого из атомов кислорода он составляет -2.

- Для Na 2 SO 4 , пользуясь нашими правилами, мы находим, что заряд (а значит и степень окисления) иона Na равен +1, а для каждого из атомов кислорода он составляет -2.
Найдите неизвестную степень окисления из заряда соединения. Теперь у вас есть все данные для простого расчета искомой степени окисления. Запишите уравнение, в левой части которого будет сумма числа, полученного на предыдущем шаге вычислений, и неизвестной степени окисления, а в правой — общий заряд соединения. Иными словами, (Сумма известных степеней окисления) + (искомая степень окисления) = (заряд соединения).
- В нашем случае Na 2 SO 4 решение выглядит следующим образом:
- (Сумма известных степеней окисления) + (искомая степень окисления) = (заряд соединения)
- -6 + S = 0
- S = 0 + 6
- S = 6. В Na 2 SO 4 сера имеет степень окисления 6 .
- В нашем случае Na 2 SO 4 решение выглядит следующим образом:
- В соединениях сумма всех степеней окисления должна равняться заряду. Например, если соединение представляет собой двухатомный ион, сумма степеней окисления атомов должна быть равна общему ионному заряду.
- Очень полезно уметь пользоваться периодической таблицей Менделеева и знать, где в ней располагаются металлические и неметаллические элементы.

- Степень окисления атомов в элементарном виде всегда равна нулю. Степень окисления единичного иона равна его заряду. Элементы группы 1A таблицы Менделеева, такие как водород, литий, натрий, в элементарном виде имеют степень окисления +1; степень окисления металлов группы 2A, таких как магний и кальций, в элементарном виде равна +2. Кислород и водород, в зависимости от вида химической связи, могут иметь 2 различных значения степени окисления.
Часть I
1. Степень окисления (с. о.) — это условный заряд атомов химического элемента в сложном веществе, вычисленный на основе предположения, что оно состоит из простых ионов.
Следует знать!
1) В соединениях с. о. водорода = +1, кроме гидридов .
2) В соединениях с. о. кислорода = -2, кроме пероксидов и фторидов
3) Степень окисления металлов всегда положительна.
Для металлов главных подгрупп первых трёх групп с. о. постоянна:
металлы IA группы — с. о. = +1,
металлы IIA группы — с.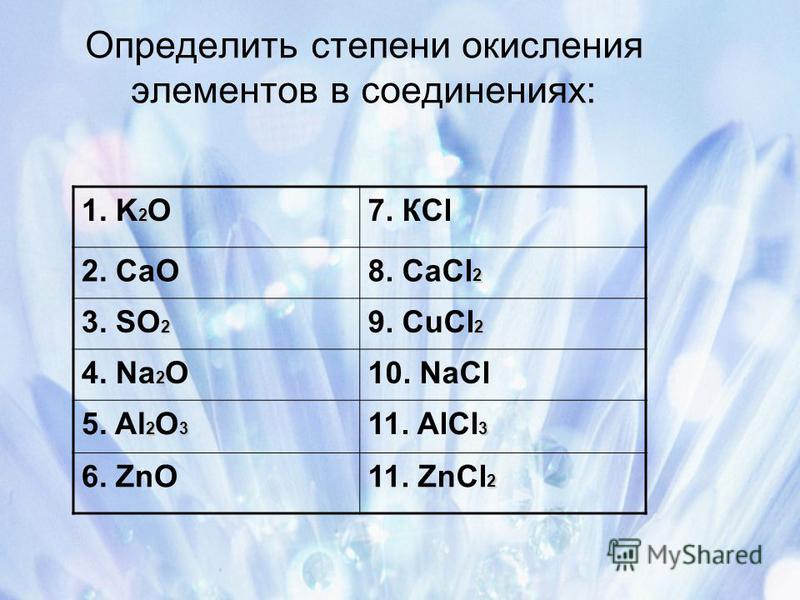 о. = +2,
о. = +2,
металлы IIIA группы — с. о. = +3.
4) У свободных атомов и простых веществ с. о. = 0.
5) Суммарная с. о. всех элементов в соединении = 0.
2. Способ образования названий двухэлементных (бинарных) соединений.
4. Дополните таблицу «Названия и формулы бинарных соединений».
5. Определите степень окисления выделенного шрифтом элемента сложного соединения.
Часть II
1. Определите степени окисления химических элементов в соединениях по их формулам. Запишите названия этих веществ.
2. Разделите вещества FeO, Fe2O3, CaCl2, AlBr3, CuO, K2O, BaCl2, SO3 на две группы. Запишите названия веществ, указав степени окисления.
3. Установите соответствие между названием и степенью окисления атома химического элемента и формулой соединения.
4. Составьте формулы веществ по названию.
5. Сколько молекул содержится в 48 г оксида серы (IV)?
Сколько молекул содержится в 48 г оксида серы (IV)?
6. С помощью Интернета и других источников информации подготовьте сообщение о применении какого-либо бинарного соединения по следующему плану:
1) формула;
2) название;
3) свойства;
4) применение.
h3O вода, оксид водорода.
Вода при обычных условиях жидкость, без цвета, запаха, в толстом слое – голубая. Температура кипения около 100⁰С. Является хорошим растворителем. Состоит молекула воды из двух атомов водорода и одного атома кислорода, это его качественный и количественный состав. Это сложное вещество, для него характерны следующие химические свойства: взаимодействие со щелочными металлами, щелочноземельными металлами. Реакции обмена с водой называются гидролизом. Эти реакции имеют большое значение в химии.
7. Степень окисления марганца в соединении К2МnO4 равна:
3) +6
8. Наименьшую степень окисления хром имеет в соединении, формула которого:
1) Сг2O3
9. Максимальную степень окисления хлор проявляет в соединении, формула которого:
Максимальную степень окисления хлор проявляет в соединении, формула которого:
3) Сl2O7
Степени окисления атомов химических элементов (таблица)
Степень окисления — это условная величина, которая указывает на состояние окисления отдельного атома молекулы химического элемента и представляет метод учёта переноса электронов, не является истинным зарядом атома в молекуле.
— Степень окисления атомов хим. элементов простых веществ равна 0.
— Степень окисления водорода H в соединениях +1, за исключением гидридов (NaH-1)
— Степень окисления кислорода O в соединениях равна -2, за исключением пероксидов и соединений с фтором F
— Сумма всех степеней окисления атомов в соединении равна 0.
— Сумма всех степеней окисления атомов в ионе равна = заряду иона.
Таблица степени окисления атомов химических элементов
|
Порядковый (атомный) номер |
Химический элемент |
Символ |
Степени окисления атомов элементов |
|
1 |
Водород / Hydrogen |
H |
+1, 0, –1 |
|
2 |
Гелий / Helium |
He |
0 |
|
3 |
Литий / Lithium |
Li |
+1 |
|
4 |
Бериллий / Beryllium |
Be |
+2 |
|
5 |
Бор / Boron |
B |
+3 |
|
6 |
Углерод / Carbon |
C |
-4, (+2), +4 |
|
7 |
Азот / Nitrogen |
N |
-3, -2, -1, 0, (+1), +2, +3, +4, +5 |
|
8 |
Кислород / Oxygen |
O |
-2 |
|
9 |
Фтор / Fluorine |
F |
-1, 0 |
|
10 |
Неон / Neon |
Ne |
0 |
|
11 |
Натрий / Sodium |
Na |
+1 |
|
12 |
Магний / Magnesium |
Mg |
+2 |
|
13 |
Алюминий / Aluminum |
Al |
+3 |
|
14 |
Кремний / Silicon |
Si |
-4, 0, (+2), +4 |
|
15 |
Фосфор / Phosphorus |
P |
-3, -1, 0, 1, 3, 5 |
|
16 |
Сера / Sulfur |
S |
-2, -1, 0, +1, +4, +6 |
|
17 |
Хлор / Chlorine |
Cl |
-1, +1, (+2), +3, (+4), +5, +7 |
|
18 |
Аргон / Argon |
Ar |
0 |
|
19 |
Калий / Potassium |
K |
+1 |
|
20 |
Кальций / Calcium |
Ca |
+2 |
|
21 |
Скандий / Scandium |
Sc |
+3 |
|
22 |
Титан / Titanium |
Ti |
+2, +3, +4 |
|
23 |
Ванадий / Vanadium |
V |
+2, +3, +4, +5 |
|
24 |
Хром / Chromium |
Cr |
0, +2, +3, +6 |
|
25 |
Марганец / Manganese |
Mn |
(+1), +2, (+3), +4, (+5), +6, +7 |
|
26 |
Железо / Iron |
Fe |
+2, +3, (+4), (+6), (+8) |
|
27 |
Кобальт / Cobalt |
Co |
(+1), +2, (+3), (+4) |
|
28 |
Никель / Nickel |
Ni |
(+1), +2, (+3), (+4) |
|
29 |
Медь / Copper |
Сu |
+1, +2, (+3) |
|
30 |
Цинк / Zinc |
Zn |
+2 |
|
31 |
Галлий / Gallium |
Ga |
(+1), +3 |
|
32 |
Германий / Germanium |
Ge |
+2 |
|
33 |
Мышьяк / Arsenic |
As |
-3, +3, +5 |
|
34 |
Селен / Selenium |
Se |
-2, +4, +6 |
|
35 |
Бром / Bromine |
Br |
-1, 0, +1, +3, +5, +7 |
|
36 |
Криптон / Krypton |
Kr |
+2, +4, +6 |
|
37 |
Рубидий / Rubidium |
Rb |
+1 |
|
38 |
Стронций / Strontium |
Sr |
+2 |
|
39 |
Иттрий / Yttrium |
Y |
+3 |
|
40 |
Цирконий / Zirconium |
Zr |
0, +1, +2, +3, +4 |
|
41 |
Ниобий / Niobium |
Nb |
+1, +2, +3, +4, +5 |
|
42 |
Молибден / Molybdenum |
Mo |
(+2), (+3), (+4), (+5), +6 |
|
43 |
Технеций / Technetium |
Tc |
-1, 0, +1, +2, +3, +4, +5, +6, +7 |
|
44 |
Рутений / Ruthenium |
Ru |
+2, +3, +4, +5, +6, +7, +8 |
|
45 |
Родий / Rhodium |
Rh |
+1, +2, +3, +4, +6 |
|
46 |
Палладий / Palladium |
Pd |
0, +1, +2, +3, +4, +5 |
|
47 |
Серебро / Silver |
Ag |
0, +1, +2, +3, +4, +5, +6 |
|
48 |
Кадмий / Cadmium |
Cd |
+2 |
|
49 |
Индий / Indium |
In |
+1, +3 |
|
50 |
Олово / Tin |
Sn |
-4, +2, +4 |
|
51 |
Сурьма / Antimony |
Sb |
-3, +3, +5 |
|
52 |
Теллур / Tellurium |
Te |
-2, (+2), +4, +6 |
|
53 |
Иод / Iodine |
I |
-1, 0, +1, (+3), +5, +7 |
|
54 |
Ксенон / Xenon |
Xe |
0, +1, +2, +4, +6, +8 |
|
55 |
Цезий / Cesium |
Cs |
+1 |
|
56 |
Барий / Barium |
Ba |
+2 |
|
57 |
Лантан / Lanthanum |
La |
+3 |
|
58 |
Церий / Cerium |
Ce |
+3, +4 |
|
59 |
Празеодим / Praseodymium |
Pr |
+3, +4 |
|
60 |
Неодим / Neodymium |
Nd |
+3 |
|
61 |
Прометий / Promethium |
Pm |
+3 |
|
62 |
Самарий / Samarium |
Sm |
+2, +3 |
|
63 |
Европий / Europium |
Eu |
+2, +3 |
|
64 |
Гадолиний / Gadolinium |
Gd |
+3 |
|
65 |
Тербий / Terbium |
Tb |
+3, +4 |
|
66 |
Диспрозий / Dysprosium |
Dy |
+3 |
|
67 |
Гольмий / Holmium |
Ho |
+3 |
|
68 |
Эрбий / Erbium |
Er |
+3 |
|
69 |
Тулий / Thulium |
Tm |
+2, +3 |
|
70 |
Иттербий / Ytterbium |
Yb |
+2, +3 |
|
71 |
Лютеций / Lutetium |
Lu |
+3 |
|
72 |
Гафний / Hafnium |
Hf |
+2, +3, +4 |
|
73 |
Тантал / Tantalum |
Ta |
(+3), (+4), +5 |
|
74 |
Вольфрам / Tungsten |
W |
0, (+2), (+3), (+4), (+5), +6 |
|
75 |
Рений / Rhenium |
Re |
(-1), +2, (+3), +4, (+5), +6, +7 |
|
76 |
Осмий / Osmium |
Os |
-2, 0, +2, +3, +4, +6, +8 |
|
77 |
Иридий / Iridium |
Ir |
(+1), (+2), +3, +4, +5, +6 |
|
78 |
Платина / Platinum |
Pt |
0, +2, +4 |
|
79 |
Золото / Gold |
Au |
-1, 0, +1, (+2), +3, +5 |
|
80 |
Ртуть / Mercury |
Hg |
+1, +2 |
|
81 |
Талий / Thallium |
Tl |
+1, +3 |
|
82 |
Свинец / Lead |
Pb |
-4, 0, +2, +4 |
|
83 |
Висмут / Bismuth |
Bi |
-3, +3, +5 |
|
84 |
Полоний / Polonium |
Po |
+2, +4, +6 |
|
85 |
Астат / Astatine |
At |
-1, 0, +1, +5, +7 |
|
86 |
Радон / Radon |
Rn |
0 |
|
87 |
Франций / Francium |
Fr |
+1 |
|
88 |
Радий / Radium |
Ra |
+2 |
|
89 |
Актиний / Actinium |
Ac |
+3 |
|
90 |
Торий / Thorium |
Th |
+2, +3, +4 |
|
91 |
Проактиний / Protactinium |
Pa |
+4, +5 |
|
92 |
Уран / Uranium |
U |
+3, +4, +5, +6 |
|
93 |
Нептуний / Neptunium |
Np |
+3, +4, +5, +6, +7 |
|
94 |
Плутоний / Plutonium |
Pu |
+2, +3, +4, +5, +6, +7 |
|
95 |
Америций / Americium |
Am |
+3, +4, +5, +6 |
|
96 |
Кюрий / Curium |
Cm |
+3, +4 |
|
97 |
Берклий / Berkelium |
Bk |
+3, +4 |
|
98 |
Калифорний / Californium |
Cf |
+2, +3, +4 |
|
99 |
Эйнштейний |
Es |
+2, +3, +4 |
|
100 |
Фермий / Fermium |
Fm |
+3 |
|
101 |
Менделевий / Mendelevium |
Md |
+1, +2, +3 |
|
102 |
Нобелий / Nobelium |
No |
+2, +3 |
|
103 |
Лоуренсий / Lawrencium |
Lr |
+3 |
|
104 |
Резерфордий / Rutherfordium |
Rf |
+4 |
|
105 |
Дубний |
Db |
+3, +4, +5 |
|
Порядковый (атомный) номер |
Химический элемент |
Символ |
Степени окисления атомов элементов |
Степени окисления переходных металлов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 650
Степень окисления элемента связана с количеством электронов, которые атом теряет, приобретает или, по-видимому, использует при соединении с другим атомом в соединениях. Он также определяет способность атома окислять (терять электроны) или восстанавливать (приобретать электроны) другие атомы или частицы. Почти все переходные металлы имеют несколько экспериментально наблюдаемых степеней окисления.
Он также определяет способность атома окислять (терять электроны) или восстанавливать (приобретать электроны) другие атомы или частицы. Почти все переходные металлы имеют несколько экспериментально наблюдаемых степеней окисления.
Введение
Для заполнения атомных орбиталей требуется определенное количество электронов. S-блок состоит из элементов I и II групп, щелочных и щелочноземельных металлов (к этому блоку относятся натрий и кальций). Группы с XIII по XVIII включают p-блок, который содержит неметаллы, галогены и инертные газы (обычными членами являются углерод, азот, кислород, фтор и хлор). Переходные металлы находятся в d-блоке между группами III и XII. Если следующая таблица покажется вам странной или ориентация неясна, просмотрите раздел, посвященный атомным орбиталям.
| с Орбитальный | p Орбиты | d Орбиты |
|---|---|---|
| 1 орбиталь, 2 электрона | 3 орбитали: p x , p y , p z ; 6 электронов | 5 орбиталей: d x 2 -y 2 , d z 2 , d xy , d |
| Орбиталь с наивысшей энергией для данного квантового числа n | Вырожденный с s-орбиталью квантового числа n+1 |
Главное, что нужно помнить об электронной конфигурации, это то, что наиболее стабильная конфигурация благородного газа идеальна для любого атома. Формирование связей — это способ приблизиться к этой конфигурации. В частности, переходные металлы образуют более мягкие связи с анионами, катионами и нейтральными комплексами по сравнению с другими элементами. Это связано с тем, что d-орбиталь довольно размыта (в большей степени f-орбиталь серий лантанидов и актинидов).
Формирование связей — это способ приблизиться к этой конфигурации. В частности, переходные металлы образуют более мягкие связи с анионами, катионами и нейтральными комплексами по сравнению с другими элементами. Это связано с тем, что d-орбиталь довольно размыта (в большей степени f-орбиталь серий лантанидов и актинидов).
Электронные конфигурации нейтрального атома
Счет в периодической таблице — это простой способ определить, какие электроны находятся на каких орбиталях. Как упоминалось ранее, подсчитав протоны (атомный номер), вы можете определить количество электронов в нейтральном атоме. Организация по блокам ускоряет этот процесс. Например, если бы нас интересовало определение электронной организации ванадия (атомный номер 23), мы бы начали с водорода и продвигались вниз по периодической таблице).
1s (H, He), 2s (Li, Be), 2p (B, C, N, O, F, Ne), 3s (Na, Mg), 3p (Al, Si, P, S, Cl, Ar), 4s (K, Ca), 3d (Sc, Ti, V).
Если вы не уверены в этой системе счета и в том, как заполняются электронные орбитали, см. раздел о конфигурации электронов.
раздел о конфигурации электронов.
Ссылка на приведенную ниже периодическую таблицу подтверждает эту организацию. У нас есть три элемента на 3d-орбитали. Поэтому пишем в порядке заполнения орбиталей.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3
or
[Ar] 4s 2 3d 3 .
Конфигурации нейтральных атомов переходных металлов четвертого периода приведены в таблице \(\PageIndex{2}\).
| Sc | Ти | В | Кр | Мн | Фе | Со | Никель | Медь | Цинк |
|---|---|---|---|---|---|---|---|---|---|
| [Ar] 4s 2 3d 1 | [Ar] 4s 2 3d 2 | [Ar] 4s 2 3d 3 | [Ar] 4s 2 3d 4 | [Ar] 4s 2 3d 5 | [Ar] 4s 2 3d 6 | [Ar] 4s 2 3d 7 | [Ar] 4s 2 3d 8 | [Ar] 4s 2 3d 9 | [Ar] 4s 2 3d 10 |
| [Ar] 4s 1 3d 5 | [Ar] 4s 1 3d 10 |
Хром и медь выглядят аномально. Взгляните на место элемента Chromium (атомный номер 24) в периодической таблице (рисунок \(\PageIndex{1}\)). Электронная конфигурация хрома не [Ar] 4s 2 3d 4 , а [Ar] 4s 1 3д 5 . Это связано с тем, что наполовину заполненное 3d-многообразие (с одним 4s-электроном) более стабильно, чем частично заполненное d-многообразие (и заполненное 4s-многообразие). Из таблицы \(\PageIndex{2}\) вы заметите, что медь демонстрирует аналогичное явление, хотя с полностью заполненным d-коллектором.
Взгляните на место элемента Chromium (атомный номер 24) в периодической таблице (рисунок \(\PageIndex{1}\)). Электронная конфигурация хрома не [Ar] 4s 2 3d 4 , а [Ar] 4s 1 3д 5 . Это связано с тем, что наполовину заполненное 3d-многообразие (с одним 4s-электроном) более стабильно, чем частично заполненное d-многообразие (и заполненное 4s-многообразие). Из таблицы \(\PageIndex{2}\) вы заметите, что медь демонстрирует аналогичное явление, хотя с полностью заполненным d-коллектором.
Степени окисления ионов переходных металлов
При рассмотрении ионов мы добавляем или вычитаем отрицательные заряды из атома. Учет атомных орбиталей при присвоении степеней окисления помогает понять, что переходные металлы представляют собой особый случай, но не исключение из этого удобного метода. Атому, который принимает электрон для достижения более стабильной конфигурации, присваивается степень окисления -1. Пожертвование электрона тогда +1. Когда переходный металл теряет электроны, он имеет тенденцию терять свои s-орбитальные электроны раньше любого из своих d-орбитальных электронов. Для более подробного обсуждения формы этих соединений см. Образование координационных комплексов.
Когда переходный металл теряет электроны, он имеет тенденцию терять свои s-орбитальные электроны раньше любого из своих d-орбитальных электронов. Для более подробного обсуждения формы этих соединений см. Образование координационных комплексов.
Пример \(\PageIndex{1}\)
Запишите электронные конфигурации:
- нейтральное железо,
- ион железа (II) и
- ион железа(III).
- Ответить
Атомный номер железа равен 26, поэтому в этом веществе 26 протонов.
- Fe: [Ar] 4s 2 3d 6
- Fe 2 + : [Ar] 3d 6
- Fe 3 + : [Ar] 3d 5
Обратите внимание, что сначала теряются s-орбитальные электроны , затем d-орбитальные электроны.
Пример \(\PageIndex{2}\)
Определите более стабильную конфигурацию между следующей парой:
- [Kr] 5s 2 4d 6 по сравнению с [Kr] 5s 1 4
- Ag 1 + против Ag 2 +
- Ответить
- Здесь описывается рутений.
 Имеется только один 5s электрон.
Имеется только один 5s электрон. - Однократно окисленное серебро ([Kr] 4d 10 ) более стабильно, чем дважды- ([Kr] 4d 9 ).
- Здесь описывается рутений.
Несколько степеней окисления
Большинство переходных металлов имеют несколько степеней окисления, поскольку переходные металлы относительно легко теряют электроны по сравнению с щелочными металлами и щелочноземельными металлами. Щелочные металлы имеют один электрон на валентной s-орбитали, а их ионы почти всегда имеют степень окисления +1 (из-за потери одного электрона). Точно так же щелочноземельные металлы имеют два электрона на своих валентных s-орбиталях, что приводит к образованию ионов со степенью окисления +2 (из-за потери обоих). Однако переходные металлы более сложны и демонстрируют ряд наблюдаемых степеней окисления, в первую очередь из-за удаления d-орбитальных электронов. В следующей таблице описаны наиболее распространенные степени окисления элементов периода 3.
Скандий — один из двух элементов первого периода переходного металла, который имеет только одну степень окисления (другой — цинк со степенью окисления +2).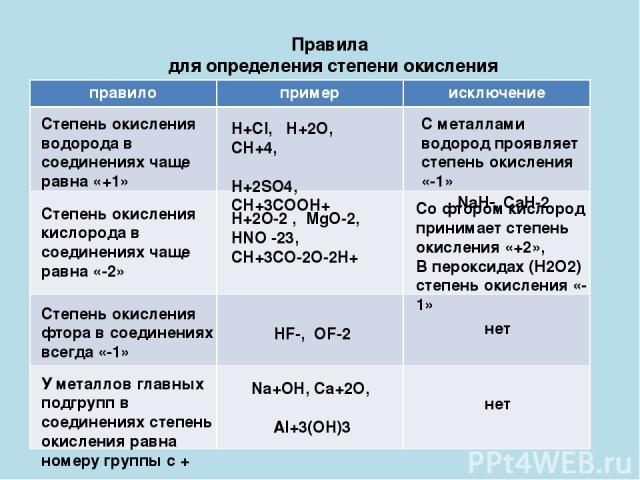 Все остальные элементы имеют как минимум две различные степени окисления. Марганец, находящийся в середине периода, имеет наибольшее количество степеней окисления и, действительно, самую высокую степень окисления за весь период, поскольку у него пять неспаренных электронов (см. таблицу ниже).
Все остальные элементы имеют как минимум две различные степени окисления. Марганец, находящийся в середине периода, имеет наибольшее количество степеней окисления и, действительно, самую высокую степень окисления за весь период, поскольку у него пять неспаренных электронов (см. таблицу ниже).
Чтобы помочь запомнить стабильность более высоких степеней окисления для переходных металлов, важно знать тенденцию: стабильность более высоких степеней окисления постепенно увеличивается вниз по группе. Например, в группе 6 (хром) Cr наиболее стабилен при степени окисления +3, а это означает, что вы не найдете много стабильных форм Cr в степени окисления +4 и +5. Напротив, существует много стабильных форм молибдена (Mo) и вольфрама (W) в степенях окисления +4 и +5.
Пример \(\PageIndex{3}\)
Что делает цинк стабильным в виде Zn 2 + ? Что делает скандий стабильным в виде Sc 3 + ?
- Ответить
Цинк имеет нейтральную конфигурацию [Ar]4s 2 3d 10 .
 Потеря 2 электронов не меняет полную d-орбиталь. Нейтральный скандий записывается как [Ar]4s 2 3d 1 . Потеря 3 электронов приводит конфигурацию в благородное состояние с валентностью 3p 6 .
Потеря 2 электронов не меняет полную d-орбиталь. Нейтральный скандий записывается как [Ar]4s 2 3d 1 . Потеря 3 электронов приводит конфигурацию в благородное состояние с валентностью 3p 6 .
Пример \(\PageIndex{4}\)
Почему железо почти всегда Fe 2 + или Fe 3 + ?
- Ответить
Железо записывается как [Ar]4s 2 3d 6 . Потеря 2 электронов с s-орбитали (3d 6 ) или 2 s- и 1 d-орбитали (3d 5 ) электрона являются довольно стабильными состояниями окисления.
Пример \(\PageIndex{5}\)
Запишите оксиды марганца в нескольких различных степенях окисления. Какие из них возможны и/или разумны?
- Ответить
Хотя Mn +2 является наиболее стабильным ионом марганца, d-орбиталь может удалять от 0 до 7 электронов.
 Таким образом, соединения марганца варьируются от Mn(0) в виде Mn (s) , Mn(II) в виде MnO, Mn(II, III) в виде Mn 3 O 4 , Mn(IV) в виде MnO 2 , или диоксид марганца, Mn(VII) в перманганат-ионе MnO 4 — и так далее.
Таким образом, соединения марганца варьируются от Mn(0) в виде Mn (s) , Mn(II) в виде MnO, Mn(II, III) в виде Mn 3 O 4 , Mn(IV) в виде MnO 2 , или диоксид марганца, Mn(VII) в перманганат-ионе MnO 4 — и так далее.
Степень окисления переходных металлов в соединениях
При наличии ионного соединения, такого как \(\ce{AgCl}\), можно легко определить степень окисления переходного металла. В этом случае вас попросят определить степень окисления серебра (Ag). Поскольку мы знаем, что хлор (Cl) находится в группе галогенов периодической таблицы, мы знаем, что он имеет заряд -1, или просто Cl — . Кроме того, видя, что для \(\ce{AgCl}\) нет общего заряда (что определяется, глядя на верхний правый угол соединения, т.е. AgCl # , где # представляет собой общий заряд соединения), мы можем заключить, что серебро (\(\ce{Ag}\)) имеет степень окисления +1. Это дает нам Ag + и Cl — , в которых положительный и отрицательный заряд компенсируют друг друга, в результате чего получается общий нейтральный заряд; поэтому +1 подтверждается как степень окисления серебра (Ag).
Пример \(\PageIndex{6}\)
Определите степень окисления кобальта в \(\ce{CoBr2}\).
- 9{-}}\)). Так как есть два брома, каждый с зарядом -1. Кроме того, мы знаем, что \(\ce{CoBr2}\) имеет общий нейтральный заряд, поэтому мы можем сделать вывод, что катион (кобальт), \(\ce{Co}\) должен иметь степень окисления от +2 до нейтрализовать заряд -2 от двух анионов брома.
Пример \(\PageIndex{7}\)
Какова степень окисления цинка в \(\ce{ZnCO3}\). (Примечание: анион \(\ce{CO3}\) имеет зарядовое состояние -2)
- Ответ 9{-}}\).
Этот пример также показывает, что атомы марганца могут иметь степень окисления +7, которая является максимально возможной степенью окисления для переходных металлов четвертого периода.
Марганец: тематическое исследование
Марганец широко изучается, поскольку он является важным восстановителем в химическом анализе, а также изучается в биохимии для катализа и в металлургии для обогащения сплавов.
Рисунок \(\PageIndex{2}\): (слева) Грубый фрагмент блестящего серебристого металла (CC BY-SA 3.0; Tomihahndorf через Википедию) (справа) В некоторых наскальных рисунках Ласко используются пигменты на основе марганца. (Общественное достояние; Prof saxx через Википедию) В растениях марганец требуется в следовых количествах; более сильные дозы начинают вступать в реакцию с ферментами и подавляют некоторые клеточные функции. Из-за гибкости марганца в принятии многих степеней окисления он становится хорошим примером для описания общих тенденций и концепций, лежащих в основе электронных конфигураций.
В растениях марганец требуется в следовых количествах; более сильные дозы начинают вступать в реакцию с ферментами и подавляют некоторые клеточные функции. Из-за гибкости марганца в принятии многих степеней окисления он становится хорошим примером для описания общих тенденций и концепций, лежащих в основе электронных конфигураций.Электронные конфигурации неспаренных электронов называются парамагнитными и реагируют на близость магнитов. Полностью спаренные электроны диамагнитны и не чувствуют этого влияния. Марганец, в частности, имеет парамагнитную и диамагнитную ориентацию в зависимости от его степени окисления. 9{0}\nonumber\]
Поскольку все 3p-орбитали спарены, этот комплекс является диамагнитным.

Резюме
Степени окисления переходных металлов подчиняются общим правилам для большинства других ионов, за исключением того факта, что d-орбиталь вырождается с s-орбиталью с более высоким квантовым числом. Переходные металлы достигают стабильности за счет соответствующего расположения своих электронов и окисляются или теряют электроны на другие атомы и ионы. Эти образующиеся катионы участвуют в образовании координационных комплексов или синтезе других соединений.
Вопросы
Определите степени окисления переходных металлов, обнаруженных в этих нейтральных соединениях. Примечание. В следующих соединениях переходный металл подчеркнут.
(A) Медь(I) Хлорид: Cu Cl (B) Медь(II) Нитрат: Cu (NO 3 ) 2 (C) Золото(V) Фтор: Au F 5 (D) Железо(II) Оксид: Fe O (E) Железо(III) Оксид: Fe 2 O 3 (F) Свинец(II) Хлор: Pb Cl 2 (G) Свинец(II) Нитрат: Pb (NO 3 ) 2 (H) Марганец(II) Хлорид: Mn Cl 2 (I) Молибден триоксид: Mo O 3 (J) Никель(II) Гидроксид: Ni (OH) 2 (K) Платина(IV) Хлорид: Pt Cl 4 (L) Серебро Сульфид: Ag 2 S (M) Вольфрам(VI) Фтор: W F 6 (N) Ванадий(III) Нитрид: V N (O) Цирконий Гидроксид: Zr (OH) 4 - Определите степень окисления переходного металла для общего ненейтрального соединения: Манганат ( Mn O 4 2 — 0 )
- Почему переходные металлы имеют большее число степеней окисления, чем металлы основной группы (т.
 е. щелочные металлы и щелочноземельные металлы)?
е. щелочные металлы и щелочноземельные металлы)? - Какой переходный металл имеет наибольшее количество степеней окисления?
- Почему число степеней окисления переходных металлов увеличивается в середине группы?
- Какие два переходных металла имеют только одну степень окисления?
Ссылки
- Окстоби Д., Гиллис Х.П., Кэмпион, А. Принципы современной химии, 6 -е, -е изд. Томсон Брукс/Коул, Белмонт. 2008 г.; 313-318.
- Audi A, Шервуд, стр. Рентгено-фотоэлектронные спектроскопические исследования валентной зоны марганца и его оксидов, интерпретированные расчетами кластерной и зонной структуры ; Серф. Интерфейс Анал.; 2002 г.; 33; 274-282.
- Reaney S, Kwik-Uribe C, Smith D. Состояние окисления марганца и его последствия для токсичности. Хим. Рез. Токсикол.; 2002 г.; 15; 1119-1126.
- CRC Handbook, 88 th ed. св. 1, пр. 1 Электронная конфигурация и энергия ионизации нейтральных атомов в основном состоянии ; 13-14.

- CRC Handbook, 88 th ed. св. 4, пр. 1 Температуры плавления, кипения, тройной и критической температуры элементов ; 133-134.
Авторы и ссылки
- Марго Крейтман (UCD), Джослин Вуд, Лиза Чу (UCD)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
- Теги
- атомные орбитали
- конфигурация
- делокализованный
- диамагнетик
- электронная конфигурация
- электронная конфигурация
- энергетические диаграммы
- ионов
- Конфигурация благородного газа
- степени окисления
- степень окисления
- степени окисления
- парамагнитный
- Физические свойства
- переходный металл
- Ион переходного металла
- Ионы переходных металлов
кобальт | Использование, свойства и факты
кобальт
Посмотреть все СМИ
- Ключевые люди:
- Георг Брандт
- Похожие темы:
- химический элемент переходный металл обработка кобальта витамин В12 кобальт-60
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
кобальт (Co) , химический элемент, ферромагнитный металл группы 9 (VIIIb) периодической таблицы, используемый в основном для жаропрочных и магнитных сплавов.

Металл был выделен (около 1735 г.) шведским химиком Георгом Брандтом, хотя соединения кобальта веками использовались для придания синего цвета глазури и керамике. Кобальт был обнаружен в египетских статуэтках и персидских бусинах для ожерелий 3-го тысячелетия до н.07 г. н.э.), а затем и в голубом фарфоре династии Мин (1368–1644). Название кобольд было впервые применено (16 век) к рудам, которые, как считалось, содержали медь, но в конечном итоге оказалось, что это ядовитые кобальтовые руды, содержащие мышьяк. В конце концов Брандт определил (1742 г.), что синий цвет этих руд обусловлен присутствием кобальта.
Тест «Британника»
Тест «118 названий и символов периодической таблицы»
Периодическая таблица состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этом тесте вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
Element Properties atomic number 27 atomic weight 58.  933194
933194melting point 1,495 °C (2,723 °F) boiling point 2,870 °C (5,198 ° F) Плотность 8,9 Грам/см 3 при 20 ° C (68 ° F) Состояния окисления +2 +3 .0035 [AR] 3 D 7 4 S 2 . Он содержится в небольших количествах в земном и метеоритном самородном никелевом железе, на Солнце и в атмосферах звезд, а в сочетании с другими элементами в природных водах, в железомарганцевых корках на глубинах океанов, в почвах, в растениях и животных, в минералы, такие как кобальтит, линнеит, скуттерудит, смальтит, гетерогенит и эритрит. У животных кобальт является микроэлементом, необходимым для питания жвачных животных (крупный рогатый скот, овцы) и для созревания эритроцитов человека в форме витамина В
12 , единственный известный витамин, содержащий такой тяжелый элемент.
За некоторыми исключениями, кобальтовая руда обычно не добывается из-за содержания кобальта. Скорее, его часто извлекают как побочный продукт добычи руд железа, никеля, меди, серебра, марганца, цинка и мышьяка, которые содержат следы кобальта. Для концентрирования и извлечения кобальта из этих руд требуется сложная переработка. Ко второму десятилетию 21 века Демократическая Республика Конго (ДРК), Китай, Канада и Россия были ведущими мировыми производителями добываемого кобальта. Однако крупнейшим производителем рафинированного кобальта был Китай, который импортировал огромные дополнительные объемы полезных ископаемых кобальта из ДРК. (Дополнительную информацию о добыче, переработке и извлечении кобальта см. в см. обработка кобальта.)
Полированный кобальт серебристо-белого цвета со слабым голубоватым оттенком. Известны два аллотропа: гексагональная плотноупакованная структура, стабильная ниже 417 ° C (783 ° F), и гранецентрированная кубическая, стабильная при высоких температурах.
 Он является ферромагнитным при температуре до 1121 ° C (2050 ° F, самая высокая известная точка Кюри для любого металла или сплава) и может найти применение там, где необходимы магнитные свойства при повышенных температурах.
Он является ферромагнитным при температуре до 1121 ° C (2050 ° F, самая высокая известная точка Кюри для любого металла или сплава) и может найти применение там, где необходимы магнитные свойства при повышенных температурах.Кобальт — один из трех металлов, обладающих ферромагнитными свойствами при комнатной температуре. Он медленно растворяется в разбавленных минеральных кислотах, не соединяется непосредственно ни с водородом, ни с азотом, но при нагревании соединяется с углеродом, фосфором или серой. Кобальт также подвергается воздействию кислорода и водяного пара при повышенных температурах, в результате чего образуется оксид кобальта CoO (с металлом в состоянии +2).
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Природный кобальт полностью состоит из стабильного изотопа кобальта-59, из которого путем облучения нейтронами в ядерном реакторе производится самый долгоживущий искусственный радиоактивный изотоп кобальт-60 (период полураспада 5,3 года).
 Гамма-излучение кобальта-60 использовалось вместо рентгеновского или альфа-излучения радия при проверке промышленных материалов для выявления внутренней структуры, дефектов или посторонних предметов. Он также использовался в терапии рака, в исследованиях по стерилизации, а также в биологии и промышленности в качестве радиоактивного индикатора.
Гамма-излучение кобальта-60 использовалось вместо рентгеновского или альфа-излучения радия при проверке промышленных материалов для выявления внутренней структуры, дефектов или посторонних предметов. Он также использовался в терапии рака, в исследованиях по стерилизации, а также в биологии и промышленности в качестве радиоактивного индикатора.Большая часть производимого кобальта используется для специальных сплавов. Относительно большой процент мирового производства приходится на магнитные сплавы, такие как Alnicos для постоянных магнитов. Значительные количества используются для сплавов, которые сохраняют свои свойства при высоких температурах, и суперсплавов, которые используются вблизи их точек плавления (где стали стали бы слишком мягкими). Кобальт также используется для твердосплавных сплавов, инструментальных сталей, сплавов с низким коэффициентом расширения (для уплотнений стекло-металл) и сплавов с постоянным модулем (упругих) (для прецизионных пружин). Кобальт является наиболее подходящей матрицей для цементированных карбидов.

Мелкодисперсный кобальт самовозгорается. Более крупные куски относительно инертны на воздухе, но при температуре выше 300 ° C (570 ° F) происходит интенсивное окисление.
В своих соединениях кобальт почти всегда проявляет степень окисления +2 или +3, хотя известны состояния +4, +1, 0 и -1. Соединения, в которых кобальт проявляет степень окисления +2 (Co 2+ , ион стабилен в воде), называются кобальтовыми, а в которых кобальт проявляет степень окисления +3 (Co 3+ ) называются кобальтовыми.
Как Co 2+ , так и Co 3+ образуют многочисленные координационные соединения или комплексы. Co 3+ образует больше известных комплексных ионов, чем любой другой металл, кроме платины. Координационное число комплексов обычно равно шести.
Кобальт образует с кислородом два четко определенных бинарных соединения: оксид кобальта, CoO, и текстроксид трикобальта, или оксид кобальта-кобальта, Co 3 O 4 .
 Последний содержит кобальт в обеих степенях окисления +2 и +3 и составляет до 40% товарного оксида кобальта, используемого в производстве керамики, стекла и эмали, а также при приготовлении катализаторов и порошка металлического кобальта.
Последний содержит кобальт в обеих степенях окисления +2 и +3 и составляет до 40% товарного оксида кобальта, используемого в производстве керамики, стекла и эмали, а также при приготовлении катализаторов и порошка металлического кобальта.Одной из наиболее важных солей кобальта является сульфат CoSO 4 , который используется в гальванике, при приготовлении осушающих средств и для подкормки пастбищ в сельском хозяйстве. Другие соли кобальта находят широкое применение в производстве катализаторов, осушителей, порошков металлического кобальта и других солей. Хлорид кобальта (CoCl 2 ∙ 6H 2 O в коммерческой форме), твердое вещество розового цвета, которое при обезвоживании становится синим, используется при приготовлении катализатора и в качестве индикатора влажности. Фосфат кобальта, Co 3 (PO 4 ) 2 ∙8H 2 O, используется для росписи фарфора и окрашивания стекла.
Эта статья была недавно отредактирована и обновлена Эриком Грегерсеном.

Химия кобальта
Химия кобальта ИсторияПроисхождение имени Кобальт считается, что оно происходит от немецкого слова кобольд, означающего «злые духи или гоблины». суеверно считалось, что они доставляют неприятности горнякам, поскольку кобальт минералы содержали мышьяк, который вредил их здоровью, а кобальтовые руды не дают металлы при обработке обычными методами. Имя также может быть происходит от греческого kobalos, означающего «мой». Кобальт был открыт в 1735 году шведским химиком Георгом Брандтом.
Отличный сайт для поиска свойств элементов, включая кобальт по номеру
Дополнительную информацию о кобальте можно найти на ООО «Институт кобальта» а также страница о кобальте в Википедии.
Залегание
Основными рудами кобальта являются кобальтит, [(Co,Fe)AsS], эритрит, [Co 3 (AsO 4 ) 2 .8(H 2 O)], глаукод, [(Co, Fe)AsS] и скуттерудит, [CoAs 3 ].
 В последние годы мировое производство кобальта неуклонно растет.
почти утроился с 1993 года. Доминирование африканских производителей меди и кобальта
сменилось более равномерным распределением выпуска продукции между ведущими
страны-производители, включая Канаду, Норвегию и совсем недавно Австралию,
вместе с экспортом из России, замещая выпадающее производство в
Демократическая Республика Конго (Заир). Наибольший рост производства кобальта
родом из Финляндии, где производство выросло более чем на 16% между 1990 и 2002.
В последние годы мировое производство кобальта неуклонно растет.
почти утроился с 1993 года. Доминирование африканских производителей меди и кобальта
сменилось более равномерным распределением выпуска продукции между ведущими
страны-производители, включая Канаду, Норвегию и совсем недавно Австралию,
вместе с экспортом из России, замещая выпадающее производство в
Демократическая Республика Конго (Заир). Наибольший рост производства кобальта
родом из Финляндии, где производство выросло более чем на 16% между 1990 и 2002.Статья о Высокие человеческие затраты на добычу кобальта могут представлять интерес.
Международный центр экологических и ядерных наук (ICENS) имеет текущую программу картографирования геохимического состава Ямайки. «Геохимический атлас Ямайки» был опубликован в 1995 г. и доступен на Amazon или ICENS.
Результаты, полученные для кобальта, показаны ниже (любезно предоставлено профессором Г.К. Лалором).
Добыча
Не рассматривается в этом курсе.
Применение
- Сплавы, такие как:
Суперсплавы для деталей газотурбинных авиационных двигателей.
Коррозионно- и износостойкие сплавы. По оценкам, около 20% производства в 2003 г. - Стали быстрорежущие.
- Твердые сплавы (также называемые твердыми сплавами) и алмазный инструмент.
- Магниты и магнитные носители информации.
- Катализаторы для нефтяной и химической промышленности.
- гальваническое покрытие из-за его внешнего вида, твердости и устойчивости к окислению.
- Осушители для красок, лаков и чернил.
- Грунтовки для фарфоровых эмалей.
- Пигменты (голубой кобальт, известный в древности, и кобальтовый зеленый).
- Аккумуляторный сектор (например, электроды) оценивается примерно в 11% производства в 2003 г.
- Радиальные шины со стальным кордом.
- Кобальт-60 имеет множество применений в качестве источника гамма-излучения:
* Он используется в лучевой терапии.
* Применяется при радиационной обработке пищевых продуктов для стерилизации (холодной пастеризации).
* Он используется в промышленной радиографии для обнаружения структурных дефектов в металлических деталях.
Соединения кобальтаОксиды
Оксиды кобальта
Препараты:Формула Цвет Степень окисления МП Структура / комментарии Ко 2 О 3 Ко 3+ Ко 3 О 4 черный Со 2+/3+ 900-950разложение нормальная шпинель СО оливково-зеленый Ко 2+ 1795 NaCl -антиферромаг. < 289 К Co 2 O 3 образуется при окислении Со(ОН) 2 .
Co 3+ + e- ⇔ Co 2+ 1,81 В
СоО при нагревании до 600-700°С превращается в Со 3 О 4
Co 3 O 4 при нагревании до 900-950°C реконвертируется вернуться в КО.
Co 2+ + 2e- ⇔ Co -0,28 Вне стабильный [Co(H 2 O) 6 ] 3+ или [Co(OH) 3 существуют, поскольку они превращаются в CoO(OH).
Синий кобальт
[Co(H 2 O) 6 ] 2+ некислотный и стабильный карбонат существуют.
Одним из первых применений кобальта было окрашивание стекла. Добавление солей кобальта.
Пигмент на основе шпинели CoAl 2 O 4 и в лаборатории могут быть легко синтезированы пиролизом смесь AlCl 3 и CoCl 2 .Галогениды
Галогениды кобальта(II)
Препараты:Формула Цвет МП мк(БМ) Структура ЦФ 2 розовый 1200 — рутил CoCl 2 синий 724 5,47 CdCl 2 Коббр 2 зеленый 678 — CDI 2 КИ 2 сине-черный 515 — CDI 2 Co или CoCO 3 + HX → CoX 2 .
Комплексы кобальта aq →
СоХ 2
aq →
СоХ 2 Ион кобальта(III) образует множество устойчивых комплексов, которые инертны, способны проявлять различные виды изомерии. подготовка и характеристика многих из этих дат комплексов вернуться к пионерской работе Вернер и его учеников.
Координационная теория была разработана на основе исследований комплексов типа:Комплексы Вернер
[Co(NH 3 ) 6 ]Cl 3 желтый [CoCl(NH 3 ) 5 ]Cl 2 красный транс -[CoCl 2 (NH 3 ) 4 ]Cl зеленый цис -[CoCl 2 (NH 3 ) 4 ]Cl фиолетовый Еще один важный комплекс в истории согласования химия — гексол.
Недавно было установлено, что структура, которую Вернер неправильно определил, связана с к исходному гексолу, хотя в этом случае комплекс содержит 6 атомов Со, то есть шестиядерный. Темно-зеленое соединение не растворяется в оптических изомеры. Это был первый комплекс, который удалось разложить на оптические изомеры.
который не содержал атомов углерода. С тех пор были найдены только три или четыре других.
Это был первый комплекс, который удалось разложить на оптические изомеры.
который не содержал атомов углерода. С тех пор были найдены только три или четыре других.
Гексол Вернера и «2-й гексол»
Заметная разница между хромом (III) и кобальтом (III) химии заключается в том, что комплексы кобальта гораздо менее восприимчивы к гидролиз, хотя и ограниченный гидролиз, приводящий к многоядерным кобальтамины с мостиковыми ОН-группами хорошо известны.
Другие часто встречающиеся мостиковые группы: NH 2 — , NH 2- и № 2 — , которые приводят к таким комплексам, как ярко-синий амидный мостик [(NH 3 ) 5 Co-NH 2 -Co(NH 3 ) 5 ] 5+ .
При получении гексаамминовых солей кобальта(III) окислением на воздухе кобальта(II) в водном растворе аммиака можно изолировать синий [(NH 3 ) 5 Co-O 2 -Co(NH 3 ) 5 ] 4+ . Это умеренно стабильно в концентрированном водный аммиак и в твердом состоянии, но легко разлагается в кислоте растворы Co(II) и O 2 , а окислители, такие как (S 2 O 8 ) 2- преобразовать его в зеленый, парамагнитный [(NH 3 ) 5 Co-O 2 -Co(NH 3 ) 5 ] 5+ (μ 300 = 1,7 БМ).
В коричневом соединении оба атома кобальта представляют собой Co(III) и соединены пероксогруппа, O 2 2-, это соответствует наблюдаемый диамагнетизм; кроме того, стереохимия центральная группа Co-O-O-Co аналогична группе Н 2 О 2 .
Зеленое соединение менее прямолинейно. Вернер подумал, что это тоже
включает пероксогруппу, но в данном случае мостик между Co (III) и Co (IV)
атомы.
Вернер подумал, что это тоже
включает пероксогруппу, но в данном случае мостик между Co (III) и Co (IV)
атомы.
Это может объяснить парамагнетизм, но данные ЭПР показывают что 2 атома кобальта эквивалентны, а рентгеновский данные показывают, что центральная группа Co-O-O-Co плоская с расстоянием O-O в 131 час, что очень близко к 128 часам дня супероксид, O 2 — , ион.
Поэтому более удовлетворительной формулировкой является формула с 2 атомами Co (III). соединены супероксидным мостиком.
Известен ряд дикислородных комплексов Co(II), некоторые из которых способны обратимо связывать O 2 из воздуха. Во время Второй мировой войны некоторые американские самолеты Сообщается, что носители использовали эти комплексы в качестве твердого источника для кислородно-ацетиленовой сварки. Слегка подогрев твердый комплекс кислород высвобождается, и при повторном охлаждении кислород будет снова согласовал. В отличие от кислородного баллона твердое тело не взорвется при попадании шальной пули![КосаленО 2 ]
А лабораторный эксперимент, предназначенный для измерения поглощения диоксигена от Cosalen доступен онлайн.
Co(acac) 3 представляет собой зеленый октаэдрический комплекс Co(III). В этом случае Co(II) можно сравнить с комплексами Ni(II).
Ni(acac) 2 оказывается мономерным только при температуры около 200°C в некоординирующих растворителях, таких как н-декан. 6-координатные мономеры образуются при комнатной температура в растворителях, таких как пиридин, но в твердом состоянии Ni(acac) 2 – тример, в котором каждый атом Ni 6-координата. Обратите внимание, что Co(acac) 2 на самом деле существует как тетрамер.[Ni(acac) 2 ] 3 [Ко(асас) 2 ] 4
Комплексы галогенидов кобальта (II) с пиридином проявляют структурную изомерию. Добавление пиридина к хлориду кобальта (II) в этаноле может привести к синие, фиолетовые или розовые комплексы, каждый из которых имеет состав «CoCl 2 пир 2 «. Структуры 4, 5 и 6 согласованы с
либо без мостиковых хлоридов, либо с моно- или димостиковыми хлоридами.
Структуры 4, 5 и 6 согласованы с
либо без мостиковых хлоридов, либо с моно- или димостиковыми хлоридами. синий-[CoCl 2 пир 2 ] CN=4 розовый-[CoCl 2 пир 2 ] CN=6
См. примечания по изомерии для примеров соединений Co (III), которые демонстрируют связь и структурную изомерию.Здоровье
см. примечания в Бристольском университете по Витамин B12 и другие виды кобальта необходимы для хорошего здоровья.
вернуться к курсу CHEM2101 (C21J) схема
Вернуться к химии, UWI-Мона, Домашняя страницаCopyright © 2002-2020 Роберт Джон Ланкашир, все права защищены.
Создан и поддерживается профессором Робертом Дж. ЛанкаширХимический факультет Вест-Индского университета,
Кампус Моны, Кингстон 7, Ямайка.
Создано в июле 2002 г. Ссылки проверены и/или последние.
изменено 28 сентября 2020 г.
Ссылки проверены и/или последние.
изменено 28 сентября 2020 г.
URL http://wwwchem.uwimona.edu.jm/courses/cobalt.htmlКомплекс фосфина кобальта в пяти степенях окисления
. 2021 6 декабря; 60 (23): 17445-17449.
doi: 10.1021/acs.inorgchem.1c03020. Epub 2021 23 ноября.
Даниэль Курц 1 , Цзибо Чжан 1 , Арвин Сукезян 2 , Джереми Каллик 2 , Майкл Дж. Хилл 2 , Брайан М Хантер 1
Принадлежности
- 1 Институт Роуленда при Гарвардском университете, Кембридж, Массачусетс 02142, США.

- 2 Химический факультет Западного колледжа, Лос-Анджелес, Калифорния, США.
- PMID: 34813328
- DOI: 10.1021/acs.inorgchem.1c03020
Бесплатная статья
Даниэль А. Курц и др. Неорг хим. .
Бесплатная статья
. 2021 6 декабря; 60 (23): 17445-17449.
doi: 10.1021/acs.inorgchem.1c03020. Epub 2021 23 ноября.

Авторы
Даниэль Курц 1 , Цзибо Чжан 1 , Арвин Сукезян 2 , Джереми Каллик 2 , Майкл Дж. Хилл 2 , Брайан М Хантер 1
Принадлежности
- 1 Институт Роуленда при Гарвардском университете, Кембридж, Массачусетс 02142, США.
- 2 Химический факультет Западного колледжа, Лос-Анджелес, Калифорния, США.
- PMID: 34813328
- DOI:
10.
 1021/acs.inorgchem.1c03020
1021/acs.inorgchem.1c03020
Абстрактный
Здесь мы сообщаем об электрохимических, спектроскопических и кристаллографических характеристиках окислительно-восстановительного ряда комплексов кобальта в пяти последовательных степенях окисления. Простой бидентатный фосфиновый лиганд, цис -1,2-бис(дифенилфосфино)этилен (dppv), позволяет выделить 3+, 2+, 1+, 0 и 1- степени окисления кобальта – единственный известный пример комплексов переходных металлов с окислительно-восстановительными лигандами в пяти степенях окисления. Электрохимия [Co(dppv) 2 ] 2+ обнаруживает три обратимых восстановления и одно обратимое окисление. Комплексы в каждой степени окисления охарактеризованы с помощью рентгеновской дифракции монокристаллов. Координационное число и геометрия комплекса изменяются в зависимости от степени окисления: включая ацетонитрильные лиганды, комплекс Со 3+ является псевдо- октаэдрическим, комплекс Со 2+ является квадратно-пирамидальным, комплекс Со + комплекс псевдоквадратно-плоский, а Co 0 и Co 9Комплексы 0056 — приближаются к псевдо- тетраэдрам, иллюстрируя структуры, предсказанные теорией кристаллического поля неорганических комплексов переходных металлов.

Похожие статьи
Настройка фосфиновых комплексов кобальта (II) на аксиальную амбивалентность.
Томас-Колуэлл Дж., Сукезян А., Курц Д.А., Каллик Дж., Хенлинг Л.М., Стич Т.А., Хилл М.Г., Хантер Б.М. Томас-Колуэлл Дж. и соавт. Неорг хим. 2022, 15 августа; 61(32):12625-12634. doi: 10.1021/acs.inorgchem.2c01562. Epub 2022 3 августа. Неорг хим. 2022. PMID: 359Комплексы P)(pbi)] с бидентатными фосфиновыми и 2-(2-пиридил)бензимидазолатными лигандами: влияние изомерии на их люминесцентные свойства.
Камецка А , Сувинска К , Каптуркевич А . Камецка А и др. Phys Chem Chem Phys. 2019 15 августа; 21 (32): 17746-17759. дои: 10.1039/c9cp03416a. Phys Chem Chem Phys. 2019. PMID: 31368465
Комплексы Co2+, Zn2+ и Cu2+ на основе гетероскорпионатов: координационное поведение, аэробное окисление и обнаружение сероводорода.

Стрианезе М., Милионе С., Бертолази В., Пеллеккья С., Грасси А. Стрианезе М. и соавт. Неорг хим. 2011 7 февраля; 50 (3): 900-10. дои: 10.1021/ic101467s. Epub 2011 7 января. Неорг хим. 2011. PMID: 21214208
Влияние искажений на геометрическую и электронную структуру одноэлектронно-окисленных саленовых комплексов ванадия(IV), меди(II) и кобальта(II)/(III).
Кансо Х., Кларк Р.М., Кохем А., Арора Х., Филуз С., Джарджайес О., Сторр Т., Томас Ф. Кансо Х. и др. Неорг хим. 2020 6 апр; 59(7): 5133-5148. doi: 10.1021/acs.inorgchem.0c00381. Epub 2020 24 марта. Неорг хим. 2020. PMID: 32207610
Молекулярные и электронные структуры моноядерных комплексов железа с использованием сильно электронодонорных лигандов и их окисленных форм.

Страутманн Дж. Б., Джордж С. Д., Боте Э., Билл Э., Вейхермюллер Т., Штаммлер А., Бегге Х., Глейзер Т. Страутманн Дж. Б. и соавт. Неорг хим. 2008 г., 4 августа; 47 (15): 6804-24. doi: 10.1021/ic800335t. Epub 2008 27 июня. Неорг хим. 2008. PMID: 18582030
Посмотреть все похожие статьи
Цитируется
Настройка фосфиновых комплексов кобальта (II) на аксиальную амбивалентность.
Томас-Колуэлл Дж., Сукезян А., Курц Д.А., Каллик Дж., Хенлинг Л.М., Стич Т.А., Хилл М.Г., Хантер Б.М. Томас-Колуэлл Дж. и соавт. Неорг хим. 2022, 15 августа; 61(32):12625-12634. doi: 10.1021/acs.inorgchem.2c01562. Epub 2022 3 августа. Неорг хим. 2022. PMID: 35
0 Бесплатная статья ЧВК.
Степени окисления (степени окисления)
СТЕПЕНИ ОКИСЛЕНИЯ (ЧИСЛА ОКИСЛЕНИЯ)
На этой странице объясняется, что такое степени окисления (степени окисления), как их рассчитать и использовать.

Степени окисления легко определить и использовать, но довольно сложно определить, что они представляют собой каким-либо быстрым способом.
Объяснение того, что такое степени окисления (степени окисления)
Степени окисления упрощают весь процесс определения того, что окисляется и что восстанавливается в окислительно-восстановительных реакциях. Однако для целей этого введения было бы полезно, если бы вы знали о:
Примечание: Если вы не уверены ни в одном из этих вопросов, возможно, вам стоит просмотреть страницы, посвященные определениям окислительно-восстановительного потенциала и полууравнениям для электронов. Вероятно, было бы лучше прочитать и вернуться к этим ссылкам, если вы чувствуете, что вам это нужно.
Мы рассмотрим несколько примеров из химии ванадия. Если вы ничего не знаете о ванадии, это не имеет ни малейшего значения.

Ванадий образует ряд различных ионов — например, V 2+ и V 3+ . Если вы думаете о том, как они могут быть получены из металлического ванадия, ион 2+ будет сформирован путем окисления металла путем удаления двух электронов:
.В В 2+ + 2e —
Теперь говорят, что ванадий находится в степени окисления +2.
Удаление другого электрона дает ион V 3+ :
В 2+ В 3+ + е —
Ванадий теперь имеет степень окисления +3.
Удаление другого электрона дает более необычный ион, VO 2+ .
В 3+ + Н 2 О VO 2+ + 2Н + + e —
Теперь ванадий имеет степень окисления +4. Обратите внимание, что степень окисления не просто подсчитывает заряд иона (это верно для первых двух случаев, но не для этого).

Положительная степень окисления подсчитывает общее количество электронов, которые необходимо удалить, начиная с элемента.
Также можно удалить пятый электрон, чтобы получить другой ион (легко спутать с предыдущим!). Степень окисления ванадия теперь +5.
VO 2+ + H 2 O VO 2 + + 2H + + e —
Каждый раз, когда вы окисляете ванадий, удаляя из него еще один электрон, его степень окисления увеличивается на 1.
Вполне очевидно, что если вы снова начнете добавлять электроны, степень окисления упадет. В конечном итоге вы могли бы вернуться к элементу ванадия, который имел бы нулевую степень окисления.
Что, если бы вы продолжали добавлять электроны к элементу? На самом деле вы не можете сделать это с ванадием, но можете с таким элементом, как сера.
S + 2e — S 2-
Сера имеет степень окисления -2.

Сводка
Степень окисления показывает общее количество электронов, которые были удалены из элемента (положительная степень окисления) или добавлены к элементу (отрицательная степень окисления), чтобы получить его текущее состояние.
Окисление включает повышение степени окисления
Восстановление включает уменьшение степени окисления
Распознавание этой простой закономерности — самая важная вещь в концепции степеней окисления. Если вы знаете, как изменяется степень окисления элемента во время реакции, вы можете мгновенно сказать, окисляется он или восстанавливается, без необходимости работать с полууравнениями электронов и переносами электронов.
Определение степеней окисления
Вы не вычисляете степени окисления, подсчитывая количество переданных электронов. Это заняло бы слишком много времени. Вместо этого вы изучаете несколько простых правил и решаете очень простые задачи!
Степень окисления несвязанного элемента равна нулю.
 Это очевидно, потому что он еще не окислился и не восстановился! Это применимо к любой структуре элемента — будь то, например, Xe или Cl 2 или S 8 , или имеет ли он гигантскую структуру, как углерод или кремний.
Это очевидно, потому что он еще не окислился и не восстановился! Это применимо к любой структуре элемента — будь то, например, Xe или Cl 2 или S 8 , или имеет ли он гигантскую структуру, как углерод или кремний.Сумма степеней окисления всех атомов или ионов в нейтральном соединении равна нулю.
Сумма степеней окисления всех атомов в ионе равна заряду иона.
Более электроотрицательный элемент в веществе получает отрицательную степень окисления. Менее электроотрицательному дается положительная степень окисления. Помните, что фтор является самым электроотрицательным элементом, вторым по электроотрицательности является кислород.
Некоторые элементы почти всегда имеют одинаковые степени окисления в своих соединениях:
element usual oxidation state exceptions Group 1 metals always +1 (see note below) Group 2 metals always +2 Oxygen обычно -2 кроме пероксидов и F 2 O (см.  ниже)
ниже)Hydrogen usually +1 except in metal hydrides where it is -1 (see below) Fluorine always -1 Chlorine usually -1 except в соединениях с O или F (см. ниже)
Примечание: Мне было указано, что существует несколько малоизвестных соединений элементов натрия с цезием, где металл образует отрицательный ион, например, Na — . Это дало бы степень окисления -1.Вы можете игнорировать их, если изучаете химию на уровне A или его эквиваленте. Обобщение о том, что металлы группы 1 всегда имеют степень окисления +1, справедливо для всех соединений, которые вы, вероятно, встретите.
Если вас интересуют эти необычные соединения, выполните поиск в Интернете по запросу алкалиды .
Причины исключений
Водород в гидридах металлов
Гидриды металлов включают такие соединения, как гидрид натрия, NaH.
 В нем водород присутствует в виде иона гидрида, H —. Степень окисления простого иона, такого как гидрид, равна заряду иона, в данном случае -1.
В нем водород присутствует в виде иона гидрида, H —. Степень окисления простого иона, такого как гидрид, равна заряду иона, в данном случае -1.В качестве альтернативы можно представить, что сумма степеней окисления в нейтральном соединении равна нулю. Так как металлы 1 группы в своих соединениях всегда имеют степень окисления +1, то из этого следует, что водород должен иметь степень окисления -1 (+1 -1 = 0).
Кислород в пероксидах
Пероксиды включают пероксид водорода, H 2 O 2 . Это электрически нейтральное соединение, поэтому сумма степеней окисления водорода и кислорода должна быть равна нулю.
Поскольку каждый водород имеет степень окисления +1, каждый кислород должен иметь степень окисления -1, чтобы сбалансировать его.
Кислород в F 2 O
Проблема в том, что кислород не самый электроотрицательный элемент. Фтор более электроотрицательный и имеет степень окисления -1.
 В этом случае кислород имеет степень окисления +2.
В этом случае кислород имеет степень окисления +2.Хлор в соединениях с фтором или кислородом
Существует так много различных степеней окисления, которые может иметь хлор в них, что безопаснее просто помнить, что хлор не имеет степени окисления -1 в них, и определять его фактическую степень окисления, когда вам нужно Это. Пример этого вы найдете ниже.
Внимание!
Не зацикливайтесь на этих исключениях. В большинстве случаев, с которыми вы столкнетесь, они неприменимы!Примеры расчета степеней окисления
Какова степень окисления хрома в Cr 2+ ?
Это просто! Для такого простого иона степень окисления — это заряд иона, другими словами: +2 (не забывайте знак +).
Какова степень окисления хрома в CrCl 3 ?
Это нейтральное соединение, поэтому сумма степеней окисления равна нулю. Хлор имеет степень окисления -1.
 Если степень окисления хрома н :
Если степень окисления хрома н :n + 3(-1) = 0
n = +3 (Опять же, не забудьте знак +!)
Какова степень окисления хрома в Cr(H 2 O) 6 3+ ?
Это ион, поэтому сумма степеней окисления равна заряду иона. Существует короткий путь для определения степеней окисления в таких сложных ионах, когда атом металла окружен электрически нейтральными молекулами, такими как вода или аммиак.
Сумма степеней окисления присоединенной нейтральной молекулы должна быть равна нулю. Это означает, что вы можете игнорировать их, когда вычисляете сумму. Это будет по существу то же самое, что и неприсоединенный ион хрома, Cr 3+ . Степень окисления +3.
Какова степень окисления хрома в дихромат-ионе, Cr 2 O 7 2- ?
Степень окисления кислорода равна -2, а сумма степеней окисления равна заряду иона. Не забывайте, что присутствуют 2 атома хрома.

2n + 7(-2) = -2
н = +6
Предупреждение: Поскольку это простые суммы, заманчиво попытаться вычислить их в уме. Если это имеет значение (например, на экзамене), запишите их, используя столько шагов, сколько вам нужно, чтобы не было шансов сделать ошибки по невнимательности. Ваши экзаменаторы не будут впечатлены вашей арифметикой в уме — все, что им нужно, это правильный ответ!Если вам нужны еще примеры для практики, вы найдете их в большинстве учебников, включая мою книгу расчетов по химии.
Какова степень окисления меди в CuSO 4 ?
К сожалению, не всегда возможно вычислить степени окисления, просто используя приведенные выше правила. Проблема в этом случае заключается в том, что соединение содержит два элемента (медь и сера), степень окисления которых может изменяться.
Единственный способ обойти это — знать простую химию! Есть два способа приблизиться к этому.
 (Могут быть и другие, но я не могу о них сейчас думать!)
(Могут быть и другие, но я не могу о них сейчас думать!)Вы можете узнать это как ионное соединение, содержащее ионы меди и сульфат-ионы, SO 4 2-. Чтобы получить электрически нейтральное соединение, медь должна присутствовать в виде иона 2+. Следовательно, степень окисления +2.
Вы можете узнать формулу сульфата меди(II). «(II)» в названии говорит о том, что степень окисления равна 2 (см. ниже).
Вы будете знать, что это +2, потому что вы знаете, что металлы образуют положительные ионы, а степень окисления будет просто зарядом иона.
Использование степеней окисления
В названиях соединений
Вы наверняка встречали такие названия, как сульфат железа(II) и хлорид железа(III). (II) и (III) представляют собой степени окисления железа в двух соединениях: +2 и +3 соответственно. Это говорит о том, что они содержат ионы Fe 2+ и Fe 3+ .

Это также может быть распространено на отрицательный ион. Сульфат железа(II) FeSO 4 . Существует также соединение FeSO 3 со старым названием сульфит железа(II). Современные названия отражают степени окисления серы в двух соединениях.
Сульфат-ион SO 4 2- . Степень окисления серы +6 (попробуй!). Этот ион правильнее называть ионом сульфата (VI).
Сульфит-ион SO 3 2-. Степень окисления серы равна +4 (и это тоже учтите!). Этот ион правильнее называть ионом сульфата (IV). 9Окончание 1656 ate просто показывает, что сера находится в отрицательном ионе.
Таким образом, FeSO 4 правильно называется сульфатом железа (II) (VI), а FeSO 3 — сульфатом железа (II) (IV). Фактически, из-за того, что эти названия легко спутать, старые названия сульфат и сульфит обычно все еще используются во вводных курсах химии.
Примечание: Даже это не полное имя! Следует также идентифицировать кислород в отрицательных ионах. FeSO 4 правильно называется тетраоксосульфатом (VI) железа (II). Все это немного выходит из-под контроля при повседневном использовании обычных ионов.
FeSO 4 правильно называется тетраоксосульфатом (VI) железа (II). Все это немного выходит из-под контроля при повседневном использовании обычных ионов.
Использование степеней окисления для определения того, что было окислено, а что восстановлено
Это наиболее распространенное использование степеней окисления.
Помните:
Окисление включает повышение степени окисления
Восстановление включает уменьшение степени окисления
В каждом из следующих примеров мы должны решить, включает ли реакция окислительно-восстановительный процесс, и если да, то что было окислено, а что восстановлено.
Пример 1:
Это реакция между магнием и соляной кислотой или газообразным хлористым водородом:
Mg + 2HCl MgCl 2 + H 2
Изменились ли степени окисления чего-либо? Да, они есть — у вас есть два элемента, которые находятся в соединениях с одной стороны уравнения и в виде несвязанных элементов с другой.
 Проверьте все степени окисления, чтобы быть уверенным:.
Проверьте все степени окисления, чтобы быть уверенным:.Повысилась степень окисления магния — он окислился. Степень окисления водорода упала — он восстановился. Хлор находится в одинаковой степени окисления в обеих частях уравнения — он не окисляется и не восстанавливается.
Пример 2:
Реакция между гидроксидом натрия и соляной кислотой:
NaOH + HCl NaCl + H 2 O
Проверка всех степеней окисления:
Ничего не изменилось. Это не окислительно-восстановительная реакция.
Пример 3:
Это подлый! Реакция между хлором и холодным разбавленным раствором гидроксида натрия:
2NaOH + Cl 2 NaCl + NaClO + H 2 O
Очевидно, хлор изменил степень окисления, потому что он оказался в соединениях, начиная с исходного элемента. Проверка всех степеней окисления показывает:
Хлор — это единственная вещь, которая изменила степень окисления.
 Он окислился или восстановился? Да! Оба! Один атом был восстановлен, потому что его степень окисления упала. Второй окислился.
Он окислился или восстановился? Да! Оба! Один атом был восстановлен, потому что его степень окисления упала. Второй окислился.Это хороший пример реакции диспропорционирования . Реакция диспропорционирования – это реакция, при которой одно вещество одновременно окисляется и восстанавливается.
Использование степеней окисления для идентификации окислителя и восстановителя
Это небольшое дополнение к последнему разделу. Если вы знаете, что окислялось, а что восстанавливалось, то вы можете легко определить, что такое окислитель и восстановитель.
Пример 1
Это реакция между ионами хрома (III) и металлическим цинком:
2Cr 3+ + Zn 2Cr 2+ + Zn 2+
Хром перешел из степени окисления +3 в +2 и, таким образом, был восстановлен. Цинк перешел от нулевой степени окисления в элементе к +2. Он был окислен.
Так что же делает сокращение? Это цинк — цинк отдает электроны ионам хрома (III).
 Таким образом, цинк является восстановителем.
Таким образом, цинк является восстановителем.Точно так же вы можете решить, что окислителем должны быть ионы хрома (III), потому что они забирают электроны у цинка.
Пример 2
Это уравнение реакции между ионами манганата(VII) и ионами железа(II) в кислой среде. Это проработано ниже на странице.
MNO 4 — + 8H + + 5FE 2+ MN 2+ + 4H 2 O+ 5FE 3+
При быстром рассмотрении видно, что ионы железа(II) окислились до ионов железа(III). Каждый из них потерял электрон, а их степень окисления увеличилась с +2 до +3.
Водород все еще находится в степени окисления +1 до и после реакции, но ионы манганата (VII) явно изменились. Если посчитать степень окисления марганца, то она упала с +7 до +2 — восстановление.
Итак, ионы железа(II) окислились, а ионы манганата(VII) восстановились.
Что восстановило ионы манганата(VII) — однозначно это ионы железа(II).
 Железо — единственное, что имеет измененную степень окисления. Таким образом, ионы железа (II) являются восстановителем.
Железо — единственное, что имеет измененную степень окисления. Таким образом, ионы железа (II) являются восстановителем.Точно так же ионы манганата(VII) должны быть окислителями.
Использование степеней окисления для расчета пропорций реакции
Это иногда бывает полезно, когда вам нужно определить реакционные пропорции для использования в реакциях титрования, когда у вас недостаточно информации для расчета полного ионного уравнения.
Помните, что каждый раз, когда степень окисления изменяется на одну единицу, передается один электрон. Если степень окисления одного вещества в реакции падает на 2, это означает, что оно приобрело 2 электрона.
Что-то еще в реакции должно терять эти электроны. Любое понижение степени окисления одного вещества должно сопровождаться таким же повышением степени окисления чем-то другим.
Этот пример основан на информации из старого вопроса уровня AQA A’.
Ионы, содержащие церий в степени окисления +4, являются окислителями.
 (Они сложнее, чем просто Ce 4+ .) Они могут окислять ионы, содержащие молибден, от степени окисления +2 до +6 (от Mo 2+ до MoO 4 2-). В процессе церий восстанавливается до степени окисления +3 (Ce 3+ ). Каковы пропорции реакции?
(Они сложнее, чем просто Ce 4+ .) Они могут окислять ионы, содержащие молибден, от степени окисления +2 до +6 (от Mo 2+ до MoO 4 2-). В процессе церий восстанавливается до степени окисления +3 (Ce 3+ ). Каковы пропорции реакции?Степень окисления молибдена увеличивается на 4. Это означает, что степень окисления церия должна упасть на 4, чтобы компенсировать это.
Но степень окисления церия в каждом из его ионов падает только с +4 до +3 — падение на 1. Таким образом, очевидно, что на каждый ион молибдена должно приходиться 4 иона церия.
Реагирующие пропорции: 4 церийсодержащих иона на 1 ион молибдена.
Или взять более распространенный пример с участием ионов железа (II) и ионов манганата (VII). . .
Раствор манганата калия(VII), KMnO 4 , подкисленный разбавленной серной кислотой, окисляет ионы железа(II) до ионов железа(III). При этом ионы манганата(VII) восстанавливаются до ионов марганца(II).
 Используя степени окисления, составьте уравнение реакции.
Используя степени окисления, составьте уравнение реакции.Степень окисления марганца в манганат-ионе (VII) равна +7. Название говорит вам об этом, но попробуйте еще раз, просто для практики!
При переходе к ионам марганца (II) степень окисления марганца упала на 5. Каждый реагирующий ион железа (II) увеличивает свою степень окисления на 1. Это означает, что должно быть пять ионов железа (II), реагирующих на каждый ион манганата(VII).
Таким образом, левая часть уравнения будет:
MnO 4 — + 5Fe 2+ + ?
Правая часть будет:
Mn 2+ + 5Fe 3+ + ?
После этого вам придется гадать, как сбалансировать оставшиеся атомы и заряды. В этом случае, например, вполне вероятно, что кислород окажется в воде. Это означает, что вам нужно откуда-то взять водород.
Это не проблема, потому что у вас есть реакция в растворе кислоты, так что водород вполне может происходить из ионов водорода.

В конце концов, вы получите это:
MNO 4 — + 8H + + 5FE 2+ MN 2+ + 4H 2 O+ 5FE 3+
Лично я предпочел бы вычислять эти уравнения из электронных полууравнений!
Вопросы для проверки вашего понимания
Если это первый набор вопросов, который вы задали, пожалуйста, прочтите вводную страницу, прежде чем начать. Вам нужно будет использовать КНОПКУ НАЗАД в браузере, чтобы вернуться сюда позже.
вопроса о степенях окисления
ответы
Куда бы вы хотели отправиться сейчас?
В меню Redox . . .
В меню неорганической химии. . .
В главное меню . . .
© Джим Кларк, 2002 г. (последнее изменение: ноябрь 2021 г.
 )
)Адаптация степени окисления кобальта за счет галогенидной функциональности в золь-гель кремнеземе
Abstract
Функциональность или степень окисления кобальта в матрице диоксида кремния можно изменить за счет использования катионных поверхностно-активных веществ и их галогенидных противоионов во время золь-гель синтеза. Просто добавляя поверхностно-активное вещество, мы могли значительно увеличить количество кобальта, существующего в виде Co 3 O 4 в кремнеземе, с 44% до 77%, без изменения концентрации предшественника кобальта. Однако, как только отношение поверхностно-активного вещества к кобальту превышало 1, дальнейшее добавление приводило к ингибирующему механизму, при котором измененный пиролиз поверхностно-активного вещества снижал содержание Co 3 О 4 производство. Эти результаты имеют важное значение для производства композитов кобальт/кремнезем, где максимизация функциональной фазы Co 3 O 4 остается целью для широкого спектра каталитических, сенсорных и материальных применений.

Введение
Процесс золь-гель кремнезема представляет собой мощный и в то же время простой подход к синтезу функциональных материалов для датчиков, мембран и оптических приложений. С появлением нанотехнологий область золь-геля кремнезема была значительно расширена, так как множество лигандных и нелигандных шаблонов использовалось в качестве строительных блоков при создании элегантных новых молекулярных структур 1 . Примеры включают использование поверхностно-активных веществ в золь-гель процессе для образования мицелл, ведущих к полым сферам 2 , или полостей в матрице диоксида кремния для подбора размера молекулы и селективности по форме 3,4,5 , или темплатную карбонизацию для противодействовать гидронеустойчивости диоксида кремния 6 . В последнее время внедрение оксидов металлов в матрицы кремнезема добавило дополнительные функциональные возможности. Особое значение имеет то, что оксид кобальта и диоксид кремния стали одними из наиболее предпочтительных функциональных композиционных материалов для широкого спектра применений, включая катализ газовых реакций 9.
 0056 7 или долговременная стабильность при высокотемпературном разделении газов 8 , магнитные материалы и датчики газа 9,10,11 . Предыдущие усилия по катализу были сосредоточены на двухстадийных процедурах синтеза, в которых предшественник кобальта загружают в уже существующую подложку из мезопористого кремнезема путем пропитки раствором с последующим прокаливанием в окислительной атмосфере 12,13,14,15 . Однако параллельная разработка в области мембран использовала метод изготовления в одном реакторе, при котором предшественники кобальта и кремнезема гомогенно смешивались во время золь-гель синтеза 16,17 . В каждом случае кобальт, существующий в виде оксида в каркасе кремнезема, весьма желателен, поскольку его функциональность сильно зависит от его степени окисления. Однако недавние сообщения предполагают, что только небольшая или умеренная фракция кобальта внедрена в виде высоковалентного оксида кобальта (Co 3 O 4 ) внутри кремнеземных или цеолитовых структур 18,19 .
0056 7 или долговременная стабильность при высокотемпературном разделении газов 8 , магнитные материалы и датчики газа 9,10,11 . Предыдущие усилия по катализу были сосредоточены на двухстадийных процедурах синтеза, в которых предшественник кобальта загружают в уже существующую подложку из мезопористого кремнезема путем пропитки раствором с последующим прокаливанием в окислительной атмосфере 12,13,14,15 . Однако параллельная разработка в области мембран использовала метод изготовления в одном реакторе, при котором предшественники кобальта и кремнезема гомогенно смешивались во время золь-гель синтеза 16,17 . В каждом случае кобальт, существующий в виде оксида в каркасе кремнезема, весьма желателен, поскольку его функциональность сильно зависит от его степени окисления. Однако недавние сообщения предполагают, что только небольшая или умеренная фракция кобальта внедрена в виде высоковалентного оксида кобальта (Co 3 O 4 ) внутри кремнеземных или цеолитовых структур 18,19 . Следовательно, увеличение выхода Co 3 O 4 из предшественника кобальта было одной из целей исследований в этой области, тем самым диктуя инновации в процедурах изготовления.
Следовательно, увеличение выхода Co 3 O 4 из предшественника кобальта было одной из целей исследований в этой области, тем самым диктуя инновации в процедурах изготовления.Следуя стратегиям по использованию дополнительных функциональных возможностей материалов на основе диоксида кремния, мы показываем процедуру максимального образования Co 3 O 4 в пористом диоксиде кремния. Мы впервые сообщаем, что степень окисления кобальта в матрице диоксида кремния можно контролировать путем осторожного добавления поверхностно-активного вещества с короткой цепью гексилтриэтиламмонийбромида (HTAB) во время золь-гель синтеза. В частности, мы обнаружили, что галоидные противоионы катионного ГТАВ преимущественно координируются с ионами кобальта во время золь-гель синтеза, что впоследствии усиливает окисление предшественников кобальта до Co 3 O 4 внутри кремнезема. Этот вывод противоречит здравому смыслу, так как HTAB обычно используется в качестве агента, регулирующего размер пор, для увеличения микропористости кремнезема 20,21 вместо адаптации степени окисления кобальта, как сообщается в этой работе.

Результаты
FTIR-спектры (см. Дополнительный рис. S1) прокаленных ксерогелей были подвергнуты деконволюции, и площадь пика для Co 3 O 4 11 при 670 см -1 9005 была нормализована по отношению к площади пика 7 силоксановые мосты 22 при 1080 см -1 . Результаты на рис. 1 показывают увеличение концентрации Co 3 O 4 в прокаленных ксерогелях в зависимости от начального содержания ПАВ, достигая максимума при мольном соотношении ПАВ/кобальт x ~ 1. Эти результаты несовместимо с первоначальным приготовлением золь-геля, когда концентрация предшественника кобальта поддерживалась постоянной для всех образцов и не наблюдалось осаждения или разделения фаз. Важно, что нет силиката кобальта 23 наблюдали при 860 см -1 , что указывает на то, что кобальт присутствует во всех образцах либо в виде Co 3 O 4 , либо в виде Co 2+ , который невозможно обнаружить с помощью FTIR.
Рисунок 1 Просвечивающая электронная микроскопия показала, что частицы Co 3 O 4 размером от 20 до 75 нм были внедрены в матрицу кремнезема со средним размером частиц 40 нм (см. Дополнительную информацию, рис. S2). Измерения дифракции рентгеновских лучей показывают картины, относящиеся к Co 3 O 4 (см. дополнительную информацию на рис. S3). Используя уравнение Шеррера, средний размер кристалла был рассчитан как 32 нм (см. Таблицу дополнительной информации S1). Для подтверждения как отсутствия силиката кобальта, так и присутствия Co 2+ , а также фактического количественного определения выхода Co 3 O 4 был также проведен дополнительный анализ степеней окисления кобальта с помощью XPS. Соответствующие XPS-спектры высокого разрешения областей Co 2p можно найти в дополнительной информации (см. Дополнительный рис. S4), которая подтвердила вышеуказанную гипотезу. Подобно FTIR, результаты XPS (также на рис. 1) ясно показывают, что количество кобальта, присутствующего в форме тетраоксида 24,25 , увеличивается с 44% до 77% для 0 < x < 1, а затем меняет свой эффект на противоположный.
Просвечивающая электронная микроскопия показала, что частицы Co 3 O 4 размером от 20 до 75 нм были внедрены в матрицу кремнезема со средним размером частиц 40 нм (см. Дополнительную информацию, рис. S2). Измерения дифракции рентгеновских лучей показывают картины, относящиеся к Co 3 O 4 (см. дополнительную информацию на рис. S3). Используя уравнение Шеррера, средний размер кристалла был рассчитан как 32 нм (см. Таблицу дополнительной информации S1). Для подтверждения как отсутствия силиката кобальта, так и присутствия Co 2+ , а также фактического количественного определения выхода Co 3 O 4 был также проведен дополнительный анализ степеней окисления кобальта с помощью XPS. Соответствующие XPS-спектры высокого разрешения областей Co 2p можно найти в дополнительной информации (см. Дополнительный рис. S4), которая подтвердила вышеуказанную гипотезу. Подобно FTIR, результаты XPS (также на рис. 1) ясно показывают, что количество кобальта, присутствующего в форме тетраоксида 24,25 , увеличивается с 44% до 77% для 0 < x < 1, а затем меняет свой эффект на противоположный. Следовательно, результаты как FTIR, так и XPS ясно показывают, что поверхностно-активное вещество HTAB изменяет степень окисления оксида кобальта, внедренного в матрицу кремнезема.
Следовательно, результаты как FTIR, так и XPS ясно показывают, что поверхностно-активное вещество HTAB изменяет степень окисления оксида кобальта, внедренного в матрицу кремнезема.Изменение содержания оксида кобальта в зависимости от концентрации поверхностно-активного вещества в прокаленных образцах.
Процент кобальта в пересчете на кобальт 3 O 4 (•) из анализа XPS. Соотношение площадей пиков для Co 3 O 4 к силоксановым связям из анализа FTIR (□). Столбики погрешностей представляют собой интервал стандартной достоверности 95%.
Изображение в полный размер
О функциональности окисления кобальта, достигаемой поверхностно-активным веществом HTAB, которое мы обнаружили в этой работе, ранее не сообщалось. Мы предполагаем, что основной механизм повышенной функциональности Co 3 O 4 заключается в комплексообразовании ионов кобальта с поверхностно-активным веществом HTAB во время золь-гель синтеза.
 Типичные золи кремнезема кобальта обладают характерным красно-розовым цветом, связанным с октаэдрической формой Co 2+ ион в водном растворе 11 . Напротив, добавление HTAB для получения гибридных золей кремнезема поверхностно-активного вещества/кобальта приводило к отчетливому изменению цвета на кобальтово-синий, что характерно для тетраэдрической формы иона Co 2+ . Яркость синего (см. Дополнительный рисунок S5) указывает на координацию ионов кобальта со слабым галогенидным лигандом, таким как бромид 26 . Эти кобальт-галогенидные (например, бромидные) комплексы образуются преимущественно в менее полярных растворителях, чем вода 27,28 , как и в случае с нашими рецептами золь-геля на основе кремнезема. Это визуальное свидетельство было подтверждено с помощью DR-UV-Vis высушенных ксерогелей (см. Дополнительный рисунок S6), что дополнительно указывает на то, что процесс сушки не разрушает комплекс бромида кобальта в матрице кремнезема.
Типичные золи кремнезема кобальта обладают характерным красно-розовым цветом, связанным с октаэдрической формой Co 2+ ион в водном растворе 11 . Напротив, добавление HTAB для получения гибридных золей кремнезема поверхностно-активного вещества/кобальта приводило к отчетливому изменению цвета на кобальтово-синий, что характерно для тетраэдрической формы иона Co 2+ . Яркость синего (см. Дополнительный рисунок S5) указывает на координацию ионов кобальта со слабым галогенидным лигандом, таким как бромид 26 . Эти кобальт-галогенидные (например, бромидные) комплексы образуются преимущественно в менее полярных растворителях, чем вода 27,28 , как и в случае с нашими рецептами золь-геля на основе кремнезема. Это визуальное свидетельство было подтверждено с помощью DR-UV-Vis высушенных ксерогелей (см. Дополнительный рисунок S6), что дополнительно указывает на то, что процесс сушки не разрушает комплекс бромида кобальта в матрице кремнезема. Это отличается от природного диоксида кремния кобальта, где ионы кобальта прочно координируются с силанольными группами или силоксановыми мостиками даже после сушки 19 .
Это отличается от природного диоксида кремния кобальта, где ионы кобальта прочно координируются с силанольными группами или силоксановыми мостиками даже после сушки 19 .При достижении максимума Co 3 O 4 образование при x ~ 1, дальнейшее добавление HTAB после этой точки начало ингибировать выход Co 3 O 4 . В основе этого обратного механизма лежит взаимодействие между кремнеземом, HTAB и частицей оксида кобальта, о чем свидетельствует тонкое изменение изотерм адсорбции азота (см. Дополнительный рисунок S7) и дифференциальный термический анализ (ДТА). Образцы, приготовленные с отношением ПАВ/кобальт × < 1, представляли собой высокомикропористые материалы, характеризующиеся изотермами I типа. Однако когда x > 1, на изотермах азота наблюдалась капиллярная конденсация, ясно указывающая на то, что избыток поверхностно-активного вещества приводит к образованию мезопор в сетке оксида кобальта и кремнезема.
Рисунок 2 Анализ ДТА на рис. 2 показывает, что образцы, приготовленные с x = 0,5, демонстрируют узкий экзотермический пик при ~250°C, обычно связанный со сжиганием HTAB, внедренного в матрицы кремнезема 29 . Однако для образцов, приготовленных с x > 1, пик при ~250°С менее интенсивен, а второй экзотермический пик появился при ~535°С, что противоречит эндотермической области для образцов, приготовленных с x < 1. Этот результат не соответствует ожидаемому взаимодействию поверхностно-активного вещества/диоксида кремния. Хотя из изотерм адсорбции видно, что некоторая часть избытка ПАВ ( x > 1) образует мезопористые структуры, если весь избыток ПАВ приводит к образованию протомицелл и или дополнительно взаимодействует с поверхностью кремнезема, то мы можно ожидать, что интенсивность экзотермического пика при ~250°C будет сильнее, чем у образца x = 0,5. Однако это не так, что позволяет предположить, что насыщение поверхности кремнезема достигнуто и дополнительную роль играет избыток ПАВ.
Анализ ДТА на рис. 2 показывает, что образцы, приготовленные с x = 0,5, демонстрируют узкий экзотермический пик при ~250°C, обычно связанный со сжиганием HTAB, внедренного в матрицы кремнезема 29 . Однако для образцов, приготовленных с x > 1, пик при ~250°С менее интенсивен, а второй экзотермический пик появился при ~535°С, что противоречит эндотермической области для образцов, приготовленных с x < 1. Этот результат не соответствует ожидаемому взаимодействию поверхностно-активного вещества/диоксида кремния. Хотя из изотерм адсорбции видно, что некоторая часть избытка ПАВ ( x > 1) образует мезопористые структуры, если весь избыток ПАВ приводит к образованию протомицелл и или дополнительно взаимодействует с поверхностью кремнезема, то мы можно ожидать, что интенсивность экзотермического пика при ~250°C будет сильнее, чем у образца x = 0,5. Однако это не так, что позволяет предположить, что насыщение поверхности кремнезема достигнуто и дополнительную роль играет избыток ПАВ.
Кривые ДТА, показывающие прокаливание образцов поверхностно-активного кобальта и кремнезема, где x = 0,5 (сплошная красная линия) и 3 (сплошная черная линия).
Изображение полного размера
Чтобы пролить больше света на природу взаимодействия избытка ПАВ, ТГА-МС процесса прокаливания была проведена для образца с наибольшим количеством ПАВ ( x = 3). Результаты на рис. 3 ясно показывают, что CO 2 , NO 2 и Br покидают кремнеземную матрицу при температуре выше 500°C, что полностью соответствует вторичному экзотермическому пику при ~535°C, наблюдаемому через ДТА (рис. 2). Эти наблюдения указывают на присутствие головных групп, прочно прикрепленных к сетке за пределами типичной температуры разложения в поверхностно-активных материалах из чистого диоксида кремния. Следовательно, мы можем сделать вывод, что мономеры поверхностно-активных веществ (особенно головные группы) могут создавать альтернативные взаимодействия либо с кобальтом, либо с координацией Co-Br на ранних стадиях подготовки материала, тем самым вызывая продолжительное термическое разложение во время прокаливания.
Рисунок 3 Следовательно, это нетипичное взаимодействие металла и поверхностно-активного вещества может ингибировать процесс окисления внутри кремнеземной матрицы 9.0056 30,31 .
Следовательно, это нетипичное взаимодействие металла и поверхностно-активного вещества может ингибировать процесс окисления внутри кремнеземной матрицы 9.0056 30,31 .ТГА-МС образца SCoSi 3.0.
Трехмерный график отображает тепловую эволюцию соответствующих видов с а.е.м. выше 50, которые покидают матрицу при температуре от 200 до 450°C в соответствии с типичным процессом разложения HTAB в матрицах кремнезема. Алифатические группы С 4 , С 5 и С 6 наблюдаются при 56, 74 и 84 а.е.м. соответственно, в то время как двойной пик бромистого этила присутствует при 110 а.е.м. Левая вставка: CO 2 9Эволюция 0048 (m/z = 44) в зависимости от температуры. Вставка справа: NO 2 (m/z = 46) и эволюция Br (m/z = 80) с температурой.
Полноразмерное изображение
Обсуждение
Адаптация кобальтовой функциональности в золь-гелевом диоксиде кремния в этой работе за счет взаимодействия с катионным поверхностно-активным веществом и его галогенидными противоионами показана на рис.
Рисунок 4 4. Для низких концентраций поверхностно-активного вещества ( x ≤ 1) комплексообразование противоионов бромида с кобальтом при золь-гель синтезе оставляет ПАВ, в частности N 9Головная группа 0056 + для взаимодействия с поверхностными силанолами в кремнеземной матрице. При прокаливании комплекс бромида кобальта легче окисляется по сравнению с нативным кремнеземом кобальта из-за более слабой тетрагональной координации бромида кобальта (рис. 4 (а) и (б)). Между тем, само поверхностно-активное вещество подвергается отдельному процессу разложения, не связанному с бромидом кобальта, в котором начальная эндотермическая стадия связана с разложением по Гофману (SI – уравнение 1), за которым следует дальнейшее окисление побочных продуктов Хофмана при температуре ниже 400°C (SI – Уравнение 2) 32 .
4. Для низких концентраций поверхностно-активного вещества ( x ≤ 1) комплексообразование противоионов бромида с кобальтом при золь-гель синтезе оставляет ПАВ, в частности N 9Головная группа 0056 + для взаимодействия с поверхностными силанолами в кремнеземной матрице. При прокаливании комплекс бромида кобальта легче окисляется по сравнению с нативным кремнеземом кобальта из-за более слабой тетрагональной координации бромида кобальта (рис. 4 (а) и (б)). Между тем, само поверхностно-активное вещество подвергается отдельному процессу разложения, не связанному с бромидом кобальта, в котором начальная эндотермическая стадия связана с разложением по Гофману (SI – уравнение 1), за которым следует дальнейшее окисление побочных продуктов Хофмана при температуре ниже 400°C (SI – Уравнение 2) 32 .Адаптация степени окисления кобальта за счет функциональности галогенидов внутри сети пор.
(a) Самородный кремнезем кобальта (слева) некальцинированный материал (справа) кальцинированный материал; (b) Поверхностно-активное вещество кобальт-диоксид кремния ( x < 1) (слева) непрокаленный материал (справа) прокаленный материал; (c) Поверхностно-активное вещество кобальт-диоксид кремния ( x > 1) (слева) непрокаленное вещество (в центре) прокаленное вещество (< 400°C) (справа) прокаленное вещество (> 500°C).

Полноразмерное изображение
По мере приближения x к 1 поверхность кремнезема становится насыщенной поверхностно-активными веществами, при дальнейшем добавлении поверхностно-активного вещества ( x > 1), что приводит к образованию мезопористых структур, предполагающих агрегацию поверхностно-активных веществ. В частности, головная группа поверхностно-активного вещества должна взаимодействовать и агрегировать вокруг комплекса бромида кобальта. Это, в свою очередь, ингибирует разложение алифатических хвостов посредством деградации по Гофману, которое вместо этого происходит по механизму крекинга пиролиза (рис. 4 (c), середина), о чем свидетельствует отсутствие эндотермического пика при < 200°C, снижение интенсивности узкого пика ДТА при ~250°С и генерации новых широких экзотермических пиков ДТА при температурах от 250 до 500°С. Однако для ингибирования Co 3 O 4 взаимодействие головной группы ПАВ/бромида кобальта должно оставаться сильно скоординированным; препятствуя процессу окисления и сохраняя состояние Co 2+ аналогично природному кремнезему кобальта (рис.
 4 (в) справа). Тот факт, что головные группы начинают разлагаться только при ~ 535 ° C, а затем по измененному пути разложения (SI — уравнение 3), дает убедительные доказательства этого усиленного взаимодействия.
4 (в) справа). Тот факт, что головные группы начинают разлагаться только при ~ 535 ° C, а затем по измененному пути разложения (SI — уравнение 3), дает убедительные доказательства этого усиленного взаимодействия.Таким образом, мы открыли новую функциональность галогенидов для контроля степени окисления частиц кобальта, встроенных в матрицы кремнезема, и новый метод повышения содержания Co 3 O 4 образование внутри кремнезема было успешно продемонстрировано. Путем комплексообразования галогенидных противоионов катионных поверхностно-активных веществ с кобальтом во время золь-гель синтеза мы смогли эффективно удвоить функциональность или степень окисления кобальта в матрице кремнезема без изменения количества используемого предшественника кобальта. Эти результаты имеют большое значение для производства композитов кобальт/кремнезем, где максимизируется желаемое содержание Co 3 O 4 9Фаза 0048 остается главным приоритетом.
Метод
В типичном синтезе мастер-золь кремнезема кобальта получали путем растворения гексагидрата нитрата кобальта (Co(NO 3 ) 2 .
 6H 2 O) в перекиси водорода (30% масс. в воде). ) и смешивание полученного раствора с этанолом (EtOH) с последующим добавлением по каплям тетраэтоксисилана (TEOS). Конечные молярные соотношения ТЭОС:Н 2 О:Н 2 О 2 :EtOH:Co(NO 3 ) 2 .6H 2 О = 4:45,5:9:256:1 33 . Процесс полимеризации проводят в среде с регулируемым рН благодаря упомянутому выше включению пероксида. Затем синтезировали гибридные поверхностно-активные золи кобальта и кремнезема, сохраняя фиксированное молярное соотношение Co/Si, путем добавления бромида гексилтриэтиламмония (HTAB) в молярных соотношениях для HTAB: Co(NO 3 ) 2 .6H 2 O (упомянутые здесь в качестве молярного соотношения поверхностно-активное вещество/кобальт) от 0,25 до 3 или эквивалентно от 0,47 до 5,4% масс. Избыток этанола обеспечивает адекватные условия для работы значительно ниже критической точки мицеллообразования HTAB при сохранении растворимости поверхностно-активного вещества.
6H 2 O) в перекиси водорода (30% масс. в воде). ) и смешивание полученного раствора с этанолом (EtOH) с последующим добавлением по каплям тетраэтоксисилана (TEOS). Конечные молярные соотношения ТЭОС:Н 2 О:Н 2 О 2 :EtOH:Co(NO 3 ) 2 .6H 2 О = 4:45,5:9:256:1 33 . Процесс полимеризации проводят в среде с регулируемым рН благодаря упомянутому выше включению пероксида. Затем синтезировали гибридные поверхностно-активные золи кобальта и кремнезема, сохраняя фиксированное молярное соотношение Co/Si, путем добавления бромида гексилтриэтиламмония (HTAB) в молярных соотношениях для HTAB: Co(NO 3 ) 2 .6H 2 O (упомянутые здесь в качестве молярного соотношения поверхностно-активное вещество/кобальт) от 0,25 до 3 или эквивалентно от 0,47 до 5,4% масс. Избыток этанола обеспечивает адекватные условия для работы значительно ниже критической точки мицеллообразования HTAB при сохранении растворимости поверхностно-активного вещества. Полученные гомогенные и стабильные гибридные золи (с учетом номенклатуры SCoSi ×, где × относится к молярному соотношению поверхностно-активное вещество/кобальт) сушили при 60°С в течение 96 часов, а затем прокаливали на воздухе при 600°С (скорость линейного изменения 1°С мин -1 и выдержка время 150 минут) для создания окончательных стабильных ксерогелей. Идентификацию и количественную оценку соответствующих функциональных групп диоксида кремния и фаз оксида кобальта проводили с помощью инфракрасной спектрометрии с преобразованием Фурье (FTIR), собранной на Shimadzu IRAffinity-1; спектрометрия диффузного отражения UV-Vis (DR-UV-Vis), собранная на спектрофотометре Varian, оснащенном интегрирующей сферой; и рентгеновская фотоэлектронная спектрометрия (XPS) с использованием рентгеновских лучей Al Kα при 1486,6 эВ (со спектрами, скорректированными до C при 284,6 эВ). Качество продуктов реакции во время термической обработки контролировали с помощью системы термогравиметрического анализа Texas Instruments Q500, связанной с системой газового анализа масс-спектрометра ThermoStar.
Полученные гомогенные и стабильные гибридные золи (с учетом номенклатуры SCoSi ×, где × относится к молярному соотношению поверхностно-активное вещество/кобальт) сушили при 60°С в течение 96 часов, а затем прокаливали на воздухе при 600°С (скорость линейного изменения 1°С мин -1 и выдержка время 150 минут) для создания окончательных стабильных ксерогелей. Идентификацию и количественную оценку соответствующих функциональных групп диоксида кремния и фаз оксида кобальта проводили с помощью инфракрасной спектрометрии с преобразованием Фурье (FTIR), собранной на Shimadzu IRAffinity-1; спектрометрия диффузного отражения UV-Vis (DR-UV-Vis), собранная на спектрофотометре Varian, оснащенном интегрирующей сферой; и рентгеновская фотоэлектронная спектрометрия (XPS) с использованием рентгеновских лучей Al Kα при 1486,6 эВ (со спектрами, скорректированными до C при 284,6 эВ). Качество продуктов реакции во время термической обработки контролировали с помощью системы термогравиметрического анализа Texas Instruments Q500, связанной с системой газового анализа масс-спектрометра ThermoStar. Дифференциальный термический анализ проводили с помощью термогравиметрического анализатора Mettler Toledo TGA/DSC 1 с газовым контроллером GC200. Измерение ПЭМ проводили на просвечивающем электронном микроскопе (ПЭМ) JEOL 1010, работающем при 100 кВ. Структурные данные были получены методом рентгеновской дифракции (XRD) с использованием дифрактометра Bruker D8 Advance с Cu Kα-излучением (40 кВ, 20 мА, λ = 1,5409).А°).
Дифференциальный термический анализ проводили с помощью термогравиметрического анализатора Mettler Toledo TGA/DSC 1 с газовым контроллером GC200. Измерение ПЭМ проводили на просвечивающем электронном микроскопе (ПЭМ) JEOL 1010, работающем при 100 кВ. Структурные данные были получены методом рентгеновской дифракции (XRD) с использованием дифрактометра Bruker D8 Advance с Cu Kα-излучением (40 кВ, 20 мА, λ = 1,5409).А°).Ссылки
Дэвис, М.Э. Заказал пористые материалы для новых применений. Природа 417, 813–821 (2002).
КАС ОБЪЯВЛЕНИЯ Статья Google ученый
Карузо Ф., Карузо Р. А. и Мохвальд Х. Наноинженерия неорганических и гибридных полых сфер методом коллоидного шаблонирования. Наука 282, 1111–1114 (1998).
КАС ОБЪЯВЛЕНИЯ Статья Google ученый
Канезаши, М., Яда, К., Йошиока, Т.
 и Цуру, Т. Органо-неорганические гибридные кремнеземные мембраны с контролируемым размером сетки из кремнезема: подготовка и характеристики газопроницаемости. Дж. Член. науч. 348, 310–318 (2010).
и Цуру, Т. Органо-неорганические гибридные кремнеземные мембраны с контролируемым размером сетки из кремнезема: подготовка и характеристики газопроницаемости. Дж. Член. науч. 348, 310–318 (2010).КАС Статья Google ученый
Cassiers, K. et al. Детальное исследование термической, гидротермической и механической стабильности широкого спектра поверхностно-активных веществ, собранных из мезопористых кремнеземов. хим. Матер. 14, 2317–2324 (2002).
КАС Статья Google ученый
Гроссо, Д. и др. Двумерные гексагональные тонкие пленки мезопористого диоксида кремния, приготовленные из черных сополимеров: подробная характеристика и механизм образования. хим. Матер. 13, 1848–1856 (2001).
КАС Статья Google ученый
Duke, M.C., Diniz da Costa, J.C., Do, D.D., Gray, P.G. & Lu, G.Q. Гидротермально устойчивое молекулярное сито на основе диоксида кремния для разделения влажных газов.
 Доп. Функц. Матер. 16, 1215–1220 (2006).
Доп. Функц. Матер. 16, 1215–1220 (2006).КАС Статья Google ученый
Мартьянов И. Н., Ума С., Родригес С. и Клабунде К. Дж. Обеззараживание газообразного ацетальдегида над ксерогелями SiO2, содержащими CoOx, в условиях окружающей среды в темноте. Ленгмюр 21, 2273–2280 (2005).
КАС Статья Google ученый
Yacou, C., Smart, S. & Diniz da Costa, J.C. Модуль мембраны из оксида кобальта и кремнезема с длительным сроком службы для высокотемпературного разделения h3. Энерг. Окружающая среда. науч. 5, 5820–5832 (2012).
КАС Статья Google ученый
Аль-Бадри, З. М. и др. Магнитные материалы при комнатной температуре из наноструктурированных диблок-сополимеров. Нац. коммун. 2, (2011).
Mattei, G. et al. Синтез, структура и магнитные свойства пленок SiO2, легированных нанокластерами Co, Ni и сплава Co-Ni, методом золь-гель обработки.
 хим. Матер. 14, 3440–3447 (2002).
хим. Матер. 14, 3440–3447 (2002).КАС Статья Google ученый
Ходаков А. Ю., Чу В. и Фонгарланд П. Успехи в разработке новых кобальтовых катализаторов Фишера-Тропша для синтеза длинноцепочечных углеводородов и чистых топлив. хим. 107, 1692–1744 (2007).
КАС Статья Google ученый
Чен, Дж. Ф., Чжан, Ю. Р., Тан, Л. и Чжан, Ю. Простой метод приготовления высокодисперсного нанесенного Co3O4 на подложке из диоксида кремния. Инд.Инж. хим. Рез. 50, 4212–4215 (2011).
КАС Статья Google ученый
Цзя, К.-Дж. и другие. Нанокомпозит Co3O4–SiO2: очень активный катализатор окисления СО с необычным каталитическим поведением. Варенье. хим. соц. 133, 11279–11288 (2011).
КАС Статья Google ученый
Мартинес, А. Н., Лопес, К.
 , Маркес, Ф. и Диас, И. Синтез углеводородов по Фишеру-Тропшу на мезопористых катализаторах Co/SBA-15: влияние металлического наполнения, предшественника кобальта и промоторов . Дж. Катал. 220, 486–499 (2003).
, Маркес, Ф. и Диас, И. Синтез углеводородов по Фишеру-Тропшу на мезопористых катализаторах Co/SBA-15: влияние металлического наполнения, предшественника кобальта и промоторов . Дж. Катал. 220, 486–499 (2003).Артикул Google ученый
Бурикас, К., Кордулис, С., Вакрос, Дж. и Ликоургиотис, А. Адсорбция частиц кобальта на границе раздела между водным раствором и оксидами металлов, используемыми для приготовления нанесенных катализаторов: критическая обзор. Доп. Коллоидный интерфейс Sci. 110, 97–120 (2004).
КАС Статья Google ученый
Ульманн, Д., Смарт, С. и Диниз да Коста, Дж. К. Исследование высокотемпературным паром мембран из оксида кобальта и кремнезема для разделения газов. Сентябрь Пуриф. Технол. 76, 171–178 (2010).
КАС Статья Google ученый
Миллер, Ч. Р., Ван, Д. К., Смарт, С.
 и Диниз да Коста, Дж. К. Обратимый окислительно-восстановительный эффект на газопроницаемость мембран из этоксиполисилоксана (ES40), легированного кобальтом. науч. 3, 1648; 10.1038/srep01648 (2013).
и Диниз да Коста, Дж. К. Обратимый окислительно-восстановительный эффект на газопроницаемость мембран из этоксиполисилоксана (ES40), легированного кобальтом. науч. 3, 1648; 10.1038/srep01648 (2013).КАС ОБЪЯВЛЕНИЯ Статья пабмед ПабМед Центральный Google ученый
Рива Р., Мисснер Х., Витали Р. и Дель Пьеро Г. Взаимодействие металла с подложкой в Co/SiO2 и Co/TiO2. заявл. Катал. A-Gen. 196, 111–123 (2000).
КАС Статья Google ученый
Эспозито, С. и др. Нанокомпозиты смешанных оксидов кобальта и кремния модифицированным золь-гель методом. J. Химия твердого тела. 180, 3341–3350 (2007).
КАС ОБЪЯВЛЕНИЯ Статья Google ученый
Че, С. и др. Синтез и характеристика хирального мезопористого кремнезема. Природа 429, 281–284 (2004).
КАС ОБЪЯВЛЕНИЯ Статья Google ученый
Инагаки С.
 , Гуан С., Осуна Т. и Терасаки О. Упорядоченный мезопористый гибридный кремнийорганический материал с кристаллической структурой стенок. Природа 416, 304–307 (2002).
, Гуан С., Осуна Т. и Терасаки О. Упорядоченный мезопористый гибридный кремнийорганический материал с кристаллической структурой стенок. Природа 416, 304–307 (2002).КАС ОБЪЯВЛЕНИЯ Статья Google ученый
Олейничак З. и др. 29 Si MAS ЯМР и FTIR исследование неорганических-органических гибридных гелей. Дж. Мол. Структура 744–747, 465–471 (2005).
ОБЪЯВЛЕНИЯ Статья Google ученый
Ortega-Zarzosa, G., Araujo-Andrade, C., Compean-Jasso, M.E., Martinez, J.R. & Ruiz, F. Порошки ксерогелей оксида кобальта/диоксида кремния: рентгеновская дифракция, исследования поглощения в инфракрасном и видимом диапазонах. Дж. Сол-Гель. науч. Техн. 24, 23–29(2002).
КАС Статья Google ученый
Окамото Ю. и др. Получение и характеристика высокодисперсных оксидно-сульфидных катализаторов кобальта, нанесенных на SiO2.
 Дж. Физ. хим. 95, 310–319 (1991).
Дж. Физ. хим. 95, 310–319 (1991).КАС Статья Google ученый
Тан, Б. Дж., Клабунде, К. Дж. и Шервуд, П. М. А. XPS-исследования катализаторов с диспергированными сольватированными атомами металлов — доказательства присутствия кобальт-марганцевых частиц на оксиде алюминия и кремнеземе. Варенье. хим. соц. 113, 855–861 (1991).
КАС Статья Google ученый
Fine, D. A. Галогенидные комплексы кобальта (II) в растворе ацетона. Варенье. хим. соц. 84, 1139–1144 (1962).
КАС Статья Google ученый
Wertz, D.L. & Kruh, R.F. Взаимодействие растворенного вещества с растворителем в некоторых концентрированных растворах бромида кобальта (II). неорг. хим. 9, 595–598 (1970).
КАС Статья Google ученый
Бобтельский М. и Шпиглер К.
 С. Галогенид кобальта и тиоцианатные комплексы в этилово-спиртовом растворе. Дж. Хим. соц. 143–148 (1949).
С. Галогенид кобальта и тиоцианатные комплексы в этилово-спиртовом растворе. Дж. Хим. соц. 143–148 (1949).Кляйц, Ф., Шмидт, В. и Шют, Ф. Поведение при кальцинировании различных мезоструктурированных кремнеземных материалов с шаблоном поверхностно-активного вещества. Микропор. Месопор. Мат. 65, 1–29 (2003).
КАС Статья Google ученый
de Souza, LKC, Pardauil, JJR, Zamian, JR, da Rocha, G.N. & da Costa, C.E.F. Влияние включенного металла на удаление темплата из мезопористых материалов типа MCM-41. Дж. Терм. Анальный. Калорим. 106, 355–361 (2011).
Артикул Google ученый
Говорек Дж., Кирис А., Гак В., Боровка А. и Кусак Р. Термическое разложение ЦТАБ в свежесинтезированном МСМ-41. Дж. Терм. Анальный. Калорим. 96, 375–382 (2009).
КАС Статья Google ученый
Кляйц Ф.
 , Шмидт В. и Шют Ф. Эволюция мезопористых материалов в процессе прокаливания: структурное и химическое поведение. Микропор. Месопор. Мат. 44–45, 95–109 (2001).
, Шмидт В. и Шют Ф. Эволюция мезопористых материалов в процессе прокаливания: структурное и химическое поведение. Микропор. Месопор. Мат. 44–45, 95–109 (2001).Артикул Google ученый
Ульманн Д., Лю С., Ладевиг Б. П. и Диниз да Коста Дж. К. Мембраны из диоксида кремния, легированные кобальтом, для разделения газов. Дж. Член. науч. 326, 316–321 (2009).
КАС Статья Google ученый
Ссылки на скачивание
Благодарности
Авторы хотели бы выразить благодарность Австралийскому исследовательскому совету за финансовую поддержку через грант проекта Discovery DP110101185. Джанни Ольгин также признателен правительству Чили за финансовую поддержку двухсотлетней программы стипендий. Авторы выражают благодарность д-ру Уэйду Мартенсу из Технологического университета Квинсленда за помощь в проведении ТГА/МС, а также средства, научную и техническую помощь д-ру Барри Вуду из Австралийского исследовательского центра микроскопии и микроанализа в Центре микроскопии и микроанализа, Университет Квинсленда.

Информация об авторе
Авторы и организации
Университет Квинсленда, FIMLab – Лаборатория пленок и неорганических мембран, Школа химического машиностроения, Брисбен, Австралия, Qld 4072
Diniz da Costa
Папский католический университет Вальпараисо, Escuela de Ingeniería Química, Chile, Valparaiso
Gianni Olguin
Авторы
- Gianni Olguin
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Christelle Yacou
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Саймон Смарт
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- João C. Diniz da Costa
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Вклады
GO провел эксперименты и подготовил первый вариант рукописи, включая все рисунки и дополнительную информацию.
 С.С., С.Ю. и J.C.D.C. способствовал анализу и обсуждению результатов и окончательному процессу написания. Все авторы написали, прочитали и исправили окончательную рукопись перед отправкой.
С.С., С.Ю. и J.C.D.C. способствовал анализу и обсуждению результатов и окончательному процессу написания. Все авторы написали, прочитали и исправили окончательную рукопись перед отправкой.Декларации этики
Конкурирующие интересы
Авторы не заявляют об отсутствии конкурирующих финансовых интересов.
Дополнительные электронные материалы
Дополнительная информация
Дополнительная информация
Права и разрешения
Эта работа находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivs 3.0 Unported License. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by-nc-nd/3.0/
Перепечатка и разрешения
Об этой статье
Дополнительная литература
Модуляция микропористых/мезопористых структур в кобальт-кремнеземе собственного изготовления
- Дана Л.
 Мартенс
Мартенс - Дэвид К. Ван
- Жоао С. Диниз да Коста
Научные отчеты (2015)
- Дана Л.
Наноразмерная сборка кремнезема лантана с плотными и пористыми межфазными структурами
- Бенджамин Баллинджер
- Юлиус Мотузас
- Жоао С.






 к кислород более электроотрицательный) дает заряд на атоме C, он равен +2 (Cº-2e→C²), связь же C-H заряд -1, значит общий заряд на атоме C равняется: (2-1=1)+1.
к кислород более электроотрицательный) дает заряд на атоме C, он равен +2 (Cº-2e→C²), связь же C-H заряд -1, значит общий заряд на атоме C равняется: (2-1=1)+1. Например, Na0, H02, P04
Например, Na0, H02, P04 Например, в соляной кислоте H+1Cl-1 (+1 и -1 = 0), а в сернистой кислоте h3+1S+4O3-2(+1 * 2 = +2 у водорода,+4 у серы и -2 * 3 = – 6 у кислорода; в сумме +6 и -6 дают 0).
Например, в соляной кислоте H+1Cl-1 (+1 и -1 = 0), а в сернистой кислоте h3+1S+4O3-2(+1 * 2 = +2 у водорода,+4 у серы и -2 * 3 = – 6 у кислорода; в сумме +6 и -6 дают 0). Теперь важно обратить внимание на количество атомов в соединении.
Теперь важно обратить внимание на количество атомов в соединении.

 Степень окисления F во всех соединениях равна « -1». Na+1 F-1, H+1 F-1
Степень окисления F во всех соединениях равна « -1». Na+1 F-1, H+1 F-1

 Пусть х — искомая степень окисления. Составляем простейшее уравнение: х + 3*(+1) = 0. Решение очевидно: х = -3. Ответ: N -3 H 3 +1 .
Пусть х — искомая степень окисления. Составляем простейшее уравнение: х + 3*(+1) = 0. Решение очевидно: х = -3. Ответ: N -3 H 3 +1 . е., -3. Уравнение: х + 4*(-2) = -3. Ответ: As(+5), O(-2).
е., -3. Уравнение: х + 4*(-2) = -3. Ответ: As(+5), O(-2).


 У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе (максимальная положительная степень окисления меди и серебра равна +2, золота +3).
У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе (максимальная положительная степень окисления меди и серебра равна +2, золота +3). Общий заряд соединения AlCl 3 равен нулю. Поскольку нам известно, что ионы Cl — имеют заряд -1, и в соединении содержится 3 таких иона, для общей нейтральности рассматриваемого вещества ион Al должен иметь заряд +3. Таким образом, в данном случае степень окисления алюминия равна +3.
Общий заряд соединения AlCl 3 равен нулю. Поскольку нам известно, что ионы Cl — имеют заряд -1, и в соединении содержится 3 таких иона, для общей нейтральности рассматриваемого вещества ион Al должен иметь заряд +3. Таким образом, в данном случае степень окисления алюминия равна +3.
 Если атом не подпадает ни под одно правило из перечисленных выше, и вы не знаете его заряда (например, атом входит в состав комплекса, и его заряд не указан), вы можете установить степень окисления такого атома методом исключения. Вначале определите заряд всех остальных атомов соединения, а затем из известного общего заряда соединения вычислите степень окисления данного атома.
Если атом не подпадает ни под одно правило из перечисленных выше, и вы не знаете его заряда (например, атом входит в состав комплекса, и его заряд не указан), вы можете установить степень окисления такого атома методом исключения. Вначале определите заряд всех остальных атомов соединения, а затем из известного общего заряда соединения вычислите степень окисления данного атома.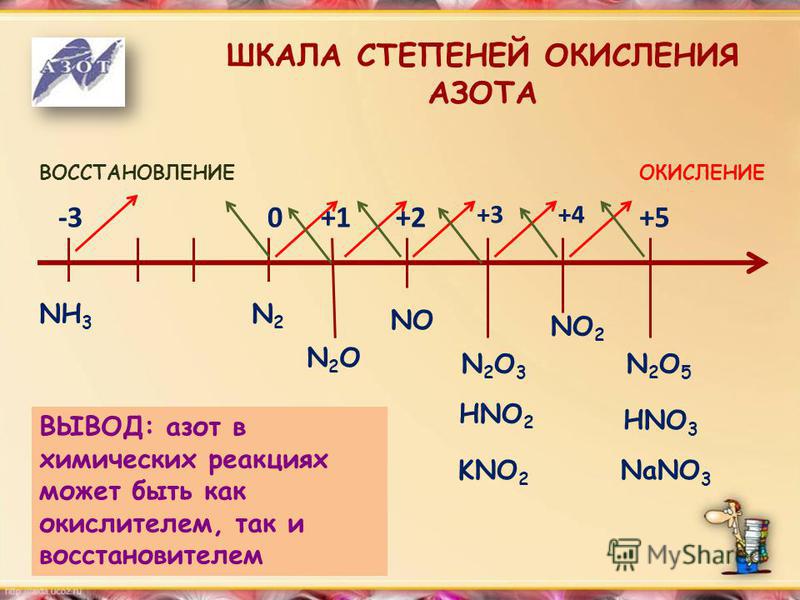

 Имеется только один 5s электрон.
Имеется только один 5s электрон. Потеря 2 электронов не меняет полную d-орбиталь. Нейтральный скандий записывается как [Ar]4s 2 3d 1 . Потеря 3 электронов приводит конфигурацию в благородное состояние с валентностью 3p 6 .
Потеря 2 электронов не меняет полную d-орбиталь. Нейтральный скандий записывается как [Ar]4s 2 3d 1 . Потеря 3 электронов приводит конфигурацию в благородное состояние с валентностью 3p 6 . Таким образом, соединения марганца варьируются от Mn(0) в виде Mn (s) , Mn(II) в виде MnO, Mn(II, III) в виде Mn 3 O 4 , Mn(IV) в виде MnO 2 , или диоксид марганца, Mn(VII) в перманганат-ионе MnO 4 — и так далее.
Таким образом, соединения марганца варьируются от Mn(0) в виде Mn (s) , Mn(II) в виде MnO, Mn(II, III) в виде Mn 3 O 4 , Mn(IV) в виде MnO 2 , или диоксид марганца, Mn(VII) в перманганат-ионе MnO 4 — и так далее.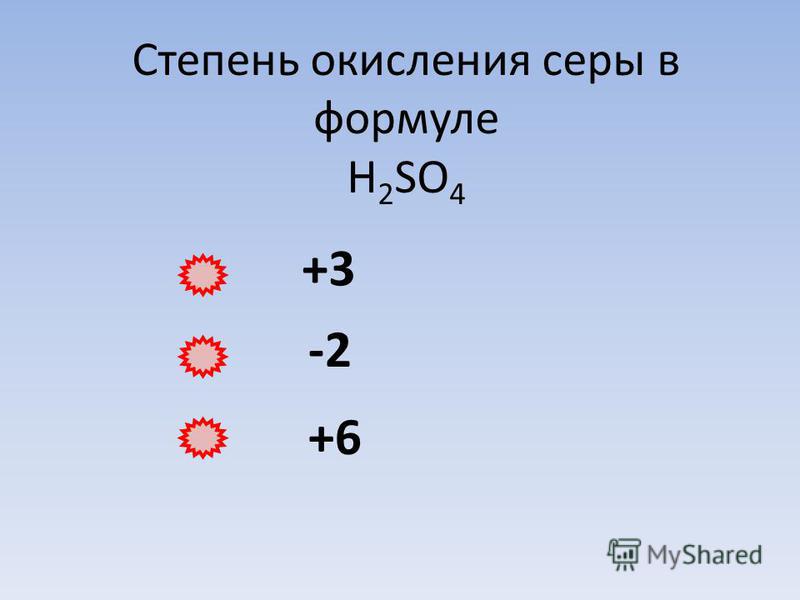 В растениях марганец требуется в следовых количествах; более сильные дозы начинают вступать в реакцию с ферментами и подавляют некоторые клеточные функции. Из-за гибкости марганца в принятии многих степеней окисления он становится хорошим примером для описания общих тенденций и концепций, лежащих в основе электронных конфигураций.
В растениях марганец требуется в следовых количествах; более сильные дозы начинают вступать в реакцию с ферментами и подавляют некоторые клеточные функции. Из-за гибкости марганца в принятии многих степеней окисления он становится хорошим примером для описания общих тенденций и концепций, лежащих в основе электронных конфигураций.
 е. щелочные металлы и щелочноземельные металлы)?
е. щелочные металлы и щелочноземельные металлы)?

 933194
933194
 Он является ферромагнитным при температуре до 1121 ° C (2050 ° F, самая высокая известная точка Кюри для любого металла или сплава) и может найти применение там, где необходимы магнитные свойства при повышенных температурах.
Он является ферромагнитным при температуре до 1121 ° C (2050 ° F, самая высокая известная точка Кюри для любого металла или сплава) и может найти применение там, где необходимы магнитные свойства при повышенных температурах.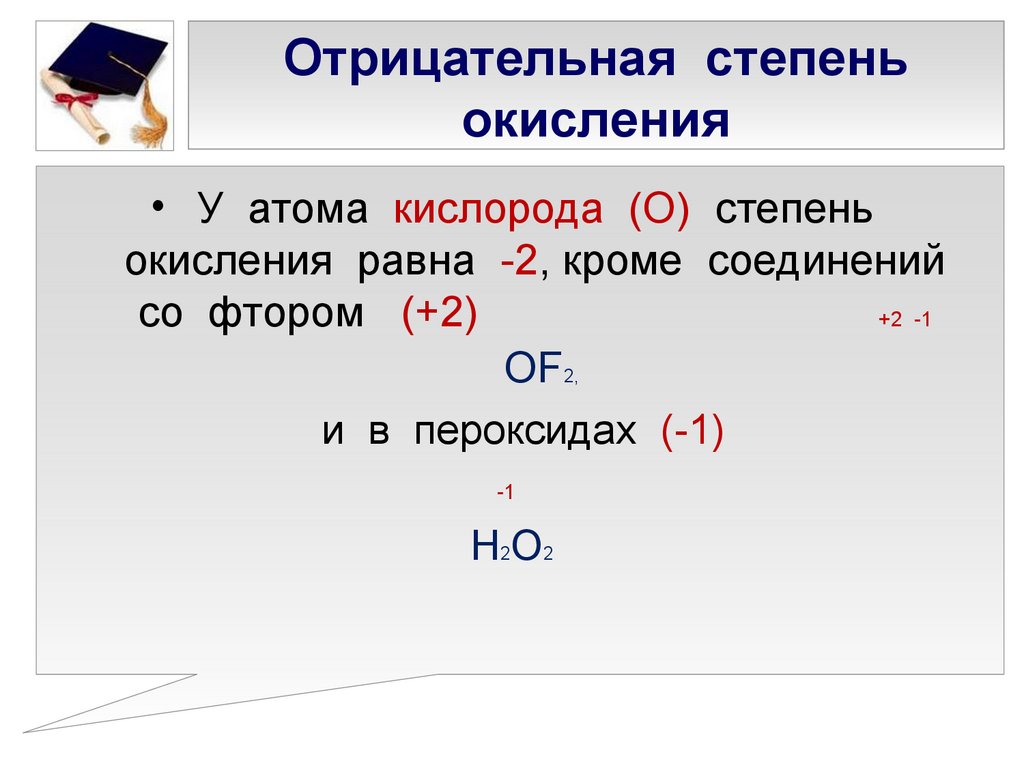 Гамма-излучение кобальта-60 использовалось вместо рентгеновского или альфа-излучения радия при проверке промышленных материалов для выявления внутренней структуры, дефектов или посторонних предметов. Он также использовался в терапии рака, в исследованиях по стерилизации, а также в биологии и промышленности в качестве радиоактивного индикатора.
Гамма-излучение кобальта-60 использовалось вместо рентгеновского или альфа-излучения радия при проверке промышленных материалов для выявления внутренней структуры, дефектов или посторонних предметов. Он также использовался в терапии рака, в исследованиях по стерилизации, а также в биологии и промышленности в качестве радиоактивного индикатора.
 Последний содержит кобальт в обеих степенях окисления +2 и +3 и составляет до 40% товарного оксида кобальта, используемого в производстве керамики, стекла и эмали, а также при приготовлении катализаторов и порошка металлического кобальта.
Последний содержит кобальт в обеих степенях окисления +2 и +3 и составляет до 40% товарного оксида кобальта, используемого в производстве керамики, стекла и эмали, а также при приготовлении катализаторов и порошка металлического кобальта.
 В последние годы мировое производство кобальта неуклонно растет.
почти утроился с 1993 года. Доминирование африканских производителей меди и кобальта
сменилось более равномерным распределением выпуска продукции между ведущими
страны-производители, включая Канаду, Норвегию и совсем недавно Австралию,
вместе с экспортом из России, замещая выпадающее производство в
Демократическая Республика Конго (Заир). Наибольший рост производства кобальта
родом из Финляндии, где производство выросло более чем на 16% между 1990 и 2002.
В последние годы мировое производство кобальта неуклонно растет.
почти утроился с 1993 года. Доминирование африканских производителей меди и кобальта
сменилось более равномерным распределением выпуска продукции между ведущими
страны-производители, включая Канаду, Норвегию и совсем недавно Австралию,
вместе с экспортом из России, замещая выпадающее производство в
Демократическая Республика Конго (Заир). Наибольший рост производства кобальта
родом из Финляндии, где производство выросло более чем на 16% между 1990 и 2002.


 aq →
СоХ 2
aq →
СоХ 2  Это был первый комплекс, который удалось разложить на оптические изомеры.
который не содержал атомов углерода. С тех пор были найдены только три или четыре других.
Это был первый комплекс, который удалось разложить на оптические изомеры.
который не содержал атомов углерода. С тех пор были найдены только три или четыре других.
 Вернер подумал, что это тоже
включает пероксогруппу, но в данном случае мостик между Co (III) и Co (IV)
атомы.
Вернер подумал, что это тоже
включает пероксогруппу, но в данном случае мостик между Co (III) и Co (IV)
атомы. 
 Структуры 4, 5 и 6 согласованы с
либо без мостиковых хлоридов, либо с моно- или димостиковыми хлоридами.
Структуры 4, 5 и 6 согласованы с
либо без мостиковых хлоридов, либо с моно- или димостиковыми хлоридами.  Ссылки проверены и/или последние.
изменено 28 сентября 2020 г.
Ссылки проверены и/или последние.
изменено 28 сентября 2020 г. 
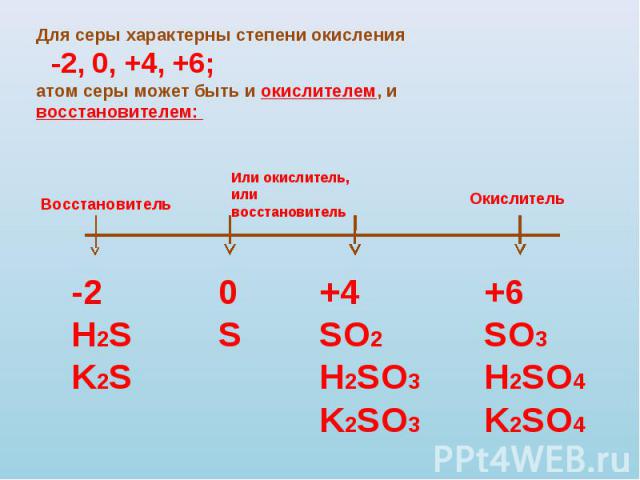
 1021/acs.inorgchem.1c03020
1021/acs.inorgchem.1c03020





 Это очевидно, потому что он еще не окислился и не восстановился! Это применимо к любой структуре элемента — будь то, например, Xe или Cl 2 или S 8 , или имеет ли он гигантскую структуру, как углерод или кремний.
Это очевидно, потому что он еще не окислился и не восстановился! Это применимо к любой структуре элемента — будь то, например, Xe или Cl 2 или S 8 , или имеет ли он гигантскую структуру, как углерод или кремний. ниже)
ниже)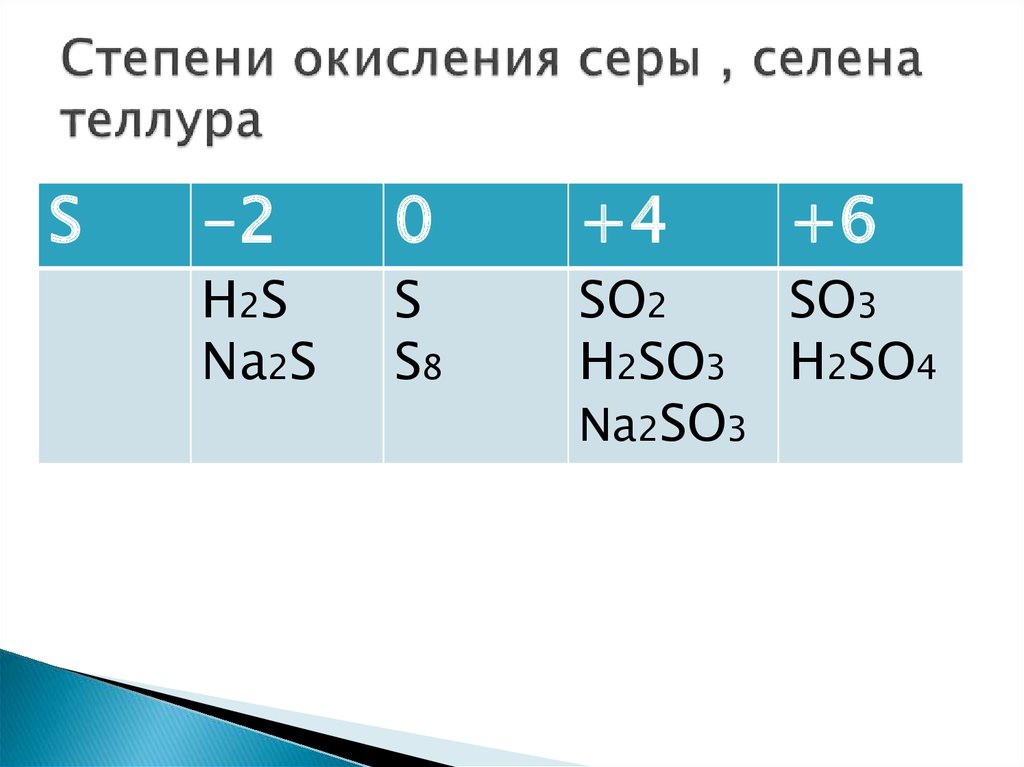 В нем водород присутствует в виде иона гидрида, H —. Степень окисления простого иона, такого как гидрид, равна заряду иона, в данном случае -1.
В нем водород присутствует в виде иона гидрида, H —. Степень окисления простого иона, такого как гидрид, равна заряду иона, в данном случае -1. В этом случае кислород имеет степень окисления +2.
В этом случае кислород имеет степень окисления +2. Если степень окисления хрома н :
Если степень окисления хрома н :
 (Могут быть и другие, но я не могу о них сейчас думать!)
(Могут быть и другие, но я не могу о них сейчас думать!)
 FeSO 4 правильно называется тетраоксосульфатом (VI) железа (II). Все это немного выходит из-под контроля при повседневном использовании обычных ионов.
FeSO 4 правильно называется тетраоксосульфатом (VI) железа (II). Все это немного выходит из-под контроля при повседневном использовании обычных ионов.  Проверьте все степени окисления, чтобы быть уверенным:.
Проверьте все степени окисления, чтобы быть уверенным:. Он окислился или восстановился? Да! Оба! Один атом был восстановлен, потому что его степень окисления упала. Второй окислился.
Он окислился или восстановился? Да! Оба! Один атом был восстановлен, потому что его степень окисления упала. Второй окислился. Таким образом, цинк является восстановителем.
Таким образом, цинк является восстановителем. Железо — единственное, что имеет измененную степень окисления. Таким образом, ионы железа (II) являются восстановителем.
Железо — единственное, что имеет измененную степень окисления. Таким образом, ионы железа (II) являются восстановителем. (Они сложнее, чем просто Ce 4+ .) Они могут окислять ионы, содержащие молибден, от степени окисления +2 до +6 (от Mo 2+ до MoO 4 2-). В процессе церий восстанавливается до степени окисления +3 (Ce 3+ ). Каковы пропорции реакции?
(Они сложнее, чем просто Ce 4+ .) Они могут окислять ионы, содержащие молибден, от степени окисления +2 до +6 (от Mo 2+ до MoO 4 2-). В процессе церий восстанавливается до степени окисления +3 (Ce 3+ ). Каковы пропорции реакции?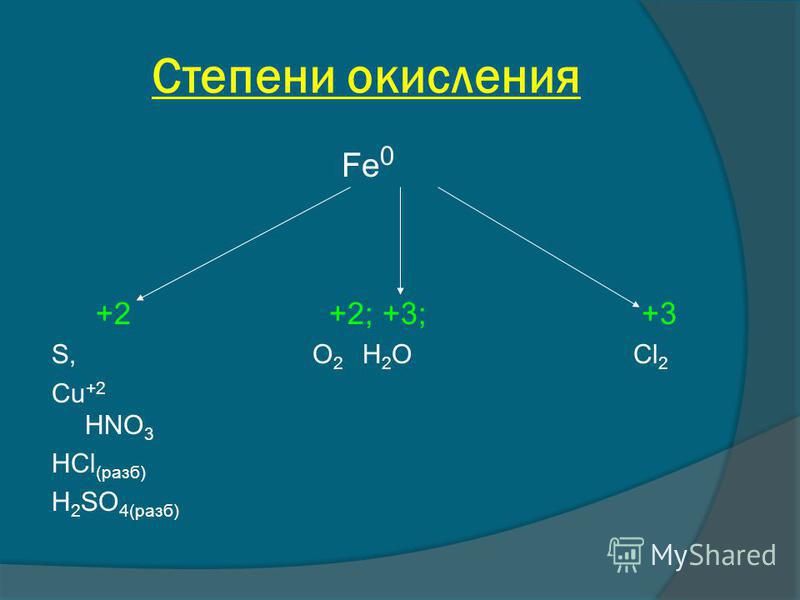 Используя степени окисления, составьте уравнение реакции.
Используя степени окисления, составьте уравнение реакции.
 )
)
 0056 7 или долговременная стабильность при высокотемпературном разделении газов 8 , магнитные материалы и датчики газа 9,10,11 . Предыдущие усилия по катализу были сосредоточены на двухстадийных процедурах синтеза, в которых предшественник кобальта загружают в уже существующую подложку из мезопористого кремнезема путем пропитки раствором с последующим прокаливанием в окислительной атмосфере 12,13,14,15 . Однако параллельная разработка в области мембран использовала метод изготовления в одном реакторе, при котором предшественники кобальта и кремнезема гомогенно смешивались во время золь-гель синтеза 16,17 . В каждом случае кобальт, существующий в виде оксида в каркасе кремнезема, весьма желателен, поскольку его функциональность сильно зависит от его степени окисления. Однако недавние сообщения предполагают, что только небольшая или умеренная фракция кобальта внедрена в виде высоковалентного оксида кобальта (Co 3 O 4 ) внутри кремнеземных или цеолитовых структур 18,19 .
0056 7 или долговременная стабильность при высокотемпературном разделении газов 8 , магнитные материалы и датчики газа 9,10,11 . Предыдущие усилия по катализу были сосредоточены на двухстадийных процедурах синтеза, в которых предшественник кобальта загружают в уже существующую подложку из мезопористого кремнезема путем пропитки раствором с последующим прокаливанием в окислительной атмосфере 12,13,14,15 . Однако параллельная разработка в области мембран использовала метод изготовления в одном реакторе, при котором предшественники кобальта и кремнезема гомогенно смешивались во время золь-гель синтеза 16,17 . В каждом случае кобальт, существующий в виде оксида в каркасе кремнезема, весьма желателен, поскольку его функциональность сильно зависит от его степени окисления. Однако недавние сообщения предполагают, что только небольшая или умеренная фракция кобальта внедрена в виде высоковалентного оксида кобальта (Co 3 O 4 ) внутри кремнеземных или цеолитовых структур 18,19 .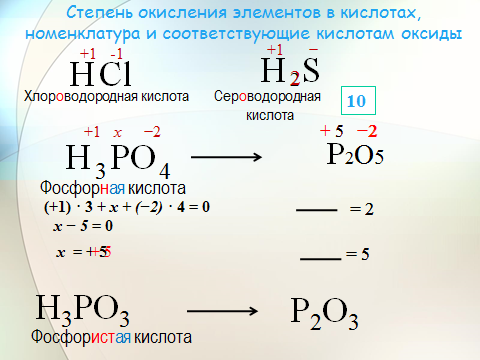 Следовательно, увеличение выхода Co 3 O 4 из предшественника кобальта было одной из целей исследований в этой области, тем самым диктуя инновации в процедурах изготовления.
Следовательно, увеличение выхода Co 3 O 4 из предшественника кобальта было одной из целей исследований в этой области, тем самым диктуя инновации в процедурах изготовления.
 Просвечивающая электронная микроскопия показала, что частицы Co 3 O 4 размером от 20 до 75 нм были внедрены в матрицу кремнезема со средним размером частиц 40 нм (см. Дополнительную информацию, рис. S2). Измерения дифракции рентгеновских лучей показывают картины, относящиеся к Co 3 O 4 (см. дополнительную информацию на рис. S3). Используя уравнение Шеррера, средний размер кристалла был рассчитан как 32 нм (см. Таблицу дополнительной информации S1). Для подтверждения как отсутствия силиката кобальта, так и присутствия Co 2+ , а также фактического количественного определения выхода Co 3 O 4 был также проведен дополнительный анализ степеней окисления кобальта с помощью XPS. Соответствующие XPS-спектры высокого разрешения областей Co 2p можно найти в дополнительной информации (см. Дополнительный рис. S4), которая подтвердила вышеуказанную гипотезу. Подобно FTIR, результаты XPS (также на рис. 1) ясно показывают, что количество кобальта, присутствующего в форме тетраоксида 24,25 , увеличивается с 44% до 77% для 0 < x < 1, а затем меняет свой эффект на противоположный.
Просвечивающая электронная микроскопия показала, что частицы Co 3 O 4 размером от 20 до 75 нм были внедрены в матрицу кремнезема со средним размером частиц 40 нм (см. Дополнительную информацию, рис. S2). Измерения дифракции рентгеновских лучей показывают картины, относящиеся к Co 3 O 4 (см. дополнительную информацию на рис. S3). Используя уравнение Шеррера, средний размер кристалла был рассчитан как 32 нм (см. Таблицу дополнительной информации S1). Для подтверждения как отсутствия силиката кобальта, так и присутствия Co 2+ , а также фактического количественного определения выхода Co 3 O 4 был также проведен дополнительный анализ степеней окисления кобальта с помощью XPS. Соответствующие XPS-спектры высокого разрешения областей Co 2p можно найти в дополнительной информации (см. Дополнительный рис. S4), которая подтвердила вышеуказанную гипотезу. Подобно FTIR, результаты XPS (также на рис. 1) ясно показывают, что количество кобальта, присутствующего в форме тетраоксида 24,25 , увеличивается с 44% до 77% для 0 < x < 1, а затем меняет свой эффект на противоположный.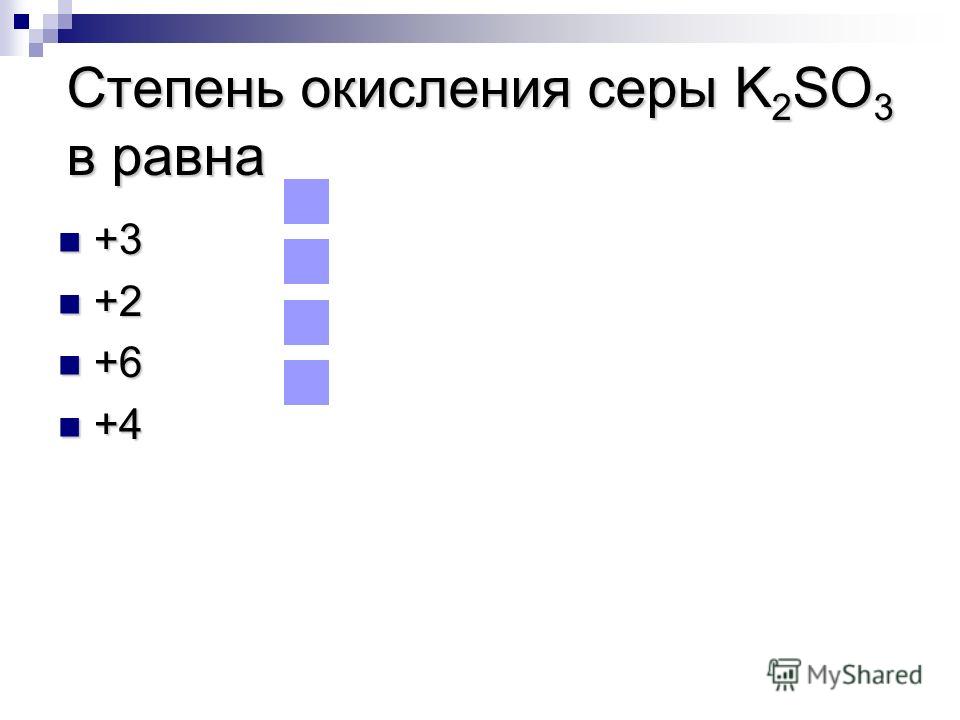 Следовательно, результаты как FTIR, так и XPS ясно показывают, что поверхностно-активное вещество HTAB изменяет степень окисления оксида кобальта, внедренного в матрицу кремнезема.
Следовательно, результаты как FTIR, так и XPS ясно показывают, что поверхностно-активное вещество HTAB изменяет степень окисления оксида кобальта, внедренного в матрицу кремнезема. Типичные золи кремнезема кобальта обладают характерным красно-розовым цветом, связанным с октаэдрической формой Co 2+ ион в водном растворе 11 . Напротив, добавление HTAB для получения гибридных золей кремнезема поверхностно-активного вещества/кобальта приводило к отчетливому изменению цвета на кобальтово-синий, что характерно для тетраэдрической формы иона Co 2+ . Яркость синего (см. Дополнительный рисунок S5) указывает на координацию ионов кобальта со слабым галогенидным лигандом, таким как бромид 26 . Эти кобальт-галогенидные (например, бромидные) комплексы образуются преимущественно в менее полярных растворителях, чем вода 27,28 , как и в случае с нашими рецептами золь-геля на основе кремнезема. Это визуальное свидетельство было подтверждено с помощью DR-UV-Vis высушенных ксерогелей (см. Дополнительный рисунок S6), что дополнительно указывает на то, что процесс сушки не разрушает комплекс бромида кобальта в матрице кремнезема.
Типичные золи кремнезема кобальта обладают характерным красно-розовым цветом, связанным с октаэдрической формой Co 2+ ион в водном растворе 11 . Напротив, добавление HTAB для получения гибридных золей кремнезема поверхностно-активного вещества/кобальта приводило к отчетливому изменению цвета на кобальтово-синий, что характерно для тетраэдрической формы иона Co 2+ . Яркость синего (см. Дополнительный рисунок S5) указывает на координацию ионов кобальта со слабым галогенидным лигандом, таким как бромид 26 . Эти кобальт-галогенидные (например, бромидные) комплексы образуются преимущественно в менее полярных растворителях, чем вода 27,28 , как и в случае с нашими рецептами золь-геля на основе кремнезема. Это визуальное свидетельство было подтверждено с помощью DR-UV-Vis высушенных ксерогелей (см. Дополнительный рисунок S6), что дополнительно указывает на то, что процесс сушки не разрушает комплекс бромида кобальта в матрице кремнезема. Это отличается от природного диоксида кремния кобальта, где ионы кобальта прочно координируются с силанольными группами или силоксановыми мостиками даже после сушки 19 .
Это отличается от природного диоксида кремния кобальта, где ионы кобальта прочно координируются с силанольными группами или силоксановыми мостиками даже после сушки 19 . Анализ ДТА на рис. 2 показывает, что образцы, приготовленные с x = 0,5, демонстрируют узкий экзотермический пик при ~250°C, обычно связанный со сжиганием HTAB, внедренного в матрицы кремнезема 29 . Однако для образцов, приготовленных с x > 1, пик при ~250°С менее интенсивен, а второй экзотермический пик появился при ~535°С, что противоречит эндотермической области для образцов, приготовленных с x < 1. Этот результат не соответствует ожидаемому взаимодействию поверхностно-активного вещества/диоксида кремния. Хотя из изотерм адсорбции видно, что некоторая часть избытка ПАВ ( x > 1) образует мезопористые структуры, если весь избыток ПАВ приводит к образованию протомицелл и или дополнительно взаимодействует с поверхностью кремнезема, то мы можно ожидать, что интенсивность экзотермического пика при ~250°C будет сильнее, чем у образца x = 0,5. Однако это не так, что позволяет предположить, что насыщение поверхности кремнезема достигнуто и дополнительную роль играет избыток ПАВ.
Анализ ДТА на рис. 2 показывает, что образцы, приготовленные с x = 0,5, демонстрируют узкий экзотермический пик при ~250°C, обычно связанный со сжиганием HTAB, внедренного в матрицы кремнезема 29 . Однако для образцов, приготовленных с x > 1, пик при ~250°С менее интенсивен, а второй экзотермический пик появился при ~535°С, что противоречит эндотермической области для образцов, приготовленных с x < 1. Этот результат не соответствует ожидаемому взаимодействию поверхностно-активного вещества/диоксида кремния. Хотя из изотерм адсорбции видно, что некоторая часть избытка ПАВ ( x > 1) образует мезопористые структуры, если весь избыток ПАВ приводит к образованию протомицелл и или дополнительно взаимодействует с поверхностью кремнезема, то мы можно ожидать, что интенсивность экзотермического пика при ~250°C будет сильнее, чем у образца x = 0,5. Однако это не так, что позволяет предположить, что насыщение поверхности кремнезема достигнуто и дополнительную роль играет избыток ПАВ.
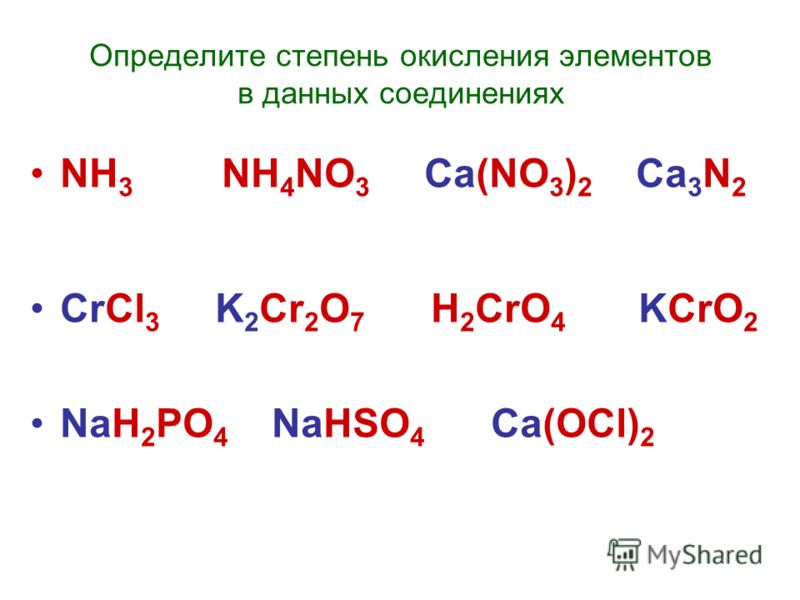 Следовательно, это нетипичное взаимодействие металла и поверхностно-активного вещества может ингибировать процесс окисления внутри кремнеземной матрицы 9.0056 30,31 .
Следовательно, это нетипичное взаимодействие металла и поверхностно-активного вещества может ингибировать процесс окисления внутри кремнеземной матрицы 9.0056 30,31 . 4. Для низких концентраций поверхностно-активного вещества ( x ≤ 1) комплексообразование противоионов бромида с кобальтом при золь-гель синтезе оставляет ПАВ, в частности N 9Головная группа 0056 + для взаимодействия с поверхностными силанолами в кремнеземной матрице. При прокаливании комплекс бромида кобальта легче окисляется по сравнению с нативным кремнеземом кобальта из-за более слабой тетрагональной координации бромида кобальта (рис. 4 (а) и (б)). Между тем, само поверхностно-активное вещество подвергается отдельному процессу разложения, не связанному с бромидом кобальта, в котором начальная эндотермическая стадия связана с разложением по Гофману (SI – уравнение 1), за которым следует дальнейшее окисление побочных продуктов Хофмана при температуре ниже 400°C (SI – Уравнение 2) 32 .
4. Для низких концентраций поверхностно-активного вещества ( x ≤ 1) комплексообразование противоионов бромида с кобальтом при золь-гель синтезе оставляет ПАВ, в частности N 9Головная группа 0056 + для взаимодействия с поверхностными силанолами в кремнеземной матрице. При прокаливании комплекс бромида кобальта легче окисляется по сравнению с нативным кремнеземом кобальта из-за более слабой тетрагональной координации бромида кобальта (рис. 4 (а) и (б)). Между тем, само поверхностно-активное вещество подвергается отдельному процессу разложения, не связанному с бромидом кобальта, в котором начальная эндотермическая стадия связана с разложением по Гофману (SI – уравнение 1), за которым следует дальнейшее окисление побочных продуктов Хофмана при температуре ниже 400°C (SI – Уравнение 2) 32 .
 4 (в) справа). Тот факт, что головные группы начинают разлагаться только при ~ 535 ° C, а затем по измененному пути разложения (SI — уравнение 3), дает убедительные доказательства этого усиленного взаимодействия.
4 (в) справа). Тот факт, что головные группы начинают разлагаться только при ~ 535 ° C, а затем по измененному пути разложения (SI — уравнение 3), дает убедительные доказательства этого усиленного взаимодействия.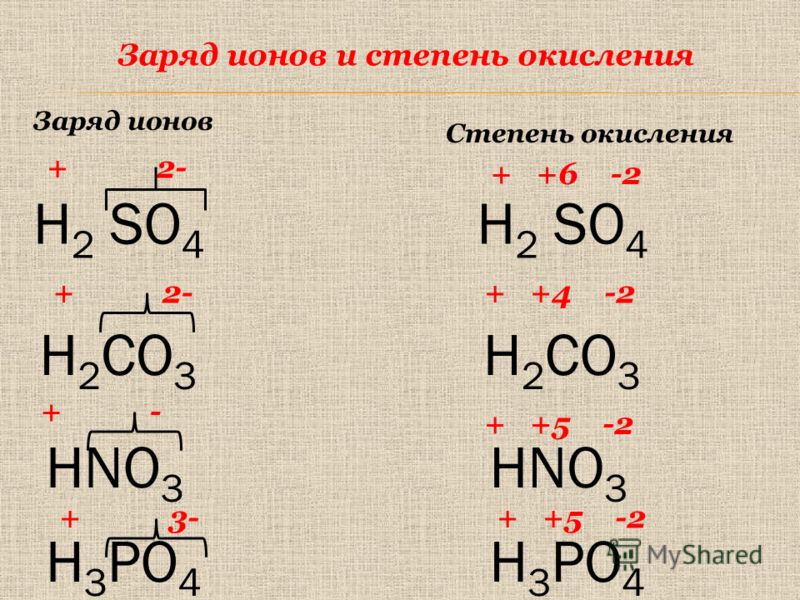 6H 2 O) в перекиси водорода (30% масс. в воде). ) и смешивание полученного раствора с этанолом (EtOH) с последующим добавлением по каплям тетраэтоксисилана (TEOS). Конечные молярные соотношения ТЭОС:Н 2 О:Н 2 О 2 :EtOH:Co(NO 3 ) 2 .6H 2 О = 4:45,5:9:256:1 33 . Процесс полимеризации проводят в среде с регулируемым рН благодаря упомянутому выше включению пероксида. Затем синтезировали гибридные поверхностно-активные золи кобальта и кремнезема, сохраняя фиксированное молярное соотношение Co/Si, путем добавления бромида гексилтриэтиламмония (HTAB) в молярных соотношениях для HTAB: Co(NO 3 ) 2 .6H 2 O (упомянутые здесь в качестве молярного соотношения поверхностно-активное вещество/кобальт) от 0,25 до 3 или эквивалентно от 0,47 до 5,4% масс. Избыток этанола обеспечивает адекватные условия для работы значительно ниже критической точки мицеллообразования HTAB при сохранении растворимости поверхностно-активного вещества.
6H 2 O) в перекиси водорода (30% масс. в воде). ) и смешивание полученного раствора с этанолом (EtOH) с последующим добавлением по каплям тетраэтоксисилана (TEOS). Конечные молярные соотношения ТЭОС:Н 2 О:Н 2 О 2 :EtOH:Co(NO 3 ) 2 .6H 2 О = 4:45,5:9:256:1 33 . Процесс полимеризации проводят в среде с регулируемым рН благодаря упомянутому выше включению пероксида. Затем синтезировали гибридные поверхностно-активные золи кобальта и кремнезема, сохраняя фиксированное молярное соотношение Co/Si, путем добавления бромида гексилтриэтиламмония (HTAB) в молярных соотношениях для HTAB: Co(NO 3 ) 2 .6H 2 O (упомянутые здесь в качестве молярного соотношения поверхностно-активное вещество/кобальт) от 0,25 до 3 или эквивалентно от 0,47 до 5,4% масс. Избыток этанола обеспечивает адекватные условия для работы значительно ниже критической точки мицеллообразования HTAB при сохранении растворимости поверхностно-активного вещества. Полученные гомогенные и стабильные гибридные золи (с учетом номенклатуры SCoSi ×, где × относится к молярному соотношению поверхностно-активное вещество/кобальт) сушили при 60°С в течение 96 часов, а затем прокаливали на воздухе при 600°С (скорость линейного изменения 1°С мин -1 и выдержка время 150 минут) для создания окончательных стабильных ксерогелей. Идентификацию и количественную оценку соответствующих функциональных групп диоксида кремния и фаз оксида кобальта проводили с помощью инфракрасной спектрометрии с преобразованием Фурье (FTIR), собранной на Shimadzu IRAffinity-1; спектрометрия диффузного отражения UV-Vis (DR-UV-Vis), собранная на спектрофотометре Varian, оснащенном интегрирующей сферой; и рентгеновская фотоэлектронная спектрометрия (XPS) с использованием рентгеновских лучей Al Kα при 1486,6 эВ (со спектрами, скорректированными до C при 284,6 эВ). Качество продуктов реакции во время термической обработки контролировали с помощью системы термогравиметрического анализа Texas Instruments Q500, связанной с системой газового анализа масс-спектрометра ThermoStar.
Полученные гомогенные и стабильные гибридные золи (с учетом номенклатуры SCoSi ×, где × относится к молярному соотношению поверхностно-активное вещество/кобальт) сушили при 60°С в течение 96 часов, а затем прокаливали на воздухе при 600°С (скорость линейного изменения 1°С мин -1 и выдержка время 150 минут) для создания окончательных стабильных ксерогелей. Идентификацию и количественную оценку соответствующих функциональных групп диоксида кремния и фаз оксида кобальта проводили с помощью инфракрасной спектрометрии с преобразованием Фурье (FTIR), собранной на Shimadzu IRAffinity-1; спектрометрия диффузного отражения UV-Vis (DR-UV-Vis), собранная на спектрофотометре Varian, оснащенном интегрирующей сферой; и рентгеновская фотоэлектронная спектрометрия (XPS) с использованием рентгеновских лучей Al Kα при 1486,6 эВ (со спектрами, скорректированными до C при 284,6 эВ). Качество продуктов реакции во время термической обработки контролировали с помощью системы термогравиметрического анализа Texas Instruments Q500, связанной с системой газового анализа масс-спектрометра ThermoStar. Дифференциальный термический анализ проводили с помощью термогравиметрического анализатора Mettler Toledo TGA/DSC 1 с газовым контроллером GC200. Измерение ПЭМ проводили на просвечивающем электронном микроскопе (ПЭМ) JEOL 1010, работающем при 100 кВ. Структурные данные были получены методом рентгеновской дифракции (XRD) с использованием дифрактометра Bruker D8 Advance с Cu Kα-излучением (40 кВ, 20 мА, λ = 1,5409).А°).
Дифференциальный термический анализ проводили с помощью термогравиметрического анализатора Mettler Toledo TGA/DSC 1 с газовым контроллером GC200. Измерение ПЭМ проводили на просвечивающем электронном микроскопе (ПЭМ) JEOL 1010, работающем при 100 кВ. Структурные данные были получены методом рентгеновской дифракции (XRD) с использованием дифрактометра Bruker D8 Advance с Cu Kα-излучением (40 кВ, 20 мА, λ = 1,5409).А°). и Цуру, Т. Органо-неорганические гибридные кремнеземные мембраны с контролируемым размером сетки из кремнезема: подготовка и характеристики газопроницаемости. Дж. Член. науч. 348, 310–318 (2010).
и Цуру, Т. Органо-неорганические гибридные кремнеземные мембраны с контролируемым размером сетки из кремнезема: подготовка и характеристики газопроницаемости. Дж. Член. науч. 348, 310–318 (2010). Доп. Функц. Матер. 16, 1215–1220 (2006).
Доп. Функц. Матер. 16, 1215–1220 (2006). хим. Матер. 14, 3440–3447 (2002).
хим. Матер. 14, 3440–3447 (2002). , Маркес, Ф. и Диас, И. Синтез углеводородов по Фишеру-Тропшу на мезопористых катализаторах Co/SBA-15: влияние металлического наполнения, предшественника кобальта и промоторов . Дж. Катал. 220, 486–499 (2003).
, Маркес, Ф. и Диас, И. Синтез углеводородов по Фишеру-Тропшу на мезопористых катализаторах Co/SBA-15: влияние металлического наполнения, предшественника кобальта и промоторов . Дж. Катал. 220, 486–499 (2003). и Диниз да Коста, Дж. К. Обратимый окислительно-восстановительный эффект на газопроницаемость мембран из этоксиполисилоксана (ES40), легированного кобальтом. науч. 3, 1648; 10.1038/srep01648 (2013).
и Диниз да Коста, Дж. К. Обратимый окислительно-восстановительный эффект на газопроницаемость мембран из этоксиполисилоксана (ES40), легированного кобальтом. науч. 3, 1648; 10.1038/srep01648 (2013). , Гуан С., Осуна Т. и Терасаки О. Упорядоченный мезопористый гибридный кремнийорганический материал с кристаллической структурой стенок. Природа 416, 304–307 (2002).
, Гуан С., Осуна Т. и Терасаки О. Упорядоченный мезопористый гибридный кремнийорганический материал с кристаллической структурой стенок. Природа 416, 304–307 (2002). Дж. Физ. хим. 95, 310–319 (1991).
Дж. Физ. хим. 95, 310–319 (1991). С. Галогенид кобальта и тиоцианатные комплексы в этилово-спиртовом растворе. Дж. Хим. соц. 143–148 (1949).
С. Галогенид кобальта и тиоцианатные комплексы в этилово-спиртовом растворе. Дж. Хим. соц. 143–148 (1949). , Шмидт В. и Шют Ф. Эволюция мезопористых материалов в процессе прокаливания: структурное и химическое поведение. Микропор. Месопор. Мат. 44–45, 95–109 (2001).
, Шмидт В. и Шют Ф. Эволюция мезопористых материалов в процессе прокаливания: структурное и химическое поведение. Микропор. Месопор. Мат. 44–45, 95–109 (2001).
 С.С., С.Ю. и J.C.D.C. способствовал анализу и обсуждению результатов и окончательному процессу написания. Все авторы написали, прочитали и исправили окончательную рукопись перед отправкой.
С.С., С.Ю. и J.C.D.C. способствовал анализу и обсуждению результатов и окончательному процессу написания. Все авторы написали, прочитали и исправили окончательную рукопись перед отправкой.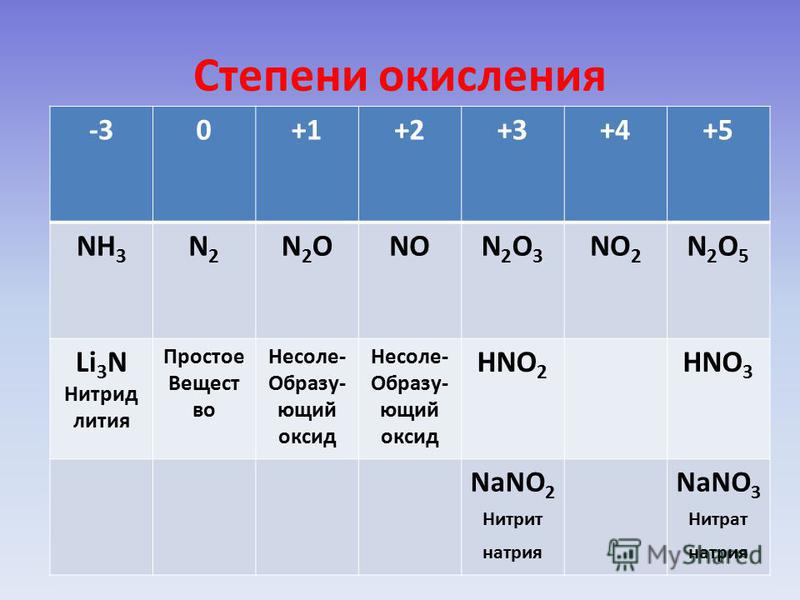 Мартенс
Мартенс