Проверочная работа «Сера и её соединения»
Проверочная работа по теме «Сера и её соединения» 9 класс
Вариант 1
Часть А. Задания с выбором одного правильного ответа (10 баллов)
Для серы характерна степень окисления:
1. -2 2. -3 3. -4 4. +7
Сера – более сильный окислитель, чем
1. Фтор 2. Хлор 3. Фосфор 4. Кислород
Степени окисления серы изменяются в последовательности +6, -2, 0 в группе веществ
1. S, SO2, SO3 2. h3SO4, SO2, h3S 3. Na2SO4, K2S, S 4. SO3, K2SO3, S
Схема превращения S+6 → S+4 соответствует уравнению реакции
1. SO3 + h3O → h3SO4 3. h3SO4 + Zn → ZnSO4 + h3
2. 2SO2 + O2 → 2SO3 4. Cu + 2h3SO4 → CuSO4 + SO2 + 2h3O
Раствор серной кислоты может взаимодействовать со всеми веществами группы
1. MgO, CO2, NaCl, Fe(OH)3 3. NaOH, ZnO, Cu, Na2CO3
MgO, CO2, NaCl, Fe(OH)3 3. NaOH, ZnO, Cu, Na2CO3
2. CuO, Fe, HNO3, NaOH Mg(OH)2, 4. BaCl2, FeO, Zn, KOH
И сернистый газ, и оксид серы (VI) будут реагировать со следующей парой веществ
1. Н2О и СО2 2. NaOH и CaO 3. h3O и Cl2 4. h3S и О2
Для осуществления превращения H2S→SO2→SO3→ K2SO4 нужно последовательно использовать
1. Воду, кислород, оксид калия 3. Кислород, воду, калий
2. Кислород, кислород, гидроксид калия 4. Воду, кислород, карбонат калия
Качественную реакцию на сульфат-анион можно представить сокращённым ионным уравнением
1. 2H+ + SO42- → h3SO4 2. Cu2+ + SO42- → CuSO4 3. Ba2+ + SO42- → BaSO4 4. S2- + 2H+ → h3S
Газ с запахом тухлых яиц, образующий при растворении в воде слабую кислоту, называется
1. Сернистый 2. Угарный 3. Сероводород 4. Хлор
Угарный 3. Сероводород 4. Хлор
Верны ли следующие утверждения о свойствах серы и её соединений?
А. Самой устойчивой аллотропной модификацией серы является ромбическая.
Б. Чтобы приготовить раствор серной кислоты, нужно в концентрированную кислоту вливать воду.
1. Верно А 2. Верно Б 3. Оба суждения верны 4. Оба суждения неверны
Часть В. Задания на соотнесение и с выбором нескольких вариантов ответа (4 балла)
Выберите два верных суждения. Ответ запишите в виде последовательности цифр без пробелов и запятых (2 балла)
11. В ряду S – Se – Te
1. Уменьшается радиус атома.
2. Усиливаются восстановительные свойства.
3. Уменьшаются кислотные свойства высших оксидов.
4. Увеличивается число электронов на внешнем энергетическом уровне.
5. Уменьшается число энергетических уровней в атоме.
12. Установите соответствие между левой и правой частями уравнения. Ответ представьте в виде последовательности четырёх цифр без пробелов и запятых (2 балла) (цифры могут повторяться!)
Ответ представьте в виде последовательности четырёх цифр без пробелов и запятых (2 балла) (цифры могут повторяться!)
№ п/п | Исходные вещества | № п/п | Продукты реакции |
1 | h3S + O2 (избыток) → | 1 | не взаимодействует |
2 | Ag + h3SO4 (разб) → | 2 | h3O + S |
3 | SO2 + NaOН(избыток) → | 3 | NaHSO3 |
4 | Fe + S → | 4 | Na2SO3 + h3O |
| 5 | Ag2SO4 + h3↑ | |
6 | Fe2S3 | ||
7 | h3O + SO2↑ | ||
8 | FeS | ||
Часть С Задания со свободным ответом (10 баллов)
(4 балла) Через 240 г 10% раствора гидроксида натрия пропускают сернистый газ объёмом 5,6 л. Определить массу полученной соли. (Ответ: 31,5 г.)
Определить массу полученной соли. (Ответ: 31,5 г.)
( 5 баллов) Составьте уравнения реакций, соответствующих схеме превращений:
S → h3S → Na2S → PbS Для последней реакции составьте уравнение в сокращённой ионной форме, укажите цвет образовавшегося осадка.
(3 балла) Для реакции h3SO4(конц.) + Zn → …. + h3S + h3O определить коэффициенты методом
электронного баланса, указать окислитель и восстановитель.
Проверочная работа по теме «Сера и её соединения» 9 класс
Вариант 2
Часть А. Задания с выбором одного правильного ответа (10 баллов)
Для серы нехарактерна степень окисления:
1. -2 2. -4 3. +4 4. +6
Сера является восстановителем в реакции с:
1. Фтором 2. Железом 3. Натрием 4. Водородом
Степени окисления серы изменяются в последовательности +6, +4, -2 в группе веществ
1. S, SO2, SO3 2. h3SO4, SO2, h3S 3. Na2SO4, K2S, S 4. SO3, K2SO3, S
S, SO2, SO3 2. h3SO4, SO2, h3S 3. Na2SO4, K2S, S 4. SO3, K2SO3, S
Схема превращения S+6 → S-2 соответствует уравнению реакции
1. SO3 + h3O → h3SO4 3. h3SO4 + Zn → ZnSO4 + h3S + h3O
2. 2SO2 + O2 → 2SO3 4. Cu + 2h3SO4 → CuSO4 + SO2 + 2h3O
Раствор серной кислоты может взаимодействовать со всеми веществами группы
1. MgO, SO2, NaCl, Fe(OH)3 3. Fe(OH)3, CaO, Zn, K2SO3
2. CuO, Ag, HNO2, NaOH 4. Ba(OH)2, NaCl, FeO, Zn
И сернистый газ, и серная кислота будут реагировать со следующей парой веществ
1. Н2О и СО2 2. КOH и MgO 3. h3O и SO3 4. Na2S и О2
Для осуществления превращения S→SO2→SO3→ BaSO4 нужно последовательно использовать
1. Воду, кислород, оксид бария 3. Кислород, кислород, гидроксид бария
2. Кислород, кислород, нитрат бария 4. Воду, кислород, нитрат бария
Кислород, кислород, нитрат бария 4. Воду, кислород, нитрат бария
Качественную реакцию на сульфит-анион можно представить сокращённым ионным уравнением
1. Pb2+ + S2-→PbS 2. Cu2+ + SO42- → CuSO4 3. Ba2+ + SO42- → BaSO4 4. 2H+ + SO32- → SO2 + h3O
Газ с запахом горящих спичек, образующий при растворении в воде слабую кислоту, называется
1. Сернистый 2. Угарный 3. Сероводород 4. Фтор
Верны ли следующие утверждения о свойствах серы и её соединений?
А. Пластическую серу можно получить при нагревании и последующем охлаждении ромбической серы.
Б. Раствор сернистого газа в концентрированной серной кислоте называется «олеум».
1. Верно А 2. Верно Б 3. Оба суждения верны 4. Оба суждения неверны
Часть В. Задания на соотнесение и с выбором нескольких вариантов ответа (4 балла)
Выберите два верных суждения. Ответ запишите в виде последовательности цифр без пробелов и запятых (2 балла)
11.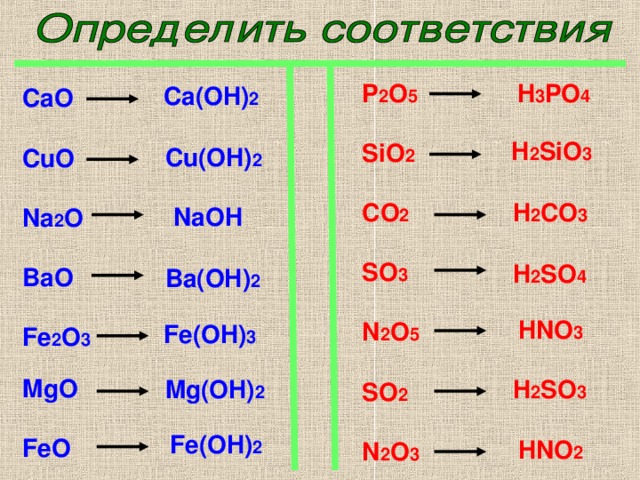 В ряду Р – S – Cl
В ряду Р – S – Cl
1. Уменьшается радиус атома.
2. Усиливаются восстановительные свойства.
3. Уменьшаются кислотные свойства высших оксидов.
4. Увеличивается число электронов на внешнем энергетическом уровне.
5. Уменьшается число энергетических уровней в атоме.
12. Установите соответствие между левой и правой частями уравнения. Ответ представьте в виде последовательности четырёх цифр без пробелов и запятых (2 балла) (цифры могут повторяться!)
№ п/п | Исходные вещества | № п/п | Продукты реакции |
1 | h3S + O2 (недостаток) → | 1 | не взаимодействует |
2 | Au + h3SO4 (разб) → | 2 | h3O + S |
3 | SO3 + NaOН(избыток) → | 3 | NaHSO4 |
4 | Fe + h3SO4 (разб) → | 4 | Na2SO4 + h3O |
| 5 | Au2SO4 + h3↑ | |
6 | Fe2(SO4)3 + h3↑ | ||
7 | h3O + SO2↑ | ||
8 | FeSO4 + h3↑ | ||
Часть С Задания со свободным ответом (10 баллов)
13. (4 балла) Через 1120 г 5% раствора гидроксида калия пропускают серный ангидрид объёмом 4,48 л. Определить массу полученной соли. (Ответ: 34,8 г.)
(4 балла) Через 1120 г 5% раствора гидроксида калия пропускают серный ангидрид объёмом 4,48 л. Определить массу полученной соли. (Ответ: 34,8 г.)
14. (5 баллов) Составьте уравнения реакций, соответствующих схеме превращений:
SО2 → SО3 → h3SО4 → ВаSО4 Для последней реакции составьте уравнение в сокращённой ионной форме, укажите цвет образовавшегося осадка.
15. (3 балла) Для реакции Mg + h3SO4 → …. + S + h3O определить коэффициенты методом электронного баланса, указать окислитель и восстановитель.
Ответы к проверочной работе по теме «Сера и её соединения» 9 класс
№ п/п | Вариант 1 | Балл | № п/п | Вариант 2 | Балл |
1 | 1 | 1 | 1 | 2 | 1 |
2 | 3 | 1 | 2 | 1 | 1 |
3 | 3 | 1 | 3 | 2 | 1 |
4 | 4 | 1 | 4 | 3 | 1 |
5 | 4 | 1 | 5 | 3 | 1 |
6 | 2 | 1 | 6 | 2 | 1 |
7 | 2 | 1 | 7 | 3 | 1 |
8 | 3 | 1 | 8 | 4 | 1 |
9 | 3 | 1 | 9 | 1 | 1 |
10 | 1 | 1 | 10 | 1 | 1 |
11 | 23 | 2 | 11 | 14 | 2 |
12 | 7148 | 2 | 12 | 2148 | 2 |
13 |
| 4 | 13 |
| 4 |
14 |
| 5 | 14 |
| 5 |
15 |
| 3 | 15 |
| 3 |
Критерий: 0-9 = 2, 10-16 =3, 17-23 = 4, 24-26 = 5
Проверочная работа по теме «Сера и её соединения» 9 класс
Вариант 3
Часть А. Задания с выбором одного правильного ответа (10 баллов)
Задания с выбором одного правильного ответа (10 баллов)
1. Распределение электронов по энергетическим уровням в атоме серы:
1) 2, 6 2) 2, 8, 8 3) 2, 8, 6 4) 2, 8, 8, 6
2. Сера — более сильный окислитель, чем:
1) фтор 2)хлор 3) фосфор 4) кислород
3. Степени окисления серы изменяются с +6 до 0 в группе веществ:
1)S, SO2, SO3 2) h3SO4, SO2, h3S 3) Na2SO4, K2S, S 4) SO2, K2SO3, S
4. Раствор серной кислоты может взаимодействовать со всеми веществами из группы:
1) MgO, CO2, NaCl, Fe(OH)3 3) NaOH, ZnO, Cu, Na2CO3
2) CuO, Fe, HNO3, NaOH 4) Mg(OH)2, BaCl2, FeO, Zn
5. Схеме превращения S+6 → S+4 соответствует уравнению реакции:
1) SO3 + h3O = h3SO4 3) h3SO4 + Zn = ZnSO4 + h3
2) 2SO2 + O2 = 2SO3 4) Cu +2h3SO4 = CuSO4 + SO2 + 2h3O
6. И сернистый газ, и оксид серы(VI) будут реагировать со следующей парой веществ:
И сернистый газ, и оксид серы(VI) будут реагировать со следующей парой веществ:
1) h3O , CO2 2) NaOH, CaO 3) h3O, Cl2 4) h3S, O2
7. Для осуществления превращения H2S → SO2 → SO3→ K2SO4 нужно последовательно использовать:
1) воду, кислород, оксид калия 3) кислород, воду, калий
2) кислород, кислород. гидроксид калия 4) воду, кислород, карбонат калия
8. В реакции, уравнение которой H2SO3 + Br2 + H2O= H2SO4 + HBr , сера
1) является восстановителем 3) является окислителем
2) понижает степень окисления 4) не изменяет степень окисления
9. Разбавленная серная кислота не будет взаимодействовать с каждым веществом из следующей пары веществ:
Разбавленная серная кислота не будет взаимодействовать с каждым веществом из следующей пары веществ:
1) CuO, HCl 2) Cu, NaCl 3) Zn, NaOH 4) CuSO4, MgO
10. Верны ли следующие утверждения о свойствах серы и её соединений?
А. Чтобы приготовить раствор серной кислоты, нужно в концентрированную кислоту вливать воду.
Б. Раствор серного ангидрида в концентрированной серной кислоте называется «олеум».
Часть В. Задания на соотнесение и с выбором нескольких вариантов ответа (4 балла)
Выберите два верных суждения. Ответ запишите в виде последовательности цифр без пробелов и запятых (2 балла)
11. В ряду S – Se – Te
1. Уменьшается радиус атома.
2. Усиливаются восстановительные свойства.
3. Уменьшаются кислотные свойства высших оксидов.
4. Увеличивается число электронов на внешнем энергетическом уровне.
5. Уменьшается число энергетических уровней в атоме.
12. Установите соответствие между левой и правой частями уравнения. Ответ представьте в виде последовательности четырёх цифр без пробелов и запятых (2 балла) (цифры могут повторяться!)
№ п/п | Исходные вещества | № п/п | Продукты реакции | ||
1 | h3S + O2 (избыток) → | 1 | не взаимодействует | ||
2 | Ag + h3SO4 (разб) → | 2 | h3O + S | ||
3 | SO2 + NaOН(избыток) → | 3 | NaHSO3 | ||
4 | Fe + S → | 4 | Na2SO3 + h3O | ||
| 5 | Ag2SO4 + h3↑ | |||
6 | Fe2S3 | ||||
7 | h3O + SO2↑ | ||||
8 | FeS | ||||
Часть С Задания со свободным ответом (10 баллов)
(4 балла) Через 120 г 20% раствора гидроксида натрия пропускают сернистый газ объёмом 2,24 л. Определить массу полученной соли.
Определить массу полученной соли.
( 5 баллов) Составьте уравнения реакций, соответствующих схеме превращений:
S → h3S → Na2S → PbS Для последней реакции составьте уравнение в полной и сокращённой ионной форме, укажите цвет образовавшегося осадка.
(3 балла) Для реакции h3SO4 + Zn …. + h3S + h3O определить коэффициенты методом
электронного баланса, указать окислитель и восстановитель.
Ответы к диагностике по сере
3 вариант
1 | 3 | 1 |
2 | 3 | 1 |
3 | 3 | 1 |
4 | 4 | 1 |
5 | 4 | 1 |
6 | 2 | 1 |
7 | 2 | 1 |
8 | 1 | 1 |
9 | 3 | 1 |
10 | Б | 1 |
11 | 23 | 2 |
12 | 7148 | 2 |
13 |
| 4 |
14 |
| 5 |
15 |
| 3 |
Контрольна робота «Хімічні реакції»
Підготовка до контрольної роботи 9 клас
1. Теоретичні питання:
Теоретичні питання:
Швидкість хімічної реакції
Класифікації хімічних реакцій за різними ознаками
Всі теоретичні питання повинні супроводжуватися прикладами
2. Установіть відповідність між рівнянням реакції та ії типом:
А. 2Са + О2 = 2СаО ; 1. обміну;
Б. Fe + 2HСl = FeCl2 + H2; 2. сполучення;
В. HNO3 + NaOH = NaNO3 + H2O; 3. розкладу;
Г. 2HgO = 2Hg + O2; 4. заміщення.
3. Вкажіть, які реакції із даних є екзотермічними:
1) S + O2 =SO2 +293 кДж;
2) Fe2O3
3) 2Н2 + О2 = 2Н2О; ∆Н = ─ 286 кДж;
4) С + Н2О = СО + Н2; ; ∆Н = +131,4 кДж.
4. Напишіть рівняння і назвіть тип реакцій, за допомогою яких можна здійснити перетворення: Al → Al2O3 → AlCl3 → Al(OH)3 → Al2(SO4)3
5. Закінчить окисно – відновну реакцію, вказати окисник та відновник.
6. При взаємодії 9,18 л (н.у.) хлору з надлишком водню виділилось 75 кДж теплоти. Напишіть термохімічне рівняння реакції.
ХІМІЧНІ РІВНЯННЯ 1 ВАРІАНТ 1. Дайте класифікацію хімічним реакціям за зміною числа реагентів і продуктів реакції. Наведіть приклади.
- Встановіть відповідність поданих реакцій їх типу:
1. CuSO4 + 2NaOH→Cu(OH)2 + Na2SO4 А. Розклад
2. 2Ca + O2→2CaO Б. Сполучення
Сполучення
3. 2KClO3→2KCl + 3O2 В. Заміщення
4. CuSO4 + Fe→FeSO4 + Cu Г. Обмін
3. Укажіть рівняння ендотермічних реакцій:
а) CH4 +2O2→CO2 + H2O; ΔH=-891 кДж
б) CaCO3→CaO + CO
в) MnO2 + 2C→Mn + 2CO; ΔH=+293 кДж
г) S + Fe→FeS; ΔH=-95,3 кДж
- Напишіть рівняння і назвіть тип реакцій, за допомогою яких можна здійснити перетворення: Mg→MgO→MgSO4→MgCO3→MgO
- Закінчить окисно – відновну реакцію, вказати окисник та відновник. Cr (NO 3) 3 = Cr 2 O 3 + NO 2 + O 2
- Напишіть молекулярну та йонні форми рівняння взаємодії між натрій гідроксидом та ортофосфатною кислотою.

- При взаємодії алюмінію масою 18 г з киснем виділилось 547 кДж теплоти. Розрахуйте тепловий ефект хімічної реакції:
————————————————————————————————
ХІМІЧНІ РІВНЯННЯ 2 ВАРІАНТ
- Дайте класифікацію хімічним реакціям за зміною ступеня окиснення. Наведіть приклади.
- Встановіть відповідність поданих реакцій їх типу:
1. CuSO4 + 2NaOH→Cu(OH)2 + Na2SO4 А. Розклад
2. CuSO4 +Fe→FeSO4 +Cu Б. Сполучення
3. Cu(OH)2CO3=CuO+CO2+H2O В. Заміщення
4. 2Ca + O2→2CaO Г. Обміну
Обміну
3. Вкажіть, які реакції із даних є екзотермічними:
а) 2KNO3→2KNO2 + 3O2; ΔH=+255 кДж
б) 2Mg + CO2→2MgO + O2; ΔH=-829 кДж
в) 4P + 5O2→2P2O5; ΔH=-3010 кДж
г) C2H4 + H2→C2H6; ΔH=-137,8 кДж
- Напишіть рівняння і назвіть тип реакцій, за допомогою яких можна здійснити перетворення: Zn→ZnSO4→ZnCl2→Zn(OH)2→ZnO
- Закінчить окисно – відновну реакцію, вказати окисник та відновник. Р + КСlOз → Р2О5 + KCl
- Напишіть молекулярну та йонні форми рівняння взаємодії між барій нітратом та калій сульфатом
- Дано термохімічне рівняння реакції горіння карбон(ІІ) оксиду: 2СО (г) + О2 (г) = 2СО2 (г), ∆ Н = — 566 кДж.
 Обчисліть кількість теплоти, що виділиться при спалюванні 4 моль карбон (ІІ) оксиду.
Обчисліть кількість теплоти, що виділиться при спалюванні 4 моль карбон (ІІ) оксиду.
——————————————————————————————————————————
ХІМІЧНІ РІВНЯННЯ 3 ВАРІАНТ
- Від яких факторів залежить швидкість хімічних реакцій? Наведіть приклади.
- Встановіть відповідність поданих реакцій їх типу:
1. Fe2O3 + 3H2→2Fe + 3H2O А. Розклад
2. FeSO4 + 2KOH→K2SO4 + Fe(OH)2
 Сполучення
Сполучення3. 2Fe(OH)3→Fe2O3 + 3H2O В. Заміщення
4. 2Mg + O2→2MgO Г. Обміну
- Укажіть рівняння ендотермічних реакцій:
а) 2KNO3→2KNO2 + 3O2; ΔH=+255 кДж
б) 2Mg + CO2→2MgO + O2; ΔH=-829 кДж
в) 4P + 5O2→2P2O5; ΔH=-3010 кДж
г) C2H4 + H2→C2H6; ΔH=-137,8 кДж
- Напишіть рівняння і назвіть тип реакцій, за допомогою яких можна здійснити перетворення: K — K2O — KOH — KCl — AgCl
- Закінчить окисно – відновну реакцію, вказати окисник та відновник.
 S + КСlO3 → KCl + SО2↑
S + КСlO3 → KCl + SО2↑ - Напишіть молекулярну та йонні форми рівняння взаємодії між арґентум нітратом та хлоридною кислотою
- При взаємодії 9,18 л (н.у.) хлору з надлишком водню виділилось 75 кДж теплоти. Напишіть термохімічне рівняння реакції.
ХІМІЧНІ РІВНЯННЯ 4 ВАРІАНТ 1.
- Встановіть відповідність поданих реакцій їх типу:
1. CuSO4 + 2NaOH→Cu(OH)2 + Na2SO4 А. Розкладу
2. 2Ca + O2→2CaO Б. Заміщення
3. 2KClO3→2KCl + 3O2 В. Обміну
Обміну
4. CuSO4 + Fe→FeSO4 + Cu Г.Сполучення
3. Укажіть рівняння екзотермічних реакцій:
а) CH4 +2O 2→CO2 + H2O; ΔH=-891 кДж
б) CaCO3→CaO + CO2; ΔH=+178 кДж
в) MnO2 + 2C→Mn + 2CO; ΔH=+293 кДж
г) S + Fe→FeS; ΔH=-95,3 кДж
- Напишіть рівняння і назвіть тип реакцій, за допомогою яких можна здійснити перетворення: Cu—> CuO—> CuCl2—> Cu(OH)2—> CuO
- Закінчить окисно–відновну реакцію, вказати окисник та відновник.
Mg + HNO 3 = Mg (NO3) 2 + N 2 + H 2 O
- Напишіть молекулярну та йонні форми рівняння взаємодії між калій гідроксидом та сульфатною кислотою.

- При взаємодії алюмінію масою 18 г з киснем виділилось 547 кДж теплоти. Розрахуйте тепловий ефект хімічної реакції:
————————————————————————————————
ХІМІЧНІ РІВНЯННЯ 5 ВАРІАНТ 1. Дайте класифікацію хімічним реакціям за зміною ступеня окиснення. Наведіть приклади.
- Встановіть відповідність поданих реакцій їх типу:
1. CuSO4 +Fe→FeSO4 +Cu А. Розклад
2. CuSO4 + 2NaOH→Cu(OH)2 + Na2SO4 Б. Сполучення
3. Cu(OH)2CO3=CuO+CO2+H2O В. Заміщення
Заміщення
4. 2Ca + O2→2CaO Г. Обміну
3. Вкажіть, які реакції із даних є ендотермічними:
а) 2KNO3→2KNO2 + 3O2; ΔH=+255 кДж
б) 2Mg + CO2→2MgO + O2; ΔH=-829 кДж
в) 4P + 5O2→2P2O5; ΔH=-3010 кДж
г) C2H4 + H2→C2H6; ΔH=-137,8 кДж
4 Напишіть рівняння і назвіть тип реакцій, за допомогою яких можна здійснити перетворення: К → К2O → КОН → K2SO4
- Закінчить окисно – відновну реакцію, вказати окисник та відновник. Na 2 SO 3 = Na 2 S + Na 2 SO 4
- Напишіть молекулярну та йонні форми рівняння взаємодії між натрій карбонатом і хлоридною кислотою
- Дано термохімічне рівняння реакції горіння карбон(ІІ) оксиду: 2СО (г) + О2 (г) = 2СО2 (г), ∆ Н = — 566 кДж.
 Обчисліть кількість теплоти, що виділиться при спалюванні 4 моль карбон (ІІ) оксиду.
Обчисліть кількість теплоти, що виділиться при спалюванні 4 моль карбон (ІІ) оксиду.
——————————————————————————————————————————
ХІМІЧНІ РІВНЯННЯ 6 ВАРІАНТ 1 Від яких факторів залежить швидкість хімічних реакцій? Наведіть приклади.
- Встановіть відповідність поданих реакцій їх типу:
1 2Mg + O2→2MgO А. Розклад
2. FeSO4 + 2KOH→K2SO4 + Fe(OH)2 Б. Сполучення
Сполучення
3. 2Fe(OH)3→Fe2O3 + 3H2O В. Заміщення
4. Fe2O3 + 3H2→2Fe + 3H2O Г. Обміну
- Укажіть рівняння екзотермічних реакцій:
а) 2KNO3→2KNO2 + 3O2; ΔH=+255 кДж
б) 2Mg + CO2→2MgO + O2; ΔH=-829 кДж
в) 4P + 5O2→2P2O5; ΔH=-3010 кДж
г) C2H4 + H2→C2H6; ΔH=-137,8 кДж
- Напишіть рівняння і назвіть тип реакцій, за допомогою яких можна здійснити перетворення: P —> P2O5—> H3PO4 —> Ca3(PO4)2
- Закінчить окисно – відновну реакцію, вказати окисник та відновник.
 Zn + HNO3 → Zn(NO3)2 + H2O + N2
Zn + HNO3 → Zn(NO3)2 + H2O + N2 - Напишіть молекулярну та йонні форми рівняння взаємодії між арґентум нітратом та бромідною кислотою
- При взаємодії 9,18 л (н.у.) хлору з надлишком водню виділилось 75 кДж теплоти. Напишіть термохімічне рівняння реакції.
= | Сбалансированное уравнение химической реакции
| Поиск |
Результаты поиска по химическому уравнению
Реклама
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1 — Пожалуйста, прокрутите до конца, чтобы увидеть больше результатов
Уравнение Результат #1
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
| png» substance-weight=»64.0638″> SO 2 | + | 6 (мукхонг) 0006 | (цепочка) | ||||
| 1 | 1 | 1 | 1 | Хоу Со | |||
| 6 | Нгуен-Фантукхой (г/моль) | ||||||
| Сум моль | |||||||
| 06 | 06 | Khối lượng (g) |
Реклама
Дополнительная информация об уравнении SO
2 + Ba(OH) 2 → H 2 O + BaSO 3Условия реакции SO2 (двуокись серы) реагирует с Ba(OH)2 (барий гидроксид) ?
Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием h3O (воды) и BaSO3 () ?
Перенос SO2 через раствор Ba(OH)2
Явление после реакции SO2 (диоксид серы) с Ba(OH)2 (гидроксид бария)
Нажмите, чтобы увидеть явление уравнения
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнений
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Другие вопросы, связанные с химическими реакциями SO
2 + Ba(OH) 2 → H 2 O + BaSO 3Вопросы, связанные с реагентом SO2 (диоксид серы)
Каковы химические и физические характеристики SO2 (диоксида серы)? диоксид серы) в качестве реагента?
Вопросы, связанные с реагентом Ba(OH)2 (гидроксид бария)
Каковы химические и физические характеристики Ba(OH)2 (гидроксид бария)? ) в качестве реагента?
Вопросы, связанные с продуктом h3O (вода)
Каковы химические и физические характеристики h3O (гидроксида бария)? Каковы химические реакции, в результате которых образуется h3O (вода)?
Вопросы, связанные с продуктом BaSO3 ()
Каковы химические и физические характеристики BaSO3 (гидроксид бария)? Каковы химические реакции, в которых BaSO3 () является продуктом?
1 результатов найдено
Отображение уравнения из 1 9от 0022 до 1 Страница 1
Дополнительная информация о веществах, которые используют уравнение
Реакция SO2 (lưu hùynh dioxit) реакция с Ba(OH)2 (баригидроксит) с образованием h3O (nước)
Реакция с образованием вещества SO2 (lưu hùynh dioxit) (двуокись серы)
2H 2 S + 3O 2 → 2H 2 O + 2SO 2 H 2 0 Na 4 0 SO 49040 2 SO 3 → Ч 2 O + Na 2 SO 4 + SO 2 Cu + 2H 2 SO 4 → 2H 2 O + SO 90 90 90 040 Cu 90 040 2 9040 2 9040 041
Реакция с образованием вещества Ba(OH)2 (Баригидроксит) (гидроксид бария)
BaCl 2 + Ca(OH) 2 → Ba(OH) 2 + CaCl 2 BaO + H 2 O → Ba( OH) 2 2H 2 O + Ba → H 2 + Ba(OH) 2
Реакция с образованием вещества h3O (nước) (вода)
NH 4 NO 2 → 2H 2 O + N 2 3BaO + 2H 3 PO 4 → 3 91 O 909040 2 (ПО 4 ) 2 (6x-2y)HNO 3 + FexOy → (3x-y)H 2 O + 3x-2yNO 2 + xFe(NO 3 ) 3
Реакция с образованием вещества BaSO3 (барисульфит) ()
BaCl 2 + 2KHSO 3 → H 2 O + 2KCl + SO 2 + BaSO 3 SO 2 + Ba(OH) 2 → H 2 O + BaSO 3 Na 2 SO 3 + Ba(OH) 90Na + 4 Ba(OH) 90O40 4 BaSO 2 9040 2 0 3
Essentt — Подобранные товары
Подобранные товары Необходимы для работы из дома!
so2+ba(oh)2 → h3o+baso3Tất cả phương trình điều chế từ so2+ba(oh)2 ra h3o+baso3 ừ so2+ ба(о)2 ра h3o+baso3
Тим Ким Пхонг Трин Хоа Хок |
| Тим Ким | Нхом Хок Мьен Пхи Онлайн Facebook | |||
| Lưu ý: mỗi chất cách nhau 1 khoảng trắng, ví dụ: h3 O2 | ||||
Tổng hợp đầy đủ và chi tiết nhất can bằng phương trình điều chế từ so2+ba(oh)2 ra h3o+baso3.



 Обчисліть кількість теплоти, що виділиться при спалюванні 4 моль карбон (ІІ) оксиду.
Обчисліть кількість теплоти, що виділиться при спалюванні 4 моль карбон (ІІ) оксиду. S + КСlO3 → KCl + SО2↑
S + КСlO3 → KCl + SО2↑
 Обчисліть кількість теплоти, що виділиться при спалюванні 4 моль карбон (ІІ) оксиду.
Обчисліть кількість теплоти, що виділиться при спалюванні 4 моль карбон (ІІ) оксиду. Zn + HNO3 → Zn(NO3)2 + H2O + N2
Zn + HNO3 → Zn(NO3)2 + H2O + N2