Расставление коэффициентов в окислительно-восстановительных реакциях
Главная \ Подготовка к ЕГЭ \ Химия \ Расставление коэффициентов в окислительно-восстановительных реакциях
Как расставлять коэффициенты в окислительно-восстановительных реакциях методом электронно-ионного баланса:
1. Определить степени окисления
2. Понять, атомы каких элементов меняют степень окисления
3. Записываем электронно-ионный баланс. Для этого, записываем атом элемента сначала со степенью окисления в левой части, а затем в правой
4. Считаем, сколько электронов было отдано или принято
5. Находим общее кратное, делим его на соответствующее количество отданных или принятых электронов
6. Атом элемента, отдающий электроны, является восстановителем (отдача — окисление), принимающий электроны — окислителем.
7. Расставляем коэффициенты
8. Подводим баланс по водороду и кислороду
Рассмотрим пример:
HClO3 + P → h4PO4 + HCl
В данной реакции хлор и фосфор меняют степень окисления. Запишем баланс.
Запишем баланс.
Фосфор в левой части находится в состоянии простого вещества, а в правой в составе ортофосфорной кислоты, то есть меняет степень окисления с 0 на +5.
Р(0) → Р(+5)
Положительная степень окисления означает, что атом отдал электроны, фосфор отдает пять электронов.
Р(0) -5е → Р(+5)
Восстановитель отдает электроны, значит фосфор является восстановителем.
Хлор в левой части находится в составе хлорноватой кислоты, а в правой — в составе соляной.
Хлор меняет степень окисления с +5 на -1, то есть хлор принимает 6 электронов.
Cl(+5) +6e → Cl(-1)
Окислитель принимает электроны.
Находим общее кратное между 5 и 6, это — 30. То есть, около хлора мы должны поставить 5, а около фосфора — 6.
Расставим коэффициенты.
5HClO3 + 5P → 6h4PO4 + 5HCl
Перед соединениями хлора поставим 5. Теперь слева 15 атомов кислорода, тогда справа перед ортофосфорной кислотой тоже поставим 6. В этот момент мы понимаем, что не можем уравнять, так как слева не хватает атомов водорода. Добавим воду слева.
Добавим воду слева.
5HClO3 + 5P + 9Н2О → 6h4PO4 + 5HCl
И перед водой поставим 9. Теперь все коэффициенты расставлены правильно.
Не во всех уравнениях коэффициенты расставляются так (добавлением воды).
Поэтому разберем окислительно-восстановительную реакцию из варианта ЕГЭ.
KMnO4 + K2SO3 + KOH = K2MnO4 + K2SO4 + h3O
В данной реакции меняют степень окисления марганец и сера.
Марганец меняет степень окисления с +7 на +6, а сера с +4 на +6.
Mn(+7) +1e → Mn(+6) (марганец принимает 1 электрон, значит является окислителем)
S(+4) -2e → S(+6) (сера отдает 2 электрона, значит является восстановителем)
Общее кратное — 2, перед марганцем нужно поставить 2, перед серой — единички.
2KMnO4 + K2SO3 + KOH = 2K2MnO4 + K2SO4 + h3O
Слева получилось 5 атомов калия, а слева 6, поставим 2 перед гидроксидом калия.
2KMnO4 + K2SO3 + 2KOH = 2K2MnO4 + K2SO4 + h3O
Теперь коэффициенты расставлены правильно!
Задания по теме
1. Al + … + KNO3 + KOH = K[Al(OH)4] + Nh4↑
Al + … + KNO3 + KOH = K[Al(OH)4] + Nh4↑
Алюминий и азот меняют степень окисления. Запишем баланс.
Al(0) -3e → Al(+3) | 8 — восстановитель
N(+5) +8e → N(-3) | 3 — окислитель
Слева не хватает атомов водорода, поэтому добавим воды. Перед алюминием слева и справа ставим 8, а перед азотом ставим 3. Считаем атомы водорода и кислорода, перед водой ставим 18.
8Al + 18Н2О + 3KNO3 + 5KOH = 8K[Al(OH)4] + 3Nh4↑
2. Al + HNO3 → Al(NO3)3 + N2O + …
Справа не хватает атомов водорода, добавим их в составе воды.
Al + HNO3 → Al(NO3)3 + N2O + Н2О
Алюминий и азот меняют степень окисления. Запишем баланс.
Al(0) -3e → Al(+3) | 4 — восстановитель
N(+5) +4e → N(+1) | 3 — окислитель
Перед алюминием ставим не 4, а 8 — иначе уравнять не получится. Перед оксидом алюминия — 3.
8Al + HNO3 → 8Al(NO3)3 + 3N2O + Н2О
Справа 30 атомов азота. значит слева перед азотной кислотой ставим 30, тогда получается 15 молекул воды.
8Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15Н2О
3. Al + HNO3 → Al(NO3)3 + Nh5NO3 + …
Справа не хватает воды.
Al + HNO3 → Al(NO3)3 + Nh5NO3 + Н2О
Алюминий и азот меняют степень окисления. Запишем баланс.
Al(0) -3e → Al(+3) | 8 — восстановитель
N(+5) +8e → N(-3) | 3 — окислитель
Перед алюминием ставим 8, перед нитратом аммония — 3.
8Al + HNO3 → 8Al(NO3)3 + 3Nh5NO3 + Н2О
Тогда справа получается 30 атомов азота, значит перед азотной кислотой поставим 30, а перед водой — (30 — 12)/2 = 9.
8Al + 30HNO3 → 8Al(NO3)3 + 3Nh5NO3 + 9Н2О
4. KNO3 + … + S → N2 + CO2 + …
Слева не хватает углерода, а справа соединения серы.
Сера превращается в сульфид.
KNO2 + С + S → N2 + CO2 + h3S
C(0) -4e → C(+4) | 5 — восстановитель
S(0) +2e → S(-2) | 10 — окислитель
2N(+5) +10e → N2(0) | 2 — окислитель
Если углерод отдает электроны и превращается в С(+4), то сера должна эти электроны принимать, иначе баланс не получится.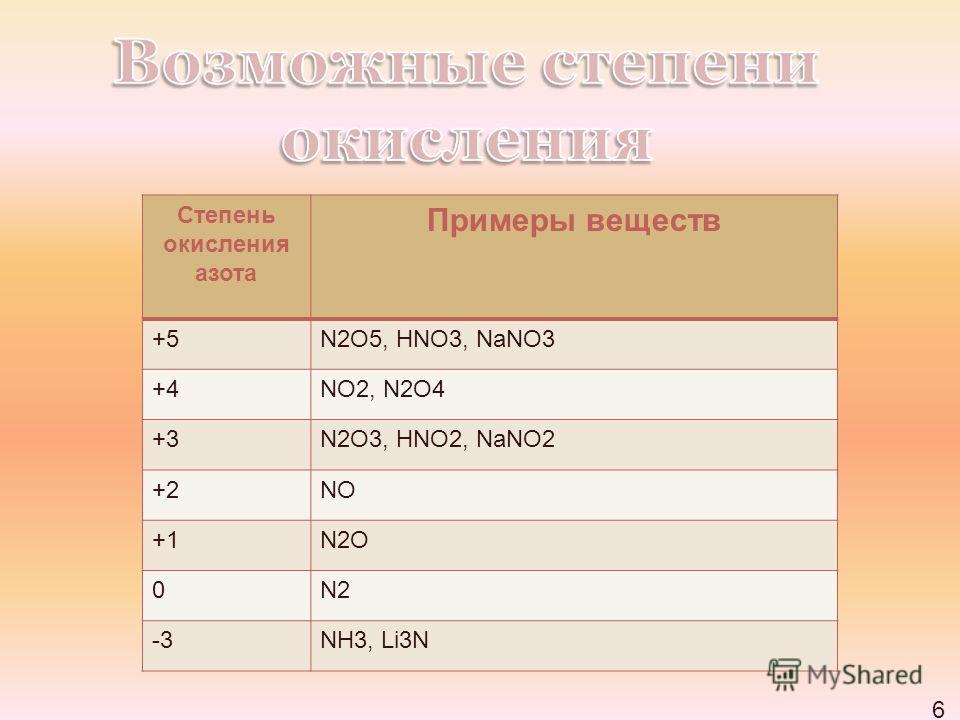
Расставляем коэффициенты.
2KNO3 + 3С + S → N2 + 3CO2 + К2S
5. KNO3 + Al → KAlO2 + … + N2
Справа не хватает соединения алюминия, а именно оксида.
KNO3 + Al → KAlO2 + Al2O3 + N2
Записываем баланс.
Al(0) -3e → Al(+3) | 10 — восстановитель
2N(+5) +10e → N2(0) | 3 — окислитель
Расставляем коэффициенты.
6KNO3 + 10Al → 6KAlO2 + 2Al2O3 + 3N2
6.
16 Билет
A1. Электронная конфигурация 1s22s22p63s23p6 соответствует иону
1) Mg2+ 2) S2– 3) Al3+ 4) N3–
A2. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
1) Li, Be, B, C 2) P, S, Cl, Ar 3) Sb, As, P, N 4) F, Cl, Br, I
A3. Химическая реакция протекает между
1) Cu и ZnCl2 2) Zn и CuSo4 3) Fe и Al(no3)3 4) Ag и FeSo4
A4. Наименьшую степень окисления хром имеет
в соединении
Наименьшую степень окисления хром имеет
в соединении
1) K2CrO4 2) CrSO4 3) CrO3 4) Cr2(SO4)3
A5. В ряду натрий – магний – алюминий
элементы расположены в порядке увеличения
1) Атомного радиуса 2) электроотрицательности 3) металлических свойств 4) числа энергетических уровней
A6. В перечне веществ
А) Ba(ClО3)2 Б) Nah3PO4 В) (Nh5)2Cr2О7 Г) C2H5COONa Д) KHS Е) Ca(HCO3)2
к средним солям относят:
1) АБВ 2) АВГ 3) БГД 4) ВДЕ
A7. Верны ли следующие суждения о магнии и его соединениях?
А. Магний реагирует и с кислотами, и со щелочами. Б. Оксид магния является основным оксидом.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
A8. Соединение состава K2ЭO3 образует каждый
из двух элементов:
Соединение состава K2ЭO3 образует каждый
из двух элементов:
1) Углерод и фосфор 2) азот и сера 3) углерод и сера 4) азот и фосфор
A9. Общим свойством меди и железа является их способность растворяться в
1) воде 2) серной кислоте (разб.) 3) растворе щелочи 4) азотной кислоте (разб.)
A10. C водой при обычных условиях реагирует
1) оксид азота (II) 2) оксид железа (II) 3) оксид железа (III) 4) оксид азота (IV)
A11. Гидроксид натрия взаимодействует с каждым из двух веществ:
1) MgO и HCl 2) Nh4 и SO3 3) h3S и KNO3 4) HNO3 и Al
A12. Химическая реакция возможна между
1) Zn и CuCl2 2) Fe и MgSO4 3) NaOH и K3PO4 4) HCl и Ba(NO3)2
A13. В схеме превращений
В схеме превращений
X Y
SiO2 → K2SiO3 → h3SiO3 веществами «X» и «Y» могут быть соответственно
1) KCl и h3O 2) K2SO4 и h3O 3) KOH и HCl 4) KCl и CO2
A14. Изомером 2-метилпропанола-1 является
1) метилизопропиловый эфир 2) пропанол-1 3) 2-метилбутанол-1 4) пропандиол-1,2
A15. Соль и щелочь образуются при взаимодействии растворов
1) K2CO3 и Ba(OH)2 2) AlCl3 и NaOH 3) h4PO4 и KOH 4) MgBr2 и Na3PO4
A16. Фенол не взаимодействует с
1) метаналем 2) метаном 3) азотной кислотой 4) бромной водой
A17. При восстановлении глюкозы образуется
1) кислота 2) сложный эфир 3) соль 4) спирт
A18. В схеме превращений этаналь → X →
этилацетат веществом «Х» является
В схеме превращений этаналь → X →
этилацетат веществом «Х» является
1) этановая кислота 2) ацетат натрия 3) ацетилен 4) ацетон
A19. Взаимодействие метановой кислоты с этанолом относится к реакциям
1) гидрирования 2) присоединения 3) этерификации 4) гидратации
А20. Уксусный альдегид реагирует с каждым из двух веществ:
1)аммиачным раствором оксида серебра (I) и кислородом 2)гидроксидом меди (II) и оксидом кальция
3)соляной кислотой и серебром 4)гидроксидом натрия и водородом
А21. В схеме превращений C6H5Ch4 → X → C6H5 – Ch3–OH веществом «Х» является
1) C6H5OH 2) C6H5–Ch3Cl 3) C6H5Cl 4) C6H5COOH
А22. Электролитом является каждое из двух
веществ:
Электролитом является каждое из двух
веществ:
1) пропанол и соляная кислота 2) серная кислота и бензол
3) хлорид натрия и гидроксид калия 4) серная кислота и толуол
A23. Сокращенное ионное уравнение Cu2+ + 2OH– → Cu(OH)2 соответствует взаимодействию
1) сульфата меди (II) и гидроксида калия 2) сульфида меди (II) и гидроксида натрия
3) хлорида меди (II) и гидроксида магния 4) нитрата меди (II) и гидроксида железа (II)
A24. Бром является восстановителем в реакции, схема которой
1) HBr + O2 → h3O + Br2 2) Br2 + Zn → ZnBr2 3) HBr + Mg → MgBr2 + h3 4) Br2 + KI → I2 + KBr
А25. При взаимодействии карбоновых кислот и спиртов образуются
1)простые эфиры 2)сложные эфиры 3)углеводы 4)аминокислоты
А26. С бромной водой взаимодействует каждое
из двух веществ:
С бромной водой взаимодействует каждое
из двух веществ:
1) этилен и бензол 2) бутадиен-1,3 и бутан 3) этан и этен 4) бутин-1 и пентадиен-1,3
A27. Альдегид получается при гидратации
1) этина 2) пропина 3) бутина-1 4) пентина-1
A28. Реактивом на многоатомные спирты является
1) KCl (р-р) 2) Cu(OH)2 (в изб. KOH) 3) Ca(NO3)2 (р-р) 4) Ag2O (в р-ре Nh4)
A29. Полипропилен получают из вещества, формула которого
1)СН2 = СН2 2)СН СН 3)СН3 – СН2 – СН3 4)СН2 = СН – СН3
A30. Аминокислоты не реагируют ни с одним из двух веществ:
1)NaOH и Ch4OH 2)Ch4Nh3 и Na 3)NaCl и Ch5 4)Nh4 и h3O
В1. Установите соответствие между названием
вещества и классом (группой) органических
соединений, к которому(-ой) оно принадлежит.
Установите соответствие между названием
вещества и классом (группой) органических
соединений, к которому(-ой) оно принадлежит.
А) глицерин 4 1) альдегиды
Б) глицин 2 2) аминокислоты
В) бутанол-1 4 3) простые эфиры
Г) толуол 5 4) спирты5) углеводороды
6) углеводы
В2. Установите соответствие между формулой вещества и степенью окисления азота в нем.
А) NOF 4 1) – 3
Б) (Ch4)2NH 1 2) – 2
В) Nh5Br 1 3) + 2
Г) N2h5 2 4) + 3
5) + 4
6) + 5
В3.
1)h3SO4 и BaCl2 б А)Al3+ + 3OH– = Al(OH)3
2)Ba(OH)2 и K2CO3 г Б)Ba2+ + SO42– = BaSO4
3)Al(NO3)3 и KOH а B)Na+ + Br – = NaBr
4)BaBr2 и Na2SO4 б Г)Ba2+ + CO32– = BaCO3
Д)К+ + NO3– = KNO3
В4. Установите соответствие между уравнением реакции и веществом-окислителем, участвующим в данной реакции.
1)2NO + 2h3 = N2 + 2h3O в А)h3
2)2Nh4 + 2Na = 2NaNh3 + h3 г Б)N2
3)h3 + 2Na = 2NaH а В)NO
4)4Nh4 + 6NO = 5N2 + 6h3O в Г)Nh4
В5. Установите соответствие между простым
веществом и реагентами, с каждым из
которых оно может взаимодействовать.
Установите соответствие между простым
веществом и реагентами, с каждым из
которых оно может взаимодействовать.
А) алюминий 1 1) Fe2O3,HNO(р-р),NaOH(р-р)
Б) кислород 3 2) Fe,HNO3,h3
В) сера 2 3) HI,Fe,P2O3
Г) натрий 4 4) C2H5OH,h3O,Cl2
5) CaCl2,KOH,HCl
В6. Реакция бромирования метана протекает
1) по радикальному механизму 2) с образованием H+ 3) с образованием различных бромпроизводных
B7. В отличие от фенола метанол
1) взаимодействует с растворами щелочей 2) вступает в реакции поликонденсации 3) взаимодействует с бромоводородом
4) при окислении образует формальдегид 5) вступает в реакции этерификации 6) реагирует с хлоридом железа (III)
B8. Диметиламин
Диметиламин
1) твердое вещество 2) плохо растворим в воде 3) взаимодействует с серной кислотой
4) образуется при восстановлении нитросоединений 5) реагирует с бромметаном 6) горит на воздухе
В9. Массовая доля соляной кислоты в растворе, полученном при растворении 11,2 л (н.у.) хлороводорода в 1 л воды, равна ___1,8______ %. (Запишите число с точностью до десятых.)
В10. При растворении сульфида железа (II) в избытке соляной кислоты выделилось 5,6 л (н.у.) газа. Масса сульфида железа (II) равна ___22_____г. (Запишите число с точностью до целых.)
С1. Используя метод электронного баланса, составьте уравнение реакции:
KNO2 + … + h3SO4 → I2 + NO + … + … . Определите окислитель и восстановитель.
KNO2 + 2HI + H2SO4 = 2NO + I2 + K2SO4 + 2H2O
N+3+1ē → N+2 2I— — 2ē → I20 | 2 1 |
KNO2 (N+3) – окислитель, HI (I—) – восстановитель
C2. Даны вещества: алюминий, вода, азотная
кислота (разб. р-р), гидроксид натрия
(конц. р-р).
Даны вещества: алюминий, вода, азотная
кислота (разб. р-р), гидроксид натрия
(конц. р-р).
Напишите четыре уравнения возможных реакций между этими веществами.
2Al(безокс.пя) + 6H2O = 2Al(OH)3 + 3H2↑
NaOH + HNO3 = NaNO3 + H2O
8Al + 30HNO3 = 8Al(NO3)3 + 3NH4NO3 + 9H2O
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
(Допустимо Na3[Al(OH)6])
C3.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
изб.KOH(спирт.),t0 t0C акт СН3Cl, AlCl3 KMnO4,h3SO4,t°
С2Н4 → С2Н4Cl2 ⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯→ X1 ⎯⎯⎯⎯⎯→ X2 ⎯⎯⎯⎯⎯→ X3⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯→С6Н5СООН.
1) С2Н4 + Cl2 → C2h5Cl2
t°
2)
C2h5Сl2 + 2KOH(спирт. ) ⎯⎯
C2h3 + 2KCl + 2h3O
) ⎯⎯
C2h3 + 2KCl + 2h3O
→
t° , Cакт
3) 3C2h3 ⎯⎯⎯⎯ C6H6 →
AlCl3
4) C6H6 + Ch4Cl ⎯⎯⎯ C6H5Ch4 + HCl
→
5) 5C6H5–Ch4 + 6KMnO4 + 9h3SO4 → 5C6H5–COOH + 6MnSO4 +
+ 3K2SO4 + 14h3O
C4. Смешали 100 мл 30%-ного раствора хлорной кислоты (ρ = 1,11 г/мл) и 300 мл 20%-ного раствора гидроксида натрия (ρ = 1,10 г/мл). Сколько миллилитров воды следует добавить к полученной смеси, чтобы массовая доля перхлората натрия в ней составила бы 8%?
1) Записано уравнение реакции:
HСlO4 + NaOH = NaClO4 + h3O
2) Рассчитаны количества веществ реагентов и сделан вывод
об избытке щелочи:
n(NaOH) = 300·1,1·0,2/40 = 1,65 моль – в избытке
n(HСlO4) = 100·1,11·0,3/100,5 = 0,33 моль
3) Вычислена масса продукта реакции:
n(NaClO4) = n(HСlO4) = 0,33 моль
m(NaClO4) = 0,33· 122,5 = 40,4 г
4) Вычислена масса добавленной воды:
40, 4
0,08 = , откуда х = 64 г
100 ⋅ 1,11 + 300 ⋅ 1,1 + x
V(h3O) = 64 мл
C5. Установите молекулярную формулу
третичного амина, если известно, что
при его сгорании выделилось 0,896 л (н.у.)
углекислого газа, 0,99 г воды и 0,112 л (н.у.)
азота.
Установите молекулярную формулу
третичного амина, если известно, что
при его сгорании выделилось 0,896 л (н.у.)
углекислого газа, 0,99 г воды и 0,112 л (н.у.)
азота.
1) Найдены количества веществ углекислого газа, воды и азота:
n(CO2) = 0,896/22,4 = 0,04 моль
n(h3O) = 0,99/18 = 0,055 моль
n(N2) = 0,112/22,4 = 0,005 моль
2) Найдено соотношение атомов в молекуле амина и установлена
молекулярная формула третичного амина:
C:H:N = 0,04:0,11:0,01 = 4:11:1
молекулярная формула (Ch4)2(C2H5)N
Видео с вопросами: Определение количества атомов кислорода, присутствующих в данном количестве молей нитрата алюминия
Сколько атомов кислорода содержится в 4,0 × 10⁻³ молях Al(NO₃)₃? Дайте ответ с точностью до 1 знака после запятой.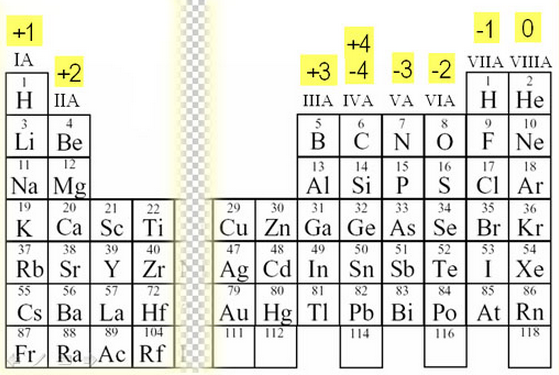
Стенограмма видео
Сколько атомов кислорода в 4,0 умножить на 10 на три отрицательных моля Al(NO3)3? Дайте ответ с точностью до одной запятой место.
Моль — единица измерения количества в системе СИ. вещества. Один моль вещества равен 6,02214076 умножить на 10 в 23 степени сущностей. Это значение известно как Авогадро. число. Нам часто не нужно использовать Число Авогадро с таким уровнем точности и может округлить значение до 6,022 раза. 10 в 23 степени. Сущности могут относиться к любому объекту который подсчитывается, но в химии часто относится к атомам, молекулам, формульные единицы или частицы.
С этой справочной информацией в
ум, вернемся к вопросу. Мы хотим посчитать количество
атомов кислорода там, учитывая моли нитрата алюминия. Мы знаем из определения
моль, что один моль нитрата алюминия будет содержать 6,022 умножить на 10 в 23-й степени.
формульные единицы нитрата алюминия. Мы знаем, что начинаем с 4.0
умножить на 10 на отрицательную треть молей нитрата алюминия. Мы можем умножить это значение на наше
отношение, записанное в виде дроби, с молями нитрата алюминия в
в знаменателе, так что единицы молей нитрата алюминия сокращаются. Выполнение расчета дает нам
значение 2,4088 умножить на 10 до 21-й формульной единицы нитрата алюминия.
Мы знаем из определения
моль, что один моль нитрата алюминия будет содержать 6,022 умножить на 10 в 23-й степени.
формульные единицы нитрата алюминия. Мы знаем, что начинаем с 4.0
умножить на 10 на отрицательную треть молей нитрата алюминия. Мы можем умножить это значение на наше
отношение, записанное в виде дроби, с молями нитрата алюминия в
в знаменателе, так что единицы молей нитрата алюминия сокращаются. Выполнение расчета дает нам
значение 2,4088 умножить на 10 до 21-й формульной единицы нитрата алюминия.
Глядя на химическую формулу
нитрата алюминия, мы видим, что каждая формульная единица нитрата алюминия содержит три
нитрат-ионы. И каждый нитрат-ион содержит три
атомы кислорода. Это означает, что одна формульная единица
нитрат алюминия имеет девять атомов кислорода. Мы знаем, что 2,4088 раз
10 к 21-й формульной единице нитрата алюминия в 4,0 раза 10 к минусу
трети моля нитрата алюминия. Мы также знаем, что одна формульная единица
нитрата алюминия содержит девять атомов кислорода. Мы можем умножить количество
формульные единицы нитрата алюминия по нашему соотношению, записанному в виде дроби, с
формульные единицы нитрата алюминия в знаменателе, так что единицы сокращаются. Выполняем расчет и
определить, что 2,168 умножить на 10 до 22 атомов кислорода.
Мы также знаем, что одна формульная единица
нитрата алюминия содержит девять атомов кислорода. Мы можем умножить количество
формульные единицы нитрата алюминия по нашему соотношению, записанному в виде дроби, с
формульные единицы нитрата алюминия в знаменателе, так что единицы сокращаются. Выполняем расчет и
определить, что 2,168 умножить на 10 до 22 атомов кислорода.
Однако вопрос требует от нас дайте наш ответ с точностью до одного десятичного знака. При соответствующем округлении имеем определили, что 4,0 умножить на 10 до отрицательной трети молей нитрата алюминия содержит 2,2 раза по 10-22 атомов кислорода.
Nagwa использует файлы cookie, чтобы обеспечить вам максимальное удобство на нашем веб-сайте. Узнайте больше о нашей Политике конфиденциальности.
Какова химическая формула нитрата алюминия?
Цитата страницы Начать эссе значок-вопрос Спросите репетитораНачать бесплатную пробную версию
Скачать PDF PDF Цитата страницы Цитировать Поделиться ссылкой ДелитьсяСсылайтесь на эту страницу следующим образом:
«Какова химическая формула нитрата алюминия?» Редакционная статья eNotes , 4 мая 2016 г.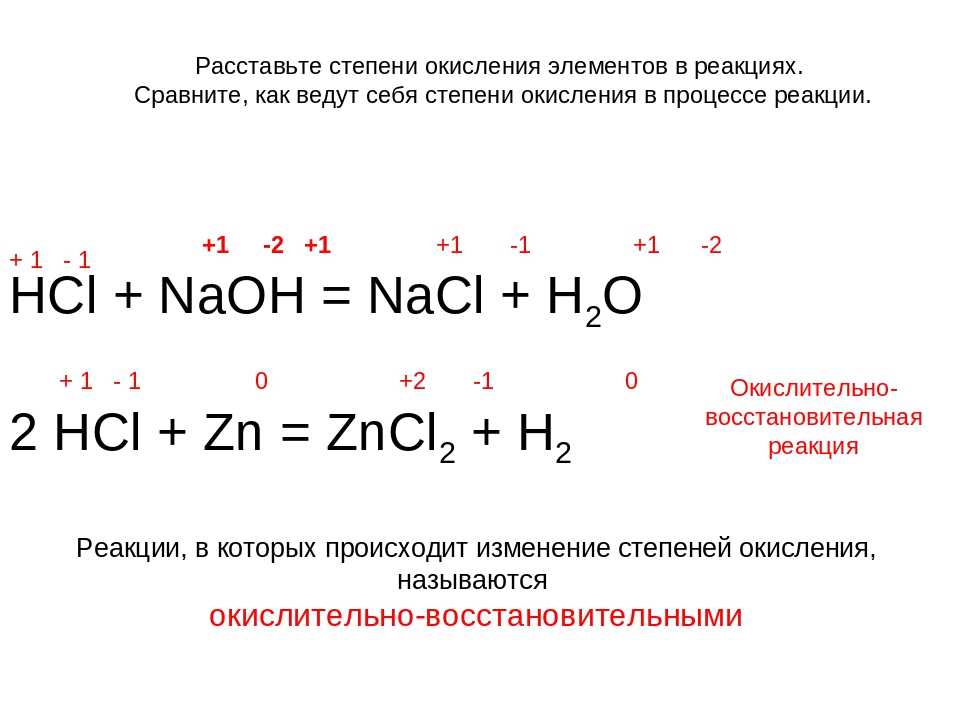 , https://www.enotes.com/homework-help/what-chemical-formula-alluminium-nitrate-666490.
По состоянию на 28 марта 2023 г.
, https://www.enotes.com/homework-help/what-chemical-formula-alluminium-nitrate-666490.
По состоянию на 28 марта 2023 г.
Ответы экспертов
Нитрат алюминия имеет химическую формулу Al(NO3)3 .
Давайте посмотрим, как можно получить эту химическую формулу, зная только название соединения. Алюминий является элементом и имеет химический символ Al. Он имеет общую степень окисления +3 и является металлом. Степень окисления показывает количество потерянных электронов. Нитрат, с другой стороны, является анионом и имеет степень окисления -1. Поскольку ион алюминия формируется путем отдачи 3 электронов, а нитрату требуется только 1 электрон, 3 иона нитрата реагируют с каждым ионом алюминия, в результате чего получается химическая формула Al(NO3)3.
Нитрат алюминия является сильным окислителем и может быть получен реакцией между азотной кислотой и хлоридом алюминия.
Надеюсь, это поможет.
См. eNotes без рекламы
Начните 48-часовую бесплатную пробную версию , чтобы получить доступ к более чем 30 000 дополнительных руководств и более чем 350 000 вопросов помощи при выполнении домашних заданий, на которые ответили наши эксперты.
Уже зарегистрирован? Войдите здесь.
Утверждено редакцией eNotes
Наука
Последний ответ опубликован 17 июля 2012 г. в 14:55:17.
Каковы три части клеточной теории?
16 Ответы педагога
Наука
Последний ответ опубликован 19 сентября 2015 г. в 9:37:47 вечера
Каковы четыре основные функции компьютерной системы?
2 Ответы воспитателя
Наука
Последний ответ опубликован 07 декабря 2018 г. в 12:04:01.
Расположите следующие элементы в порядке от большего к меньшему: клетка, хромосома, ген, ДНК, организм, ядро.
