Золото
| Золото | |
|---|---|
| Атомный номер | 79 |
| Внешний вид простого вещества |
Мягкий ковкий жёлтый металл |
| Свойства атома | |
|
Атомная масса (молярная масса) |
196,96654 а. е. м. (г/моль) |
| Радиус атома | 146 пм |
|
Энергия ионизации (первый электрон) |
889,3 (9,22) кДж/моль (эВ) |
| Электронная конфигурация | [Xe] 4f14 5d10 6s1 |
| Ковалентный радиус | 134 пм |
| Радиус иона | (+3e) 85 (+1e) 137 пм |
|
Электроотрицательность (по Полингу) |
2,54 |
| Электродный потенциал |
Au←Au-3 1,50 В Au←Au+ 1,70В |
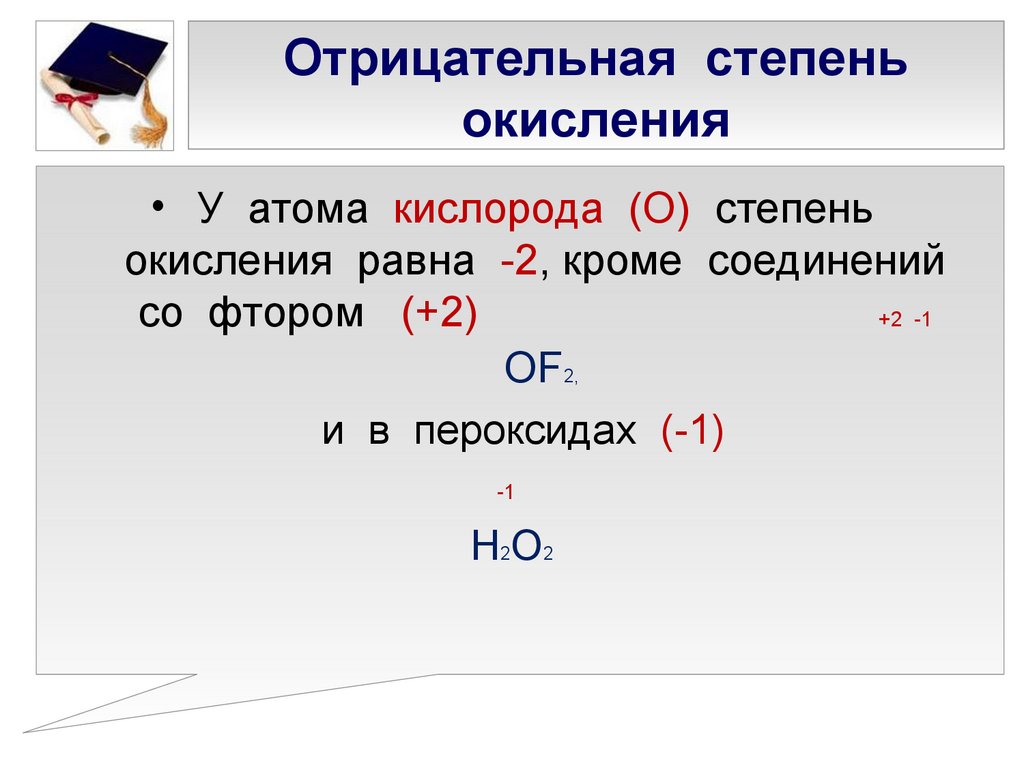
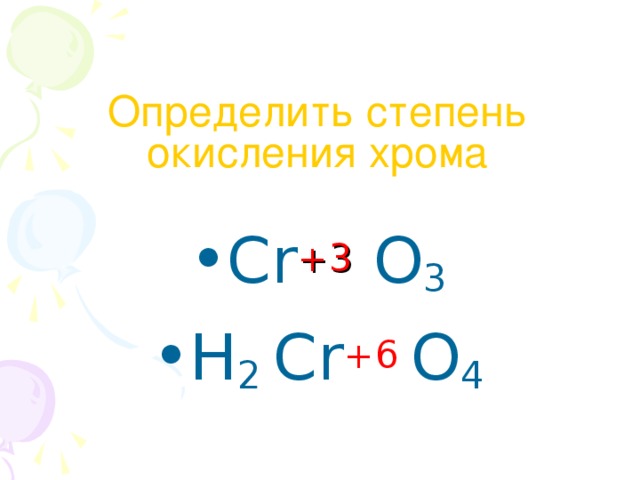
| Степени окисления | -3, 1 |
| Термодинамические свойства простого вещества | |
| Плотность | 19,3 г/см³ |
| Молярная теплоёмкость | 25,39[1]Дж/(K·моль) |
| Теплопроводность | 318 Вт/(м·K) |
| Температура плавления | 1337,58 K |
| Теплота плавления | 12,68 кДж/моль |
| Температура кипения | 3080 K |
| Теплота испарения | ~340 кДж/моль |
| Молярный объём | 10,2 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая гранецентрированая |
| Параметры решётки | 4,080 Å |
| Отношение c/a | n/a |
| Температура Дебая | 170,00 K |
| Au | 79 |
| 196,96654 | |
| [Xe]4f145d106s1 | |
| Золото | |
Золото — элемент побочной подгруппы первой группы, шестого периода периодической системы химических элементов, с атомным номером 79. Обозначается символом Au (лат. Aurum). Простое вещество золото (CAS-номер: 7440-57-5) — благородный металл жёлтого цвета.
Обозначается символом Au (лат. Aurum). Простое вещество золото (CAS-номер: 7440-57-5) — благородный металл жёлтого цвета.
Схема атома золота
Праславянское *zolto (русск. золото, укр. золото, ст.-слав. злато, польск. złoto) родственно лит. geltonas «жёлтый», латыш. zelts «золото, золотой»; с другим вокализмом: готск. gulþ, нем. Gold, англ. gold; далее санскр. hiraṇyam, авест. zaranya «золото», также санскр. hari «жёлтый, золотистый, зеленоватый», от праиндоевропейского корня *ǵʰel- «жёлтый, зелёный, яркий». Отсюда же названия цветов: жёлтый, зелёный.
Связь с корнем «солнце» (sol, др.-греч. ἥλιος) сомнительна.
Свойства золота
Физические свойства
Чистое золото — мягкий металл жёлтого цвета. Красноватый оттенок некоторым изделиям из золота, например, монетам, придают примеси других металлов, в частности меди. В тонких плёнках золото просвечивает зелёным. Золото обладает исключительно высокой теплопроводностью и низким электрическим сопротивлением. Золото — очень тяжёлый металл: шар из чистого золота диаметром 46 мм имеет массу 1 кг. Литровая бутыль, заполненная золотым песком, весит приблизительно16 кг.
Золото — очень тяжёлый металл: шар из чистого золота диаметром 46 мм имеет массу 1 кг. Литровая бутыль, заполненная золотым песком, весит приблизительно16 кг.
Тяжесть золота — плюс для его добычи. Самые простые технологические процессы, такие, как, например, промывка на шлюзах, могут обеспечить весьма высокую степень извлечения золота из промываемой породы.
Золото очень ковко и тягуче. Из кусочка золота массой в один грамм можно вытянуть проволоку длиной в три километра или изготовить золотую фольгу в 500 раз тоньше человеческого волоса (0,0001 мм). Через такой листочек фольги луч света просвечивает зеленоватым цветом. Мягкость чистого золота настолько велика, что его можно царапать ногтем. Поэтому в ювелирных изделиях золото всегда сплавляется с медью или серебром. Состав таких сплавов выражается пробой, которая указывает число весовых частей золота в 1000 частей сплава(в российской практике). Проба химически чистого золота соответствует 999.9 пробе — его ещё называют «банковским» золотом, так как из такого золота изготавливают слитки.
Химические свойства
Золото — самый инертный металл, стоящий в ряду напряжений правее всех других металлов, при нормальных условиях оно не взаимодействует с большинством кислот и не образует оксидов, благодаря чему было отнесено к благородным металлам, в отличие от металлов обычных, легко разрушающихся под действием окружающей среды. Затем была открыта способность царской водки растворять золото, что поколебало уверенность в его инертности.
Наиболее устойчивая степень окисления золота в соединениях +3, в этой степени окисления оно легко образует с однозарядными анионами (F−, Cl−. CN−) устойчивые плоские квадратные комплексы [AuX4]−. Относительно устойчивы также соединения со степенью окисления +1, дающие линейные комплексы [AuX2]−. Долгое время считалось, что +3 — высшая из возможных степеней окисления золота, однако, используя дифторид криптона, удалось получить соединения Au+5
 Соединения золота(V) стабильны лишь со фтором и являются сильнейшими окислителями.
Соединения золота(V) стабильны лишь со фтором и являются сильнейшими окислителями.Степень окисления +2 для золота нехарактерна, в веществах, в которых она формально равна 2, половина золота, как правило, окислена до +1, а половина — до +3, например, правильной ионной формулой сульфата золота(II) AuSO4 будет не Au2+(SO4)2−, а Au1+Au3+(SO4)2−2. Недавно обнаружены комплексы в которых золото все-таки имеет степень окисления +2.
Из чистых кислот золото растворяется только в горячей концентрированной селеновой кислоте:
- 2Au + 6H2SeO4 = Au2(SeO4)3 + 3H2SeO3 + 3H2 O
Золото сравнительно легко реагирует с кислородом и другими окислителями при участии комплексобразователей. Так, в водных растворах цианидов при доступе кислорода золото растворяется, образуя цианоаураты:
- 4Au + 8CN− + 2H2O + O2 → 4[Au(CN)2]− + 4 OH−
В случае реакции с хлором возможность комплексообразования также значительно облегчает ход реакции: если с сухим хлором золото реагирует при ~200 °C с образованием хлорида золота(III), то в концентрированном водном растворе соляной и азотной кислот (царская водка) золото растворяется с образованием хлораурат-иона уже при комнатной температуре:
- 2Au + 3Cl2 + 2Cl− → 2[AuCl4]−
Золото легко реагирует с жидким бромом и его растворами в воде и органических растворителях, давая трибромид AuBr3.
Со фтором золото реагирует в интервале температур 300−400°C, при более низких реакция не идёт, а при более высоких фториды золота разлагаются.
Золото также растворяется во ртути, фактически образуя легкоплавкий сплав (амальгаму).
Физиологическое воздействие
Некоторые соединения золота токсичны, накапливаются в почках, печени, селезёнке и гипоталамусе, что может привести к органическим заболеваниям и дерматитам, стоматитам, тромбоцитопении.
Геохимия золота
Содержание золота в земной коре очень низкое — 3 мкг/кг, но месторождения и участки, резко обогащённые металлом, весьма многочисленны. Золото содержится и в воде. 1 л и морской, и речной воды несёт примерно 4*10−9 г золота.
Для золота характерна самородная форма. Среди других его форм стоит отметить электрум, сплав золота с серебром, который обладает зеленоватым оттенком и относительно легко разрушается при переносе водой. В горных породах золото обычно рассеяно на атомарном уровне.
Различаются первичные месторождения золота, россыпи, в которые оно попадает в результате разрушения рудных месторождений и месторождения с комплексными рудами, в которых золото извлекается в качестве попутного компонента.
Добыча золота
Люди добывают золото с незапамятных времён. С золотом человечество столкнулось уже в V тыс. до н. э. в эпоху неолита благодаря его распространению в самородном состоянии.
По предположению археологов, начало системной добычи было положено на Ближнем Востоке, откуда золотые украшения поставлялись, в частности, в Египет. Именно в Египте в гробнице королевы Зер и одной из королев Пу-аби Ур в Шумерской цивилизации были найдены первые золотые украшения, датируемые III тыс. до н. э.
В России принято считать началом золотодобычи 21 мая (1 июня) 1745 г., когда Ерофей Марков, нашедший золото на Урале, объявил о своем открытии в Канцелярии Главного правления заводов в Екатеринбурге.
За всю историю человечеством добыто около 140 тыс. т золота.
В 2007 году добыли 2 380 т золота, а в 2008 — 2 330 т. Лидерами добычи стали: Китай (добыл в 2007 году 275 т, а в 2008 г. — 295 т), ЮАР (252/250), США (238/230), Австралия (246/225), Перу (170/175), Россия (157/165), Канада (101/100), Индонезия (118/90), Узбекистан (85/85), Гана (84/84), Папуа — Новая Гвинея (65/65), Чили (42/42), Мексика (39/41), Бразилия (40/40).
В России существует около 16 золотодобывающих компаний. Лидером добычи золота в России является компания Полюс Золото на которую приходится около 20 % рынка. Наибольшее количество золота добывается в Чукотском АО, Красноярском крае и Амурской области. [3]
Разведанные мировые запасы золота оцениваются в 100 тыс. т.
Получение
Золотой самородок
Для получения золота используются его основные физические и химические свойства: присутствие в природе в самородном состоянии, способность реагировать лишь с немногими веществами (ртуть, цианиды). C развитием современных технологий более популярными становятся химические способы.
C развитием современных технологий более популярными становятся химические способы.
Промывка
Метод промывки основан на высокой плотности золота, благодаря которой в потоке воды, минералы с плотностью меньше золота (а это почти все минералы земной коры) смываются и металл концентрируется в тяжёлой фракции, песка состоящего из минералов повышенной плотности, который называется шлихом. Этот процесс называется отмывкой шлиха или шлихованием. В небольших объёмах её можно проводить вручную, при помощи промывочного лотка. Этот способ используется с древнейших времён, и до сих пор для отработки маленьких россыпных месторождений старателями, но основное его применение — поиск месторождений золота, алмазов и других ценных металлов.
Промывка используется для разработки крупных россыпных месторождений, но при этом применяются специальные технические устройства: драги и промывочные устройства. Полученные шлихи, кроме золота, содержат множество других плотных минералов и металл из них извлекается, например, путём амальгамации.
Методом промывки разрабатываются все россыпные месторождения золота, ограничено он применяется на коренных месторождениях. Для этого породу дробят и затем подвергают промывке. Этот метод не может быть применён на месторождениях с рассеянным золотом, где оно так распылено в породе, что после дробления не обособляется в отдельные зёрна и смывается при промывке вместе с другими минералами. К сожалению, при промывке теряется не только мелкое золото, которое легко смывается с промывочной колоды, но и крупные самородки, гидравлическая крупность которых не позволяет им спокойно оседать в ячейках коврика. Поэтому на драгах и на промприборах обязательно следят за крупными катящимися обломками — это вполне могут оказаться самородки!
Этот метод добычи золота исторически был первым, и он очень дёшев, потому что не требует строительства дорогих заводов, и в случае речных отложений не нужно дробить породу. Экономически рентабельна отработка россыпей с содержанием золота более 0,1 г на 1 кубический метр рыхлой породы (песков, суглинков и т. д.).
д.).
Амальгамация
Метод амальгамации основан на способности ртути образовывать сплавы — амальгамы с различными металлами, в том числе и с золотом. В этом методе увлажнённая дроблёная порода смешивалась со ртутью и подвергалась дополнительному измельчению в мельницах — бегунных чашах. Амальгаму золота (и сопутствующих металлов) извлекали из получившегося шлама промывкой, после чего ртуть отгонялась из собранной амальгамы и использовалась повторно. Метод амальгамации известен с I века до н. э., наибольшие масштабы приобрёл в американских колониях Испании начиная с XVI века: это стало возможным благодаря наличию в Испании огромного ртутного месторождения — Альмаден. В более позднее время использовался метод внешней амальгамации, когда дроблёная золотоносная порода при промывке пропускалась через обогатительные шлюзы, выстланные медными листами, покрытыми тонким слоем ртути. Метод амальгамации применим только на месторождениях с высоким содержанием золота или уже при его обогащении. Сейчас он используется очень редко, главным образом старателями в Африке и Южной Америке.
Сейчас он используется очень редко, главным образом старателями в Африке и Южной Америке.
Цианирование
Золото растворяется в растворах синильной кислоты и её солей, и это его свойство дало начало ряду методов извлечения путем цианирования руд.
Метод цианирования основан на реакции золота с цианидами в присутствии кислорода воздуха: измельчённая золотоносная порода обрабатывается разбавленным (0,3-0,03 %) раствором цианида натрия, золото из образующегося раствора цианоаурата натрия Na[Au(CN)2] осаждается либо цинковой пылью, либо на специальных ионнообменых смолах.
Метод цианирования первоначально применялся на крупных заводах, где порода дробилась и цианирование проводилось в специальных чанах. Однако развитие технологии привело к появлению метода кучного выщелачивания, который заключается в следующем: готовится водонепроницаемая площадка, на неё насыпается руда и её орошают растворами цианидов, которые, просачиваясь через толщу породы, растворяют золото. После этого они поступают в специальные сорбционные колонны, в которых золото осаждается, а регенерированный раствор вновь отправляется на кучу.
После этого они поступают в специальные сорбционные колонны, в которых золото осаждается, а регенерированный раствор вновь отправляется на кучу.
Метод цианирования ограничен минеральным составом руд, он неприменим, если руда содержит большое количество сульфидов или арсенидов, так как цианиды реагируют с этими минералами. Поэтому цианированием перерабатываются малосульфидные руды или руды из зоны окисления, в которой сульфиды и арсениды окислены атмосферным кислородом.
Для извлечения золота из сульфидных руд используются сложные многоэтапные технологии. Золото, добытое из месторождений, содержит различные примеси, поэтому его подвергают специальным процессам высокой очистки, которые производятся на аффинажных заводах.
Регенерация
Осуществляется действием 10 % раствора щелочи на растворы солей золота с последующим осаждением аффинажного золота на алюминий из горячего раствора гидрооксида.
Применение
Имеющееся в настоящее время в мире золото распределено так: около 10 % — в промышленных изделиях, остальное делится приблизительно поровну между централизованными запасами (в основном, в виде стандартных слитков химически чистого золота), собственностью частных лиц в виде слитков и ювелирными изделиями.
Как объект инвестирования
Золото является важнейшим элементом мировой финансовой системы, поскольку данный металл не подвержен коррозии, имеет много сфер технического применения, а запасы его невелики. Золото практически не терялось в процессе исторических катаклизмов, а лишь накапливалось и переплавлялось. В настоящее время мировые банковские резервы золота оцениваются в 32 тыс. тонн (если сплавить все это золото воедино, получится куб со стороной всего лишь 12 м).
Золото издавна использовалось многими народами в качестве денег. Золотые монеты — самый хорошо сохраняющийся памятник старины. Однако как монопольный денежный товар оно утвердилось только к XIX веку. Вплоть до Первой мировой войны все мировые валюты были основаны на золотом стандарте (период 1870—1914 называют «золотым веком»). Бумажные купюры в это время выполняли роль удостоверений о наличии золота. Они свободно обменивались на золото.
В промышленности
По своей химической стойкости и механической прочности золото уступает большинству платиноидов, но незаменимо, как материал для электрических контактов. Поэтому в микроэлектронике золотые проводники и гальванические покрытия золотом контактных поверхностей, разъёмов, печатных плат используются очень широко.
Поэтому в микроэлектронике золотые проводники и гальванические покрытия золотом контактных поверхностей, разъёмов, печатных плат используются очень широко.
Золото используется в качестве мишени в ядерных исследованиях, в качестве покрытия зеркал, работающих в дальнем инфракрасном диапазоне, в качестве специальной оболочки в нейтронной бомбе.
Золотые припои очень хорошо смачивают различные металлические поверхности и применяются при пайке металлов. Тонкие прокладки, изготовленные из мягких сплавов золота, используются в технике сверхвысокого вакуума.
Золочение металлов (в древности — исключительно амальгамный метод, в настоящее время — преимущественно гальваническое) широко используется в качестве метода защиты от коррозии. Хотя такое покрытие неблагородных металлов имеет существенные недостатки (мягкость покрытия, высокий потенциал при точечной коррозии), оно распространено также из-за того, что готовое изделие приобретает вид очень дорогого, «золотого».
Золото зарегистрировано в качестве пищевой добавки Е175.
В ювелирных изделиях
Золотые изделия. Золотая медаль полученная художником Гореловым Г.Н. в 1909 на Международной выставке в Мюнхене за картину «Осмеяние еретиков» и золотые обручальные кольца супругов Горелова Г.Н и Гореловой Т. Н.
Традиционным и самым крупным потребителем золота является ювелирная промышленность. Ювелирные изделия изготавливают не из чистого золота, а из его сплавов с другими металлами, значительно превосходящими золото по механической прочности и стойкости. В настоящее время для этого служат сплавы Au-Ag-Cu, которые могут содержать добавки цинка, никеля, кобальта, палладия. Стойкость к коррозии таких сплавов определяются, в основном, содержанием в них золота, а цветовые оттенки и механические свойства — соотношением серебра и меди.
Важнейшей характеристикой ювелирных изделий является их проба, характеризующая содержание в них золота.
В стоматологии
Значительные количества золота потребляет стоматология: коронки и зубные протезы изготовляют из сплавов золота с серебром, медью, никелем, платиной, цинком. Такие сплавы сочетают коррозионную стойкость с высокими механическими свойствами.
В фармакологии
Соединения золота входят в состав некоторых медицинских препаратов, используемых для лечения ряда заболеваний (туберкулёза,ревматоидных артритов и т. д.). Радиоактивное золото используют при лечении злокачественных опухолей
Цены на золото
Цены на золото после дефолта США по золоту
В 1792 в США было установлено, что 1 унция золота будет стоить 19,3 $. В 1834 году за унцию давали уже 20,67 $, поскольку США не имели достаточного золотого запаса, чтобы обеспечить весь объём выпущенных денег, и курс валюты приходилось снижать.
После Первой мировой войны девальвация продолжалась. В 1934 году за 1 унцию золота давали 35 $. Несмотря на экономический кризис, США пытались сохранить фиксированную привязку доллара к золоту, ради этого поднималась учётная ставка, но это не помогло. Однако в связи с последовавшими войнами золото из Старого Света стало перемещаться в Новый, что восстановило на время привязку доллара к золоту.
Несмотря на экономический кризис, США пытались сохранить фиксированную привязку доллара к золоту, ради этого поднималась учётная ставка, но это не помогло. Однако в связи с последовавшими войнами золото из Старого Света стало перемещаться в Новый, что восстановило на время привязку доллара к золоту.
В 1944 было принято Бреттон-Вудское соглашение. Был введен золотодевизный стандарт, основанный на золоте и двух валютах — долларе США и фунте стерлингов Великобритании, что положило конец монополии золотого стандарта. Согласно новым правилам, доллар становился единственной валютой, напрямую привязанной к золоту. Казначейство США обязывалось обменивать доллары на золото иностранным правительственным учреждениям и центральным банкам в соотношении 35 $ за тройскую унцию. Фактически золото превратилось из основной в резервную валюту.
В конце 1960-х годов высокая инфляция в США вновь сделала невозможным сохранение золотой привязки на прежнем уровне, ситуацию осложнял и внешнеторговый дефицит США. Рыночная цена золота стала ощутимо превышать официально установленную. В 1971 содержание золота в долларе было снижено до 38 $ за унцию, а в 1973 — до 42,22 $ за унцию. В 1971 президент США Ричард Никсон отменил привязку доллара к золоту, хотя официально этот шаг был подтвержден лишь в 1976, когда была создана так называемая ямайская валютная система плавающих курсов. Это означало, что доллар больше не был обеспечен ничем, кроме долговых обязательств США.
Рыночная цена золота стала ощутимо превышать официально установленную. В 1971 содержание золота в долларе было снижено до 38 $ за унцию, а в 1973 — до 42,22 $ за унцию. В 1971 президент США Ричард Никсон отменил привязку доллара к золоту, хотя официально этот шаг был подтвержден лишь в 1976, когда была создана так называемая ямайская валютная система плавающих курсов. Это означало, что доллар больше не был обеспечен ничем, кроме долговых обязательств США.
Цены на золото с учетом инфляции
После этого золото превратилось в особый инвестиционный товар. Инвесторы на протяжении многих лет доверяли исключительно золоту. К концу 1974 цены на золото подскочили до 195 $ за унцию, а к 1978 — до 200 $ за унцию. К началу 1980 года цена на золото достигло рекордной отметки — 850 $ за унцию (свыше 2000 в ценах 2008 года), после чего она начала постепенно падать. В конце 1987 года она составляла около 500 $ за унцию. Самое быстрое падение произошло в 1996—1999 гг. , когда цена на золото снизилась с 420 до 260 $ за унцию.
, когда цена на золото снизилась с 420 до 260 $ за унцию.
Как бы то ни было, падение прекратилось и снова начался рост цены на золото в связи с соглашением ведущих центральных банков об ограничении продаж золота в 1999 году. К концу 2006 года цена на унцию золота достигла 620 $, а к концу 2007 года уже около 800 $. В начале 2008 года цена золота превысила рубеж в 1000 долларов за унцию. Тем не менее, в сравнимых ценах золото не дошло до пика 80х — выше 2000$. В середине октября 2009 года цена золота колебалась в пределах 1060 $ — 1070 $ за тройскую унцию.[4]
Золото для инвестиций выступает в нескольких формах — золотые слитки, золотые монеты, золотой песок. Инвестиционные монеты являются лучшим средством для инвестиций в РФ: покупатель не платит НДС. Тем не менее, цена за 1 грамм золота в монетах в России превышает цену 1 грамма в слитках даже с учетом НДС и процентов на спред последнего (например, в Сбербанке РФ). В отличие от аукционов E-bay, где стоимость чётко коррелирует с мировой ценой. Золото в монетах чеканки Uncirculated (название чеканки для инвестиционных монет) может стоить на 20-30 % дороже золота в слитках 50 или 100 граммовых, даже с учетом того, что за золото в слитке платится 18 % НДС и проценты так называемого «спреда» банку (около 2 % на покупку золота банком и 2 % на его продажу Вам, то есть в сумме около 4 % помимо НДС).
Золото в монетах чеканки Uncirculated (название чеканки для инвестиционных монет) может стоить на 20-30 % дороже золота в слитках 50 или 100 граммовых, даже с учетом того, что за золото в слитке платится 18 % НДС и проценты так называемого «спреда» банку (около 2 % на покупку золота банком и 2 % на его продажу Вам, то есть в сумме около 4 % помимо НДС).
Кроме того, динамика цен на золото является важнейшим экономическим индикатором, позволяя оценить склонность инвесторов к риску. Зачастую можно наблюдать, что цена на золото и фондовые индексы движутся в противофазе, так как в периоды неустойчивой экономической ситуации инвесторы предпочитают консервативные активы, защищенные от полного обесценивания. И наоборот, когда ожидания роста экономики становятся оптимистичнее, аппетиты к повышенной доходности растут, заставляя котировки жёлтого металла снижаться.
Золотой запас России
Предполагаемые золотые резервы стран мира в 2006
См. также Золотой запас Российской империи
также Золотой запас Российской империи
Запасы золота в государственном резерве России в декабре 2008 г. составили 495,9 тонн (2,2 % от всех государств мира).[5] Доля золота в общем объёме золотовалютных резервов России в марте 2006 составила 3,8 %. Россия занимает 9 место в мире по объёму золота, находящегося в государственном резерве.
Уровень международных резервов
Международные резервы стран мира в 2006
Государства с наибольшими международными резервами.
|
В десятке данных стран находится более 50 процентов от общих международных резервов мира.
Меры чистоты золота
Британская каратная система
Традиционно чистота золота измеряется в британских каратах. 1 британский карат равен одной двадцать четвёртой части массы сплава. 24-каратное золото (24K) является чистым, без каких-либо примесей.
Чтобы изменить качественные характеристики золота, для различных целей (например, увеличить твёрдость) изготавливают сплавы с различными примесями. Например, 18-каратное золото (18K) означает содержание в сплаве 18 частей золота и 6 частей примесей.
Российская система проб
Принятая в России система отличается от британской и аналогична принятой в Германии. В России чистота золота измеряется пробой.
Проба варьируется от 0 до 1000 и показывает содержание золота в тысячных долях. Так, 18-каратное золото соответствует 750-й пробе. Золото 999,96-й пробы считается «практически чистым», именно такой пробы оно и бывает в слитках. Золото 999,99 пробы крайне дорого в получении и употребляется только в химии. В отечественной ювелирной промышленности изготавливаются ювелирные изделия из золота 375, 500, 585, 750, 900, 916 и 958 пробы. По просьбе физического лица пробирная инспекция может поставить 583 пробу, хотя во многих странах бывшего СССР отказались от 583 пробы и оставили 585,например в Латвии.
В отечественной ювелирной промышленности изготавливаются ювелирные изделия из золота 375, 500, 585, 750, 900, 916 и 958 пробы. По просьбе физического лица пробирная инспекция может поставить 583 пробу, хотя во многих странах бывшего СССР отказались от 583 пробы и оставили 585,например в Латвии.
Периодическая система химических элементов Менделеева:
|
IA |
IIA |
IIIB |
IVB |
VB |
VIB |
VIIB |
—- |
VIIIB |
—- |
IB |
IIB |
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
|
| Период | ||||||||||||||||||
| 1 |
1
H |
2
He |
||||||||||||||||
| 2 |
3
Li |
4
Be |
5
B |
6
C |
7
N |
8
O |
9
F |
10
Ne |
||||||||||
| 3 |
11
Na |
12
Mg |
13
Al |
14
Si |
15
P |
16
S |
17
Cl |
18
Ar |
||||||||||
| 4 |
19
K |
20
Ca |
21
Sc |
22
Ti |
23
V |
24
Cr |
25
Mn |
26
Fe |
27
Co |
28
Ni |
29
Cu |
30
Zn |
31
Ga |
32
Ge |
33
As |
34
Se |
35
Br |
36
Kr |
| 5 |
37
Rb |
38
Sr |
39
Y |
40
Zr |
41
Nb |
42
Mo |
(43)
Tc |
44
Ru |
45
Rh |
46
Pd |
47
Ag |
48
Cd |
49
In |
50
Sn |
51
Sb |
52
Te |
53
I |
54
Xe |
| 6 |
55
Cs |
56
Ba |
* |
72
Hf |
73
Ta |
74
W |
75
Re |
76
Os |
77
Ir |
78
Pt |
79
Au |
80
Hg |
81
Tl |
82
Pb |
83
Bi |
(84)
Po |
(85)
At |
86
Rn |
| 7 |
87
Fr |
88
Ra |
** |
(104)
Rf |
(105)
Db |
(106)
Sg |
(107)
Bh |
(108)
Hs |
(109)
Mt |
(110)
Ds |
(111)
Rg |
(112)
Cp |
(113)
Uut |
(114)
Uuq |
(115)
Uup |
(116)
Uuh |
(117)
Uus |
(118)
Uuo |
| 8 |
(119)
Uue |
(120)
Ubn |
||||||||||||||||
| Лантаноиды * |
57
La |
58
Ce |
59
Pr |
60
Nd |
(61)
Pm |
62
Sm |
63
Eu |
64
Gd |
65
Tb |
66
Dy |
67
Ho |
68
Er |
69
Tm |
70
Yb |
71
Lu |
|||
| Актиноиды ** |
89
Ac |
90
Th |
91
Pa |
92
U |
(93)
Np |
(94)
Pu |
(95)
Am |
(96)
Cm |
(97)
Bk |
(98)
Cf |
(99)
Es |
(100)
Fm |
(101)
Md |
(102)
No |
(103)
Lr |
|||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
Золото – один из первых металлов, ставших
известным человеку.
Золото традиционно добывали из речного песка методом промывания, что связано с его высокой плотностью (19,3 г см3) по сравнению с песком (около 2,5 г/см3). Однако такие источники большей частью выработаны. Современное производство основано на добыче из золотоносных горных пород, обычно содержащих 5•10–4–15•10–4% золота. Горную породу размалывают в мелкий порошок, из которого металл выделяют с помощью цианидного процесса. Золото выщелачивают из раздробленной породы с помощью насыщенного воздухом разбавленного раствора цианида: 4Au + 8CN– + 2H2O + O2 = 4[Au(CN)2]– + 4OH–. Затем металл осаждают добавлением цинковой пыли: 2[Au(CN)2]– + Zn = 2Au + [Zn(CN)4]2–. Используют также амальгамирование ртутью, из
полученной амальгамы ртуть испаряют. Для
получения золота чистотой 99,99% применяют
электролитическое рафинирование.
Золото является наиболее
электроотрицательным из всех металлов. Физические свойства
Металлическое золото имеет
характерный желтый цвет. Оно очень мягкое,
тягучее и пластичное. Из 1 г золота можно выковать
лист площадью около 1 м2 и толщиной всего в
240 атомов. Твердый металл имеет
гранецентрированную кубическую решетку.
Химические свойства Золото можно получить в красной, синей и
фиолетовой коллоидных формах добавлением
различных восстановителей к очень разбавленным
водным растворам хлорида золота(III). При
использовании в качестве восстановителя хлорида
олова(II) образуется чрезвычайно устойчивый
«пурпур Кассия». °(Au+/Au) = +1,691 В. Благодаря устойчивости золота к действию
воздуха, даже при нагревании, оно было названо
алхимиками благородным металлом. Химическая
активность золота очень низка. Так, это
единственный металл, который непосредственно не
реагирует с серой.
С другими кислотами оно не взаимодействует, однако растворяется в концентрированной соляной кислоте в присутствии сильных окислителей, например концентрированной азотной кислоты: Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O. Смесь концентрированной соляной и
концентрированной азотной кислот (1:3) была
названа алхимиками «царской водкой», поскольку
она растворяет «царя металлов». 2K[AuCl4] + 6KOH = Au2O3•2H2O + 8KCl + H2O, Au2O3•2H2O = Au2O3 + 2H2O. Это единственный оксид золота, образование которого точно установлено. Он разлагается при нагревании выше 160 °С. В присутствии воды проявляет слабые кислотные свойства, растворяясь в щелочах и образуя соли, содержащие ион [Au(OH)4]–: Au2O3 + 2KOH + 3H2O = 2K[Au(OH)4]. Этот оксид реагирует также с хлороводородной кислотой с образованием комплексного иона: Au2O3 + 8HCl = 2H[AuCl4] + 3H2O. Действие сероводорода на водный раствор
соединения золота(I) приводит к осаждению
сульфида состава Au2S, а при пропускании
сероводорода через холодный раствор хлорида
золота(III) в эфире образуется Au2S3,
который легко восстанавливается до сульфида
золота(I) или до металла при добавлении воды. * Числовая оценка среднего содержания элемента в земной коре, атмосфере, биосфере. Кларк выражается в атомных процентах или единицах массы (г/т и др.). ЛИТЕРАТУРАGreenwood N.N., Earnshaw A. Е.В.САВИНКИНА(Москва) |
Для скачивания — Кафедра химии
- Главная
- Университет
- Для скачивания
- Кафедра химии
Лекция. Растворы неэлектролитов
Размер файла:
638.79 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Растворы неэлектролитов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 33 с.
Учебно-методическое пособие включает лекцию по теме «Растворы неэлектролитов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Окислительно-восстановительные реакции
Размер файла:
609. 98 kB
98 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Окислительно – восстановительные реакции. Лекция по курсу «Общая химия » для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекцию по теме «Окислительно – восстановительные реакции» и предназначено для контролируемой самостоятельной работы студентов инженерно–технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Комплексные соединения
Размер файла:
531.46 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Лекция «Комплексные соединения» по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 26 с.
Учебно-методическое пособие включает лекцию по теме «Комплексные соединения» курса «Общая химия».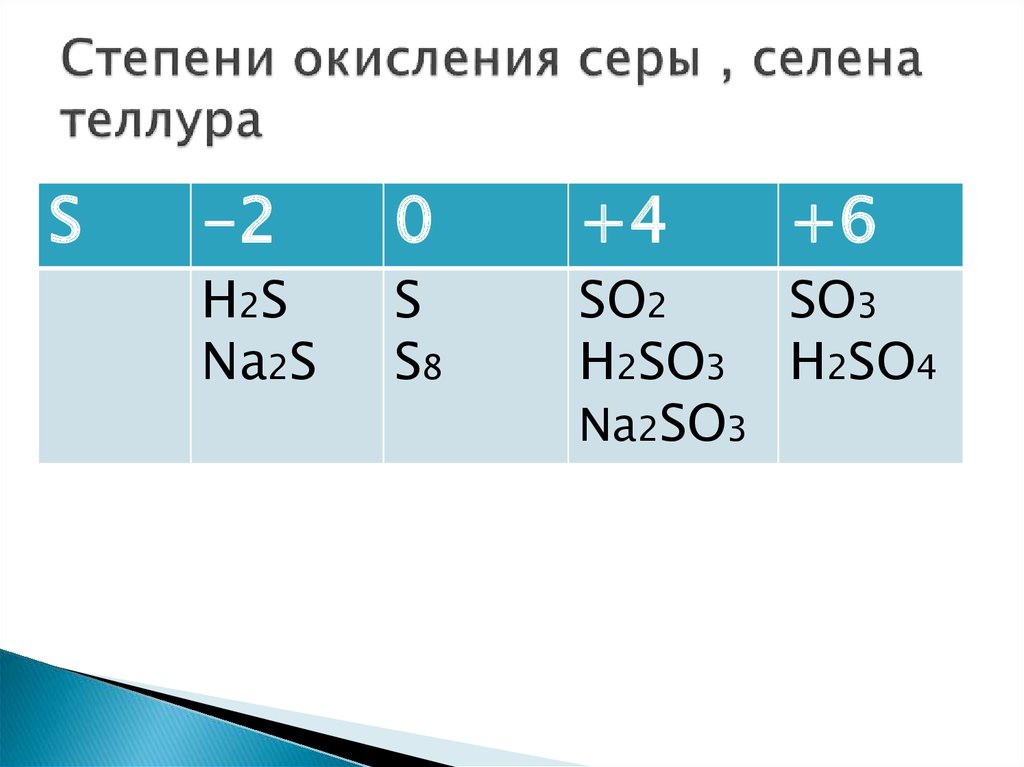 Комплексные соединения играют важную роль в природе и технике, прежде всего, это ферментативные и фотохимические процессы, перенос кислорода в биологических системах, тонкая технология редких металлов, каталитические реакции и т.д. Координационные свойства проявляются всеми элементами периодической системы.
Комплексные соединения играют важную роль в природе и технике, прежде всего, это ферментативные и фотохимические процессы, перенос кислорода в биологических системах, тонкая технология редких металлов, каталитические реакции и т.д. Координационные свойства проявляются всеми элементами периодической системы.
Скачать
Лекция. Кинетика химических реакций. Химическое равновесие
Размер файла:
768.32 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Кинетика химических реакций. Химическое равновесие. Лекции по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 44 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Предэкзаменационные тесты по органической и биологической ХИМИИ
Размер файла:
1.30 MB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
26.12.2016 12:02
Предэкзаменационные тесты по органической и биоло-гической химии для студентов биотехнологического факультета / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 205 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на биотехнологическом факультете, по предмету «Химия (органическая и биологическая)»
Скачать
Лекция. Электролиз. Коррозия металлов и методы защиты металлов от коррозии
Размер файла:
758.87 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Электролиз. Коррозия металлов и методы защиты металлов от коррозии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Энергетика химических процессов.
Размер файла:
604.00 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Энергетика химических процессов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 25 с.
Учебно-методическое пособие включает лекцию по теме «Энергетика химических процессов» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Строение атомов элементов
Размер файла:
789.90 kB
Автор:
Апанович, З.В.
Дата:
26. 12.2016 12:02
12.2016 12:02
Строение атомов элементов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 23 с.
Учебно-методическое пособие включает лекцию по теме «Строение атомов элементов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Основные понятия и законы химии
Размер файла:
675.23 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Основные понятия и законы химии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 30 с.
Учебно-методическое пособие включает лекцию по теме «Основные понятия и законы химии» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование студентами распечатки лекционной темы значительно сэкономит время для понимания материала, излагаемого лектором, и конспектирования.
Использование студентами распечатки лекционной темы значительно сэкономит время для понимания материала, излагаемого лектором, и конспектирования.
Скачать
Предэкзаменационные тесты по химии
Размер файла:
813.02 kB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
14.11.2016 11:47
Предэкзаменационные тесты по химии для студентов, обучающихся на агробиологических специальностях / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 201 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на агробиологических специальностях, по предмету «Химия».
Скачать
Методическое пособие для лабораторных работ по аналитической химии
Размер файла:
544.41 kB
Автор:
Апанович З.В., Тараненко Т.В., Томашева Е.В., Кулеш И.В., Цветницкая Э.В.
Дата:
28.12.2015 12:22
В пособие излагается материал по аналитической химии в объеме соответствующих программ по специальностям: «Ветеринарная медицина», «Аграномия», «Биотехналогия». Содержатся методические указания по технике выполнения лабораторных работ по качественному и количественному анализу.
Содержатся методические указания по технике выполнения лабораторных работ по качественному и количественному анализу.
Скачать
Комментарии для работы с рабочими тетрадями по химии элементов
Размер файла:
655.75 kB
Дата:
28.12.2015 12:22
Комментарии для работы с рабочими тетрадями по химии элементов / З.В. Апанович, Ю.А. Лукашенко.
Учебно-методическое пособие включает лекции по отдельным темам курса «Неорганическая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета, для которых введен отдельный курс по химии элементов, а также может быть использовано студентами других факультетов.
Скачать
Практикум по физической химии
Размер файла:
1.03 MB
Дата:
01.04.2013 04:24
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
Практикум по физической химии: учеб.-мет. пособие / О. И. Валентюкевич.- Гродно: ГГАУ, 2008 – 88с.
Валентюкевич.- Гродно: ГГАУ, 2008 – 88с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Коллоидная химия
Размер файла:
834.37 kB
Дата:
01.04.2013 04:09
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
К-60 Практикум по физической химии: учеб.-мет. пособие / И. В. Кулеш, О. И. Валентюкевич.- Гродно: ГГАУ, 2013 – 94с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Курс лекций по дисциплине «Неорганическая химия»
Размер файла:
1.33 MB
Дата:
28.12.2015 12:22
Лекции по курсу «Неорганическая химия »для студентов инженерно – технологического факультета / З. В. Апанович.
В. Апанович.
Скачать
Рабочая тетрадь и методические указания по неорганической химии
Размер файла:
701.32 kB
Дата:
28.12.2015 12:23
Рабочая тетрадь и методические указания по неорганической химии. Для студентов технологических специальностей / З.В. Апанович.
Скачать
Ионные равновесия и обменные реакции в растворах электролитов
Скачать
Лабораторные работы по химии элементов для студентов технологических специальностей
Скачать
Университет
НЕАКТИВНЫЕ МЕТАЛЛЫ Сu 2 Hg Ag Pt Au
НЕАКТИВНЫЕ МЕТАЛЛЫ Сu, 2 Hg, Ag, Pt, Au
Cu • Медь — элемент побочной подгруппы А — группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. • 3 s² 3 p⁶ 3 d¹⁰ 4 s¹ — электронная конфигурация атома • В соединениях медь проявляет две основные степени окисления: +1 и +2. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3, +4, +5. • Возможные Валентности: II и I.
В необычных условиях можно получить соединения со степенью окисления +3, +4, +5. • Возможные Валентности: II и I.
Нахождение в природе и важнейшие соединения: • Содержание меди в земной коре составляет 0, 005%, что позволяет ей занимать лишь 23 -е место среди всех элементов. • Чаще встречается в соединениях, нежели в свободном виде. • Подавляющая часть меди присутствует в горных породах. • Соединения: куприт Cu 2 O, борнит Cu 5 Fe. S 4 , халькопирит (медный колчедан) — Cu. Fe. S₂; халькозин (медный блеск) — Cu₂S; ковеллин — Cu. S; малахит — Cu 2 CO 3(OH)2; и азурит — Cu 3(CO 3)2(OH)2.
Получение Меди: • Исходным сырьем для промышленного получения меди служат главным образом сульфидные руды, Этот Процесс получения меди относят к пирометаллургическим (протекающим при высокой температуре). Он представляет из себя окислительный обжиг: • Cu₂S+2 О₂=2 Cu. O+SO₂ К образовавшемуся оксиду меди (II) добавляют новую порцию сульфида. При высокой температуре протекает реакция: 2 Cu. O+Cu₂S=4 Cu+SO₂ Таким способом получают черновую медь, которую дальше подвергают рафинированию.
O+Cu₂S=4 Cu+SO₂ Таким способом получают черновую медь, которую дальше подвергают рафинированию.
Медь: Пластичный, переходный металл золотисто – розового цвета. Высокая теплопроводность. Встречается в свободном виде и в соединениях Пластична. На воздухе быстро покрывается оксидной плёнкой, кот. Придает красновато-жёлтый оттенок. В природе находится в осадочных породах. Применение: электротехника (производство кабелей, проводов), гальванотехника (покрытия, изготовление изделий сложной формы), ювелирные сплавы(добавляется к золоту). Высокая биологическая роль! Находится во многих ферментах. Химические свойства: 1. С концентр. холодной серной кислотой:
2. С концентр. Горячей серной кислотой 3. С разбавл. Серной кислотой 4. С концентр. Азотной кислотой 5. С разбавл. Азотной к-той 6. С царской водкой 7. С некоторыми кислотами
8. С кислородом: 2 Cu+O₂=2 Cu. O 9. C неметаллами: Cu+S=Cu. S 10. C кислотными и основными оксидами: 2 Cu+ 2 NO=2 Cu. O+N₂ 4 Cu + 2 NO₂=4 Cu. O+N₂
O+N₂ 4 Cu + 2 NO₂=4 Cu. O+N₂
• • • Интересные факты Медь, как полагают, — первый металл, который человек научился обрабатывать и использовать для своих нужд. Найденные в верховьях реки Тигр изделия из меди датируются десятым тысячелетием до нашей эры. Позднее широкое применение сплавов меди связано с бронзовым веком, и в дальнейшем сопровождало развитие цивилизации на всех этапах. Медь и ее сплавы использовались для изготовления посуды, утвари, украшений, различных художественных изделий. Латинское название меди происходит от названия острова Кипра (Cuprus), где в древности добывали медную руду; В Японии медным трубопроводам для газа в зданиях присвоен статус «сейсмостойких» . Инструменты, изготовленные из меди и её сплавов не создают искр, а потому применяются там, где существуют особые требования безопасности (огнеопасные, взрывоопасные производства). В организме взрослого человека содержится до 80 мг меди. Учёные установили, что в тех водоёмах, где присутствует медь, рыбы отличаются крупными габаритами. В прудах или озёрах, где меди нет, быстро развивается грибок, который поражает рыб.
В прудах или озёрах, где меди нет, быстро развивается грибок, который поражает рыб.
Hg • Ртуть — элемент побочной подгруппы второй группы шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80. • В природе находится как в самородном виде, так и образует ряд минералов. • Электронная конфигурация: 5 s 25 p 65 d 106 s 2; • Валентности: |, || • Степени окисления: +1, +2
Важнейшие соединения: • Hg. O , оксид ртути, имеет аллотропные модификации: • Жёлтый оксид ртути, Красный оксид ртути. • Хлорид ртути(I), Hg. Cl, каломель. • Хлорид ртути(II), Hg. Cl₂, сулема • Амидохлорид ртути (белый преципитат ртути) Hg(NH 2)Cl • Нитрат ртути(II) Hg 2(NO 3)2.
Метод Получения: • Ртуть получают сжиганием киновари (Сульфида ртути (II)). Этот способ применяли алхимики древности. Уравнение реакции горения киновари: Hg. S+O 2→Hg+SO 2 • В России известны 23 месторождения ртути, промышленные запасы составляют 15, 6 тыс. тонн (на 2002 год)
тонн (на 2002 год)
Ртуть: Все металлы находятся в твердом агрегатном состоянии, кроме Hg (жидкое) при комнатной температуре. Ртуть – тяжёлый переходный металл серебристо – белого цвета. Очень малоактивна! Пары очень ядовиты Получают путём восстановления из минерала киноварь(Hg. S) Считается очень редким металлом( самые богатые руды содержат 2, 5% ртути), Нахождение в природе: магма вулканов, атмосфера (2%), земная кора. Применение: изготовление зеркал, вакуумных насосов, источников света, измерительных приборов, амальгамной металлургии(способна образовывать жидкие сплавы с другими металлами, особенно Au, Ag). Широко используется в медицине (радиофармакологии).
Химические Свойства: 1. 2 Hg+O₂=2 Hg. O, с кислородом 2. Разложение оксида ртути: 2 Hg. O=2 Hg+O₂ 3. Hg+S=Hg. S, с серой 4. Hg+HNO₃=Hg 2(NO 3)2, в растворе холодной азотной кислоты 5. Латинское «hydrargirum» произошло от греческих слов «hýdor» — вода и «árgyros» — серебро.
Ag • элемент побочной подгруппы первой группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 47. • 4 d 105 s 1 • +1, +2 — степени окисления • Валентность: чаще всего |, встречается||, ||| • Происхождение названия: от греческого слова «argos» — белый, блестящий.
И. Менделеева, с атомным номером 47. • 4 d 105 s 1 • +1, +2 — степени окисления • Валентность: чаще всего |, встречается||, ||| • Происхождение названия: от греческого слова «argos» — белый, блестящий.
Важнейшие соединения серебра: • Минералы : аргентин (сульфид серебра Ag. S), прустит (Ag₃As. S₃), кераргит (Ag. Cl), бромаргерит (Ag. Br) • Ag 2 O – оксид серебра • Ag. NO 3, нитрат серебра • Ag. F 2 – дифторид серебра • Получение (в проммышленности): • 2 Ag + 4 Na. CN +O 2 + H 2 O = 2 Na[Ag(CN)2] + 2 Na. OH. • 2[Ag(CN)2]-+ Zn = [2 Zn(CN)4]2 — + 2 Ag.
Серебро: Ковкий, пластичный, благородный металл серебристо – белого цвета. Тяжелый металл. С прошествием времени тускнеет (налёт сероводорода), обладает высокой теплопроводностью. Имеет самую высокую электропроводность. В основном – самородная форма. В природе: глинистые сланцы, месторождения, морская вода, серебряные припои. Применение: чеканка монет, наград, орденов, СВЧ – техника, ювелирные украшения, Пищевые добавки.
Химические свойства: 1. С концентр. Азотной кислотой: Ag + HNO₃= Ag. NO₃+NO₂+H₂O 2. Растворяется в хлорном железе: Ag+Fe. Cl₃ = Ag. Cl+Fe. Cl₂ 3. С галогенами: 2 Ag+I₂=2 Ag. I 4. В течение времени на серебре образуется налёт, вызывающий потемнение серебряных изделий: 4 Ag + 2 H 2 S + O 2 = 2 Ag 2 S + 2 H 2 O
Pt • 78 элемент Периодической Системы, • • Расположена в 8 -й группе, побочной подгруппе, 6 -м периоде Валентность: 1, 2, 3, 4, 6, 8. Степени окисления: 2, 3, 4, 6, редко 5 Название было дано испанскими конкистадорами, в 16 веке. Т. К платина внешне похожа на серебро(исп. platina del Pinto). Слово буквально означает «маленькое серебро» , «серебришко» (платина против серебра стоила вдвое дешевле). Объясняется такое пренебрежительное название исключительной тугоплавкостью платины, которая не поддавалась переплавке, долгое время не находила применения и ценилась вдвое ниже, чем серебро.
Важнейшие соединения платины: • • • Дихлорид Pt. Cl₂ Pt. O Платинаты(Pt. Br₄, Pt. I₄ и др. ) Cоли платины: K₂[Pt. Cl₄], K[Pt. Cl₃(С₂H₄)] и др. Гидроксиды-Pt(OH)₄, галогениды-Pt. Hal₄, сульфиды-Pt. S₂ и др. • Получение в проммышленности: • Прокаливание соли аммония: • 3(NH 4)2[Pt. Cl 6] = 2 N 2 + 2 NH 3 + 18 HCl + 3 Pt
Cl₂ Pt. O Платинаты(Pt. Br₄, Pt. I₄ и др. ) Cоли платины: K₂[Pt. Cl₄], K[Pt. Cl₃(С₂H₄)] и др. Гидроксиды-Pt(OH)₄, галогениды-Pt. Hal₄, сульфиды-Pt. S₂ и др. • Получение в проммышленности: • Прокаливание соли аммония: • 3(NH 4)2[Pt. Cl 6] = 2 N 2 + 2 NH 3 + 18 HCl + 3 Pt
Платина: Благородный металл серо-стального цвета. В природе находится в рассыпных месторождениях. Пластичный, тяжёлый металл. Проявляет большую хим. Устойчивость, реагирует ТОЛЬКО с царской водкой: 3 Pt + 4 HNO 3 + 18 HCl = 3 H 2[Pt. Cl 6] + 4 NO + 8 H 2 O Применение: как катализатор, ювелирное дело, стоматология, в лазерной технике, гальванические покрытия, произв-во плавиковой кислоты, в качестве нераств. Анодов, СВЧ-техника.
• • «Царская Водка» — смесь концентрированных кислот — соляной HCl и азотной HNO 3 (в отношении 1: 3 по объёму) + иногда и серной H 2 SO 4. Жидкость жёлтого цвета, пахнущая хлором и окислами азота. В ней растворяются все неактивные металлы
Au: • Зо лото — элемент побочной подгруппы первой группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 79. • Происхождение названия: (лат. «geltonas» — «жёлтый» — «gold» . ) • Электронная конфигурация: 4 f¹⁴ 5 d¹⁰ 6 s¹ • Валентности: |, ||| • Степени окисления: -1, 1, 2(очень редко), 3, 5.
И. Менделеева, с атомным номером 79. • Происхождение названия: (лат. «geltonas» — «жёлтый» — «gold» . ) • Электронная конфигурация: 4 f¹⁴ 5 d¹⁰ 6 s¹ • Валентности: |, ||| • Степени окисления: -1, 1, 2(очень редко), 3, 5.
Важнейшие соединения: • • Гидроксид Au(OH)3, Гемисульфид Au 2 S, оксид Аu 2 О 3 , Au 2 O 3· 4 NH 3 — «гремучее золото» , Моноселенид Au. Se, теллурид Аu. Те 2, Селенаты: Au 2(Se. O 3)3· 3 H 2 Se. O 3, Au 2(Se. O 4)3. • Получение • Оксид золота при температуре выше 220⁰ разлагается: • 2 Au 2 O 3 = 4 Au +3 О₂ • При восстановлении солей Золота хлоридом олова (II) • 2 Аu. Cl 3 + 3 Sn. Cl 2 = 3 Sn. Cl 4 + 2 Au
Золото: Благородный металл жёлтого цвета. Очень мягкий, пластичный (можно сравнить с тверд. Ногтя). Некоторым изделиям придает красноватый оттенок примеси меди. Обладает исключительно высокой теплопроводностью, низким электр. Сопротивлением. Очень тяжелый металл( плотность=19 621 кг/м³). Самый инертный металл. Чаще встречаема самородная форма. Нахождение в природе: Постмагматические породы, россыпи. Применение: стоматология, ювелирное искусство, тонкая обработка чеканкой, филигрань, литьё, декор, гравировка, проммышленность(мишени в ядер. Исследованиях), электроника, фармакологии.
Нахождение в природе: Постмагматические породы, россыпи. Применение: стоматология, ювелирное искусство, тонкая обработка чеканкой, филигрань, литьё, декор, гравировка, проммышленность(мишени в ядер. Исследованиях), электроника, фармакологии.
Химические свойства: реагирует с царской водкой С галогенами образует галогениды: 2 Аu + ЗCl 2 = 2 Аu. Cl 3
Спасибо за внимание!
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.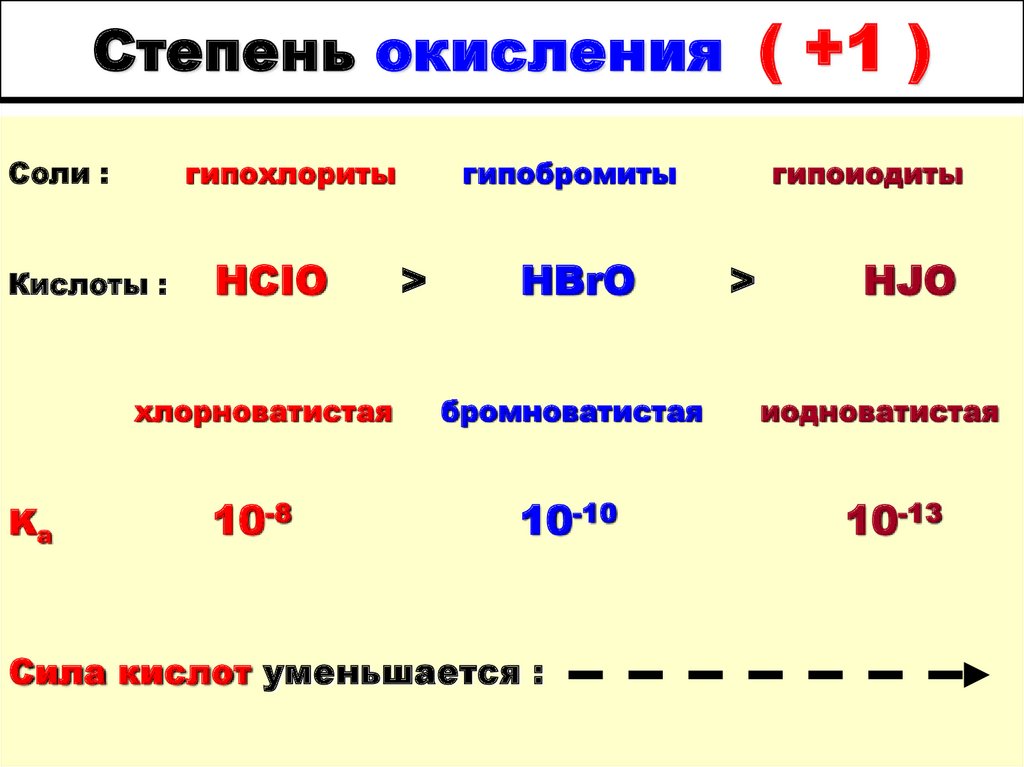
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/NXwmZ4aXXsQ» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/WIbBf3NZEZI» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/dihxr1liTvQ» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Аурум и его соединения
uCl, желтый, получают разложением AuCl3.Более устойчивы комплексные соединения, например цианидные K[Au(CN)2], или тиосульфатные K3[Au(S2O3)2].
6.2 Соединения Au(III)
Для элементов подгруппы меди степень окисления +3 наиболее характерна для золота.
Из бинарных соединений золота известны:
Оксид Au(III) Au2O3,имеющий черно-бурый цвет.
Гидроксид Au(III) Au(OH)3 имеющий красно-коричневый цвет.
Фторид Au(III) AuF3 имеющий оранжевый цвет.
Хлорид Au(III) AuCl3 имеющий красный цвет.
Бромид Au(III) AuBr3 имеющий темно-бурый цвет.
В Водном растворе растворимы лишь AuCl3 и AuBr3,состоящие из димерных плоских молекул.
Галогениды, оксиды и гидроксид Au(III)-амфотерные соединения с преобладанием кислотных признаков. Так Au(OH)3 легко растворяется в щелочах, образуя гидроксоаураты (III):
+ Au(OH)3 = Na [Au(OH)4]
Даже растворение в кислотах Au(OH)3 происходит за счет образования анионных комплексов:
(OH)3 + 4 HNO3 = H[Au(NO3)4] + 3 h3O
В присутствии солей щелочных металлов образуются аураты :[Au(NO3)4] нитрато-[Au(SO4)2]сульфато-[Au(CN)4]циано-[AuS2] сульфидо-
Кислотный характер галогенидов Au(III)проявляется в их исключительной склонности давать галогеноаураты (III) M[AuHal4]. Большинство галогеноауратов хорошо растворимо в воде и органических растворителях.
Большинство галогеноауратов хорошо растворимо в воде и органических растворителях.
Особая склонность Au(III) к образованию анионных комплексов проявляется и при гидролизе его тригалогенидов:
+h3O== H[Au(OH)Cl3]+h3O== h3[AuOCl3]
Образующаяся при это кислота h3[AuOCl3] дает труднорастворимую соль Ag2[AuOCl3].
6.3 Соединения золота(V)
Взаимодействия золота и фторида криптона получен пентафторид золота AuF5-кристаллическое вещество красно-коричневого цвета.
Au+5KrF2== 2AuF5+5Kr
Пентафторид проявляет кислотные свойства, с основными фторидами. С основными фторидами образует гексафтораураты(V):
+ KF = K[AuF6]+AuF5==Na[AuF6]
Соединения Au (V)-очень сильные окислители. Так пентафторид окисляет XeF2.
+XeF2==XeF4+ AuF3
Известен AuF7,однако он крайне неустойчив.
6. 4 Золото, как простое вещество
4 Золото, как простое вещество
1.Au+4HCl(k)+HNO3(k)== H[AuCl4]+NO+2h3O
.2Au+6h3SeO4==Au2(SeO4)3+3SeO2+6h3O
3.2Au+3F2==2AuF3 (300-400C)
.2Au+3Cl2==2AuCl3 (150)
5.2Au+Cl2==2AuCl (150-250C)
.2Au+2Br2==AuBr3+AuBr
.2Au+I2==2AuI (120-393C)
.2Au+3Cl2+2h3O===(t)===2H [AuCl3(OH)]
.Au+3Cl2+2HCl===2 H[AuCl4]
.Au+3Br2+2HBr===2 H[AuBr4]
.Au+3I2+2HI==2H[AuI4]
.4Au+8NaCN(k)+O2+2h3O===4Na [Au(CN)2]+NaOH
. 4Au+8KCN(k)+O2+2h3O===4K [Au(CN)2]+KOH
14.Au+NaNO3===NaAuO2+NO (350-400C)
6.5 Оксид золота(III)
=441.93
Соединение золота и кислорода с формулой Au2O3. Наиболее устойчивый оксид золота. Получается при осторожном нагревании (до 140-150°) гидроокиси золота (золотой кислоты) путём обезвоживания. Однако оксид золота(III) начинает заметно терять кислород уже при немного более высокой температуре (примерно начиная со 160 °C). Нерастворим в воде, растворяется в азотной и соляной кислотах. Коричнево-черный, термически неустойчивый, при нагревании разлагается. Не реагирует с водой. Из раствора осаждается в виде гидрата Au2O3*nh3O.Проявляет амфотерные свойства :реагирует с кислотами ,Концентрированными щелочами.
Нерастворим в воде, растворяется в азотной и соляной кислотах. Коричнево-черный, термически неустойчивый, при нагревании разлагается. Не реагирует с водой. Из раствора осаждается в виде гидрата Au2O3*nh3O.Проявляет амфотерные свойства :реагирует с кислотами ,Концентрированными щелочами.
Восстанавливается водородом, монооксидом углерода.
1.2Au2O3==4Au+3O2 (160-290C)
.Au2O3* nh3O===Au2O3+nh3O (100-120C)
3.Au2O3+8HCl(k) ==2 H[AuCl4]+3h3O
.Au2O3+2NaOH(k)(Гор)+3h3O==2 Na [Au(OH)4]
.Au2O3+3h3==2Au+3h3O(<260C)
.Au2O3+3CO==2Au+3CO2(100C)
6.6 Хлорид золота(I)
Mr=232.42
T(пл)==289C(Разл)
Хлорид золота(I) (монохлорид золота) — соединение золота с хлором. Cветло-желтый, термически неустойчивый. Плавится с разложением. Не растворяется в холодной воде, кристаллогидратов не образует. Разлагается горячей водой, реагирует с кислотами, щелочами, гидратом аммиака. Вступает в реакции комплексообразования. Хлорид золота(I) получается путем термического разложения хлорида золота (III):
Вступает в реакции комплексообразования. Хлорид золота(I) получается путем термического разложения хлорида золота (III):
===(t)==AuCl+Cl2
Au+Cl2==2AuCl(150-250)
.2AuCl==2Au+Cl2(<289C)
.3AuCl+h3O(гор)== H [AuCl3(OH)]+2Au
.AuCl+HCl (k)=== H[AuCl2]
.AuCl+NaCl(k)== Na[AuCl2]
. AuCl+KCl(k)== K[AuCl2]
.2AuCl+3NaOH(Конц,Гор)== Na [Au(OH)2]+AuOH+NaCl
.AuCl+2(Nh4 h3O)(k)== [Au(Nh4)2]Cl+2h3O
Монохлорид золота раздражает кожу и глаза, повреждает функции почек и сокращает количество белых кровяных телец. При прикосновении, промыть пораженный участок водой с мылом в течение 15 минут.
6.7 Хлорид золота(III)
Mr=303.33(пл)=288C
Хлорид золота (III) (трихлорид золота) — вещество, химическая формула — AuCl3.Темно-красный,летучий,при нагревании разлагается, плавится только под избыточным давлением Cl2. При обработке водой переходит в раствор с изменением состава. Реагирует с кислотами ,щелочами .Является окислителем. Для реакций в водном растворе берется в виде H[AuCl4]. Внешний вид — красные моноклинные кристаллы. В безводном состоянии лучше всего получать действием хлора на золотую фольгу или на сухой порошок золота, полученный восстановлением сульфатом железа(II) при температуре немного выше 200 °C. AuCl3 возгоняется при этой температуре в токе хлора и осаждается в форме красных игл удельного веса 3,9.
При обработке водой переходит в раствор с изменением состава. Реагирует с кислотами ,щелочами .Является окислителем. Для реакций в водном растворе берется в виде H[AuCl4]. Внешний вид — красные моноклинные кристаллы. В безводном состоянии лучше всего получать действием хлора на золотую фольгу или на сухой порошок золота, полученный восстановлением сульфатом железа(II) при температуре немного выше 200 °C. AuCl3 возгоняется при этой температуре в токе хлора и осаждается в форме красных игл удельного веса 3,9.
Давление разложения хлорида золота (III) при 251 °C достигает 1 атм. Теплота образования, по данным Бильтца, составляет 28,3 ккал/моль. При повышенном давлении хлора хлорид золота плавится при температуре 287-288 °C.
В воде он растворяется, давая коричнево-красную окраску, с образованием комплексной кислоты h3AuOCl3 (оксотрихлорозолото(III) кислота).
Золота (III) хлорид наиболее часто готовят путем пропускания газообразного хлора над золотым порошком при температуре 180 °С:
Au+3Cl2==2AuCl3
. AuCl3==AuCl+Cl2(150-85C)
AuCl3==AuCl+Cl2(150-85C)
. AuCl3* 2h3O===AuCl3+2h3O(<30C)
. AuCl3+2h3O== [AuCl3(OH)]+h4O
. AuCl3+HCl(k)== H[AuCl4]
. 2AuCl3+6NaOH(p)==Au2O3+6NaCl+3h3O
. 2AuCl3+3F2==(t)==2AuF3+3Cl2 (200C)
.2AuCl3+3h3S(г)==Au2S3+6HCl
.2AuCl3+3h3O2(k)===2Au(Коллоид)+3O2+HCl
9.AuCl3+3FeSO4==Au+Fe2(SO4)3+FeCl3 (200C)
10AuCl3+4Na2S2O3(k)== Na[Au(S2O3)2]+3NaCl+Na2S4O6
6.8 Дицианоаурат (I) калия
==288.10
ДИЦИАНОАУРАТ(I) Калия K[Au(CN)2]. Белый, устойчив на свету и воздухе. Гексагональная кристаллическая решетка. Не реагирует на холоду с кислотами, щелочами, гидратом аммиака. Хорошо растворим в воде, Кристаллогидратов не образует. При нагревании разлагается концентрированными кислотами, реагирует с сероводородом. Восстанавливается цинком, окисляется галогенами. Мало растворим в этаноле, ацетоне и эфире. Из водного раствора кристаллизуется при добавлении спирта или кислот. При действии Zn, Al, Mn, Mg и др. восстановителей на водные растворы калия дицианоаурат(i) выделяется Аu, при нагревании с разбавленными кислотами — AuCN. калия дицианоаурат(i) легко окисляется галогенами с образованием K[Au(CN)2X2], где Х — Сl, Вr или I. Получают калия дицианоаурат(i) взаимодействием Аu с раствором KCN в присутствии Н2О2 или О2, реакцией AuCN с раствором KCN, анодным растворением Аu в растворе KCN. калия дицианоаурат(i) — промежуточный продукт при извлечении Аu из руд. Его применяют при электролитическим золочении металлических поверхностей и элементов микроэлектронных схем, как реагент для анализа белков и ферментов. Токсичен. Вызывает дерматит и стоматит, повреждает почки и головной мозг.
При действии Zn, Al, Mn, Mg и др. восстановителей на водные растворы калия дицианоаурат(i) выделяется Аu, при нагревании с разбавленными кислотами — AuCN. калия дицианоаурат(i) легко окисляется галогенами с образованием K[Au(CN)2X2], где Х — Сl, Вr или I. Получают калия дицианоаурат(i) взаимодействием Аu с раствором KCN в присутствии Н2О2 или О2, реакцией AuCN с раствором KCN, анодным растворением Аu в растворе KCN. калия дицианоаурат(i) — промежуточный продукт при извлечении Аu из руд. Его применяют при электролитическим золочении металлических поверхностей и элементов микроэлектронных схем, как реагент для анализа белков и ферментов. Токсичен. Вызывает дерматит и стоматит, повреждает почки и головной мозг.
. 2 K[Au(CN)2]==2KCN+2Au+C2N2 (250-400C)
. K[Au(CN)2]+6h3O== [Au(CN)2]+ [K(h3O)6]
. K[Au(CN)2]+HCl(k)==AuCN(Желт)+HCN+KCl (50C)
. 2 K[Au(CN)2](k)+h3S(г)+2HCl(p)==AuS2+2KCl+4HCN
. 2 K[Au(CN)2]+Zn==K2[Zn (CN)4] +2Au
6. 9 Тетрахлораурат (III) водорода
9 Тетрахлораурат (III) водорода
=339.79пл =196C
Светло- желтый, гигроскопичный. Хорошо растворяется в малом количестве воды, концентрированной соляной кислоте. При разбавлении раствора изменяет состав. Разлагается щелочами. Реагирует и гидратом аммиака, типичными восстановителями Вступает в реакции обмена лигандами.
. H[AuCl4]==AuCl+HCl+Cl2 (156-205C)
. H[AuCl4](k)+h3O==H[AuCl3(OH)]+HCl (Разбавление)
. 2 H[AuCl4]+8NaOH(p)==Au2O3+8NaCl+5h3O (70-80C)
. H[AuCl4]+5(Nh4*h3O)(k)==Au(Nh3)2Cl+3Nh5Cl+5h3O
. 2H[AuCl4]+3h3S(г)==2Au+3S+8HCl (Кип)
. H[AuCl4]+CsCl==Cs [AuCl4]+HCl
. H[AuCl4]+3KI==AuI+I2+HCl+3KCl
. H[AuCl4]+SО2+2h3O==H[AuCl2]+h3SO4+2HCl (0C)
. 2H[AuCl4]+ 3H[SnCl3]+HCl(k)==2Au+3h3[SnCl6]
. 4H[AuCl4]+3N2H5Cl(k)=4Au(Коллоидное)+3N2+19HCl (кип)
.2H[AuCl4]+11KOH+3HC(H)O ==2Au(Коллоидное)+3K(HCOO)+8KCl+8h3O
. H[AuCl4]+4HCN(k)==H [Au(CN)4]+3HCl+HCl
H[AuCl4]+4HCN(k)==H [Au(CN)4]+3HCl+HCl
. H[AuCl4]+4KCN(k)==K [Au(CN)4]+3KCl+HCl
7. Получение Золота
Для получения золота используются его основные физические и химические свойства: присутствие в природе в самородном состоянии, способность реагировать лишь с немногими веществами (ртуть, цианиды). C развитием современных технологий более популярными становятся химические способы.
7.1 Промывка
Метод промывки основан на высокой плотности золота, благодаря которой в потоке воды, минералы с плотностью меньше золота (а это почти все
Золото со степенями окисления +4 и +6 в AuF 4 и AuF 6
. 2018 1 августа; 140 (30): 9545-9550.
doi: 10.1021/jacs.8b04563. Epub 2018 23 июля.
Цзяньян Линь, Шутао Чжан, Вэй Гуань, Гочунь Ян, Яньмин Ма 1 2 3
Принадлежности
- 1 Государственная ключевая лаборатория сверхтвердых материалов, Физический колледж, Цзилиньский университет, Чанчунь 130012, Китай.

- 2 Международный центр науки будущего, Цзилиньский университет, Чанчунь 130012, Китай.
- 3 Инновационный центр методов и программного обеспечения вычислительной физики, Физический колледж, Цзилиньский университет, Чанчунь 130012, Китай.
- PMID: 29996646
- DOI: 10.1021/jacs.8b04563
Цзяньян Лин и соавт. J Am Chem Soc. .
. 2018 1 августа; 140 (30): 9545-9550.
doi: 10. 1021/jacs.8b04563.
Epub 2018 23 июля.
1021/jacs.8b04563.
Epub 2018 23 июля.
Авторы
Цзяньян Линь, Шутао Чжан, Вэй Гуань, Гочунь Ян, Яньмин Ма 1 2 3
Принадлежности
- 1 Государственная ключевая лаборатория сверхтвердых материалов, Физический колледж, Цзилиньский университет, Чанчунь 130012, Китай.
- 2 Международный центр науки будущего, Цзилиньский университет, Чанчунь 130012, Китай.
- 3 Инновационный центр методов и программного обеспечения вычислительной физики, Физический колледж, Цзилиньский университет, Чанчунь 130012, Китай.
- PMID: 29996646
- DOI:
10.
 1021/jacs.8b04563
1021/jacs.8b04563
Абстрактный
Важной целью в химии является получение соединений с необычными степенями окисления, проявляющих захватывающие свойства. Для золота (Au) релятивистское расширение его 5d-орбиталей заставляет его образовывать соединения с высокой степенью окисления. На сегодняшний день самая высокая известная степень окисления золота составляет +5. Здесь мы предлагаем высокое давление в качестве контролируемого метода получения степеней окисления +4 и +6 в Au посредством его реакции с фтором. Поиск структуры роевого интеллекта на основе первых принципов идентифицирует два до сих пор неизвестных стехиометрических соединения, AuF 9.0077 4 и AuF 6 , демонстрирующие типичный молекулярно-кристаллический характер. Фазовая диаграмма высокого давления фторидов Au сильно отличается от фторидов Cu или Ag, на что указывают стабильные химические составы и давления, необходимые для синтеза этих соединений. Это различие может быть связано с более сильными релятивистскими эффектами в Au по сравнению с Cu или Ag. Наша работа представляет собой значительный шаг вперед в более полном понимании степеней окисления золота.
Это различие может быть связано с более сильными релятивистскими эффектами в Au по сравнению с Cu или Ag. Наша работа представляет собой значительный шаг вперед в более полном понимании степеней окисления золота.
Похожие статьи
Рост кристаллов из безводных растворов HF M 2+ (M = Ca, Sr, Ba) и [AuF 6 ] — , не только простых солей M (AuF 6 ) 2 .
Мазей З., Горешник Е. Мазей З. и др. Неорг хим. 2022 11 июля; 61 (27): 10587-10597. doi: 10.1021/acs.inorgchem.2c01675. Epub 2022 30 июня. Неорг хим. 2022. PMID: 35770501 Бесплатная статья ЧВК.
Структурные особенности Ag[AuF4] и Ag[AuF6] и структурная связь Ag[AgF4]2 и Au[AuF4]2 с Ag[AuF4]2.
Граудейс О.
 , Уилкинсон А.П., Бартлетт Н.
Граудеюс О. и др.
Неорг хим. 3 апреля 2000 г .; 39 (7): 1545-8. дои: 10.1021/ic9
, Уилкинсон А.П., Бартлетт Н.
Граудеюс О. и др.
Неорг хим. 3 апреля 2000 г .; 39 (7): 1545-8. дои: 10.1021/ic9
t. Неорг хим. 2000. PMID: 12526462Кристаллические структуры и сверхпроводимость гидридов золота, имплантированных литием и фтором, при высоких давлениях.
Чжан С., Ян Ц., Чжан С., Чжао К., Ю. Х., Чжу Л., Лю Х. Чжан С. и др. Phys Chem Chem Phys. 2021 6 октября; 23(38):21544-21553. дои: 10.1039/d1cp02781f. Phys Chem Chem Phys. 2021. PMID: 34549743
IrF 8 Молекулярный кристалл под высоким давлением.
Линь Дж., Чжао З., Лю С., Чжан Дж., Ду С., Ян Г., Ма Ю. Лин Дж. и др. J Am Chem Soc. 2019 3 апр;141(13):5409-5414. doi: 10.1021/jacs.9b00069. Epub 2019 21 марта. J Am Chem Soc.
 2019.
PMID: 30864432
2019.
PMID: 30864432Золото как 6p-элемент в плотных литиевых ауридах.
Ян Г., Ван Ю, Пэн Ф, Бергара А, Ма Ю. Ян Г и др. J Am Chem Soc. 2016 30 марта; 138 (12): 4046-52. doi: 10.1021/jacs.5b11768. Epub 2016 15 марта. J Am Chem Soc. 2016. PMID: 26942558
Посмотреть все похожие статьи
Цитируется
Рост кристаллов из безводных растворов HF M 2+ (M = Ca, Sr, Ba) и [AuF 6 ] — , не только простых солей M (AuF 6 ) 2 .
Мазей З., Горешник Е. Мазей З. и др. Неорг хим. 2022 11 июля; 61 (27): 10587-10597. doi: 10.1021/acs.inorgchem.2c01675. Epub 2022 30 июня. Неорг хим. 2022. PMID: 35770501 Бесплатная статья ЧВК.

Идентификация двухкоординированного железо(I)-оксалатного комплекса.
Майер М., Ванкова Н., Штольц Ф., Абель Б., Гейне Т., Асмис К.Р. Майер М. и соавт. Angew Chem Int Ed Engl. 2022 11 апреля; 61 (16): e202117855. doi: 10.1002/anie.202117855. Epub 2022 24 февраля. Angew Chem Int Ed Engl. 2022. PMID: 35088489 Бесплатная статья ЧВК.
Фазовые переходы за постперовскитом в NaMgF 3 до 160 ГПа.
Датта Р., Гринберг Э., Пракопенко В.Б., Даффи Т.С. Датта Р. и соавт. Proc Natl Acad Sci U S A. 2019 Sep 24;116(39):19324-19329. doi: 10.1073/pnas.16116. Epub 2019 10 сентября. Proc Natl Acad Sci U S A. 2019. PMID: 31506347 Бесплатная статья ЧВК.
Гипервалентная и кубически координированная молекулярная фаза IF 8 прогнозируется при высоком давлении.

Луо Д., Лв. Дж., Пэн Ф., Ван Ю., Ян Г., Рам М., Ма Ю. Луо Д. и др. хим. наук. 2019 3 января; 10 (8): 2543-2550. дои: 10.1039/c8sc04635b. Электронная коллекция 2019 28 февраля. хим. наук. 2019. PMID: 30881685 Бесплатная статья ЧВК.
Закрытие запрещенной зоны, несоизмеримость и молекулярная диссоциация плотного хлора.
Далладей-Симпсон П., Биннс Дж., Пенья-Альварес М., Доннелли М.Е., Гринберг Э., Пракапенка В., Чен XJ, Грегорянц Э., Хоуи Р.Т. Далладей-Симпсон П. и др. Нац коммун. 20198 марта; 10 (1): 1134. doi: 10.1038/s41467-019-09108-x. Нац коммун. 2019. PMID: 30850606 Бесплатная статья ЧВК.
Типы публикаций
11.1: Числа окисления — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 58844
Результаты обучения
- Присвойте степени окисления свободным элементам или элементам в соединении или ионе.

Числа окисления
Число окисления — это положительное или отрицательное число, которое присваивается атому для обозначения его степени окисления или восстановления . Термин степень окисления часто используется взаимозаменяемо со степенью окисления. Частичный перенос электрона — это сдвиг электронной плотности вблизи атома в результате изменения других атомов, с которыми он ковалентно связан. Этот сдвиг заряда основан на относительной электроотрицательности атомов, участвующих в связи.
В целом степень окисления атома в молекуле представляет собой заряд, который атом имел бы, если бы все полярные ковалентные и ионные связи приводили к полному переносу электронов от менее электроотрицательного атома к более электроотрицательному. Номера окисления могут быть присвоены с использованием набора правил, изложенных ниже.
- Степень окисления атома в нейтральном свободном элементе равна нулю. Свободным элементом считается любой элемент в несвязанном состоянии, будь то одноатомный или многоатомный.
 Например, степень окисления каждого атома в \(\ce{Fe}\), \(\ce{Li}\), \(\ce{N_2}\), \(\ce{Ar}\), и \(\ce{P_4}\) равно нулю. 9{3+}}\) равны \(+1\), \(-2\) и \(+3\) соответственно.
Например, степень окисления каждого атома в \(\ce{Fe}\), \(\ce{Li}\), \(\ce{N_2}\), \(\ce{Ar}\), и \(\ce{P_4}\) равно нулю. 9{3+}}\) равны \(+1\), \(-2\) и \(+3\) соответственно. - Степень окисления кислорода в большинстве соединений равна \(-2\).
- Степень окисления водорода в большинстве соединений равна \(+1\).
- Степень окисления фтора во всех соединениях равна \(-1\). Другие галогены обычно имеют степень окисления \(-1\) в бинарных соединениях, но могут иметь переменную степень окисления в зависимости от среды связывания.
- В нейтральной молекуле сумма степеней окисления всех атомов равна нулю. Например, в \(\ce{H_2O}\) степени окисления \(\ce{H}\) и \(\ce{O}\) равны \(+1\) и \(-2\ ), соответственно. Поскольку в формуле два атома водорода, сумма всех степеней окисления в \(\ce{H_2O}\) равна \(2 \left( +1 \right) + 1 \left(-2 \right) = 0\). 9{2-}}\), степени окисления \(\ce{S}\) и \(\ce{O}\) равны \(+6\) и \(-2\) соответственно.
 Сумма всех степеней окисления сульфат-иона будет равна \(1\влево(+6\вправо) + 4\влево(-2\вправо) = -2\), что является зарядом иона.
Сумма всех степеней окисления сульфат-иона будет равна \(1\влево(+6\вправо) + 4\влево(-2\вправо) = -2\), что является зарядом иона.
Изучение правил присвоения степеней окисления показывает, что существует много элементов, для которых нет конкретных правил, таких как азот, сера и хлор. Эти элементы, как и некоторые другие, могут иметь различные степени окисления в зависимости от других атомов, с которыми они ковалентно связаны в молекулярном соединении. Полезно проанализировать несколько молекул, чтобы понять, какой стратегии следует придерживаться при присвоении степеней окисления другим атомам.
Числа окисления атомов в бинарном ионном соединении легко определить, поскольку они равны заряду иона (правило 2). В \(\ce{FeCl_3}\) степень окисления железа равна \(+3\), а степень окисления хлора равна \(-1\). В \(\ce{Ca_3P_2}\) кальций равен \(+2\), а фосфор равен \(-3\). Это связано с тем, что ионное соединение имеет форму кристаллической решетки, которая на самом деле состоит из этих ионов.
Присвоить степени окисления молекулярным соединениям сложнее. Главное — помнить правило 6: сумма всех степеней окисления для любых нейтральных частиц должна быть равна нулю. Обязательно учитывайте все индексы, которые появляются в формуле. В качестве примера рассмотрим соединение азотной кислоты \(\ce{HNO_3}\). Согласно правилу 4 степень окисления водорода равна \(+1\). Согласно правилу 3 степень окисления кислорода равна \(-2\). В отношении азота нет правил, но его степень окисления можно рассчитать следующим образом.
\[1 \left( +1 \right) + x + 3 \left( -2 \right) = 0, \: \text{где} \: x \: \text{степень окисления азота} \]
\[\text{Решение:} \: x = 0 — 1 — \left( -6 \right) = +5\]
Степень окисления атома азота в \(\ce{HNO_3} \) равно \(+5\). Часто при присвоении степеней окисления удобно писать их над символом внутри формулы.
\[\overset{+1}{\ce{H}} \overset{+5}{\ce{N}} \overset{-2}{\ce{O_3}}\]
Вы можете задаться вопросом если есть ограничения на значения степеней окисления. Ключевым моментом, который следует учитывать, является правило октетов. Поскольку азот имеет 5 валентных электронов, то самое большее, что он может «потерять» при образовании связей в молекуле, равно 5, поэтому его максимально возможная степень окисления равна \(+5\). В качестве альтернативы он может получить до 3 электронов, поэтому его самая низкая (самая отрицательная) возможная степень окисления равна \(-3\). Точно так же хлор может иметь степени окисления в диапазоне от \(-1\) до \(+7\). 9{2-}}\). Натрий не является частью ковалентно связанного многоатомного иона, поэтому его степень окисления такая же, как и в бинарном ионном соединении \(+1\). Сера — это атом, степень окисления которого не подпадает ни под одно из правил. Степень окисления серы присваивается переменной \(х\) в следующем расчете. Помните, что сумма степеней окисления всех элементов должна равняться нулю, потому что \(\ce{Na_2S_2O_3}\) является нейтральным соединением.
Ключевым моментом, который следует учитывать, является правило октетов. Поскольку азот имеет 5 валентных электронов, то самое большее, что он может «потерять» при образовании связей в молекуле, равно 5, поэтому его максимально возможная степень окисления равна \(+5\). В качестве альтернативы он может получить до 3 электронов, поэтому его самая низкая (самая отрицательная) возможная степень окисления равна \(-3\). Точно так же хлор может иметь степени окисления в диапазоне от \(-1\) до \(+7\). 9{2-}}\). Натрий не является частью ковалентно связанного многоатомного иона, поэтому его степень окисления такая же, как и в бинарном ионном соединении \(+1\). Сера — это атом, степень окисления которого не подпадает ни под одно из правил. Степень окисления серы присваивается переменной \(х\) в следующем расчете. Помните, что сумма степеней окисления всех элементов должна равняться нулю, потому что \(\ce{Na_2S_2O_3}\) является нейтральным соединением.
\[ \begin{align}2 \left( +1 \right) + 2 \left( x \right) + 3 \left( -2 \ right) &= 0 \\[5pt] 2 + 2x -6 &=0 \\[5pt] -4 + 2x &= 0 \\[5pt] 2x &= +4 \\[5pt] x &= +2 \end{align}\] 9{2-}}\).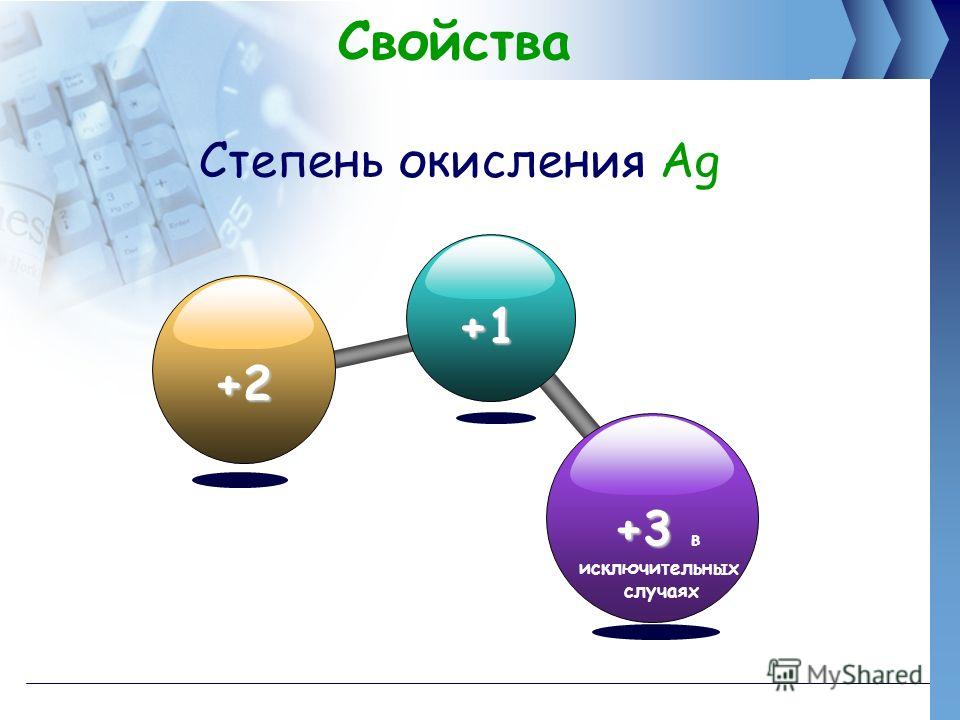
\[ \begin{align} 2 \left( x \right) + 3 \left( -2 \right) &= -2 \\[5pt] 2x — 6 &= -2 \\[5pt] 2x & = +4 \\[5pt] x &= +2 \end{align}\]
Авторы и авторство
Эта страница под названием 11.1: Oxidation Numbers распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Фундамент СК-12
- Лицензия
- СК-12
- Показать страницу Содержание
- нет на странице
- Метки
- степени окисления
Числа окисления и степени окисления Учебное пособие по химии
Числа окисления и степени окисления Учебное пособие по химииКлючевые понятия
- Степень окисления используется для обозначения степени окисления атома в соединении.

- Степень окисления определяется как заряд, который мог бы нести атом, если бы молекула или многоатомный ион были полностью ионными.
При расчете степени окисления элемента в соединении рассматривайте все присутствующие элементы так, как если бы они присутствовали в виде ионов, ДАЖЕ, если они явно являются частью ковалентной молекулы.
- Степень окисления атома может быть представлена как степень окисления одним из двух способов:
IUPAC рекомендуется (1)
степень окисленияАльтернатива
степень окисленияОбщая форма: Римская цифра Арабский номер Положительная степень окисления Примеры: я +1 II +2 III +3 Нулевая степень окисления: 0 0 Отрицательная степень окисления Примеры: -я -1 -II -2 -III -3 ПРИМЕЧАНИЕ: знак (+ или -) всегда располагается слева от числа в степени окисления.

- Существуют различные методы присвоения степеней окисления атомам в соединениях. (2)
В таблице ниже перечислены 4 правила, которые можно использовать для присвоения степеней окисления атомам в соединениях.Правила присвоения номеров окисления Правило 1: Степень окисления атомов, составляющих элемент в свободном состоянии, включая его стандартное состояние (3), равна 0. Правило 2: Степень окисления иона элемента равна заряду иона (его зарядовому числу). Правило 3: При обнаружении в соединениях степень окисления некоторых элементов всегда одинакова (за некоторыми исключениями), поэтому их степени окисления всегда будут одинаковыми.
Эти элементы и их степени окисления перечислены ниже:Элемент
(в составе)окисление
номерИсключения из этого правила ИЮПАК альтернатива Элемент группы 1 я +1 Элемент группы 2 II +2 водород я +1 гидриды металлов (например, NaH),
степень окисления водорода -I или -1фтор -я -1 кислород -II -2 (a) пероксиды, O 2 2-
[название IUPAC: диоксид(2-)],
например H 2 O 2
степень окисления кислорода -I или -1(b) супероксиды, O 2 —
[название IUPAC: диоксид (1-)],
например KO 2
степень окисления кислорода (4) составляет -½(c) фториды кислорода:
⚛ в ОФ 2 степень окисления кислорода II или +2
⚛ в O 2 F 2 степень окисления кислорода I или +1Правило 4: Степени окисления других элементов в соединениях можно рассчитать, используя общий заряд соединения: (a) Для соединения или молекулы без общего суммарного заряда (5) сумма степеней окисления для каждого атома каждого элемента в молекуле равна 0.

(b) Для заряженной молекулы (многоатомного иона) сумма степеней окисления для каждого атома каждого элемента в ионе равна заряду иона (зарядовому числу иона).
- Если не указано иное, предполагается, что все атомы одного и того же элемента в молекулярной формуле имеют одинаковую степень окисления. (6)
- Степень окисления или степень окисления присваивается, чтобы помочь нам определить, был ли элемент в реакции окислен или восстановлен.
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Что такое число окисления?
Прежде чем мы рассмотрим, что такое степень окисления, стоит вспомнить, что такое ион, и что такое зарядовое число.
Рассмотрим атом кислорода O, который имеет 6 валентных электронов.
Он имеет сильную тенденцию притягивать к себе 2 электрона, чтобы завершить свой октет электронов (говорят, что он электроотрицательный). Если атом кислорода получает 2 электрона, он образует оксидный ион O 2- с зарядом 2- (зарядовое число равно 2-).
Если атом кислорода получает 2 электрона, он образует оксидный ион O 2- с зарядом 2- (зарядовое число равно 2-).
Это происходит, когда наш атом кислорода сталкивается с атомом, который намного, намного менее электроотрицательен (то есть с более электроположительным атомом), таким как атом магния, Mg.
Если мы взаимодействуем газообразным кислородом и металлическим магнием вместе в реакции окисления, то атом кислорода отрывает 2 электрона от атома магния, образуя ион магния Mg 2+ и оксидный ион O 2- .
Вместе они составляют соединение оксида магния, в котором соотношение Mg 9От 0007 2+ до O 2- составляет 1:1, поэтому соединение может быть представлено как Mg 2+ O 2- , но обычно дается «молекулярная» формула MgO.
Обратите внимание, что соединение Mg 2+ O 2- или MgO не имеет общего суммарного заряда, поскольку количество положительных зарядов равно количеству отрицательных зарядов в соединении. Зарядовое число соединения равно 0.
Зарядовое число соединения равно 0.
Но что произойдет, если наш атом кислорода встретится с другим атомом, не способным оторвать электроны от атома кислорода?
Например, такой атом, как азот.
Представьте, что мы могли бы взаимодействовать газообразный азот и газообразный кислород в реакции окисления для получения новых соединений, которые являются оксидами азота.
Все эти новые соединения ковалентны, ионов в них нет.
Все эти новые соединения электрически нейтральны, общий заряд отсутствует, число зарядов каждого соединения равно 0.
Рассмотрим следующие возможные соединения:
- NO (монооксид азота)
- № 2 (двуокись азота)
Монооксид азота (NO) является наименее окисленной формой азота, он содержит наименьшее количество атомов кислорода. Можно сказать, что атом азота в NO находится в низшей степени окисления, низшей степени окисления.
Двуокись азота (NO 2 ) является наиболее окисленной формой азота, содержит наибольшее количество атомов кислорода. Можно сказать, что атом азота в NO 2 находится в высшей степени окисления, высшей степени окисления.
Можно сказать, что атом азота в NO 2 находится в высшей степени окисления, высшей степени окисления.
Но подождите, а как насчет N 2 O (оксид азота)? Является ли атом азота в N 2 O менее окисленным, чем NO, или более окисленным?
Чтобы ответить на этот вопрос, мы будем использовать понятие степени окисления для обозначения степени окисления (степени окисления) каждого атома азота в каждой молекуле выше.
Степень окисления — это своего рода «учет», помогающий нам понять, как электроны (отрицательные заряды) распределяются внутри молекулы.
Начнем с того, что скажем: «Давайте представим, что каждое из этих ковалентных соединений без суммарного общего заряда на самом деле является ионным, то есть в каждом соединении мы предположим, что присутствует оксидный ион O 2-. Тогда мы сможем вычислить, каков будет заряд каждого из этих воображаемых «ионов азота».
В этом сценарии NO является электрически нейтральной молекулой, она имеет нулевой общий заряд, число зарядов = 0
Оксид-ион, O 2- имеет номер заряда 2-
Итак, какой «заряд» должен быть у «иона азота», чтобы уравновесить заряд иона оксида?
Назовем неизвестный заряд x .
Чтобы молекула имела суммарный заряд, равный 0, сумма зарядов всех «анионов» и «катионов» должна быть равна 0.
0 = заряд на ион оксида + заряд на «ион азота»
Заменитель 2- для заряда оксид-иона:
0 = 2- + х
Добавьте 2+ к обеим частям уравнения:
0 + 2+ = ( 2+ + 2- ) + х
2+ = х
Если бы атом азота нес заряд, то заряд был бы 2+.
Но это НЕ ионное соединение, поэтому атом азота НЕ НЕСЕТ заряд.
Вместо этого мы называем атом азота находящимся в окисленном состоянии (НЕ заряженным), а «кажущийся заряд» атома мы называем его степенью окисления.
Теперь ясно, что мы не можем использовать 2+ для обозначения степени окисления, поскольку это указывало бы на степень заряда иона, поэтому мы используем либо:
- Римская цифра (знак не требуется для положительной степени окисления, знак минус, — требуется перед римской цифрой для отрицательной степени окисления)
- арабское число (знак + или — перед числом)
Некоторые римские цифры и соответствующие им арабские цифры приведены в таблице ниже:
| Арабский номер | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|---|---|---|---|---|---|---|---|---|---|---|
| Римская цифра | я | II | III | IV | В | ВИ | VII | VIII | IX | х |
Нам нужно преобразовать «заряд» атома азота, рассчитанный выше (2+), в степень окисления:
- Римская цифра II (для положительной степени окисления знак не требуется)
- Арабский номер: знак + предшествует числу, то есть +2
Степень окисления азота в NO равна II (или, альтернативно, +2)
Поскольку соединение NO НЕ является ионным, мы никогда не должны были называть атом кислорода в молекуле «ионом оксида» с зарядовым числом 2-
Но мы МОЖЕМ указать, что каждый атом кислорода в соединении имеет степень окисления -II (или, альтернативно, -2).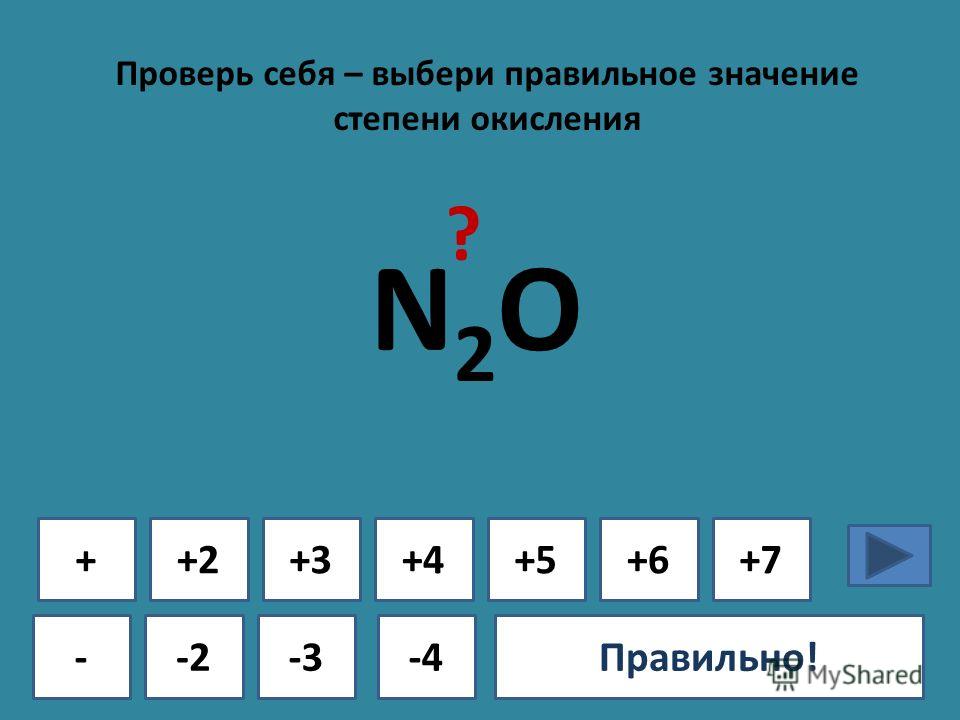
Рассчитаем степень окисления азота в наиболее окисленной форме NO 2 .
NO 2 представляет собой ковалентную молекулу без общего суммарного заряда, зарядовое число = 0
Пусть каждый атом кислорода имеет степень окисления -II (в расчетах будем использовать -2)
Пусть x = степень окисления атома азота
Напишите выражение для расчета степени окисления атома азота:
число зарядов молекулы = сумма степеней окисления кислорода + сумма степеней окисления азота
Так как в молекулярной формуле 2 атома кислорода и 1 атом азота:
степень заряда молекулы = 2 × степень окисления кислорода + степень окисления азота
Подставьте степени окисления в уравнение:
0 = (2 × -2) + х
0 = -4 + х
Добавьте +4 к обеим частям уравнения:
+4 + 0 = +4 +-4 + х
+4 = х
Степень окисления азота в NO 2 равна IV (или, альтернативно, +4)
Обратите внимание, что NO является менее окисленной формой азота, чем NO 2 , потому что:
- содержит меньше кислорода на атом азота
(поэтому валентные электроны азота меньше притягиваются к атомам кислорода) Азот - имеет более низкую степень окисления, чем в NO 2
А как насчет N 2 O?
Степень окисления азота в N 2 O равна I (или, альтернативно, +1), что меньше степени окисления азота в NO (которая равна II или +2), поэтому N 2 O — менее окисленная форма азота, чем NO.
Вы увидите два разных метода, используемых для обозначения степени окисления атома в соединении, как указано ниже:
- Рекомендованные ИЮПАК степени окисления используют римские цифры.
(a) Если степень окисления положительная, она обозначается степенью окисления ТОЛЬКО римской цифрой (без знака +), например, I, II
(б) Если степень окисления отрицательная, то она обозначается степенью окисления со знаком минус (-) непосредственно перед римской цифрой, например -I, -II
(c) Если степень окисления равна нулю, это обозначается степенью окисления с использованием арабского числа 0.
- Альтернативный метод указания степени окисления атома использует знаки и арабские числа для степени окисления (эти арабские числа проще использовать в расчетах):
(a) Если степень окисления положительная, она обозначается степенью окисления со знаком плюс (+) непосредственно перед арабской цифрой, например, +1, +2
(b) Если степень окисления отрицательная, это обозначается степенью окисления со знаком минус (-) непосредственно перед арабским числом, например -1, -2
(c) Если степень окисления равна нулю, это обозначается степенью окисления с использованием арабского числа 0.

Мы можем использовать понятие степени окисления, даже если в молекуле нет кислорода!
Мы можем применить понятие степени окисления к атомам в гидридах, фторидах, хлоридах, бромидах, йодидах, нитридах, сульфидах, фосфидах и т. д.
Но прежде чем мы сможем это сделать, нам нужно будет изучить правила присвоения степеней окисления…
Как применять правила для нахождения степени окисления для представления степени окисления элемента
Сначала выучите следующие 4 правила:
| Правила присвоения номеров окисления | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Правило 1: | Степень окисления атомов, составляющих элемент в свободном состоянии, включая его стандартное состояние, равна 0. | ||||||||||||||||||||||||||
| Правило 2: | Степень окисления иона элемента равна заряду иона (его зарядовому числу). | ||||||||||||||||||||||||||
| Правило 3: | При обнаружении в соединениях степень окисления некоторых элементов всегда одинакова (за некоторыми исключениями), поэтому их степени окисления всегда будут одинаковыми. Эти элементы и их степени окисления перечислены ниже:
| ||||||||||||||||||||||||||
| Правило 4: | Степени окисления других элементов в соединениях можно рассчитать, используя общий заряд соединения:(a) Для молекулы или соединения без общего заряда сумма степеней окисления для каждого атома каждого элемента в молекуле равна 0. | ||||||||||||||||||||||||||
Затем выполните шаги, указанные ниже, чтобы рассчитать степень окисления элемента в соединении.
Примечание. Если не указано иное, предполагается, что все атомы одного и того же элемента в молекулярной формуле имеют одинаковую степень окисления.
| общий пример | ||
| Шаг 1: | Напишите формулу вида (молекулы, иона или соединения). | MX 2 |
| Шаг 2: | Присвойте символ общему начислению на виды и укажите его значение, если оно известно. (мы будем использовать ON как символ степени окисления) | ВКЛ(MX 2 ) = 0 |
| Шаг 3: | Перечислите элементы, составляющие вид (молекулу, ион или соединение), и отметьте, сколько атомов этого элемента присутствует. | 1 × М 2 × Х |
| Шаг 4: | Назначьте символ для представления степени окисления каждого элемента в составе. | НА(М) ВКЛ(Х) |
| Шаг 5: | Впишите любые известные значения степени окисления для указанных выше элементов. (Ознакомьтесь с правилами присвоения степеней окисления!) | ВКЛ(М) = ? ВКЛ(Х) = ? |
| Шаг 6: | Напишите уравнение, используя эти символы, чтобы показать, что сумма степеней окисления для «атомов» каждого присутствующего элемента равна общему заряду частиц. | ВКЛ(MX 2 )= ВКЛ(M)+[2×ВКЛ(X)] |
| Шаг 7: | Подставьте известные значения и решите, чтобы найти неизвестное значение. | 0=ВКЛ(М)+[2×ВКЛ(Х)] |
Лучший способ узнать, как это сделать, это сделать несколько примеров. ….
….
Рабочие примеры: расчет степеней окисления для элементов в электрически нейтральных соединениях
Вопрос 1: Найдите степень окисления, соответствующую степени окисления фтора в F 2 .
Решение:
(На основе подхода StoPGoPS к решению проблем.)
- Какой вопрос просит вас сделать?
Рассчитать степень окисления фтора
- Какие данные (информация) были указаны в вопросе?
Извлечь данные из вопроса:
формула молекулы: F 2(g)
- Какая связь между тем, что вы знаете, и тем, что вам нужно узнать?
Шаг 1: Напишите формулу вида (молекулы, иона или соединения).
Ф 2
Шаг 2: Присвойте символ общему сбору за вид и укажите его значение, если оно известно.
ВКЛ(Ф 2 ) = 0
Молекула F 2 электрически нейтральна, она не имеет общего суммарного заряда.
Шаг 3: Перечислите элементы, из которых состоит вид (молекула, ион или соединение), и отметьте, сколько атомов этого элемента присутствует.
2 атома фтора = 2 × F
Шаг 4: Назначьте символ для представления степени окисления каждого элемента в составе.
Пусть ON(F) = степень окисления каждого атома фтора в молекуле
Шаг 5: Впишите любые известные значения степени окисления для указанных выше элементов.
ВКЛ(Ф) = ?
Шаг 6: Напишите уравнение, используя эти символы, чтобы показать, что сумма степеней окисления для «атомов» каждого присутствующего элемента равна общему заряду частиц.
ВКЛ(F 2 ) = 2 × ВКЛ(F)
Обратите внимание, что F 9Молекула 0077 2 состоит из 2 атомов F, и каждому атому должна быть присвоена степень окисления.Шаг 7: Подставьте известные значения в уравнение:
0 = 2 × ВКЛ(F)
- Решите уравнение, чтобы найти степень окисления фтора
0 = 2 × ВКЛ(F)
Разделите обе части уравнения на 2:
0 ÷ 2 = [
2 ×ВКЛ(Ф)] ÷2
0 = ВКЛ(F)Степень окисления фтора = 0
- Ваш ответ правдоподобен?
Одно из правил присвоения номеров окисления, правило 1, гласит, что
«Степень окисления атомов элемента в свободном состоянии, включая его стандартное состояние, равна 0»
F 2(g) представляет свободное состояние (и стандартное состояние) фтора.
Таким образом, степень окисления фтора в F 2 должна быть 0Поскольку это согласуется с вычисленным выше значением, мы уверены, что наш ответ правдоподобен.
- Укажите свое решение задачи «найти степень окисления фтора»:
Степень окисления фтора в F 2 равно 0
Вопрос 2: Найдите степень окисления, которая представляет степень окисления углерода в CO 2
Решение:
(На основе подхода StoPGoPS к решению проблем.)
- Какой вопрос просит вас сделать?
Рассчитать степень окисления углерода (C)
- Какие данные (информация) были указаны в вопросе?
Извлечь данные из вопроса:
Формула соединения: CO 2
- Какая связь между тем, что вы знаете, и тем, что вам нужно узнать?
Шаг 1: Напишите формулу вида (молекулы, иона или соединения).

СО 2
Шаг 2: Присвойте символ общему сбору за виды и укажите его значение, если оно известно.
ВКЛ(СО 2 ) = 0
Молекула CO 2 электрически нейтральна, она не имеет общего суммарного заряда.Шаг 3: Перечислите элементы, из которых состоит вид (молекула, ион или соединение), и отметьте, сколько атомов этого элемента присутствует.
1 атом углерода = 1 × C
2 атома кислорода = 2 × O
Шаг 4: Назначьте символ для представления степени окисления каждого элемента в составе.
Пусть степень окисления углерода будет ON(C)
Пусть степень окисления кислорода будет ON(O)
Шаг 5: Впишите любые известные значения степени окисления для указанных выше элементов.
ВКЛ(С) = ?
ВКЛ(О) = -II = -2
(из Правил степень окисления О всегда -II (-2), кроме пероксидов, супероксидов и фторидов кислорода)Шаг 6: Напишите уравнение, используя эти символы, чтобы показать, что сумма степеней окисления для «атомов» каждого присутствующего элемента равна общему заряду частиц.

ВКЛ(СО 2 ) = ВКЛ(С) + [2 × ВКЛ(О)]
Обратите внимание, что молекула CO 2 состоит из 1 атома C и 2 атомов O, и каждому атому должна быть присвоена степень окисления.Шаг 7: Подставьте известные значения в уравнение:
0 = ВКЛ(С) + (2 × -2)
- Решите уравнение для расчета степени окисления (состояния) углерода
ВКЛ(С) = 0 — (2 × -2)
ВКЛ(С) = 0 — (-4)
ВКЛ(С) = +4Степень окисления углерода в CO 2 равна IV (или +4)
- Ваш ответ правдоподобен?
Кислород более электроотрицателен, чем углерод, то есть кислород обладает большей способностью притягивать к себе общие отрицательно заряженные электроны в ковалентной связи, чем атом углерода, поэтому мы ожидаем, что кислород будет иметь отрицательное значение степени окисления, в то время как углерод следовательно, будет иметь положительное значение степени окисления.

В этом отношении наш ответ правдоподобен.Работайте в обратном порядке, используя рассчитанное значение степени окисления углерода и значение степени окисления кислорода, заданное «правилами», для расчета общего заряда молекулы CO 2 .
Пусть ON(CO 2 ) = заряд молекулы
и ON(O) = степень окисления кислорода = -2
и ON(C) = степень окисления углерода = +4
Затем:
ВКЛ(СО 2 ) = ВКЛ(С) + [2 × ВКЛ(О)]
ВКЛ(СО 2 ) = +4 + (2 × -2) = +4 + (-4) = +4 — 4 = 0
Таким образом, CO 2 имеет общий заряд 0.
Таким образом, мы достаточно уверены, что наш ответ правильный. - Укажите свое решение задачи «найти степень окисления углерода»:
Степень окисления углерода IV (или альтернативно +4)
Рабочие примеры: расчет степеней окисления элементов в заряженных формах (ионы)
Вопрос 1: Определите степень окисления серы в S 2-.
Решение:
(На основе подхода StoPGoPS к решению проблем.)
- Какой вопрос просит вас сделать?
Рассчитать степень окисления серы
- Какие данные (информация) были указаны в вопросе?
Извлечь данные из вопроса:
формула иона: S 2-
- Какая связь между тем, что вы знаете, и тем, что вам нужно узнать?
Шаг 1: Напишите формулу вида (молекулы, иона или соединения).
С 2-
Шаг 2: Присвойте символ общему сбору за вид и укажите его значение, если оно известно.
Пусть ON(S 2- ) = заряд иона
ВКЛ(S 2- ) = -2
Шаг 3: Перечислите элементы, из которых состоит вид (молекула, ион или соединение), и отметьте, сколько атомов этого элемента присутствует.
1 атом серы = 1 × S
Шаг 4: Назначьте символ для представления степени окисления каждого элемента в составе.

Пусть ON(S) = степень окисления серы в ионе
Шаг 5: Впишите любые известные значения степени окисления для указанных выше элементов.
ВКЛ(С) = ?
Шаг 6: Напишите уравнение, используя эти символы, чтобы показать, что сумма степеней окисления для «атомов» каждого присутствующего элемента равна общему заряду частиц.
ВКЛ(S 2- ) = ВКЛ(S)
Шаг 7: Подставьте известные значения в уравнение:
-2 = ВКЛ(С)
- Решите уравнение для расчета степени окисления
ВКЛ(С) = -2 = -II
- Ваш ответ правдоподобен?
Правило 2 гласит, что «степень окисления иона элемента равна заряду иона».
S 2- — сульфид-ион, ион элемента серы.
Значит, степень окисления S 2- будет равна заряду на ионе.
Плата за S 2- 2-
Следовательно, степень окисления серы в S 2- должна быть -2 или -IIПоскольку это значение согласуется с тем, что мы рассчитали выше, мы достаточно уверены, что наш ответ правдоподобен.

- Укажите решение задачи «Определить степень окисления серы»:
Степень окисления серы в S 2- равна -II (или, альтернативно, -2)
Вопрос 2: Определить степень окисления хрома в Cr 2 O 7 2-
Решение:
(На основе подхода StoPGoPS к решению проблем.)
- Какой вопрос просит вас сделать?
Рассчитать степень окисления хрома
- Какие данные (информация) были указаны в вопросе?
Извлечь данные из вопроса:
Формула многоатомного иона: Cr 2 O 7 2-
- Какая связь между тем, что вы знаете, и тем, что вам нужно узнать?
Шаг 1: Напишите формулу вида (молекулы, иона или соединения).
Cr 2 O 7 2-
Шаг 2: Присвойте символ общему сбору за вид и укажите его значение, если оно известно.

Пусть ON(Cr 2 O 7 2- ) — заряд многоатомного иона
ON(Cr 2 O 7 2- ) = -2Шаг 3: Перечислите элементы, из которых состоит вид (молекула, ион или соединение), и отметьте, сколько атомов этого элемента присутствует.
2 атома хрома = 2 × Cr
7 атомов кислорода = 7 × OШаг 4: Назначьте символ для представления степени окисления каждого элемента в составе.
Пусть ON(Cr) = степень окисления каждого атома хрома
Пусть ON(O) = степень окисления каждого атома кислорода
Шаг 5: Впишите любые известные значения степени окисления для указанных выше элементов.
ON(Cr) = ?
ВКЛ(О) = -II = -2
(из Правил степень окисления О всегда -II (-2), кроме пероксидов, супероксидов и фторидов кислорода)Шаг 6: Напишите уравнение, используя эти символы, чтобы показать, что сумма степеней окисления для «атомов» каждого присутствующего элемента равна общему заряду частиц.

ON(Cr 2 O 7 2- ) = [2 × ON(Cr)] + [7 × ON(O)]
помните, каждая молекула Cr 2 O 7 2- состоит из 2 атомов Cr и 7 атомов O, и каждый атом имеет степень окисленияШаг 7: Подставьте известные значения в уравнение:
-2 = [2 × ВКЛ(Cr)] + [7 × -2]
- Решите уравнение для расчета степени окисления
-2 = [2 × ВКЛ(Cr)] + [7 × -2]
-2 = 2ОН(Кр) -14Собрать похожие термины:
-2 + 14 = 2ОН(Кр)
+12 = 2ВКЛ(Кр)Разделите обе части уравнения на 2:
+12 ÷ 2 =2ВКЛ(Cr) ÷2
+6 = ВКЛ(Cr) = VI - Ваш ответ правдоподобен?
Хром является переходным металлом, поэтому мы ожидаем, что он будет менее электроотрицательным, чем кислород, поэтому мы ожидаем, что хром будет иметь положительную степень окисления, а кислород — отрицательную степень окисления.

Исходя из этого, наш ответ правдоподобен.Работайте в обратном направлении, используя наше расчетное значение степени окисления хрома и известную степень окисления кислорода, чтобы увидеть, получим ли мы заряд 2- для многоатомного иона, указанного в вопросе:
ВКЛ(Cr) = +6
ВКЛ(О) = -2
ON (многоатомный ион) = (2 × +6) + (7 × -2)
= +12 + -14 = -2
Заряд многоатомного иона = 2-Поскольку это заряд многоатомного иона, указанный в вопросе, мы уверены, что наш ответ правдоподобен.
- Укажите свой вариант решения задачи «Определить степень окисления хрома»:
Степень окисления хрома в Cr 2 O 7 2- VI (или, как вариант, +6)
Сноски:
(1) На этой странице рекомендации ИЮПАК ссылаются на «Номенклатуру неорганической химии», Рекомендации ИЮПАК 2005 г. (обычно называемые «Красной книгой»).
Вы обнаружите, что «Альтернативные» степени окисления легче использовать в расчетах.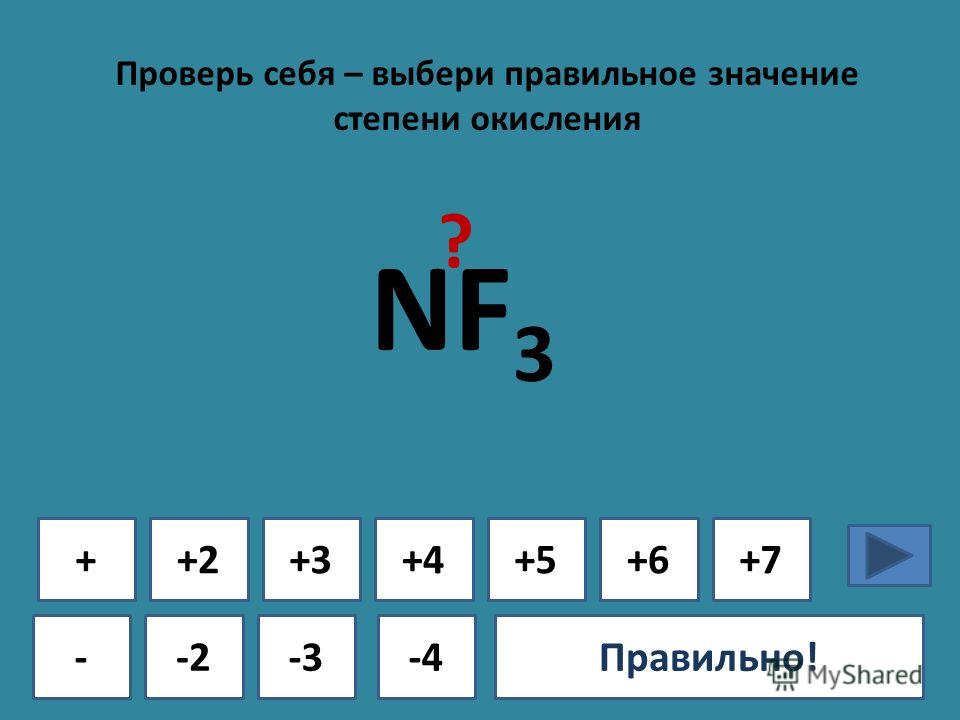
Следует ли в ответе на вопрос по химии указывать степень окисления римскими или арабскими цифрами?
Руководствуйтесь своим учителем, потому что в вашей программе по химии может быть указано, что вы используете только один из этих методов.
Вернуться к началу
(2) Другой метод определения степеней окисления использует структуры Льюиса (электронно-точечные диаграммы).
Оба электрона связывающей пары относятся к наиболее электроотрицательному атому.
Если два связанных атома идентичны, связывающая пара делится между ними поровну.
Затем подсчитываются валентные электроны каждого атома.
Каждый валентный электрон, присоединенный к атому, приводит к увеличению степени окисления на I (или +1).
Каждый валентный электрон, удаленный из атома, приводит к уменьшению степени окисления на -I (или -1)
Мы будем использовать «Правила присвоения степеней окисления» на этой странице, потому что это проще, то есть нам не нужно рисовать структуру Льюиса каждый раз, когда мы хотим определить степень окисления атома в молекуле.
Вернуться к началу
(3) Стандартным состоянием элемента является форма, которую он принимает при температуре 25°C и давлении 100 кПа.
(I) Металлы являются твердыми телами (M (s) ), КРОМЕ ртути, которая является жидкостью. (Hg (л) )
(II) Неметаллами будут твердые вещества с рядом молекулярных формул, ЗА ИСКЛЮЧЕНИЕМ:
(i) бром жидкий (Br 2(l) )
(ii) 11 газообразных элементов:
(a) ВСЕ 6 благородных газов (группа 18) являются одноатомными газами (He (г) , Ne (г) , Ar (г) , Kr (г) , Xe (г) , Ra (г) )
(b) 5 двухатомных газов, F 2(g) , Cl 2(g) , O 2(g) , N 2g , H 2(g)
Вернуться к началу
(4) Невозможно представить эту степень окисления (-½) римской цифрой.
Вернуться к началу
(5) Химики используют слово «нейтральный» в разных контекстах для разных значений.
Соединение HCl электрически нейтрально, потому что не имеет общего заряда.
Но HCl является донором протонов, поэтому она кислая, а не нейтральная, когда мы говорим о ее кислотности.
Вернуться к началу
(6) Рассмотрим Pb 3 O 4 .
Атомам кислорода присвоена степень окисления -II (-2)
Если рассматривать все атомы Pb как имеющие одинаковую степень окисления, то мы получим степень окисления (4 × 2) ÷ 3 = +2 2 / 3
Это вводит в заблуждение, поскольку 2 атома Pb в формуле имеют степень окисления II (или +2), а другой атом Pb в формуле имеет степень окисления IV (или +4)
Для соединения чистый общий заряд 0: (2 × +2) + (1 × +4) + (4 × -2) = 4 + 4 — 8 = 8 — 8 = 0
Лучшей формулой для этого соединения будет Pb II 2 Pb IV O 4
Вернуться к началу
©AUS-e-TUTEwww.ausetute.com.au
Какова степень окисления золота в Au? – Книга Vea
Содержание
Какова степень окисления золота в Au?
Для золота (Au) релятивистское расширение его 5d-орбиталей приводит к образованию соединений с высокой степенью окисления. На сегодняшний день наивысшая известная степень окисления золота составляет +5
На сегодняшний день наивысшая известная степень окисления золота составляет +5
. Есть ли у золота несколько степеней окисления?
Согласно знаниям из учебника, обычные степени окисления золота в соединениях +I и +III. Двухвалентная форма (+II), напротив, предпочитает образовывать многоядерные соединения или просто претерпевает превращение в одно- и трехвалентные формы.
Каково чистое состояние золота?
Золото бывает разной степени чистоты; от 10-каратного золота самой низкой чистоты до 24-каратного золота, чистота которого составляет 100 процентов. Золото менее 24 карат всегда представляет собой сплав с другими металлами, такими как медь, серебро или платина.
Проходит ли золото окисление?
Corrosionpedia объясняет коррозию золота Чистое золото не вступает в реакцию с кислородом; однако во многих приложениях используются сплавы золота, а не чистое золото. Золотые сплавы содержат элементы, которые не подвергаются окислению.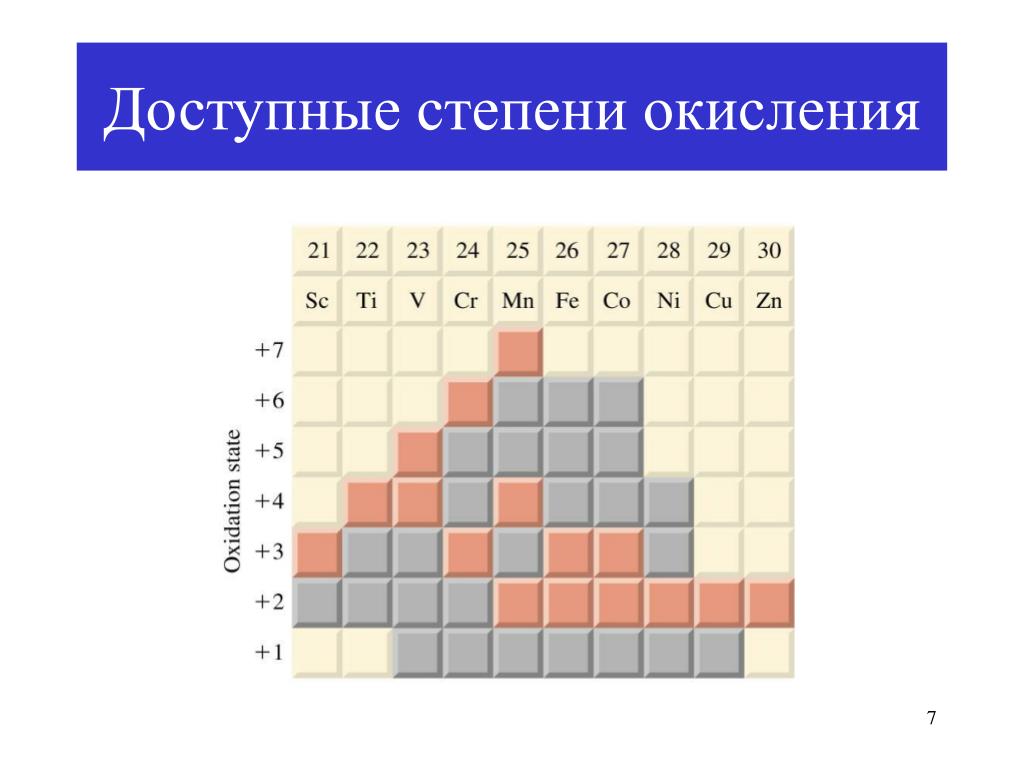 Чем больше легирующих элементов содержится в золотом сплаве, тем выше вероятность коррозии золота.
Чем больше легирующих элементов содержится в золотом сплаве, тем выше вероятность коррозии золота.
Что такое степень окисления золота?
Наиболее распространенными степенями окисления золота являются +1 и +3. Это означает, что он жертвует 1 или 3 электрона для образования стабильных соединений. Например, в AuCl3 ионы хлорида имеют степень окисления -1, поэтому золото будет иметь степень окисления Au + 3(-1) 0, поэтому золото будет иметь степень окисления +3.
Какова степень окисления золота в Au CN 4 -?
Состояние III
Сколько степеней окисления имеет золото?
Обычные степени окисления золота включают +1 (золото(I) или соединения золота) и +3 (золото(III) или соединения золота).
Почему золото имеет степень окисления +3?
Это означает, что отдает 1 или 3 электрона для образования стабильных соединений. Например, в AuCl3 ионы хлорида имеют степень окисления -1, поэтому золото будет иметь степень окисления Au + 3(-1) 0, поэтому золото будет иметь степень окисления +3. Следовательно, золото в своей элементарной форме имеет степень окисления 0, но его обычные степени окисления включают +1 и +3.
Следовательно, золото в своей элементарной форме имеет степень окисления 0, но его обычные степени окисления включают +1 и +3.
Какие металлы имеют несколько степеней окисления?
Большинство переходных металлов имеют несколько степеней окисления, поскольку переходные металлы относительно легко теряют электрон(ы) по сравнению со щелочными металлами и щелочноземельными металлами.
Что имеет несколько степеней окисления?
Переходные металлы
Как называется 100% чистое золото?
24-каратное золото
Является ли чистое золото твердым или жидким?
твердый
Что такое чистое золото?
24-каратное золото — это чистое золото. В него абсолютно не добавлен сплав. Его ярко-желтый цвет не распространен в США или других западных странах. Однако он очень популярен в Китае, Индии и других азиатских странах. Внешний вид: 24-каратное золото очень ярко-желтого цвета.
Может ли золото быть на 100% чистым?
Поскольку получить 100% чистое золото практически невозможно, самый чистый тип золота, доступный в настоящее время, имеет пробу 999,99. Иногда это называют пятью девятками. Королевский монетный двор Канады регулярно выпускает памятные монеты из этого чистого золота. Чуть ниже это 999,9 или четыре девятки нормально.
Иногда это называют пятью девятками. Королевский монетный двор Канады регулярно выпускает памятные монеты из этого чистого золота. Чуть ниже это 999,9 или четыре девятки нормально.
Окисляется или восстанавливается золото?
Все ответы (11) золото обычно восстанавливается при подаче 1,5 В. но золото существует в виде наночастиц, все будет по-другому.
Почему золото устойчиво к окислению?
– Золото является благородным металлом в таблице Менделеева, химически инертным и не подвергается коррозии в естественной или промышленной среде. Это потому, что золото не реагирует с кислородом в атмосфере
Есть ли у золота степени окисления?
Характерные степени окисления золота: +1 (золотосодержащие соединения) и +3 (золотосодержащие соединения). Состояние +1 обычно довольно нестабильно, и большая часть химии золота связана с состоянием +3.
Золото легко окисляется?
Золото — один из наименее реакционноспособных элементов.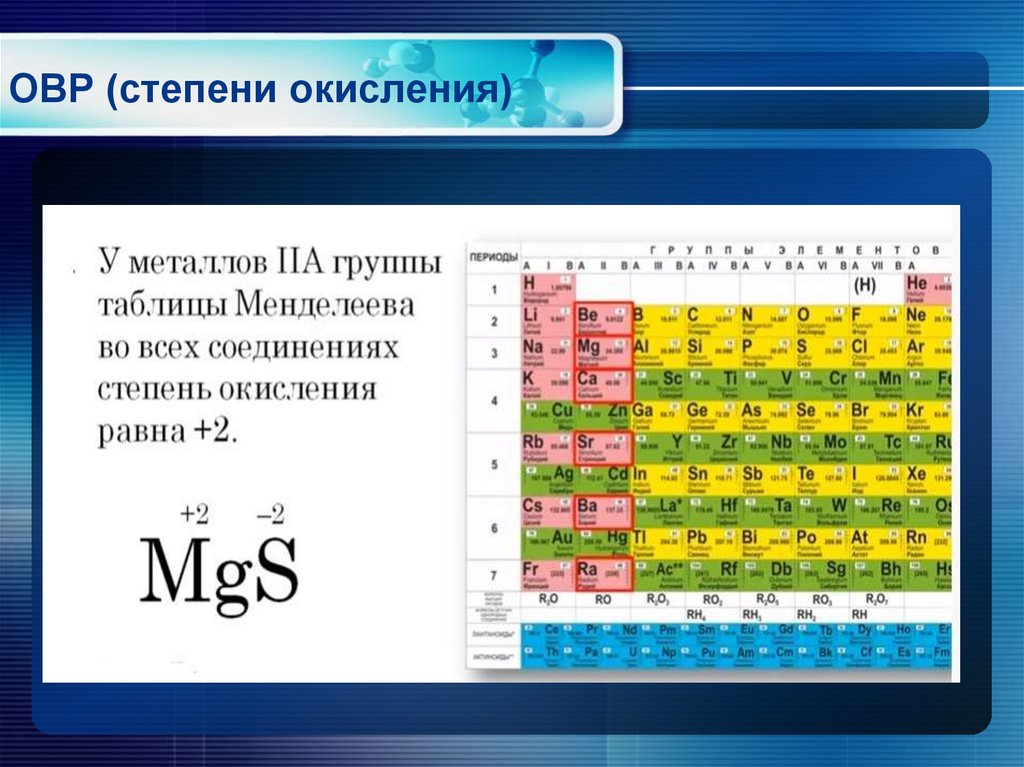 Чистое золото плохо взаимодействует с кислородом, поэтому оно остается блестящим, не ржавеет и не тускнеет. Однако чистое золото или 24-каратное золото слишком мягкое для использования в ювелирных изделиях, поэтому его обычно смешивают с пропорциями других неблагородных металлов, обычно серебра или меди, чтобы сделать его более твердым.
Чистое золото плохо взаимодействует с кислородом, поэтому оно остается блестящим, не ржавеет и не тускнеет. Однако чистое золото или 24-каратное золото слишком мягкое для использования в ювелирных изделиях, поэтому его обычно смешивают с пропорциями других неблагородных металлов, обычно серебра или меди, чтобы сделать его более твердым.
Какова степень окисления золота в комплексе ниже?
Согласно знаниям из учебника, обычные степени окисления золота в соединениях +I и +III. Двухвалентная форма (+II), напротив, предпочитает образовывать многоядерные соединения или просто претерпевает превращение в одно- и трехвалентные формы.
Есть ли в золоте оксид?
В данном комплексе присутствуют 4 атома хлора и 1 атом золота, комплекс имеет заряд -1. Таким образом, степень окисления золота [{rm{(Au)}}] равна 9.0331 +3. Следовательно, правильный вариант (B) +3.
Какова степень окисления золота в Au CN 4?
оксид золота(III) с хлорной кислотой и перхлоратом щелочного металла в герметичной кварцевой трубке при температуре около 250 и давлении около 30 МПа.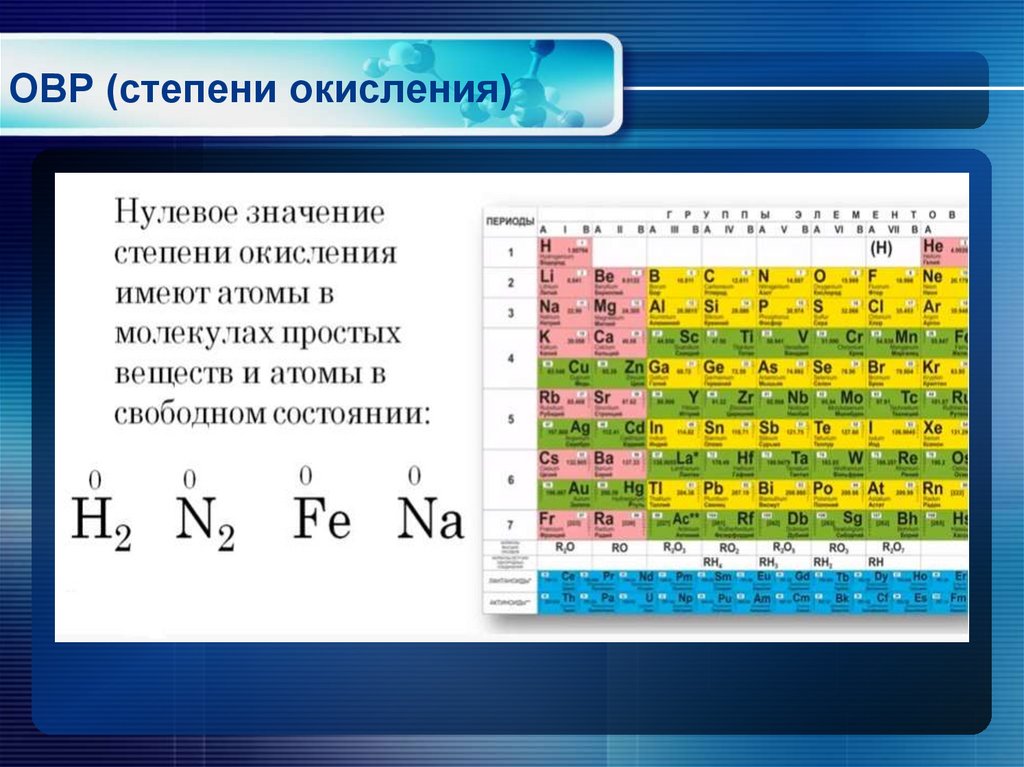 Оксид золота(III). НазванияХимическая формулаAu2O3Молярная масса441,93Внешний вид красно-коричневого твердого веществаПлотность11,34 г/см3 в 20 21 дополнительных рядах
Оксид золота(III). НазванияХимическая формулаAu2O3Молярная масса441,93Внешний вид красно-коричневого твердого веществаПлотность11,34 г/см3 в 20 21 дополнительных рядах
Какова степень окисления золота в Au CN 2?
Окисление золота в [Au(CN)2] 1.
Какова степень окисления золота?
Наиболее распространенными степенями окисления золота являются +1 и +3. Это означает, что он жертвует 1 или 3 электрона для образования стабильных соединений. Например, в AuCl3 ионы хлорида имеют степень окисления -1, поэтому золото будет иметь степень окисления Au + 3(-1) 0, поэтому золото будет иметь степень окисления +3.
Какова степень окисления Au в K Au OH 4?
2
Почему золото показывает 3 степени окисления?
Согласно учебнику знаний, обычные степени окисления золота в соединениях +I и +III. Двухвалентная форма (+II), напротив, предпочитает образовывать многоядерные соединения или просто претерпевает превращение в одно- и трехвалентные формы.
Au Gold Информация об элементе: факты, свойства, тенденции, использование и сравнение — Периодическая таблица элементов
Кристаллическая структура золота
Твердотельная структура золота Гранецентрированная кубическая .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена параметрами решетки, которые являются длинами ребер ячейки Постоянные решетки (a, b и c)
| a | b | c |
|---|---|---|
| 407,82 пм | 407,82 пм | 407,82 пм |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | Гамма |
|---|---|---|
| π/2 | π/2 | π/2 |
. y i , z i ), измеренные от опорной точки решетки.
y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219различные типы или 230, если хиральные копии считаются различными.
| Space Group Name | Fm_ 3m | |
| Oxidation States | Space Group Number | 225 |
| Crystal Structure | Face Centered Cubic |
Gold Atomic and Orbital Properties
Атомы золота имеют 79 электронов и структуру электронной оболочки [2, 8, 18, 32, 18, 1] с символом атомного термина (квантовые числа) 2 S 1/2 .
| Atomic Number | 79 |
| Number of Electrons (with no charge) | 79 |
| Number of Protons | 79 |
| Mass Number | 197 |
| Number нейтронов | 118 |
| Структура оболочки (электронов на энергетический уровень) | 2, 8, 18, 32, 18, 1 |
| Электронная конфигурация | [Xe] 4f14 5d10 6s1 |
| Valence Electrons | 5d10 6s1 |
| Valence (Valency) | 5 |
| Main Oxidation States | 1, 3 |
| Oxidation States | — 3, -2, -1, 0, 1, 2, 3, 5 |
| Символ атомного термина (квантовые числа) | 2 S 1/2 |
1933503191.Золото — Электроны на энергетический уровень
Электронная конфигурация основного состояния золота — нейтральный атом золота
Сокращенная электронная конфигурация золота
Сокращенная электронная конфигурация основного состояния нейтрального атома золота [Xe] 4f14 5d10 6s1. Часть конфигурации золота, эквивалентная благородному газу предшествующего периода, обозначается аббревиатурой [Xe]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 5d10 6s1, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтрального золота
Полная электронная конфигурация основного состояния атома золота. Полная электронная конфигурация
порядок, определяемый принципом Ауфбау, принципом исключения Паули и правилом Хунда.
В соответствии с принципом Ауфбау электроны будут занимать орбитали с более низкой энергией, прежде чем займут орбитали с более высокой энергией. По этому принципу электроны заполняются в следующем порядке: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p. …
Принцип запрета Паули гласит, что максимум два электрона, каждый из которых имеет противоположные спины, могут разместиться на одной орбитали. Правило Хунда гласит, что каждая орбиталь в данной подоболочке по одному занята электронами, прежде чем второй электрон заполнит орбиталь. Атомная структура золота
Атомный радиус золота составляет 174 пм, а ковалентный радиус — 144 пм.
Вычисленный атомный радиус 174 пм (1,74 Å)
Atomic Radius Empirical 135 pm (1.35 Å)
Atomic Volume 10.21 cm3/mol Covalent Radius 144 pm (1.44 Å) Van der Waals Radius 166 pm Neutron Cross Section 98. 7
Neutron Mass Absorption 0.017 Atomic Spectrum of Gold
Химические свойства золота: Энергия ионизации золота и сродство к электрону
Сродство золота к электрону составляет 222,8 кДж/моль.
Valence 5 Electronegativity 2.54 ElectronAffinity 222.8 kJ/mol Ionization Energy of Gold
Refer to table below for Ionization energies of Gold
Ionization energy number Enthalpy — kJ/mol 1st 890.1 2nd 1980 Gold Physical Properties
Refer to below table for Gold Physical Properties
Плотность 19,3 г/см3 (для жидкости при т. пл. плотности $17,31 г/см3)
Молярный объем 10,21 см3/моль 72 Elastic Properties
Young Modulus 78 Shear Modulus 27 GPa Bulk Modulus 220 GPa Poisson Ratio 0.44 Hardness of Gold — Испытания на измерение твердости элемента
Твердость по Моосу 2,5 МПа Твердость по Виккерсу 216 МПа Твердость по Бринеллю 2450 МПа Электрические свойства золота
Золото является проводником электричества. Refer to table below for the Electrical properties ofGold
Electrical Conductivity 45000000 S/m Resistivity 2.2e-8 m Ω Superconducting Point — Gold Теплопроводность и теплопроводность
Thermal Conductivity 320 W/(m K) Thermal Expansion 0. 0000142 /K
Gold Magnetic Properties
Magnetic Type Diamagnetic Curie Точка — Массовая магнитная восприимчивость -1,78e-9 м3/кг Молярная магнитная восприимчивость -3,51e-10 м3/моль Volume Magnetic Susceptibility -0.0000344 Optical Properties of Gold
Refractive Index — Acoustic Properties of Gold
Speed of Sound 1740 м/с Тепловые свойства золота – энтальпии и термодинамика
Тепловые свойства золота см. в таблице ниже
Melting Point 1337.33 K (1064.18°C, 1947.524 °F) Boiling Point 3129 K (2855. 85°C, 5172.53 °F)
Critical Temperature — Superconducting Point — Enthalpies of Gold
Heat of Fusion 12.5 kJ/mol Heat of Vaporization 330 kJ/mol Теплота сгорания — Изотопы золота. Ядерные свойства золота
Золото состоит из 37 изотопов, содержащих от 169 до 205 нуклонов. Золото имеет 1 стабильный изотоп природного происхождения.
Изотопы золота — Встречающиеся в природе стабильные изотопы: 197Au.
Изотоп Z N Изотоп Масса % Содержание T половина Decay Mode 169Au 79 90 169 Synthetic 170Au 79 91 170 Synthetic 171Au 79 92 171 Synthetic 172Au 79 93 172 Synthetic 173Au 79 94 173 Synthetic 174Au 79 95 174 Synthetic 175Au 79 96 175 Synthetic 176Au 79 97 176 Synthetic 177Au 79 98 177 Synthetic 178Au 79 99 178 Synthetic 179Au 79 100 179 Synthetic 180Au 79 101 180 Synthetic 181Au 79 102 181 Synthetic 182Au 79 103 182 Synthetic 183Au 79 104 183 Synthetic 184Au 79 105 184 Synthetic 185Au 79 106 185 Synthetic 186Au 79 107 186 Synthetic 187Au 79 108 187 Synthetic 188Au 79 109 188 Synthetic 189Au 79 110 189 Synthetic 190Au 79 111 190 Synthetic 191Au 79 112 191 Synthetic 192Au 79 113 192 Синтетический 193AU 79 114 193491 090 1934191 0 19341 90 19341 0350194Au 79 115 194 Synthetic 195Au 79 116 195 Synthetic 196Au 79 117 196 Синтетический 197AU 79 118 197 100% Ст. 0340 198Au
79 119 198 Synthetic 199Au 79 120 199 Synthetic 200Au 79 121 200 Синтетический 201AU 79 122 201 3503503503503503503503503503503503503503503503503503503503503503503503503503503503503539н. 123 202 Synthetic 203Au 79 124 203 Synthetic 204Au 79 125 204 Synthetic 205Au 79 126 205 Синтетический первый выделенный комплекс золота; новое фундаментальное понимание также обеспечивает возможное объяснение механизма действия цитостатических золотых (+III) порфиринов — ScienceDaily
Новости науки
от исследовательских организаций
2
Найдено недостающее золотое звено: комплекс двухвалентного золота выделен впервые в чистом виде; новое фундаментальное понимание также обеспечивает возможное объяснение механизма действия цитостатических золотых (+III) порфиринов
- Дата:
- 8 августа 2017 г.
- Источник:
- Университет Иоганна Гутенберга в Майнце
- Резюме:
- Группе химиков удалось выделить и проанализировать золото в очень редкой степени окисления +II. Это обеспечивает недостающие звенья в гомологическом ряду чеканных ионов металлов меди (+II), серебра (+II), золота (+II) и в «релятивистской» триаде платины (+II), золота (+II). ) и ртуть(+II).
- Поделиться:
ПОЛНАЯ ИСТОРИЯ
Согласно учебникам, обычные степени окисления золота в соединениях +I и +III. Двухвалентная форма (+II), напротив, предпочитает образовывать многоядерные соединения или просто претерпевает превращение в одно- и трехвалентные формы. Однако элементы, следующие за золотом в периодической таблице, в этом отношении сильно отличаются. Ионы металлов чеканки, меди (+II) и серебра (+II), обычно присутствуют в двухвалентной форме, и это также относится к соседям золота слева и справа, платине (+II) и ртути (+II). ). Было высказано предположение, что, когда золото подвергается реакциям фотохимического катализа, может образоваться состояние +II, но окончательных доказательств до сих пор не представлено.
Соответствующее доказательство только что было представлено исследователями из Майнцского университета имени Иоганна Гутенберга (JGU) в недавней публикации.
объявление
Группа химиков под руководством профессора Кати Хайнце из Института неорганической и аналитической химии JGU смогла выделить и проанализировать золото в очень редкой степени окисления +II. Это обеспечивает недостающие звенья в гомологическом ряду чеканных ионов металлов меди (+II), серебра (+II), золота (+II) и в «релятивистской» триаде платины (+II), золота (+II). ) и ртуть(+II). «Фундаментальные данные, неизвестные на сегодняшний день, такие как размер ионов, предпочтительное структурное расположение и реакционная способность золота (+II), теперь стали доступными», — объяснил Себастьян Прейсс, докторант в группе Хайнце, который смог выделить золото (+II). II) комплекс в чистом виде впервые. Результаты были опубликованы в Химия природы .
Стабилизация очень лабильного иона золота(+II) была достигнута исследователями с помощью так называемого порфирина, используемого для инкапсуляции иона золота(+II).
В сочетании с ионами магния или железа в центре соответственно макроцикл порфирина присутствует в зеленом пигменте растений (хлорофилле) и в красном пигменте крови (геме). С золотом(+II) в центре порфирин блокирует нормальные пути реакции золота(+II), т. е. образование полиядерных соединений или превращение в более стабильные комплексы золота(+I) и золота(+III). «Это позволило впервые исследовать этот уникальный класс стабильных моноядерных комплексов золота(+II) и всесторонне описать их», — резюмировала профессор Катя Хайнце. Интересно, что расположение четырех атомов рядом с ионом золота (+II) не является квадратно-плоским с атомами, расположенными на одинаковом расстоянии от золота, как в случае соответствующих структур соседних с золотом элементов меди (+II), серебра (+II), платина(+II) и ртуть(+II). Вместо этого структура демонстрирует ромбическое искажение с двумя короткими и двумя длинными расстояниями. С технической точки зрения это ранее ненаблюдавшееся явление в случае ионов золота (+II) можно объяснить эффектом Яна-Теллера второго порядка, обусловленным релятивистскими свойствами золота.
Поскольку это новое соединение золота(+II) также может быть получено из комплекса золота(+III), присутствующего в сильнодействующих противораковых средствах, исследователи попытались выяснить, играет ли роль порфирин золота(+II) в биологические системы. Они обнаружили, что комплекс золота(+II) может образовываться в условиях, близких к физиологическим, из цитостатического агента золота(+III). При воздействии атмосферного кислорода порфирин золота (+II) образует активные формы кислорода (АФК), которые, как известно, вызывают апоптоз или запрограммированную гибель клеток. «Таким образом, у нас есть правдоподобная функциональная цепочка, начинающаяся с цитостатического агента и ведущая к целенаправленной гибели клеток с помощью золотого (+II) порфирина, выступающего в качестве важного звена в цепи», — подчеркнул Хайнце. «Основным стимулом для продолжения исследований в этой области для нас является то, что основанные на любопытстве фундаментальные исследования необычных видов позволили нам прийти к пониманию, которое вполне может иметь отношение к медицинским приложениям», — заключил Хайнце.
изменить мир к лучшему: спонсируемая возможность
Источник истории:
Материалы предоставлены Университетом им. Иоганна Гутенберга, Майнц, . Примечание. Содержимое можно редактировать по стилю и длине.
Номер журнала :
- Себастьян Прейс, Кристоф Фёрстер, Свен Отто, Матиас Бауэр, Патрик Мюллер, Дариуш Хиндербергер, Халех Хашеми Хаэри, Лука Карелла, Катя Хайнце. Строение и реакционная способность моноядерного комплекса золота(II) . Природохимия , 2017; DOI: 10.1038/nchem.2836
Цитировать эту страницу :
- MLA
- АПА
- Чикаго
Майнцский университет имени Иоганна Гутенберга. «Золото, стабилизированное в очень редкой степени окисления +II: найдено недостающее золотое звено: комплекс двухвалентного золота выделен впервые в чистом виде; новое фундаментальное понимание также дает возможное объяснение механизма действия цитостатических порфиринов золота (+III).

 Оно присутствует также в морской воде (в
концентрации примерно 1•10–7%), однако
экономически выгодных способов его добычи пока
не разработано.
Оно присутствует также в морской воде (в
концентрации примерно 1•10–7%), однако
экономически выгодных способов его добычи пока
не разработано. Ном на Аляске (1900).
Ном на Аляске (1900).

 Оно имеет
такую же электроотрицательность, как селен, и
лишь ненамного меньше, чем сера и йод (2,5).
Значение сродства к электрону для золота также
близко к соответствующему значению для йода
Оно имеет
такую же электроотрицательность, как селен, и
лишь ненамного меньше, чем сера и йод (2,5).
Значение сродства к электрону для золота также
близко к соответствующему значению для йода Элемент в степени окисления
+1 обычно имеет координационное число 2.
Соединения, для которых формальная степень
окисления золота равна +2, в действительности, как
правило, являются смешанными соединениями,
содержащими золото(I) и золото(III) AuI/AuIII.
Пример: AuIAuIIISO4.
Элемент в степени окисления
+1 обычно имеет координационное число 2.
Соединения, для которых формальная степень
окисления золота равна +2, в действительности, как
правило, являются смешанными соединениями,
содержащими золото(I) и золото(III) AuI/AuIII.
Пример: AuIAuIIISO4.

 Продуктом его дегидратации является коричневый
Au2O3:
Продуктом его дегидратации является коричневый
Au2O3:
 В твердом и газообразном
состояниях они являются димерами и имеют плоское
строение. При нагревании оба соединения теряют
галоген и превращаются сначала в моногалогенид,
а затем в металлическое золото. Димерный хлорид
золота(III) Au2Cl6 является одним из самых
известных соединений золота. При растворении в
хлороводородной кислоте он дает устойчивый ион
[AuCl4]–. Взаимодействием Au2Cl6 c фтором или трифторидом брома получают фторид
золота(III) AuF3 – мощный фторирующий агент.
Это оранжевое твердое вещество состоит из
плоскоквадратных групп AuF4, которые
объединены через цисрасположенные атомы фтора
двух соседних AuF4–, образуя
спиралевидные цепочки.
В твердом и газообразном
состояниях они являются димерами и имеют плоское
строение. При нагревании оба соединения теряют
галоген и превращаются сначала в моногалогенид,
а затем в металлическое золото. Димерный хлорид
золота(III) Au2Cl6 является одним из самых
известных соединений золота. При растворении в
хлороводородной кислоте он дает устойчивый ион
[AuCl4]–. Взаимодействием Au2Cl6 c фтором или трифторидом брома получают фторид
золота(III) AuF3 – мощный фторирующий агент.
Это оранжевое твердое вещество состоит из
плоскоквадратных групп AuF4, которые
объединены через цисрасположенные атомы фтора
двух соседних AuF4–, образуя
спиралевидные цепочки. Это соединение склонно
к диссоциации с образованием фторида золота(III) AuF3.
При взаимодействии с дифторидом ксенона XeF2 в безводном растворе в жидком фтороводороде оно
образует желто-оранжевые кристаллы комплекса [Xe2F3][AuF6].
Это соединение склонно
к диссоциации с образованием фторида золота(III) AuF3.
При взаимодействии с дифторидом ксенона XeF2 в безводном растворе в жидком фтороводороде оно
образует желто-оранжевые кристаллы комплекса [Xe2F3][AuF6]. Получены также многочисленные катионные
комплексы с аммиаком и аминами.
Получены также многочисленные катионные
комплексы с аммиаком и аминами. Chemistry of the Elements. Oxford: Butterworth,
1997.
Chemistry of the Elements. Oxford: Butterworth,
1997.
 1021/jacs.8b04563
1021/jacs.8b04563 , Уилкинсон А.П., Бартлетт Н.
Граудеюс О. и др.
Неорг хим. 3 апреля 2000 г .; 39 (7): 1545-8. дои: 10.1021/ic9
, Уилкинсон А.П., Бартлетт Н.
Граудеюс О. и др.
Неорг хим. 3 апреля 2000 г .; 39 (7): 1545-8. дои: 10.1021/ic9 2019.
PMID: 30864432
2019.
PMID: 30864432


 Например, степень окисления каждого атома в \(\ce{Fe}\), \(\ce{Li}\), \(\ce{N_2}\), \(\ce{Ar}\), и \(\ce{P_4}\) равно нулю. 9{3+}}\) равны \(+1\), \(-2\) и \(+3\) соответственно.
Например, степень окисления каждого атома в \(\ce{Fe}\), \(\ce{Li}\), \(\ce{N_2}\), \(\ce{Ar}\), и \(\ce{P_4}\) равно нулю. 9{3+}}\) равны \(+1\), \(-2\) и \(+3\) соответственно. Сумма всех степеней окисления сульфат-иона будет равна \(1\влево(+6\вправо) + 4\влево(-2\вправо) = -2\), что является зарядом иона.
Сумма всех степеней окисления сульфат-иона будет равна \(1\влево(+6\вправо) + 4\влево(-2\вправо) = -2\), что является зарядом иона.
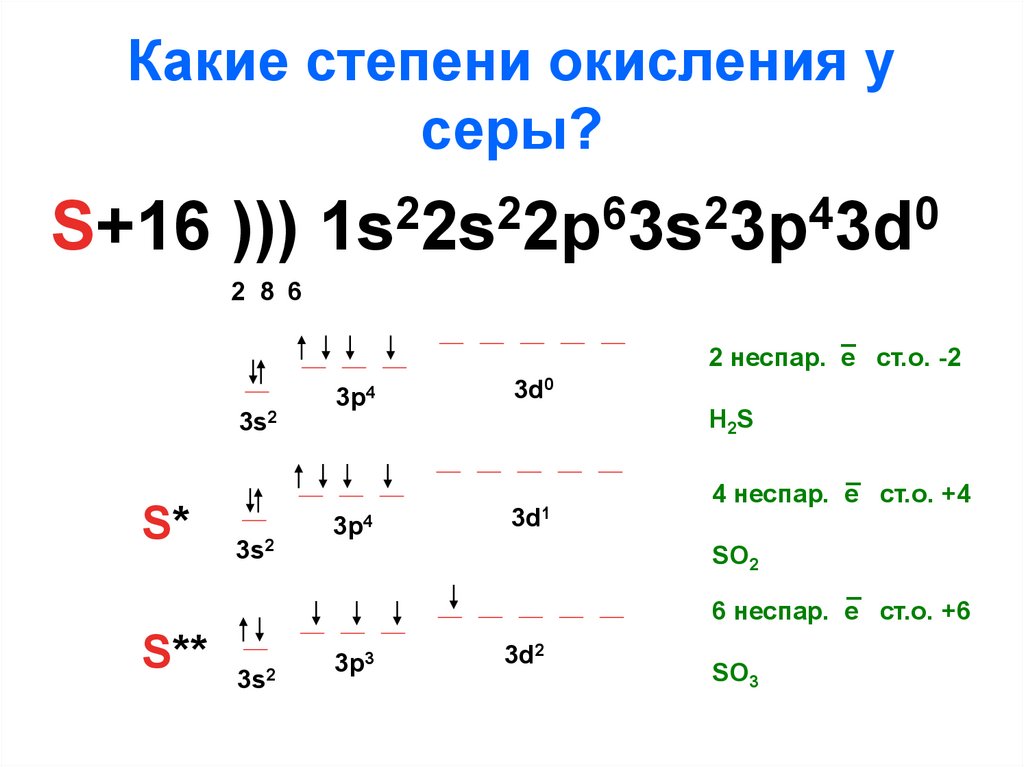












 Золото — Электроны на энергетический уровень
Золото — Электроны на энергетический уровень  По этому принципу электроны заполняются в следующем порядке: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p. …
По этому принципу электроны заполняются в следующем порядке: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p. … 7
7 пл. плотности $17,31 г/см3)
пл. плотности $17,31 г/см3) 0000142 /K
0000142 /K 85°C, 5172.53 °F)
85°C, 5172.53 °F) 0340 198Au
0340 198Au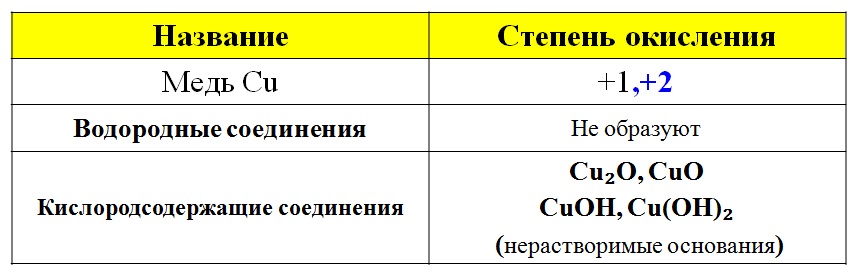
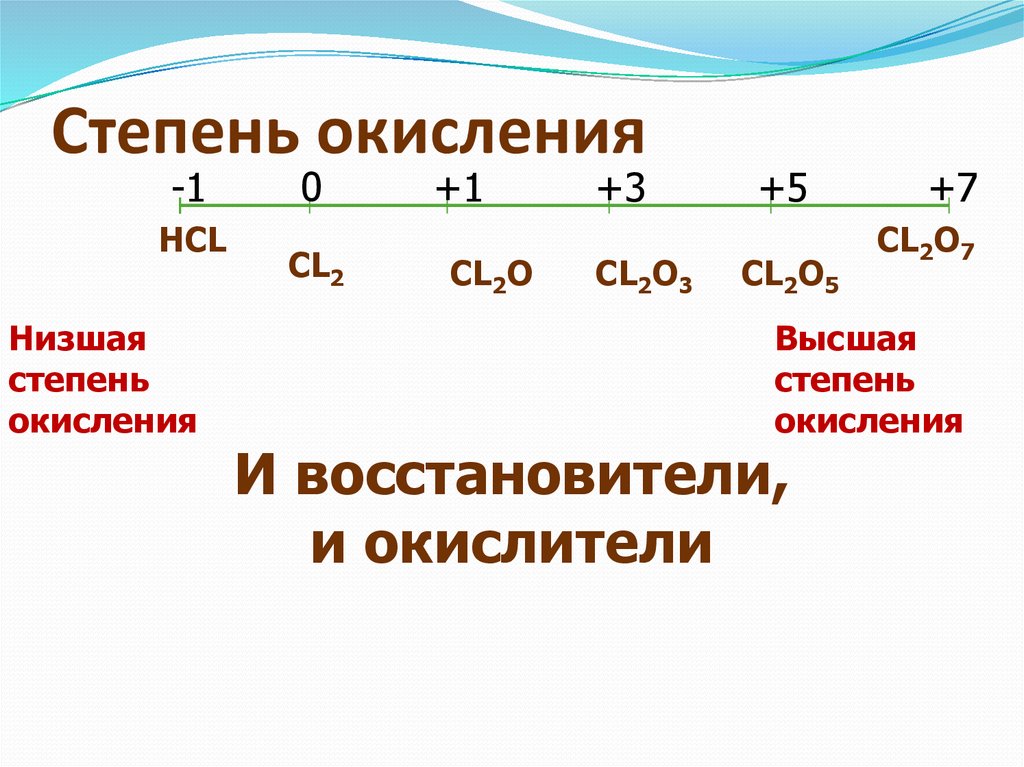 Соответствующее доказательство только что было представлено исследователями из Майнцского университета имени Иоганна Гутенберга (JGU) в недавней публикации.
Соответствующее доказательство только что было представлено исследователями из Майнцского университета имени Иоганна Гутенберга (JGU) в недавней публикации. В сочетании с ионами магния или железа в центре соответственно макроцикл порфирина присутствует в зеленом пигменте растений (хлорофилле) и в красном пигменте крови (геме). С золотом(+II) в центре порфирин блокирует нормальные пути реакции золота(+II), т. е. образование полиядерных соединений или превращение в более стабильные комплексы золота(+I) и золота(+III). «Это позволило впервые исследовать этот уникальный класс стабильных моноядерных комплексов золота(+II) и всесторонне описать их», — резюмировала профессор Катя Хайнце. Интересно, что расположение четырех атомов рядом с ионом золота (+II) не является квадратно-плоским с атомами, расположенными на одинаковом расстоянии от золота, как в случае соответствующих структур соседних с золотом элементов меди (+II), серебра (+II), платина(+II) и ртуть(+II). Вместо этого структура демонстрирует ромбическое искажение с двумя короткими и двумя длинными расстояниями. С технической точки зрения это ранее ненаблюдавшееся явление в случае ионов золота (+II) можно объяснить эффектом Яна-Теллера второго порядка, обусловленным релятивистскими свойствами золота.
В сочетании с ионами магния или железа в центре соответственно макроцикл порфирина присутствует в зеленом пигменте растений (хлорофилле) и в красном пигменте крови (геме). С золотом(+II) в центре порфирин блокирует нормальные пути реакции золота(+II), т. е. образование полиядерных соединений или превращение в более стабильные комплексы золота(+I) и золота(+III). «Это позволило впервые исследовать этот уникальный класс стабильных моноядерных комплексов золота(+II) и всесторонне описать их», — резюмировала профессор Катя Хайнце. Интересно, что расположение четырех атомов рядом с ионом золота (+II) не является квадратно-плоским с атомами, расположенными на одинаковом расстоянии от золота, как в случае соответствующих структур соседних с золотом элементов меди (+II), серебра (+II), платина(+II) и ртуть(+II). Вместо этого структура демонстрирует ромбическое искажение с двумя короткими и двумя длинными расстояниями. С технической точки зрения это ранее ненаблюдавшееся явление в случае ионов золота (+II) можно объяснить эффектом Яна-Теллера второго порядка, обусловленным релятивистскими свойствами золота.