СУНЦ УрФУ
Расписание
Электронный журнал
Поступающим
Олимпиады, турниры, конкурсы
Планы работы
Подготовительные курсы
Новости:
07.05.2023
Учимся и побеждаем!
Лицеисты заняли I и II места в Школе практического программирования.
06.05.2023
Поэзии чарующие звуки…
В СУНЦ стартует регистрация на поэтический вечер, который пройдёт 15 мая в 15:30 в актовом зале.
05.05.2023
Заключительный этап. Успех!
Наши лицеисты достойно выступили на заключительном этапе Всероссийской олимпиады школьников.
04.05.2023
Успехи на международном форуме в Кыргызстане
Лицеисты привезли из солнечного Кыргызстана золотую и бронзовую медали международного форума «Мы — интеллектуалы XXI века!».
04.05.2023
Зарядись «Энергией будущего»!
Лицеисты СУНЦ с успехом выступили на всероссийском конкурсе научно-исследовательских работ и проектов.
25.04.2023
Время зарабатывать!
Соцэки СУНЦ совершенствуют свои практические навыки.
Больше новостей
Видеогалерея:
Мужчины СУНЦ о 8 Марта (2023)
Концерт к 8 Марта (2023)
Поздравление с Днем защитника Отечества (2023)
Больше видео
О нас:
Специализированный учебно-научный центр (СУНЦ) — структурное подразделение ФГАОУ ВО «УрФУ имени первого Президента России Б.Н. Ельцина», созданное в 1990 году как нетиповое структурное подразделение вуза, осуществляющее углубленное дифференцированное обучение по программам основного общего и среднего общего образования. Всего в России 10 СУНЦев. До мая 2011 года СУНЦ работал в составе Уральского государственного университета имени А. М. Горького (УрГУ).

Иногородние обучающиеся проживают в уютном общежитии.
Прием производится в 8, 9, 10 и 11 классы. Работают подготовительные курсы.
Подробнее о правилах приема в СУНЦ можно узнать в отделе конкурсного отбора
по телефону +7 343 367-82-22 и в разделе нашего сайта «Поступающим».
Как нас найти:
Данилы Зверева ул., 30, Екатеринбург. N56°52´4˝ E60°39´16˝
Проезд:
- автобусами № 48, 52, 81 до остановки «Фирма Авангард»;
- автобусами № 28, 58 до остановки «Данилы Зверева», далее 7 минут пешком по улице Данилы Зверева;
- троллейбусом № 18 до остановки «Данилы Зверева», далее 14 минут пешком по улицам Сулимова, Данилы Зверева;
- троллейбусами № 4 до остановки «Сулимова», № 19, 32 до остановки «Боровая», далее 15 минут пешком по улицам Боровая, Вилонова, Данилы Зверева.
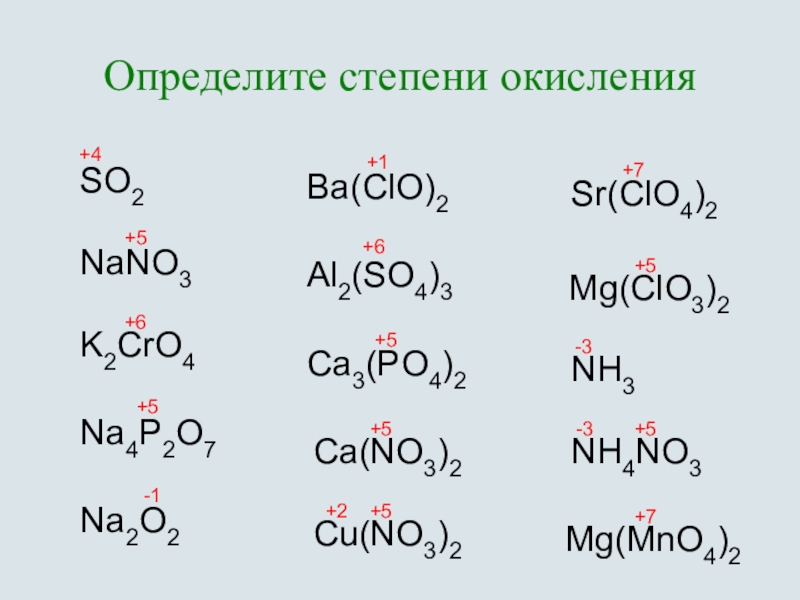
Ba(no3)2 определить степени окисления элементов в соединении определить его молекулярную массу и процентное содержание элементов — Школьные Знания.
 net
netВсе предметы
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Информатика
Українська література
Қазақ тiлi
Экономика
Музыка
Беларуская мова
Французский язык
Немецкий язык
Психология
Оʻzbek tili
Кыргыз тили
Астрономия
Физкультура и спорт
Ответ дан
svetka1574
Ответ:
Объяснение:
Ba(+2)N(+5)O(-2)
Mr(Ba(NO3)2 = 137 + 14*2 + 16*6=261
W(Ba) = Ar(Ba) *n / Mr(Ba(NO3)2) *100% = 137*1 / 261 *100% =52%
W(N) = Ar(N) *n / Mr(Ba(NO3)2) *100% = 14*2 / 261 *100% =11%
W(O) = Ar(O) *n / Mr(Ba(NO3)2) *100% = 16*6 / 261 *100% =37%
Формула нитрата бария – структура, свойства, использование, примеры вопросов
Барий – это элемент с атомным номером 56. Он обозначается буквой «Ba». Это пятый элемент группы II, который является щелочноземельным металлом. Барий в свободном состоянии в природе не встречается из-за его высокой реакционной способности. Барий является сильным основным оксидом, его степень окисления +1, +2.
Он обозначается буквой «Ba». Это пятый элемент группы II, который является щелочноземельным металлом. Барий в свободном состоянии в природе не встречается из-за его высокой реакционной способности. Барий является сильным основным оксидом, его степень окисления +1, +2.
Что такое азот?
Азот — это элемент с атомным номером 7. Он обозначается буквой «N». Это элемент 15 группы, который является неметаллом. Это самый легкий элемент группы. Азот является сильным кислотным оксидом, и его степень окисления равна -3, -2, -1, 0, +1, +2, +3, +4, +5.
Что такое кислород?
Кислород — это элемент с атомным номером 8. Он обозначается буквой «О». Это элемент группы халькогенов, высокореактивный неметалл. Кислород является сильным окислителем и имеет степень окисления -2, -1, 0, +1, +2.
Нитрат бария
Нитрат бария представляет собой неорганическое соединение, также известное как динитрат бария, нитробарит или даже соль бария. Соль бария обычно находится в кристаллическом состоянии белого цвета. Соединение является негорючим по своей природе. Но, при использовании в качестве окислителя, горит зеленым пламенем и может взорваться из-за длительного воздействия пламени.
Соль бария обычно находится в кристаллическом состоянии белого цвета. Соединение является негорючим по своей природе. Но, при использовании в качестве окислителя, горит зеленым пламенем и может взорваться из-за длительного воздействия пламени.
Молекулярная формула
Соединение нитрата бария образуется путем соединения двух частей нитрата и одной части бария. Следовательно, молекулярная формула нитрата бария дается как
Молекулярная формула нитрата бария = Ba(NO 3 ) 2
Структурная формула
Структурная формула соединения дает позиционная структура атомов в состав. Структура нитрата бария указана как
Свойства нитрата бария
- Его химическое название – нитрат бария.
- Молекулярная масса нитрата бария составляет 261,33 г/моль.
- Плотность 3,24 г/дм 3 .
- Температура плавления нитрата бария 592°C.
Процесс производства нитрата бария
Производство нитрата бария может осуществляться двумя различными способами. Процессы инициируются исходными компонентами бария.
Процессы инициируются исходными компонентами бария.
Процесс I
В первом процессе в качестве источника используется карбонат бария. Для производства нитрата бария следуют следующие этапы;
- Шаг I: Сначала растворите карбонат бария (BaCO 3 ) в азотной кислоте (HNO 3 ).
- Стадия II: Осаждение примесей железа.
- Стадия III: Отделить примеси железа путем фильтрации.
- Стадия IV: Выпаривание избытка растворителя.
- Этап V: Кристаллизация нитрата бария.
Процесс II
Во втором процессе в качестве источника используется сульфид бария. Для производства нитрата бария сульфид бария (BaS) смешивают с азотной кислотой (HNO 3 ).
А при высоких температурах нитрат бария разлагается на оксид бария, нитрит и кислород.
2Ba(NO 3 ) 2 => 2BaO + 2NO 2 + O 2
Использование нитрата бария
- Нитрат бария широко используется в пиротехнике.

- Используется в качестве окислителя, пропеллента и вспенивателя.
- Используется в родентицидах.
- Используется во взрывчатых веществах.
- Используется в детонаторах.
- Используется в производстве красок.
- Соединение используется для изготовления керамической глазури.
- Он также используется в качестве компонента некоторых взрывчатых веществ.
- Также используется в трассирующих пулях.
Примеры вопросов
Вопрос 1. Каков показатель преломления нитрата бария?
Ответ:
Показатель преломления нитрата бария равен 1,565.
Вопрос 2. Какая реакция протекает при разложении нитрата бария?
Ответ:
Когда допускается высокая температура на нитрате бария (Ba(NO 3 ) 2 ), он разлагается на оксид бария, нитрит и кислород.
2Ba(NO 3 ) 2 => 2BaO + 4NO 2 + O 2
Вопрос 3. Каково влияние бара нитрата иума на здоровье человека?
Каково влияние бара нитрата иума на здоровье человека?
Ответ:
Нитрат бария влияет на здоровье человека:
- При контакте может вызвать раздражение кожи или глаз.
- При случайном проглатывании может вызвать рвоту, диарею, повышение артериального давления.
- Нитрат бария может вызывать кровотечения в кишечнике, желудке, почках и т. д.
Вопрос 4. Назовите взрывчатое вещество, в котором используется нитрат бария.
Ответ:
Нитрат бария используется в заряде взрывчатого вещества «SR 365».
Вопрос 5. Перечислите стадии производства нитрата бария.
Ответ:
Этапы производства нитрата бария:
- Растворить карбонат бария в азотной кислоте.
- Осаждение примесей железа
- Фильтрация
- Испарение
- Кристаллизация
Вопрос 6. Что произойдет, если азотнокислый барий длительное время подвергать воздействию пламени?
Что произойдет, если азотнокислый барий длительное время подвергать воздействию пламени?
Ответ:
Нитрат бария является негорючим веществом, но способствует процессу горения горючих веществ. Следовательно, нитрат бария может привести к взрыву при длительном воздействии пламени.
Вопрос 7. Что такое катионы и анионы нитрата бария?
Ответ:
Нитрат бария состоит из катионов бария Ba 2+ и нитрат-анионов NO 3- .
Ответ: Определите Ksp для Ba(NO3)2. Что такое…
Химия: молекулярная наука5-е издание
ISBN: 9781285199047
Автор: Джон В. Мур, Конрад Л. Станицки
Издатель: Cengage Learning
1 Природа химии. Химия растворенных веществ и растворов14 Кислоты и основания15 Дополнительные водные равновесия16 Термодинамика: направленность химических реакций17 Электрохимия и ее приложения18 Ядерная химия19Химия элементов главной группы20 Химия некоторых переходных элементов и координационных соединений expand_more
20. 1 Свойства переходных (d-блочных) элементов20.2 Железо и сталь: пирометаллургия20.3 Медь: металл для чеканки20.4 Серебро и Золото: другие металлы для чеканки 20.5 Хром 20.6 Координатные ковалентные связи: комплексные ионы и координационные соединения 20.7 Теория кристаллического поля: цвет и магнетизм в координационных соединениях Вопросы к главе expand_more
1 Свойства переходных (d-блочных) элементов20.2 Железо и сталь: пирометаллургия20.3 Медь: металл для чеканки20.4 Серебро и Золото: другие металлы для чеканки 20.5 Хром 20.6 Координатные ковалентные связи: комплексные ионы и координационные соединения 20.7 Теория кристаллического поля: цвет и магнетизм в координационных соединениях Вопросы к главе expand_more
Проблема 1QRTПроблема 2QRTПроблема 3QRTПроблема 4QRTПроблема 5QRTПроблема 6QRTПроблема 7QRTПроблема 8QRTПроблема 9QRTПроблема 10QRTПроблема 11QRTПроблема 12QRTПроблема 13QRTПроблема 14QRTПроблема 15QRTProblem 16QRT: Какие ионы переходных металлов периода 4 изоэлектронны с (a) Zn2+ (b) Mn2+ (c) Cr3+ (d) Fe3+Problem 17QRTProblem 18QRTProblem 19QRTProblem 20QRTProblem 21QRTProblem 22QRTProblem 23QRTProblem 24QRTProblem 25QRTProblem 26QRTProblem 27QRTProblem 28QRTProblem 29QRTProblem 30QRTProblem 31QRTProblem 32QRTProblem 3 3QRTПроблема 34QRTПроблема 35QRTПроблема 36QRTПроблема 37QRTПроблема 38QRTПроблема 39QRTProblem 40QRTProblem 41QRTProblem 42QRTProblem 43QRTProblem 44QRTProblem 45QRTProblem 46QRTProblem 47QRTProblem 48QRTProblem 49QRTProblem 50QRTProblem 51QRTProblem 52QRTProblem 53QRT: Подать заряд на центральный металл ион в каждом из них.


