Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
youtube.com/embed/4sKc0lcxi7g» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/zW5JhiZ4140″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
2.2.1 Бинарные соединения водорода
Соединения элементов с водородом, весьма разнообразны по своим физическим и химическим свойствам.
Водородистые соединения щелочных и щелочно-земельных металлов – NaH, KH, CaH2, BaH2 – солеподобные вещества, в которых степень окисления водорода составляет (–1). При действии воды эти вещества разлагаются с выделением водорода:
NaH + H2O H2 + NaOH.
Системетические названия солеподобных гидридов образуются по общим правилам, например:
NaH – гидрид натрия, CaH2 – гидрид кальция
Соединения
с водородом элементов главных подгрупп
IV
– VII
групп Периодической системы представляют
собой легко летучие жидкости и газы. Степень окисления водорода в них (+1).
Соединения, в которых элемент имеет
электроотрицательность близкую
электроотрицательности водорода (CH 4,
SiH4,
GeH4,
SnH4,
PH3,
AsH3,
SbH3 и др.) практически мало растворимы в
воде и их водные растворы не обладают
ни кислотными, ни основными свойствами.
Соединения, в которых электроотрицательность
элементов больше электро-отрицательности
водорода (HF, HCl, HBr, HI, H2S,
H2Se,
H2Te,
NH3),
хорошо растворяются в воде. Для всех
соединений водорода(+1) используются традиционные
названия:
Степень окисления водорода в них (+1).
Соединения, в которых элемент имеет
электроотрицательность близкую
электроотрицательности водорода (CH 4,
SiH4,
GeH4,
SnH4,
PH3,
AsH3,
SbH3 и др.) практически мало растворимы в
воде и их водные растворы не обладают
ни кислотными, ни основными свойствами.
Соединения, в которых электроотрицательность
элементов больше электро-отрицательности
водорода (HF, HCl, HBr, HI, H2S,
H2Se,
H2Te,
NH3),
хорошо растворяются в воде. Для всех
соединений водорода(+1) используются традиционные
названия:
CH4 – метан, SiH4 – силан, GeH4 – герман
NH3 – аммиак, РН3 – фосфин, AsH3 – арсин, SbH3 – стибин
Н2О – вода, H2S – сероводород, H2Se – селеноводород
HF – фтороводород, HCl – хлороводород,
HBr – бромоводород, HI – иодоводород
Водные растворы HF, HCl, HBr, HI, H2S, H2Se, H2Te являются кислотами, поэтому их называют добавляя слово «кислота» к традиционному названию вещества, например:
HF – фтороводородная кислота,
HCl – хлороводородная кислота,
H2Se – селеноводородная кислота
Следует
отметить, что для растворов HF и HCl в
основном используют исторические
названия – «плавиковая кислота» и
«соляная кислота» соответственно.
С переходными металлами (d-элементами) водород образует нестехиометрические соединения, свойства которых в этом издании не рассматриваются.
Оксидами называют бинарные соединения кислорода, в которых кислород проявляет степень окисления (–2).
Написание эмпирических формул и название оксидов выполняется по правилам номенклатуры бинарных соединений, например:
СО – монооксид углерода или оксид углерода(+2),
Ag2O – оксид серебра(+1),
SO2 – диоксид серы или оксид серы(+4),
СаО – оксид кальция
RuO4 – тетраоксид рутения или оксид рутения(+8),
В2О3 – оксид бора
Рассмотрим
изображение графических формул. В
графических формулах отражается не
только качественный и количественный
состав соединения, но и порядок соединения
атомов в соединении, а также число
химических связей между атомами. Для
определения числа химических связей
необходимо знать валентность элемента.
Для
определения числа химических связей
необходимо знать валентность элемента.
Под валентностью элемента понимают число электронных пар, которые соединяют атом элемента с другими атомами. В графических формулах связывающую электронную пару обозначают валентным штрихом « –– » . Валентность элемента в соединении в большинстве случаев совпадает с численным значением степени окисления элемента. Поэтому степень окисления элемента помогает при изображении графических формул. Так как в оксидах кислород имеет степень окисления (–2), то его валентность равна 2, при этом атом кислорода с другими атомами может образовывать двойные и одинарные связи. В последнем случае атом кислорода выполняет роль мостика между атомами другого элемента (Э–О–Э).
Примеры графических формул оксида свинца(+4) и оксида мышьяка(+3):
PbO2 Pb+4O2–2 O=Pb=O
As2O3 As2+3O3–2 O=As–O–As=O
Следует
помнить, что в оксидах атомы кислорода
не бывают связаны друг с другом, а атомы
второго элемента, как правило, связаны
через кислородный мостик.
По своим химическим свойствам оксиды подразделяются на две группы – солеобразующие и несолеобразующие. Несолеобразующих оксидов немного – это СО, SiO, N2O и NO. Подавляющее большинство оксидов относятся к группе солеобразующих. Солеобразующие оксиды по характеру реакций солеобразования подразделяют на основные оксиды, кислотные оксиды и амфотерные оксиды.
Основными называются оксиды, способные вступать в реакции солеобразования с кислотными оксидами и кислотами.
Пример
Основной характер оксида кальция проявляется в реакциях
CaO
+ CO
CaO + H2SO4 CaSO4 + H2O.
Кислотными называются оксиды, способные вступать в реакции солеобразования
с основными оксидами и основаниями.
Пример
Кислотный характер оксида серы(+6) проявляется в реакциях.
SO3 + MgO MgSO4
SO3 + 2NaOH Na2SO4 + H2O.
Амфотерные оксиды проявляют свойства и основных и кислотных оксидов, т.е. вступают в реакции солеобразования с кислотными и основными оксидами, а также с кислотами и основаниями.
Пример
Амфотерный оксид цинка взаимодействует с кислотными оксидами и кислотами:
ZnO + SO3 ZnSO4
ZnO + 2HNO3 Zn(NO3)2 + H2O,
а также с основными оксидами и со щелочами:
ZnO + CaO CaZnO2
ZnO + 2NaOH расплав Na2ZnO2 + H2O
ZnO
+ 2NaOH раствор +
H2O
Na2[Zn(OH)4].
Некоторые основные и кислотные оксиды могут взаимодействовать с водой, например:
CaO + H2O Ca(OH)2
SO3 + H2O H2SO4.
Характер оксидов большинства элементов можно определить, руководствуясь следующими правилами:
Элементы-неметаллы образуют только кислотные оксиды.
Элементы-неметаллы располагаются в Периодической системе в главных подгруппах на диагонали B–Si–As–Te–At и правее её. Таким образом, к неметаллам относят 22 элемента. Остальные элементы относят к металлам.
Элементы-металлы в высоких степенях окисления (+8, +7, +6, +5) образуют только кислотные оксиды.
Металлы в степени окисления (+1) образуют только основные оксиды.
Оксиды металлов в степенях окисления (+2) и (+3) могут быть основными и амфотерными, а в степени окисления (+4) – амфотерными и кислотными.

С уменьшением степени окисления металла от высшей к низшей характер его оксидов изменяется от кислотного к основному.
Пример
Марганец в соединениях с кислородом проявляет степени окисления от +2 до +7. Очевидно, что оксид марганца(+7) кислотный, у оксида марганца(+2) преобладает основной характер, оксид марганца(+4) – амфотерный.
Степень окисления | Формула оксида | Характер оксида |
+7 | Mn2O7 | кислотный |
+4 | MnO2 | амфотерный |
+2 | MnO | основной |
Применение
указанных правил для определения
характера оксидов МО2,
М2О3 и МО существенно облегчается, если
известны амфотерные оксиды элемента. Для запоминания амфотерных оксидов
полезна следующая информация.
Для запоминания амфотерных оксидов
полезна следующая информация.
Элементы главных подгрупп расположенные в Периодической системе на ломаной линии Be–Al–Ge–Sn–Pb имеют оксиды только амфотерного характера. Элементы расположенные рядом с этой линией – Ga, In и As, Sb имеют амфотерные оксиды – Ga2O3, In2O3 и As2O3, Sb2O3. У оксида As2O3 ярко выражены кислотные свойства и очень слабо основные свойства.
Для элементов побочных подгрупп необходимо запомнить следующие амфотерные оксиды:
CuO Au2O3 ZnO CdO Cr2O3 MnO2.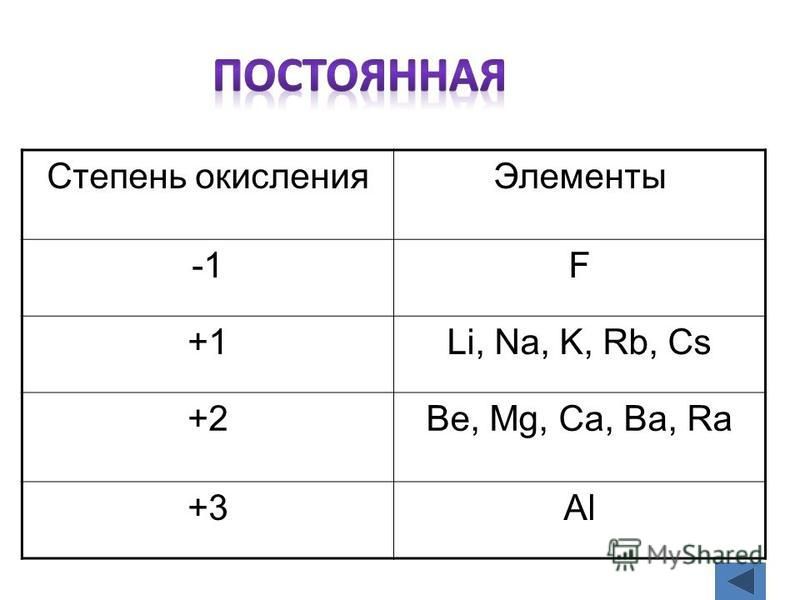
У некоторых элементов существуют смешанные оксиды, в которых атомы элемента находятся в двух степенях окисления, например, Fe3O4 (Fe+2,+3), Pb3O4, Pb2O3 (Pb+2,+4) и др.. Среди кислотных оксидов следует отметить смешанные ангидриды. В последних элемент имеет неустойчивую степень окисления, поэтому реакции солеобразования сопровождаются окислительно-восстановительными превращениями с образованием двух солей, в которых элемент приобретает ближайшие устойчивые степени окисления, например:
2N+4O2 + 2KOH KN+3O2 + KN+5O3 + H2O
2Cl+6O3 + 2KOH KCl+5O3 + KCl+7O4 + H2O.
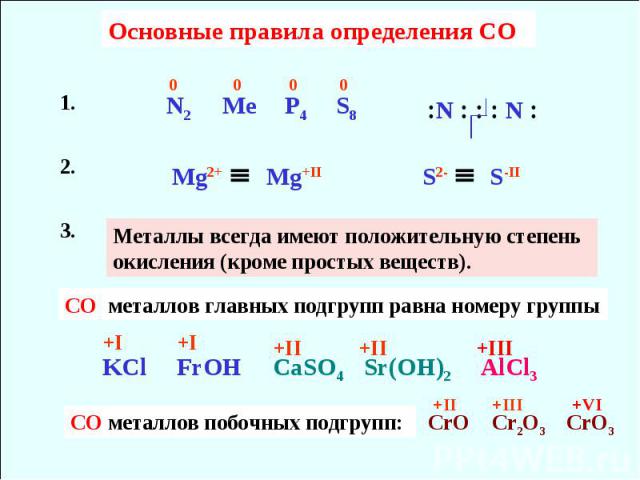
Степени окисления элементов в соединениях. Как расставлять и как определить степень окисления элементов.
 Что делать, если неизвестны степени окисления двух элементов
Что делать, если неизвестны степени окисления двух элементовЗнания и умения определять степень окисления элементов в молекулах позволяют решать очень сложные уравнения реакций и соответственно правильно рассчитывать количества отбираемых веществ для реакций, опытов и в технологических процессах. Степень окисления — одно из важнейших, ключевых понятий в химии. Данная таблица помогает в определении степени окисления элементов, также указаны исключения из правила, приведен алгоритм выполнения заданий такого типа
Скачать:
Предварительный просмотр:
ПРАВИЛА ОПРЕДЕЛЕНИЯ СТЕПЕНИ ОКИСЛЕНИЯ. |
Правило № 1 | Правило № 2 | Правило № 3 | Правило № 4 | Правило № 5 | Правило № 6 | Правило № 7 | Правило № 8 |
Изолированные атомы химических элементов имеют степень окисления 0. | Простые вещества имеют степень окисления 0. | Водород имеет Степень окисления, | Кислород имеет степень окисления, -2. | Фтор в соединениях имеет степень окисления, равную -1. | Щелочные металлы (гл. подгруппа I группа) имеют степень окисления, +1 | Щелочно-земельные металлы (гл. подгруппа II группа, Са-Ra) и Mg имеют степень окисления +2. | Алюминий имеет в соединениях степень окисления +3. |
Примеры. | Примеры. | Примеры. | Примеры. | Примеры. | Примеры. | Примеры. | Примеры. |
H 2 O | Na 2 S | CaF 2 | Al 2 O 3 | ||||
H 3 N | Cr 2 O 3 | CaF 2 | K 2 O | Al(OH) 3 | |||
H 2 Se | SeO 2 | SiF 4 | LiOH | Ba(OH) 2 | Al 2 S 3 | ||
Cl 2 | H 3 AsO 4 | Rb 2 O | ClF 3 | NaOH | |||
Сa(OH) 2 | RbOH | ||||||
NaH 2 PO 4 | HPO 3 | ||||||
Be(OH) 2 =H 2 BeO 2 | Al(OH) 3 =H 3 AlO 3 | ||||||
CН 4 | Li 2 SO 3 | ||||||
Ca(HSO 4 ) 2 | |||||||
Исключения. | Исключе ния. | Исключения. | Исключения. | Исключения. | Исключения. | Исключения. | Исключения. |
Гидриды металлов: | OF 2- фторид кислорода | ||||||
1 -1 MeH (KH) | Н 2 О 2 — пероксид водорода | ||||||
2 -1 MeH 2 (BaH 2 ) | 1 -1 Me 2 O 2 (Na 2 O 2 ) — пероксиды щелочных металлов | ||||||
3 -1 MeH 3 (AlH 3 ) | 1 -1 MeO 2 (CaO 2, BaO 2 ) — пероксиды щелочноземельных металлов | ||||||
Выводы
: высшая положительная степень окисления большинства элементов численно равна номеру группы таблицы элементов, в которой он находится. Низшая отрицательная степень окисления элемента-неметалла определяется числом электронов, которых недостает для заполнения валентного слоя
Низшая отрицательная степень окисления элемента-неметалла определяется числом электронов, которых недостает для заполнения валентного слоя
Находим, какой из двух элементов в соединении является более электроотрицательным. | Определяем числовое значение степени окисления для более электроотрицательного элемента. (См. правила) | Определяем общее число отрицательных зарядов в соединении. | Находим степень окисления менее электроотрицательного элемента. |
Над символом более электроотрицательного элемента ставим знак «минус» (-). | Для этого общее число положительных зарядов делим на индекс у данного элемента. | ||
Над символом менее электроотрицательного элемента ставим знак «плюс» (+). | Для этого степень окисления более электроотрицательного элемента умножаем на его индекс. | Помним, что алгебраическая сумма степеней окисления химических элементов в соединении должна быть равна =0. |
Закрепление: определите степени окисления элементов в заданных формулах бинарных соединений . SiF 4 , P 2 O 5 , As 2 O 5 , CaH 2 , Li 3 N, OsF 8 , SiCl 4 , H 3 P, SCl 4 , PCL 3 , H 4 C, H 3 As, SF 6 , AlN, CuO, Fe
Во многих школьных учебниках и пособиях учат составлять формулы по валентностям, даже для соединений с ионными связями. Для упрощения процедуры составления формул это, на наш взгляд, допустимо. Но нужно понимать, что это не совсем корректно ввиду вышеизложенной причины.
Более универсальным понятием является понятие о степени окисления. По значениям степеней окисления атомов так же как и по значениям валентности можно составлять химические формулы и записывать формульные единицы.
По значениям степеней окисления атомов так же как и по значениям валентности можно составлять химические формулы и записывать формульные единицы.
Степень окисления — это условный заряд атома в частице (молекуле, ионе, радикале), вычисленный в приближении того, что все связи в частице являются ионными.
Прежде чем определять степени окисления, необходимо сравнить электроотрицательности связуемых атомов. Атом с большим значением электроотрицательности имеет отрицательную степень окисления, а с меньшим положительную.
С целью объективного сравнения значений электроотрицательности атомов при расчёте степеней окисления, в 2013 году IUPAC дал рекомендацию использовать шкалу Аллена.
* Так, например, по шкале Аллена электроотрицательность азота 3,066, а хлора 2,869.
Проиллюстрируем данное выше определение на примерах. Составим структурную формулу молекулы воды.
Ковалентные полярные связи O-H обозначены синим цветом.
Представим, что обе связи являются не ковалентными, а ионными. Если бы они были ионными, то с каждого атома водорода на более электроотрицательный атом кислорода перешло бы по одному электрону. Обозначим эти переходы синими стрелками.
Если бы они были ионными, то с каждого атома водорода на более электроотрицательный атом кислорода перешло бы по одному электрону. Обозначим эти переходы синими стрелками.
*В этом примере, стрелка служит для наглядной иллюстрации полного перехода электронов, а не для иллюстрации индуктивного эффекта.
Легко заметить, что число стрелок показывает количество перешедших электронов, а их направление — направление перехода электронов.
На атом кислорода направлено две стрелки, это значит, что к атому кислорода переходит два электрона: 0 + (-2) = -2. На атоме кислорода образуется заряд равный -2. Это и есть степень окисления кислорода в молекуле воды.
С каждого атома водорода уходит по одному электрону: 0 — (-1) = +1. Значит, атомы водорода имеют степень окисления равную +1.
Сумма степеней окисления всегда равняется общему заряду частицы.
Например, сумма степеней окисления в молекуле воды равна: +1(2) + (-2) = 0. Молекула — электронейтральная частица.
Если мы вычисляем степени окисления в ионе, то сумма степеней окисления, соответственно, равна его заряду.
Значение степени окисления принято указывать в верхнем правом углу от символа элемента. Причём, знак пишут впереди числа . Если знак стоит после числа — то это заряд иона.
Например, S -2 — атом серы в степени окисления -2, S 2- — анион серы с зарядом -2.
S +6 O -2 4 2- — значения степеней окисления атомов в сульфат-анионе (заряд иона выделен зелёным цветом).
Теперь рассмотрим случай, когда соединение имеет смешанные связи: Na 2 SO 4 . Связь между сульфат-анионом и катионами натрия — ионная, связи между атомом серы и атомами кислорода в сульфат-ионе — ковалентные полярные. Запишем графическую формулу сульфата натрия, а стрелками укажем направление перехода электронов.
*Структурная формула отображает порядок ковалентных связей в частице (молекуле, ионе, радикале). Структурные формулы применяют только для частиц с ковалентными связями. Для частиц с ионными связями понятие структурной формулы не имеет смысла. Если в частице имеются ионные связи, то применяют графическую формулу.
Для частиц с ионными связями понятие структурной формулы не имеет смысла. Если в частице имеются ионные связи, то применяют графическую формулу.
Видим, что от центрального атома серы уходит шесть электронов, значит степень окисления серы 0 — (-6) = +6.
Концевые атомы кислорода принимают по два электрона, значит их степени окисления 0 + (-2) = -2
Мостиковые атомы кислорода принимают по два электрона, их степень окисления равна -2.
Определить степени окисления возможно и по структурно-графической формуле, где черточками указывают ковалентные связи, а у ионов указывают заряд.
В этой формуле мостиковые атомы кислорода уже имеют единичные отрицательные заряды и к ним дополнительно приходит по электрону от атома серы -1 + (-1) = -2, значит их степени окисления равны -2.
Степень окисления ионов натрия равна их заряду, а т.е. +1.
Определим степени окисления элементов в надпероксиде (супероксиде) калия. Для этого составим графическую формулу супероксида калия, стрелочкой покажем перераспределение электронов. Связь O-O является ковалентной неполярной, поэтому в ней перераспределение электронов не указывается.
Для этого составим графическую формулу супероксида калия, стрелочкой покажем перераспределение электронов. Связь O-O является ковалентной неполярной, поэтому в ней перераспределение электронов не указывается.
* Надпероксид-анион является ион-радикалом. Формальный заряд одного атома кислорода равен -1, а другого, с неспаренным электроном, 0.
Видим, что степень окисления калия равна +1. Степень окисления атома кислорода, записанного в формуле напротив калия, равна -1. Степень окисления второго атома кислорода равна 0.
Точно также можно определить степени окисления и по структурно-графической формуле.
В кружочках указаны формальные заряды иона калия и одного из атомов кислорода. При этом значения формальных зарядов совпадают со значениями степеней окисления.
Так как оба атома кислорода в надпероксид-анионе имеют разные значения степени окисления, то можно вычислить средне-арифметическую степень окисления кислорода.
Она будет равна / 2 = — 1/2 = -0,5.
Значения среднеарифметических степеней окисления обычно указывают в брутто-формулах или формульных единицах, чтобы показать что сумма степеней окисления равна общему заряду системы.
Для случая с надпероксидом: +1 + 2(-0,5) = 0
Легко определить степени окисления используя электронно-точечные формулы, в которых указывают точками неподеленные электронные пары и электроны ковалентных связей.
Кислород — элемент VIА — группы, следовательно в его атоме 6 валентных электронов. Представим, что в молекуле воды связи ионные, в этом случае атом кислорода получил бы октет электронов.
Степень окисления кислорода соответственно равна: 6 — 8 = -2.
А атомов водорода: 1 — 0 = +1
Умение определять степени окисления по графическим формулам бесценно для понимания сущности этого понятия, так же это умение потребуется в курсе органической химии. Если же мы имеем дело с неорганическими веществами, то необходимо уметь определять степени окисления по молекулярным формулам и формульным единицам.
Для этого прежде всего нужно понять, что степени окисления бывают постоянными и переменными. Элементы, проявляющие постоянную степень окисления необходимо запомнить.
Любой химический элемент характеризуется высшей и низшей степенями окисления.
Низшая степень окисления — это заряд, который приобретает атом в результате приёма максимального количества электронов на внешний электронный слой.
Ввиду этого, низшая степень окисления имеет отрицательное значение, за исключением металлов, атомы которых электроны никогда не принимают ввиду низких значений электроотрицательности. Металлы имеют низшую степень окисления равную 0.
Большинство неметаллов главных подгрупп старается заполнить свой внешний электронный слой до восьми электронов, после этого атом приобретает устойчивую конфигурацию (правило октета ). Поэтому, чтобы определить низшую степень окисления, необходимо понять сколько атому не хватает валентных электронов до октета.
Например, азот — элемент VА группы, это значит, что в атоме азота пять валентных электронов. До октета атому азота не хватает трёх электронов. Значит низшая степень окисления азота равна: 0 + (-3) = -3
В химических процессах главную роль играют атомы и молекулы, свойства которых определяют исход химических реакций. Одной из важных характеристик атома является окислительное число, которое упрощает метод учета переноса электронов в частице. Как определить степень окисления или формальный заряд частицы и какие правила необходимо знать для этого?
Определение
Любая химическая реакция обусловлена взаимодействием атомов различных веществ. От характеристик мельчайших частиц зависит процесс реакции и ее результат.
Термин окисление (оксидация) в химии означает реакцию, в ходе которой группа атомов или один из них теряют электроны или приобретают, в случае приобретения реакцию называют «восстановлением».
Степень окисления – это величина, которая измеряется количественно и характеризует перераспределяемые электроны в ходе реакции
. Т.е. в процессе оксидации электроны в атоме уменьшаются или увеличиваются, перераспределяясь между другими взаимодействующими частицами, и уровень оксидации показывает, как именно они реорганизуются. Данное понятие тесно связано с электроотрицательностью частиц – их умением притягивать и отталкивать от себя свободные ионы.
Т.е. в процессе оксидации электроны в атоме уменьшаются или увеличиваются, перераспределяясь между другими взаимодействующими частицами, и уровень оксидации показывает, как именно они реорганизуются. Данное понятие тесно связано с электроотрицательностью частиц – их умением притягивать и отталкивать от себя свободные ионы.
Определение уровня оксидации зависит от характеристик и свойств конкретного вещества, поэтому нельзя однозначно назвать процедуру вычисления легкой или сложной, но ее результаты помогают условно записать процессы окислительно-восстановительных реакций. Следует понимать, что полученный результат вычислений является результатом учета переноса электронов и не имеет физического смысла, а также не является истинным зарядом ядра.
Важно знать ! Неорганическая химия часто использует термин валентности вместо степени окисления элементов, это не является ошибкой, но следует учитывать, что второе понятие более универсальное.
Понятия и правила вычислений движения электронов являются основой для классификации химических веществ (номенклатура), описания их свойств и составления формул связи. Но наиболее часто данное понятие используется для описания и работы с окислительно-восстановительными реакциями.
Но наиболее часто данное понятие используется для описания и работы с окислительно-восстановительными реакциями.
Правила определения степени окисления
Как узнать степень окисления? При работе с окислительно-восстановительными реакциями важно знать, что формальный заряд частицы всегда будет равен величине электрона, выраженного в числовом значении. Эта особенность связана с тем предположением, что электронные пары, образующие связь, всегда полностью смещаются в сторону более отрицательных частиц. Следует понимать, что речь идет об ионных связях, а в случае реакции при электроны будут делиться поровну между одинаковыми частицами.
Окислительное число может иметь как положительные, так и отрицательные значения. Все дело в том, что в процессе реакции атом должен стать нейтральным, а для этого нужно либо присоединить к иону некое количество электронов, если он положительный, либо отнять их, если он отрицательный. Для обозначения данного понятия при записи формулы обычно прописывают над обозначением элемента арабскую цифру с соответствующим знаком. Например, или и т.д.
Например, или и т.д.
Следует знать, что формальный заряд металлов всегда будет положительным, а в большинстве случаев, чтобы определить его, можно воспользоваться таблицей Менделеева. Существует ряд особенностей, которые необходимо учитывать, чтобы определять показатели правильно.
Степень оксидации:
Запомнив эти особенности, достаточно просто будет определять окислительное число у элементов, независимо от сложности и количества уровней атомов.
Полезное видео: определение степени окисления
Периодическая таблица Менделеева содержит почти всю необходимую информацию для работы с химическими элементами. Например, школьники используют только ее для описания химических реакций. Так, чтобы определить максимальные положительные и отрицательные значения окислительного числа необходимо свериться с обозначением химического элемента в таблице:
- Максимально положительное – это номер группы, в которой находится элемент.
- Максимально отрицательная степень окисления – это разница между максимально положительной границей и числом 8.

Таким образом, достаточно просто узнать крайние границы формального заряда того или иного элемента. Такое действие можно совершить с помощью вычислений на основе таблицы Менделеева.
Важно знать ! У одного элемента могут быть одновременно несколько различных показателей оксидации.
Различают два основных способа определения уровня оксидации, примеры которых представлены ниже. Первый из них – это способ, который требует знаний и умений применять законы химии. Как расставлять степени окисления с помощью этого способа?
Правило определения степеней окисления
Для этого необходимо:
- Определить, является ли данное вещество элементарным и находится ли оно вне связи. Если да, то его окислительное число будет равно 0, независимо от состава вещества (отдельные атомы или многоуровневые атомные соединения).
- Определить, состоит ли рассматриваемое вещество из ионов. Если да, то степень оксидации будет равна их заряду.

- Если рассматриваемое вещество металл, то посмотреть на показатели других веществ в формуле и вычислить показания металла путем арифметических действий.
- Если все соединение имеет один заряд (по сути это сумма всех частиц представленных элементов), то достаточно определить показатели простых веществ, затем вычесть их от общей суммы и получить данные металла.
- Если связь нейтральная, то общая сумма должна быть равна нулю.
Для примера можно рассмотреть объединение с ионом алюминия, чей общий заряд равен нулю. Правила химии подтверждают тот факт, что ион Cl имеет окислительное число -1, а в данном случае их три в соединении. Значит ион Al должен быть равен +3, чтобы все соединение было нейтральным.
Этот способ весьма хорош, поскольку правильность решения всегда можно проверить, если сложить все уровни оксидации вместе.
Второй метод можно применять без знания химических законов:
- Найти данные частиц, по отношению к которым нет строгих правил и точное количество их электронов неизвестно (можно путем исключения).

- Выяснить показатели всех прочих частиц и после из общей суммы путем вычитания найти нужную частицу.
Рассмотрим второй метод на примере вещества Na2SO4, в котором не определен атом серы S, известно лишь, что он отличен от нуля.
Чтобы найти, чему равны все степени окисления необходимо:
- Найти известные элементы, помня о традиционных правилах и исключениях.
- Ион Na = +1, а каждый кислород = -2.
- Умножить количество частиц каждого вещества на их электроны и получить степени оксидации всех атомов, кроме одного.
- В Na2SO4 состоят 2 натрия и 4 кислорода, при умножении получается: 2 X +1 = 2 – это окислительное число всех частиц натрия и 4 X -2 = -8 – кислородов.
- Сложить полученные результаты 2+(-8) =-6 – это общий заряд соединения без частицы серы.
- Представить химическую запись в виде уравнения: сумма известных данных + неизвестное число = общий заряд.
- Na2SO4 представлено следующим образом: -6 + S = 0, S = 0 + 6, S = 6.

Таким образом, чтобы использовать второй метод, достаточно знать простые законы арифметики.
Цель: Продолжить изучение валентности. Дать понятие степени окисления. Рассмотреть виды степеней окисления: положительная, отрицательная, нулевой значение. Научиться правильно, определять степени окисления атома в соединении. Научить приемам сравнения и обобщения изучаемых понятий; отработать умения и навыки в определении степени окисления по химическим формулам; продолжить развитие навыков самостоятельной работы; способствовать развитию логического мышления. Формировать чувство толерантности (терпимости и уважения к чужому мнению) взаимопомощи; осуществлять эстетическое воспитание (через оформление доски и тетрадей, при применении презентаций).
Ход урока
I . Организационный момент
Проверка учащихся к уроку.
II . Подготовка к уроку.
К уроку понадобятся: Периодическая система Д.И.Менделеева, учебник, рабочие тетради, ручки, карандаши.
III . Проверка домашнего задания .
Фронтальный опрос, некоторые будут работать у доски по карточкам, проведение теста, и подведением данного этапа будет интеллектуальная игра.
1. Работа с карточками.
1 карточка
Определить массовые доли (%) углерода и кислорода в углекислом газе (СО 2 ) .
2 карточка
Определить тип связи в молекуле Н 2 S. Написать структурную и электронную формулы молекулы.
2. Фронтальный опрос
- Что называется химической связью?
- Какие виды химических связей вы знаете?
- Какая связь называется ковалентной связью?
- Какие ковалентные связи выделяют?
- Что такое валентность?
- Как мы определяем валентность?
- Какие элементы (металлы и неметаллы) имеют изменчивую валентность?
3. Тестирование
1. В каких молекулах существует неполярная ковалентная связь?
2 . У какой молекулы при образовании ковалентно-неполярной связи образуется тройная связь?
У какой молекулы при образовании ковалентно-неполярной связи образуется тройная связь?
3 . Как называется положительно заряженные ионы?
А) катионы
Б) молекулы
В) анионы
Г) кристаллы
4. В каком ряду располагаются вещества ионного соединения?
А) СН 4 , NН 3 , Мg
Б) СI 2 , МgО, NаСI
В) МgF 2 , NаСI, СаСI 2
Г) Н 2 S, НСI, Н 2 О
5 . Валентность определяются по:
А) по номеру группы
Б) по числу неспаренных электронов
В) по типу химической связи
Г) по номеру периода.
4. Интеллектуальная игра «Крестики-нолики »
Найдите вещества с ковалентно-полярной связь.
IV . Изучение нового материала
Степень окисления является важной характеристикой состояния атома в молекуле. Валентность, определяется по числу неспаренных электронов в атоме, орбиталями с неподеленными электронными парами, только в процессе возбуждения атома. Высшая валентность элемента, как правило, равна номеру группы. Степень окисления в соединениях с разными химическими связями образуется неодинаково.
Высшая валентность элемента, как правило, равна номеру группы. Степень окисления в соединениях с разными химическими связями образуется неодинаково.
Как образуется степень окисления у молекул с разными химическими связями?
1) В соединениях с ионной связью степени окисления элементов равно зарядам ионов.
2) В соединениях с ковалентной неполярной связью (в молекулах простых веществ) степень окисления элементов равно 0.
Н 2 0 , С I 2 0 , F 2 0 , S 0 , AI 0
3) У молекул с ковалентно-полярной связью степень окисления определяется подобно молекулам с ионной химической связью.
Степень окисления элемента – это условный заряд его атома, в молекуле, если считать, что молекула состоит из ионов.
Степень окисления атома в отличие от валентности имеет знак. Она может быть положительной, отрицательной и нулевой.
Валентность обозначатся римскими цифрами сверху символа элемента:
II | I | IV |
Fe | Cu | S , |
а степень окисления обозначается арабскими цифрами с зарядом над символам элемента (М g +2 , Са +2 , N а +1 , CI ˉ¹).
Положительная степень окисления – равна числу электронов, отданных данным атомам. Атом может отдать все валентные электроны (для главных групп это электроны внешнего уровня) соответствующее номеру группы, в котором находится элемент, проявляя при этом высшую степень окисления (исключение ОF 2).Например: высшая степень окисления главной подгруппы II группы равна +2 (Zn +2) Положительную степень проявляют как металлы и неметаллы, кроме F, He, Ne.Например: С+4 , Na +1 , Al +3
Отрицательная степень окисления равна числу электронов, принятых данным атомом, ее проявляют только неметаллы. Атомы неметаллов присоединяют столько электронов, сколько их не хватает до завершения внешнего уровня, проявляя при этом отрицательную степень.
У элементов главных подгрупп IV-VII групп минимальная степень окисления численно равна
Например:
Значение степени окисления между высшим и низшим степенями окислений называется промежуточными:
Высшая | Промежуточные | Низшая |
С +3 , С +2 ,С 0 ,С -2 | ||
В соединениях с ковалентной неполярной связью (в молекулах простых веществ) степень окисления элементов равно 0: Н 2 0 , С I 2 0 , F 2 0 , S 0 , AI 0
Для определения степени окисления атома в соединении следует учитывать ряд положений:
1.
Степень окисления F во всех соединениях равна « -1». Na +1 F -1 , H +1 F -1
2. Степень окисления кислорода в большинстве соединений равна (-2) исключение: О F 2 , где степень окисления О +2 F -1
3. Водород в большинстве соединений имеет степень окисления +1, кроме соединения с активными металлами, где степень окисления (-1) : Na +1 H -1
4.Степень окисления металлов главных подгрупп I , II , III групп во всех соединениях равна +1,+2,+3.
Элементы с постоянной степенью окисления это:
А) щелочные металлы (Li, Na, K, Pb, Si, Fr) — степень окисления +1
Б) элементы II главной подгруппы группы кроме (Hg): Be, Mg, Ca, Sr, Ra, Zn, Cd — степень окисления +2
В) элемент III группы: Al — степень окисления +3
Алгоритм составления формулы в соединениях:
1 способ
1 . На первом месте пишется элемент с меньшей электроотрицательностью, на втором с большей электроотрицательностью.
На первом месте пишется элемент с меньшей электроотрицательностью, на втором с большей электроотрицательностью.
2 . Элемент, написанный на первом месте имеет положительный заряд «+», а на втором с отрицательным зарядом «-».
3 . Указать для каждого элемента степень окисления.
4 . Найти общее кратное значение степеней окисления.
5. Разделить наименьшее общее кратное на значение степеней окисления и полученные индексы приписать внизу справа после символа соответствующего элемента.
6. Если степень окисления четное – нечетное, то они становятся рядом с символом справа внизу крест – накрест без знака «+» и «-»:
7. Если степень окисления имеет четное значение, то их сначала нужно сократить на наименьшее значение степени окисления и поставить крест – накрест без знака «+» и «-»: С +4 О -2
2 способ
1 . Обозначим степень окисления N через Х, указать степень окисления О: N 2 x O 3 -2
2 . Определить сумму отрицательных зарядов, для этого степень окисления кислорода умножаем на индекс кислорода: 3· (-2)= -6
Определить сумму отрицательных зарядов, для этого степень окисления кислорода умножаем на индекс кислорода: 3· (-2)= -6
3 .Чтобы молекула была электронейтральной нужно определить сумму положительных зарядов: Х2 = 2Х
4 .Составить алгебраическое уравнение:
N 2 + 3 O 3 –2
V . Закрепление
1) Проведение закрепления темы игрой, которое называется «Змейка».
Правила игры: учитель раздает карточки. На каждой карточке написан один вопрос и один ответ на другой вопрос.
Учитель начинает игру. Зачитает вопрос, ученик, у которого на карточке есть, ответ на мой вопрос поднимает руку и говорит ответ. Если ответ правильный, то он читает свой вопрос и у того ученика у которого есть ответ на этот вопрос поднимает руку и отвечает и т.д. Образуется змейка правильных ответов.
- Как и где обозначается степень окисления у атома химического элемента?
Ответ : арабской цифрой над символом элемента с зарядом «+» и «-».
- Какие виды степеней окисления выделяют у атомов химических элементов?
Ответ : промежуточная - Какую степень проявляет металлы?
Ответ : положительная, отрицательная, нулевая. - Какую степень проявляют простые вещества или молекулы с неполярной ковалентной связью.
Ответ : положительная - Какой заряд имеют катионы и анионы?
Ответ : нулевое. - Как называется степень окисления, которая стоит между положительным и отрицательным степенями окисления.
Ответ : положительный,отрицательный
2) Написать формулы веществ состоящих из следующих элементов
- N и H
- Р и О
- Zn и Cl
3) Найти и зачеркнуть вещества, не имеющие переменчивую степень окисления.
Na, Cr, Fe, K, N, Hg, S, Al, C
VI . Итог урока.
Выставление оценок с комментариями
VII . Домашнее задание
§23, стр. 67-72, задание после §23-стр 72 №1-4 выполнить.
67-72, задание после §23-стр 72 №1-4 выполнить.
Умение находить степень окисления химических элементов является необходимым условием для успешного решения химический уравнений, описывающих окислительно-восстановительные реакции. Без него вы не сможете составить точную формулу вещества, получившегося в результате реакции между различными химическими элементами. В результате решение химических задач, построенных на подобных уравнениях, будет либо невозможным, либо ошибочным.
Понятие степени окисления химического элемента
Степень окисления – это условная величина, с помощью которой принято описывать окислительно-восстановительные реакции. Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
В окислительно-восcтановительных реакциях понятие степень окисления используется для определения химических формул соединений элементов, получающихся в результате взаимодействия нескольких веществ.
На первый взгляд может показаться, что степень окисления эквивалентна понятию валентности химического элемента, но это не так. Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Как определить степень окисления конкретного химического элемента
Определение степени окисления для конкретного химического элемента подчиняется следующим правилам:
- Степень окисления простых веществ всегда равна нулю.

- Щелочные металлы, которые находятся в первой группе периодической таблицы, имеют степень окисления +1.
- Щелочноземельные металлы, занимающие в периодической таблице вторую группу, имеют степень окисления +2.
- Водород в соединениях с различными неметаллами всегда проявляет степень окисления +1, а в соединениях с металлами +1.
- Степень окисления молекулярного кислорода во всех соединениях, рассматриваемых в школьном курсе неорганической химии, равна -2. Фтора -1.
- При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
- Алюминий во всех соединениях проявляет степень окисления равную +3.
Дальше, как правило, начинаются сложности, так как остальные химические элементы демонстрируют и проявляют переменную степень окисления в зависимости от типов атомов других веществ, участвующих в соединении.
Различают высшую, низшую и промежуточную степени окисления. Высшая степень окисления, как и валентность, соответствует номеру группы химического элемента в периодической таблице, но имеет при этом положительное значение. Низшая степень окисления численно равна разности между числом 8 группой элемента. Промежуточной степенью окисления будет любой число в диапазоне от низшей степени окисления до высшей.
Чтобы помочь вам сориентироваться в многообразии степеней окисления химических элементов предлагаем вашему вниманию следующую вспомогательную таблицу. Выберите в ней интересующий вас элемент и вы получите значения его возможных степеней окисления. В скобках будут указаны редко встречающиеся значения.
1
Первый слайд презентации: Степень окисления
Изображение слайда
2
Слайд 2: Задание № 1
Определить тип химической связи в молекулах: Na, NaCl, Cl 2, HCl
Изображение слайда
3
Слайд 3: Степень окисления
Степень окисления — это условный заряд атомов, вычисленный из предположения, что вещество состоит только из ионов.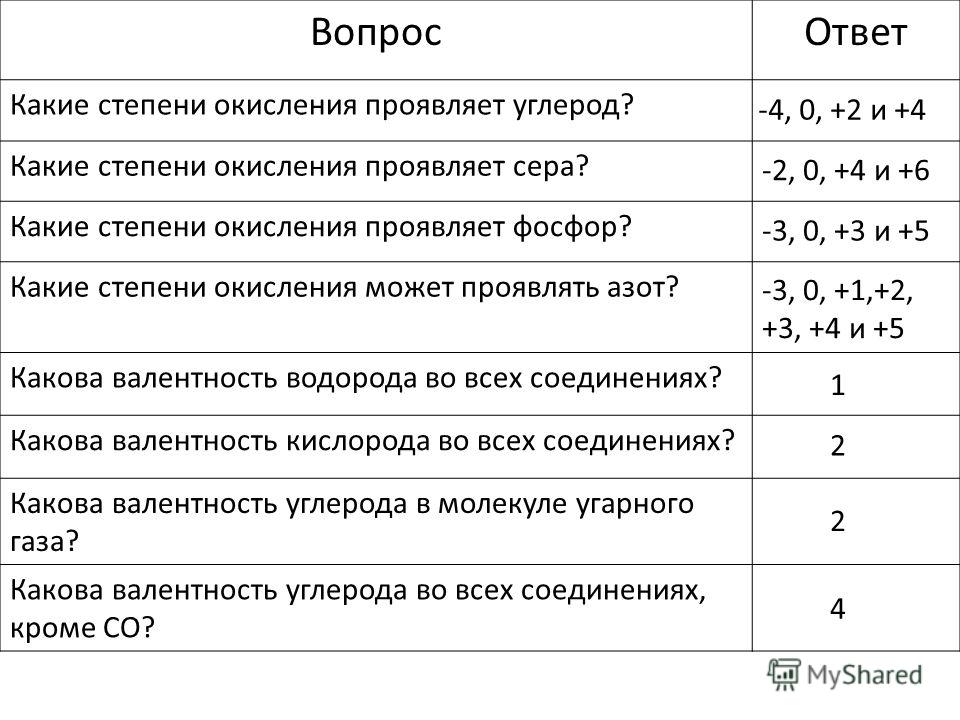
Изображение слайда
4
Слайд 4: Правила для определения степени окисления
Степень окисления Правила для определения степени окисления. Положительная Отрицательная Нулевая
Изображение слайда
5
Слайд 5: Правила для определения степени окисления
Степень окисления Правила для определения степени окисления. Постоянная Переменная
Изображение слайда
6
Слайд 6: Нулевая степень окисления
Степень окисления простых веществ и свободных атомов всегда равна нулю ( 0): 0 О 2 0 Cl 2 0 Fe
Изображение слайда
7
Слайд 7: Постоянная степень окисления
+1 Н (кроме соединений с металлами (-1) NaH
Изображение слайда
8
Слайд 8: Задание 1: Определить степень окисления в соединениях K 2 О, AlH 3, CaF 2
+1 -2 K 2 O +3 -1 AlH 3 +2 -1 CaF 2
Изображение слайда
9
Слайд 9: Суммарная степень окисления в молекуле всегда равна 0
+1 -2 Na 2 O +3 -1 AlCl 3 +2 -1 BaH 2
Изображение слайда
10
Слайд 10: Бинарные соединения
Бинарные соединения – это соединения, состоящие из двух химических элементов.
Изображение слайда
11
Слайд 11: Бинарные соединения
На первом месте всегда записывается элемент с положительной степенью окисления, а на втором — с отрицательной.
Изображение слайда
12
Слайд 12: Названия бинарных соединений
Изображение слайда
13
Слайд 13: Названия бинарных соединений
Названия элементов с отрицательной степенью окисления: Cl — хлор ид О — окс ид Н — гидр ид S — сульф ид N — нитр ид P — фосф ид С — карб ид Br — бром ид
Изображение слайда
14
Слайд 14: Задание 2: назвать бинарные соединения, формулы которых даны
+1 -1
NaCl —
+2 -1
SCl 2 —
+2 -2
CuO –
+1 -2
Cu 2 O —
Хлорид натрия
Численное значение степени окисления для элементов с переменной степенью окисления. Оксид меди ( II)
Хлорид серы ( II)
Оксид меди ( I)
Оксид меди ( II)
Хлорид серы ( II)
Оксид меди ( I)
Изображение слайда
15
Слайд 15: Составление формул бинарных соединений по названию
оксид углерода ( IV). 1) Записать символы химических элементов образующих соединение: СО
Изображение слайда
16
Слайд 16: Составление формул бинарных соединений по названию
2) Над атомами химических элементов в соединении проставить их степени окисления (в скобках указана переменная степень окисления элемента – она положительна): +4 -2 СО оксид углерода ( IV).
Изображение слайда
17
Слайд 17: Составление формул бинарных соединений по названию
3) Найти наименьшее общее кратное между значениями степеней окисления: +4 -2 СО 4
Изображение слайда
18
Слайд 18: Составление формул бинарных соединений по названию
Определить индексы, разделив НОК на значения степеней окисления каждого элемента. +4 -2
СО
СО 2 — оксид углерода ( IV)
4
2
Индекс «1» не пишут
+4 -2
СО
СО 2 — оксид углерода ( IV)
4
2
Индекс «1» не пишут
Изображение слайда
19
Слайд 19: Задание 3: Составить формулы веществ по названиям
Сульфид лития — Оксид серы ( IV) — Оксид азота ( V) – Оксид железа ( III) — Li 2 S SO 2 N 2 O 5 Fe 2 O 3
Изображение слайда
20
Последний слайд презентации: Степень окисления: Домашнее задание:
§ 1 8 Назвать вещества: NO, N 2 O, N 2 O 3, PCl 3, PCl 5, CuCl 2. Составить формулы веществ по названиям: 1) хлорид кальция 2) оксид хрома ( VI) 3) сульфид железа ( II)
Изображение слайда
Соединения существует степень окисления. Основы химии: Степень окисления
Степень окисления. Определение степени окисления атома элемента по химической формуле соединения. Составление формулы соединения по известным степеням окисления атомов элементов
Определение степени окисления атома элемента по химической формуле соединения. Составление формулы соединения по известным степеням окисления атомов элементов
Степень окисления элемента — это условный заряд атома в веществе, исчисленный с предположением, что она состоит из ионов. Для определения степени окисления элементов необходимо запомнить определенные правила:
1. Степень окисления может быть положительным, отрицательным или равным нулю. Он обозначается арабской цифрой со знаком «плюс» или «минус» над символом элемента.
2. При определении степеней окисления исходят из электроотрицательности вещества: сумма степеней окисления всех атомов в соединении равна нулю.
3. Если соединение образована атомами одного элемента (в простой веществе), то степень окисления этих атомов равен нулю.
4. Атомам некоторых химических элементов обычно приписывают стали степени окисления. Например, степень окисления фтора в соединениях всегда равна -1; лития, натрия, калия, рубидия и цезия +1; магния, кальция, стронция, бария и цинка +2, алюминия +3.
5. Степень окисления водорода в большинстве соединений +1, и только в соединениях с некоторыми металлами он равен -1 (KH, Bah3).
6. Степень окисления кислорода в большинстве соединений -2, и лишь в некоторых соединениях ему приписывают степень окисления -1 (h3O2, Na2O2 или +2 (OF2).
7. Атомы многих химических элементов оказывают переменные степени окисления.
8. Степень окисления атома металла в соединениях положительный и численно равна его валентности.
9. Максимальный положительный степень окисления элемента, как правило, равна номеру группы в периодической системе, в которой находится элемент.
10. Минимальная степень окисления для металлов равна нулю. Для неметаллов в большинстве случаев ниже отрицательный степень окисления равна разнице между номером группы и цифрой восемь.
11. Степень окисления атома образует простой ион (состоит из одного атома), равна заряду этого иона.
Пользуясь приведенным правилам, определим степени окисления химических элементов в составе h3SO4. Это сложное вещество, состоящее из трех химических элементов — водорода Н, серы S и кислорода О. Отметим степени окисления тех элементов, для которых они являются постоянными. В нашем случае это водород Н и кислород О.
Это сложное вещество, состоящее из трех химических элементов — водорода Н, серы S и кислорода О. Отметим степени окисления тех элементов, для которых они являются постоянными. В нашем случае это водород Н и кислород О.
Определим неизвестный степень окисления серы. Пусть степень окисления серы в этой соединении равно х.
Составим уравнения, умножив для каждого элемента его индекс в степень окисления и добытую сумму приравняем к нулю: 2 · (+1) + x + 4 · (-2) = 0
2 + X — 8 = 0
x = +8 — 2 = +6
Следовательно, степень окисления серы равна плюс шесть.
В следующем примере выясним, как можно составить формулу соединения с известными степенями окисления атомов элементов. Составим формулу феррум (III) оксида. Слово «оксид» означает, что справа от символа железа надо записать символ кислорода: FeO.
Отметим степени окисления химических элементов над их символами. Степень окисления железа указана в названии в скобках (III), следовательно, равна +3, степень окисления кислорода в оксидах -2.
Найдем наименьшее общее кратное для чисел 3 и 2, это 6. Разделим число 6 на 3, получим число 2 — это индекс для железа. Разделим число 6 на 2, получим число 3 — это индекс для кислорода.
В следующем примере выясним, как можно составить формулу соединения с известными степенями окисления атомов элементов и зарядами ионов. Составим формулу кальций ортофосфата. Слово «ортофосфат» означает, что справа от символа Кальция надо записать кислотный остаток ортофосфатнои кислоты: CaPO4.
Отметим степень окисления кальция (правило номер четыре) и заряд кислотного остатка (по таблице растворимости).
Найдем наименьшее общее кратное для чисел 2 и 3, это 6. Разделим число 6 на 2, получим число 3 — это индекс для кальция. Разделим число 6 на 3, получим число 2 — это индекс для кислотного остатка.
При изучении ионной и ковалентной полярной химической связи вы знакомились со сложными веществами, состоящими из двух химических элементов. Такие вещества называют би парными (от лат. би — «два») или двухэлементными.
би — «два») или двухэлементными.
Вспомним типичные бпнарные соединения, которые мы привели в качестве примера для рассмотрения механизмов образования ионной и ковалентноЙ полярной химической связи : NaHl — хлорид натрия и НСl — хлороводород. В первом случае связь ионная: атом натрия передал свой внешний электрон атому хлора и превратился при этом в ион с зарядом -1. а атом хлора принял электрон и превратился в ион с зарядом -1. Схематически процесс превращения атомов в ионы можно изобразить так:
В молекуле же НСl связь образуется за счет спаривания не-спаренных внешних электронов и образования общей электронной пары атомов водорода и хлора.
Правильнее представлять образование ковалентной связи в молекуле хлороводорода как перекрывание одноэлектронного s-облака атома водорода с одноэлектронным p-облаком атома хлора:
При химическом взаимодействии общая электронная пара смещена в сторону более электроотрицательного атома хлора:
Такие условные заряды называются степенью окисления . При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных ионов.
При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных ионов.
— это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентно-полярные) состоят только из ионов.
Степень окисления может иметь отрицательное, положительное или нулевое значения, которые обычно ставятся над символом элемента сверху, например:
Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов пли к которым смещены общие электронные пары, то есть атомы более электроотрицательных элементов. Фтор всегда имеет степень окисления -1 во всех соединениях. Кислород , второй после фтора по значению элекгроотрицательности элемент, почти всегда имеет степень окисления -2, кроме соединений со фтором, например:
Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, то есть атомы менее электроотрицательных элементов. Металлы всегда имеют положительную степень окисления. У металлов главных подгрупп:
Металлы всегда имеют положительную степень окисления. У металлов главных подгрупп:
I группы во всех соединениях степень окисления равна +1,
II группы равна +2. III группы — +3, например:
В соединениях суммарная степень окисления всегда равна нулю. Зная это и степень окисления одного из элементов, всегда можно найти степень окисления другого элемента по формуле бинарного соединения. Например, найдем степень окисления хлора в соединении Сl2О2. Обозначим степень окисления -2
кислорода: Сl2О2. Следовательно, семь атомов кислорода будут иметь общий отрицательный заряд (-2) 7 =14. Тогда общий заряд двух атомов хлора будет равен +14, а одного атома хлора:
(+14):2 = +7.
Аналогично, зная степени окисления элементов, можно составить формулу соединения, например карбида алюминия (соединения алюминия и углерода). Запишем знаки алюминия н углерода рядом АlС, причем сначала знак алюминия, так как это металл. Определим по таблице элементов Менделеева число внешних электронов: у Аl — 3 электрона, у С — 4. Атом алюминия отдаст свои 3 внешних электрона углероду и получит при этом степень окисления +3, равную заряду иона. Атом углерода, наоборот, примет недостающие до «заветной восьмерки» 4 электрона и получит при этом степень окисления -4.
Атом алюминия отдаст свои 3 внешних электрона углероду и получит при этом степень окисления +3, равную заряду иона. Атом углерода, наоборот, примет недостающие до «заветной восьмерки» 4 электрона и получит при этом степень окисления -4.
Запишем эти значения в формулу: АlС, и найдем наименьшее общее кратное для них, оно равно 12. Затем рассчитаем индексы:
Знать степени окисления элементов необходимо и для того, чтобы уметь правильно называть химическое соединение.
Названия бинарных соединений состоят из двух слов — названий образующих их химических элементов. Первое слово обозначает электроотрицательную часть соединения — неметалл, его латинское название с суффиксом -ид стоит всегда в именительном падеже. Второе слово обозначает электроположительную часть — металл или менее электроотрицательный элемент, его название всегда стоит в родительном падеже. Если же электроположительный элемент проявляет разные степени окисления, то это отражают в названии, обозначив степень окисления римской цифрой, которая ставится в конце.
Чтобы химики разных стран понимали друг друга, потребовалось создание единой терминологии и номенклатуры веществ. Принципы химической номенклатуры были впервые разработаны французскими химиками А. Лавуазье, А.Фурктуа, Л.Гитоном и К.Бертолле в 1785г. В настоящее время Международный союз теоретической и прикладной химии (ИЮПАК) координирует деятельность ученых рядных стран и издает рекомендации по номенклятурс веществ и терминологии, используемой к химии.
Химического элемента в соединении, вычисленный из предположения, что все связи имеют ионный тип.
Степени окисления могут иметь положительное, отрицательное или нулевое значение, поэтому алгебраическая сумма степеней окисления элементов в молекуле с учётом числа их атомов равна 0, а в ионе — заряду иона .
1. Степени окисления металлов в соединениях всегда положительные.
2. Высшая степень окисления соответствует номеру группы периодической системы, где находится данный элемент (исключение составляют: Au +3 (I группа), Cu +2 (II), из VIII группы степень окисления +8 может быть только у осмия Os и рутения Ru .
3. Степени окисления неметаллов зависят от того, с каким атомом он соединён:
- если с атомом металла, то степень окисления отрицательная;
- если с атомом неметалла то степень окисления может быть и положительная, и отрицательная. Это зависит от электроотрицательности атомов элементов.
4. Высшую отрицательную степень окисления неметаллов можно определить вычитанием из 8 номера группы, в которой находится данный элемент, т.е. высшая положительная степень окисления равна числу электронов на внешнем слое, которое соответствует номеру группы.
5. Степени окисления простых веществ равны 0, независимо от того металл это или неметалл.
Элементы с неизменными степенями окисления.
Элемент | Характерная степень окисления | Исключения |
Гидриды металлов: LIH -1 | ||
Степенью окисления называют условный заряд частицы в предположении, что связь полностью разорвана (имеет ионных характер). H — Cl = H + + Cl — , Связь в соляной кислоте ковалентная полярная. Электронная пара в большей степени смещена в сторону атома Cl — , т.к. он более электроотрицацельный элемент. Как определить степень окисления?Электроотрицательность — это способность атомов притягивать к себе электроны других элементов. Степень окисления указывается над элементом: Br 2 0 , Na 0 , O +2 F 2 -1 , K + Cl — и т.д. Она может быть отрицательной и положительной. Степень окисления простого вещества (несвязанное, свободное состояние) равна нулю. Степень окисления кислорода у большинстве соединений равна -2 (исключение составляют пероксиды Н 2 О 2 , где она равна -1 и соединения с фтором — O +2 F 2 -1 , O 2 +1 F 2 -1 ). — Степень окисления простого одноатомного иона равна его заряду: Na + , Ca +2 . Водород в своих соединениях имеет степень окисления равную +1 (исключения составляют гидриды — Na + H — и соединения типа C +4 H 4 -1 ). В связях «металл-неметалл» отрицательную степень окисления имеет тот атом, который обладает большей электрооприцательностью (данные об элеткроотрицательности приведены в шкале Полинга): H + F — , Cu + Br — , Ca +2 (NO 3 ) — и т.д. Правила определения степени окисления в химических соединениях.Возьмем соединение KMnO 4 , необходимо определить степень окисления у атома марганца. Рассуждения:
К + Mn X O 4 -2 Пусть Х — неизвестная нам степень окисления марганца. Количество атомов калия — 1, марганца — 1, кислорода — 4. Доказано, что молекула в целом электронейтральна, поэтому ее общий заряд должен быть равен нулю. 1*(+1) + 1*(X ) + 4(-2) = 0, Х = +7, Значит, степень окисления марганца в перманганате калия = +7. Возьмем другой пример оксида Fe 2 O 3 . Необходимо определить степень окисления атома железа. Рассуждение:
2*(Х) + 3*(-2) = 0, Вывод: степень окисления железа в данном оксиде равна +3. Примеры. Определить степени окисления всех атомов в молекуле. 1. K 2 Cr 2 O 7 . Степень окисления К +1 , кислорода О -2 . Учитывая индексы: О=(-2)×7=(-14), К=(+1)×2=(+2). Т.к. алгебраическая сумма степеней окисления элементов в молекуле с учётом числа их атомов равна 0, то число положительных степеней окисления равно числу отрицательных. Степени окисления К+О=(-14)+(+2)=(-12). Из этого следует, что у атома хрома число положительных степеней равно 12, но атомов в молекуле 2, значит на один атом приходится (+12):2=(+6). Ответ: К 2 + Cr 2 +6 O 7 -2 . 2. (AsO 4) 3- . В данном случае сумма степеней окисления будет равна уже не нулю, а заряду иона, т. е. — 3. Составим уравнение: х+4×(— 2)= — 3 . Ответ: (As +5 O 4 -2) 3- . |
Валентность —
— это способность атома образовывать определенное количество связей с другими атомами.
Правила определения валентности
1. В молекулах простых веществ: H 2 , F 2 , Cl 2 , Br 2 , I 2 равна единице.
2. В молекулах простых веществ: O 2 , S 8 равна двум.
3. В молекулах простых веществ: N 2 , P 4 и CO — оксиде углерода (II) — равна трем.
4. В молекулах простых веществ, которые образует углерод (алмаз, графит), а также в органических соединениях, которые он образует, валентность углерода равна четырем.
5. В составе сложных веществ водород одновалентен, кислород, в основном, двухвалентен. Для определения валентности атомов других элементов в составе сложных веществ надо знать строение этих веществ.
Степень окисления
– это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все
соединения (с ионной и ковалентной полярной связью) состоят только из ионов.
Высшая степень окисления элемента равна номеру группы.
Исключения:
фтор высшая степень окисления ноль в простом веществе F 2 0
кислород высшая степень окисления +2 во фториде кислорода О +2 F 2
Низшая степень окисления элемента равна восемь минус номер группы (по числу электронов, которые атом элемента может принять до завершенного восьми электронного уровня)
Правила определения степени окисления (далее обозначим: ст.ок.)
Общее правило: Сумма всех степеней окисления элементов в молекуле с учетом количества атомов равна нулю (Молекула электронейтральна.) , в ионе — равна заряду иона.
I. Степень окисления простых веществ равна нулю: Са 0 , O 2 0 , Cl 2 0
II. ст.ок. в бинарных c оединениях:
Менее электроотрицательный элемент ставится на первое место. (Исключения: С -4 Н 4 + метан и N -3 H 3 + аммиак)
Нужно помнить, что
Ст. ок. металла всегда положительна
ок. металла всегда положительна
Ст.ок. металлов I , II , III групп главных подгрупп постоянна и равна номеру группы
Для остальных ст.ок. вычисляется по общему правилу.
Более электроотрицательный элемент ставится на второе место, его ст.ок. равна восемь минус номер группы (по числу электронов, которые он принимает до завершенного восьми электронного уровня).
Исключения: пероксиды, например, Н 2 +1 О 2 -1 , Ba +2 O 2 -1 и др. ; карбиды металлов I и II групп Ag 2 +1 C 2 -1 , Ca +2 C 2 -1 и др. (В школьном курсе встречается соединение FeS 2 — пирит. Это дисульфид железа. Степень окисления серы в нем (-1) Fe +2 S 2 -1 ). Это происходит потому, что в этих соединениях есть связи между одинаковыми атомами -О-О-, -S -S- , тройная связь в карбидах между атомами углерода. Степень окисления и валентность элементов в этих соединениях не совпадают: у углерода валентность IV , у кислорода и серы II .
III. Степень окисления в основаниях
Ме +
n
(ОН)
n
равна количеству гидроксогрупп .
1. в гидроксогруппе ст.ок. кислорода -2, водорода +1, заряд гидроксогруппы 1-
2. ст.ок. металла равна количеству гидроксогрупп
IV. Степень окисления в кислотах:
1. ст.ок. водорода +1, кислорода -2
2. ст.ок. центрального атома вычисляется по общему правилу путем решения простого уравнения
Например, Н 3 +1 Р х О 4 -2
3∙(+1) + х + 4∙(-2) = 0
3 + х – 8 = 0
х = +5 (не забудьте знак +)
Можно запомнить , что у кислот с высшей ст.ок. центрального элемента, соответствующего номеру группы, название будет заканчиваться на –ная:
Н 2 СО 3 угольная Н 2 С +4 О 3
Н 2 Si О 3 кремниевая (искл.) Н 2 Si +4 О 3
НN О 3 азотная НN +5 О 3
Н 3 P О 4 фосфорная Н 3 P +5 О 4
Н 2 S О 4 серная Н 2 S +6 О 4
НСl О 4 хлорная НCl +7 О 4
Н Mn О 4 марганцовая НMn +7 О 4
Останется запомнить:
Н N О 2 азотистая НN +3 О 2
Н 2 S О 3 сернистая Н 2 S +4 О 3
НСl О 3 хлорноватая НCl +5 О 3
НСl О 2 хлористая НCl +3 О 2
НСl О хлорноватистая НCl +1 О
V. Степень окисления в солях
Степень окисления в солях
у центрального атома такая же, как в кислотном остатке. Достаточно помнить или определить ст.ок. элемента в кислоте.
VI. Степень окисления элемента в сложном ионе равна заряду иона.
Например, NH 4 + Cl — : записываем ион N х Н 4 +1
х + 4∙(+1) = +1
х= — 3;
ст.ок. азота -3
Наприме р, определить ст.ок. элементов в гексацианоферрате(III ) калия К 3
У калия +1: К 3 +1 , отсюда заряд иона 3-
У железа +3 (указано в названии) 3- , отсюда (CN ) 6 6-
У одной группы (CN ) —
Более электроотрицательный азот: у него -3, отсюда (C х N -3 ) —
х – 3 = — 1
х = +2
ст.ок. углерода +2
VII. Степень окисления углерода в органических соединениях разнообразна и вычисляется, исходя из учета того, что ст.ок. водорода равна +1, кислорода -2
Например, С 3 Н 6
3∙х + 6∙1 = 0
3х = -6
х = -2
ст. ок. углерода -2
(при этом валентность углерода равна IV)
ок. углерода -2
(при этом валентность углерода равна IV)
Задание. Определить степень окисления и валентность фосфора в фосфорноватистой кислоте H 3 PO 2 .
Вычислим степень окисления фосфора.
Обозначим её за х. Подставим степень окисления водорода +1, а кислорода -2, умножив на соответствующее количество атомов: (+1) ∙ 3 + х + (-2) ∙ 2 = 0, отсюда х = +1.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
Элемент | Степень окисления практически во всех соединениях | Исключения |
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = № группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Нахождение степеней окисления элементов в различных соединениях
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Решение:
Запишем формулу серной кислоты:
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Степень окисления кислорода во всех сложных веществах равна -2 (кроме пероксидов и фторида кислорода OF 2). Расставим известные степени окисления:
Расставим известные степени окисления:
Обозначим степень окисления серы как x :
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
Т.е. мы получили следующее уравнение:
Решим его:
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Обратим внимание на то, что указанное вещество относится к классу солей и, соответственно, имеет ионное строение. Тогда справедливо можно сказать, что в состав дихромата аммония входят катионы NH 4 + (заряд данного катиона можно посмотреть в таблице растворимости). Следовательно, так как в формульной единице дихромата аммония два положительных однозарядных катиона NH 4 + , заряд дихромат-иона равен -2, поскольку вещество в целом электронейтрально. Т.е. вещество образовано катионами NH 4 + и анионами Cr 2 O 7 2- .
Тогда справедливо можно сказать, что в состав дихромата аммония входят катионы NH 4 + (заряд данного катиона можно посмотреть в таблице растворимости). Следовательно, так как в формульной единице дихромата аммония два положительных однозарядных катиона NH 4 + , заряд дихромат-иона равен -2, поскольку вещество в целом электронейтрально. Т.е. вещество образовано катионами NH 4 + и анионами Cr 2 O 7 2- .
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:
Т.е. мы получаем два независимых уравнения:
Решая которые, находим x и y :
Таким образом, в дихромате аммония степени окисления азота -3, водорода +1, хрома +6, а кислорода -2.
Как определять степени окисления элементов в органических веществах можно почитать .
Валентность
Валентность атомов обозначается римскими цифрами: I, II, III и т. д.
д.
Валентные возможности атома зависят от количества:
1) неспаренных электронов
2) неподеленных электронных пар на орбиталях валентных уровней
3) пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня. Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных () орбиталей валентного уровня. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т. е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH 3), азотистой кислоты (HNO 2), треххлористого азота (NCl 3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор() предоставляет ее другому атому с вакантной () орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии. Атом азота не имеет d -подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO 3 или оксида азота N 2 O 5 ? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Пунктирной линией на иллюстрации изображена так называемая делокализованная π -связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O 3 , бензола C 6 H 6 и т.д.
По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O 3 , бензола C 6 H 6 и т.д.
Валентные возможности фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d -подуровень с 5-ю вакантными орбиталями.
В связи с этим он способен переходить в возбужденное состояние, распаривая электроны 3s -орбитали:
Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т. д.
д.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях. Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа. Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).
Из-за того что атом кислорода не имеет на внешнем уровне d -подуровня, распаривание электронов s и p- орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода H 2 S.
И действительно, валентность II сера имеет, например, в молекуле сероводорода H 2 S.
Как мы видим, у атома серы на внешнем уровне появляется d -подуровень с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p -подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV. Действительно, валентность IV сера имеет в молекулах SO 2 , SF 4 , SOCl 2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s -подуровне, внешний энергетический уровень приобретает конфигурацию:
В таком состоянии уже становится возможным проявление валентности VI. Примером соединений с VI-валентной серой являются SO 3 , H 2 SO 4 , SO 2 Cl 2 и т. д.
д.
Аналогично можно рассмотреть валентные возможности остальных химических элементов.
правила определения степени окисления химических элементов | Методическая разработка по химии (8 класс) на тему:
Опубликовано 04.02.2015 — 22:44 — Лукуша Елена Фёдоровна
Знания и умения определять степень окисления элементов в молекулах позволяют решать очень сложные уравнения реакций и соответственно правильно рассчитывать количества отбираемых веществ для реакций, опытов и в технологических процессах. Степень окисления — одно из важнейших, ключевых понятий в химии. Данная таблица помогает в определении степени окисления элементов, также указаны исключения из правила, приведен алгоритм выполнения заданий такого типа
Скачать:
Реклама
Подтяните оценки и знания с репетитором Учи.ру
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Записаться >
Предварительный просмотр:
ПРАВИЛА ОПРЕДЕЛЕНИЯ СТЕПЕНИ ОКИСЛЕНИЯ. |
Правило № 1 | Правило № 2 | Правило № 3 | Правило № 4 | Правило № 5 | Правило № 6 | Правило № 7 | Правило № 8 |
Изолированные атомы химических элементов имеют степень окисления 0. | Простые вещества имеют степень окисления 0. | Водород имеет степень окисления, +1. | Кислород имеет степень окисления, -2. | Фтор в соединениях имеет степень окисления, равную -1. | Щелочные металлы (гл. подгруппа I группа) имеют степень окисления, +1 | Щелочно-земельные металлы (гл. подгруппа II группа, Са-Ra) и Mg имеют степень окисления +2. | Алюминий имеет в соединениях степень окисления +3. |
Примеры. | Примеры. | Примеры. | Примеры. | Примеры. | Примеры. | Примеры. | Примеры. |
0 Cl | 0 N2 | h3O | SrO | -1 HF | Na2S | CaF2 | Al2O3 |
0 Na | 0 Cu | h4N | Cr2O3 | CaF2 | K2O | MgO | Al(OH)3 |
0 He | 0 O3 | h3Se | SeO2 | SiF4 | LiOH | Ba(OH)2 | Al2S3 |
0 O | 0 Cl2 | h4AsO4 | Rb2O | ClF3 | NaOH | ||
0 Cu | 0 Na | Сa(OH)2 | RbOH | ||||
Nah3PO4 | HPO3 | ||||||
Be(OH)2=h3BeO2 | Al(OH)3=h4AlO3 | ||||||
CН4 | Li2SO3 | ||||||
Ca(HSO4)2 | |||||||
Исключения. | Исключе ния. | Исключения. | Исключения. | Исключения. | Исключения. | Исключения. | Исключения. |
Гидриды металлов: | +2 OF2-фторид кислорода | ||||||
+1 -1 MeH (KH) | -1 Н2О2 -пероксид водорода | ||||||
+2 -1 Meh3(Bah3) | -1 -1 Me2O2(Na2O2) -пероксиды щелочных металлов | ||||||
+3 -1 Meh4(Alh4) | -1 -1 MeO2(CaO2, -1 BaO2 ) — пероксиды щелочноземельных металлов | ||||||
Выводы: высшая положительная степень окисления большинства элементов численно равна номеру группы таблицы элементов, в которой он находится. Низшая отрицательная степень окисления элемента-неметалла определяется числом электронов, которых недостает для заполнения валентного слоя
Низшая отрицательная степень окисления элемента-неметалла определяется числом электронов, которых недостает для заполнения валентного слоя
АЛГОРИТМ определения степени окисления химического элемента в бинарных соединениях. |
1 | 2 | 3 | 4 |
Находим, какой из двух элементов в соединении является более электроотрицательным. | Определяем числовое значение степени окисления для более электроотрицательного элемента. (См. правила) | Определяем общее число отрицательных зарядов в соединении. | Находим степень окисления менее электроотрицательного элемента. |
Над символом более электроотрицательного элемента ставим знак «минус» (-). | Для этого общее число положительных зарядов делим на индекс у данного элемента. | ||
Над символом менее электроотрицательного элемента ставим знак «плюс» (+). | Для этого степень окисления более электроотрицательного элемента умножаем на его индекс. | Помним, что алгебраическая сумма степеней окисления химических элементов в соединении должна быть равна =0. |
Закрепление: определите степени окисления элементов в заданных формулах бинарных соединений.SiF4, P2O5, As2O5, Cah3, Li3N, OsF8, SiCl4, h4P, SCl4, PCL3, h5C, h4As, SF6, AlN, CuO, Fe
По теме: методические разработки, презентации и конспекты
Видео.
 Определение степени окисления (8 класс)
Определение степени окисления (8 класс)Это видео пригодится при объяснении темы: «Степень окисления» (к учебнику Химия, 8 класс, автор Габриелян О.С.).В нем показана последовательность определения степени окисления атомов химических элемен…
ВСЕ степени окисления химических элементов
таблица «ВСЕ степени окисления химических элементов» — своеобразная шпаргалка про написании уравнений окислительно-восстановительных реакций, которая поможет не только учащимся но и учителям химии….
Алгоритм определения степени окисления элементов
Пример определения степени окисления химических элементов по формуле…
разработка урока по химии «Составление химических формул бинарных соединений по степени окисления химических элементов» (8 класс)
разработка содержит конспект урока по теме, а также презентацию к уроку…
Степени окисления химических элементов. Химия 8 класс
Целью данного урока является формирование понятия о степени окисления; отработка навыков нахождения со по формуле вещества и составлению формул бинарных соединений. По типу этот урок-урок усвоени…
По типу этот урок-урок усвоени…
Степень окисления. Алгоритм определения степени окисления.
Степень окисления. Алгоритм определения степени окисления….
Степень окисления химических элементов
quot;Степень окисления химических элемкнтов» одновременно и простая и сложная тема 8 класса. От усвоения этой темы зависит дальнейшее успешное изучение химии в 9 классе…
Поделиться:
| 1 | Найдите количество нейтронов | Х | |
| 2 | Найдите массу 1 моля | Н_2О | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найдите массу 1 моля | Х | |
| 5 | Найдите количество нейтронов | Фе | |
| 6 | Найдите количество нейтронов | ТК | |
| 7 | Найдите электронную конфигурацию | Х | |
| 8 | Найдите количество нейтронов | Са | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найдите число нейтронов | С | |
| 11 | Найдите число протонов | Х | |
| 12 | Найдите количество нейтронов | О | |
| 13 | Найдите массу 1 моля | СО_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найдите атомную массу | Х | |
| 16 | Определить, растворимо ли соединение в воде | Н_2О | |
| 17 | Найдите электронную конфигурацию | Нет | |
| 18 | Найдите массу отдельного атома | Х | |
| 19 | Найдите количество нейтронов | № | |
| 20 | Найдите количество нейтронов | Золото | |
| 21 | Найдите количество нейтронов | Мн | |
| 22 | Найдите количество нейтронов | Ру | |
| 23 | Найдите электронную конфигурацию | О | |
| 24 | Найдите массовые проценты | Н_2О | |
| 25 | Определить, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую/простейшую формулу | Н_2О | |
| 27 | Найти степени окисления | Н_2О | |
| 28 | Найдите электронную конфигурацию | К | |
| 29 | Найдите электронную конфигурацию | Мг | |
| 30 | Найдите электронную конфигурацию | Са | |
| 31 | Найдите количество нейтронов | Рх | |
| 32 | Найдите количество нейтронов | Нет | |
| 33 | Найдите количество нейтронов | Пт | |
| 34 | Найдите количество нейтронов | Быть | Быть |
| 35 | Найдите количество нейтронов | Кр | |
| 36 | Найдите массу 1 моля | Н_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Фе | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите количество нейтронов | Медь | |
| 41 | Найдите количество нейтронов | С | |
| 42 | Найдите степени окисления | Х | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найдите атомную массу | О | |
| 45 | Найдите атомный номер | Х | |
| 46 | Найдите количество нейтронов | Пн | |
| 47 | Найдите количество нейтронов | ОС | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | О | |
| 50 | Найдите электронную конфигурацию | Фе | |
| 51 | Найдите электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | Нет | |
| 55 | Найдите число нейтронов | Н | |
| 56 | Найдите количество нейтронов | Ли | |
| 57 | Найдите количество нейтронов | В | |
| 58 | Найдите число протонов | № 92О | |
| 60 | Упростить | ч*2р | |
| 61 | Определить, растворимо ли соединение в воде | Х | |
| 62 | Найдите плотность на STP | Н_2О | |
| 63 | Найти степени окисления | NaCl | |
| 64 | Найдите атомную массу | Он | Он |
| 65 | Найдите атомную массу | Мг | |
| 66 | Найдите количество электронов | Х | |
| 67 | Найдите число электронов | О | |
| 68 | Найдите число электронов | С | |
| 69 | Найдите число нейтронов | Пд | |
| 70 | Найдите количество нейтронов | рт. ст. ст. | |
| 71 | Найдите количество нейтронов | Б | |
| 72 | Найдите массу отдельного атома | Ли | |
| 73 | Найдите эмпирическую формулу | Н=12%, С=54%, N=20 | , , |
| 74 | Найдите число протонов | Быть | Быть |
| 75 | Найдите массу 1 моля | На | |
| 76 | Найдите электронную конфигурацию | Со | |
| 77 | Найдите электронную конфигурацию | С | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | Н_2+О_2→Н_2О | |
| 80 | Найдите электронную конфигурацию | Р | |
| 81 | Найдите электронную конфигурацию | Пб | |
| 82 | Найдите электронную конфигурацию | Ал | |
| 83 | Найдите электронную конфигурацию | Ар | |
| 84 | Найдите массу 1 моля | О_2 | |
| 85 | Найдите массу 1 моля | Н_2 | |
| 86 | Найдите количество нейтронов | К | |
| 87 | Найдите количество нейтронов | Р | |
| 88 | Найдите число нейтронов | Мг | |
| 89 | Найдите количество нейтронов | Вт | |
| 90 | Найдите массу отдельного атома | С | |
| 91 | Упростить | н/д+кл | |
| 92 | Определить, растворимо ли соединение в воде | Н_2SO_4 | |
| 93 | Найдите плотность на STP | NaCl | |
| 94 | Найти степени окисления | C_6H_12O_6 | |
| 95 | Найти степени окисления | Нет | |
| 96 | Определить, растворимо ли соединение в воде | C_6H_12O_6 | |
| 97 | Найдите атомную массу | Кл | |
| 98 | Найдите атомную массу | Фе | |
| 99 | Найдите эмпирическую/самую простую формулу | СО_2 | |
| 100 | Найдите количество нейтронов | Мт |
[PDF] Глава 11.
 Электрохимия Реакции окисления и восстановления. Окислительно-восстановительные реакции. Окислительно-восстановительные реакции
Электрохимия Реакции окисления и восстановления. Окислительно-восстановительные реакции. Окислительно-восстановительные реакции1 Реакции окисления-восстановления Глава 11 Электрохимия Реакции окисления и восстановления Окисление и восстановление…
Реакции окисления-восстановления
Глава 11 Электрохимия – реакции окисления и восстановления
Реакции окисления и восстановления происходят как в водных растворах, так и в реакциях, при которых вещества сжигаются в присутствии газообразного кислорода, включают перенос электронов в качестве движущей силы химическая реакция. |
|
Реагенты в этих реакциях теряют или приобретают электроны и меняют свой заряд по мере образования продуктов. Движущей силой этих химических изменений является перенос электронов. 2
1
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции |
Окислительно-восстановительные реакции представляют собой очень важный класс химических реакций.
|
Они встречаются вокруг нас и даже внутри нас. z Основная часть энергии, необходимой для функционирования всех живых организмов, в том числе и человека, получается из пищи в результате окислительно-восстановительных процессов. z Такие разнообразные явления, как электричество, получаемое от аккумулятора для запуска автомобиля, использование природного газа для обогрева дома, ржавление железа и действие антисептических средств для уничтожения или предотвращения роста бактерий, — все они связаны с окислительно-восстановительными реакциями. z Знание этого типа реакции имеет фундаментальное значение для понимания многих биологических и технологических процессов.
Исторически сложилось так, что слово окисление впервые использовалось для описания реакции вещества с кислородом. Согласно этому историческому определению, каждая из следующих реакций включает окисление: 4 Fe (т) + 3 O2 (г) Æ 2 Fe2O3 (т) S (т) + O2 (г) Æ SO2 (г) Ch5 (г) + 2 O2 (г) Æ CO2 (г) + 2 h3O (г) |
Реагент в крайнем левом (жирным шрифтом) в каждом из этих химических уравнений считается окисленным.
3
4
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции
Первоначально термин «восстановление» относился к процессам, при которых кислород удалялся из соединения. | Особенно распространенным типом реакции восстановления, в соответствии с первоначальным определением, является удаление кислорода из оксида металла с получением свободного металла. CuO (т) + h3 (г) Æ Cu (т) + h3O (г) 2 Fe2O3 (т) + 3 C (т) Æ 4 Fe (т) + 3 CO2 (г)
Сегодня слова окисление и восстановление употребляются в гораздо более широком смысле. |
|
Слово «восстановление» происходит от уменьшения массы оксида металла; свободный металл имеет меньшую массу, чем оксид металла. 5
Текущие определения включают предыдущие примеры, но также включают реакции с многочисленными веществами, не содержащими кислород. Реакции, которые включают перенос электронов от одного реагента к другому реагенту, независимо от участвующих веществ, в совокупности называются окислительно-восстановительными реакциями (окислительно-восстановительными). 6
6
Окислительно-восстановительные реакции
Номера окисления
Для всех окислительно-восстановительных реакций реагенты должны терять электроны и приобретать электроны в ходе химического процесса. Окислительно-восстановительные реакции: НЕФТЯНАЯ ВЫШКА | OIL Î окисление – это потеря электронов (например, металлов в солях) | RIG Î восстановление – это приобретение электронов (например, неметаллы в солях)
Название, данное заряду элемента, иона или элемента в ковалентной связи, называется степенью окисления или степенями окисления. Например: | Na+ имеет степень окисления +1. | F– имеет степень окисления –1.
7
8
Степень окисления
Степень окисления Степень окисления Чтобы присвоить степень окисления элементам в соединениях, существует несколько простых правил: 1. Степень окисления любого свободного, несвязанного элемента равна нулю.
Чтобы определить, какое вещество окисляется, а какое восстанавливается, мы должны определить начальную и конечную степени окисления каждого вещества в ходе химической реакции. | Для определения степеней окисления всех элементов в молекулах или ионных соединениях необходимо соблюдать несколько правил.
| Для определения степеней окисления всех элементов в молекулах или ионных соединениях необходимо соблюдать несколько правил.
z
Na (т), Mg (т), Cu (т), Fe (т) и Zn (т)
9
10
Число окисления |
Номера окисления
Все встречающиеся в природе двухатомные молекулы имеют нулевую степень окисления. Br2 I2 N2 Cl2 h3 O2 F2 Это имеет смысл — между общими электронами в двухатомных молекулах нет диполя (разницы в электроотрицательности). Неметаллы в их естественном несвязанном состоянии имеют нулевую степень окисления. z
2. Для простых бинарных ионных соединений (солей) группы А степень окисления представляет собой заряд элемента: |
z
|
z
|
Металлам (группа I A, IIA и IIIA) присваивается положительная степень окисления, определяемая количеством электронов, потерянных элементом. Неметаллам (группа VA, VIA, VIIA) присваивается отрицательная степень окисления, определяемая количеством электронов, которые приобрел элемент.
Например, P4 (s) и S8 (s) 11
12
Числа окисления
Числа окисления Используйте периодическую таблицу, чтобы помочь при присвоении степеней окисления элементам. а. Металлы IA имеют степень окисления +1. б. Металлы IIA имеют степень окисления +2. в. Металлы IIIA имеют степень окисления +3. • Есть несколько редких исключений.
д. Элементы VA имеют степени окисления –3 в бинарных соединениях с H, металлами или Nh5+. е. Элементы VIA ниже O имеют степень окисления –2 в бинарных соединениях с H, металлами или Nh5+. ф. Элементы VIIA имеют степени окисления –1 в бинарных соединениях с H, металлами или Nh5+.
13
14
Числа окисления
Числа окисления
Группы
Число окисления
Одноатомные ионы металлов
s 111911
11
Li+, Na+, K+, Rb+, Cs+
IIA metals
+2
Mg2+, Ca2+, Sr2+, Ba2+
IIIA metals
+3
Al3+, Ga3+, In3+
V nonmetals
– 3
N3–, P3–, As3–, Sb3–, Bi3–
VI неметаллы
–2
O2–, S2–, Se2–, Te2–
VII неметаллы
–1
F , Cl–, Br–, I–
3.
В формуле любого соединения сумма степеней окисления всех элементов в соединении равна нулю. Na2SO4 = нулевой заряд формульной единицы В многоатомном ионе сумма степеней окисления составляющих элементов равна заряду иона.
SO42- =- 2на ион. 16
Степень окисления
Степень окисления Фтор в своих соединениях имеет степень окисления –1. 5. Водород, H, имеет степень окисления +1, если только он не соединен с металлами, где он имеет степень окисления — 1. z Примеры – LiH, Bah3 4.
17
6. Кислород обычно имеет степень окисления –2. z Исключения: z В пероксидах O имеет степень окисления –1. • Примеры: h3O2, CaO2, Na2O2 z В OF2 O имеет степень окисления +2. (Фтор является наиболее электроотрицательным элементом и имеет большую долю электронов.)
18
Числа окисления
Числа окисления Для простых бинарных ионных соединений, состоящих из переходных металлов (с более чем одной возможной степенью окисления), степень окисления металла определяется балансировкой заряда: z Для наших целей, все переходные металлы в солях (кроме цинка и серебра) имеют степени окисления, которые определяются уравновешиванием заряда аниона.
напр. FeO по сравнению с Fe2O3 -2
FeO z Поскольку степень окисления кислорода в соединении равна -2, атом железа должен иметь заряд +2, чтобы дать формульной единице общий суммарный заряд, равный нулю. х + (- 2) = 0 х = +2
19
Числа окисления
Числа окисления
–2
Fe2O3 Поскольку степень окисления кислорода в соединении равна −2 и имеется три атома кислорода, железо должно иметь заряд +3, чтобы дать формулу единица, общий чистый заряд равен нулю.
|
|
2x + 3(- 2) = 0 x = +3
Цинк всегда имеет степень окисления +2 в сочетании с солью. ZnCl2, ZnS, ZnSO4, Zn3(PO4)2 Серебро всегда имеет степень окисления +1 при соединении в соли. AgCl, Ag2O, Ag2SO4, Ag3PO4
21
22
Числа окисления
Числа окисления K2Sn(OH)6 K = +1 O =- 2 H = +1 Sn = ?
Пример: Присвойте степени окисления каждому элементу в следующих соединениях: NaNO3 Na = +1 O = –2 N=? z Вычислить по правилу 3. z +1 + 3(-2) + x = 0 z x = +5
z +1 + 3(-2) + x = 0 z x = +5
|
N = +5
Sn = +4 23
| | | |
z z
2(+1) + 6(-2) + 6(+1) + x = 0 x = +4
24
Число окисления |
h4PO4
|
Н = +1 О =- 2 Р=?
Число окисления | |
| |
|
SO32O =- 2 S=? 3(-2) + x = -2 x = +4
3(+1) + 4(–2) + x = 0 =+5
S = +4
P = +5 25
26
Число окисления | | | |
Числа окисления
HCO3– O =- 2 H = +1 C=?
|
Cr2O72-
|
О = –2 Cr = ?
|
+1 + 3(–2) + х = –1 х = +4
7(–2) + 2(x) = –2 x = +6
C = +4
Cr = +6 27
Числа окисления
28
Число окисления
1
подчеркнутый элемент в FeSO4. Степень окисления железа должна быть +2, чтобы уравновесить -2 сульфат-иона. Fe = + 2 O = −2 +2 + x + 4(−2) = 0 x = +6
–OR– Степень окисления серы можно определить по иону сульфата: SO42– x + 4(–2 ) = — 2 х = +6 29
30
Число окисления
Число окисления
Определите степень окисления подчеркнутого элемента в Mg(ClO4)2.
|
Mg = + 2 O = −2
H = +1 (наименее электроотрицательный элемент) C=–4 |
+2 + 2x + 8(-2) = 0 x =+7
Определите степень окисления подчеркнутого элемента в CO2. O = – 2 (наиболее электроотрицательный элемент) C=+4
–OR– ClO4–
Определите степень окисления подчеркнутого элемента в гл.5.
x + 4(-2) = -1 x = +7
31
32
Числа окисления |
Электронный перенос
Определите степень окисления подчеркнутого элемента в H3O.
Окислительно-восстановительные реакции: REDOX | Окислители — это те элементы, которые вызывают потерю электронов (вызывают окисление) — окислители восстанавливаются, приобретая электроны. | Восстановители — это те элементы, которые отдают электроны (вызывают восстановление) — восстановители окисляются, отдавая электроны.
H = + 1 (наименее электроотрицательный элемент) O=–2 |
Определите степень окисления подчеркнутого элемента в h3O2. H = + 1 (наименее электроотрицательный элемент) O=–1 33
34
Электронный перенос
Электронный перенос
В окислительно-восстановительных реакциях реагенты переносят электроны — между реагентами происходит окисление и восстановление. 0
0
2 Na (т)
0
+
+1 −1
Cl2 (г) Æ
2 NaCl (т)
Так как мы не можем ни создавать, ни уничтожать электроны, количество переданных электронов в реакции должно быть одинаковым в обеих частях химического уравнения: 0
Чтобы определить окислитель и восстановитель, мы можем разделить реакцию реагентов в полуреакции: 0
0
+3 −2
4 Fe (т) + 3 O2 (г) Æ 0
+1
2 Fe2O3 (т) +3
реакция окисления: 1:
2 Na Æ 2 Na+ + 2 e– восстановительреакция окисления 4 Fe Æ 4 Fe3+ + 12 e- восстановитель
0
реакция восстановления::
Cl2 + 2 e- Æ 2 Cl-
реакция восстановления
−2
3 O2 + 12 e− Æ 6 O2–
oxidizing agent 36
Electron Transfer +
−
0
+
Electron Transfer −
0
Æ 2 NaCl (aq) + Br2 (т)
2 NaBr (водн.) + Cl2 (ж)
Мы можем удалить ион-спектатор (Na+) до того, как настроим полуреакции. −1 Реакция окисления
−1 Реакция окисления
+1 +6 −2
0
2 BR
—
æ BR2 +
+1 -1
+4 –2
1414 0
11111111111111111111111111111111111111111111111111111111111111111111111111119н. Реакция восстановления что окисляется и что восстанавливается путем присвоения степеней окисления всем элементам в реагентах и продуктах.-1
Cl2 + 2 e- Æ 2 Cl-
окислитель 37
38
Электронный перенос +1 +6 -2
+1 -1
9091 904 90 Электронный перенос+1 −2
h3SO4 (водн.) + 2 HI (г) Æ SO2 (г) + I2 (т) + 2 h3O Необходимо определить в реакции, какие элементы изменили степень окисления. | Степень окисления водорода одинакова в обеих частях уравнения, поэтому он не участвует в переносе электронов. | Степень окисления кислорода одинакова в обеих частях уравнения, поэтому он не участвует в переносе электронов. | Изменилась степень окисления серы и изменилась степень окисления йода.
oxidation reaction
−1
0
2 I− Æ
I2
+ 2 e−
+6
reduction reaction SO42– + 2 e− Æ
+4
SO2
39
|
Окислительно-восстановительный агент
40
Балансировка окислительно-восстановительных уравнений |
красный агент
Балансировка окислительно-восстановительных уравнений
Не всегда очевидно, как сбалансировать окислительно-восстановительные уравнения. Для этих более сложных окислительно-восстановительных реакций у нас есть система, с помощью которой можно сбалансировать уравнение по массе и по заряду.
Для этих более сложных окислительно-восстановительных реакций у нас есть система, с помощью которой можно сбалансировать уравнение по массе и по заряду.
41
|
|
|
Метод полуреакции полезен тем, что этот метод используется в электролизе. Максимально сбалансируйте уравнение без ионов-наблюдателей. Настройте полуреакции (окисление и восстановление), как мы это делали в предыдущих реакциях.
42
Балансировка окислительно-восстановительных уравнений
Метод полуреакций Правила метода полуреакций:
Балансировка полуреакций по следующим правилам: | Сначала определите, происходила ли реакция в кислых (H+) или щелочных (OH-) условиях. | Правила уравновешивания кислорода и водорода различаются в зависимости от того, протекает ли реакция в кислых или основных растворах.
Напишите неуравновешенную реакцию. Разбейте реакцию на 2 полуреакции: одну полуреакцию окисления и одну полуреакцию восстановления. Каждая реакция должна иметь полные формулы для молекул и ионов. 3. Сбалансируйте массу каждой полуреакции, добавив соответствующие стехиометрические коэффициенты. 1. 2.
3. Сбалансируйте массу каждой полуреакции, добавив соответствующие стехиометрические коэффициенты. 1. 2.
43
44
Метод полуреакций
Балансировка окислительно-восстановительных уравнений
4.
Заряды уравновешивают полуреакции путем добавления соответствующего количества электронов. Электроны будут продуктами полуреакции окисления. Электроны будут реагентами в полуреакции восстановления. 5. Умножьте каждую полуреакцию на число, чтобы число электронов в полуреакции окисления равнялось числу электронов в полуреакции восстановления. 6. Добавьте две полуреакции. 7. Удалите все общие термины и уменьшите коэффициенты до наименьших целых чисел.
В кислой среде: | Сбалансируйте кислород, добавив молекулы h3O в противоположную часть уравнения. | Сбалансируйте водород, добавив H+ в противоположную часть уравнения.
45
46
Балансирующие окислительно -восстановительные уравнения
Уравнения окислительно -восстановительных (т) + HNO3 (водн. ) Æ CO2 (г) + NO2 (г) + h3O
) Æ CO2 (г) + NO2 (г) + h3O
2 h3O + C Æ CO2 + 4 e− − − NO3 + 1e Æ NO2 + h3O Уравновешивают водород добавлением H+ к противоположному сторона. 2 h3O + C Æ CO2 + 4 e− + 4 H+ + − − 2 H + NO3 + 1e Æ NO2 + h3O
Set up the half- reactions: 0
+4
C Æ +5
NO3− + 1e−
CO2
+ 4 e−
oxidation
+4
Æ
NO2
Сбалансируйте кислород, добавив H3O на противоположную сторону. (Один h3O для каждого кислорода)
восстановление 47
48
Балансировка окислительно-восстановительных уравнений
Балансировка окислительно-восстановительных уравнений
Число e- должно быть одинаковым в обеих частях уравнения. Сбалансируйте заряд, умножив полуреакцию на соответствующее число, чтобы получить одинаковое количество электронов в обеих частях уравнения. 2 H 2O + C 4 (2 H+ + NO3- + 1e- 2 H 2O + C 8 H+ + 4 NO3- + 4 e-
Æ CO2 Æ NO2 Æ Æ
Сократите e-, воду и H+ из противоположных частей уравнений и просуммируйте оставшиеся реагенты и продукты. 2 h3O + C Æ CO2 + 4 e− + 4 H+ 4 2 + − − 8 H + 4 NO3 + 4 e Æ 4 NO2 + 4 h3O . 4 H+ + 4 NO3- + C Æ 4 NO2 + CO2 + 2 h3O
2 h3O + C Æ CO2 + 4 e− + 4 H+ 4 2 + − − 8 H + 4 NO3 + 4 e Æ 4 NO2 + 4 h3O . 4 H+ + 4 NO3- + C Æ 4 NO2 + CO2 + 2 h3O
+ 4 e — + 4 H+ + h3O)
CO2 + 4 e- + 4 H+ 4 NO2 + 4 h3O 49
Балансирующие окислительно-восстановительные уравнения
Уравновешивание уравнений окислительно-восстановительного потенциала
Добавьте H+ обратно к ионам NO3–, чтобы завершить уравнение: + C Æ
4 HNO3
50
В основных условиях: | Сбалансируйте кислород, добавив 2 молекулы OH- на сторону, которая нуждается в кислороде, и добавив одну молекулу h3O на другую сторону. | Сбалансируйте водород, добавив h3O на сторону, которая нуждается в водороде, и добавив один OH- на другую сторону.
4 NO2 + CO2 + 2 h3O
52
51
Балансировка окислительно-восстановительных уравнений
Балансировка окислительно-восстановительных уравнений
CrO42–) и восстанавливаются до ионов хлора. Напишите сбалансированное суммарное ионное уравнение для этой реакции. +3
+3
+1
+6
Сбалансируйте кислород, добавив 2 OH– на противоположную сторону. (2 OH– на каждый кислород) CrO2– + 4 OH– Æ CrO42– + 3 e– ClO– + 2 e– Æ Cl– + 2 OH–
–1
CrO2– + ClO– Æ CrO42– + Cl – Настройте полуреакции: CrO2– Æ CrO42– + 3 e– – ClO + 2 e– Æ Cl–
Уравновесьте водород, добавив один h3O на каждые два OH- на противоположной стороне. CrO2– + 4 OH– Æ CrO42– + 2 h3O + 3 e– h3O + ClO– + 2 e– Æ Cl– + 2 OH–
окислительно-восстановительный
53
54
Балансировка окислительно-восстановительных уравнений
Балансировка окислительно-восстановительных уравнений
Балансировка заряда путем умножения полуреакции на соответствующее число, чтобы получить одинаковое количество электронов в обеих частях уравнения.
Добавьте две полуреакции. Удалите все общие термины и уменьшите коэффициенты до наименьших целых чисел. 2 1 2 CrO2– + 8 OH– Æ 2 CrO42– + 4 h3O + 6 e– 3 h3O + 3 ClO– + 6 e– Æ 3 Cl– + 6 OH–
2 (CrO2– + 4 OH– Æ CrO42 – + 2 h3O + 3 e–) 3 (h3O + ClO– + 2 e– Æ Cl– + 2 OH– )
2 Cro2– + 2 OH– + 3 Clo– 2 Cro2 + 8 —
OH–
æ 2 Cro4
2–
+ 4 H3O + 6
—
2 CRO42–6
14 —2 CRO42–6
4 —2 CRO42–6
3 Cl–e–
3 h3O + 3 ClO– + 6 e– Æ 3 Cl– + 6 OH– 55
Электронный перенос |
56
Стехиометрия окислительно-восстановительных реакций
В некоторых реакциях возможно, что элемент в реагенте окисляется, а также восстанавливается. Это называется окислительно-восстановительной реакцией диспропорционирования.
Это называется окислительно-восстановительной реакцией диспропорционирования.
Окислительно-восстановительное титрование: | Можно провести предварительное титрование для определения присутствия окисляющихся или восстанавливаемых веществ. | В этой процедуре стандартом является раствор известного окислителя или восстановителя. Слайд 25
с.148
Обратите внимание, что хлор в реагенте окисляется, а также восстанавливается в ходе реакции. Мы будем делать полуреакции на уроке. 57
Стехиометрия окислительно-восстановительных реакций |
58
Стехиометрия окислительно-восстановительных реакций
Пример. Какой объем 0,200 М KMnO4 потребуется для окисления 35,0 мл 0,150 М HCl? Сбалансированная реакция:
(35 мл HCl) (0,150 М HCl) = 5,25 ммоль HCl (5,25 ммоль HCl)
2 KMnO4 + 16 HCl → 2 KCl+2 MnCl2 + 5 Cl2 + 8 h3O
2 mmol KMnO 4 = 0.656 mmol KMnO 4 16 mmol HCl 1 mL ( 0.656 mmol KMnO4 ) = 3.28 mL 0. 200 mmol KMnO 4
200 mmol KMnO 4
60
Stoichiometry of Redox Reactions
End главы 11
Пример. 40,0 мл сульфата железа (II) окисляют до железа (III) 20,0 мл 0,100 М раствора бихромата калия. Какова концентрация раствора сульфата железа (II)? Эту и другие задачи мы решим на уроке.
|
61
Окислительно-восстановительные реакции | Онлайн-учебники по химии
Окислительно-восстановительные реакции
Если между веществами происходит перенос электрона, эти реакции называются окислительно-восстановительные или окислительно-восстановительные реакции. Если атом/соединение или элемент принимают электрон, то этот процесс называется восстановлением, и наоборот, если атом/соединение или элемент отдают электрон, этот процесс называется окислением. Посмотрите на следующие примеры окислительно-восстановительных реакций;
Примеры:
1. Mg → Mg +2 + 2e —
Атом Mg теряет два электрона и окисляется.
2. С -2 → С +6 + 8e —
Ион S теряет восемь электронов и окисляется.
3. S + 2e — → S -2
Атом S получает два электрона и восстанавливается.
4. S +6 + 2e — → S +4
S +6 ион получает два электрона и восстанавливается.
5. 2Al(s) + 3Cu +2 (водн.) → 2Al +3 (водн.) + 3Cu(s)
В этой реакции нейтральный реагент Al отдает 3 электрона и окисляется, и поскольку он уменьшить Cu мы называем Al « восстановитель «, Cu изначально имеет степень окисления плюс два и он получает два электрона и восстанавливается, так как он окисляет Al мы называем его « окислитель «. Эта реакция называется окислительно-восстановительной или окислительно-восстановительной реакцией.
Некоторые важные моменты о степени окисления веществ заряд иона, например, Na + имеет степень окисления +1, S -2 имеет степень окисления -2.
3. Фтор имеет степень окисления -1 во всех соединениях.
4. Обычно водород имеет степень окисления +1, но есть некоторые исключения, когда он имеет степень окисления -1 в таких соединениях, как LiH, NaH, BaH 2 .
5. Обычно кислород имеет степень окисления -2, есть два исключения, в которых он имеет степень окисления -1, например Na 2 O 2 , H 2 O 2 и в соединении OF 2 O имеет степень окисления +2.
6. В соединении сумма степеней окисления элементов равна нулю. Например;
In K 2 CO 3 соединение позволяет мне найти степень окисления C, используя известные значения.
K имеет степень окисления +1, а O имеет степень окисления -2.
2.(+1) +(X)+3(-2)=0
X=+4
7. В многоатомном ионе сумма степеней окисления атомов равна заряду иона.
Пример:
Найти степень окисления Cr в соединении Cr 2 O 7 -2 .
O имеет степень окисления -2.
2X+7.(-2)=-2
X=+6
8. Если металл имеет более одной степени окисления, мы находим его степень окисления, используя известные значения в ионах.
Пример: Найти степени окисления Cu и N в соединении CuNO 3 .
Cu может иметь степени окисления +1 и +2 в соединениях. Нитрат NO 3 — имеет степень окисления -1, поэтому Cu должна иметь степень окисления +1.
Мы находим степень окисления N, используя соединение, как указано ниже;
CuNO 3
+1+X+3.(-2)=0
X=+5
В этом соединении N имеет степень окисления +5.
Пример: Какие из следующих реакций являются окислительно-восстановительными?
И. 2СО 2 + О 2 → 2СО 3
г. II. Mg + 2HCl → MgCl 2 + H 2
II. Mg + 2HCl → MgCl 2 + H 2
III. AgNO 3 + KCl → AgCl +KNO 3
Является окислительно-восстановительной реакцией; должно иметь место по крайней мере одно восстановление или одно окисление. Теперь исследуем данные реакции, изменяются ли степени окисления элементов или нет.
я . 2SO 2 + O 2 → 2SO 3
В SO 2 S имеет значение
S+2(-2)=0
S=+4
В SO3 S имеет степень окисления;
S+3.(-2)=0
S=+6 Таким образом, I – окислительно-восстановительная реакция.
II. Mg + 2HCl → MgCl 2 + H 2
Mg в левой части имеет степень окисления 0, однако в части продукта имеет значение;
Mg+2(-1)=0
Mg=+2
И H имеет значение +1 в соединении HCl и значение 0 в стороне продукта.
II также является окислительно-восстановительной реакцией.
III. AgNO 3 + KCl → AgCl +KNO 3
Поскольку степени окисления частиц не изменяются, эта реакция не является окислительно-восстановительной реакцией.
Ag имеет степень окисления +1, K имеет степень окисления +1, Cl имеет степень окисления -1 и NO 3 имеет степень окисления -1 в реагентах и продуктах.
Химические реакции Экзамены и решения задач
| Типы химических реакций с примерами< Предыдущая | г. Далее >Уравновешивание химических реакций с примерами |
|---|
Tags:
- oxidation
- oxidizing agent
- redox oxidation reduction reactions
- reducing agent
- reduction
Synthesis and reactivity of low-oxidation-state alkaline earth metal complexes
- «>
Анастас, П. Т. и Кирхгоф, М. М. Происхождение, текущее состояние и будущие проблемы зеленой химии. Согл. хим. Рез. 35 , 686–694 (2002).
КАС пабмед Google ученый
Гринвуд, Н. Н. и Эрншоу, А. Химия элементов 2-е изд. 107–138 (Баттерворт-Хайнеманн, 1997).
Lide, R.D. CRC Справочник по химии и физике г., 77-е изд. (CRC, 1993).
Анкер, доктор медицины и Хилл, магистр наук в Энциклопедии неорганической и бионеорганической химии (изд. Р.А. Скотт) 1–23 (John Wiley & Sons, 2017).
Хардер, С. Молекулярные гидриды металлов первой основной группы: синтетические задачи, структуры и приложения.
 Хим. коммун. 48 , 11165–11177 (2012).
Хим. коммун. 48 , 11165–11177 (2012).КАС Google ученый
Крик, С. и Вестерхаузен, М. Престижность и возрождение s — блочная химия металлов. Неорганические вещества 5 , 17 (2017).
Google ученый
Hill, M.S., Liptrot, D.J. & Weetman, C. Щелочные земли как реагенты основной группы в молекулярном катализе. Хим. соц. 45 , 972–988 (2016).
КАС пабмед Google ученый
Harder, S. Соединения щелочноземельных металлов: странности и применение (Springer, 2013).
Джонс, C. Открытые вопросы в химии группы 2 низкой степени окисления. Комм. хим. 3 , 159 (2020).
КАС Google ученый
«>Причард Х. и Скиннер Х. Концепция электроотрицательности. Хим. 55 , 745–786 (1955).
КАС Google ученый
Камбе, Н., Ивасаки, Т. и Терао, Дж. Pd-катализируемые реакции кросс-сочетания алкилгалогенидов. Хим. соц. 40 , 4937–4947 (2011).
КАС пабмед Google ученый
Смолл, Б.Л., Брукхарт, М. и Беннетт, А.М.А. Высокоактивные железо-кобальтовые катализаторы полимеризации этилена. Дж. Ам. хим. соц. 120 , 4049–4050 (1998).
КАС Google ученый
«>Болм, К., Легрос, Дж., Ле Пай, Дж. и Зани, Л. Катализируемые железом реакции в органическом синтезе. Хим. 104 , 6217–6254 (2004 г.).
КАС пабмед Google ученый
Венгер, О. С. Является ли железо новым рутением? Хим. Евро. Дж. 25 , 6043–6052 (2019).
КАС пабмед Google ученый
Аматоре, К. и Ютанд, А. Анионные промежуточные соединения Pd(0) и Pd(II) в катализируемых палладием реакциях Хека и кросс-сочетания. Согл. хим. Рез. 33 , 314–321 (2000).

КАС пабмед Google ученый
Крик, С., Герлс, Х., Ю, Л., Райхер, М. и Вестерхаузен, М. Стабильный «обратный» сэндвич-комплекс с беспрецедентным органокальцием (I): кристаллические структуры [(thf) 2 Mg(Br)-C 6 H 2 -2,4,6-Ph 3 ] и [(thf) 3 Ca{μ-C 6 H 3 — ,3,5-Ph 3 }Ca(thf) 3 ]. Дж. Ам. хим. соц. 1391 , 2977–2985 (2009 г.).
Google ученый
Грин, С. П., Джонс, К. и Сташ, А. Стабильные соединения магния (I) со связями Mg–Mg. Наука 318 , 1754–1757 (2007).
КАС пабмед Google ученый
Эрроусмит, М. и др. Нейтральные нульвалентные s -блочные комплексы с сильными кратными связями.
 Нац. хим. 8 , 890–894 (2016).
Нац. хим. 8 , 890–894 (2016).КАС Google ученый
Грин, С. П., Джонс, К. и Сташ, А. Стабильные аддукты димерного соединения магния (I). Анжю. хим. Междунар. Эд. 47 , 9079–9083 (2008).
КАС Google ученый
Overgaard, J., Jones, C., Stasch, A. & Iversen, B.B. Экспериментальное исследование электронной плотности характера связи Mg-Mg в димере магния (I). Дж. Ам. хим. соц. 131 , 4208–4209 (2009).
КАС пабмед Google ученый
Bonyhady, S.J. et al. Стабилизированные β-дикетимином димеры магния (I) и комплексы гидрида магния (II): синтез, характеристика, образование аддуктов и исследования реакционной способности. хим. Евро. J. 16 , 938–955 (2010).
КАС пабмед Google ученый
«>Бутланд, А. Дж., Данге, Д., Сташ, А., Марон, Л. и Джонс, К. Двухкоординированные димеры магния (I), стабилизированные сверхобъемными амидными лигандами. Анжю. хим. Междунар. Эд. 55 , 9239–9243 (2016).
КАС Google ученый
Jones, D.D.L., Douair, I., Maron, L. & Jones, C. Фотохимически активированные соединения димагния (I): реагенты для восстановления и селективной активации связи C-H инертных аренов. Анжю. хим. Междунар. Эд. 60 , 7087–7092 (2021).
КАС Google ученый
Rösch, B. et al. Сильно восстанавливающие комплексы магния(0).
 Природа 592 , 717–721 (2021).
Природа 592 , 717–721 (2021).ПабМед Google ученый
Wang, G. et al. Стабильный кристаллический катион-радикал бериллия. Дж. Ам. хим. соц. 142 , 4560–4564 (2020).
КАС пабмед Google ученый
Wang, G. et al. Выделение циклического (алкил) (амино) карбен-висмутинидена с участием комплекса бериллия (0). хим. Евро. J. 25 , 4335–4339 (2019).
КАС пабмед Google ученый
млн лет, М. и др. Mg-Mg-связанные соединения с N , N ‘-дипп-замещенными фенантрен-диамидо- и o -фенилендиаминолигандами. Далтон Транс. 48 , 2295–2299 (2019).
КАС пабмед Google ученый
«>Schlenk, W. & Schlenk, W.Jr Über die Konstitution der Grignardschen Magnesiumverbindungen. Бер. Дтч. хим. Гэс. 62 , 920–924 (1929).
Google ученый
Сильверман, Г. С. и Ракита, П. Е. Справочник реактивов Гриньяра (CRC, 1996).
Вестерхаузен, М. 100 лет после Гриньяра: на каком месте сегодня находится металлоорганическая химия тяжелых щелочноземельных металлов? Анжю. хим. Междунар.
 Эд. 40 , 2975–2977 (2001).
Эд. 40 , 2975–2977 (2001).КАС Google ученый
Вестерхаузен, М., Кох, А., Герлс, Х. и Крик, С. Тяжелые реагенты Гриньяра: синтез, физические и структурные свойства, химическое поведение и реакционная способность. Хим. Евро. J. 23 , 1456–1483 (2017).
КАС пабмед Google ученый
Пельцер, Р. М., Эйзенштейн, О., Нова, А. и Каселла, М. Как динамика растворителя контролирует равновесие Шленка реагентов Гриньяра: вычислительное исследование CH 3 MgCl в тетрагидрофуране. J. Phys. хим. B 121 , 4226–4237 (2017).
КАС пабмед Google ученый
Сариш С.П., Нембена С., Нагендран С. и Роески Х.В. Химия растворимых комплексов β-дикетиминатощелочноземельных металлов со связями М-Х (M = Mg, Ca, Sr; X = OH, галогениды , Х).
 Акк. хим. Рез. 44 , 157–170 (2011).
Акк. хим. Рез. 44 , 157–170 (2011).КАС пабмед Google ученый
Edelmann, F. T. N — силилированные бензамидины: универсальные строительные блоки в основной группе и координационной химии. Координ. хим. 137 , 403–481 (1994).
Google ученый
Jones, C. Объемные гуанидинаты для стабилизации металлоциклов с низкой степенью окисления. Координ. хим. 254 , 1273–1289 (2010).
КАС Google ученый
Ruspic, C. & Harder, S. Большие лиганды для стабилизации небольших функциональных групп в химии кальция. Неорг. хим. 46 , 10426–10433 (2007).
КАС пабмед Google ученый
Нестеров В.
 и др. NHC в химии главных групп. хим. Ред. 118 , 9678–9842 (2018 г.).
и др. NHC в химии главных групп. хим. Ред. 118 , 9678–9842 (2018 г.).КАС пабмед Google ученый
Ардуенго А.Дж., Дэвидсон Ф., Крафчик Р., Маршалл В.Дж. и Тамм М. Аддукты карбенов с металлоценами группы II и XII. Металлоорганические соединения 17 , 3375–3382 (1998).
КАС Google ученый
Wolf, R. & Uhl, W. Кластеры металлов основной группы, стабилизированные N-гетероциклическими карбенами. Анжю. хим. Междунар. Эд. 48 , 6774–6776 (2009).
КАС Google ученый
Хопкинсон, М. Н., Рихтер, К., Шедлер, М. и Глориус, Ф. Обзор N-гетероциклических карбенов. Природа 510 , 485–496 (2014).
КАС пабмед Google ученый
«>Тернер, З. Р. и Баффет, Дж.-К. Циклические (алкил)(амино)карбеновые комплексы 1 и 2 групп. Далтон Транс. 44 , 12985–12989 (2015).
КАС пабмед Google ученый
Wong, Y. O. et al. Два карбена против одного в химии магния: синтез терминального дигалогенида, диалкила и реактивов Гриньяра. Металлоорганические соединения 38 , 688–696 (2019).
КАС Google ученый
Soleilhavoup, M. & Bertrand, G. Циклические (алкил)(амино)карбены (CAAC): стабильные карбены на подъеме.
 Согл. хим. Рез. 48 , 256–266 (2015).
Согл. хим. Рез. 48 , 256–266 (2015).КАС пабмед Google ученый
Мелайми, М., Джаззар, Р., Солейлхавоуп, М. и Бертран, Г. Циклические (алкил)(амино)карбены (CAAC): последние разработки. Анжю. хим. Междунар. Эд. 56 , 10046–10068 (2017).
КАС Google ученый
Бейли, П.Дж., Дик, С.М., Фабр, С., Парсонс, С. и Йеллоулиз, Л. Комплексообразование диметилмагния с α-дииминами; структурная и ЭПР-характеристика продуктов одноэлектронного и алкильного переноса. Dalton Trans 2006 , 1602–1610 (2006).
Google ученый
Freeman, L. A. et al. Ступенчатое восстановление магния и бериллия: совместное действие карбенов с окислительно-восстановительными невинными α-дииминами. Неорг. хим. 58 , 10554–10568 (2019).

КАС пабмед Google ученый
Федушкин И. Л., Хвойнова Н. М., Скатова А. А., Фукин Г. К. Окислительное присоединение фенилацетилена через разрыв связи С–Н с образованием Mg II – комплекс dpp-bian: молекулярная структура [Mg{dpp-bian(H)}(C≡CPh)(thf) 2 ] и его продукт внедрения дифенилкетона [Mg(dpp-bian) ·− {OC (Ph 2 )C≡CPh}(thf)]. Анжю. хим. Междунар. Эд. 42 , 5223–5226 (2003).
КАС Google ученый
Федушкин И.Л. и др. Мономерные комплексы магния и кальция, содержащие жесткие дианионные 1,2-бис[(2,5-ди- трет -бутилфенил)имино]аценафтеновый (dtb-BIAN) и 1,2-бис[(2-бифенил)имино]аценафтеновый (bph-BIAN) лиганды. З. Анорг. Allg. хим. 630 , 501–507 (2004).
КАС Google ученый
«>Федушкин И. Л., Чудакова В. А., Скатова А. А., Фукин Г. К. Безрастворные комплексы дииминовых лигандов щелочных и щелочноземельных металлов. Гетероат. хим. 16 , 663–670 (2005).
КАС Google ученый
Гао Дж., Лю Ю., Чжао Ю., Ян X.-J. и Sui, Y. Синтезы и структуры комплексов магния с восстановленными α-дииминовыми лигандами. Металлоорганические соединения 30 , 6071–6077 (2011).
КАС Google ученый
Ren, W., Fang, X., Sun, W., Gu, D. & Yu, Y. Комплекс магния, содержащий восстановленный 2,2′-бипиридильный лиганд: синтез, структура, реакционная способность и расчет исследования.
 Дж. Органомет. хим. 842 , 47–53 (2017).
Дж. Органомет. хим. 842 , 47–53 (2017).КАС Google ученый
Рен, В. и Гу, Д. Азобензонил-анион-радикальный комплекс магния: синтез, структура и исследования реакционной способности. Неорг. хим. 55 , 11962–11970 (2016).
КАС пабмед Google ученый
Couchman, S.A., Holzmann, N., Frenking, G., Wilson, D.J.D. & Dutton, JL. Химия бериллия безопасным путем: теоретическая оценка соединений бериллия с низкой степенью окисления. Далтон Транс. 42 , 11375–11384 (2013).
КАС пабмед Google ученый
Мерритт, Дж. М., Бондибей, В. Е. и Хевен, М. С. Димер бериллия — захвачен в процессе связывания. Наука 324 , 1548–1551 (2009).
КАС пабмед Google ученый
«>Юань, К., Чжао, X.-Ф., Ву, Ю.-Б. и Ван, X. Сверхкороткие расстояния между бериллием и бериллием, соперничающие с расстояниями между пятикратными связями металл-металл между переходными металлами. Анжю. хим. Междунар. Эд. 55 , 15651–15655 (2016).
КАС Google ученый
Bondybey, V.E. & English, JH. Лазерное испарение бериллия: спектр газовой фазы и молекулярный потенциал Be 2 . J. Chem. физ. 80 , 568–570 (1984).
КАС Google ученый
Патковски К.
 , Шпирко В. и Салевич К. О неуловимом двенадцатом колебательном состоянии димера бериллия. Наука 326 , 1382–1384 (2009).
, Шпирко В. и Салевич К. О неуловимом двенадцатом колебательном состоянии димера бериллия. Наука 326 , 1382–1384 (2009).КАС пабмед Google ученый
Шарма С., Янаи Т., Бут Г. Х., Умригар С. Дж. и Чан Г. К.-Л. Спектроскопическая точность напрямую из квантовой химии: применение к основному и возбужденному состояниям димера бериллия. J. Chem. физ. 140 , 104112 (2014).
ПабМед Google ученый
Дейбл, М.Дж., Кесслер, М., Гасперих, К.Е. и Джордан, К.Д. Расчет энергии связи димера бериллия методом квантового Монте-Карло. г. J. Chem. физ. 143 , 084116 (2015).
ПабМед Google ученый
Лю, X. и др. Двойные связи бериллий–бериллий π в октаэдрическом кластере Be 2 (μ 2 -X) 4 (X = Li, Cu, BeF).
 Хим. физ. лат. 20 , 23898–23902 (2018).
Хим. физ. лат. 20 , 23898–23902 (2018).КАС Google ученый
Наглав, Д., Бюхнер, М. Р., Бендт, Г., Краус, Ф. и Шульц, С. В глуши — автостопщик по химии бериллия. Анжю. хим. Междунар. Эд. 55 , 10562–10576 (2016).
КАС Google ученый
Бюхнер, М. Р. Недавний вклад в координационную химию бериллия. Хим. Евро. J. 25 , 12018–12036 (2019).
КАС пабмед Google ученый
Херрманн, В. А., Рунте, О. и Артус, Г. Синтез и структура ионного комплекса бериллий-карбен. Дж. Органомет. хим. 501 , C1–C4 (1995).
КАС Google ученый
Шустер, Дж. К., Рой, Д. К., Ленчик, К., Мис, Дж. и Брауншвейг, Х.
 Новые результаты химии бериллия: аддукты оснований Льюиса для реакций отщепления соли. Неорг. хим. 58 , 2652–2658 (2019).
Новые результаты химии бериллия: аддукты оснований Льюиса для реакций отщепления соли. Неорг. хим. 58 , 2652–2658 (2019).КАС пабмед Google ученый
Walley, J., Wong, Y.-O., Freeman, L., Dickie, D. & Gilliard, R. N-гетероциклические арил- и алкоксиды бериллия и магния на карбеновом носителе. Катализаторы 9 , 934 (2019).
КАС Google ученый
Soleilhavoup, M. & Bertrand, G. Борилены: новый класс соединений. Анжю. хим. Междунар. Эд. 56 , 10282–10292 (2017).
КАС Google ученый
Сингх А. П. и др. Синглетное бирадикалоидное соединение цинка и его нерадикальный аналог. Дж. Ам. хим. соц. 135 , 7324–7329 (2013).
КАС пабмед Google ученый
«>Бондыбей В.Е. Электронная структура и связывание Be 2 . Хим. физ. лат. 109 , 436–441 (1984).
КАС Google ученый
Бреа, О., Мо, О., Яньес, М., Алькорта, И. и Эльгуэро, Дж. О существовании внутримолекулярных одноэлектронных связей Be-Be. хим. коммун. 52 , 9656–9659 (2016).
КАС Google ученый
Саха, Р., Пан, С., Мерино, Г. и Чаттарадж, П.К. Беспрецедентная ситуация связывания в жизнеспособном E 2 (NHBMe) 2 (E = Be, Mg; 2 B) комплексы: нейтральные E 2 образуют одинарную ковалентную связь E-E.
 Анжю. хим. Междунар. Эд. 58 , 8372–8377 (2019).
Анжю. хим. Междунар. Эд. 58 , 8372–8377 (2019).КАС Google ученый
Walley, J. E. et al. s -Химия блочных карбодикарбенов: C( sp 3 )–H активация и циклизация, опосредованные бериллиевым центром. Хим. коммун. 55 , 1967–1970 (2019).
Google ученый
Czernetzki, C. et al. Нейтральный радикал бериллия (I). Анжю. хим. Междунар. Эд. 60 , 20776–20780 (2021).
КАС Google ученый
Папаро, А. и др. N-гетероциклические карбеновые, карбодифосфорановые и дифосфиновые аддукты дигалогенидов бериллия: синтез, характеристика и исследования восстановления. Далтон Транс. 50 , 7604–7609 (2021).
КАС пабмед Google ученый
«>Paparo, A. & Jones, C. Галогенидные комплексы бериллия, включающие нейтральные или анионные лиганды: потенциальные предшественники для химии бериллия. Хим. Asian J. 14 , 486–490 (2019).
КАС пабмед Google ученый
Walley, J. E. et al. Расширение кольца карбодикарбенового бериллацикла, промотируемое циклическим (алкил) (амино) карбеном. Неорг. хим. 58 , 11118–11126 (2019).
КАС пабмед Google ученый
Папаро, А., Смит, К. Д. и Джонс, К. Диагонально связанные s — и p -блочные металлы объединяют усилия: синтез и характеристика комплексов с ковалентными связями бериллий-алюминий.
 Анжю. хим. Междунар. Эд. 58 , 11459–11463 (2019).
Анжю. хим. Междунар. Эд. 58 , 11459–11463 (2019).КАС Google ученый
Рой Д.К. и др. Выделение и реакционная способность антиароматического соединения s -блочного металла. Анжю. хим. Междунар. Эд. 60 , 3812–3818 (2020).
Google ученый
Тюрина Л.А. и др. Синтез кластерных алкильных и арильных реактивов Гриньяра в растворе. Металлоорганические соединения 23 , 1349–1351 (2004).
КАС Google ученый
Веласкес А., Фернандес И., Френкинг Г. и Мерино Г. Мультиметаллоцены. Теоретическое исследование. Металлоорганические соединения 26 , 4731–4736 (2007).
КАС Google ученый
Xie, Y.
 , Schaefer, H. F. & Jemmis, E. D. Характеристики новых многослойных димеров бериллия, магния и кальция: C 5 H 5 BeBeC 5 H 7 7 H 8, 916 5 MgMgC 5 H 5 и C 5 H 5 CaCaC 5 H 5 . Хим. физ. лат. 402 , 414–421 (2005).
, Schaefer, H. F. & Jemmis, E. D. Характеристики новых многослойных димеров бериллия, магния и кальция: C 5 H 5 BeBeC 5 H 7 7 H 8, 916 5 MgMgC 5 H 5 и C 5 H 5 CaCaC 5 H 5 . Хим. физ. лат. 402 , 414–421 (2005).КАС Google ученый
Петри С. Металлоорганическая химия дальнего космоса. австр. Дж. Хим. 56 , 259–262 (2003).
КАС Google ученый
Кручинский Т. и др. Из MgBr через одноэлектронный перенос (SET) в парамагнитное соединение Mg(II) и обратно в Mg(I): [MgBr(L 1 ) · ] 2 и [K(thf) 3 ] 2 [Mg 2 (L 1 ) 2 ], L 1 = RN=C(Me)C(Me)=NR, R = 2,6-диизопропил Хим.
 коммун. 50 , 15677–15680 (2014).
коммун. 50 , 15677–15680 (2014).Google ученый
Arras, J., Kruczyński, T., Bresien, J., Schulz, A. & Schnöckel, H. Галогенид магния(I) по сравнению с металлическим магнием: различия в энергии реакции и реакционной способности, отслеживаемые в процессах восстановления связей P-Cl . Анжю. хим. Междунар. Эд. 131 , 726–731 (2019).
Google ученый
Wang, X. & Andrews, L. Инфракрасные спектры молекул гидрида магния, комплексов и твердого дигидрида магния. г. J. Phys. хим. А 108 , 11511–11520 (2004 г.).
КАС Google ученый
Jasien, PG & Dykstra, CE Простейший магниевый кластер Гриньяра. Теоретические доказательства сильной стабилизации металлов RMg 2 X. Дж. Ам. хим. соц. 105 , 2089–2090 (1983).

КАС Google ученый
Джонс, К. Димерные β-дикетиминаты магния(I): новый класс квазиуниверсальных восстановителей. Нац. Преподобный Хим. 1 , 0059 (2017).
КАС Google ученый
Хубер, Р. и Вебер, Х.Г. Комплекс столкновения в реакции обмена Na + Na 2 . I. Эксперимент по накачиванию орто – пара на Na 2 . Хим. физ. 37 , 173–180 (19{+}\) димеры. Физ. Ред. А 64 , 052717 (2001).
Google ученый
Террабуйо, Л. А., Теодоро, Т. К., Матта, К. Ф. и Хайдуке, Р. Л. А. Неядерные аттракторы в гетероядерных двухатомных системах. J. Phys. хим. А 120 , 1168–1174 (2016).
КАС пабмед Google ученый
«>Платтс, Дж. А., Овергаард, Дж., Джонс, К., Иверсен, Б. Б. и Сташ, А. Первая экспериментальная характеристика неядерного аттрактора в димерном соединении магния (I). J. Phys. хим. А 115 , 194–200 (2011).
КАС пабмед Google ученый
Yuvaraj, K., Douair, I., Paparo, A., Maron, L. & Jones, C. Восстановительная тримеризация CO до дельта-дианиона с использованием активированных соединений магния (I). Дж. Ам. хим. соц. 141 , 8764–8768 (2019).
КАС пабмед Google ученый
Boutland, A.J. et al.
 Обратимое внедрение связи C=C в димеры магния(I): образование высокоактивных соединений 1,2-димагнезиоэтана. Дж. Ам. хим. соц. 139 , 18190–18193 (2017).
Обратимое внедрение связи C=C в димеры магния(I): образование высокоактивных соединений 1,2-димагнезиоэтана. Дж. Ам. хим. соц. 139 , 18190–18193 (2017).КАС пабмед Google ученый
Lalrempuia, R. et al. Активация CO гидрированными димерами магния (I): стерически контролируемое образование этендиолатных и циклопропантриолатных комплексов. Дж. Ам. хим. соц. 137 , 8944–8947 (2015).
КАС пабмед Google ученый
Бейквелл, К., Уайт, А.Дж.П. и Криммин, М.Р. Добавление связей углерод-фтор к связи Mg(I)-Mg(I): эквивалент образования Гриньяра в растворе. Дж. Ам. хим. соц. 138 , 12763–12766 (2016).
КАС пабмед ПабМед Центральный Google ученый
Папаро, А. и др. Восстановительная гексамеризация CO с участием восстановителей магния (I) и [Mo (CO) 6 ]: синтез четко определенных комплексов бензолгексолата магния.
 Анжю. хим. 133 , 640–644 (2021).
Анжю. хим. 133 , 640–644 (2021).Google ученый
Rösch, B. et al. Поляризация связи Mg–Mg, индуцированная сверхобъемным β-дикетиминатным лигандом. Хим. коммун. 56 , 11402–11405 (2020).
Google ученый
Turner, ZR. Химически невинные циклические (алкил)(амино)карбены: перегруппировка лигандов, активация связей C-H и C-F. хим. Евро. J. 22 , 11461–11468 (2016).
КАС пабмед Google ученый
Hicks, J., Juckel, M., Paparo, A., Dange, D. & Jones, C. Многограммовые синтезы соединений магния (I) с использованием галогенидов щелочных металлов на носителе в качестве диспергируемых восстановителей. Металлоорганические соединения 37 , 4810–4813 (2018).
КАС Google ученый
«>Rösch, B. et al. Комплексообразование и восстановление азота на низковалентный кальций. Наука 371 , 1125–1128 (2021).
ПабМед Google ученый
Wu, X. et al. Наблюдение за комплексами щелочноземельных металлов M(CO) 8 (M = Ca, Sr или Ba), которые имитируют переходные металлы. Наука 361 , 912–916 (2018).
КАС пабмед Google ученый
«>Кох, Д., Чен, Ю., Голуб, П. и Манжос, С. Ответ на «Комментарий к «Пересмотру обратной связи π : влияние орбиталей d на связи металл-СО и лиганд» красные смещения» Г. Френкинга и С. Пэна, Phys. хим. хим. физ., 201922. Физ. хим. хим. физ. 22 , 5380–5382 (2020).
КАС пабмед Google ученый
Pan, S. & Frenking, G. Комментарий к статье «Пересмотр обратных связей π: влияние d-орбиталей на связи металл-CO и красные смещения лиганда» Д. Коха, Ю. Чена, П. Голуба и С. Манжос, физ. хим. хим. Phys., 2019, 21, 20814. Chem. физ. лат. 22 , 5377–5379 (2020).

КАС Google ученый
Чжао, Л., Пан, С., Чжоу, М. и Френкинг, Г. Ответ на комментарий к «Наблюдению за щелочноземельными комплексами M(CO) 8 (M = Ca, Sr или Ba) которые имитируют переходные металлы». Наука 365 , eaay5021 (2019).
КАС пабмед Google ученый
Чжоу М. и Френкинг Г. Химия переходных металлов более тяжелых атомов щелочноземельных металлов Ca, Sr и Ba. Согл. хим. Рез. 54 , 3071–3082 (2021).
КАС пабмед Google ученый
Gilliard, R. J. et al. Выделение циклического (алкил) (амино) карбен-висмутинидена с участием комплекса бериллия (0). Хим. Евро. J. 25 , 4335–4339 (2019).
ПабМед Google ученый
Power, P. P. Main элементы -группы как переходные металлы. Природа 463 , 171–177 (2010).
КАС пабмед Google ученый
Рёш, Б. и Хардер, С. Новые горизонты в химии металлов группы 2 с низкой степенью окисления. Хим. коммун. 57 , 9354–9365 (2021).
Google ученый
Накамура М., Мацуо К., Ито С. и Накамура Э. Катализируемое железом перекрестное сочетание первичных и вторичных алкилгалогенидов с арильными реагентами Гриньяра. Дж. Ам. хим. соц. 126 , 3686–3687 (2004).
КАС пабмед Google ученый
Stasch, A. & Jones, C. Стабильные димерные соединения магния(I): от химических ориентиров до универсальных реагентов. Далтон Транс. 40 , 5659–5672 (2011).
КАС пабмед Google ученый
Liu, Y., Li, S., Yang, X.-J., Yang, P. & Wu, B. Связь магний-магний, стабилизированная дважды восстановленным α-диимином: синтез и структура [K(THF ) 3 ] 2 [LMg-MgL] (L = [(2,6- i Pr 2 C 6 H 3 )NC(Me)] 6
2 2 J. Am. Chem. Soc. 131 , 4210–4211 (2009). пабмед Google ученыйBellemin-Laponnaz, S. & Dagorne, S. Группа 1 и 2 и ранние комплексы переходных металлов, несущие N-гетероциклические карбеновые лиганды: координационная химия, реакционная способность и приложения. хим. Ред. 114 , 8747–8774 (2014).
КАС пабмед Google ученый
Федушкин И. Л., Морозов А. Г., Рассадин О. В., Фукин Г. К. Присоединение нитрилов к щелочноземельным комплексам 1,2-бис[(фенил)имино]аценафтенов. Хим. Евро. J. 11 , 5749–5757 (2005).
КАС пабмед Google ученый
De, S. & Parameswaran, P. Нейтральные трехкоординированные соединения бериллия (0) — изоструктурные BH 3 , но изоэлектронный NH 3 . Далтон Транс. 42 , 4650–4656 (2013).
КАС пабмед Google ученый
Gilliard, R. J. et al. s-Block множественные связи: выделение имидокомплекса бериллия. Анжю. хим. Междунар. Эд. 60 , 9407–9411 (2021).
Google ученый
Эроусмит, М. и др. Трехкоординированные β-дикетиминаты бериллия: синтез и восстановительная химия. Неорг. хим. 51 , 13408–13418 (2012).
КАС пабмед Google ученый
Тимергазин К.К. и Песлхербе Г.Х. Неядерный аттрактор электронной плотности как проявление сольватированного электрона. г. J. Chem. физ. 127 , 064108 (2007).
ПабМед Google ученый
Крик, С., Герлс, Х. и Вестерхаузен, М. Выяснение механизма образования обратного сэндвичевого комплекса Ca(I) [(thf) 3 Ca(μ-C 6 H 3 -1,3,5-Ph 3 )Ca(thf) 3 ] и стабильность арилзамещенных фенилкальциевых комплексов. Дж. Ам. хим. соц. 132 , 12492–12501 (2010).
КАС пабмед Google ученый
Кох Д., Чен Ю., Голуб П. и Манжос С. Повторное посещение 9Обратная связь 1901 π : влияние орбиталей d на связи металл-CO и красные смещения лигандов. Хим. физ. лат. 21 , 20814–20821 (2019).
КАС Google ученый
Ссылки для скачивания
Гидрид щелочноземельных металлов – обзор
ScienceDirectРегистрацияВойти
PlusДобавить в Mendeley Джеймс Э. Хаус, Кэтлин А. Хаус, описательная неорганическая химия (третье издание), 2016 г.
Хаус, Кэтлин А. Хаус, описательная неорганическая химия (третье издание), 2016 г.
с низкой электроотрицательностью может образовывать ионы гидрида, отдавая электроны водороду. Водород имеет сродство к электрону -74,5 кДж моль
-1 , но этого недостаточно для преодоления энергии ионизации металла, если бы образовалась только пара ионов. Процесс становится энергетически выгодным, когда образуется твердый кристалл, а твердые гидриды известны для элементов IA и IIA групп периодической таблицы. Как правило, эти соединения могут быть образованы прямым соединением элементов.(7.20)2 M + H 2 → 2 MH
Реакцию проводят при температуре около 400 °C для натрия, калия и рубидия и примерно при 700 °C для лития. Также можно использовать соединения металлов, такие как нитриды.
(7,21)Na 3 N + 3 H 2 → 3 NaH + NH 3
Ионные гидриды представляют собой белые твердые вещества с высокими температурами плавления, а все гидриды щелочных металлов имеют кристаллическую структуру хлорида натрия. . Поскольку они напоминают соли щелочных и щелочноземельных металлов, ионные гидриды часто называют солевыми или солевыми гидридами. Свойства гидридов щелочных металлов показаны в Таблице 7.3, а свойства гидридов щелочноземельных металлов показаны в Таблице 7.4.
. Поскольку они напоминают соли щелочных и щелочноземельных металлов, ионные гидриды часто называют солевыми или солевыми гидридами. Свойства гидридов щелочных металлов показаны в Таблице 7.3, а свойства гидридов щелочноземельных металлов показаны в Таблице 7.4.
Таблица 7.3. Selected Properties of the Group I Hydrides
| Compound | ΔHfo (kJ mol −1 ) | U (kJ mol −1 ) | H − Radius (pm) | Apparent Charge on H ( e units) | Density Hydride (g cm −3 ) | Density Metal (g cm −3 ) |
|---|---|---|---|---|---|---|
| LiH | −89.1 | 916 | 136 | −0.49 | 0.77 | 0.534 |
| NaH | −59.6 | 808 | 146 | −0. 50 50 | 1.36 | 0.972 |
| KH | −57.7 | 720 | 152 | −0.60 | 1.43 | 0.859 |
| RbH | −47.7 | 678 | 153 | −0.63 | 2.59 | 1.525 |
| CSH | −42,6 | 644 | 154 | -0,65 | 3,41 | 1,903 |
Таблица 7.4. Некоторые свойства щелочных земных гидридов
| Соединение | ΔHFO (KJ MOL −1 ) | Являющийся заряд на H ( E UNITS)27277 2-19377 9377 2-1
1613 + . Из данных, представленных в Таблице 7.3, очевидно, что радиус, присвоенный H − в Li–H, меньше, чем в других гидридах группы IA. Считается, что связь Li–H имеет в значительной степени ковалентный характер. Вероятно, более высокая ковалентность в этом соединении по сравнению с другими гидридами щелочных металлов является результатом более высокого потенциала ионизации Li и того факта, что орбиталь 1 s водорода и 2 s орбиталь лития имеют одинаковый размер. Огромная разница в размерах между 1 s H и 3 s или 4 s Na или K снижают эффективность перекрытия. Кроме того, тот факт, что Na и K имеют более низкий потенциал ионизации, чем Li, делает NaH и KH более ионными, чем LiH. Ион H — представляет собой крупную мягкую электронную частицу, которая легко поляризуется, поэтому электронная плотность будет стягиваться к меньшему иону, такому как Li + , в большей степени, чем к другим ионам металлов группы IA. Расплавленные гидриды групп IA и IIA являются хорошими электрическими проводниками, при этом на аноде выделяется водород в результате окисления H − . (7.22)2 H − → H 2 + 2e − Щелочной или щелочноземельный металл восстанавливается на катоде. Доминирующей особенностью химии ионных гидридов является сильно основной характер иона H − . Все ионные гидриды легко реагируют с протонными растворителями с образованием газообразного водорода и основания, более слабого, чем H — . (7,23)H − + H 2 O → OH — +H 2 (7,24) H — +ROH → RO — +H 2 (7.25) H -+NH4 → NH3–+H3 4 (7.25) H -+NH4 → NH3–+H34 (7.25) H -+NH4 → NH3-109114 (7.25) H -+NH4 → NH3-11114 (7.25). пару электронов, он также может функционировать как основание Льюиса. Например, известно много координационных соединений, в которых гидрид-ион присутствует в качестве лиганда. Одними из самых простых из них являются ионы тетрагидридоалюмината (III), Alh5- и тетрагидридобората (III). Хотя эти виды в значительной степени ковалентны, их можно рассматривать как возникающие в результате координации четырех H — ионов в Al 3+ и B 3+ ионов. Соли этих комплексных ионов LiAlH 4 и NaBH 4 широко используются в качестве гидрирующих (восстановительных) реагентов в реакциях органического синтеза. Их также можно использовать для получения других гидридов по реакциям, таким как Одними из самых простых из них являются ионы тетрагидридоалюмината (III), Alh5- и тетрагидридобората (III). Хотя эти виды в значительной степени ковалентны, их можно рассматривать как возникающие в результате координации четырех H — ионов в Al 3+ и B 3+ ионов. Соли этих комплексных ионов LiAlH 4 и NaBH 4 широко используются в качестве гидрирующих (восстановительных) реагентов в реакциях органического синтеза. Их также можно использовать для получения других гидридов по реакциям, таким как(7.26)MR 2 + 2 LiAlH 4 → MH 2 + 2 LiAlH 3 R Zn, где Md=, Zn , или Mg и R = CH 3 или C 2 H 5 . Из-за большого размера электронное облако H − легко поляризуется, поэтому H − является мягкой основой. Следовательно, обычно образуются комплексы с переходными металлами, в которых металлы являются мягкими кислотами Льюиса. Просмотреть главуКнига покупок Прочитать главу полностью URL: https://www.sciencedirect.com/science/article /B9780128046975000075 Костич Н.М., Л.-М. Dutcă, in Comprehensive Coordinated Chemistry II, 2003 6.4.7.4 Водород Семейство гидридов в твердом состоянии теперь включает элементы Li 2 (PdH 2 ), Na 21677 2 ), NaBa(PdH 3 ), Sr 2 (PdH 4 ) и Ba 2 (PdH 4 ). 888–891 Кроме того, эти гидриды могут быть довольно удобно получены путем горячего спекания прессованных порошковых смесей бинарных гидридов щелочных или щелочноземельных металлов с Pd в водороде. Гидриды металлов, содержащие комплексы переходного металла (ТМ) с водородом, причем переходный металл находится в формально низкой степени окисления, представляют фундаментальный интерес для выяснения того, как электронно-богатый атом металла может быть стабилизирован без доступа к обычный механизм снижения электронной плотности за счет «обратного донорства» на подходящие орбитали лиганда. Реакцией электроположительных щелочных или щелочноземельных металлов ( s -элементов) с переходными металлами 7, 8, 9 и 10 групп в присутствии водорода было синтезировано большое количество интересных тройных и четвертичных комплексных гидридов переходных металлов. Хотя ни один из переходных металлов не образует стабильных бинарных гидридов, за исключением палладия, гидриды на основе богатых водородом комплексов TM обладают значительно более высокой емкостью хранения, чем сплавы для хранения водорода, коммерчески доступные в начале двадцать первого века. Для гидридов палладия образование комплексов [Pd 0 H 2 ] предпочтительнее, чем более распространенное квадратно-плоское расположение в [Pd II H 4 ]·Na 2 PdH 4 , содержащий последний четырехкоординированный комплекс, был синтезирован, но мог быть получен только при экстремальном давлении 2 кбар H 2 . 893 K 2 PdH 4 , содержащий более крупный и электроположительный ион калия, был синтезирован при более умеренном давлении. 895 Оба гидрида являются неметаллическими, а расстояния PdH короткие, 1,61 Å и 1,63 Å соответственно, что указывает на более обычную ковалентную связь, чем более длинные расстояния PdH, 1,68 Å, в металлическом Li 2 PdH 2 и Na 2 PdH 2 гидриды. Четвертичный гидрид NaBaPdH 3 содержит беспрецедентные 16-электронные комплексы [PdH 3 ], которые содержат формально нульвалентный палладий с плоской тригональной D 3 h симметрией. Просмотреть главуКнига покупок Прочитать главу полностью URL: https://www.sciencedirect.com/science/article/pii/B008043748 in Chemistry, Molecular Sciences and Chemical Engineering, 2021 7.4 Катализируемый обмен H/D Соединения, меченные дейтерием или тритием, находят широкое применение во многих научных дисциплинах, хотя в основном используются для ЯМР-спектроскопии, кинетических исследований и в качестве молекулярных маркеров по химии, биологии и физике. 195,196 Развитие методов высокоэффективной масс-спектрометрии (МС) и жидкостной хроматографии-масс-спектрометрии (ЖХ-МС) еще больше увеличило спрос на дейтерированные молекулы. Введение дейтерия в органические молекулы обычно осуществляется двумя путями. В 2017 г. ГИЭ между гидридом кальция [(Me 4 TACD) 2 Ca 2 (μ-H) 2 ][B(C 6 H — 4 4 9 t Bu) 4 ] 2 ( 60 ) и D 2 , каталитическое получение HD из равномолярной смеси H 2 и Д 2 . Рис. 81. Предполагаемый механизм дейтерирования и анионной деградации [(Me 3 TACD) 3 Sr 3 H 2 ][SiPh 3 ] в присутствии H 2 /D 2 . Также был продемонстрирован ГИЭ между комплексом гидрида стронция [{BDI DiPeP }Sr(μ-H)] 2 ( 93 ) и дейтерированным бензолом при нагревании до 60 °C (рис. 82). 193 Когда тот же комплекс подвергался воздействию D 2 (1,5 бар), дейтерированное соединение 93 -D 2 и HD образовывались в течение 2 ч при 20 °C без признаков разложения комплекса. Рис. 82. Реакции изотопного обмена водорода с гидридом стронция [{BDI DiPeP }Sr(μ-H)] 2 ( 93 ). DiPeP = 2,6-диизопентилфенил. Хардер расширил эту работу в 2020 году, сообщив о каталитической ГИЭ ряда ароматических комплексов с использованием гомолептических комплексов амидов щелочноземельных металлов {N(Si i Pr 3 ) 2 } 2 ] ( 67–69 ) и [Ae{N(Si i Pr 3 )(DiPP)} 2 ] ( 70 – 82 83). Рис. 83. Изотопный обмен водорода между протио- или дейтериобензолом с H 2 или D 2 с использованием предкатализаторов на основе амидов щелочноземельных металлов. Обратная реакция, где D 2 в качестве источника дейтерия и бензола в качестве растворителя реакции, происходит в 1,5–2 раза быстрее за счет кинетического изотопного эффекта. Степень включения дейтерия была исследована для ряда замещенных аренов. Алкилзамещенный бензол дает умеренные замещения атомов водорода на α-углероде (до 42% для этилбензола), но не дает замещения β-водородов. Интересно, что при увеличении времени реакции исходно высокое содержание α-D в алкилбензолах уменьшается, а общий процент дейтерирования молекулы увеличивается. Об аналогичном обмене HIE сообщалось с гидридом кальция без растворителя [{BDI DiPP }Ca(μ-H)] 2 ( 58 ). 200 В попытке воспроизвести реакцию ГИЭ, представленную на рис. 82, раствор 58 в C 6 D 6 нагревали до 60 °C в течение 12 ч (рис. Рис. 84. Реакции разложения и дейтерирования для [{BDI DiPP }Ca(μ-H)] 2 ( 58 ). Просмотреть главуКнига покупок Прочитать главу полностью URL: https://www.sciencedirect.com/science/article/pii/B978012820206700069X N. Просмотреть статью Прочтите полную статью URL: https://www.scienceedirect.com/science/article/pii/s0360319 STEWART F. Parker, в координации . из рассмотренных до сих пор комплексов A 2 [TH 6 ] были получены твердофазными реакциями гидрида щелочного или щелочноземельного металла с переходным металлом в присутствии H 2 атмосферы при повышенных температуре и давлении [12–15]. Также возможно получение растворимых солей [TH 6 ] 4− (T = Fe, Ru) по реакции FeX 2 или [Ru(η 4 -1,5-COD)X 2 ] (X = Cl или Br, COD = циклооктадиен) с растворами C 6 H 5 MgBr в атмосфере водорода с последующей экстракцией тетрагидрофураном (ТГФ) [59–61]. Просмотреть статью Прочитать статью полностью URL: https://www.sciencedirect.com/science/article/pii/S00108545084 с подсказками и ответами на проблемы Первый семестр Единицы 2-22 Это задачи для ваших заданий. Пожалуйста, выполните их для каждого задания модуля. Важные схемы и таблицы Быстрый поиск объектов Не нажимайте сюда до полной загрузки страницы!!! *** Здесь начинаются задания юнитов: *** Задания должны выполняться ЧЕРНИЛАМИ!! Ответы на вопросы должны быть ПОЛНЫМИ ПРЕДЛОЖЕНИЯМИ, а МЕТОД РЕШЕНИЯ должен быть показан для вычислений (Hup, Two, Three, Four)! Задания должны быть озаглавлены правильно! Задания не будут оцениваться, если не будет выполнено вышеперечисленное. Лучше всего выполнять эти задания ОН-ЛАЙН, потому что они имеют горячие ссылки на схемы, таблицы, задачи и подсказки. Для проведения исследований перейдите к интерактивному справочному тексту или воспользуйтесь учебником. Примечание: Вам не нужно распечатывать лист с заданиями, просто отвечайте на вопросы полными предложениями и решайте задачи с помощью Hup, Two, Three, Four. НИКАКИХ проблем для блока 1, просто прочитайте главу 1 «Введение в химию» в онлайн-учебнике. Модуль 2, Измерение и расчет ВСЕ РАБОТЫ ДОЛЖНЫ ВЫПОЛНЯТЬСЯ ЧЕРНИЛАМИ!!! Для поиска информации перейдите в онлайн-справочник 2. Измерение и расчет 1. Сколько значащих цифр в каждом из следующих чисел? а. 903.2, б. 90.3, в. 900.04, д. 0,0090, э. 0,0900, ф. 99, г. 0,0088, ч. 0,049, т.е. 0,02, Дж. 70. Ответ: a = 4, b = 3, c = 5, d = 2, e = 3, f = 2, g = 2, h = 2, i = 1, j = 2. 2. Ans: a = 5.53 X10 5 , b = 8.65 X 10 3 , c = 5.23 X 10 18 , d = 2.60 X 10 1 , g = 1.24 X 10 3 , h = 1.05 Х 10 1 МЕТОД ДОЛЖЕН ПОКАЗЫВАТЬСЯ ПРИ ВСЕХ ПРОБЛЕМАХ! — 3. Какова плотность куска цемента массой 8,76 г и объемом 3,07 см 3 ? Ответ: 2,85 г/см 3 4. Какова плотность пробки массой 0,650 г и объемом 2,71 см 3 ? Ответ: 0,240 г/см 3 . 5. Известняк имеет плотность 2,72 г/см 3 . Какова масса 981 см 3 известняка? Ответ: 2670 г. Решите следующие задачи на массу: 6. Хромат магния аммонийный имеет плотность 1,84 г/см 3 . Какова масса 6,9?6 см 3 этого вещества? Ответ: 12,8 г. 7. Перхлорат бария имеет плотность 2,74 г/см 3 . Какова масса 610 см 3 этого вещества? Ответ: 1670 г. Решите следующие задачи для тома: 8. Сульфат церия имеет плотность 3,17 г/см 3 . Каков объем 706 г этого вещества? Ответ: 223 см 3 . ВСЕ ПОЯСНЕНИЯ ДОЛЖНЫ БЫТЬ ПОЛНЫМИ ПРЕДЛОЖЕНИЯМИ!! 9. Почему в научной работе вместо веса используется масса? 10. Почему важно поддерживать правильное количество значащих цифр в вычислениях? 11. Укажите количество значащих цифр для каждого из следующего: а. 1.х10 8 , б. 6,8 х 10 8 , в. 4.930 00 х 10 9 , д. 8.420 000 0 х 10 8 Ответ: а = 1, б = 2, в = d, d = 8 12. Выразить в экспоненциальном представлении: а. 36.8, б. 0,0387, в 0,000 216 5, г. 516 830 000 000 Ответ: а = 3,6 х 10 1 , b = 3,87 х 10 -2 , с = 2,165 х 10 -4 , d = 5,16 х 10 11 717 Часть 3, Материя Для получения информации перейдите в The On-Line Reference Text Unit 3. ОБЪЯСНИТЕ ВАШИ ОТВЕТЫ! 1. Классифицируйте следующие материалы как гетерогенные смеси, растворы, соединения или элементы. а. воздух, б. смесь следов, c. бумага, д. поваренная соль, т. алкоголь, ф. яблоко, г. молоко, ч. плутоний, т. вода. 2. Укажите, как бы вы продемонстрировали, что каждое из следующих веществ является гетерогенной смесью или гомогенной смесью: а. кусок дерева, б. стакан газировки, c. кусок ткани, рекламируемый как 50% шерсти и 50% синтетики. 3. Классифицируйте следующие свойства как химические или физические. а. цвет, б. реактивность, в. воспламеняемость, д. запах, т. пористость, ф. стабильность, г. пластичность, ч. растворимость, т. расширение, ж. температура плавления, к. ржавчина, л. реагирует с воздухом 4. Классифицируйте следующие изменения как химические или физические: а. переваривание пищи, б. выцветание краски на ткани, c. рост растения, д. таяние льда. 5. а. взрыв бензина в двигателе автомобиля, b. образование облаков в воздухе. 6. Составьте список из пяти решений, обычно используемых в домашних условиях. 7. Классифицируйте следующие материалы как гетерогенные смеси, растворы, соединения или элементы. а. краска, б. медь, гр. гранит, д. кожа, т. кукурузный сироп, ж. золото. 8. Классифицируйте следующие свойства как химические или физические: а. плотность, б. температура плавления, с. длина. Блок 4, химические формулы Для поиска информации перейдите в The On-Line Reference Text Unit 4. Химические формулы Нажмите здесь, чтобы распечатать листок с заданиями и практическими рекомендациями по химическим формулам.pdf. … Это химические формулы, которые необходимо выполнить и сдать. Сохраните раздаточный материал для будущей практики. Блок 5 будет выполнен после Блок 6. Раздел 6, Химические уравнения Для поиска информации перейдите в The On-Line Reference Text Unit 6. Химические уравнения. Распечатайте Equations & Answers.pdf Задание и практический лист. … Это химические уравнения, которые нужно составить и сдать. Сохраните раздаточный материал для будущей практики. Блок 5, Крот Для поиска информации перейдите в онлайн-справочную текстовую группу 5. Крот 1. Рассчитайте молекулярные или формульные массы следующих соединений, все в а.е.м. (г/моль) : а. С 2 Н 6 , б. SiCl 4 , г. MgCO 3 , д. Ca 3 (P0 4 ) 2 , e. К 2 Ю, ф. СН 2 СНСН 2 ОН, г. Pb 3 (As0 4 ) 2 , з. С 12 Н 22 0 11 . Ответ: а=30, b=170, c=84, d=310, e=110, f=58, g=899, h=342. Сделайте следующие преобразования ПОКАЗЫВАЯ ВАШ МЕТОД, Hup, Two, Three, Four! 2. 1,00 x 10 26 молекул SnCl 2 в моли. Ответ: 1,66 X 10 2 мол. 3. 0,400 моль H 2 O до молекул. Ответ: 2,41 х 10 23 молекул. 4. 76,0 грамм CaBr 2 в моль. Ответ: 0,380 моль. Или 3,80 X 10 -1 мол. 5. 18.0 грамм HBr в моль. Ответ: 0,222 моль. Или 2,22 X 10 -1 мол. 6. 9,30 молей SiH 4 до молекул. Ответ: 5,60 X !0 24 молекул. 7. Найдите массу одного атома Na. Ответ 3,82 X 10 -23 г/атом 8. Найдите массу одной молекулы H 2 SO 4 . Ответ 1,63 X 10 -22 г/молекула Рассчитайте молярность следующих растворов: 9. 145 г NH 4 Cl в 500 мл раствора. Ответ: 5,4 М 10. 41,3 г Fe(N0 3 ) 2 в 100 мл раствора. 11. 35,0 г MnSiF 6 в 50,0 мл раствора. Ответ: 3,56 М ПОКАЖИТЕ СПОСОБ, Hup, Два, Три, Четыре! Опишите приготовление следующего раствора: 12. 500 мл 1,50 М AgF. Ответ: Растворите 95,3 г AgF в достаточном количестве воды, чтобы получилось 500 мл раствора. Найдите процентный состав следующего: 13. Ксф. Ответ: 87,5%; 12,5%. 14. Би 2 0 3 . Ответ: 89,7%, 10,3%. 15. БаХ 2 . Ответ: 98,6%, 1,44%. Найдите эмпирические формулы следующих соединений: 16. 1,67 г Ce, 4,54 г I. Ответ: CeI 3 17. 6,27 г Ca, 1,46 г N. Ответ: Ca 3 N 2 18. Молекулярная масса бензола равна 78, а его эмпирическая формула – CH. Какова молекулярная формула бензола? Ответ: С 6 Н 6 19. Какова молекулярная формула дихлоруксусной кислоты, если эмпирическая формула CHOCl и молекулярная масса 129 г/моль? Ответ: C 2 H 2 O 2 Cl 2 Найдите формулы для следующих гидратов: 20. 21. 89,2 % BaBr 2 , 44,6 % H 2 O (Примечание: возраст в % можно заменить граммами, поскольку они находятся в том же соотношении). Ответ: BaBr 2 • 8H 2 0 22. Объясните разницу между терминами моль и молярность. 23. Объясните разницу между эмпирической формулой и молекулярной формулой. Блок 7, Стехиометрия (математика Big Chem) Для получения информации перейдите в The On-Line Reference Text Unit 7. Количественные зависимости Примечание. Перед решением задач необходимо составить сбалансированное уравнение! 1. Сколько граммов H 2 можно получить при взаимодействии 11,5 граммов натрия с избытком воды? Подсказка: 2Na + 2H 2 O —> 2NaOH + H 2 . Ответ: 0,505 г. 2. Азот реагирует с 2,00 граммами водорода. 3. Сколько граммов кислорода требуется для сжигания 85,6 граммов углерода? Подсказка: кислород двухатомный, C + O 2 —> CO 2 . Ответ: 228 г. 4. Действие оксида углерода на оксид железа(III) (оксид железа) можно представить уравнением Fe 2 O 3 + 3CO —-> 2Fe + 3CO 2 . Какое количество угарного газа было бы использовано, если бы было произведено 18,7 г железа? Ответ: 14,1 г. 5. Сколько граммов соляной кислоты потребуется для реакции с 75,1 граммами гидроксида кальция? Помните правила оформления скобок для гидроксида кальция. Ответ: 74,6 г. 6. Сколько граммов газообразного водорода образуется при взаимодействии 5,62 грамма алюминия с соляной кислотой? Подсказка: соляная кислота — это хлористый водород, газообразный водород — двухатомный. Ответ: 0,631 г. Таблица A-5 будет использоваться для задач 7, 8, 9. 7. Какое количество теплоты потребуется для повышения температуры 91,4 г PCl 3 с 25,0 o C до 76,1 o C? Ответ = 4080 Дж. 8. Какое количество теплоты потребуется для повышения температуры 4,66 г CCl 4 с 20,9 o C до 76,8 o C? Ответ = 223 Дж 9. Какое количество теплоты потребуется, чтобы поднять температуру 787 г Н 2 О с 18,0 o С до 100,0 o С? Ответ = 270,000 Дж. 10. Рассчитайте изменение энтальпии образования 193 г бромида аммония из аммиака и бромистого водорода. Таблица А-6. Подсказка: запомните разницу между аммиаком и аммонием (не забудьте!), найдите ΔH и умножьте на количество молей бромида аммония. Ответ: ΔH = -188 кДж/моль, -370 кДж. 11. Рассчитайте изменение энтальпии при вытеснении 0,0663 г брома из бромида натрия хлором. Таблица А-6. Примечание: также образуется хлорид натрия. Подсказка: бром двухатомный. 12. Чем отличаются эндотермические реакции от экзотермических? 13. Приведите пример использования энергии активации в повседневной жизни. Блок 8, атомная структура Для проведения исследований перейдите в The On-Line Reference Text Unit 8. Атомная структура 1. Назовите пять шагов атомной теории Дальтона. 2. Какой вклад в формирование атомной теории внес каждый из следующих элементов? а. Далтон, б. Томсон, ок. Резерфорд, Д. Чедвик, е, Авогадро, ф. Франклин, г. Фарадей, х. Крукс, И. Перрин, Дж. Милликен, К. Рентген, л. Беккерель, м. Кюри. 3. Сформулируйте закон сохранения массы и приведите пример. Подсказка: A = массовое число = протоны + нейтроны. Z = атомный номер = количество протонов. Z также = количество электронов в нейтральном атоме. Количество нейтронов = A — Z. 4. Отдельный атом аргона содержит 18 протонов, 18 электронов и 22 нейтрона. 5. Каковы основные различия между протонами, нейтронами и электронами? 6. Сколько электронов, нейтронов и протонов в изотопе азота с массовым числом 14? Ответ: 7 электронов, 7 протонов, 7 нейтронов. 7. Сформулируйте закон определенных пропорций и приведите пример. 8. Сформулируйте закон Гей-Люссака и приведите пример (уравнение баланса). 9. Почему индукционная катушка (Sparky) важна в химии. 10. Перечислите пять свойств катодных лучей в трубках Крукса. 11. Опишите эксперимент, показывающий, что электроны имеют массу. 12. Что обнаружено в трубке сэра Дж. Дж. Томпсона? 13. Какие три вещи были измерены в эксперименте Милликена с каплей масла? 14. Дайте определение Ион и приведите два примера. 15. Дайте определение Изотоп и приведите пример. 16. Какие две химические вещи мы узнали из рентгеновских лучей ? 17. 18. Какие три частицы радиоактивности? 19. Перечислите пять свойств радиоактивности. 20. Как был открыт Флуоресценция ? Блок 9, Электронная структура Для получения информации перейдите в онлайн-справочный текстовый блок 9. Электронные облака/вероятность Помните, что дополнительную справку можно найти в учебнике, интерактивном исследовательском тексте и в дополнительной справке на нашей веб-странице. Электронные орбитали Диаграммы вероятностей 1. Какова длина волны электрона с массой 9,11 x 10 -28 кг, движущегося со скоростью 2,00 x 10 8 м/с? (Постоянная Планка = 6,63 x 10 -34 Дж/Гц. Подсказка: подставьте в эту формулу: Ответ: 3,64 х 10 -15 м. Для проблем с электронными конфигурациями используйте уровни электронной энергии (диаграмма Гуся). 2. Рассчитайте максимальное число электронов, которые могут находиться на уровнях при n = 2, 3, 5 и 7. 3. Сколько орбиталей в a(n) a. д подуровень, б. f подуровень ? 4. Запишите электронные конфигурации элементов с Z = 1 до Z = 20. (Z = атомный номер = количество электронов для конфигурации) . Подсказка: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 … и т. д. 5. Запишите электронных конфигурации и начертите точечные диаграммы для следующих элементов: Помните, что точечные структуры используют только валентные (самые внешние) электроны и s- и p-орбитали. а. Z = 28, б. Z = 18, в. з = 16, д. Z = 47, т.е. Z = 19, ж. Z = 32, 6. Какая связь между импульсом и длиной волны? 7. Сколько электронов может находиться на пятом энергетическом уровне? См. Уровни электронной энергии. 8. Какие элементы состоят из атомов, имеющих следующие конфигурации: Подсказка: общее количество электронов, Z, является атомным номером. а. 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 б. 1S 2 2S 2 2p 6 3S 2 3p 6 4S 2 3d 10 4p 6 5S 2 4d 4 9. Напишите электронные конфигурации ниобия и цинка. 10. Сколько пар электронов в атоме бора? атом серы? атом фтора? Подсказка: заполненная орбиталь представляет пару электронов на электронных энергетических уровнях . Раздел 10, Периодическая таблица. Блок 11 входит в комплект Блока 10. Для получения информации перейдите к интерактивному справочному текстовому блоку 10. Периодическая таблица и Раздел 11. Периодические свойства. Помните, что дополнительную справку можно найти в учебнике, интерактивном исследовательском тексте и в дополнительной справке на нашей веб-странице. Используйте периодическую таблицу элементов для решения следующих задач: 1. Классифицируйте следующие элементы как металлы, металлоиды или неметаллы: а. кадмий, б. кальций, в. Калифорния, д. углерод, т. диспрозий, ф. празеодим, г. таллий. 2. В таблице Менделеева больше металлов или неметаллов? 3. Из каждой из следующих пар частиц выберите частицу с большим радиусом: Используйте Таблицу 10-9 ниже. а. Он, Не. б. Бе, Б. в. Н, Н 3-, д. А1, А1 3+ . е. П, Ас. ф. С, бр. грамм. К, ок. час Se, Se 2+ . я. Sc, Sc 3+ . б. Назовите причины ваших ответов. 4. Предсказать степени окисления гадолиния, радия и ниобия. Подсказка: помните, что столбцы — это семейства, имеющие одинаковую степень окисления (валентность) и общую склонность элементов. 5. Классифицируйте следующие элементы как металлы или неметаллы: а. хром, б. Используйте Таблицу 10-9 выше для следующего: 6. Что происходит с размером атомов при движении слева направо по горизонтальному ряду периодической таблицы? 7. Что происходит с размером атомов при перемещении от верха к низу столбца периодической таблицы? 8. Как размер положительного иона соотносится с размером атома, из которого он образовался? 9. Как размер отрицательного иона соотносится с размером атома, из которого он образовался? 10. Element X has the following electron configuration ls 2 2s 2 2p 6 3s 2 3p 6 4s 2 3 10 4p 4 а. Найдите его положение в периодической таблице. Подсказка: посчитайте электроны для атомного номера. б. К какой группе и к какому периоду относится этот элемент? с. д. Перечислите свойства, связанные с выбранной вами классификацией. эл. Предсказать степень окисления элемента (его валентность). ф. Нарисуйте электронную точечную диаграмму атома элемента X. Нарисуйте электронную точечную диаграмму иона элемента X. Подсказка: положительный ион потерял электроны, отрицательный ион приобрел электроны. А точечные структуры используют только крайние электронные s- и p-орбитали. Ах Яз! г. Как соотносится размер атома элемента X с размером иона элемента X? Подсказка: добавление электронов увеличивает размер иона, удаление электронов уменьшает размер иона. См. рис. 10-9 ниже. 11. Положения некоторых элементов выделены в периодической таблице, рисунок 10-12 ниже. Для каждого выделенного элемента ответьте следующее: а. К какой группе и какому периоду относится этот элемент? б. Классифицируйте элемент как металл, неметалл или металлоид. с. Перечислите свойства, которыми должен обладать этот элемент, исходя из классификации, выбранной вами в б. д. Напишите электронную конфигурацию элемента. эл. Предсказать степень окисления элемента. ф. Нарисуйте электронно-точечные диаграммы атома и иона этого элемента. Блоки 12 и 13 Химическая связь и молекулярная структура. Для проведения исследований перейдите в онлайн-справочный блок 12. Химическая связь и 13. Молекулярная структура Помните, что дополнительную справку можно найти в учебнике, интерактивном исследовательском тексте и в дополнительной справке на нашей веб-странице. 1. Объясните каждый из пиков на графике на рис. 12-2. Подсказка: посмотрите, какая группа элементов находится на каждом пике. 2. Классифицируйте связи между следующими парами атомов как преимущественно ионные или ковалентные: Подсказка: вспомните, как образуются эти связи. а. бор и углерод, б. цезий и фтор, c. фтор и кремний, d. водород и хлор, т.е. магний и азот, f. бериллий и фтор, ж. бром и стронций, з. хлор и литий, т.е. хлор и натрий, j. водород и йод. 3. Для каждой пары атомов, перечисленных ниже, решите, будет ли образовываться ионная или ковалентная связь между элементами: Подсказка: посмотрите, где они расположены на Периодической таблице элементов . а. фтор — астат, б. бор — торий, гр. гадолиний — астат, д. лантан-селен, e. стронций — хлор, ж. йод-натрий. 4. Объясните различия в шести энергиях ионизации углерода, показанных в таблице 12-3 ниже. Подсказка: Факторы, определяющие энергию ионизации , приведены в таблице 12-2 ниже. И рассмотрим г. Отношение оставшихся электронов к заряду ядра (соотношение узников/охранников). 5. Используя Таблицы 12-8 и 12-9, предскажите длины связей, указанные для веществ: Совет: возьмите среднее значение. а. Cl—CI в Cl 2 , б. NH в NH 3 , c. H-Br в HBr, d. F—O в OF 2 . 6. Какие четыре фактора влияют на получаемые значения энергии ионизации элемента. См. Таблицу 12-2 выше. 7. Предскажите валентные углы, указанные в следующих соединениях: Подсказка: используйте рис. 13-1 и таблицы 13-1,2 и периодическую таблицу элементов. Если вы знаете валентные углы для одного элемента, они будут такими же для других элементов в том же столбце. Рисунок 13-1 а. H—Te—H в H 2 Te, б. H—P—H в PH 3 , c. Cl—As-Cl в AsCl 3 . 8. В чем основное различие между сигма, s, и пи, p, связями? См. рисунки 13-6,7. 9. Что означает термин гибридизация? Подсказка: некоторые электроны переходят с s-на p-орбитали. 10. Предскажите форму следующих молекул: Совет: используйте рис. 13-1, таблицы 13-1,2 выше и периодическую таблицу элементов. а. СО 2 , б. БФ 3 г., ок. СФ 6 , д. СФ 4 . 11. Можно было бы ожидать, что валентный угол для каждой связи C—H в метане (CH 4 ) будет равен 90 o . Почему этот прогноз неверен? См. рис. 13-1 выше. Подсказка: мыслите в трех измерениях (оси x, y, z). 12. Нарисуйте прямоугольники и точечные структуры для a. NF 3 , б. Н 2 Ю, с. N 2 . 13. Объясните межмолекулярную силу (Ван-дер-Ваальса) и приведите пример. 14. Объясните водородную связь и приведите пример. 15. Объясните металлическую связку и приведите пример. 16. Объясните Инфракрасная спектроскопия и что мы из нее узнаем. 17. Назовите четыре моды молекулярных колебаний . Подсказка: Моды молекулярных колебаний . Блок 14, Полярные молекулы Для поиска информации перейдите в The On-Line Reference Text Unit 14. Polar Molecules Помните, что дополнительную справку можно найти в учебнике, интерактивном исследовательском тексте и в дополнительной справке на нашей веб-странице. 1. Дайте определение Polar Molecule и приведите пример. 2. Дайте определение водородной связи и приведите пример. 3. Что такое Межмолекулярные силы (Ван-дер-Ваальса) и как они соотносятся по прочности с ковалентными связями? 4. В чем разница между Межмолекулярными силами и Covalent Bond ? 5. Что такое водородная связь и чем она отличается по прочности от ковалентной связи ? 6. Дайте определение симметричным и асимметричным молекулам. Почему они важны? 7. Дайте определение Аллотроп , назовите два аллотропа кислорода и напишите их формулы. 8. Чем отличается молекулярная структура жидкой воды от твердой? 9. Почему лед плавает в воде? 10. Почему вода полярная? 11. Как работает микроволновая печь ? 12. Что такое хроматография и как она используется? 13. Как молекулярная спектроскопия используется в работе полиции? 14. Какие силы удерживают молекулярные вещества в жидком и твердом состояниях? Подсказка: это притяжение между молекулами , а не химические связи между атомами. Блок 15, кинетическая теория, абсолютная температура, атмосферное давление. Для поиска информации перейдите в The On-Line Reference Text Unit 15. Kinetic Theory Помните, что дополнительную справку можно найти в учебнике, интерактивном исследовательском тексте и в дополнительной справке на нашей веб-странице. Подсказка для тестов 1-4: 1 кПа = 7,50 мм , поэтому 1 мм = 0,13 кПа . Для задач 1,2,3 используйте рис. 15-3. 1. Открытый манометр на рис. 15-3 наполнен ртутью и соединен с сосудом с водородом. Уровень ртути на 80,0 мм (переводится в кПа) выше в плече трубки, подсоединенной к газу (поэтому давление ниже атмосферного). Атмосферное давление 99,0 кПа. Каково давление водорода в килопаскалях? Ответ: 88,6 кПа. 2. Закрытый манометр, подобный показанному на рис. 15-3, наполнен ртутью и соединен с сосудом с азотом. Разница высоты ртутного столба в двух рукавах составляет 690 мм. Каково давление азота в килопаскалях? Ответ: 690 мм = 90 кПа. 3. Открытый манометр наполнен ртутью и соединен с сосудом с кислородом. Уровень ртути на 6,00 мм выше в плече трубки, соединенной с баллоном с кислородом (поэтому давление кислорода ниже атмосферного). (Измените мм на кПа). Атмосферное давление 100,0 кПа. Каково давление кислорода в килопаскалях? См. Рисунок 15-3. Подсказка для задач 5-8: используйте формулу K = C + 273 , поэтому C = K -273. 4. Преобразуйте следующие температуры из градусов Цельсия в градусы Кельвина: а. 87 или ,б. 16 или , г. 59 или , д. 59 -68 или , эл. 73 или . Подсказка: следите за знаками! 5. Преобразуйте следующие температуры из кельвинов в градусы Цельсия: а. 86 или , р. 191 или , г. 533 или , д. 318 или , эл. 894 или . 6. Предположим, у вас есть два флакона, один с аммиаком, другой с хлором. Когда их откроют по всей комнате, какой запах вы ожидаете услышать первым и почему? Подсказка: Закон диффузии Грэма связывает скорость молекул с молекулярной массой (более тяжелые молекулы движутся медленнее). 7. Что касается движения частиц, каковы различия в состояниях материи? Подсказка: что движется быстрее: твердые, жидкие или газовые молекулы? 8. 9. Каково значение абсолютного нуля с точки зрения кинетической теории? 10. Что такое упругий удар? Чем он отличается от неупругого удара? Подсказка: Молекулы сталкиваются с упругим столкновением, что означает, что энергия не теряется. Бам, бам, бац, бац продолжается до бесконечности. Пирог в лицо неэластичен. 11. Что такое кинетическая теория материи и перечислите 9 доказательств, подтверждающих кинетическую теорию. 12. Как Торричелли открыл атмосферное давление? 13. Как найти плотность воздуха и какова ее величина в г/л? 14. Приведите значения давления на одну атмосферу (среднее на уровне моря) в а) метрах водяного столба, б) миллиметрах ртутного столба, в) килограммах/см 2 и г) килопаскалях. 15. Опишите демонстрацию магдебургских полушарий и расскажите, что они нам сообщают. 16. Каково истинное значение всасывания ? Единица измерения 16, твердые вещества Для получения информации перейдите в The On-Line Reference Text Unit 16. Помните, что дополнительную справку можно найти в учебнике, интерактивном исследовательском тексте и в дополнительной справке на нашей веб-странице. Советы по главе 16 «Испытания: основные кристаллические системы и элементарные ячейки в действии». 1. По фотографии решетки NaCl покажите, почему NaCl является самой простой формулой. 2. Найдите процентное содержание воды в кристалле CuSO 4 5H 2 0. Подсказка: сравните ММ для пяти молекул воды с ММ одной CuSO 7 7 6 0 и получаем %. Ответ: 36% 3. Используйте алмаз и графит, чтобы объяснить, как связывание влияет на свойства кристалла. См. Графит, алмаз и бакиболлы. 4. Назовите причины низкой температуры плавления неметаллических элементов. Подсказка: помните о межмолекулярных силах (ван-дер-ваальсовых) и ионных силах. 5. Чем отличаются свойства дефектного кристалла от идеального кристалла? 6. 7. Что такое Bucky Balls? 8. Сравните эти термины: а) изотоп, б) аллотроп, в) изомер. 9. Назовите семь основных кристаллических структур. 10. Сравните структуру льда со структурой жидкой воды и объясните, в чем разница. Раздел 17, Жидкости Для получения информации перейдите в онлайновый справочный текстовый блок 17. Жидкости Помните, что дополнительную справку можно найти в учебнике, интерактивном исследовательском тексте и в дополнительной справке на нашей веб-странице. 1. Используя рис. 17-8 ниже, определите точки кипения следующих веществ при перечисленных условиях: а. CHCl 3 при 50,0 кПа, б. H 2 O при 100,0 кПа, c. CCl 4 при 75,0 кПа, д. H 2 O при 11,0 кПа. Рисунок 17-8 2. Имеется образец Н 2 О массой 23,0 г при температуре -46,0 o С. Сколько джоулей тепловой энергии необходимо для: а. нагреть лед до О o С?, б. растопить лед?, c. нагреть воду от O o C до 100 o C?, d. кипятить воду?, т. нагреть пар от 100 o C до 109 o C? Энергии следующие: ….. Нагреть лед (удельная теплоемкость льда) = 2,06 Дж/г•C o ………. Ответ: а = 2180 Дж, Ь = 7680 Дж, с = 9610 Дж, d = 52000 Дж, е = 418 Дж. 3. Начертите кривую нагрева воды и обозначьте ПЯТЬ частей. 4. Используя кривую нагревания задачи 3 и образец задачи , найденный в ваших заметках или в примере задачи из онлайн-заметок, рассчитайте Общее количество калорий , необходимое для превращения 20,0 граммов льда при — 15,0 o C в водяной пар при + 125,0 o C. Таблица теплотворной способности воды . Ответ: 14 760 калорий. Таблица теплотворной способности: 5. Дайте определение «Точка кипения» и опишите два способа закипания жидкости. 6. Что такое критическая температура? Что такое критическое давление? Подсказка: используйте онлайн-текст или свою книгу. 7. Что такое тройная точка? Посмотрите на фазовую диаграмму на рис. 17-9. определить значение тройной точки воды. Рис. 17-9. Фазовая диаграмма воды. 8. Что такое принцип Ле Шателье? Как надавливание на воздушный шар демонстрирует этот принцип? 9. Что такое сублимация? Назовите три примера вещества, которое возгоняется. 10. Объясните, почему вода охлаждается при кипячении с помощью вакуумного насоса. 11. Опишите, что происходит с кристаллической решеткой при таянии льда. 12. В чем разница между летучими и нелетучими веществами? Приведите твердые и жидкие примеры каждого из них. 13. Хорошо перемешанная смесь льда и воды находится в равновесии. Если добавить небольшое количество теплой воды или льда, температура не изменится, почему? Раздел 18, Газы Для получения информации перейдите в онлайн-справочник, блок 18. Газы Помните, что дополнительную справку можно найти в учебнике, интерактивном исследовательском тексте и в дополнительной справке на нашей веб-странице. Проблемы с парциальным давлением Совет: используйте закон Дальтона для парциального давления P (атм.) = P газ + P (водяной пар) , и Таблица 18-2. 1. Найти парциальное давление газа Н 2 , собранного над водой при температуре 20 o С при атмосферном давлении 98,0 кПа. Ответ: 95,7 кПа. Подсказка по следующим проблемам. Используйте уравнение газового закона: PV/T = P’V’/T’ Стандартное давление = 101 кПа Стандартная температура = 273 K 2. Исправьте объемы следующих газов, как указано: Помните, что T должно быть в K. K = C + 273 . а. 7,51 л при 5,00 o °С и 59,9 кПа до н.у.т. Ответ: 4,36 л б. 80,0 л при 35,0 o °С и 111 кПа до н.у.т. Ответ: 78,0 л Для решения задачи 3 вам понадобятся Закон диффузии Грэма , Скорость диффузии обратно пропорциональна квадратному корню из молекулярных масс. Другими словами, тяжелые молекулы движутся медленнее. 3. Каково отношение скорости атомов гелия к скорости атомов радона, когда оба газа имеют одинаковую температуру? Ответ: 7.45. Периодическая таблица элементов. 4. Что теоретически произойдет с газом, охлажденным до абсолютного нуля? Почему мы не можем стать холоднее абсолютного нуля? Блок 19, Газовые кроты Для получения информации перейдите в The On-Line Reference Text Unit 19. Газы и крот Подсказка: Уравнение закона идеального газа: PV = nRT . Где P — давление в кПа, V — объем в л, n — число молей, T — абсолютная температура в K (K = C + 273), а R — газовая постоянная = 8,31 л•кПа. /моль•К. 1. Какое давление будет оказывать 0,300 моль газа, содержащегося в сосуде объемом 8,00 л при температуре 18,0 o С? Ответ: 90,7 кПа. Не забудьте изменить или C в K . 2. 3. Какой объем займет 0,362 моль газа при 100,3 кПа и 8,00 o С? Ответ: 8,43 л. Подсказка: переформулируйте уравнение PV = nRT , найдя V . 4. При какой температуре находится газ, если 0,0851 моль его находится в сосуде объемом 0,604 л при давлении 100,4 кПа? Ответ: 85.3K = -187 o C. Подсказка: переформулируйте уравнение, PV = nRT , найдя T . Для следующего вам нужно сбалансированное уравнение. Молярный объем любого газа при нормальных условиях составляет 22,4 л/моль. 5. Сбалансируйте уравнение: Br 2 + NaI —> NaBr + I 2 . Найдите, сколько литров газа Br 2 необходимо для получения 5,0 граммов I 2 в STP. ММ I 2 составляет 254 г/моль. Единица 20, Энтропия Для исследования перейдите к справочному тексту в Интернете. по Энтропии. Без письменного задания. Блок 21, Растворы, Блок 22, Коллигативные свойства Для проведения исследований перейдите к разделу 21 интерактивного справочного текста. Дополнительная помощь на нашей веб-странице. Периодическая таблица элементов 1. Рассчитайте молярность иона, обозначенного в следующих растворах: Подсказка: вам нужно сбалансированное ионное уравнение для растворения, чтобы получить молярное соотношение ионов. И М = моль/л. А моль = г/мм. а. Br 1- для 316 г MgBr 2 в 859 мл раствора. Ответ: 4.00M. б. Ca 2+ для 8,28 г Ca(C 5 H 9 0 2 ) 2 в 414 мл раствора. Ответ: 0,82М. 2. Рассчитайте молярность следующих растворов: а. б. 59,5 г CaCl 2 в 100 мл раствора. Ответ: 5,36 млн. Периодическая таблица элементов 3. Вычислите массу растворенного вещества, необходимого для приготовления следующих растворов: Помните: г = (М)(ММ)(L) . л = мл / 1000 мл/л а. 1,000 л 0,780 М Sc (NO 3 ) 3 . Ответ: 180 гр. б. 100 мл 0,626 М VBr 3 . Ответ: 18,2 г. 4. Кристаллы йода относительно нерастворимы в воде, однако растворяются в четыреххлористом углероде. Объяснить, почему. Подсказка: помните о полярных и неполярных молекулах. Рис. 14-1. Рисунок 14-1 5. Приведите следующие сбалансированные уравнения к чистой ионной форме. Подсказки: Ионизируют все водные вещества (водн.). Не ионизируйте твердые вещества (s) кристаллы (c) газы (g) или H 2 O (l) . Правила и примеры задач: Покажи свою работу! CoCl 2(водн.) + 2KOH (водн.) —> Co(OH) 2(т) + 2 KCl (водн.) Ответ: Co +2 (водн.) + 2OH -1 (водн.) —> Co(OH) 2(s) 3 Ag 2 CrO 4(водн.) + 2 AlBr 3(водн.) —> Al 2 (CrO 4 ) 3(тв) + 67 Ag Ответ: 6 Ag + (водн.) + 6 Br — (водн.) —> 6 AgBr (тв.) или Ag + (водн.) + — 91 7 (7aq — ) 6 AgBr (водн.) —> AgBr (с) H 2 SO 4(водн.) + 2 NaOH (водн.) —> Na 2 SO 4(водн.) + 2 H 2 O (7) Ответ: 2 H + (водн. 2 HCl (водн.) + CaCO 3 (водн.) —> CO 2 (г) + H 2 O (л) + CaCl 2 (водн.) Ans: 2 H + (водн.) + CO 3 -2 (водн.) —> CO 2(г) + H 2 8 O 691 (l 6 6. Что такое коллигативные свойства? См. Коллигативные свойства. 7. Дайте определение энергозависимому и энергонезависимому и приведите пример каждого из них. 8. Дайте определение растворенного вещества и приведите пример. 9. Как добавление растворенного вещества снижает температуру замерзания растворителя? Подсказка: количество молекул или ионов влияет на коллигативные свойства. 10. |
|---|







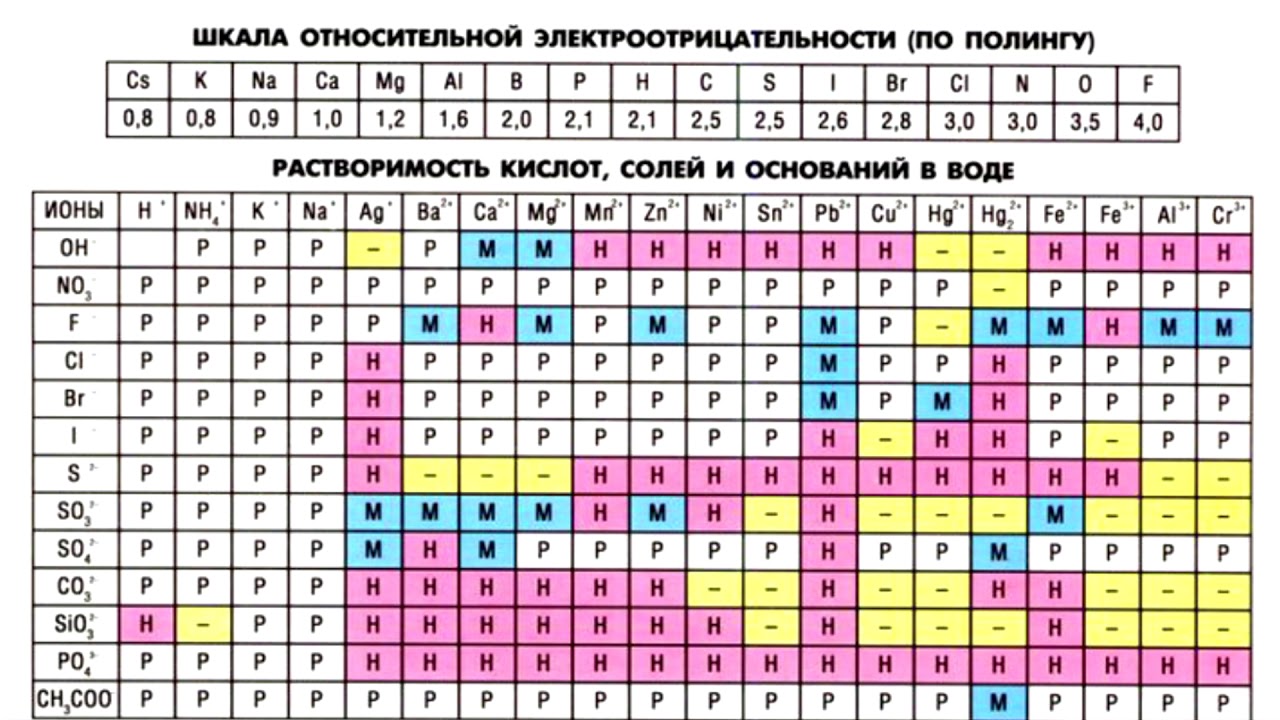


 Степень окисления F во всех соединениях равна « -1». Na +1 F -1 , H +1 F -1
Степень окисления F во всех соединениях равна « -1». Na +1 F -1 , H +1 F -1