Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука
Пользуйтесь нашим приложением
11 класс.
 Химия. Окислительно-восстановительные реакции — Окислительно-восстановительные реакцииКомментарии преподавателя
Химия. Окислительно-восстановительные реакции — Окислительно-восстановительные реакцииКомментарии преподавателя1. Понятие ОВР, определение окислителей и восстановителей
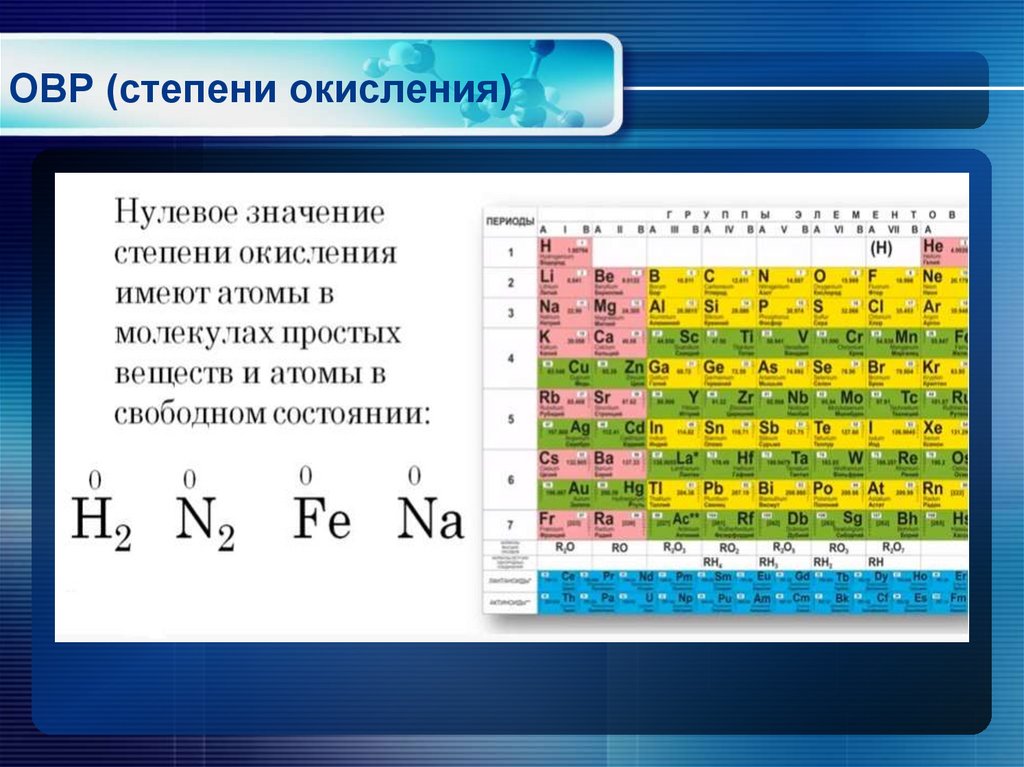
Реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными. Изменение степеней окисления происходит из-за перехода электронов от восстановителя к окислителю. Степень окисления – это формальный заряд атома, если считать, что все связи в соединении являются ионными.
Окислитель – это вещество, молекулы или ионы которого принимает электроны. Если элемент является окислителем, его степень окисления понижается.
О02 +4е-→ 2О-2 (Окислитель, процесс восстановления)
Процесс приема веществами электронов называется восстановлением. Окислитель в ходе процесса восстанавливается.
Восстановитель – это вещество, молекулы или ионы которого отдают электроны. У восстановителя степень окисления повышается.
У восстановителя степень окисления повышается.
S0 -4е- →S+4 (Восстановитель, процесс окисления)
Процесс отдачи электронов называется окислением. Восстановитель в ходе процесса окисляется.
2. Составление схемы электронного баланса
Пример №1. Получение хлора в лаборатории
В лаборатории хлор получают из перманганата калия и концентрированной соляной кислоты. В колбу Вюрца помещают кристаллы перманганата калия. Закрывают колбу пробкой с капельной воронкой. В воронку наливается соляная кислота. Соляная кислота приливается из капельной воронки. Сразу же начинается энергичное выделение хлора. Через газоотводную трубку хлор постепенно заполняет цилиндр, вытесняя из него воздух. Рис. 1.
Рис. 1
На примере этой реакции рассмотрим, как составлять электронный баланс.
1. Запишем схему этой реакции:
KMnO4 + HCI = KCI + MnCI2 + CI2 + h3O
2. Расставим степени окисления всех элементов в веществах, участвующих в реакции:
K+Mn+7O-24 + H+CI- = K+CI- + Mn+2CI-2 + CI02 + H+2O-2
Степени окисления поменяли марганец и хлор.
3. Составляем схему, отражающую процесс перехода электронов:
Mn+7+5е- = Mn+2 окислитель, процесс восстановление
2 CI- -2е- = CI02 восстановитель, процесс окисление
4. Уравняем число отданных и принятых электронов. Для этого находим наименьшее общее кратное для чисел 5 и 2. Это 10. В результате деления наименьшего общего кратного на число отданных и принятых электронов, находим коэффициенты перед окислителем и восстановителем.
Mn+7+5е- = Mn+2 2
2 CI- -2е- = CI02 5
5. Переносим коэффициенты в исходную схему и преобразуем уравнение реакции.
2KMnO4 + ? HCI = ?KCI + 2MnCI2 + 5CI2 +? h3O
Однако перед формулой соляной кислоты не поставлен коэффициент, так как не все хлоридные ионы участвовали в окислительно-восстановительном процессе. Метод электронного баланса позволяет уравнивать только ионы, участвующие в окислительно-восстановительном процессе. Поэтому нужно уравнять количество ионов, не участвующих в окислительно-восстановительной реакции. А именно катионов калия, водорода и хлоридных анионов. В результате получается следующее уравнение:
А именно катионов калия, водорода и хлоридных анионов. В результате получается следующее уравнение:
2KMnO4 + 16 HCI = 2KCI + 2MnCI2 + 5CI2 + 8h3O
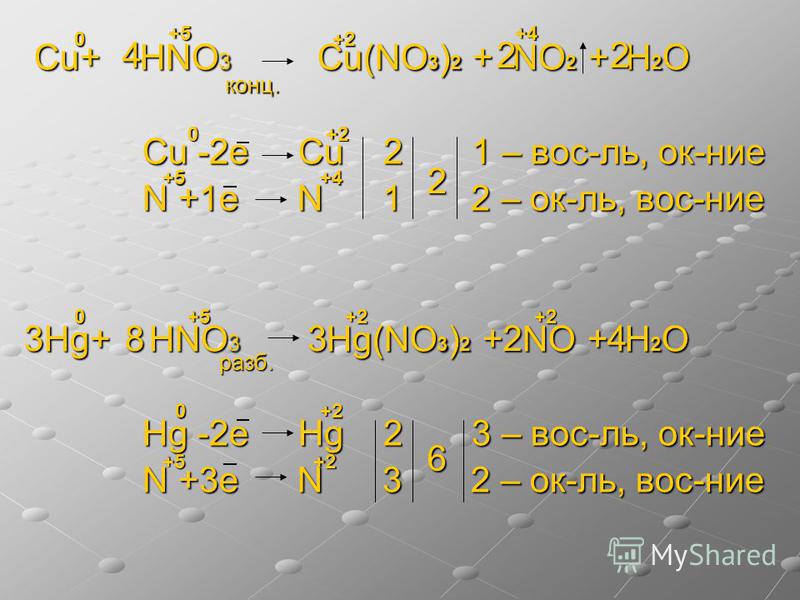
Пример №2. Взаимодействие меди с концентрированной азотной кислотой. Рис. 2.
В стакан с 10 мл кислоты поместили «медную» монету. Быстро началось выделение бурого газа (особенно эффектно выглядели бурые пузырьки в еще бесцветной жидкости). Все пространство над жидкостью стало бурым, из стакана валили бурые пары. Раствор окрасился в зеленый цвет. Реакция постоянно ускорялась. Примерно через полминуты раствор стал синим, а через две минуты реакция начала замедляться. Монета полностью не растворилась, но сильно потеряла в толщине (ее можно было изогнуть пальцами). Зеленая окраска раствора в начальной стадии реакции обусловлена продуктами восстановления азотной кислоты.
Рис. 2
1. Запишем схему этой реакции:
Cu + HNO3 = Cu (NO3)2 + NO2↑ + h3O
2. Расставим степени окисления всех элементов в веществах, участвующих в реакции:
Cu0 + H+N+5O-23 = Cu+2(N+5O-23)2 + N+4O-22↑ + H+2O-2
Степени окисления поменяли медь и азот.
3. Составляем схему, отражающую процесс перехода электронов:
N+5+е- = N+4 окислитель, процесс восстановление
Cu0 -2е- = Cu+2 восстановитель, процесс окисление
4. Уравняем число отданных и принятых электронов. Для этого находим наименьшее общее кратное для чисел 1 и 2. Это 2. В результате деления наименьшего общего кратного на число отданных и принятых электронов, находим коэффициенты перед окислителем и восстановителем.
N+5+е- = N+4 2
Cu0 -2е- = Cu+2 1
5. Переносим коэффициенты в исходную схему и преобразуем уравнение реакции.
Cu + ?HNO3 = Cu (NO3)2 + 2NO2↑ + 2h3O
Азотная кислота участвует не только в окислительно-восстановительной реакции, поэтому коэффициент сначала не пишется. В результате, окончательно получается следующее уравнение:
Cu + 4HNO3 = Cu (NO3)2 + 2NO2↑+ 2h3O
3. Классификация ОВР
Классификация окислительно-восстановительных реакций
1. Межмолекулярные окислительно-восстановительные реакции.
Это реакции, в которых окислителем и восстановителем являются разные вещества.
Н2S-2 + Cl02 → S0 + 2HCl-
2. Внутримолекулярные реакции, в которых окисляющиеся и останавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H+2O-2 → 2H02 + O02
3. Диспропорционирование (самоокисление-самовосстановление) – реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl02 + h3O → HCl+O + HCl-
4. Конпропорционирование (Репропорционирование) – реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления
5. N-3h5N+5O3 → N+2O + 2h3O
4/ Факторы, влияющие на продукты окисления
Факторы, влияющие на конечные продукты реакции
При протекании окислительно-восстановительных реакций, конечные продукты зависят от многих факторов.
· Состав реагирующих веществ
· Температура
· Концентрация
· Кислотность среды
ИСТОЧНИКИ
источник видео — http://www. youtube.com/watch?v=l2j57kNSLEk
youtube.com/watch?v=l2j57kNSLEk
источник видео — http://www.youtube.com/watch?v=bz65sRqJUjQ
источник презентации — http://ppt4web.ru/khimija/okislitelnovosstanovitelnye-reakcii3.html
http://interneturok.ru/ru/school/chemistry/11-klass — конспект
Какова степень окисления $ CuN{O_3} $ .
Ответить
Проверено
160,5 тыс.+ просмотров
Подсказка: Степень окисления — это общее количество электронов, полученных или потерянных атомом при образовании связи с другим атомом. Окисление также известно как степень окисления элемента. Степень окисления ионного соединения равна чистому общему заряду соединения.
Полный ответ:
Степень окисления ионного соединения – это общий заряд соединения. Когда атом образует катион или анион, заряд, приобретаемый элементом, также называется степенью окисления или степенью окисления элемента. Здесь суммарный заряд соединения $CuN{O_3}$ равен нулю. Таким образом, мы можем сказать, что он электрически нейтрален. Также известно, что степень окисления атомов кислорода $-2$. Поэтому для трех молей атома кислорода имеем $ 3{\text{ }} \times {\text{ }}\left( { — 2} \right){\text{ = — 6}} $ . Данное соединение можно разбить как $ = {\text{ — 1 + 1 = 0}} $
Здесь суммарный заряд соединения $CuN{O_3}$ равен нулю. Таким образом, мы можем сказать, что он электрически нейтрален. Также известно, что степень окисления атомов кислорода $-2$. Поэтому для трех молей атома кислорода имеем $ 3{\text{ }} \times {\text{ }}\left( { — 2} \right){\text{ = — 6}} $ . Данное соединение можно разбить как $ = {\text{ — 1 + 1 = 0}} $
$ CuN{O_3}{\text{ }}\xrightarrow{{}}{\text{ Cu + N}}{{\text{O}}_3} $
Сумма производимых зарядов должна быть равна нулю. Поэтому мы докажем, что как,
Суммарный заряд $ {\text{N}}{{\text{O}}_3} $ будет рассчитываться как, $ + 5{\text{ + 3}}\left( { — 2} \right) $ равно $ — 1 $ .
Суммарный заряд меди будет равен $ = {\text{ + 1}} $
Таким образом, суммарный заряд образовавшегося иона равен $ = {\text{ — 1 + 1 = 0}} $
Отсюда полный заряд на реагенты равен суммарному расходу на продукты. Таким образом, уравнение можно записать в виде 9{ — 1} $
Примечание:
Степень окисления ионных соединений – это заряд ионов. Это связано с тем, что степень окисления кислорода принимается равной $-2$. Также для азота принимается $+5$. Медь проявляет две степени окисления $+2$ и $+1$. Здесь степень окисления меди $+1$. Когда степень окисления меди $ + 2 $, то используется два моля нитрата.
Это связано с тем, что степень окисления кислорода принимается равной $-2$. Также для азота принимается $+5$. Медь проявляет две степени окисления $+2$ и $+1$. Здесь степень окисления меди $+1$. Когда степень окисления меди $ + 2 $, то используется два моля нитрата.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класс химия JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класса химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций 12 химического класса JEE_Main
Актуальные сомнения
Какова степень окисления меди в cuno32? – Easyerwithpractice.
 com
comКакова степень окисления меди в cuno32?
Cu(NO3)2 представляет собой ионное соединение со степенью окисления «0». Поэтому мы знаем, что сумма всех степеней окисления Cu, N и O равна 0. 1) заряды элементов, так как это ионная связь. Cu=+2, N=+5, O=-2.
Какая степень окисления у I2?
0
Какова степень окисления I в I3?
-1
Какая степень окисления у h3S4O6?
Где 1 — степень окисления водорода, а −2 — степень окисления кислорода, которые умножаются на число составляющих атомов. Следовательно, степень окисления серы в h3S4O6 равна 2,5.
Имеет ли h3S4O6 связь SS?
Мы можем ясно видеть, что количество присутствующих связей S-S равно 3, в общей формуле оксокислот количество присутствующих связей S-S будет (n-1). Следовательно, 3 связи S-S образованы h3S4O6. Примечание. Степень окисления 2 атомов серы в тетратионовой кислоте равна +5.
Какая степень окисления у h3S2O6?
Ответ: h3S2O6 = 0 (СУММА ЧИСЛА ОКИСЛЕНИЯ ВСЕХ ЭЛЕМЕНТОВ В СОЕДИНЕНИИ РАВНА НОЛЬ. ) ПОЭТОМУ ЧИСЛО ОКИСЛЕНИЯ СЕРЫ РАВНО 3.
) ПОЭТОМУ ЧИСЛО ОКИСЛЕНИЯ СЕРЫ РАВНО 3.
Как называется h3S4O6?
Тетратионовая кислота
Как называется h3 s2 o7?
Кислота серная
Как называется кислота hCl4 2 балла?
Кислоты
| HClO4 | хлорная кислота |
|---|---|
| h3SO4 | серная кислота |
| HNO2 | азотистая кислота |
| HI (водный) | йодистоводородная кислота |
| Ch4COOH | уксусная кислота |
Почему h3s2o7 называют дымящей серной кислотой?
Из-за тенденции к выделению трехокиси серы при контакте с воздухом олеум также известен как «дымящая серная кислота».
Как называется h3S2O6?
Дитионовая кислота
Является ли h3so4 оксикислотой?
D. Оксикислота – это кислота, содержащая атом кислорода, связанный с атомом водорода, и по крайней мере один другой элемент. Примеры: серная кислота (h3SO4), фосфорная кислота (h4PO4) и азотная кислота (HNO3) являются оксикислотами.
Примеры: серная кислота (h3SO4), фосфорная кислота (h4PO4) и азотная кислота (HNO3) являются оксикислотами.
Какая оксикислота не имеет мостиковой оксисвязи?
Хлорная кислота HClO4 не содержит перекисной связи.
Сколько существует оксокислот серы?
Оксокислота серы
| Кислота | Формула | Формальная степень окисления |
|---|---|---|
| Дитионовая кислота | h3S2O6 | +5 |
| Тиосерная кислота | h3S2O3 | 0 (для конечной серы), +4 (для центрального атома) |
| Сернистая кислота или пиросернистая кислота | h3S2O5 | +5 (атома серы, связанного с 3 атомами кислорода), +3 (другого атома серы) |
| Сернистая кислота | h3SO3 | +4 |
Является ли h3s2o7 пирокислотой?
Пиросерная кислота – это сильная кислота, которая является основным компонентом «дымящей» серной кислоты (олеума). Он также широко известен как дисульфуровая кислота.
Он также широко известен как дисульфуровая кислота.
Какая оксокислота Sulphur имеет связь OO?
h3S2O8 имеет связь -O-O-.
Как определить оксокислоты?
Более конкретно, оксокислота – это кислота, которая:
- содержит кислород.
- содержит как минимум еще один элемент.
- имеет по крайней мере один атом водорода, связанный с кислородом.
- образует ион за счет потери одного или нескольких протонов в растворе.
Что такое hcio2?
Хлористая кислота представляет собой неорганическое соединение с формулой HClO2. Это слабая кислота. В этой кислоте хлор имеет степень окисления +3. Хотя кислоту трудно получить в чистом виде, сопряженное основание, хлорит, полученное из этой кислоты, стабильно.
Как восстановить баланс pH кожи?
Как восстановить pH-баланс кожи естественным путем
- Витамин С — попробуйте усилитель витамина С!
- Отшелушивающие средства с AHA и BHA.


 12.18
12.18