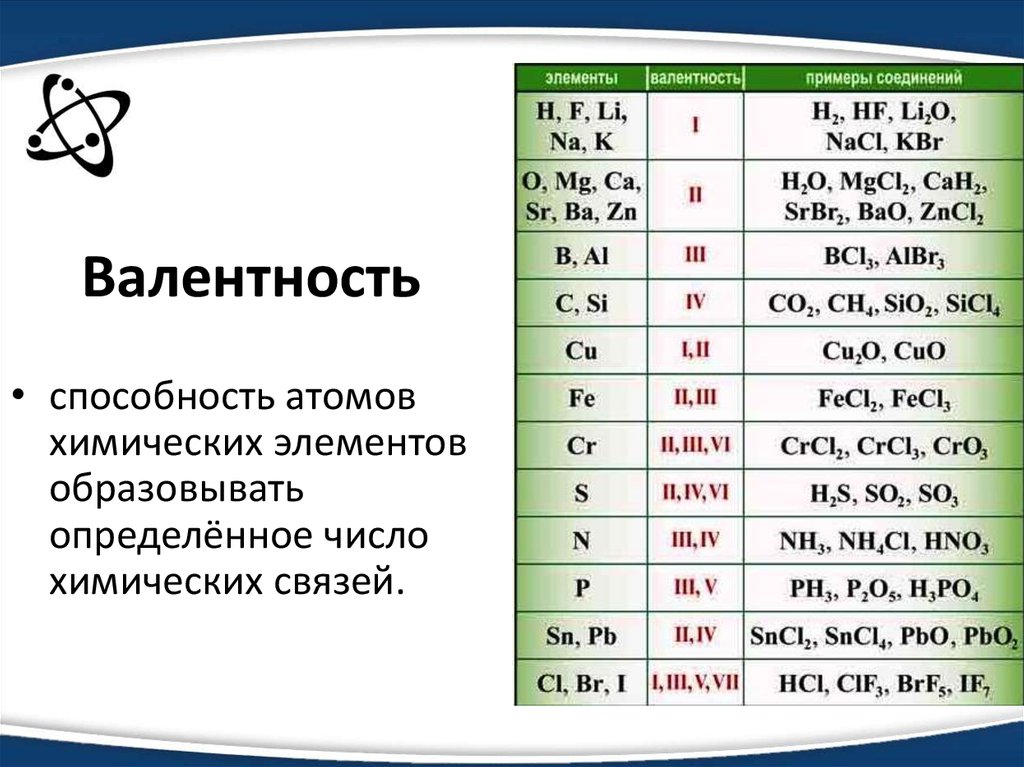
What, How To Balance & FAQs – Lambda Geeks
MnO2 is a basic oxide of Mn having a lower oxidation state and it can react with H2SO4 at any condition. Let us see the reaction mechanism between H2SO4 и MnO2.
Manganese dioxide is a reducing agent because of the oxidation number of Mn is +4 and can oxidation to increase its oxidation number and reduce other elements. MnO2 can use in several ORR (oxygen reduction reactions) in plants or in vivo. Where H2SO4 has higher affinity to water molecules and rapidly reacts with it.
The reaction between MnO2 и Н2SO4 не требует катализатор and even can occur in diluted conditions. Let us discuss the mechanism of the reaction between sulfuric acid and manganese, the reaction enthalpy, the type of reaction, product formation, etc in the following part of the article.
1. Чему равно произведение H
2SO4 и MnO2?Сульфат марганца образуется в качестве основного продукта, когда H2SO4 и MnO2 реагируют вместе с молекулами воды, и выделяется газообразный кислород.
H2SO4 + MnO2 = MnSO4 + H2О + О2
2. Какой тип реакции Н
2SO4 + MnO2?Реакция между H2SO4 + MnO2 is mainly a redox reaction along with displacement and precipitation reactions. It is also an acid-base neutralization reaction.
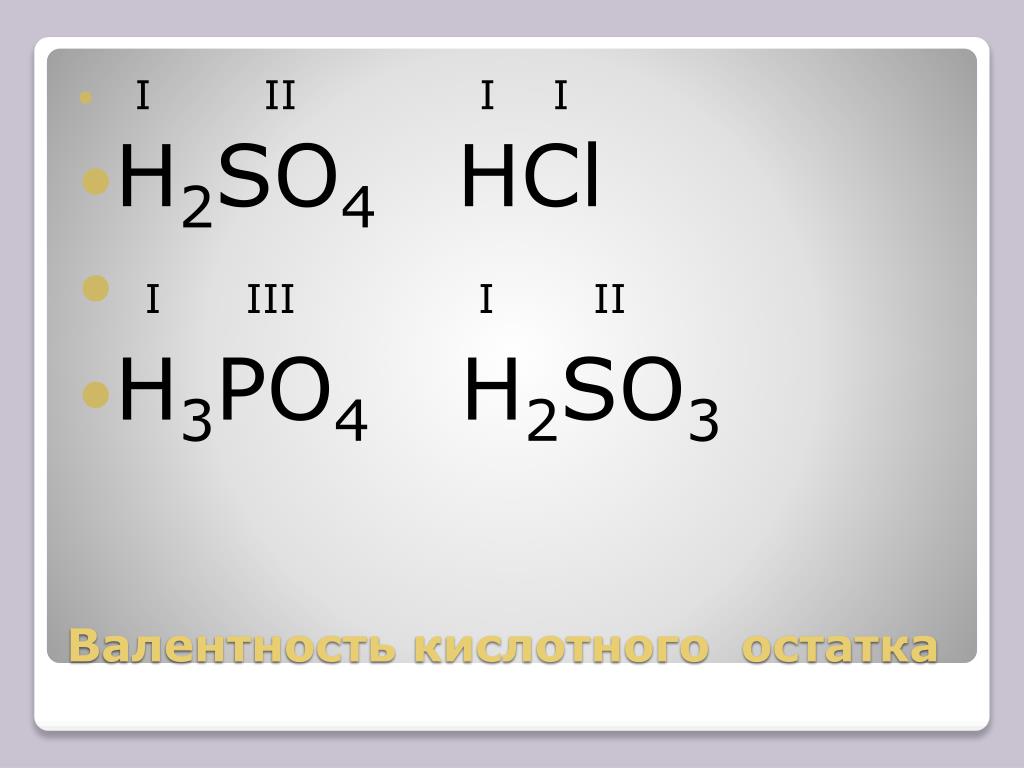
3. Как сбалансировать H
2SO4 + MnO2?Мы должны сбалансировать уравнение,
H2SO4 + MnO2 = MnSO4 + H2О + О2 следующим образом:
- Во-первых, мы помечаем все реагенты и продукты буквами A, B, C, D и E, так как для этой реакции получено только пять различных атомов, и реакция выглядит следующим образом.
 : AH2SO4 + B MnO2 = C MnSO4 + ЦТ2О + ЭО2
: AH2SO4 + B MnO2 = C MnSO4 + ЦТ2О + ЭО2 - Приравнивание всех коэффициентов для всех однотипных элементов путем их перестановки
- After the rearrangement of all the coefficients of the same elements by their stoichiometric proportion we get,
- H = 2A = 2D, S = A = C, O = 4A = 2B = 4C = D = 2E, Mn = B = C
- Используя исключение Гаусса и приравнивая все уравнения, мы получаем A = 2, B = 2, C = 2, D = 2 и E = 1.
- Теперь запишите все уравнение в сбалансированной форме
- Общее сбалансированное уравнение будет,
2H2SO4 + 2MnO2 = 2MnSO4+ 2H2О + О2
- Общее сбалансированное уравнение будет,
4.
 Ч2SO4 + MnO2 титрование
Ч2SO4 + MnO2 титрованиеTo estimate the quantity of manganese we can perform a titration between MnO2 и Н2SO4
Используемый аппарат
Для этого титрования нам потребуются бюретка, коническая колба, держатель бюретки, мерная колба и стаканы.
Титр и титрант
H2SO4 acts as a titrant which is taken in the burette and the molecule to be analyzed are MnO2 который отбирают в коническую колбу.
Индикаторные
Все титрование проводят в кислой среде, так как концентрация H2SO4 is high and for this reaction, MnO2 действует как самоиндикатор, потому что это окрашенный раствор и при разном pH он меняет цвет.
Процедура
Бюретка была заполнена стандартизированным H2SO4 and MnO2 отбирали в коническую колбу вместе с соответствующим индикатором. ЧАС2SO4 is added dropwise to the conical flask and the flask was shaking constantly. After a certain time when the endpoint arrived, MnO2 меняет свой цвет.
Мы повторяем титрование несколько раз для получения лучших результатов, а затем оцениваем количество марганца и сульфата по формуле V1S1 V =2S2.
5. Ч
2SO4+ MnO2 чистое ионное уравнениеЧистое ионное уравнение между H2SO4 + MnO2 как следует,
H+ + ТАК42- + Мн4+ + 2О2- = Мн2+ + ТАК42- + H+ + OH– + О2
Чтобы получить чистое ионное уравнение, необходимы следующие шаги:
- Первый Н2SO4 будет ионизирован протонными и сульфат-ионами, так как это сильный электролит
- After that MnO2 также диссоциирует на Mn4+ И O2-.

- После этого продукт MnSO4 также диссоциирует на Mn2+ что д5 стабильная конфигурация и соответствующий SO42-.
- Вода также ионизируется до H+ и ОН-.
- O2 остается в газообразном состоянии.
6. Ч
2SO4+ MnO2 conjugate pairsH2SO4 + MnO2 сопряженные пары будут соответствующими депротонированными и протонированными формами этого конкретного вида, которые перечислены ниже:
- Сопряженная пара H2SO4 = ТАК42-
- Сопряженная пара ОН– = Н2O
7.
 Ч2SO4 and MnO2 intermolecular forces
Ч2SO4 and MnO2 intermolecular forcesМежмолекулярная сила между H2SO4 is an electrostatic, covalent force. For MnO2, ionic interaction is present. In MnSO4, наряду с дипольной силой присутствуют сильные ионные взаимодействия, а для воды присутствует водородная связь и присутствует кислородная сила Ван-дер-Ваальса.
| молекула | и.о. сила |
| H2SO4 | электростатический, Ван дер Вааль Диполь взаимодействие |
| MnO2 | Ionic, and электростатический |
| MnSO4 | Кулоновская сила, сильный ионный взаимодействие |
| H2O | ковалентный, Н-связь |
| O2 | Сила Ван-дер-Вааля и сила Лондона |
8.
 ЧАС2SO4 + MnO2 энтальпия реакции
ЧАС2SO4 + MnO2 энтальпия реакцииH2SO4 + MnO2 энтальпия реакции составляет -2088.34 кДж/моль, что можно получить по формуле энтальпия продуктов – энтальпия реагентов, причем изменение энтальпии отрицательно.
| молекула | энтальпия (кДж/моль) |
| MnO2 | -520 |
| H2SO4 | -814 |
| MnSO4 | -220.83 |
| H2O | -68 |
| O2 | 0 |
9.
 Н2SO4 + MnO2 буферный раствор?
Н2SO4 + MnO2 буферный раствор?Реакция между H2SO4 + MnO2 дает буферный раствор of MnSO4 и Н2O and this mixture can control the pH of the whole solution even after adding acid.
10. Н
2SO4 + MnO2 полная реакция?Реакция между H2SO4 + MnO2 является полным, потому что дает один полный продукт MnSO4 вместе с молекулой воды и газообразным кислородом. Таким образом, реагенты используются.
11 Н2SO4 + MnO2 экзотермическая или эндотермическая реакция?Реакция Н2SO4 + MnO2 is exothermic in terms of thermodynamics first law. So, the reaction released energy and temperature to the surrounding which helps to proceed with the reaction, where δH is always negative.
So, the reaction released energy and temperature to the surrounding which helps to proceed with the reaction, where δH is always negative.
12. Н
2SO4 + MnO2 окислительно-восстановительная реакция?Реакция между H2SO4 + MnO2 — это окислительно-восстановительная реакция because in this reaction many elements get reduced and oxidized. Here, Mn gets reduced and sulfur gets oxidized.
Окислительно-восстановительная схемаH2SO4 и MnO2 реакция
13. Н
2SO4 + MnO2 реакция осажденияРеакция Н2SO4 + MnO2 является реакцией осаждения, потому что MnSO4 gets precipitated in the solution and is not soluble in the reaction mixture even in an acidic medium.
14. Н
2SO4 + MnO2 обратимая или необратимая реакция?Реакция между H2SO4+ MnO2 является необратимым, потому что мы получаем кислород, который формируется в виде газа. При образовании газообразной молекулы энтропия реакции возрастает, равновесие смещается вправо и движется в прямом направлении.
15. Н
2SO4 + MnO2 реакция смещения?Реакция между H2SO4+ MnO2 является примером реакция двойного замещения потому что в реакции Mn вытеснил H+ в H2SO4 и Н+ also displaced Mn from MnO2.
Двойная реакция смещенияЗаключение
H2SO4 и MnO2 реакции в основном дают нам MnSO4 along with water and oxygen gas. So, this reaction is very much important for the production of oxygen gas. MnO2 is one of the most important molecules for organometallic chemistry and it is under several reactions like ORR and evolved oxygen in vivo. MnO2 is a non-stoichiometric deficient cluster having several vacant sites.
So, this reaction is very much important for the production of oxygen gas. MnO2 is one of the most important molecules for organometallic chemistry and it is under several reactions like ORR and evolved oxygen in vivo. MnO2 is a non-stoichiometric deficient cluster having several vacant sites.
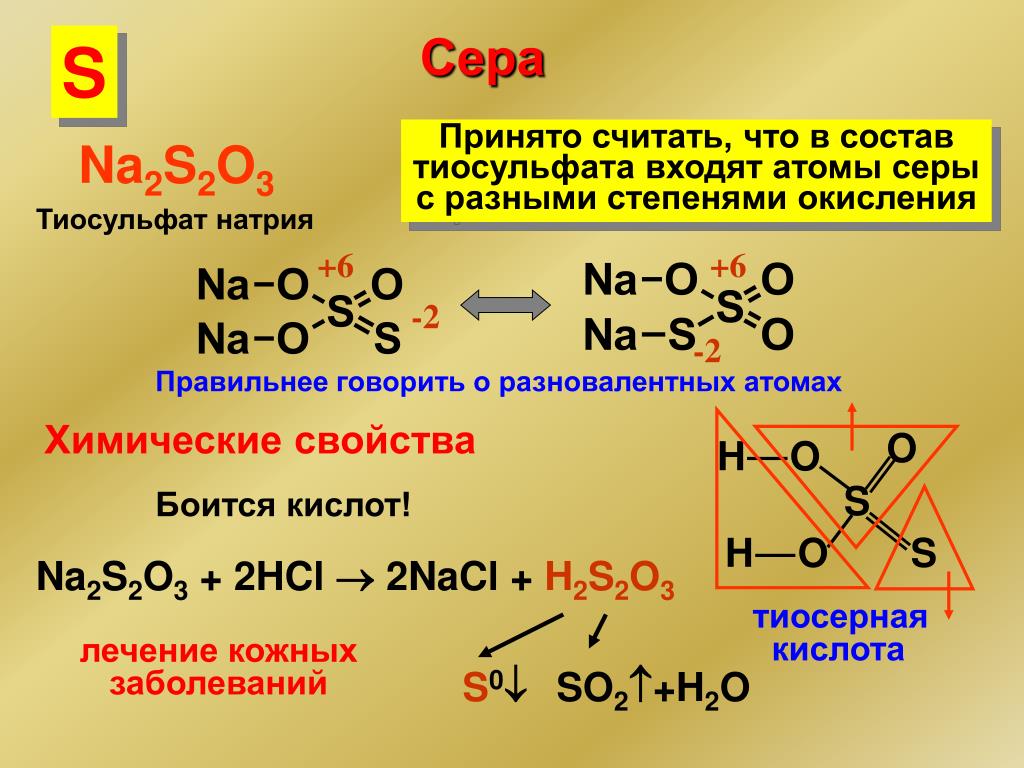
Степень — окисление — сера
Cтраница 2
Реакции с изменением степени окисления серы для разбавленной h3SO4 нехарактерны. [16]
В первой реакции изменяется степень окисления серы и кислорода, во второй — водорода и цинка, в третьей — железа и иода. [17]
Поскольку в молекуле сероводорода степень окисления серы равна — 2, а в молекуле серной кислоты она равна 6, делаем вывод, что 1 молекуле h3S соответствуют 8 электронов. [18]
Это было удивительно: формально степень окисления серы в S207 и SO4 оказывалась равной VII и VIII, а сера находится в VIA-группе Периодической системы, имеет только 6 валентных электронов и не может иметь степень окисления выше чем VI. ..
[19]
..
[19]
Процессы, связанные с повышением степени окисления серы, в самом SO2 протекают несколько труднее. [20]
Реакции, протекающие с понижением степени окисления серы, например уже отмеченное выше взаимодействие сернистой и сероводородной кислот. [21]
В приведенных примерах наблюдается изменение степени окисления серы и фосфора. [22]
При соприкосновении SO2 с h3S, в котором степень окисления серы наинизшая, 5О2 выступает в роли окислителя и восстанавливается до свободной серы, а сероводород окисляется до свободной серы. [23]
Приведите уравнения известных вам реакций сернистого газа, в которых степень окисления серы: а) не меняется; б) повышается; в) понижается. [24]
Приведите по два примера реакций с участием S02, в которых степень окисления серы: а) повышается; б) понижается; в) не изменяется. [25]
Так, по данным [430], токсичность сернистых соединений уменьшается с возрастанием степени окисления серы.
Второй пример — окисление SC2 в 5Оз и НЗОз в HSO В обоих случаях степень окисления серы изменяется от 4 до f6, т.е. происходит один и тот же процесс окисления. [27]
Поэтому их формулы следует изображать так S2O5 ( 02) и S02 ( 02) Степень окисления серы в обоих случаях равна VI Необычные соединения ( не оксиды, а пероксиды. [28]
Наряду с описанным рядом превращений ( сульфиды — HzS — S — HaSOi — сульфаты), наблюдаемых в природе и ведущих к повышению степени окисления серы, происходят восстановительные процессы, приводящие снова к образованию сероводорода. [29]
Оценка редокс-свойств оксианионов серы, проведенная нами ранее, показала, что в ряду производных сернистой кислоты пиросуль-фит-ион, рассматриваемый как внутримолекулярная редокс-система со степенью окисления серы 4 и 6 и способный в растворе образовывать потенциалопределяющие редокс-системы, обладает повышенной нуклеофильностыо.
Страницы: 1 2 3
Почему степень окисления S равна +4, когда сера реагирует с h3SO4, а степень окисления S равна +6, когда она реагирует с HNO3?
значок-вопрос Спросите репетитораНачать бесплатную пробную версию
Скачать PDF PDF Цитата страницы Цитировать Поделиться ссылкой ДелитьсяСсылайтесь на эту страницу следующим образом:
«Почему степень окисления S равна +4, когда сера реагирует с h3SO4, а степень окисления S равна +6, когда она реагирует с HNO3?» eNotes Editorial , 15 октября 2015 г.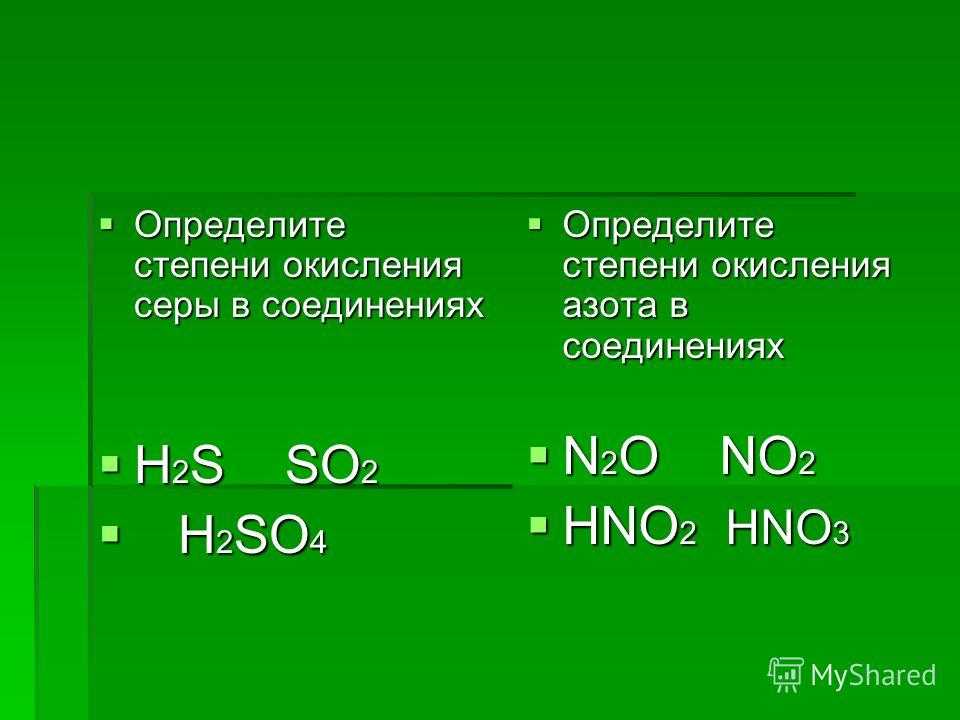 , https://www.enotes.com/homework-help/my-question-that-why-oxidation-state-s-4-when-524319.
По состоянию на 8 декабря 2022 г.
, https://www.enotes.com/homework-help/my-question-that-why-oxidation-state-s-4-when-524319.
По состоянию на 8 декабря 2022 г.Когда сера реагирует с концентрированной серной кислотой, она окисляется до диоксида серы следующим образом:
S + 2 h3SO4 → 3 SO2 + 2 h3O
Сера имеет степень окисления +6 в h3SO4. Обратите внимание, что поскольку сера имеет степень окисления +6 в h3SO4, а степень окисления в SO2 достигает +4, сера в SO2 восстанавливается, а свободная сера, переходя от 0 до +4, окисляется. Это называется сопропорционированием, при котором один атом реагента, существующий в двух формах, в результате реакции достигает одинаковой степени окисления в одном продукте. Это противоположно диспропорционированию, когда элемент из одного реагента одновременно окисляется и восстанавливается, проявляясь в двух разных реагентах.
При реакции серы с азотной кислотой следующим образом:
S + 6HNO3 → h3SO4 + 2 h3O + 6 NO2
Сера окисляется из нулевой степени окисления до +6. Азотная кислота является окислителем, окисляющим серу сначала до SO2, а затем до SO3, который по существу является ангидридом h3SO4.
Азотная кислота является окислителем, окисляющим серу сначала до SO2, а затем до SO3, который по существу является ангидридом h3SO4.
Назад к первой реакции: серная кислота способна окислять элементарную серу, как показано. Это приводит к тому, что сера получает кислород, как это было во второй реакции. Однако это также приводит к восстановлению S в кислоте, поскольку азот восстанавливается во второй реакции, когда кислород переходит от оксианиона к восстановленной сере.
На самом деле это не связано с относительными концентрациями кислоты, это связано с относительной склонностью S и N восстанавливаться в соответствующих соединениях. Хотя первая реакция протекает только в концентрированной серной кислоте. Серная кислота не обязательно более концентрированная, чем азотная. Обе являются сильными кислотами, которые диссоциируют на 100%, а серная кислота является двухосновной, поэтому, если концентрации двух кислот равны, серная кислота будет иметь более высокую концентрацию ионов водорода.
Утверждено редакцией eNotes
Наука
Последний ответ опубликован 17 июля 2012 г. в 14:55:17.
Каковы три части клеточной теории?
16 Ответы педагога
Наука
Последний ответ опубликован 21 июня 2018 г. в 17:01:30.
Какие десять примеров решений вы можете найти у себя дома?
2 Ответы воспитателя
Наука
Последний ответ опубликован 19 сентября 2015 г. в 21:37:47.
Каковы четыре основные функции компьютерной системы?
2 Ответы воспитателя
Наука
Последний ответ опубликован 06 июля 2009 г.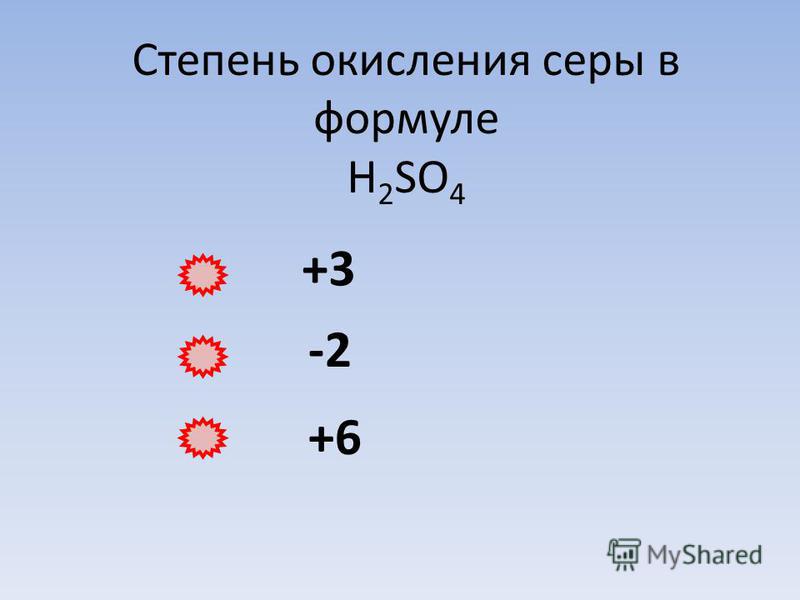 в 21:23:22.
в 21:23:22.
Каковы функции компьютера?
7 Ответы педагога
Наука
Последний ответ опубликован 23 июня 2012 г. в 17:12:04.
В чем сходство и различие фотосинтеза и дыхания? Сравните и сопоставьте основные пути фотосинтеза и дыхания.
3 Ответа воспитателя
Реакция углерода и серной кислоты
Концентрированная серная кислота представляет собой окисляющую кислоту, которая может окислять углерод до двуокиси углерода, серная кислота восстанавливается до диоксид серы. Это окислительно-восстановительная реакция, потому что степени окисления атомы углерода и серы меняются. В этом уроке мы обсудим характеристики реакции углерода и серной кислоты.
C + H
2 SO 4 → CO 2 + SO 2 + H 2 OУсловия реакции
Для окисления углерода до диоксида углерода следует использовать горячую концентрированную серную кислоту. За это время атом серы в серной кислоте восстанавливается до диоксида серы. Следовательно, это окислительно-восстановительная реакция.
За это время атом серы в серной кислоте восстанавливается до диоксида серы. Следовательно, это окислительно-восстановительная реакция.
Продукты реакции
- Углерод окисляется до бесцветного газообразного диоксида углерода (CO 2 ). Степень окисления углерода увеличивается от 0 до +4.
- Серная кислота восстанавливается до бесцветного газообразного диоксида серы. Степень окисления серы снижается с +6 до +4. Следовательно, горячая концентрированная серная кислота ведет себя как окисляющая кислота.
- Вода также образуется как продукт.
Как сбалансировать реакцию углерода и серной кислоты
Поскольку эта реакция является окислительно-восстановительной реакцией, мы можем следовать теориям балансировки окислительно-восстановительных химических уравнений. Ниже каждый шаг Балансировка подробно описана.
Определите, какие элементы окисляются и восстанавливаются
Мы уже узнали, что углерод окисляется, а атом серы восстанавливается в серной кислоте.
Количество окисленных и восстановленных атомов должно быть одинаковым
- Количество атомов углерода в левой (1) и правой (1) частях реакции одинаково, и их не нужно уравновешивать.
- Количество атомов серы в левой (1) и правой части (1) реакции одинаково, и их не нужно уравновешивать.
В чем разница степеней окисления соответствующих атомов?
- Степень окисления углерода увеличена с 0 до +4. Следовательно, разница степеней окисления углерода составляет 4,9.0097
- Степень окисления серы снижена с +4 до +4. Следовательно, разность степеней окисления углерода равна 2.
Разность обменных степеней окисления в простейшем соотношении
Разность степеней окисления углерода и серы составляет 4 и 2 соответственно. Поэтому соотношение 4:2. Вы можете упростить это соотношение как 2:1. Итак, курсовая разница.
C + 2H 2 SO 4 → CO 2 + 2SO 2 + H 2 O
Теперь окислительные и восстановительные атомы сбалансированы. Давайте сбалансируем остальные атомы, наблюдая левую и правую части реакции.
Давайте сбалансируем остальные атомы, наблюдая левую и правую части реакции.
C + 2H 2 SO 4 → CO 2 + 2SO 2 + 2H 2 O
0s0 заданный студентами вопрос и найти03 вопросы06 ответ бесплатно.
h3so4 или «серная кислота» или «серная кислота»
По обоим названиям и химической формуле определите одно и то же соединение. Серная кислота используется в американском английском, а серная кислота используется в британском английском.
Какие газы образуются при реакции серной кислоты с углеродом
При взаимодействии серной кислоты с углеродом образуются два газа. Это диоксид серы и диоксид углерода. Оба являются кислыми газами, а диоксид серы немного кислее, чем диоксид углерода.
Что произойдет, если к углю добавить разбавленную серную кислоту?
Разбавленная серная кислота не проявляет свойств окисляющей кислоты. Поэтому разбавленная серная кислота не реагировать с углеродом.

 : AH2SO4 + B MnO2 = C MnSO4 + ЦТ2О + ЭО2
: AH2SO4 + B MnO2 = C MnSO4 + ЦТ2О + ЭО2