Определите валентность и степень окисления углерода в сое… -reshimne.ru
Новые вопросы
Ответы
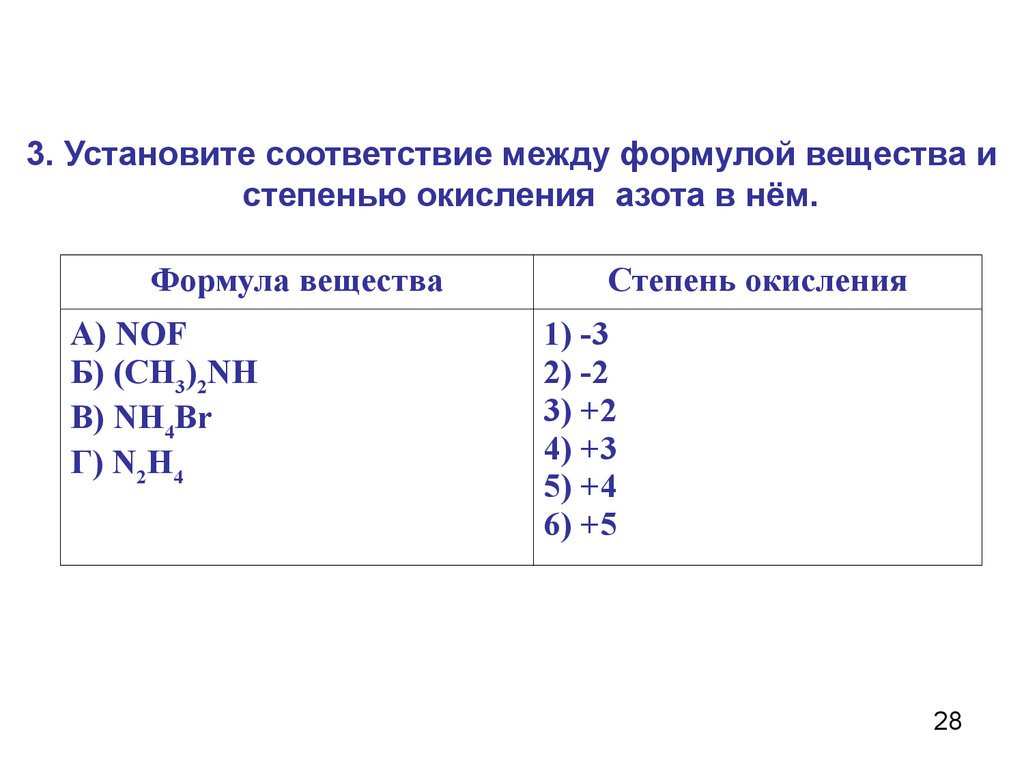
Валентность равна 4, а степень окисления -3
Похожие вопросы
Запишите уравнения в молекулярной и ионном виде
KOH+HCl
PbCl+NaOH…
Окислительно востоновительный баланс h3+cl2->hcl…
Расписать виды связей.
ClBr2
KJ
Nh4
Br2…
Какую массу имеет оксид кальция количеством вещества 0,75 моль…
Bas+niso4 уравнение ионного обмена. ..
..
7.По уравнению реакции h3SO4 + 2NaOH = Na2SO4 + 2Н2О рассчитайте
содержащего 49 г серной кислоты.
И пожалуйста напишите как решить
(если можно)
…
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
МузыкаПраво
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
Теория химического строения органических соединений А.
 М. Бутлерова
М. Бутлерова1. ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ А. М. БУТЛЕРОВА
Становление органической химии.Предпосылки теории строения
органических соединений
Ключевой вопрос Почему началом
становления органической химии как науки
считают вторую половину XIX века?
С древнейших времен
человечеству известны
различные соединения
углерода растительного
и животного происхождения и некоторые
способы их получения и
Рис. 1 Лаборатория
переработки.
XII века
План урока
1.
2.
3.
Становление
органической химии.
Предпосылки теории
строения органических
соединений.
Основные положения
теории химического
строения органических
соединений.
Значение теории и
направления её
дальнейшего развития.
Например:
Сбраживая виноградный сок, получали вино, а при его перегонке — спирт;
Нагревая жир с содой, получали мыло;
Из цветов извлекали эфирные масла;
В Древней Индии, Финикии, Египте для крашения использовали
растительные красители – пурпур, индиго, ализарин.

Однако в тот период, вплоть до начала XIX в., не делали различия между
органическими и неорганическими веществами.
В 1807 г. известный уже вам шведский учёный И. Я. Берцелиус предложил
выделить изучение веществ растительного и животного происхождения в
самостоятельную дисциплину – органическую химию. И. Я. Берцелиуса
считают родоначальником органической химии.
В начале XIX века в органической химии царил полный хаос. Ученые умели
определять качественный и количественный состав вещества, но не имели
представления о том, как атомы соединяются в молекулы, не пользовались
привычными для нас формулами, химические реакции описывали словами,
а не уравнениями реакций.
Нельзя сказать, что химики того времени не пытались обобщить и
систематизировать знания об органических веществах. В 30-е годы немецкими
химиками Ю. Либихом и Ф. Велером была предложена теория радикалов, в
40-е заметное место занимала теория типов французских химиков О. Лорана
и Ш.
 Жерара, существовали и другие разновидности теорий. Но одни из них
Жерара, существовали и другие разновидности теорий. Но одни из нихне подтверждались (или даже отвергались) экспериментом, другие объявляли
«внутреннее строение молекул» принципиально непознаваемым, допускали
множественность «рациональных» формул для одного и того же вещества.
На этом фоне следует выделить успешные попытки синтеза органических
веществ, а также введение понятия о валентности английским химиком Э.
Франкландом. Напомним одно из определений валентности ( хотя и не очень
строгое).
Валентность – это способность атома присоединять или
замещать определенное число атомов или групп атомов с
образованием химической связи.
Постепенное накопление экспериментального материала и попытки его
теоретического осмысления (см. таблицу) подготовили создание первой
научной теории строения органических соединений, автором которой явился
выдающийся русский химик Александр Михайлович Бутлеров.
Предпосылки теории строения.
Экспериментальные
Теоретические
1824 г.
 — Ф. Вёлер, получил
— Ф. Вёлер, получилщавелевую кислоту
1828 г. — Ф. Вёлер, получил
мочевину
1842 г. – Н. Н. Зинин,
получил анилин
1845 г. – А. Кольбе,
синтезировал уксусную
кислоту
1854 г. – М. Бертло,
получил жиры
1861 г. — А.М. Бутлеров,
получил углеводы
1852 г. — Э. Франкланд, ввёл понятие
о валентности
1857 г. — Ф. Кекуле, развил
представления о
четырехвалентности атомов
углерода в органических
соединениях
1858 г. — Ф. Кекуле и А. Купер
сделали вывод о возможности
соединения атомов С друг с другом
1860 г. — состоялся конгресс химиков
в Карлсруэ, положивший начало
атомно-молекулярному учению
19 сентября 1861 г. на съезде немецких врачей и натуралистов
в г. Шпейере он выступил с докладом «О химическом
строении веществ». Конечно, А. М. Бутлеров опирался на
труды своих предшественников и современников, но немалую
роль сыграли его личные качества: богатые знания, умение
сравнивать и делать выводы, обобщения, его нестандартное
мышление, целенаправленность научного поиска, умение
А.
 М. Бутлеров
М. Бутлеровотказаться от стереотипов, прекрасные эксперементальные
умения.
Задание с открытым ответом
Мини-исследование
Вспомните предпосылки основного закона неорганической химии — Периодического
закона и Периодической системы Д.И. Менделеева. Для этого можно заглянуть в
учебники за основную школу или в любой учебник(а также пособие по общей химии),
например, в учебник «Химия 11» О.С. Габриеляна, Г.Г. Лысовой. М., Дрофа.
Найдите общее в предпосылках двух ведущих теорий химии — Периодического закона
Д.И. Менделеева и теории химического строения органических соединений А.М.
Бутлерова.
Основные положения теории химического строения органических соединений
1.
2.
Атомы в молекулах соединены между собой в определенном порядке, в
соответствии с их валентностью. Этот порядок соединения атомов
называется химическим строением молекулы. Строение молекулы можно
установить химическими методами. Под химическими методами понимается
исследование химических свойств вещества или осуществление его синтеза,
который либо подтверждал, либо отвергал предполагаемую формулу
строения.
 Для доказательства этого А.М. Бутлеров сам осуществил
Для доказательства этого А.М. Бутлеров сам осуществилнесколько блестящих синтезов.
Атомы углерода могут соединяться друг с другом: а) разными по кратности
связями : одинарной
, двойной
б) в цепочки разного вида: прямые –С-С-С- , разветвленные
замкнутые
Причем разный вид углеродной цепи может сочетаться с наличием различных по
кратности химических связей между атомами углерода, а также связей с
другими атомами, например, кислородом, азотом, галогенами.
Важный вывод: такая особенность атомов углерода объясняет
многообразие органических соединений.
3. Свойства органических соединений зависят:
а) от качественного и количественного состава молекулы
Вещества
Форму
ла
Свойства
Метан
СН4
Газ без запаха, не растворим в воде
Метиловый
спирт
СН4О
Жидкость с характерным запахом,
неограниченно растворим в воде
Качественный состав веществ разный ► свойства разные.
б) от химического строения, т.
 е. порядка связей в молекуле с учетом
е. порядка связей в молекуле с учетомвзаимного влияния атомов.
Вещества
Формула строения
( структурная
формула)
Свойства
Этиловый спирт
Жидкость, неограниченно
растворим в воде.
Взаимодействует с
натрием
Диметиловый эфир
Газ, не растворим в воде.
Не взаимодействует с
натрием
У этих веществ: состав одинаковый С2Н6О, строение разное ► свойства
разные.
В молекуле этилового спирта один атом водорода связан не с атомом углерода, а с
атомом кислорода. Такое соседство делает атом водорода подвижным, что
выражается в его способности замещаться на атом натрия. Наличие группы –ОН
определяет его растворимость в воде и значительно более высокую температуру
кипения по сравнению с диметиловым эфиром.
Важный вывод: анализируя строение молекулы вещества, можно предсказать
его свойства, и, наоборот, на основании экспериментального изучения
свойств соединения определить его химическое строение.
Задание с открытым ответом
Проблемный вопрос
1.

Почему некоторые западные химики сознательно старались принизить и
даже отрицать заслуги А. М. Бутлерова?
2.
Какой самый главный вклад в развитие органической химии сделал А. М.
Бутлеров?
Значение теории и направления ее дальнейшего развития
Значение теории химического строения А.М. Бутлерова для
органической химии можно сравнить со значением
Периодического закона Д.И.Менделеева для неорганической
химии
Теория строения органических соединений:
объяснила неясности и противоречия в знаниях
об органических веществах,
творчески обобщила достижения в области
химии,
определила качественно новый подход к
пониманию строения соединений,
стала основой для объяснения и
прогнозирования свойств органических веществ,
открыла путь для синтеза новых органических
соединений.
Отстаивая свое учение о химическом строении, и показывая его
практическую значимость, А. М. Бутлеров не считал это учение
абсолютным и неизменным.
 Действительно, если молекула
Действительно, если молекулареальность, построенная из реальных атомов, то она должна
Я. Х. Вант-Гофф представлять собой определенное физическое тело в
трехмерном пространстве.
Конкретную гипотезу о пространственном ( стереохимическом)
строении органических соединений выдвинул в 1874 г. Я. Х.
Вант-Гофф. Идея заключалась в том, что четыре атома водорода ( или его заместителя) располагаются симметрично в углах
Рис. 2. Модель молекулы метана
воображаемого тетраэдра вокруг четырехвалентного
атома углерода.
Стереохимия с развитием науки получила прочную физическую основу — с
помощью рентгенографии и электрографии стали определять межатомные
расстояния и валентные углы, то есть получать картину реального расположения
атомов в молекуле.
В связи с научной революцией в физике в конце XIX — начале XX веков атом
предстал перед исследователями уже не просто неизменным «шариком», а
сложной системой. Это позволило американским физико-химикам Г.
 Льюису
Льюисуи И. Ленгмюру заложить основы теории валентных связей, на основании
которой валентная черточка классической теории представляет пару
электронов!
Молекулярная
Полная
Свернутая
Электронная
структурная
структурная
С2Н6
СН3-СН3
Рис.3 Различные формулы этана
Электронная теория позволила объяснить и пространственное строение молекул
органических веществ, и взаимное влияние атомов, и механизмы химических
реакций.
На последующих уроках вы подробнее познакомитесь с современными
(электронными и стереохимическими) представлениями о строении органических
соединений.
Задание с открытым ответом
Мини-исследование
Вспомните курс химии за основную школу и ответьте на вопрос:
как развивался важнейший закон неорганической химии Периодический закон и Периодическая система Д.И. Менделеева? В чем
выражалась его прогностическая роль?
Для этого можно также заглянуть в любой учебник или пособие по общей
химии.
 Например, в учебник «Химия 11» О.С. Габриеляна, Г.Г. Лысовой. М.,
Например, в учебник «Химия 11» О.С. Габриеляна, Г.Г. Лысовой. М.,Дрофа.
Найдите общее в направлениях развития и прогностической роли двух
ведущих теорий химии — Периодического закона Д.И. Менделеева и
теории химического строения органических соединений А.М. Бутлерова.
Задание с открытым ответом
Ключевой вопрос:
Почему началом становления органической химии считают вторую
половину XIX века?
Тест
Готовимся к ЕГЭ
1. Понятие «органическая химия» ввёл:
а) Ф. Вёлер
б) Я. Берцелиус
в) А. М. Бутлеров
г) К. Шорлеммер
2. Ученый, основоположник органической химии как науки,
это:
а) Й. Я. Берцелиус
б) Д. И. Менделеев
в) А. М. Бутлеров
г) А. Кекуле
3. Валентность атомов углерода в этилене равна:
а) двум
б) трём
в) четырём
г) пяти
4. Валентность и степень окисления атома углерода различны
по значению в веществе, формула которого:
а) СН4
б) СО2
в) СН2Cl2
г) CCl4
Домашнее задание:
Вариант 1
Какова степень окисления и валентность атомов углерода в этане C2H6? Как
объясняет валентность атома углерода теория строения А.
 М. Бутлерова?
М. Бутлерова?Явление изомерии более значительно распространено в органической химии, чем в
неорганической. Почему?
Ниже приведено несколько формул органических соединений. Одно из них имеет
изомеры. Напишите структурные формулы всех соединений и укажите изомеры:
C2h5, C3H6, C3H8, CH5N.
Вариант 2
Какова степень окисления и валентность атомов углерода в этилене C2h5? Как
объясняет валентность атома углерода теория строения А.М. Бутлерова?
Приведите из курса неорганической химии пример, подтверждающий, что атомы
при соединении в молекулы влияют друг на друга, и свойства веществ при этом
изменяются.
Ниже приведено несколько формул органических соединений. Одно из них имеет
изомеры. Напишите структурные формулы всех соединений и укажите изомеры:
Ch3О, C3H7Cl, C2Н2, Ch5O.
Ошибка 404 — Страница не найдена
К сожалению мы не можем показать то, что вы искали. Может быть, попробуете поиск по сайту или одну из приведенных ниже ссылок?
Архивы
Архивы Выберите месяц Октябрь 2022 Сентябрь 2022 Август 2022 Июль 2022 Июнь 2022 Май 2022 Апрель 2022 Март 2022 Февраль 2022 Январь 2022 Декабрь 2021 Ноябрь 2021 Октябрь 2021 Сентябрь 2021 Август 2021 Июль 2021 Июнь 2021 Май 2021 Апрель 2021 Март 2021 Февраль 2021 Январь 2021 Декабрь 2020 Ноябрь 2020 Октябрь 2020 Сентябрь 2020 Август 2020 Июль 2020 Июнь 2020 Май 2020 Апрель 2020 Март 2020 Февраль 2020 Январь 2020 Декабрь 2019 Ноябрь 2019 Октябрь 2019 Сентябрь 2019 Август 2019 Июль 2019 Июнь 2019 Май 2019 Апрель 2019 Март 2019 Февраль 2019 Январь 2019 Декабрь 2018 Ноябрь 2018 Октябрь 2018 Сентябрь 2018 Август 2018 Июль 2018 Июнь 2018 Февраль 2018 Январь 2018 Ноябрь 2017 Сентябрь 2017 Август 2017 Июль 2017 Апрель 2017 Март 2017 Февраль 2017 Январь 2017Рубрики
РубрикиВыберите рубрикуbritish bulldogАстраБез рубрикиВидеоурокивоспитательная работаВПРВСОШвысшая пробадвидиктантЕГЭЕГЭ 2022 информатикаЕГЭ 2022 математикаЕГЭ по химиизолотое руноизложениеитоговое сочинениеитоговое устное собеседованиеКенгуруКИТконкурс Пегасконтрольная работактпматематический праздникмежрегиональный химический турнирМОШмцкоОВИООГЭОГЭ 2022 математикаолимпиада звездаолимпиада курчатоволимпиада ЛомоносовОПКРаботы статградрабочая программарабочая тетрадьРДРРешу ЕГЭРешу ОГЭрусский медвежонокСочинениеСтатьитексты егэтесттурнир ЛомоносоваУчебные пособияЧИПЮМШСтраницы
- 04.
 10.2020 XLIII Турнир Ломоносова задания и ответы
10.2020 XLIII Турнир Ломоносова задания и ответы - 05.12.17 Ответы и задания по математике 10 класс СтатГрад варианты МА00201-МА00208
- 05.12.17 Ответы и задания по математике 7 класс «СтатГрад» варианты МА70101-МА70106
- 06.11.2017 Олимпиада «Звезда» естественные науки задания и ответы 6-11 класс отборочный этап
- 06.12.17 Официальные темы итогового сочинения 2017 для Камчатского края и Чукотского автономного округа
- 06.12.17 Официальные темы итогового сочинения 2017 для Республика Алтай, Алтайский край, Республика Тыва, Респ. Хакасия, Красноярский край, Кемеровская, Томская и Новосибирская область
- 06.12.17 Официальные темы итогового сочинения 2017 зона 8 Республика Саха (Якутия), город Якутск, Амурская область, Забайкальский край
- 06.12.17 Официальные темы итогового сочинения для Республика Бурятия, Иркутская область зона 7
- 06.12.2017 5 зона Омск MSK+3 (UTC+6) официальные темы
- 06.12.2017 Ответы и задания по обществознанию 9 класс «СтатГрад» варианты ОБ90201-ОБ90204
- 07.
 12.17 Ответы и задания по русскому языку 11 класс СтатГрад варианты РЯ10701-РЯ10702
12.17 Ответы и задания по русскому языку 11 класс СтатГрад варианты РЯ10701-РЯ10702 - 07.12.2017 Ответы и задания по биологии 9 класс пробное ОГЭ 4 варианта
- 08.12.2017 Ответы и задания по географии 9 класс контрольная работа ОГЭ 56 регион
- 08.12.2017 Ответы и задания по физике 9 класс работа СтатГрад ОГЭ ФИ90201-ФИ90204
- 10.04.2020 Решать впр тренировочные варианты по математике 6 класс с ответами
- 10.10.17 Математика 9 класс контрольная работа 4 варианта ФГОС 56 регион задания и ответы
- 10.10.17 Русский язык 9 класс задания и ответы «СтатГрад» варианты РЯ90101-РЯ90102
- 10.11.2017 История 9 класс задания и ответы статград варианты ИС90201-ИС90204
- 100balnik мы в ВКОНТАКТЕ
- 100balnik отзывы пользователей
- 11 апреля 10-11 класс география ответы и задания
- 11 апреля 6 класс история ответы и задания
- 11 апреля 7 класс биология ответы и задания
- 11.04.2020 Решать ВПР тренировочные варианты по математике 5 класс с ответами
- 11.
 10.17 Физика 11 класс СтатГрад задания и ответы варианты ФИ10101-ФИ10104
10.17 Физика 11 класс СтатГрад задания и ответы варианты ФИ10101-ФИ10104 - 11.12.2017 — 16.12.2017 Олимпиада по дискретной математике и теоретической информатике
- 11.12.2017 Зимняя олимпиада по окружающему миру для 4 класса задания и ответы
- 11.12.2017 Ответы и задания по английскому языку 11 класс СтатГрад вариант АЯ10101
- 11.12.2017 Соревнование для 5-6 классов интернет-карусель по математике задания и ответы
- 12.04.2020 Решать тренировочные варианты ВПР по математике 4 класс + ответы
- 12.10 Русский язык 10 класс диагностическая работа ФГОС для 11 региона задания и ответы
- 12.10.17 Русский 2 класс ВПР официальные варианты задания и ответы
- 12.10.17 Химия 9 класс «СтатГрад» задания и ответы варианты ХИ90101-ХИ90104
- 12.12.2017 Ответы и задания по географии 9 класс работа СтатГрад варианты ГГ90101-ГГ90102
- 13.09.2017 Биология 11 класс СтатГрад задания и ответы все варианты
- 13.10.17 Математика 9 класс задания и ответы для 11 региона
- 13.
 10.2017 Обществознание 11 класс работа СтатГрад задания и ответы ОБ10101-ОБ10104
10.2017 Обществознание 11 класс работа СтатГрад задания и ответы ОБ10101-ОБ10104 - 13.12.2017 Ответы по физике 11 класс статград задания варианты ФИ10201-ФИ10204
- 13.12.2017 Письмо говорение по английскому языку 7-9 класс работа 56 регион
- 14.09.2017 Информатика 11 класс тренировочная работа статград ответы и задания
- 14.12 Геометрия 9 класс задания и ответы «СтатГрад»
- 14.12.2017 КДР ответы по русскому языку 8 класс задания все варианты
- 14.12.2017 Контрольная работа по математике 8 класс за 1 полугодие 2 варианта заданий с ответами
- 14.12.2017 Литература 11 класс ответы и задания СтатГрад вариант ЛИ10101
- 14.12.2017 Ответы КДР по математике 10 класс задания 6 вариантов
- 14.12.2017 Ответы по геометрии 9 класс СтатГрад задания варианты МА90301-МА90304
- 14.12.2017 Ответы по математике 11 класс КДР задания 6 вариантов
- 15.09 Математика 10 класс контрольная работа 3 варианта 56 регион задания и ответы
- 15.
 09.2017 Биология 9 класс тренировочная работа «СтатГрад» БИ90101-БИ90104 ответы и задания
09.2017 Биология 9 класс тренировочная работа «СтатГрад» БИ90101-БИ90104 ответы и задания - 15.11.2017 Задания и ответы 2-11 класс по Русскому медвежонку 2017 год
- 15.12.2017 Обществознание 11 класс ответы и задания СтатГрад варианты ОБ10201-ОБ10204
- 16 апреля 11 класс английский язык ответы и задания
- 16 апреля 5 класс история ответы и задания
- 16 апреля 6 класс биология ответы и задания
- 16 апреля 7 класс география ответы и задания
- 16.01.2018 Контрольная работа по русскому языку 9 класс в формате ОГЭ с ответами
- 16.01.2018 Ответы и задания КДР по русскому языку 11 класс 23 регион
- 16.10.2017 Ответы и задания всероссийской олимпиады школьников по математике 4-11 класс ВОШ
- 16.11.2017 МЦКО 10 класс русский язык ответы и задания
- 17.01.2018 Ответы и задания по информатике 11 класс работа статград варианты ИН10301-ИН10304
- 17.10.17 Физика 9 класс «СтатГрад» задания и ответы варианты ФИ90101-ФИ90104
- 18 апреля 11 класс химия ответы и задания
- 18 апреля 5 класс биология ответы и задания
- 18 апреля 6 класс обществознание ответы и задания
- 18 апреля 7 класс математика ответы и задания
- 18.
 09. Математика 10 класс задания и ответы
09. Математика 10 класс задания и ответы - 18.10.17 Математика 9 класс РПР 64 регион задания и ответы 1 этап
- 18.10.2017 Задания и ответы по математике 9 класс 50 регион Московская область
- 18.12.2017 Биология 11 класс Статград задания и ответы варианты БИ10201-БИ10204
- 19.09 Диагностическая работа по русскому языку 5 класс задания и ответы за 1 четверть
- 19.09 Контрольная работа по русскому языку 11 класс для 56 региона задания и ответы 1 четверть
- 19.09.2017 школьный этап всероссийской олимпиады по ОБЖ 5-11 класс задания и ответы
- 19.10.17 Русский язык 11 класс (ЕГЭ) задания и ответы статград варианты РЯ10601-РЯ10602
- 19.12.2017 КДР геометрия 8 класс краевая диагностическая работа задания и ответы
- 19.12.2017 КДР математика 9 класс краевая диагностическая работа задания и ответы
- 19.12.2017 Математика 10 класс тригонометрия база и профиль ответы и задания СтатГрад
- 2 апреля 11 класс история ВПР
- 2 апреля 7 класс английский язык ВПР
- 20.
 09 Входная контрольная работа русский язык 7 класс для 56 региона задания и ответы
09 Входная контрольная работа русский язык 7 класс для 56 региона задания и ответы - 20.09.2017 История 9 класс варианты ИС90101-ИС90102 ОГЭ задания и ответы
- 20.11.2017 Русский язык 9 класс «СтатГрад» ОГЭ задания и ответы РЯ90701-РЯ90702
- 20.12.2017 Химия 9 класс ответы и задания работа Статград варианты ХИ90201-ХИ90202
- 21.09.17 Математика 11 класс варианты МА10101-МА10108 задания и ответы
- 21.10.17 ОБЖ 7-11 класс муниципальный этап ВОШ для Москвы ответы и задания
- 21.11.17 Биология 9 класс СтатГрад задания и ответы варианты БИ90201-БИ90204
- 21.12.2017 Математика 9 класс РПР для 64 региона задания и ответы 2 этап
- 21.12.2017 Ответы и задания по математике 11 класс «СтатГрад» база и профиль
- 21.12.2017 Ответы и задания по русскому языку 10-11 класс варианты КДР 23 регион
- 22.09.17 Обществознание 9 класс работа статград ОГЭ варианты ОБ90101-ОБ90102 задания и ответы
- 22.09.17 Русский язык 10 класс входная контрольная работа ФГОС задания и ответы
- 22.
 10 Задания и ответы олимпиады по литературе 7-11 класс муниципальный этап 2017
10 Задания и ответы олимпиады по литературе 7-11 класс муниципальный этап 2017 - 23 апреля математика 5 класс ВПР 2019
- 23 апреля русский язык 6 класс ВПР 2019
- 23 апреля ФИЗИКА 7 класс ВПР 2019
- 23.11.2017 Задания и ответы по информатике 9 класс для вариантов статград ИН90201-ИН90204
- 24.10.17 Изложение 9 класс русский язык СтатГрад варианты РЯ90601-РЯ90602
- 24.10.17 КДР 8 класс математика алгебра задания и ответы 23 регион
- 24.10.17 Контрольная работа английский язык 7-9 класс для 56 региона письмо
- 25.09.17 Информатика 9 класс задания и ответы СтатГрад варианты ИН90101-ИН90102
- 25.10.17 Английский язык 7-9 класс контрольная работа для 56 региона чтение варианты
- 25.10.17 История 11 класс МЦКО варианты задания и ответы
- 25.10.17 Русский язык 9 класс МЦКО задания и ответы
- 26.09 Английский язык 7,8,9 класс контрольная работа для 56 региона задания и ответы ФГОС
- 26.09.17 История 11 класс задания и ответы «СтатГрад» варианты ИС10101-ИС10102
- 26.
 09.17 Математика 11 класс мониторинговая работа ЕГЭ 3 варианта задания и ответы
09.17 Математика 11 класс мониторинговая работа ЕГЭ 3 варианта задания и ответы - 26.10 ВПР Русский язык 5 класс ответы и задания все реальные варианты
- 26.10.17 Химия 11 класс «СтатГрад» задания и ответы варианты ХИ10101-ХИ10104
- 27.09.2017 Математика 9 класс работа статград варианты МА90101-МА90104 задания и ответы
- 27.10 Задания и ответы для олимпиады по биологии муниципальный этап 2017
- 28.09.17 Русский язык 11 класс задания и ответы «СтатГрад» варианты РЯ10101-РЯ10102
- 29.09.17 Математика 10 класс задания и ответы «СтатГрад» варианты МА00101-МА00104
- 30.11.2017 МЦКО математика 11 класс ответы и задания
- 4 апреля 11 класс биология ВПР
- 4 апреля 7 класс обществознание ВПР
- 4 класс диктант 2019 год
- 4 класс диктант платно
- 4 класс математика 22.04.2019-26.04.2019
- 4 класс математика платно ответы и задания
- 4 класс окр. мир платно
- 4 класс окружающий мир 22.04.2019-26.
 04.2019
04.2019 - 4 класс русский тест 2019 год
- 4 класса тест платно
- 5 класс биология платно
- 5 класс история платно
- 5 класс русский язык впр 25 апреля
- 5 класс русский язык платно
- 6 класс история платно
- 6 класс математика впр 25 апреля
- 6 класс математика платно
- 6 класс общество платно
- 6 класс платно гео ответы и задания
- 6 класс платно ответы и задания
- 7 класс ВПР 2019 по географии ответы и задания 16 апреля 2019
- 7 класс история впр 25 апреля
- 7 класс русский язык 56 регион ответы и задания 21.12.2018
- 7.11.17 Английский язык 9 класс от СтатГрад задания и ответы варианты АЯ90101-АЯ90102
- 8.11.2017 Русский язык 11 класс СтатГрад задания и ответы варианты РЯ10201-РЯ10202
- 9 апреля география 6 класс ВПР 2019
- 9 апреля русский язык 7 класс ВПР 2019
- 9 апреля физика 11 класс ВПР 2019
- 9 класс английский язык ОГЭ 24 25 мая
- 9 класс БИОЛОГИЯ ЭКЗАМЕН огэ 2019 год
- 9 класс информатика огэ 2019 год
- 9 класс математика огэ 2019 год
- 9 класс обществознание ОГЭ 2019
- 9 класс ОГЭ 2019
- 9 класс русский язык ОГЭ 2019
- 9 класс ФИЗИКА огэ 2019 год
- 9 класс ФИЗИКА ЭКЗАМЕН огэ 2019 год
- 9 класс экзамен по истории огэ 2019 год
- 9.
 11.17 Математика 9 класс работа «СтатГрад» задания и ответы варианты МА90201-МА90204
11.17 Математика 9 класс работа «СтатГрад» задания и ответы варианты МА90201-МА90204 - British Bulldog 2019 ответы и задания 3-4 класс 10-11 декабря 2019
- British Bulldog 3-4 класс ответы и задания 2018-2019
- British Bulldog 5-6 класс ответы и задания 2018-2019
- British Bulldog 9-11 класс ответы и задания 2018-2019
- FAQ
- My Calendar
- Алгебра 7 класс статград 4 декабря 2019 ответы и задания МА1970101-106
- Алгебра и начала анализа статград 10 класс 4 декабря 2019 ответы и задания
- Английский 9 класс СтатГрад задания и ответы
- Английский язык 11 класс АЯ10301 ответы и задания 23 апреля 2019 год
- Английский язык 11 класс СтатГрад 17.04
- Английский язык 11 класс статград 5 декабря 2019 ответы и задания АЯ1910101
- Английский язык 7 класс ВПР 2020 тренировочные варианты задания и ответы
- Английский язык 7 класс ВПР ответы и задания 2 апреля 2019 год
- Английский язык 7-9 класс ответы и задания 56 регион
- Английский язык 7,8,9 класс мониторинговая работа чтение 2019
- Английский язык 9 класс ответы и задания АЯ1990101 АЯ1990102 статград 6 ноября 2019
- Английский язык 9 класс платно
- Английский язык 9 класс статград ответы и задания 2018-2019 06.
 11
11 - Английский язык аудирование ответы 7 8 9 класс 56 регион 2018-2019
- Английский язык говорение 56 регион ответы 7 8 9 класс 2018-2019
- Английский язык задания и ответы школьного этапа олимпиады ВОШ 2019-2020
- Английский язык ответы 7 8 класс 56 регион чтение 2018-2019
- Английский язык письмо 7 8 класс ответы и задания 2018-2019
- Аргументы для тем итогового сочинения 2019-2020 регион МСК+8
- Архив работ
- 01.04.2020 Английский язык 9 класс ответы и задания для АЯ1990201-АЯ1990202
- 05.03.2020 Физика 11 класс статград ответы и задания ФИ1910401-ФИ1910404
- 06.03.2020 История 11 класс ИС1910401-ИС1910404 статград ответы и задания
- 12.02.2020 Математика 10 класс МА1900401-МА1900404 ответы и задания
- 12.05.2020 Математика 9 класс МА1990701-МА1990704 ответы и задания статград
- 13.05.2020 Русский язык 11 класс варианты РУ1910501-РУ1910502 ответы и задания
- 14.05.2020 Химия 11 класс варианты ХИ1910501-ХИ1910504 ответы и задания
- 14.
 09.2017 Варианты и ответы контрольной работы математика 8 класс для 56 региона
09.2017 Варианты и ответы контрольной работы математика 8 класс для 56 региона - 15.05.2020 Математика 10-11 класс варианты МА1900701-МА1900710 ответы и задания
- 18.05.2020 Физика 11 класс варианты ФИ1910501-ФИ1910504 ответы и задания
- 19.03.2020 Русский язык 10-11 класс РЯ1910901-РЯ1910902 ответы и задания
- 19.05.2020 История 11 класс варианты ИС1910501-ИС1910504 статград ответы и задания
- 21.05.2020 ОБ1910501-ОБ1910504 ответы и задания обществознание 11 класс статград
- 24.03.2020 Химия 11 класс ХИ1910401-ХИ1910404 ответы и задания статград
- Биология 11 класс контрольная работа в формате ЕГЭ 2020 ответы и задания
- Вариант № 33006760 тренировочный ЕГЭ по математике профильный уровень с ответами
- Варианты с ответами пробного экзамена ЕГЭ 2020 по математике в Санкт-Петербурге
- ВПР 2020 по математике 8 класс новые варианты с ответами
- ВПР 2020 тренировочная работа по обществознанию 8 класс задания и ответы
- ВПР 2020 тренировочные варианты БИ1980201-БИ1980202 по биологии 8 класс задания с ответами
- ВПР 2020 тренировочные варианты по биологии 6 класс задания с ответами
- ВПР 2020 тренировочные варианты по географии 7 класс задания с ответами
- ВПР 2020 тренировочные варианты по математике 7 класс
- ВПР 2020 физика 7 класс варианты ФИ1970101, ФИ1970102 с ответами
- ВПР по математике 4 класс задания и ответы 2018
- ВПР по математике 5 класс задания и ответы 2018 год
- ВПР по обществознанию 7 класс 2020 тренировочные варианты с ответами
- ЕГЭ 2020 тренировочный вариант 200622 с ответами по литературе 11 класс
- ЕГЭ 2020 тренировочный вариант 200622 с ответами по математике ПРОФИЛЬ 11 класс
- ЕГЭ 2020 тренировочный вариант 200622 с ответами по русскому языку 11 класс
- Задания и ответы для всероссийской олимпиады школьников по праву 5-11 класс 2017-2018
- Задания и ответы регионального этапа 2019 по экономике ВСОШ
- История 5 класс ИС1950101-ИС1950102 ВПР 2020 ответы и задания
- Контрольная работа в формате ОГЭ 2020 по истории 9 класс 3 четверть
- Контрольная работа ЕГЭ 2020 по химии 11 класс задания и ответы
- Контрольная работа по истории 11 класс в формате ЕГЭ 2020 задания и ответы
- Математика 7 класс ответы и задания по диагностической работе 09.
 10.2018
10.2018 - МЦКО русский язык 11 класс задания и ответы варианты 14 января 2020
- Новые задачи с ответами по химии 9-10 класс Сириус
- Новый тренировочный вариант 200622 по информатике и ИКТ 11 класс ЕГЭ 2020 с ответами
- Новый тренировочный вариант 33006755 по математике профильный ЕГЭ с ответами
- Обществознание 9 класс ответы ОБ90301 и ОБ90302 25.01.2019
- Олимпиада по английскому языку 4-7 класс ответы и задания для пригласительного этапа 16 апреля 2020
- Ответы Биология 11 класс тренировочная работа 18 января 2019
- Ответы пробное ОГЭ география 9 класс 22 января 2019
- Ответы работа статград история 11 класс 22 января 2019
- Пробные варианты ВПР 2020 по окружающему миру 4 класс с ответами
- Пробный ЕГЭ по математике 11 класс задания и ответы апрель 2020 год
- РДР 2020 5 класс реальные 2 варианта задания и ответы
- РДР 2020 6 класс реальные задания и ответы 12 марта 2020 год
- Решать новые тренировочные варианты впр по обществознанию 6 класс 2020
- Решу ЕГЭ 2020 по информатике 11 класс тренировочный вариант задания №200106
- Тренировочная работа Обществознание 11 класс ответы 1 февраля 2019
- Тренировочная работа по математике 9 класс ответы 12 февраля 2019
- Тренировочная работа по физике 9 класс ответы статград 29 января 2019
- Тренировочная работа по химии 9 класс ответы статград 14 февраля 2019
- Тренировочная работа русский язык 11 класс ответы 5 февраля 2019
- Тренировочная работа русский язык 9 класс ответы 7 февраля 2019
- Тренировочный вариант 200622 по английскому языку 11 класс ЕГЭ 2020 с ответами
- Тренировочный вариант 200622 по географии 11 класс ЕГЭ 2020 с ответами
- Тренировочный вариант 200622 по обществознанию 11 класс ЕГЭ 2020 с ответами
- Тренировочный вариант 200622 по химии 11 класс ЕГЭ 2020 с ответами
- Тренировочный вариант 29382872 по математике профильный ЕГЭ с ответами
- Тренировочный вариант 29382873 по математике профильный ЕГЭ задания с ответами
- Тренировочный вариант 29382874 по математике профильный ЕГЭ задания с ответами
- Тренировочный вариант 29527679 по математике профильный ЕГЭ с ответами
- Тренировочный вариант 29527683 по математике профильный ЕГЭ задания с ответами
- Тренировочный вариант 29527684 по математике профильный ЕГЭ задания с ответами
- Тренировочный вариант 29527685 по математике профильный ЕГЭ задания с ответами
- Тренировочный вариант 29527686 по математике профильный ЕГЭ задания с ответами
- Тренировочный вариант 29527687 по математике 11 класс профильный ЕГЭ задания с ответами
- Тренировочный вариант 33006750 по математике профильный ЕГЭ с ответами
- Тренировочный вариант 33006751 по математике профильный ЕГЭ с ответами
- Тренировочный вариант 33006752 по математике профильный ЕГЭ с ответами
- Тренировочный вариант 33006753 по математике профильный ЕГЭ с ответами
- Тренировочный вариант 33006754 по математике профильный ЕГЭ с ответами
- Тренировочный вариант 33006756 по математике профильный уровень ЕГЭ с ответами
- Тренировочный вариант ЕГЭ 200525 задания и ответы по математике профиль
- Тренировочный вариант ЕГЭ 29527688 по математике 11 класс профильный задания с ответами
- Тренировочный вариант ЕГЭ 29527689 по математике 11 класс профильный задания с ответами
- Тренировочный вариант ЕГЭ 29527690 по математике 11 класс профильный задания с ответами
- Тренировочный вариант ЕГЭ 33006763 задания и ответы по математике профиль
- Тренировочный вариант ЕГЭ 33006764 задания и ответы по математике профиль
- Физика 9 класс ФИ1990401- ФИ1990404 ответы и задания статград 3 марта 2020
- Химия 11 класс ХИ1910601-ХИ1910602 ВПР 2020 тренировочная работа
- Экзаменационная контрольная работа по литературе 9 класс ОГЭ 2020
- Астра 2019 ответы и задания 3-4 класс 20 ноября 2019
- Банк заданий ФИПИ по русскому языку ЕГЭ 2019 морфемика и словообразование
- Биология 10 класс РДР задания и ответы 14 ноября 2019-2020
- Биология 11 класс 5 ноября 2019 статград ответы и задания БИ1910201-204
- Биология 11 класс ВПР 2019 ответы и задания 4 апреля 2019 год
- Биология 11 класс ВПР ответы и задания 11.
 05
05 - Биология 11 класс ответы и задания тренировочная №5 26 апреля 2019
- Биология 5 класс ВПР 2018 ответы и задания
- Биология 5 класс ВПР 2019 ответы и задания 18 апреля 2019 год
- Биология 5 класс ВПР 2020 вариант демоверсии ответы и задания
- Биология 6 класс ВПР 2018 ответы и задания
- Биология 6 класс ВПР 2019 ответы и задания 16 апреля 2019
- Биология 6 класс платно
- Биология 7 класс ВПР 2019 ответы и задания 11 апреля 2019
- Биология 7 класс впр статград ответы и задания 11 сентября 2019
- Биология 9 класс 15 ноября ответы и задания статград 2018
- Биология 9 класс БИ90501 БИ90502 ответы и задания 23 апреля 2019
- Биология 9 класс ответы БИ90401 и БИ90402 статград 01.2019
- Биология 9 класс ответы и задания 25 ноября работа статград БИ1990201-БИ1990204
- Биология 9-10 класс ответы КДР 24 января 2019
- Биология ОГЭ 2018 платно
- Благодарим за ваш заказ!
- Британский бульдог 7-8 класс ответы и задания 2018-2019
- Вариант 322 КИМы с реального ЕГЭ 2018 по математике
- Вариант № 33006761 тренировочный ЕГЭ по математике профильный уровень с ответами
- Вариант № 33006762 тренировочный ЕГЭ по математике профильный уровень с ответами
- Вариант №1 морфемика и словообразование банк заданий ФИПИ ЕГЭ 2018-2019
- Вариант №2 морфемика и словообразование банк заданий ФИПИ ЕГЭ 2018-2019
- Вариант №3 морфемика и словообразование банк заданий ФИПИ ЕГЭ 2018-2019
- Вариант №4 морфемика и словообразование банк заданий с ответами ФИПИ ЕГЭ
- Вариант №5 банк заданий с ответами ФИПИ ЕГЭ 2019 по русскому языку морфемика
- Вариант №6 банк заданий с ответами ФИПИ ЕГЭ 2019 по русскому языку морфемика
- Вариант №7 банк заданий с ответами ФИПИ ЕГЭ 2019 по русскому языку морфемика
- Вариант по биологии с реального ЕГЭ 2020 задания и ответы
- Варианты БИ1910301-БИ1910304 по биологии 11 класс ответы и задания 14 января 2020
- Варианты ВПР по физике 11 класс задания и ответы за 2018 год
- Варианты для проведения ВПР 2020 по математике 6 класс с ответами
- Ваши отзывы — пожелания
- Вероятность и статистика 7 класс ответы 16.
 05
05 - Вероятность и статистика 8 класс ответы 16.05
- Витрина
- ВКР английский язык 7,8,9 класс задания и ответы говорение 2019-2020
- ВКР по геометрии 8 класс ответы и задания
- Возможные варианты для устного собеседования 9 класс ОГЭ 13 марта 2019
- Вот что с восторгом воскликнул Иван Васильевич готовые сочинения
- ВОШ всероссийская олимпиада школьников задания и ответы
- ВОШ ВСЕРОССИЙСКИЕ школьные олимпиады 2017-2018 задания и ответы
- ВОШ муниципальный этап по обществознанию ответы и задания 2018-2019
- ВОШ по ОБЩЕСТВОЗНАНИЮ 2017-2018
- ВОШ Школьный этап 2017-2018 задания и ответы для Республики Коми
- ВОШ школьный этап по экономике ответы и задания 2018-2019
- ВПР 11 класс английский язык ответы и задания 20 марта 2018
- ВПР 11 класс география
- ВПР 11 класс история ответы и задания 21 марта 2018
- ВПР 2019 6 класс обществознание ответы и задания 18 апреля 2019 год
- ВПР 2019 по математике 7 класс ответы и задания 18 апреля 2019 год
- ВПР 2019 по химии 11 класс ответы и задания 18 апреля 2019 год
- ВПР 2019 физика 11 класс ответы и задания 9 апреля 2019 год
- ВПР 2020 6 класс задание №10 по математике с ответами которые будут
- ВПР 2020 6 класс задание №11 по математике с ответами которые будут
- ВПР 2020 6 класс задание №6 по математике с ответами
- ВПР 2020 6 класс задание №7 по математике с ответами
- ВПР 2020 6 класс задание №8 по математике с ответами
- ВПР 2020 6 класс задание №9 по математике с ответами которые будут
- ВПР 2020 английский язык варианты АЯ1910201-АЯ1910202 задания и ответы
- ВПР 2020 биология 11 класс варианты БИ1910601-БИ1910602 ответы и задания
- ВПР 2020 биология 5 класс новые варианты с ответами
- ВПР 2020 вариант демоверсии по биологии 7 класс задания и ответы
- ВПР 2020 география 10-11 класс варианты ГГ1910401-ГГ1910402 ответы и задания
- ВПР 2020 география 6 класс варианты ГГ1960101, ГГ1960102 задания и ответы
- ВПР 2020 год 6 класс задание №12 по математике с ответами которые будут
- ВПР 2020 год 6 класс задание №12 по русскому языку с ответами
- ВПР 2020 год 6 класс задание №13 по математике с ответами которые будут
- ВПР 2020 год 6 класс задание №13 по русскому языку с ответами
- ВПР 2020 год 6 класс задание №14 по русскому языку с реальными ответами
- ВПР 2020 демоверсия по биологии 8 класс задания и ответы
- ВПР 2020 демоверсия по географии 7 класс задания и ответы
- ВПР 2020 демоверсия по географии 8 класс задания и ответы
- ВПР 2020 демоверсия по иностранным языкам 7 класс задания и ответы
- ВПР 2020 демоверсия по истории 7 класс задания и ответы
- ВПР 2020 демоверсия по истории 8 класс задания и ответы
- ВПР 2020 демоверсия по математике 7 класс задания и ответы
- ВПР 2020 демоверсия по математике 8 класс задания и ответы
- ВПР 2020 демоверсия по обществознанию 7 класс задания и ответы
- ВПР 2020 демоверсия по обществознанию 8 класс задания и ответы
- ВПР 2020 демоверсия по русскому языку 7 класс задания и ответы
- ВПР 2020 демоверсия по русскому языку 8 класс задания и ответы
- ВПР 2020 задание 6 по русскому языку 6 класс с ответами
- ВПР 2020 задание №1 по математике 6 класс с ответами
- ВПР 2020 задание №1 по русскому языку 6 класс с ответами
- ВПР 2020 задание №10 по русскому языку 6 класс ответы которые будут
- ВПР 2020 задание №11 по русскому языку 6 класс ответы которые будут
- ВПР 2020 задание №2 по математике 6 класс с ответами
- ВПР 2020 задание №2 по русскому языку 6 класс с ответами
- ВПР 2020 задание №3 по математике 6 класс с ответами
- ВПР 2020 задание №3 по русскому языку 6 класс с ответами
- ВПР 2020 задание №4 по математике 6 класс с ответами
- ВПР 2020 задание №4 по русскому языку 6 класс с ответами
- ВПР 2020 задание №5 по математике 6 класс с ответами
- ВПР 2020 задание №5 по русскому языку 6 класс с ответами
- ВПР 2020 задание №7 по русскому языку 6 класс с реальными ответами
- ВПР 2020 задание №8 по русскому языку 6 класс с реальными ответами
- ВПР 2020 задание №9 по русскому языку 6 класс ответы которые будут
- ВПР 2020 математика 5 класс реальные задания с ответами
- ВПР 2020 новые варианты с ответами по русскому языку 7 класс
- ВПР 2020 ответы и задания всероссийские проверочные работы
- ВПР 2020 по биологии 6 класс задание №1 с ответами
- ВПР 2020 по биологии 6 класс задание №10 с реальными ответами
- ВПР 2020 по биологии 6 класс задание №2 с ответами
- ВПР 2020 по биологии 6 класс задание №3 с ответами
- ВПР 2020 по биологии 6 класс задание №4 с ответами
- ВПР 2020 по биологии 6 класс задание №6 с ответами
- ВПР 2020 по биологии 6 класс задание №7 с ответами
- ВПР 2020 по биологии 6 класс задание №8 с реальными ответами
- ВПР 2020 по биологии 6 класс задание №9 с реальными ответами
- ВПР 2020 по биологии 7 класс тренировочные варианты БИ1970201,БИ1970202
- ВПР 2020 по истории 6 класс задание 1 с ответами
- ВПР 2020 по истории 6 класс задание №10 с реальными ответами
- ВПР 2020 по истории 6 класс задание №2 с ответами
- ВПР 2020 по истории 6 класс задание №3 с ответами
- ВПР 2020 по истории 6 класс задание №4 с реальными ответами
- ВПР 2020 по истории 6 класс задание №5 с реальными ответами
- ВПР 2020 по истории 6 класс задание №6 с реальными ответами
- ВПР 2020 по истории 6 класс задание №7 с реальными ответами
- ВПР 2020 по истории 6 класс задание №8 с реальными ответами
- ВПР 2020 по истории 6 класс задание №9 с реальными ответами
- ВПР 2020 по математике 7 класс задание 11 реальное с ответами
- ВПР 2020 по математике 7 класс задание 12 реальное с ответами
- ВПР 2020 по математике 7 класс задание №1 реальное с ответами
- ВПР 2020 по математике 7 класс задание №13 реальное с ответами
- ВПР 2020 по математике 7 класс задание №2 реальное с ответами
- ВПР 2020 по математике 7 класс задание №8 реальное с ответами
- ВПР 2020 русский язык 8 класс варианты РУ1980201, РУ1980202 ответы
- ВПР 2020 тренировочные варианты по географии 8 класс задания с ответами
- ВПР 2020 тренировочные варианты по русскому языку 5 класс задания с ответами
- ВПР 2020 физика 11 класс варианты ФИ1910601-ФИ1910602 ответы и задания
- ВПР 2020 химия 8 класс демоверсия задания и ответы
- ВПР 2021 ответы и задания всероссийские проверочные работы
- ВПР 2022 ответы и задания всероссийские проверочные работы
- ВПР 4 класс математика 2020 год реальные официальные задания и ответы
- ВПР БИОЛОГИЯ 11 класс 2018 реальные ответы и задания
- ВПР география 10-11 класс
- ВПР математика 5 класс ответы и задания
- ВПР по истории 11 класс ответы и задания 18.
 05
05 - ВПР ФИЗИКА 11 класс 2018
- ВПР физика 11 класс резервный день ответы
- ВПР ХИМИЯ 11 05.04
- ВСЕРОССИЙСКАЯ олимпиада муниципальный этап 2018-2019 задания и ответы
- ВСЕРОССИЙСКАЯ олимпиада муниципальный этап 2019-2020 задания и ответы
- Всероссийская олимпиада по праву ответы и задания школьный этап 25-26 октября 2019
- Всероссийская олимпиада по химии ответы и задания школьный этап 21-22 октября 2019
- ВСЕРОССИЙСКАЯ олимпиада региональный этап 2018-2019 задания и ответы
- Всероссийская олимпиада школьников региональный этап 2019-2020 задания и ответы
- ВСЕРОССИЙСКАЯ олимпиада школьный этап 2019-2020 задания и ответы
- ВСЕРОССИЙСКИЕ олимпиады 2017-2018 муниципальный этап задания и ответы
- ВСЕРОССИЙСКИЕ олимпиады 2017-2018 муниципальный этап задания и ответы для Краснодарского края
- ВСЕРОССИЙСКИЕ олимпиады 2017-2018 муниципальный этап задания и ответы для Челябинской области
- ВСЕРОССИЙСКИЕ олимпиады 2017-2018 региональный этап задания и ответы
- ВСЕРОССИЙСКИЕ олимпиады 2017-2018 учебный год задания и ответы
- ВСЕРОССИЙСКИЕ олимпиады 2018-2019 учебный год задания и ответы
- ВСЕРОССИЙСКИЕ олимпиады 2018-2019 школьный этап задания и ответы
- ВСЕРОССИЙСКИЕ олимпиады 2019-2020 учебный год задания и ответы
- ВСЕРОССИЙСКИЕ олимпиады 2020-2021 муниципальный этап задания и ответы
- ВСЕРОССИЙСКИЕ олимпиады 2020-2021 региональный этап задания и ответы
- ВСЕРОССИЙСКИЕ олимпиады 2020-2021 школьный этап задания и ответы
- ВСЕРОССИЙСКИЕ олимпиады 2021 заключительный этап задания и ответы
- ВСЕРОССИЙСКИЕ олимпиады 2022-2023 задания и ответы
- Всероссийские проверочные работы 2017 задания и ответы
- Всероссийские проверочные работы 2017-2018 задания и ответы
- Всероссийские проверочные работы 2018-2019 задания и ответы
- Всесибирская олимпиада школьников задания и ответы по математике 2018-2019
- Входная контрольная работа по математике 11 класс ответы и задания 2019-2020
- Входная контрольная работа по математике 4 класс ответы и задания 2019-2020
- Входная контрольная работа по математике 5 класс ответы и задания 2019-2020
- Входная работа по русскому языку 11 класс ответы и задания ФГОС 2019-2020
- Входные контрольные работы ФГОС варианты и ответы с 1 по 11 класс
- Гарантия
- ГГ1910101 ответы и задания география 11 класс статград 4 октября 2019
- ГДЗ 5 классы решебники
- ГДЗ по Математике за 5 класс: Виленкин Н.
 Я
Я - ГДЗ решебники
- Гелиантус АСТРА 1-2 класс ответы и задания 2018-2019
- Гелиантус АСТРА 3-4 класс ответы и задания 2018-2019
- География 10-11 класс ВПР 2019 ответы и задания 11 апреля 2019
- География 11 класс ответы и задания 17 апреля 2019 тренировочная №4
- География 11 класс ответы и задания вариант ГГ10101 статград 2018-2019
- География 11 класс платно
- География 11 класс статград ЕГЭ ответы и задания
- География 6 класс ВПР 2019 ответы и задания 9 апреля 2019
- География 6 класс ВПР 2020 год задание 7 и официальные ответы
- География 6 класс ВПР 2020 год задание №8 и реальные ответы
- География 6 класс ВПР 2020 задание №2 официальное с ответами
- География 6 класс ВПР 2020 задание №3 с ответами официальные
- География 6 класс ВПР 2020 задание №4 с ответами официальные
- География 6 класс ВПР 2020 задание №5 с ответами официальные
- География 6 класс ВПР 2020 задание №6 и официальные ответы
- География 6 класс задание №1 реального ВПР 2020 с ответами
- География 9 класс ОГЭ 4 июня 2019 год
- География 9 класс ответы и задания ГГ90401 ГГ90402 22 апреля 2019
- География 9 класс ответы и задания тренировочная статград 18 марта 2019
- География 9 класс СтатГрад задания и ответы
- География 9 класс статград ответы и задания 13 марта 2018
- География задания и ответы школьный этап 2019-2020 всероссийской олимпиады
- География муниципальный этап 2019 задания и ответы всероссийской олимпиады
- Геометрия 9 класс ответы и задания 12 декабря 2019 работа статград
- Готовое итоговое сочинение 2018-2019 на тему может ли добрый человек проявлять жестокость?
- Готовые сочинения для варианта №1 из сборника ЕГЭ 2021 Цыбулько И.
 П
П - Готовые сочинения для варианта №2 из сборника ЕГЭ 2021 Цыбулько И.П
- Готовые сочинения для варианта №3 из сборника ЕГЭ 2021 Цыбулько И.П
- Готовые сочинения для варианта №4 из сборника ЕГЭ 2021 Цыбулько И.П
- Готовые сочинения для варианта №5 из сборника ЕГЭ 2021 Цыбулько И.П
- Готовые сочинения для варианта №6 из сборника ЕГЭ 2021 Цыбулько И.П
- Готовые сочинения для варианта №7 из сборника ЕГЭ 2021 Цыбулько И.П
- Готовые сочинения ЕГЭ в избушке у самого леса живёт старый охотник
- Готовые сочинения ЕГЭ несомненно Дюма останется ещё на многие
- Готовые сочинения ЕГЭ по тексту может быть самая трогательная и самая глубокая
- Готовые сочинения ЕГЭ по тексту Н. Тэффи нежность самый кроткий робкий божественный лик любви
- Готовые сочинения ЕГЭ по тексту отправь голову в отпуск Измайлов
- Готовые сочинения ЕГЭ ты часто жаловался мне, что тебя «не понимают!»
- Готовые сочинения как-то Анатолий Бочаров высказал по тексту В.
 В. Быкову
В. Быкову - Готовые сочинения на Невском, у Литейного постоянно толпились
- Готовые сочинения по тексту Ф. М. Достоевскому в эту ночь снились мне
- Готовые сочинения чего нам так не хватает а не хватает нам любви к детям по тексту А. А. Лиханову
- Готовые сочинения я очень плохо знаю деревенскую жизнь с проблемами и текстом
- ДВИ МГУ варианты ответы и программы вступительных испытаний
- Демоверсии ЕГЭ 2023 года ФИПИ по всем предметам
- Демоверсия ВПР 2020 география 6 класс задания и ответы фипи
- Демоверсия ВПР 2020 история 6 класс задания и ответы фипи
- Демоверсия ВПР 2020 по биологии 6 класс задания и ответы фипи
- Демоверсия ВПР 2020 по обществознанию 6 класс задания и ответы фипи
- Демоверсия ОГЭ 2019 по математике решение заданий
- Диктант по русскому языку 4 класс ВПР 2018 задания
- ДКР 2019 по географии 10 класс ответы и задания Свердловская область
- ДКР 2019 по географии 7 класс задания и ответы 11 декабря 2019-2020
- Добро пожаловать
- Доступ ко всем работам
- ЕГЭ 2020 тренировочный вариант 200622 с ответами по истории 11 класс
- Если хочешь понять душу леса найди лесной 9 готовых сочинений ЕГЭ
- Естественные науки ответы и задания олимпиада ЗВЕЗДА 25-29 ноября 2019-2020
- за эти месяцы тяжелой борьбы решающей 9 готовых сочинений ЕГЭ
- Задание № 15 неравенства ОГЭ по математике 9 класс 2020
- Задания ВПР 2017 для 11 класса по географии
- Задания ВПР 2017 для 4 класса по русскому языку
- Задания ВПР 2017 для 5 класса по математике
- Задания заключительного этапа ВСЕРОССИЙСКОЙ олимпиады по информатике 2017/2018
- Задания и ответы 2 варианта пробного экзамена ЕГЭ по математике 11 класс 4 апреля 2018
- Задания и ответы 56 регион на ФЕВРАЛЬ 2017
- Задания и ответы 6 класс XXX математический праздник 2019 год
- Задания и ответы Англ.
 яз 18.11
яз 18.11 - Задания и ответы Биология 14.11
- Задания и ответы Биология 9 класс 21.11.
- Задания и ответы всероссийской олимпиады по русскому языку Московской области 19 ноября 2017
- Задания и ответы ГЕОГРАФИЯ 21.11.2017
- Задания и ответы для комплексной работы КДР для 8 класса ФГОС 4 варианта
- Задания и ответы для Оренбургской области 56 регион декабрь 2017
- Задания и ответы для Оренбургской области ноябрь 2017
- Задания и ответы для Оренбургской области октябрь 2017
- Задания и ответы для Оренбургской области сентябрь 2017
- Задания и ответы для работ 11 регион Республика Коми 2018-2019
- Задания и ответы для работ 11 региона Республика Коми Декабрь 2018-2019
- Задания и ответы для работ 11 региона Республика Коми НОЯБРЬ 2018-2019
- Задания и ответы для работ 56 региона октябрь 2018
- Задания и ответы для работ Республики Коми
- Задания и ответы для регионального этапа по физической культуре 2018
- Задания и ответы для школьных работ Оренбургской области 56 регион декабрь 2018
- Задания и ответы для школьных работ Оренбургской области 56 регион февраль 2018
- Задания и ответы КДР 2019 математика 9 класс 20 февраля
- Задания и ответы Математика 03.
 12
12 - Задания и ответы Математика 17.11
- Задания и ответы муниципального этапа 2019-2020 по немецкому языку 7-11 класс ВСОШ
- Задания и ответы муниципального этапа по русскому языку 2019-2020 Москва
- Задания и ответы МХК 15.11
- Задания и ответы на Апрель 2017 для 56 региона
- Задания и ответы на Май 2017 для 56 региона
- Задания и ответы на Март 2017 для 56 региона
- Задания и ответы олимпиады по литературе региональный этап 2020
- Задания и ответы по информатике 11 класс 28 ноября 2017 СтатГрад варианты ИН10201-ИН10204
- Задания и ответы по истории для 11 классов (56 регион)
- Задания и ответы по математике 11 класс профиль вариант №22397963
- Задания и ответы по математике 11 класс профиль ЕГЭ вариант №22397967
- Задания и ответы по математике 6 класс ВПР 2018
- Задания и ответы по русскому языку 6 класс ВПР 2018
- Задания и ответы по русскому языку 9 класс СтатГрад 29 ноября 2017 варианты РЯ90201-РЯ90202
- Задания и ответы по физике муниципального этапа 2019 всероссийская олимпиада
- Задания и ответы по химии 11 класс СтатГрад 30 ноября 2017 года варианты ХИ10201-ХИ10204
- Задания и ответы ПРАВО 14.
 11
11 - Задания и ответы право региональный этап ВОШ 2019
- Задания и ответы регионального этапа 2019 по английскому языку
- Задания и ответы регионального этапа 2019 по испанскому языку
- Задания и ответы регионального этапа 2019 по китайскому языку
- Задания и ответы регионального этапа 2019 по химии ВОШ
- Задания и ответы региональный этап ВОШ 2019 по французскому
- Задания и ответы Русский язык 19.11
- Задания и ответы Русский язык ОГЭ 9 класс 20.11.
- Задания и ответы Физика 18.11
- Задания и ответы Химия 24.11
- Задания Московской математической олимпиады 8 класс 17 марта 2019 год
- Задания МОШ 2019 по физике 1 тур 7 8 9 10 класс
- Задания по истории муниципальный этап 11 ноября всероссийской олимпиады 2018-2019
- Задания, ответы и результаты олимпиады по биологии региональный этап 2020
- Задания, ответы и результаты олимпиады по химии региональный этап 2020
- Заключительный этап 2022 задания и ответы многопрофильной инженерной олимпиады звезда
- Заключительный этап всероссийской олимпиады школьников 2019-2020 задания и ответы
- Закрытый раздел
- Золотое руно 2018 ответы и задания 16 февраля конкурс по истории
- Изложение русский язык 9 класс статград ответы и задания 4 октября 2019
- Информатика 11 класс 15 ноября 2019 статград ответы и задания ИН1910201- ИН1910204
- Информатика 11 класс КДР ответы и задания 18 декабря 2018
- Информатика 11 класс платно
- Информатика 11 класс СтатГрад задания и ответы
- Информатика 11 класс тренировочная №5 ответы и задания 15 апреля 2019 год
- Информатика 7 класс ответы РДР 21 февраля 2019
- Информатика 9 класс 06.
 03
03 - Информатика 9 класс ОГЭ 4 июня 2019 год
- Информатика 9 класс ответы и задания тренировочная №5 25 апреля 2019
- Информатика 9 класс ответы статград 13 ноября 2018
- Информатика 9 класс ответы статград 31 января 2019
- Информатика ВОШ школьный этап ответы и задания 2018-2019
- Информатика ОГЭ 2018
- Информатика ОГЭ 2018 платно
- Информатика ответы и задания школьный этап 2019 всероссийской олимпиады школьников
- История 10 класс РДР 2019 официальные задания и ответы все варианты
- История 11 класс 13 ноября 2019 ответы и задания статград вариант ИС1910201- ИС1910204
- История 11 класс ВПР 2018 год задания и ответы все варианты
- История 11 класс ВПР 2019 ответы и задания 2 апреля 2019 год
- История 11 класс ВПР 2020 тренировочные варианты с ответами
- История 11 класс задания и ответы СтатГрад
- История 11 класс ИС10201 и ИС10202 ответы и задания статград 23.11.2018
- История 11 класс ответы и задания СтатГрад 24.
 04
04 - История 11 класс ответы ИС10401 и ИС10402 11 марта 2019 год
- История 11 класс СтатГрад 24 ноября 2017 задания и ответы варианты ИС10201-ИС10204
- История 5 класс ВПР 2018 ответы и задания
- История 5 класс ВПР 2019 ответы и задания 16 апреля 2019
- История 5 класс ВПР 2020 вариант демоверсии ответы и задания
- История 5 класс ВПР 25.04
- История 6 класс ВПР 2018 ответы и задания
- История 6 класс ВПР 2019 ответы и задания 11 апреля 2019
- История 6 класс тренировочные варианты ВПР 2020 задания и ответы
- История 7 класс ВПР 2019 ответы и задания варианты 25 апреля
- История 7 класс платно 24 апреля
- История 9 класс входная контрольная работа ФГОС задания и ответы 2019-2020
- История 9 класс ответы и задания тренировочная №5 26 апреля 2019 год
- История 9 класс СтатГрад 27 февраля ответы и задания
- История 9 класс статград ответы и задания 2018-2019
- История 9 класс статград ответы и задания 30 марта 2018
- История всероссийская олимпиада школьный этап 2019-2020 задания и ответы московская область
- Итоговая контрольная работа по математике 8 класс за 2018-2019 учебный год
- Итоговая контрольная работа по русскому языку 7 класс за 2018-2019 учебный год
- Итоговая работа математика 10 класс ответы и задания 24 апреля 2019 год
- Итоговое собеседование варианты 12 февраля 2020
- Итоговое сочинение 05.
 12.2018
12.2018 - Итоговое сочинение 2017
- Итоговое устное собеседование ОГЭ 2022 по русскому языку 9 класс
- Как написать эссе по обществознанию ЕГЭ
- Как получить задания и ответы для ВПР 2019
- Как получить работу задания и ответы
- Как получить темы на итоговое сочинение 6 декабря 2017 года
- Как человеку воспитать в себе доброту? готовое итоговое сочинение 2018-2019
- КДР (задания+ответы) на Февраль 2017
- КДР (задания+ответы) на Январь 2017
- КДР 1 класс задания и ответы комплексная работа варианты 2018 год
- КДР 2 класс задания и ответы комплексная работа варианты 2018 год
- КДР 2019 23 регион ответы и задания май 2019 год
- КДР 2019 задания и ответы по английскому языку 8 класс 21 мая 2019 год
- КДР 2019 ответы и задания апрель 2019 год
- КДР 2019 ответы по географии 9 класс 15 февраля
- КДР 2019 химия 9 и 10 класс ответы 19 марта 2019 год
- КДР 2019-2020 декабрь 23 регион ответы и задания
- КДР 2020 23 регион ответы и задания Краснодарский край
- КДР 9 класс русский язык ответы и задания 14 декабря 2018
- КДР Английский язык 8 класс ответы и задания 2018-2019
- КДР апрель 2017 работы задания и ответы
- КДР апрель 2018 задания и ответы для Краснодарского края 23 регион
- КДР декабрь 2017 задания и ответы для Краснодарского края 23 регион
- КДР задания и ответы
- КДР задания и ответы комплексная работа 3 класс 2018 год
- КДР задания и ответы комплексная работа 4 класс варианты 2018 год
- КДР Май 2017 работы задания и ответы
- КДР Май 2018 задания и ответы для Краснодарского края 23 регион
- КДР математика 11 класс задания и ответы 28 февраля 2018 год
- КДР математика 7 класс ответы и задания 12.
 04
04 - КДР математика 9 класс 19.04
- КДР ответы и задания 23 регион Январь 2019
- КДР ответы и задания для Краснодарского края 23 регион ДЕКАБРЬ 2018
- КДР ответы и задания математика 10-11 класс 23 ноября 2018
- КДР ответы и задания НОЯБРЬ 2018 для Краснодарского края 23 регион
- КДР ответы и задания октябрь 2018 для Краснодарского края 23 регион
- КДР ответы и задания по английскому языку 9 10 11 класс 8 февраля 2018
- КДР ответы и задания по Биологии 10 класс 23 января 2018
- КДР ответы и задания по Биологии 11 класс 23 января 2018
- КДР ответы и задания по Биологии 9 класс 23 января 2018
- КДР ответы и задания по Географии 10 класс 25 января 2018
- КДР ответы и задания по Географии 9 класс 25 января 2018
- КДР ответы и задания по информатике 10 класс 18 января 2018
- КДР ответы и задания по информатике 9 класс 18 января 2018
- КДР ответы и задания по истории 9 10 11 класс 13 февраля 2018
- КДР ответы и задания по обществознанию 9 10 11 класс 1 февраля 2018
- КДР ответы и задания по русскому языку 9 класс 6 февраля 2018
- КДР ответы и задания по химии 10 11 класс 6 февраля 2018
- КДР ответы математика 7 класс 30 января 2019
- КДР ответы русский язык 9 класс 6 февраля 2019
- КДР ответы физика 9-10 класс 31 января 2019
- КДР по алгебре 8 класс ответы и задания 2018-2019
- КДР ПО ГЕОГРАФИИ 11 КЛАСС 23 регион ответы и задания 22 февраля
- КДР по литературе 10 11 класс 2018 ответы и задания
- КДР по литературе 10 класс ответы
- КДР по Математике 9 класс официальные ответы
- КДР по русскому языку для 9 классов
- КДР русский язык 7 8 класс ответы и задания
- КДР русский язык 7-8 класс ответы 17.
 05
05 - КДР февраль 2018 задания и ответы для Краснодарского края 23 регион
- КДР январь 2018 задания и ответы для Краснодарского края 23 регион
- Кенгуру 2017 9 класс ответы
- Кенгуру 2017 ответы и задания 2-10 класс
- Кенгуру 2019 ответы и задания 5-6 класс
- Кенгуру 2019 ответы и задания для 7-8 класса
- КИТ 2-3 класс ответы и задания 2018-2019
- КИТ 8-9 класс ответы и задания 2018-2019
- КИТ-2019 ответы и задания 10-11 класс 27 ноября 2019-2020
- Комплексная работа ФГОС 5 6 7 8 9 класс ответы и задания 30 ноября 2018
- Конкурс АСТРА 2019 ответы и задания 5-6 класс 20 ноября 2019
- Конкурс КИТ 2018 4-5 класс ответы и задания
- Конкурс КИТ 2019 ответы и задания 2-3 класс 27 ноября 2019
- Контакты
- Контрольная входная работа по русскому языку 10 класс ответы и задания 2019-2020
- Контрольная работа за 1 полугодие по русскому языку 7 класс ответы и задания
- Контрольная работа по математике 11 класс 2 четверть в формате ЕГЭ 3 варианта с ответами
- Контрольная работа по русскому языку 10 класс за 1 полугодие 2 варианта с ответами
- Контрольная работа по русскому языку 8 класс за 1 полугодие 2 четверть задания и ответы
- Контрольные работы ОГЭ 2021 задания и ответы для 9 класса
- Контрольные срезы 56 регион ответы и задания октябрь 2019-2020
- Корзина
- Критерии ответы и задания по физике 11 класс статград 23 марта 2018
- Критерии ответы по информатике 11 класс статград 16 марта 2018
- Критерии ответы по русскому языку 11 класс статград 2018
- Кружила январская метелица скрипели мерзлые готовые сочинения ЕГЭ
- Куда поступить после 11 класса в 2017 году
- Литература 11 класс ответы и задания ЕГЭ статград 22.
 03.2018
03.2018 - Литература 11 класс СтатГрад задания и ответы
- Литература 9 класс ОГЭ 2019 год
- Литература 9 класс ответы и задания статград 22 ноября 2018 год
- Литература 9 класс статград ОГЭ сочинение ответы 14 марта 2018
- Литература ОГЭ 2018 платно
- Литература олимпиада ВОШ задания муниципальный этап 2018-2019
- Литература ответы и задания школьный этап 2019 всероссийской олимпиады школьников
- Литература ответы и задания школьный этап всероссийской олимпиады школьников 2019-2020
- Литература школьный этап 2019-2020 задания и ответы олимпиады ВОШ
- Математика 7 классов 56 регион задания и ответы
- Математика 10 класс (вероятность и статистика)
- Математика 10 класс 56 регион ответы 16.05
- Математика 10 класс вероятность и статистика ответы и задания 4 апреля 2019
- Математика 10 класс задания и ответы мониторинговая работа ФГОС 2019-2020
- Математика 10 класс ответы и задания 18.05
- Математика 10 класс ответы и задания статград
- Математика 10 класс ответы и задания статград 2018-2019
- Математика 10 класс статград ответы и задания 29.
 03.2018
03.2018 - Математика 10 класс статград ответы и задания БАЗА и ПРОФИЛЬ
- Математика 10 класс тригонометрия ответы статград 18.12.2018
- Математика 10-11 класс ответы и задания варианты статград 17 мая 2019
- Математика 10-11 класс ответы и задания СтатГрад
- Математика 11 класс 17 декабря 2019 контрольная работа задания и ответы
- Математика 11 класс диагностическая работа ЕГЭ профиль задания и ответы для 11 региона
- Математика 11 класс КДР ответы и задания 28 февраля
- Математика 11 класс ответы база профиль статград 24 января 2019
- Математика 11 класс ответы и задания БАЗА ПРОФИЛЬ 20.09
- Математика 11 класс ответы и задания тренировочная работа №5 19 апреля 2019
- Математика 11 класс ответы статград БАЗА ПРОФИЛЬ 20.12.2018
- Математика 11 класс профиль 56 рег
- Математика 11 класс тренировочная №4 статград ответы и задания 13 марта 2019
- Математика 3 класс задания ВСОКО МЦКО итоговая работа 2019
- Математика 4 класс ВПР 2018 ответы и задания
- Математика 4 класс ВПР ответы 25.
 04
04 - Математика 4 класс демоверсия ВПР 2020 задания и ответы ФИПИ
- Математика 5 класс ВПР 2018 ответы и задания
- Математика 5 класс ВПР 2019 ответы и задания 23 апреля
- Математика 5 класс задания и ответы СтатГрад варианты 12 сентября 2017 год
- Математика 5 класс контрольная работа за 1 полугодие задания и ответы 2019-2020
- Математика 5 класс официальная демоверсия ВПР 2020 задания и ответы
- Математика 5 класс платно
- Математика 6 класс ВПР 2018 ответы и задания
- Математика 6 класс ВПР 2019 ответы и задания варианты 25 апреля
- Математика 6 класс ВПР 2020 демоверсия фипи задания и ответы
- Математика 6 класс ответы СтатГрад 15.05
- Математика 7 класс ответы и задания варианты МА70301 МА70302 14 мая 2019
- Математика 7 класс РДР ответы 2018-2019
- Математика 8 класс 56 регион 17.03
- Математика 8 класс 56 регион ответы и задания 15 марта 2018
- Математика 8 класс входная контрольная работа ответы и задания 2019-2020
- Математика 8 класс задания и ответы работа статград 12 сентября 2017
- Математика 8 класс ответы и задания варианты МА80201 МА80202 14 мая 2019
- Математика 8 класс ответы и задания по диагностической работе 11 регион 2018-2019
- Математика 8 класс статград ответы и задания
- Математика 9 класс — 64 регион ответы
- Математика 9 класс 12 ноября 2019 ответы и задания работа статград МА1990201-04
- Математика 9 класс 13.
 02
02 - Математика 9 класс 56 рег ответы
- Математика 9 класс контрольная работа в формате ОГЭ 4 варианта ответы и задания
- Математика 9 класс ОГЭ 2018 ответы и задания
- Математика 9 класс ответы 11 регион 18.12.2018
- Математика 9 класс ответы 15.05 СтатГрад
- Математика 9 класс ответы и задания 11 регион 4 октября 2018
- Математика 9 класс ответы и задания варианты 56 регион 10 октября 2019
- Математика 9 класс ответы и задания РПР 64 регион 20.12.2018
- Математика 9 класс ответы и задания статград 19 марта 2019
- Математика 9 класс ответы и задания статград варианты 15 мая 2019 год
- Математика 9 класс ответы РПР 64 регион 2019 3 этап 20 марта
- Математика 9 класс пробник статград ответы и задания 21 марта 2018
- Математика 9 класс статград ОГЭ ответы и задания
- Математика 9 класс статград ответы и задания 13 февраля 2018 года
- Математика 9 класс статград ответы и задания 27.09.2018
- Математика База платно
- Математика геометрия 9 класс КДР ответы и задания 20 февраля 2018
- Математика задания и ответы муниципальный этап ВОШ 2018-2019 для Москвы
- Математика олимпиада ВОШ 2018-2019 школьный этап задания и ответы
- Математика ответы и задания для школьного этапа всероссийской олимпиады 2019-2020
- Математика профиль 11 класс 56 регион контрольная работа 18.
 12.2018
12.2018 - Математика тренировочная работа 9 класс ответы статград 8 ноября 2018 года
- Математическая вертикаль 2021-2022 ответы и задания
- Математическая вертикаль ответы и задания 2020-2021 учебный год
- Материалы за 2016-2021 учебный год
- Международный молодёжный предметный чемпионат по правоведению для 10-11 классов.
- Многопрофильная инженерная олимпиада «Звезда» 2017-2018 задания и ответы
- Многопрофильная инженерная олимпиада «Звезда» 2018-2019 ответы и задания
- Многопрофильная инженерная олимпиада Звезда 2021-2022 ответы и задания
- Многопрофильная олимпиада Звезда 2019-2020 ответы и задания
- Многопрофильная олимпиада Звезда 2020-2021 ответы и задания
- Мой аккаунт
- Мониторинговая работа аудирование по английскому языку 7,8,9 класс задания и ответы 2019-2020
- Мониторинговая работа по английскому языку 7,8,9 класс задания и ответы 2019
- Мониторинговая работа по русскому языку 5 класс ответы и задания ФГОС 2019-2020
- Мониторинговая работа по русскому языку 8 класс ответы и задания ФГОС 2019-2020
- Мониторинговые работы 56 регион ответы и задания сентябрь 2019
- Московская олимпиада школьников 2020-2021 ответы и задания
- Московская олимпиада школьников 2021-2022 ответы и задания
- Московский турнир юных физиков задания 2019-2020 учебный год
- МПУ МЦКО 4 класс задания 31 января 2019 год
- Муниципальный этап 2019 олимпиады по испанскому языку задания и ответы ВОШ
- Муниципальный этап 2019 олимпиады по истории задания и ответы ВСОШ
- Муниципальный этап 2019-2020 олимпиада по ОБЖ ответы и задания для Москвы
- Муниципальный этап 2019-2020 олимпиады по химии задания и ответы Московская область
- Муниципальный этап 2019-2020 олимпиады по экологии ответы и задания ВсОШ Москва
- Муниципальный этап 2019-2020 по литературе ответы и задания ВсОШ Москва
- Муниципальный этап ВОШ 2018 по праву задания и ответы для Москвы
- Муниципальный этап ВОШ 2018-2019 задания по химии в Московской области
- Муниципальный этап ВОШ по астрономии ответы и задания 2018-2019 учебный год
- Муниципальный этап ВОШ по ОБЖ ответы и задания 2018-2019
- Муниципальный этап олимпиады 2019 по искусству МХК задания и ответы ВСОШ
- Муниципальный этап олимпиады 2019-2020 по астрономии задания и ответы Московская область
- Муниципальный этап олимпиады по биологии ответы и задания 19 октября 2019
- Муниципальный этап по астрономии всероссийской олимпиады задания 2018-2019
- Муниципальный этап по обществознанию 2019-2020 ответы и задания ВСОШ Москва
- Муниципальный этап по экономике всероссийская олимпиада 2018-2019
- МХК искусство задания и ответы муниципального этапа 2019-2020 учебный год
- МХК искусство школьный этап 2019 ответы и задания всероссийской олимпиады школьников
- МХК муниципальный этап 8 ноября задания всероссийской олимпиады 2018-2019
- МЦКО 2019-2020 расписание и демоверсии диагностических работ
- МЦКО 2020-2021 расписание и демоверсии диагностических работ с ответами
- МЦКО 2021-2022 расписание и демоверсии диагностических работ с ответами
- МЦКО 2022-2023 демоверсии, варианты и ответы диагностических работ
- МЦКО 7 класс математика ответы 13 февраля 2018
- МЦКО 8 класс метопредмет ответы и задания 27 февраля
- МЦКО 8 класс ответы 15.
 03
03 - МЦКО история 10 класс ответы 25.10.2018
- МЦКО математика 3 класс задания
- Мцко математика 7 класс 02.03.17
- МЦКО математика 9 класс варианты задания и ответы 2019-2020
- МЦКО математика 9 класс ответы и задания 3 октября 2018
- МЦКО ответы и задания по русскому языку 11 класс 18 января 2018
- МЦКО ответы и задания по русскому языку 7 8 класс 1 февраля 2018
- МЦКО по физике для 9 классов
- МЦКО русский язык 9 класс ответы 2018-2019
- МЦКО физика для 7 классов ответы и задания
- Направления тем итогового сочинения 2017-2018
- Наше наследие 1-11 класс муниципальный тур ответы и задания 2019-2020
- Наше наследие 1-11 класс школьный тур ответы и задания 2019-2020
- Наше наследие олимпиада задания и ответы 2017-2018
- Наше наследие ответы и задания 5-6 класс школьный тур 2019-2020
- Наше наследие ответы и задания 9-11 класс школьный тур 2019-2020
- Новый тренировочный вариант 200622 по биологии 11 класс ЕГЭ 2020 с ответами
- Новый тренировочный вариант 200622 по физике 11 класс ЕГЭ 2020 с ответами
- Новый тренировочный вариант 210201 по английскому языку 11 класс ЕГЭ 2021 с ответами
- Новый тренировочный вариант 210201 по истории 11 класс ЕГЭ 2021 с ответами
- Новый тренировочный вариант 210201 по литературе 11 класс ЕГЭ 2021 с ответами
- Новый тренировочный вариант 210201 по обществознанию 11 класс ЕГЭ 2021 с ответами
- Новый тренировочный вариант 210208 по химии 11 класс ЕГЭ 2021 с ответами
- Новый тренировочный вариант 34072997 по математике профиль 11 класс ЕГЭ с ответами
- Новый тренировочный вариант 34072998 по математике профиль 11 класс ЕГЭ с ответами
- Новый тренировочный вариант 34072999 по математике профиль 11 класс ЕГЭ 2021 с ответами
- Новый тренировочный вариант 34073000 по математике профиль 11 класс ЕГЭ 2021 с ответами
- Новый тренировочный вариант ЕГЭ 34073001 по математике профильный с ответами
- Новый тренировочный вариант КИМ 210208 по биологии 11 класс ЕГЭ 2021 с ответами
- Новый тренировочный вариант КИМ 210208 по физике 11 класс ЕГЭ 2021 с ответами
- О нас
- ОБ1910201-ОБ1910204 ответы и задания обществознание 11 класс 13 декабря 2019
- ОБЖ школьный этап задания и ответы олимпиады ВОШ 2019-2020
- Обществознание 10 класс КДР 2019 задания и ответы 01.
 03.2019
03.2019 - Обществознание 11 класс 04.05
- Обществознание 11 класс ответы тренировочная №4 статград 20 марта 2019
- Обществознание 11 класс статград ЕГЭ ответы и задания 19 марта 2018
- Обществознание 11 класс СтатГрад задания и ответы
- Обществознание 11 класс Статград ответы и задания
- Обществознание 6 класс ВПР 2018 ответы и задания
- Обществознание 7 класс ВПР 2019 ответы и задания 4 апреля 2019 год
- Обществознание 9 11 класс контрольная работа 56 регион 20 февраля 2018
- Обществознание 9 класс 19 декабря 2019 ответы и задания ОБ1990201-ОБ1990204
- Обществознание 9 класс КДР 2019 ответы 01.03.2019
- Обществознание 9 класс ответы и задания 29 апреля 2019 тренировочная №5
- Обществознание 9 класс СтатГрад задания и ответы
- Обществознание 9 класс тренировочная №4 статград ответы и задания 14 марта 2019
- Обществознание 9 класс тренировочная работа №1 ответы и задания 21.09
- ОБЩЕСТВОЗНАНИЕ для 9 классов Республика Коми, 11 регион
- Обществознание ОГЭ 2018 платно
- ОГЭ
- ОГЭ 2017 закрытый раздел
- ОГЭ 2018 Математика платно
- ОГЭ 2019 география 9 класс ответы для 24 региона
- ОГЭ 2019 география 9 класс ответы для 54 региона
- ОГЭ 2019 официальное расписание экзаменов 9 класс
- ОГЭ английский язык 2018 ответы и задания 9 класс
- Одно желание было у лейтенанта Бориса Костяева готовые сочинения ЕГЭ
- Окружающий мир 4 класс ВПР 2018 ответы и задания
- Окружающий мир 4 класс демоверсия ВПР 2020 задания и ответы ФИПИ
- Олимпиада Звезда заключительный тур 2017-2018 задания и ответы
- Олимпиада Ломоносов по математике 11 класс задания и ответы 2018-2019
- Олимпиада Наше Наследие 2019-2020 учебный год задания и ответы
- Школьный тур 5-11 класс наше наследие задания и ответы 2019-2020
- Олимпиада Наше Наследие 2020-2021 учебный год ОВИО задания и ответы
- Олимпиада Наше Наследие задания и ответы 2018-2019 учебный год
- Олимпиада основы православной культуры задания и ответы 2019-2020
- Олимпиада по английскому языку 8-10 класс ответы и задания для пригласительного этапа 17 апреля 2020
- Олимпиада по английскому языку задания и ответы муниципального этапа 2019
- Олимпиада по английскому языку школьный этап 2017 задания
- Олимпиада по астрономии муниципальный этап 2019 задания и ответы
- Олимпиада по биологии ответы и задания школьный этап 2019 ВОШ
- Олимпиада по биологии ответы и задания школьный этап ВсОШ 23-24 октября 2019
- Олимпиада по математике НТИ отборочный этап ответы и задания 2018-2019
- Олимпиада по МХК школьный этап 2017 задания
- Олимпиада по обществознанию школьный этап 2017 задания
- Олимпиада по праву школьный этап 2017 задания
- Олимпиада по русскому языку задания и ответы школьного этапа 2019
- Олимпиада по физической культуре муниципальный этапа 2019-2020 задания и ответы
- Олимпиада по экологии 4-10 класс ответы и задания для пригласительного этапа 15 апреля 2020
- Олимпиада по экологии ответы и задания школьный этап 2019-2020 Московская область
- Олимпиада по экологии школьный этап 2017 задания
- Олимпиада РОСАТОМ 2018-2019 задания и ответы
- Олимпиада ФИЗТЕХ 11 класс ответы и задания 2018-2019
- Олимпиада школьников САММАТ 2019-2020 ответы и задания
- Оплата заказа
- Оренбургская область 56 регион задания и ответы работы январь 2018
- Отборочные задания по математике для физико-математической школы 2019 год
- Отборочные задания по физике для физико-математической школы 2019 год
- Ответы 56 регион математика 8 класс 19 декабря 2018
- Ответы 7 8 класс золотое руно 2019 с заданиями
- Ответы 9-11 класс золотое руно задания 2019
- Ответы английский язык 7 8 9 класс говорение 56 регион 2018-2019
- Ответы английский язык для 9 классов 56 регион
- Ответы ВПР 2020 по биологии 6 класс задание №5
- Ответы для реального задания №10 ВПР 2020 по географии 6 класс
- Ответы для реального задания №9 ВПР 2020 по географии 6 класс
- Ответы задания и сочинения татарский язык ЕРТ
- Ответы задания изложение по русскому языку 9 класс СтатГрад 8 февраля 2018
- Ответы и задания 1-2 класс конкурс АСТРА 20 ноября 2019-2020
- Ответы и задания 10-11 класс КИТ 2018
- Ответы и задания 11 класс кенгуру выпускника 2019
- Ответы и задания 12.
 04.2018
04.2018 - Ответы и задания 2 класс пегас 2019
- Ответы и задания 2 класс чип 2019-2020 Австралия
- Ответы и задания 3-4 класс золотое руно 2019
- Ответы и задания 3-4 класс кенгуру 2019 год
- Ответы и задания 3-4 класс пегас 2019
- Ответы и задания 3-4 класс ЧИП 2019 год
- Ответы и задания 4-5 класс КИТ 2019 конкурс 27 ноября 2019-2020
- Ответы и задания 4-5 класс русский медвежонок 14 ноября 2019
- Ответы и задания 5-6 класс Гелиантус (астра) 2018-2019
- Ответы и задания 5-6 класс золотое руно 2019 год
- Ответы и задания 6-7 класс КИТ 2019 конкурс 27 ноября 2019-2020
- Ответы и задания 6-7 класс русский медвежонок 2018-2019
- Ответы и задания 8-9 класс русский медвежонок 2018-2019
- Ответы и задания 9 класс кенгуру выпускника 2019
- Ответы и задания 9-10 класс кенгуру 2019 год
- Ответы и задания английский язык 9 класс диагностика №2 22 марта 2019
- Ответы и задания БИ10401 и БИ10402 биология 11 класс 4 марта 2019
- Ответы и задания биология 11 класс статград
- Ответы и задания биология 11 класс статград 30 ноября 2018
- Ответы и задания ВПР по географии 10-11 класс 03.
 04.2018
04.2018 - Ответы и задания география 11 класс статград 9 декабря 2019 ГГ1910201
- Ответы и задания для конкурса Кенгуру 2020 11 класс
- Ответы и задания для конкурса по информатике КИТ 1-11 класс 29 ноября 2017 год
- Ответы и задания для Оренбургской области 56 регион март 2019
- Ответы и задания для пробных работ 56 региона 2018
- Ответы и задания для работ 15.02.2017
- Ответы и задания для работы статград по истории 9 класс
- Ответы и задания золотое руно 2019 1-2 класс
- Ответы и задания информатика 11 класс ИН1910101 ИН1910102 23 сентября 2019
- Ответы и задания история 9 класс статград 29 ноября 2018 год
- Ответы и задания КДР 23 регион март 2019 год
- Ответы и задания КДР геометрия 8 класс 16 ноября 2018 года
- Ответы и задания кенгуру 2 класс 2019 год
- Ответы и задания кенгуру выпускника 4 класс 2019
- Ответы и задания контрольная по математике 7 класс
- Ответы и задания контрольных работ для 56 региона декабрь 2019
- Ответы и задания МЦКО английский язык 9 класс 2018
- Ответы и задания ОГЭ 2018 по математике 9 класс
- Ответы и задания олимпиада звезда по обществознанию 2019-2020 отборочный этап
- Ответы и задания олимпиады по физкультуре 8,9,10 класс пригласительный этап 28 апреля 2020
- Ответы и задания по астрономии школьный этап всероссийской олимпиады 2019-2020
- Ответы и задания по биологии 11 класс 30 января 2018 СтатГрад
- Ответы и задания по биологии 11 класс статград 12.
 09
09 - Ответы и задания по биологии 9 класс 17.09 статград
- Ответы и задания по Биологии 9 класс 24 января 2018 СтатГрад
- Ответы и задания по биологии 9 класс БИ1990101-02 статград 14 октября 2019
- Ответы и задания по биология 9 класс СтатГрад 2018
- Ответы и задания по информатике 11 класс статград 14.09
- Ответы и задания по информатике 9 класс статград 19.09
- Ответы и задания по информатике 9 класс СтатГрад 31 января 2018
- Ответы и задания по Истории 11 класс 23 января 2018 СтатГрад
- Ответы и задания по истории 11 класс ИС1910101 ИС1910102 27 сентября 2019
- Ответы и задания по истории 9 класс 18 января 2018 СтатГрад
- Ответы и задания по истории школьный этап всероссийской олимпиады школьников 2019-2020
- Ответы и задания по итальянскому языку школьный этап всероссийской олимпиады 2019-2020
- Ответы и задания по китайскому языку олимпиада школьный этап 2019-2020
- Ответы и задания по литературе школьный этап всероссийской олимпиады 2019-2020 московская область
- Ответы и задания по математике 10 класс контрольная работа
- Ответы и задания по математике 11 класс 25 января 2018 СтатГрад
- Ответы и задания по математике 11 класс ЕГЭ база 56 регион 04.
 04.18
04.18 - Ответы и задания по математике 11 класс мониторинговая работа 2019-2020
- Ответы и задания по математике 8 класс статград 11.09
- Ответы и задания по математике 9 класс 12 декабря 2019 статград все варианты
- Ответы и задания по математике 9 класс 56 регион 4 декабря 2018
- Ответы и задания по математике 9 класс МА1990101-МА1990104 3 октября 2019
- Ответы и задания по математике школьный этап 2019-2020 всероссийская олимпиада
- Ответы и задания по математике школьный этап 2019-2020 всероссийской олимпиады
- Ответы и задания по МХК искусство всероссийская олимпиада школьный этап 2019-2020
- Ответы и задания по ОБЖ всероссийская олимпиада 2018-2019
- Ответы и задания по ОБЖ школьный этап всероссийской олимпиады школьников 2019-2020
- Ответы и задания по обществознанию 11 класс ОБ10101 ОБ10102 статград 2018-2019
- Ответы и задания по обществознанию 9 класс 26 января 2018 СтатГрад
- Ответы и задания по обществознанию ОГЭ 2018
- Ответы и задания по праву муниципальный этап 11 ноября всероссийской олимпиады 2018-2019
- Ответы и задания по русскому языку 11 класс 19 января 2018 СтатГрад
- Ответы и задания по русскому языку 11 класс 2 октября 2019 РУ1910101 РУ1910102
- Ответы и задания по Русскому языку 11 класс статград 28 марта 2018
- Ответы и задания по русскому языку 7 класс входная работа
- Ответы и задания по русскому языку 8 класс 56 регион
- Ответы и задания по русскому языку 9 класс МЦКО 1 октября 2019
- Ответы и задания по русскому языку 9 класс статград РУ1990101-02 16 октября 2019
- Ответы и задания по Русскому языку КДР 11 класс январь 2019
- Ответы и задания по русскому языку муниципальный этап 11 ноября всероссийской олимпиады 2018-2019
- Ответы и задания по русскому языку ОГЭ 2018
- Ответы и задания по русскому языку олимпиада школьный этап 22 октября 2019
- Ответы и задания по физике 10 класс КДР 30 января 2018
- Ответы и задания по физике 11 класс ВОШ 2018-2019
- Ответы и задания по физике 11 класс ВПР 2018 10.
 04.18
04.18 - Ответы и задания по физике 11 класс КДР 30 января 2018
- Ответы и задания по физике 9 класс 29 января 2018 СтатГрад
- Ответы и задания по физике 9 класс КДР 30 января 2018
- Ответы и задания по физике 9 класс статград
- Ответы и задания по физике школьный этап всероссийской олимпиады 2019-2020
- Ответы и задания по химии 11 класс 28 ноября 2018
- Ответы и задания по химии 11 класс ВПР 2018 05.04.18
- Ответы и задания по химии 11 класс статград ХИ1910101 и ХИ1910102 15 октября 2019
- Ответы и задания по химии 9 класс статград ХИ1990101-ХИ1990104 21 октября 2019
- Ответы и задания по химии 9 класс тренировочная работа статград
- Ответы и задания по экологии школьный этап всероссийской олимпиады школьников 2019-2020
- Ответы и задания русский язык 11 класс варианты 16 мая 2019 год
- Ответы и задания русский язык 7 класс ВПР 9 апреля 2019 год
- Ответы и задания русский язык 9 класс 56 регион 06.
 04.18
04.18 - Ответы и задания стартовая работа русский язык 8 класс 23 сентября 2019
- Ответы и задания статград обществознание 11 класс 14 декабря 2018
- Ответы и задания статград по физике 9 класс варианты 24 октября 2019
- Ответы и задания тренировочная №4 история 9 класс 21 марта 2019
- Ответы и задания ФИ90401 и ФИ90402 физика 9 класс 4 марта 2019
- Ответы и задания Физика ОГЭ 2018 9 класс
- Ответы и задания ЧИП 1-2 класс 2019
- Ответы и задания школьный этап по математике всероссийской олимпиады новосибирская область 2019-2020
- Ответы и задания школьный этап по физике всероссийской олимпиады в Московской области 2019-2020
- Ответы КДР 2019 по информатике 10 класс 15 марта 23 регион
- Ответы КДР 2019 по информатике 9 класс 15 марта 23 регион
- Ответы КДР 2019 по литературе 10 класс 15 марта 23 регион
- Ответы КДР 2019 по литературе 9 класс 15 марта 23 регион
- Ответы КДР 23 регион биология 11 класс 21.
 12.2018
12.2018 - Ответы КДР 23 регион история 11 класс 21.12.2018
- Ответы КДР задания 23 регион Февраль 2019 год
- Ответы КДР литература 11 класс 14 декабря 2018
- Ответы КДР физика 11 класс 14 декабря 2018
- Ответы МЦКО математика 10 класс 5 декабря 2018
- Ответы МЦКО математика 11 класс 28 ноября 2018
- Ответы МЦКО по истории 9 класс 19.09
- Ответы на тренировочная работа по химии 9 класс «СтатГрад»
- Ответы на тренировочную работу по русскому языку 11 класс
- Ответы обществознание 9 класс статград 5 декабря 2018
- Ответы обществознание для 10 классов 23 регион
- Ответы ОГЭ 2018 английский язык
- Ответы ОГЭ 2018 русский язык
- Ответы олимпиада по праву 9 класс школьный этап ВОШ 2018-2019
- Ответы олимпиада по физике 9 класс 2018-2019
- Ответы по английскому языку 7-9 класс 56 регион 10.12.2018 Аудирование
- Ответы по английскому языку олимпиада ВОШ школьный этап 2018-2019
- Ответы по астрономии школьный этап олимпиады ВОШ 2018-2019
- Ответы по биологии 9 10 11 класс вош 2018-2019 школьный этап
- Ответы по биологии для 9 классов (Оренбургская область, 56 регион)
- Ответы по географии ВОШ олимпиада школьный этап 2018-2019
- Ответы по географии для 9 классов 11 регион
- Ответы по информатике 11 класс 12.
 05
05 - Ответы по искусству МХК олимпиада ВОШ школьный этап 2018-2019
- Ответы по истории 11 класс статград тренировочная работа №1 26.09
- Ответы по истории 11 класс школьный этап олимпиады ВОШ 2018-2019
- Ответы по истории 9 класс статград
- Ответы по истории для 9 классов (Оренбургская область, 56 регион)
- Ответы по математике 7-8 класс КДР
- Ответы по математике 8 класс МЦКО 28 марта 2018
- Ответы по математике 9 класс 64 регион
- Ответы по математике 9 класс СтатГрад 15.02
- Ответы по немецкому языку 7-9 класс 56 регион 10.12.2018 Аудирование
- Ответы по русскому языку 11 класс 11 регион 13.02
- Ответы по русскому языку для 7 и 8 класс 12.05
- Ответы по русскому языку школьный этап олимпиады ВОШ 2018-2019
- Ответы по тренировочная работа по биологии 11 класс
- Ответы по тренировочная работа по обществознанию 9 класс
- Ответы по физике 9 класс ФИ90201 и ФИ90202 статград 7 декабря 2018
- Ответы по физике, биологии для 11 классов 56 регион 16.
 02
02 - Ответы по химии 11 класс пробное ЕГЭ статград 12 марта 2019
- Ответы по химии 9 класс статград 19 декабря 2018
- Ответы по химии, информатике, географии, обществознанию для 9 классов
- Ответы по экологии школьный этап ВОШ 2018-2019
- Ответы репетиционный экзамен по математике 9 класс пробное ОГЭ 9 февраля 2018
- Ответы РПР по математике 9 класс 64 регион 3 этап 2018
- Ответы русский язык 10 класс 56 регион 12.05
- Ответы русский язык 5-8 класс контрольная работа за 1 полугодие 56 регион 2018
- Ответы статград география 11 класс 11.12.2018
- Ответы СтатГрад по обществознанию 9 класс
- Ответы статград по обществознанию 9 класс варианты ОБ1990101-02 23 октября 2019
- Ответы тренировочная работа по истории 9 класс
- Ответы тренировочная работа по математике 10 класс 08.02.2017
- Ответы тренировочная работа по русскому языку 9 класс 09.02.2017
- Ответы тренировочная работа по химии 11 класс 14.
 02
02 - Ответы физике для 9 классов (Оренбургская область, 56 регион)
- Отзывы прошлых лет
- Отзывы с первого экзамена ОГЭ 2018 по английскому языку
- Отзывы с первых экзаменов ЕГЭ 2017
- Отзывы с прошедших экзаменов ОГЭ 2019
- Отзывы с экзамена по русскому языку ОГЭ 2018
- Открытый банк заданий и ответы ФИПИ ЕГЭ 2019 по русскому языку 11 класс
- Официальные работы РДР 2019-2020 для 78 региона
- РДР 2020 по математике 11 класс задания и ответы 2 варианта ИС «Знак»
- РДР 2020 по математике 9 класс задания, ответы и критерии
- Официальные работы РДР для 78 региона 2018-2019 учебный год
- Официальные РДР 2020 для Московской области задания и ответы
- Официальные РДР 2021 для Московской области задания и ответы
- Официальные РДР 2022 для Московской области задания и ответы
- Официальные темы для Республика Саха (Якутия) Сахалинская область итоговое сочинение 2018-2019
- Официальные темы итогового сочинения 2018-2019 11 класс для часового пояса MSK+1
- Официальные темы итогового сочинения 2018-2019 11 класс для часового пояса MSK+6
- Официальные темы итогового сочинения 2018-2019 11 класс для часового пояса МСК
- Официальные темы итогового сочинения 2018-2019 для часового пояса MSK +9
- Официальные темы итогового сочинения 2018-2019 для часового пояса MSK+7
- Оформление заказа
- Пегас 2018 задания и ответы 7 февраля конкурс по литературе
- Пегас 2019 5-6 класс ответы и задания
- Пегас 2019 7-8 класс ответы и задания
- Пегас 2019 ответы для 9-11 класса
- Письмо английский язык 7 8 9 класс 56 регион ответы и задания
- Платно русский язык 9 класс
- Поддержать проект
- Полугодовая контрольная работа по русскому языку 11 класс задания и ответы 2019-2020
- ПОЛЬЗОВАТЕЛЬСКОЕ СОГЛАШЕНИЕ
- Предэкзаменационная работа задания и ответы по информатике 9 класс ОГЭ 2019
- Предэкзаменационная работа задания и ответы по математике 11 класс ЕГЭ 2019
- Пригласительный школьный этап 2021 всероссийская олимпиада школьников задания и ответы
- Пробная (тренировочная) ВПР 2019 география 10-11 класс ответы и задания
- Пробное (тренировочное) ВПР 2019 биология 11 класс ответы и задания
- Пробное (тренировочное) ВПР 2019 география 6 класс ответы и задания
- Пробное (тренировочное) ВПР 2019 математика 7 класс ответы и задания
- Пробное (тренировочное) ВПР 2019 русский язык 4 класс ответы и задания
- Пробное (тренировочное) ВПР 2019 русский язык 5 класс ответы и задания
- Пробное (тренировочное) ВПР 2019 русский язык 6 класс ответы и задания
- Пробное ВПР 2019 ответы и задания по английскому языку 11 класс
- Пробное ВПР 2019 ответы и задания по биологии 5 класс
- Пробное ВПР 2019 ответы и задания по биологии 7 класс
- Пробное ВПР 2019 по истории 5 класс ответы и задания
- Пробное ВПР 2019 по истории 6 класс ответы и задания
- Пробное ВПР 2019 по химии 11 класс ответы и задания
- Пробное Итоговое собеседование 9 класс русский язык ОГЭ 2019 задания
- Пробный экзамен по обществознанию и литературе для 11 классов ответы
- Проект математическая вертикаль ответы и задания
- Работа по математике 11 класс статград ответы и задания 25 сентября 2019
- Работа статград по русскому языку 9 класс 3 декабря 2019 ответы и задания
- Работы (задания+ответы) для Республики Коми Март 2017
- Работы (задания+ответы) Март 2017 СтатГрад
- Работы (задания+ответы) Февраль 2017
- Работы (задания+ответы) Январь 2017
- Работы 56 регион ответы и задания май 2019 год
- Работы для 56 региона Май 2018 ответы и задания
- Работы для Оренбургской области
- Работы для Республики Коми Декабрь 2017 задания и ответы
- Работы для Республики Коми Ноябрь 2017 задания и ответы
- Работы для Республики Коми Октябрь 2017 задания и ответы
- Работы задания и ответы по регионам
- Работы МЦКО демоверсии задания и ответы
- Работы СтатГрад 2018 февраль задания и ответы
- Работы СтатГрад апрель 2018 задания и ответы
- Работы Статград ВПР задания и ответы февраль 2019
- Работы статград ВПР март 2019 задания и ответы
- Работы СтатГрад декабрь 2017 задания и ответы
- Работы статград декабрь 2018-2019 ответы и задания
- Работы статград декабрь 2019 задания и ответы 2019-2020 учебный год
- Работы статград задания и ответы ноябрь 2019-2020 учебный год
- Работы СтатГрад задания и ответы октябрь 2018
- Работы статград задания и ответы октябрь 2019-2020 учебный год
- Работы СтатГрад задания и ответы сентябрь 2018
- Работы СтатГрад март 2018 задания и ответы
- Работы СтатГрад ноябрь 2017 задания и ответы
- Работы СтатГрад октябрь 2017 задания и ответы
- Работы СтатГрад сентябрь 2017 задания и ответы
- Работы статград сентябрь 2019 год ответы и задания
- Работы СтатГрад январь 2018 задания и ответы
- Работы статград январь 2020 задания и ответы 2019-2020 учебный год
- Работы СтатГрад, КДР за апрель 2017
- Работы СтатГрад, КДР за май 2017
- Работы СтатГрад, КДР за март 2017
- Работы СтатГрад, КДР, тренировочные за февраль 2017
- Работы СтатГрад, КДР, тренировочные за январь 2017
- Рабочая программа по окружающему миру ФГОС с 1 по 4 класс на 2022-2023
- Рабочая программа по чтению ФГОС с 1 по 4 класс на 2022-2023
- Рабочие программы по английскому языку ФГОС с 2 по 11 класс на 2022-2023
- Рабочие программы ФГОС на 2022-2023 учебный год для 1-11 класса
- Рабочая программа по информатике ФГОС с 5 по 11 класс на 2022-2023
- Рабочие программы 7 класс по ФГОС на 2022-2023 год
- Рабочие программы для 10 класса ФГОС на 2022-2023
- Рабочие программы по ОБЖ ФГОС с 5 по 11 класс на 2022-2023
- Разговоры о важном цикл внеурочных занятий 2022-2023
- Расписание
- ЕГЭ 2021 официальное расписание проведения экзаменов от Рособрнадзора
- ЕГЭ и ОГЭ 2020 год официальное расписание экзаменов у 9 и 11 класса
- ОГЭ 2021 официальное расписание проведения экзаменов у 9 класса
- Официальное расписание ЕГЭ 2019 11 класс основной досрочный этап
- Расписание муниципального этапа всероссийской олимпиады школьников в Санкт-Петербурге 2018-2019
- Расписание работ КДР 2019
- Расписание РДР 2020-2021 для 58 региона задания и ответы Пензенская область
- Расписание РПР 2018-2019 для 26 региона
- Расписание ГИА ОГЭ 2017
- Расписание ЕГЭ 2018 досрочный основной резервный период
- Расписание итогового сочинения 2017-2018
- Расписание проведения экзаменов 9 класса ОГЭ 2018
- Расписание школьных олимпиад 2017-2018 задания и ответы
- Распределения реальных тем итогового сочинения 2017-2018 по зонам регионам
- РДР 2019-2020 по физике 10 класс ответы и задания
- РДР 8 класс ответы и задания по математике 15 ноября 2018
- РДР математика 10 класс 14 ноября 2019 ответы и задания
- РДР математика 6 класс ответы и задания 21 ноября 2019 78 регион
- РДР ответы и задания для Санкт-Петербурга
- Официальные работы РДР для 78 региона задания и ответы 2020-2021 учебный год
- РДР по русскому языку 9 класс ответы и задания вариант 1901 и 1902 17 октября 2019
- Реальное ВПР 2020 задание 1 по биологии 5 класс с ответами
- Реальное ВПР 2020 задание 2 по биологии 5 класс с ответами
- Реальное ВПР 2020 задание №1 по русскому языку 5 класс с ответами
- Реальное ВПР 2020 задание №10 по биологии 5 класс с ответами
- Реальное ВПР 2020 задание №10 по русскому языку 5 класс с ответами
- Реальное ВПР 2020 задание №11 по русскому языку 5 класс с ответами
- Реальное ВПР 2020 задание №12 по русскому языку 5 класс с ответами
- Реальное ВПР 2020 задание №2 по русскому языку 5 класс с ответами
- Реальное ВПР 2020 задание №3 по биологии 5 класс с ответами
- Реальное ВПР 2020 задание №3 по русскому языку 5 класс с ответами
- Реальное ВПР 2020 задание №4 по биологии 5 класс с ответами
- Реальное ВПР 2020 задание №4 по русскому языку 5 класс с ответами
- Реальное ВПР 2020 задание №5 по биологии 5 класс с ответами
- Реальное ВПР 2020 задание №5 по русскому языку 5 класс с ответами
- Реальное ВПР 2020 задание №6 по биологии 5 класс с ответами
- Реальное ВПР 2020 задание №6 по русскому языку 5 класс с ответами
- Реальное ВПР 2020 задание №7 по биологии 5 класс с ответами
- Реальное ВПР 2020 задание №7 по русскому языку 5 класс с ответами
- Реальное ВПР 2020 задание №8 по русскому языку 5 класс с ответами
- Реальное ВПР 2020 задание №9 по русскому языку 5 класс с ответами
- Реальные задания по математике ПРОФИЛЬ ЕГЭ 2018
- Реальные темы и готовые сочинения 4 декабря 2019 ФИПИ для региона МСК+9
- Реальные темы итогового сочинения 2018-2019 5 декабря
- Реальный вариант с ЕГЭ 2019 по математике 29 мая 2019 год
- Региональный экзамен по математике 7 класс
- Региональный экзамен по математике 7 класс 56 регион ответы и задания
- Региональный экзамен по русскому языку 8 класс 56 регион
- Региональный этап 2019 по астрономии задания и ответы всероссийская олимпиада
- Региональный этап 2019 по географии ответы и задания ВОШ
- Региональный этап 2019 по искусству МХК ответы и задания ВОШ
- Региональный этап 2019 по истории задания и ответы всероссийская олимпиада
- Региональный этап 2019 по немецкому языку задания и ответы
- Региональный этап по биологии задания всероссийская олимпиада 2018-2019
- Региональный этап по математике ответы и задания 2019
- Результаты ЕГЭ 2017 у школьников
- Решать реальное ВПР 2020 задание №8 по биологии 5 класс с ответами
- Решать реальное ВПР 2020 задание №9 по биологии 5 класс с ответами
- Решения и задания муниципального этапа 2019 олимпиады по математике
- РПР 2017-2021 задания и ответы для Саратовской области 64 регион
- РПР математика 9 класс 3 этап задания и ответы 2018-2019
- РПР по математике 9 класс 64 регион задания 2018-2019
- Русский медвежонок 10-11 класс ответы и задания 2018-2019
- Русский медвежонок 14 ноября 2019 ответы и задания 6-7 класс
- Русский медвежонок 2-3 класс ответы и задания 2018-2019
- Русский медвежонок 2019 ответы и задания для 10-11 класса 14 ноября
- Русский Медвежонок 2019 ответы и задания для 2-3 класса
- Русский медвежонок 2019-2020 ответы и задания 8-9 класс 14 ноября
- Русский медвежонок 4-5 класс ответы и задания 2018-2019
- Русский медвежонок для учителей 2020 год задания и ответы
- Русский язык 10 класс КДР ответы и задания
- Русский язык 10 класс КДР ответы и задания 19 декабря 2018
- Русский язык 10 класс ответы и задания 56 регион
- Русский язык 10 класс ответы МЦКО 8 ноября 2018 год
- Русский язык 10 класс СтатГрад ответы 12.
 05
05 - Русский язык 10-11 класс ответы и задания 22 апреля 2019 тренировочная №1
- Русский язык 10-11 класс ответы и задания СтатГрад
- Русский язык 10-11 класс ответы РЯ10901 и РЯ10902 6 марта 2019
- Русский язык 11 класс 03.06.2019
- Русский язык 11 класс 11 ноября 2019 ответы и задания работа статград
- Русский язык 11 класс 56 регион ответы
- Русский язык 11 класс диагностическая работа №5 ответы и задания 8 апреля 2019
- Русский язык 11 класс КДР ответы и задания 19 декабря 2018
- Русский язык 11 класс контрольная работа в формате ЕГЭ 2 варианта задания и ответы
- Русский язык 11 класс мониторинговая работа ответы и задания
- Русский язык 11 класс ответы и задания диагностика 2 статград 18 марта 2019
- Русский язык 11 класс ответы и задания СтатГрад 17.05
- Русский язык 11 класс ответы РЯ10601 и РЯ10602 статград 2018-2019
- Русский язык 11 класс ответы статград 30 января 2019
- Русский язык 11 класс РЯ1910701-РЯ1910702 статград ответы и задания 11 декабря 2019
- Русский язык 11 класс статград 24 октября 2019 ответы и задания РЯ1910601-02
- Русский язык 11 класс статград ЕГЭ ответы и задания
- Русский язык 11 класс СТАТГРАД ответы и задания 28 февраля
- Русский язык 11 класс статград ответы и задания вариант РЯ10201 и РЯ10202 07.
 11.2018
11.2018 - Русский язык 11 класс тренировочная работа №1 ответы статград 2018-2019
- Русский язык 3 класс МЦКО ВСОКО задания итоговая работа 2019
- Русский язык 4 класс ВПР 2020 демоверсия задания и ответы ФИПИ
- Русский язык 4 класс задания и ответы мониторинговая работа 2019-2020
- Русский язык 5 класс демоверсия ВПР 2020 ФИПИ задания и ответы
- Русский язык 5 класс ответы и задания 21.09
- Русский язык 6 класс ВПР 2018 ответы и задания
- Русский язык 6 класс ВПР 2019 ответы и задания 23 апреля
- Русский язык 6 класс ВПР 2020 демоверсия фипи задания и ответы
- Русский язык 6 класс статград ответы и задания 2018-2019
- Русский язык 7 класс 56 регион ответы
- Русский язык 7 класс 56 регион ответы и задания 15 марта 2018
- Русский язык 7 класс задания и ответы мониторинговая работа 10 сентября 2019
- Русский язык 7 класс ответы и задания РУ1970101 и РУ1970102 26 сентября 2019
- Русский язык 7 класс ответы и задания статград 2018-2019
- Русский язык 7 класс статград ответы и задания
- Русский язык 7-8 класс ответы КДР 23 января 2019
- Русский язык 8 класс 56 регион задания и ответы
- Русский язык 8 класс КДР ответы и задания 19 декабря 2018
- Русский язык 8 класс ответы и задания 56 регион
- Русский язык 8 класс ответы и задания 6 мая 2019 итоговая работа
- Русский язык 8 класс стартовая работа ответы и задания 24.
 09
09 - Русский язык 8 класс статград ответы и задания
- Русский язык 9 класс 11.05 ответы
- Русский язык 9 класс 74 регион ответы
- Русский язык 9 класс ответы и задания 19 апреля 2019 диагностическая работа №4
- Русский язык 9 класс ответы и задания варианты 13 мая 2019 год
- Русский язык 9 класс ответы и задания диагностика статград 15 марта 2019
- Русский язык 9 класс ответы и задания полугодовая работа 2018-2019
- Русский язык 9 класс ответы изложение статград 2018-2019
- Русский язык 9 класс СтатГрад 17.04
- Русский язык 9 класс СтатГрад задания и ответы
- Русский язык 9 класс статград ОГЭ ответы и задания 15 марта 2018
- Русский язык 9 класс СТАТГРАД ответы и задания
- Русский язык 9 класс статград РЯ90201-РЯ90202 ответы и задания 27.11.
- Русский язык платно
- Русский язык школьный этап 2018-2019 ответы и задания Санкт-Петербург
- Русский язык школьный этап 2019-2020 задания и ответы московская область
- РЭ по математике 7 класс 24.
 05 ответы
05 ответы - РЭ по русскому языку 7 класс ответы 19.05
- РЭ по русскому языку 8 класс ответы 24.05
- СтатГрад
- Задания и ответы работы СТАТГРАД ВПР март 2020
- Работы статград апрель 2021 год задания ответы и решения
- Работы статград апрель 2022 год варианты ответы и решения
- Работы статград декабрь 2020 год задания ответы и решения
- Работы статград декабрь 2021 год задания ответы и решения
- Работы статград задания и ответы апрель 2020 год
- Работы статград май 2020 год задания, ответы, решения
- Работы статград май 2021 год задания ответы и решения
- Работы статград май 2022 год варианты ответы и решения
- Работы статград март 2021 год задания ответы и решения
- Работы статград март 2022 год задания ответы и решения
- Работы статград ноябрь 2020 год задания, ответы и решения
- Работы статград ноябрь 2021 год задания ответы и решения
- Работы статград октябрь 2020 год задания, ответы и решения
- Работы статград октябрь 2021 год задания ответы и решения
- Работы статград октябрь 2022 год варианты ответы и решения
- Работы статград сентябрь 2020 год задания, ответы и решения
- Работы статград сентябрь 2021 год задания ответы и решения
- Работы статград сентябрь 2022 год варианты ответы и решения
- Работы статград февраль 2021 год задания ответы и решения
- Работы статград февраль 2022 год задания ответы и решения
- Работы статград январь 2021 год задания ответы и решения
- Работы статград январь 2022 год задания ответы и решения
- Статград 9 класс русский язык ответы и задания 21.
 12.2018
12.2018 - СтатГрад апрель 2017 работы задания и ответы
- СтатГрад биология 11 класс 14.04.17
- Статград ВПР работы апрель 2019 ответы и задания
- СТАТГРАД ВПР февраль 2020 задания и ответы 2019-2020 учебный год
- Статград география 11 класс ответы и задания март 2018
- Статград география 9 класс ответы и задания 20 ноября 2018
- СтатГрад задания и ответы по обществознанию 11 класс 1 февраля 2018 года
- Статград задания и ответы январь 2018-2019
- Статград информатика 9 класс 27 ноября 2019 ответы и задания ИН1990201-ИН1990204
- СтатГрад информатика 9 класс ответы и задания 5 марта 2018
- Статград история 11 класс 2 варианта ответы и задания 12 марта 2018
- СтатГрад май 2017 работы задания и ответы
- СтатГрад математика 11 класс ответы и задания 6 марта 2018
- Статград Обществознание 11 класс ответы и задания
- Статград обществознание 9 класс ответы и задания 13 марта 2018
- СтатГрад обществознание 9 класс ответы и задания 17.
 05
05 - СтатГрад ответы и задания для работ ноябрь 2018
- СтатГрад ответы и задания по математике 10 класс База и Профиль 7 февраля 2018
- СтатГрад ответы и задания по русскому языку 11 класс 6 февраля 2018
- Статград ответы русский язык 11 класс 19.12.2018
- СтатГрад по математике для 11 классов
- Статград работы май 2018 ответы и задания
- Статград работы ответы и задания май 2019
- СтатГрад русский язык диагностические работы 2017 задания и ответы
- Темы итогового сочинения 2017
- Темы на пробное итоговое сочинение для 52 региона
- Темы по направлениям которые будут итоговое сочинение 2018 6 декабря
- Тест по русскому языку 4 класс ВПР 2018 ответы и задания
- Тренировочная работа по биологии 11 класс
- Тренировочная работа по биологии 9 класс ответы и задания 15 января 2019
- Тренировочная работа по информатике 11 класс
- Тренировочная работа по информатике 9 класс ответы
- Тренировочная работа по математике 10 класс ответы 6 февраля 2019
- Тренировочная работа по математике 11 класс ответы 06.
 03
03 - Тренировочная работа по химии 11 класс ответы 8 февраля 2019
- Тренировочная работа статград по географии 11 класс ответы 15.02.2019
- Тренировочное ВПР 2019 ответы и задания по английскому языку 7 класс
- Тренировочное ВПР 2019 ответы и задания по биологии 6 класс
- Тренировочное ВПР 2019 ответы и задания по истории 11 класс
- Тренировочное ВПР 2019 ответы и задания по математике 6 класс
- Тренировочное ВПР 2019 ответы и задания по физике 11 класс
- Тренировочные варианты 200203, 200217, 200302 по химии 11 класс с ответами 2020
- Тренировочные варианты ВПР 2020 по химии 8 класс ХИ1980101,ХИ1980102
- Тренировочные варианты ЕГЭ 2022 по биологии задания с ответами
- Тренировочные варианты ЕГЭ 2022 по обществознанию 11 класс задания с ответами
- Тренировочные варианты ЕГЭ 2022 по русскому языку задания с ответами
- Тренировочные варианты ЕГЭ 2023 по математике 11 класс задания с ответами
- Тренировочные варианты ЕГЭ по английскому языку 11 класс задания с ответами
- Тренировочные варианты ЕГЭ по географии 11 класс задания с ответами
- Тренировочные варианты ЕГЭ по информатике задания с ответами
- Тренировочные варианты ЕГЭ по истории 11 класс задания с ответами
- Тренировочные варианты ЕГЭ по литературе 11 класс задания с ответами
- Тренировочные варианты ЕГЭ по физике 11 класс задания с ответами
- Тренировочные варианты ЕГЭ по химии 11 класс задания с ответами
- Тренировочные варианты КДР 10 класс обществознание 2019
- Тренировочные варианты ОГЭ по английскому языку 9 класс задания с ответами
- Тренировочные варианты ОГЭ по биологии 9 класс задания с ответами
- Тренировочные варианты ОГЭ по географии 9 класс задания с ответами
- Тренировочные варианты ОГЭ по информатике 9 класс задания с ответами
- Тренировочные варианты ОГЭ по истории 9 класс задания с ответами
- Тренировочные варианты ОГЭ по математике 9 класс задания с ответами
- Тренировочные варианты ОГЭ по обществознанию 9 класс задания с ответами
- Тренировочные варианты ОГЭ по русскому языку 9 класс задания с ответами
- Тренировочные варианты ОГЭ по физике 9 класс задания с ответами
- Тренировочные варианты ОГЭ по химии 9 класс задания с ответами
- Тренировочные варианты по биологии 10 класс задания с ответами
- Тренировочные задания МЦКО ВСОКО математика 3 класс 2019
- Тренировочные работы для 56 региона задания и ответы сентябрь 2018
- Тренировочные работы для 56 региона Оренбургской области задания и ответы
- Тренировочные работы по математике статград 2017 задания и ответы
- Тренировочный вариант 33006757 ЕГЭ по математике профильный уровень с ответами
- Тренировочный вариант 33006758 ЕГЭ по математике профильный уровень с ответами
- Тренировочный вариант 33006759 ЕГЭ по математике профильный уровень с ответами
- Тренировочный вариант ЕГЭ 34073002 по математике профильный уровень с ответами
- Тренировочный вариант ЕГЭ 34073003 по математике профильный уровень с ответами
- Тренировочный вариант ЕГЭ 34073004 по математике профильный уровень с ответами
- Тренировочный вариант ЕГЭ 34073005 по математике профильный уровень с ответами
- Тренировочный вариант ЕГЭ 34073006 по математике профильный уровень с ответами
- Тренировочный вариант ЕГЭ 34073007 по математике профильный уровень с ответами
- Тренировочный вариант ЕГЭ 34073008 по математике профильный уровень с ответами
- Тренировочный вариант ЕГЭ 34073009 по математике профильный уровень с ответами
- Тренировочный вариант ЕГЭ 34073010 по математике профильный уровень с ответами
- Тренировочный вариант ЕГЭ 34073011 по математике профильный уровень с ответами
- Тренировочный вариант с ответами 200316 по физике 11 класс ЕГЭ 2020
- Тренировочный варианты №191223 и №191209 по химии 11 класс ЕГЭ 2020
- Тренировочный ЕГЭ 2020 математика 11 класс профиль задания и ответы
- Турнир ЛОМОНОСОВ задания и ответы 2018-2019
- Турнир Ломоносова задания и ответы 2019-2020 учебный год
- 09.
 03.2020 XLII Заключительный тур Ломоносова по биологии задания и ответы
03.2020 XLII Заключительный тур Ломоносова по биологии задания и ответы - 09.03.2020 Заключительный тур Ломоносова по астрономии задания и ответы
- 29.09.2019 Задания и ответы по астрономии 42 турнир М.В.Ломоносова
- 29.09.2019 Задания и ответы по биологии 42 турнир М.В. Ломоносова
- 29.09.2019 Задания и ответы по истории 42 турнир М.В. Ломоносова
- 29.09.2019 Задания и ответы по лингвистике 42 турнир М.В. Ломоносова
- 29.09.2019 Задания и ответы по литературе 42 турнир М.В. Ломоносова
- 29.09.2019 Задания и ответы по математике 42 турнир М.В. Ломоносова
- 29.09.2019 Задания и ответы по физике 42 турнир М.В. Ломоносова
- 29.09.2019 Задания и ответы по химии 42 турнир М.В. Ломоносова
- Ответы и задания по истории XLII заключительный тур Ломоносова 9 марта 2020
- Ответы и задания по лингвистике XLII заключительный турнир Ломоносова 9 марта 2020
- Ответы и задания по литературе XLII заключительный турнир Ломоносова 9 марта 2020
- Ответы и задания по математике XLII заключительный турнир Ломоносова 9 марта 2020
- Ответы и задания по физике XLII заключительный турнир Ломоносова 9 марта 2020
- Ответы и задания по химии XLII заключительный турнир Ломоносова 9 марта 2020
- 09.
- Условия перепечатки материалов | Правообладателям
- Устная часть английский язык 2018 платно
- Устное собеседование 2019 официальные варианты 13 февраля
- Устное собеседование 9 класс 2019
- Физика 11 класс 7 ноября 2019 статград ответы и задания варианты ФИ1910201-ФИ1910204
- Физика 11 класс ВПР ответы 25.
 04
04 - Физика 11 класс ответы и задания 6 мая 2019 тренировочная работа №5
- Физика 11 класс ответы и задания пробник статград 14 февраля 2018
- Физика 11 класс ответы и задания статград 2018
- Физика 11 класс ответы и задания ФИ1910101 ФИ1910102 19 сентября 2019
- Физика 11 класс СтатГрад ответы и задания
- Физика 11 класс тренировочная ЕГЭ №4 статград ответы и задания 14 марта 2019
- Физика 7 класс ВПР 2019 ответы и задания 23 апреля
- Физика 9 класс задания и ответы СтатГрад
- Физика 9 класс ответы и задания ФИ90101 и ФИ90102 статград 2018-2019
- Физика 9 класс ответы и задания ФИ90401 ФИ90402 статград
- Физика 9 класс СтатГрад 03.05 ответы
- Физика 9 класс статград ответы и задания 10 декабря 2019 варианты ФИ1990201-ФИ1990204
- Физика ОГЭ 2018 ответы и задания 2 июня
- Физика ОГЭ 2018 платно
- Физика турнир Ломоносова задания 2018-2019
- Физическая культура 10 ноября задания муниципальный этап всероссийская олимпиада 2018-2019
- ФИПИ открытый банк заданий ЕГЭ 2019 по русскому языку Лексика и фразеология
- Французский язык 7-11 класс муниципальный этап 2019-2020 ответы и задания Москва
- Химия 11 класс 10.
 05 СтатГрад ответы
05 СтатГрад ответы - Химия 11 класс ВПР 27.04 задания и ответы
- Химия 11 класс ЕГЭ статград ответы и задания 14 марта 2018
- Химия 11 класс ответы для ХИ10101 ХИ10102 статград 19.10
- Химия 11 класс ответы и задания 28 ноября 2019 статград ХИ1910201-ХИ1910204
- Химия 11 класс ответы и задания варианты статград 13 мая 2019 год
- Химия 11 класс ответы и задания СтатГрад 9 февраля 2018 года
- Химия 11 класс СтатГрад задания и ответы
- Химия 9 класс задания и ответы СтатГрад
- Химия 9 класс КДР ответы и задания 15 февраля 2018 года
- Химия 9 класс ОГЭ 4 июня 2019 год
- Химия 9 класс ОГЭ статград ответы и задания 15 февраля 2018
- Химия 9 класс ответы и задания 16.05
- Химия 9 класс ответы и задания ОГЭ статград 22.03.2018
- Химия 9 класс ответы тренировочная №4 статград 20 марта 2019
- Химия 9 класс статград ОГЭ ответы и задания
- Химия ВОШ школьный этап ответы и задания 2018-2019
- Химия ответы и задания для школьного этапа всероссийской олимпиады 2019-2020
- Частная группа
- ЧИП Австралия 23 октября 2019 ответы и задания 7-8 класс
- ЧИП Австралия 3-4 класс ответы и задания 23 октября 2019-2020
- ЧИП Австралия ответы и задания 5-6 класс 23 октября 2019-2020
- ЧИП мир сказок 2019 ответы и задания для 1 класса 5-7 лет
- Читательская грамотность 4 класс МЦКО 2019 тестирование
- Чтение читательская грамотность 3 класс МЦКО ВСОКО задания 2019
- Школьные конкурсы расписание 2017-2018
- Школьные олимпиады и конкурсы 2017-2018 задания и ответы
- Школьный тур наше наследие 7-8 класс ответы и задания 2019-2020
- Школьный этап 2019-2020 всероссийская олимпиада по астрономии ответы и задания
- Школьный этап 2019-2020 олимпиады ВОШ по физике ответы и задания
- Школьный этап 2019-2020 по биологии ответы и задания всероссийской олимпиады школьников
- Школьный этап 2019-2020 по испанскому языку ответы и задания всероссийской олимпиады
- Школьный этап 2019-2020 по праву задания и ответы для всероссийской олимпиады школьников
- Школьный этап 2019-2020 по праву ответы и задания всероссийской олимпиады школьников
- Школьный этап 2019-2020 по русскому языку ответы и задания всероссийская олимпиада школьников
- Школьный этап ВОШ 2019-2020 ответы и задания по французскому языку
- Школьный этап ВОШ по информатике ответы и задания 2018-2019
- Школьный этап ВОШ по испанскому языку ответы и задания 2018-2019
- Школьный этап ВОШ по математике задания и ответы 2018-2019
- Школьный этап ВСЕРОССИЙСКИХ олимпиад 2017-2018 задания
- Школьный этап всероссийской олимпиады задания и ответы по обществознанию 2019-2020 учебный год
- Школьный этап всероссийской олимпиады задания и ответы по физической культуре 2019-2020
- Школьный этап ВсОШ 2019-2020 ответы и задания по обществознанию
- Школьный этап олимпиады по информатике ответы и задания всероссийской олимпиады 2019
- Школьный этап олимпиады по математике ответы и задания всероссийской олимпиады 2019
- Школьный этап олимпиады по экономике ответы и задания всероссийской олимпиады 2019
- Школьный этап по английскому языку 2019-2020 задания и ответы московская область
- Школьный этап по ОБЖ задания и ответы всероссийская олимпиада 2019-2020
- Экзамен по географии ОГЭ 2019
- Экономика олимпиада муниципальный этап 2019 ВсОШ задания и ответы
8.
 5: Структуры Льюиса — Химия LibreTexts
5: Структуры Льюиса — Химия LibreTexts- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 349446
- Анонимный
- LibreTexts
Цели обучения
- Использовать символы точек Льюиса для объяснения стехиометрии соединений.
- Чтобы понять концепцию резонанса.
Начнем обсуждение связи между структурой и связью в ковалентных соединениях с описания взаимодействия двух одинаковых нейтральных атомов, например молекулы Н 2 , содержащей чисто ковалентную связь. Каждый атом водорода в H 2 содержит один электрон и один протон, причем электрон притягивается к протону электростатическими силами. Поскольку два атома водорода сближаются, необходимо учитывать дополнительные взаимодействия (рис. 5.3.1):
Поскольку два атома водорода сближаются, необходимо учитывать дополнительные взаимодействия (рис. 5.3.1):
- Электроны в двух атомах отталкиваются друг от друга, потому что они имеют одинаковый заряд ( E > 0).
- Аналогичным образом протоны в соседних атомах отталкиваются друг от друга ( E > 0).
- Электрон в одном атоме притягивается к противоположно заряженному протону в другом атоме и наоборот ( E < 0). Напомним из главы 2, что невозможно точно указать положение электрона в любом из атомов водорода. Следовательно, необходимо использовать квантово-механические распределения вероятностей.
Рис. 5.3.1 Взаимодействия притяжения и отталкивания между электронами и ядрами в молекуле водорода
электрон-протонные взаимодействия являются привлекательными. При наблюдаемом расстоянии связи отталкивающие и притягивающие взаимодействия уравновешиваются.
График зависимости потенциальной энергии системы от межъядерного расстояния (рис. 5.3.2) показывает, что система становится более стабильной (энергия системы уменьшается) по мере того, как два атома водорода движутся навстречу друг другу из r = ∞, пока энергия не достигнет минимума при r = r 0 (наблюдаемое межъядерное расстояние в H 2 равно 74 пм). Таким образом, на промежуточных расстояниях преобладают взаимодействия протон-электрон притяжения, но когда расстояние становится очень коротким, взаимодействия электрона-электрона и протон-протона отталкивания вызывают быстрый рост энергии системы. Обратите внимание на сходство между рис. 5.3.2 и рис. 4.1.2, на которых описывается система, содержащая два противоположно заряженных ионы . Формы кривых зависимости энергии от расстояния на двух рисунках похожи, потому что они оба являются результатом сил притяжения и отталкивания между заряженными объектами.
5.3.2) показывает, что система становится более стабильной (энергия системы уменьшается) по мере того, как два атома водорода движутся навстречу друг другу из r = ∞, пока энергия не достигнет минимума при r = r 0 (наблюдаемое межъядерное расстояние в H 2 равно 74 пм). Таким образом, на промежуточных расстояниях преобладают взаимодействия протон-электрон притяжения, но когда расстояние становится очень коротким, взаимодействия электрона-электрона и протон-протона отталкивания вызывают быстрый рост энергии системы. Обратите внимание на сходство между рис. 5.3.2 и рис. 4.1.2, на которых описывается система, содержащая два противоположно заряженных ионы . Формы кривых зависимости энергии от расстояния на двух рисунках похожи, потому что они оба являются результатом сил притяжения и отталкивания между заряженными объектами.
Рис. 5.3.2 График зависимости потенциальной энергии от межъядерного расстояния для взаимодействия двух атомов газообразного водорода
На больших расстояниях взаимодействия притяжения и отталкивания малы. По мере уменьшения расстояния между атомами преобладают притягивающие электрон-протонные взаимодействия, и энергия системы уменьшается. При наблюдаемом расстоянии связи отталкивающие электрон-электронные и протон-протонные взаимодействия как раз уравновешивают притягивающие взаимодействия, предотвращая дальнейшее уменьшение межъядерного расстояния. На очень коротких межъядерных расстояниях преобладают отталкивающие взаимодействия, что делает систему менее стабильной, чем изолированные атомы.
По мере уменьшения расстояния между атомами преобладают притягивающие электрон-протонные взаимодействия, и энергия системы уменьшается. При наблюдаемом расстоянии связи отталкивающие электрон-электронные и протон-протонные взаимодействия как раз уравновешивают притягивающие взаимодействия, предотвращая дальнейшее уменьшение межъядерного расстояния. На очень коротких межъядерных расстояниях преобладают отталкивающие взаимодействия, что делает систему менее стабильной, чем изолированные атомы.
Использование символов точек Льюиса для описания ковалентной связи
Это совместное использование электронов, позволяющее атомам «слипаться» вместе, является основой ковалентной связи. Существует некоторое промежуточное расстояние, как правило, немного длиннее 0,1 нм или, если вы предпочитаете 100 пм, при котором силы притяжения значительно перевешивают силы отталкивания, и связь будет образована, если оба атома смогут достичь полного s 2 нп 6 конфигурация. Именно это поведение отразил Льюис в своем правиле октетов. Конфигурации валентных электронов составляющих атомов ковалентного соединения являются важными факторами, определяющими его структуру, стехиометрию и свойства. Например, у хлора с семью валентными электронами на один электрон меньше октета. Если два атома хлора делят свои неспаренные электроны, образуя ковалентную связь и образуя Cl 2 , каждый из них может завершить свою валентную оболочку:
Именно это поведение отразил Льюис в своем правиле октетов. Конфигурации валентных электронов составляющих атомов ковалентного соединения являются важными факторами, определяющими его структуру, стехиометрию и свойства. Например, у хлора с семью валентными электронами на один электрон меньше октета. Если два атома хлора делят свои неспаренные электроны, образуя ковалентную связь и образуя Cl 2 , каждый из них может завершить свою валентную оболочку:
Каждый атом хлора теперь имеет октет. Электронная пара, совместно используемая атомами, называется связывающей парой. Пара электронов в структуре Льюиса, которая является общей для двух атомов, образуя ковалентную связь; остальные три пары электронов на каждом атоме хлора называются неподеленными парами. Пара электронов в структуре Льюиса, которая не участвует в ковалентной связи. Неподеленные пары не участвуют в ковалентной связи. Если оба электрона в ковалентной связи происходят от одного и того же атома, связь называется координационной ковалентной связью. Ковалентная связь, в которой оба электрона происходят от одного и того же атома. Примеры этого типа связи представлены в разделе 5.4, когда мы обсуждаем атомы с менее октета электронов.
Ковалентная связь, в которой оба электрона происходят от одного и того же атома. Примеры этого типа связи представлены в разделе 5.4, когда мы обсуждаем атомы с менее октета электронов.
Мы можем проиллюстрировать образование молекулы воды из двух атомов водорода и атома кислорода, используя символы точек Льюиса:
Структура справа представляет собой электронную структуру Льюиса или структуру Льюиса для H 2 O. Имея две пары связей и две неподеленные пары, атом кислорода завершил свой октет. Более того, благодаря общей паре связей с кислородом каждый атом водорода теперь имеет полную валентную оболочку из двух электронов. Химики обычно обозначают связующую пару одной линией, как показано здесь для двух наших примеров:
Для построения электронных структур Льюиса для более сложных молекул и ионов можно использовать следующую процедуру:
1. Расположите атомы так, чтобы показать определенные связи. Когда есть центральный атом, это обычно наименее электроотрицательный элемент в соединении. Химики обычно указывают этот центральный атом первым в химической формуле (как в CCl 4 и CO 3 2− , в которых C является центральным атомом), что является еще одним ключом к разгадке структуры соединения. Водород и галогены почти всегда связаны только с одним другим атомом, поэтому они обычно терминал , а не центральный.
Химики обычно указывают этот центральный атом первым в химической формуле (как в CCl 4 и CO 3 2− , в которых C является центральным атомом), что является еще одним ключом к разгадке структуры соединения. Водород и галогены почти всегда связаны только с одним другим атомом, поэтому они обычно терминал , а не центральный.
Обратите внимание на шаблон
Центральный атом обычно является наименее электроотрицательным элементом в молекуле или ионе; водород и галогены обычно концевые.
2. Определите общее количество валентных электронов в молекуле или ионе. Сложите валентные электроны от каждого атома. (Вспомните из главы 2, что количество валентных электронов определяется положением элемента в периодической таблице.) Если частица представляет собой многоатомный ион, не забудьте добавить или вычесть количество электронов, необходимое для получения общего заряда на элементе. ион. Для СО 3 2− , например, мы добавляем к сумме два электрона из-за заряда -2.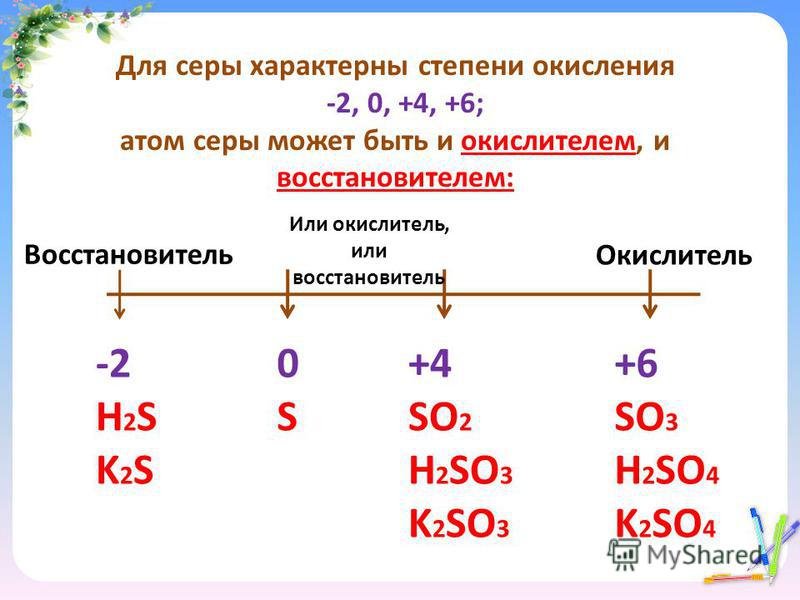
3. Поместите связывающую пару электронов между каждой парой соседних атомов, чтобы получить одинарную связь. В H 2 O, например, есть связывающая пара электронов между кислородом и каждым водородом.
4. Начиная с концевых атомов, добавьте к каждому атому столько электронов, чтобы дать каждому атому октет (два для водорода). Эти электроны обычно представляют собой неподеленные пары.
5. Если остались электроны, поместите их на центральный атом. В разделе 4.6 мы объясняем, что некоторые атомы способны разместить более восьми электронов.
6. Если у центрального атома меньше электронов, чем у октета, используйте неподеленные пары концевых атомов для образования множественных (двойных или тройных) связей с центральным атомом, чтобы получить октет. Это не изменит количество электронов на концевых атомах.
Теперь давайте применим эту процедуру к некоторым конкретным соединениям, начиная с того, который мы уже обсуждали.
H
2 O1. Поскольку атомы H почти всегда концевые, расположение внутри молекулы должно быть HOH.
2. Каждый атом H (группа 1) имеет 1 валентный электрон, а атом O (группа 16) имеет 6 валентных электронов, всего 8 валентных электронов.
3. Размещение одной связывающей пары электронов между атомом O и каждым атомом H дает H:O:H с 4 остатками электронов.
4. Каждый атом H имеет полную валентную оболочку из 2 электронов.
5. Добавление оставшихся 4 электронов к кислороду (в виде двух неподеленных пар) дает следующую структуру:
Это структура Льюиса, которую мы нарисовали ранее. Поскольку он дает кислороду октет, а каждому водороду два электрона, нам не нужно использовать шаг 6.
OCl
−1. Поскольку в молекуле всего два атома, центрального атома нет.
2. У кислорода (16 группа) 6 валентных электронов, у хлора (17 группа) 7 валентных электронов; мы должны добавить еще один для отрицательного заряда иона, что дает в общей сложности 14 валентных электронов.
3. Помещение связывающей пары электронов между O и Cl дает O:Cl с 12 оставшимися электронами.
4. Если мы поместим шесть электронов (в виде трех неподеленных пар) на каждый атом, мы получим следующую структуру:
Каждый атом теперь имеет октет электронов, поэтому шаги 5 и 6 не нужны. Электронная структура Льюиса изображена в скобках, как это принято для иона, вне скобок указан общий заряд, а связывающая пара электронов указана сплошной линией. OCl — представляет собой ион гипохлорита, активный ингредиент хлорного отбеливателя для белья и дезинфицирующего средства для бассейнов.
CH
2 O1. Поскольку углерод менее электроотрицателен, чем кислород, а водород обычно является концевым, C должен быть центральным атомом. Одно возможное расположение:
2. Каждый атом водорода (группа 1) имеет один валентный электрон, углерод (группа 14) имеет 4 валентных электрона, а кислород (группа 16) имеет 6 валентных электронов, всего [( 2)(1) + 4 + 6] = 12 валентных электронов.
3. Размещение связывающей пары электронов между каждой парой связанных атомов дает следующее:
Шесть электронов используются, 6 остаются.
4. Добавление всех 6 оставшихся электронов к кислороду (в виде трех неподеленных пар) дает следующее:
Хотя у кислорода теперь есть октет, а каждый водород имеет 2 электрона, у углерода только 6 электронов.
5. Не осталось электронов для размещения на центральном атоме.
6. Чтобы дать углероду октет электронов, мы используем одну из неподеленных пар электронов на кислороде для образования двойной связи углерод-кислород:
И кислород, и углерод теперь имеют октет электронов, так что это приемлемая электронная структура Льюиса. O имеет две пары связей и две неподеленные пары, а C имеет четыре пары связей. Это структура формальдегида, который используется в жидкости для бальзамирования.
Можно нарисовать альтернативную структуру с одним H, связанным с O. Формальные заряды , обсуждаемые далее в этом разделе, предполагают, что такая структура менее стабильна, чем показанная ранее.
Пример 3
Напишите электронную структуру Льюиса для каждого вида.
- NCl 3
- С 2 2−
- NOCl
Дано: химический вид
Запрошено: Электронные структуры Льюиса
Стратегия:
Используйте процедуру из шести шагов, чтобы записать электронную структуру Льюиса для каждого вида.
Решение:
- Азот менее электроотрицателен, чем хлор, а атомы галогена обычно концевые, поэтому азот является центральным атомом. Атом азота (группа 15) имеет 5 валентных электронов, а каждый атом хлора (группа 17) имеет 7 валентных электронов, всего 26 валентных электронов. Использование 2 электронов для каждой связи N – Cl и добавление трех неподеленных пар к каждому Cl дает (3 × 2) + (3 × 2 × 3) = 24 электрона. Правило 5 приводит нас к размещению оставшихся 2 электронов на центральном N:
Трихлорид азота представляет собой нестабильную маслянистую жидкость, когда-то использовавшуюся для отбеливания муки; это использование теперь запрещено в Соединенных Штатах.

- В двухатомной молекуле или ионе нам не нужно беспокоиться о центральном атоме. Каждый атом серы (группа 16) содержит 6 валентных электронов, и нам нужно добавить 2 электрона для заряда -2, что дает в общей сложности 14 валентных электронов. Используя 2 электрона для связи S-S, мы размещаем оставшиеся 12 электронов в виде трех неподеленных пар на каждой сере, давая каждому атому S октет электронов:
- Поскольку азот менее электроотрицателен, чем кислород или хлор, он является центральным атомом. Атом N (группа 15) имеет 5 валентных электронов, атом O (группа 16) имеет 6 валентных электронов, а атом Cl (группа 17) имеет 7 валентных электронов, что дает в общей сложности 18 валентных электронов. Размещение одной связывающей пары электронов между каждой парой связанных атомов использует 4 электрона и дает следующее:
Добавление трех неподеленных пар к кислороду и хлору требует еще 12 электронов, оставляя 2 электрона для размещения в виде неподеленной пары на азоте:
Поскольку эта структура Льюиса имеет только 6 электронов вокруг центрального атома азота, для образования связывающей пары должна использоваться неподеленная пара электронов на концевом атоме.
 Мы могли бы использовать одиночную пару либо на O, либо на Cl. Поскольку мы видели много структур, в которых O образует двойную связь, но ни одной с двойной связью с Cl, разумно выбрать неподеленную пару из O, чтобы получить следующее:
Мы могли бы использовать одиночную пару либо на O, либо на Cl. Поскольку мы видели много структур, в которых O образует двойную связь, но ни одной с двойной связью с Cl, разумно выбрать неподеленную пару из O, чтобы получить следующее:Все атомы теперь имеют октетные конфигурации. Это электронная структура Льюиса нитрозилхлорида, очень агрессивного красновато-оранжевого газа.
Упражнение
Напишите электронные структуры Льюиса для CO 2 и SCl 2 , неустойчивой красной жидкости с неприятным запахом, которая используется при производстве каучука.
Ответить
Использование электронных структур Льюиса для объяснения стехиометрии
Символы точек Льюиса обеспечивают простое объяснение того, почему элементы образуют соединения с наблюдаемой стехиометрией. В модели Льюиса количество связей, образованных элементом в нейтральном соединении, равно количеству неспаренных электронов, которые он должен разделить с другими атомами, чтобы завершить свой октет электронов. Для элементов группы 17 (галогены) это число равно единице; для элементов 16-й группы (халькогены) — два; для группы 15 — три; и для группы 14, четыре. Эти требования иллюстрируются следующими структурами Льюиса для гидридов самых легких членов каждой группы:
Для элементов группы 17 (галогены) это число равно единице; для элементов 16-й группы (халькогены) — два; для группы 15 — три; и для группы 14, четыре. Эти требования иллюстрируются следующими структурами Льюиса для гидридов самых легких членов каждой группы:
Элементы могут образовывать несколько связей для завершения октета. В этилене, например, каждый углерод вносит два электрона в двойную связь, давая каждому углероду октет (два электрона/связь × четыре связи = восемь электронов). Нейтральные структуры с меньшим или большим количеством связей существуют, но они необычны и нарушают правило октета.
Аллотропы элемента могут иметь очень разные физические и химические свойства из-за различного пространственного расположения атомов; однако количество связей, образованных атомами компонентов, всегда одинаково. Как отмечалось в начале главы, алмаз — твердое прозрачное тело; графит — мягкое твердое вещество черного цвета; а фуллерены имеют структуру с открытой клеткой. Несмотря на эти различия, атомы углерода во всех трех аллотропах образуют четыре связи в соответствии с правилом октета. Элементарный фосфор также существует в трех формах: белый фосфор, токсичное воскообразное вещество, которое сначала светится, а затем самовозгорается при контакте с воздухом; красный фосфор, аморфное вещество, которое коммерчески используется в безопасных спичках, фейерверках и дымовых шашках; и черный фосфор, нереакционноспособное кристаллическое твердое вещество с текстурой, похожей на графит (рис. 5.1.3). Тем не менее, атомы фосфора во всех трех формах подчиняются правилу октетов и образуют три связи на атом фосфора.
Элементарный фосфор также существует в трех формах: белый фосфор, токсичное воскообразное вещество, которое сначала светится, а затем самовозгорается при контакте с воздухом; красный фосфор, аморфное вещество, которое коммерчески используется в безопасных спичках, фейерверках и дымовых шашках; и черный фосфор, нереакционноспособное кристаллическое твердое вещество с текстурой, похожей на графит (рис. 5.1.3). Тем не менее, атомы фосфора во всех трех формах подчиняются правилу октетов и образуют три связи на атом фосфора.
Обратите внимание на шаблон
Структуры Льюиса объясняют, почему элементы групп 14–17 образуют нейтральные соединения с четырьмя, тремя, двумя и одним связанным атомом (атомами) соответственно.
Рисунок 5.3.3 Три аллотропа фосфора: белый, красный и черный
Все три формы содержат только атомы фосфора, но они различаются расположением и связью их атомов. Белый фосфор содержит тетраэдры P 4 , красный фосфор представляет собой сеть связанных P 8 и Р 9 ед. , а черный фосфор образует листы шестичленных колец. В результате их физические и химические свойства резко различаются.
, а черный фосфор образует листы шестичленных колец. В результате их физические и химические свойства резко различаются.
Формальные обвинения
Иногда можно записать более одной структуры Льюиса для вещества, не нарушающего правила октета, как мы видели для CH 2 O, но не каждая структура Льюиса может быть одинаково разумной. В этих ситуациях мы можем выбрать наиболее стабильную структуру Льюиса, учитывая формальный заряд. Разность между числом валентных электронов в свободном атоме и числом электронов, присвоенных ему в конкретной электронной структуре Льюиса. на атомах, что представляет собой разность между числом валентных электронов в свободном атоме и числом, присвоенным ему в электронной структуре Льюиса. Формальный заряд — это способ вычисления распределения заряда в структуре Льюиса; сумма формальных зарядов атомов внутри молекулы или иона должна равняться общему заряду молекулы или иона. Формальное обвинение делает , а не представляют собой истинный заряд атома в ковалентной связи, но просто используются для предсказания наиболее вероятной структуры, когда соединение имеет более одной действительной структуры Льюиса.
Для расчета формальных зарядов мы отнесем электроны в молекуле к отдельным атомам по следующим правилам:
- Несвязывающие электроны отнесем к атому, на котором они расположены.
- Связывающие электроны делятся поровну между связанными атомами.
{\left ( атом\; в\; Льюис\; структура \right )}
\end{matrix} \tag{5.3.1} \)
Чтобы проиллюстрировать этот метод, рассчитаем формальный заряд атомов в аммиаке. (NH 3 ), электронная структура которого по Льюису выглядит следующим образом:
Нейтральный атом азота имеет пять валентных электронов (он находится в группе 15). Судя по электронной структуре Льюиса, атом азота в аммиаке имеет одну неподеленную пару и три общих пары связи с атомами водорода, поэтому самому азоту соответствует в общей сложности пять электронов [2 несвязывающие e 9{-}}{2} \right )=0 \tag{4.4.3} \)
Атомы водорода в аммиаке имеют такое же количество электронов, как и нейтральные атомы водорода, поэтому их формальный заряд также равен нулю. Сложение формальных зарядов должно дать нам общий заряд молекулы или иона. В этом примере азот и каждый водород имеют формальный нулевой заряд. При суммировании общий заряд равен нулю, что согласуется с общим зарядом молекулы NH 3 .
Сложение формальных зарядов должно дать нам общий заряд молекулы или иона. В этом примере азот и каждый водород имеют формальный нулевой заряд. При суммировании общий заряд равен нулю, что согласуется с общим зарядом молекулы NH 3 .
Как правило, структура с наибольшим количеством зарядов на ближайших к нулю атомах является более стабильной структурой Льюиса. В случаях, когда на различных атомах имеются положительные или отрицательные формальные заряды, стабильные структуры обычно имеют отрицательные формальные заряды на более электроотрицательных атомах и положительные формальные заряды на менее электроотрицательных атомах. Следующий пример также демонстрирует, как рассчитать формальные сборы.
Пример 4
Рассчитайте формальные заряды каждого атома в ионе NH 4 + .
Дано: химический вид
Запрошено: формальный заряд
Стратегия:
Определите количество валентных электронов в каждом атоме NH 9. 0041 41 Используйте электронную структуру Льюиса NH 4 + , чтобы определить количество связывающих и несвязывающих электронов, связанных с каждым атомом, а затем используйте уравнение 4.4.1 для расчета формального заряда на каждом атоме.
0041 41 Используйте электронную структуру Льюиса NH 4 + , чтобы определить количество связывающих и несвязывающих электронов, связанных с каждым атомом, а затем используйте уравнение 4.4.1 для расчета формального заряда на каждом атоме.
Решение:
Электронная структура Льюиса для иона NH 4 + выглядит следующим образом:
Атом азота имеет четыре общих пары электронов связи, а нейтральный атом азота имеет пять валентностей. Таким образом, используя уравнение 4.4.1, формальный заряд атома азота равен
\( формальный\; заряд\левый ( N \правый )=5-\левый ( 0+\frac{8}{2} \right )= 0 \)
Каждый атом водорода имеет одну связывающую пару. Таким образом, формальный заряд каждого атома водорода равен 9.0044
\( формальный\; заряд\левый ( H \правый )=1-\левый ( 0+\frac{2}{2} \правый )=0 \)
Формальные заряды атомов в NH Таким образом, 4 + ионов равны
Сложение формальных зарядов атомов должно дать нам общий заряд молекулы или иона. В этом случае сумма формальных зарядов равна 0 + 1 + 0 + 0 + 0 = +1.
В этом случае сумма формальных зарядов равна 0 + 1 + 0 + 0 + 0 = +1.
Упражнение
Запишите формальные заряды всех атомов в BH 4 − .
Ответ
Если атом в молекуле или ионе имеет типичное для этого атома число связей (например, четыре связи для углерода), то его формальный заряд равен нулю.
Обратите внимание на образец
Атом, молекула или ион имеют формальный нулевой заряд, если они имеют число связей, типичное для этого вида.
Использование формальных зарядов для различения структур Льюиса
В качестве примера того, как можно использовать формальные заряды для определения наиболее стабильной структуры Льюиса для вещества, мы можем сравнить две возможные структуры для CO 2 . Обе структуры соответствуют правилам электронной структуры Льюиса.
CO
21. C менее электроотрицателен, чем O, поэтому он является центральным атомом.
2. C имеет 4 валентных электрона, а каждый O имеет 6 валентных электронов, всего 16 валентных электронов.
C имеет 4 валентных электрона, а каждый O имеет 6 валентных электронов, всего 16 валентных электронов.
3. Помещение одной электронной пары между C и каждым O дает O–C–O с 12 оставшимися электронами.
4. Разделение оставшихся электронов между атомами О дает три неподеленных пары на каждом атоме:
Эта структура имеет октет электронов вокруг каждого атома O, но только 4 электрона вокруг атома C.
5. У центрального атома не осталось электронов.
6. Чтобы дать атому углерода октет электронов, мы можем преобразовать две неподеленные пары атомов кислорода в связывающие электронные пары. Однако есть два способа сделать это. Мы можем либо взять по одной электронной паре от каждого кислорода, чтобы сформировать симметричную структуру, либо взять обе электронные пары от одного атома кислорода, чтобы получить асимметричную структуру:
Обе электронные структуры Льюиса дают всем трем атомам октет. Как мы выбираем между этими двумя возможностями? Формальные заряды для двух электронных структур Льюиса CO 2 следующие:
Обе структуры Льюиса имеют общий формальный заряд, равный нулю, но структура справа имеет +1 заряд на более электроотрицательном атоме (O) . Таким образом, симметричная структура Льюиса слева предсказывается как более стабильная, и это фактически структура, наблюдаемая экспериментально. Помните, однако, что формальные обвинения делают , а не представляют фактические заряды атомов в молекуле или ионе. Они используются просто как бухгалтерский метод для предсказания наиболее стабильной структуры Льюиса для соединения.
Таким образом, симметричная структура Льюиса слева предсказывается как более стабильная, и это фактически структура, наблюдаемая экспериментально. Помните, однако, что формальные обвинения делают , а не представляют фактические заряды атомов в молекуле или ионе. Они используются просто как бухгалтерский метод для предсказания наиболее стабильной структуры Льюиса для соединения.
Обратите внимание на шаблон
Структура Льюиса с набором формальных зарядов, ближайшим к нулю, обычно является наиболее стабильной.
Пример 5
Ион тиоцианата (SCN — ), который используется в печати и в качестве ингибитора коррозии против кислых газов, имеет по крайней мере две возможные электронные структуры Льюиса. Нарисуйте две возможные структуры, присвойте формальные заряды всем атомам в обеих и решите, какое расположение электронов является предпочтительным.
Дано: химический вид
Запрошено: Электронные структуры Льюиса, формальные заряды и предпочтительное расположение конструкции для СЦН − .
B Рассчитайте формальный заряд каждого атома, используя уравнение 4.4.1.
C Предскажите, какая структура предпочтительнее, исходя из формального заряда каждого атома и его электроотрицательности по отношению к другим присутствующим атомам.
Решение:
A Возможные структуры Льюиса для иона SCN − следующие:
B Мы должны рассчитать формальные заряды на каждом атоме, чтобы определить более стабильную структуру. Если мы начнем с углерода, мы заметим, что атом углерода в каждой из этих структур разделяет четыре пары связей, число связей типично для углерода, поэтому он имеет формальный заряд, равный нулю. Продолжая с серой, мы наблюдаем, что в (а) атом серы имеет одну общую пару связей и три неподеленные пары и имеет в общей сложности шесть валентных электронов. Таким образом, формальный заряд атома серы равен \( 6-\left ( 6+\frac{2}{2} \right )=-1,5-\left ( 4+\frac{4}{2} \right )= -1 \) В (c) азот имеет формальный заряд -2.
C Какая структура предпочтительнее? Структура (b) предпочтительнее, потому что отрицательный заряд находится на более электроотрицательном атоме (N) и имеет более низкие формальные заряды на каждом атоме по сравнению со структурой (c): 0, -1 по сравнению с +1, -2.
Упражнение
Соли, содержащие гремучий ион (CNO − ), используются в детонаторах взрывчатых веществ. Нарисуйте три электронные структуры Льюиса для CNO − и используйте формальные заряды, чтобы предсказать, какая из них более стабильна. (Примечание: N — центральный атом.)
Ответ
Предполагается, что вторая структура будет более стабильной.
Резонансные структуры
Иногда, даже при учете формальных зарядов, связь в некоторых молекулах или ионах не может быть описана одной структурой Льюиса. Так обстоит дело с озоном (O 3 ), аллотропом кислорода с V-образной структурой и углом O–O–O 117,5°.
O
3 1. Мы знаем, что озон имеет V-образную структуру, поэтому один атом O является центральным:
Мы знаем, что озон имеет V-образную структуру, поэтому один атом O является центральным:
2. Каждый атом O имеет 6 валентных электронов, всего 18 валентных электронов.
3. Присвоение одной связывающей пары электронов каждой связи кислород-кислород дает
с 14 оставшимися электронами.
4. Если мы поместим три неподеленные пары электронов на каждый концевой кислород, мы получим
и у нас останется 2 электрона.
5. В этот момент оба концевых атома кислорода имеют октеты электронов. Поэтому мы помещаем последние 2 электрона на центральный атом:
6. Центральный кислород имеет только 6 электронов. Мы должны преобразовать одну неподеленную пару на концевом атоме кислорода в связывающую пару электронов — но какую? В зависимости от того, что мы выбираем, мы получаем либо
, либо Что правильно? На самом деле ни то, ни другое не верно. Оба предсказывают одну одинарную связь O – O и одну двойную связь O = O. Как вы узнаете из раздела 4.8, если бы связи были разных типов (например, одна одинарная и одна двойная), они имели бы разную длину. Однако оказывается, что оба расстояния связи O–O одинаковы, 127,2 пм, что меньше, чем типичная одинарная связь O–O (148 пм), и больше, чем двойная связь O=O в O 2 (120,7 вечера).
Однако оказывается, что оба расстояния связи O–O одинаковы, 127,2 пм, что меньше, чем типичная одинарная связь O–O (148 пм), и больше, чем двойная связь O=O в O 2 (120,7 вечера).
Эквивалентные точечные структуры Льюиса, такие как структуры озона, называются резонансными структурами Электронная структура Льюиса, которая имеет различное расположение электронов вокруг атомов, положение которых не меняется. Положение атомов одинаково в различных резонансных структуры соединения, но положение электронов другое. Двунаправленные стрелки связывают различные резонансные структуры соединения:
До развития квантовой химии считалось, что двунаправленная стрелка указывает на то, что реальная электронная структура представляет собой в среднем показанных, или что молекула колеблется между двумя структурами. Сегодня мы знаем, что электроны, участвующие в двойных связях, занимают орбиталь, которая распространяется на все три молекулы кислорода, объединяя p-орбитали на всех трех.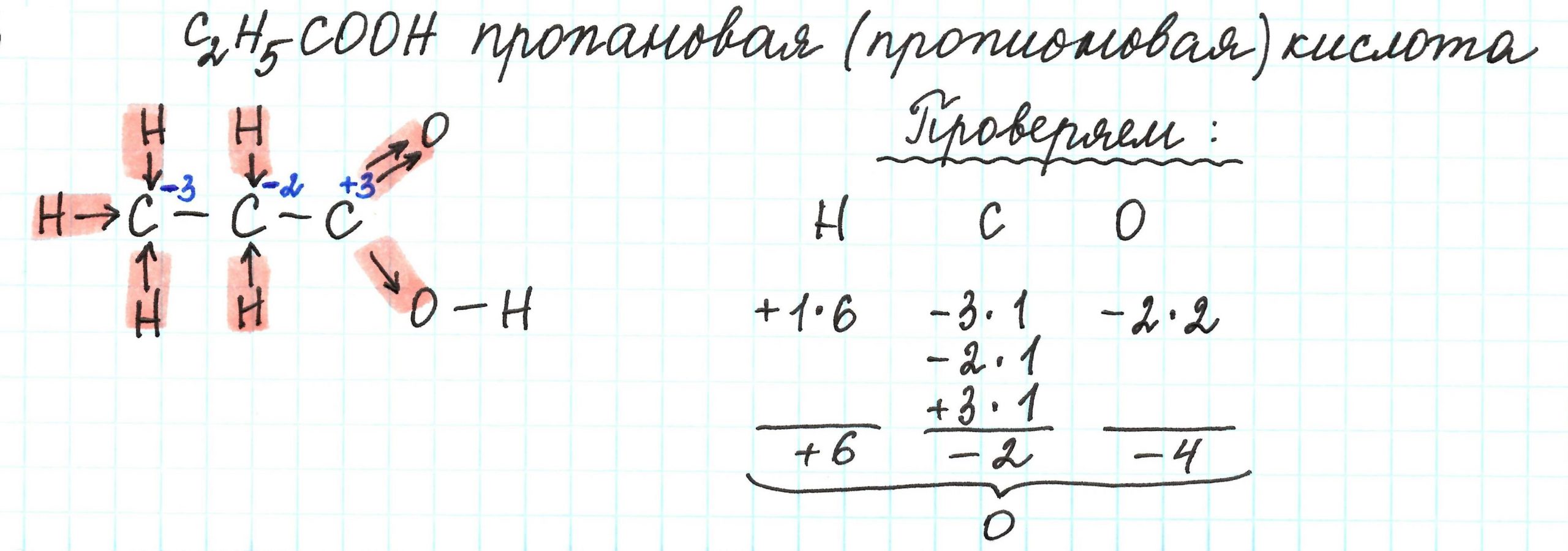
Рис. 5.3.4 Резонансная структура озона включает молекулярную орбиталь, охватывающую все три атома кислорода
В озоне молекулярная орбиталь, охватывающая все три атома кислорода, формируется из трех атомов с центром p z орбиталей. Подобные молекулярные орбитали находятся в каждой резонансной структуре.
Мы обсудим формирование этих молекулярных орбиталей в следующей главе, но важно понимать, что резонансные структуры основаны на молекулярных орбиталях, а не на средних значениях различных связей между атомами. Мы описываем электроны на таких молекулярных орбиталях как делокализованные, то есть их нельзя отнести к связи между двумя атомами.
Обратите внимание на шаблон
Когда возможно написать более одной эквивалентной резонансной структуры для молекулы или иона, фактическая структура включает молекулярную орбиталь, которая представляет собой линейную комбинацию атомных орбиталей каждого из атомов.
CO
3 2−Подобно озону, электронная структура карбонат-иона не может быть описана одной электронной структурой Льюиса. Однако, в отличие от O 3 , структуры Льюиса, описывающие CO 3 2− , имеют три эквивалентных представления.
1. Поскольку углерод является наименее электроотрицательным элементом, мы помещаем его в центральное положение:
2. У углерода 4 валентных электрона, у каждого кислорода 6 валентных электронов, и еще 2 приходится на заряд -2. Это дает 4 + (3 × 6) + 2 = 24 валентных электрона.
3. Шесть электронов используются для образования трех пар связи между атомами кислорода и углерода:
4. Разделим оставшиеся 18 электронов поровну между тремя атомами кислорода, поместив три неподеленные пары на каждый и указав заряд -2 :
5. У центрального атома не осталось электронов.
6. На данный момент атом углерода имеет только 6 валентных электронов, поэтому мы должны взять одну неподеленную пару из кислорода и использовать ее для образования двойной связи углерод-кислород. В этом случае, однако, есть три возможных варианта:
В этом случае, однако, есть три возможных варианта:
Как и в случае с озоном, ни одна из этих структур точно не описывает связывание. Каждый из них предсказывает одну двойную связь углерод-кислород и две одинарные связи углерод-кислород, но экспериментально все длины связей C-O идентичны. Мы можем написать резонансные структуры (в данном случае три) для карбонат-иона:
Как и в случае с озоном, фактическая структура включает в себя формирование молекулярной орбитали из орбиталей p z с центром на каждом атоме и расположенных выше и ниже плоскости иона CO 3 2− .
Пример 6
Бензол является обычным органическим растворителем, который ранее использовался в бензине; Однако он больше не используется для этой цели, потому что теперь известно, что он является канцерогеном. Молекула бензола (C 6 H 6 ) состоит из правильного шестиугольника атомов углерода, каждый из которых также связан с атомом водорода. Используйте резонансные структуры для описания связи в бензоле.
Используйте резонансные структуры для описания связи в бензоле.
Дано: молекулярная формула и молекулярная геометрия
Запрошено: резонансные структуры
Стратегия:
A Нарисуйте структуру бензола, иллюстрирующую связанные атомы. Затем подсчитайте количество валентных электронов, используемых на этом рисунке.
B Вычтите это число из общего числа валентных электронов в бензоле и затем расположите оставшиеся электроны так, чтобы каждый атом в структуре достиг октета.
C Нарисуйте резонансные структуры для бензола.
Решение:
A Каждый атом водорода дает 1 валентный электрон, а каждый атом углерода дает 4 валентных электрона, всего (6 × 1) + (6 × 4) = 30 валентных электронов. Если мы поместим одну пару связывающих электронов между каждой парой атомов углерода и между каждым углеродом и атомом водорода, мы получим следующее:
Каждый атом углерода в этой структуре имеет только 6 электронов и имеет формальный заряд +1, но мы использовали только 24 из 30 валентных электронов.
B Если 6 оставшихся электронов равномерно распределить попарно на чередующихся атомах углерода, мы получим следующее:
Три атома углерода теперь имеют октетную конфигурацию и формальный заряд -1, в то время как три атома углерода имеют только 6 электронов и формальный заряд +1. Мы можем преобразовать каждую неподеленную пару в пару связывающих электронов, которая дает каждому атому октет электронов и формальный заряд, равный 0, путем образования трех двойных связей C=C.
C Однако это можно сделать двумя способами:
Каждая структура имеет чередующиеся двойные и одинарные связи, но эксперименты показывают, что каждая углерод-углеродная связь в бензоле идентична, а длина связи (139,9 пм) является промежуточной между длинами, обычно находимыми для одинарной связи С-С (154 пм) и Двойная связь C=C (134 пм). Мы можем описать связь в бензоле, используя две резонансные структуры, но фактическая электронная структура является средней из двух. Существование множественных резонансных структур для ароматических углеводородов, таких как бензол, часто обозначается кружком или пунктирными линиями внутри шестиугольника:
Существование множественных резонансных структур для ароматических углеводородов, таких как бензол, часто обозначается кружком или пунктирными линиями внутри шестиугольника:
Эту комбинацию p-орбиталей для бензола можно представить в виде кольца с узлом в плоскости атомов углерода.
Упражнения
Натриевая соль нитрита используется для снятия мышечных спазмов. Нарисуйте две резонансные структуры для нитрит-иона (NO 2 − ).
Ответ
Резонансные структуры особенно распространены в оксоанионах р -блочных элементов, таких как сульфат и фосфат, и в ароматических углеводородах, таких как бензол и нафталин.
Резюме
График общей энергии ковалентной связи как функции межъядерного расстояния идентичен графику ионной пары, потому что оба являются результатом сил притяжения и отталкивания между заряженными объектами. В электронных структурах Льюиса мы встречаем пар связей , которые являются общими для двух атомов, и неподеленных пар , которые не являются общими для атомов. Если оба электрона в ковалентной связи исходят от одного и того же атома, связь называется -координатной ковалентной связью 9.0061 . Структуры Льюиса — это попытка рационализировать, почему для элементов определенных семейств обычно соблюдаются определенные стехиометрии. Нейтральные соединения элементов группы 14 обычно содержат четыре связи вокруг каждого атома (двойная связь считается за две, тройная связь — за три), тогда как нейтральные соединения элементов группы 15 обычно содержат три связи. В случаях, когда возможно написать более одной электронной структуры Льюиса с октетами вокруг всех неводородных атомов соединения, формальный заряд для каждого атома в альтернативных структурах должен учитываться, чтобы решить, какую из действительных структур можно исключить и какая является наиболее разумной. Формальный заряд — это разница между числом валентных электронов свободного атома и числом электронов, приписанных ему в соединении, где связывающие электроны поровну делятся между связанными атомами.
Если оба электрона в ковалентной связи исходят от одного и того же атома, связь называется -координатной ковалентной связью 9.0061 . Структуры Льюиса — это попытка рационализировать, почему для элементов определенных семейств обычно соблюдаются определенные стехиометрии. Нейтральные соединения элементов группы 14 обычно содержат четыре связи вокруг каждого атома (двойная связь считается за две, тройная связь — за три), тогда как нейтральные соединения элементов группы 15 обычно содержат три связи. В случаях, когда возможно написать более одной электронной структуры Льюиса с октетами вокруг всех неводородных атомов соединения, формальный заряд для каждого атома в альтернативных структурах должен учитываться, чтобы решить, какую из действительных структур можно исключить и какая является наиболее разумной. Формальный заряд — это разница между числом валентных электронов свободного атома и числом электронов, приписанных ему в соединении, где связывающие электроны поровну делятся между связанными атомами. Структура Льюиса с наименьшими формальными зарядами на атомах почти всегда является наиболее стабильной. Некоторые молекулы имеют две или более химически эквивалентных электронных структуры Льюиса, называемых резонансные структуры . Эти структуры отмечены двунаправленной стрелкой между ними, что указывает на то, что ни одна из структур Льюиса точно не описывает связь, но фактическая структура представляет собой среднее отдельных резонансных структур.
Структура Льюиса с наименьшими формальными зарядами на атомах почти всегда является наиболее стабильной. Некоторые молекулы имеют две или более химически эквивалентных электронных структуры Льюиса, называемых резонансные структуры . Эти структуры отмечены двунаправленной стрелкой между ними, что указывает на то, что ни одна из структур Льюиса точно не описывает связь, но фактическая структура представляет собой среднее отдельных резонансных структур.
Key Takeaway
- Символы точек Льюиса обеспечивают простое объяснение того, почему элементы образуют соединения с наблюдаемой стехиометрией.
Ключевое уравнение
{-}}{2} \right ) \)
Концептуальные проблемы
Сравните и сопоставьте ковалентные и ионные соединения в отношении
- летучести.
- температура плавления.
- электропроводность.
- внешний вид.
В чем сходство графиков зависимости общей энергии от межъядерного расстояния для ионного соединения и ковалентного соединения? Почему сюжеты так похожи?
Какой атом, по вашему мнению, будет центральным в каждом из следующих видов?
- СО 4 2−
- НХ 4 +
- БКл 3
- SO 2 Cl 2 ?
Какой атом является центральным в каждом из следующих видов?
- ПКл 3
- CHCl 3
- СО 2
- ЕСЛИ 3 ?
Какова связь между количеством связей, обычно образованных элементами периода 2 в группах 14, 15 и 16, и их электронной структурой Льюиса?
Хотя формальные заряды не представляют фактические заряды атомов в молекулах или ионах, они все же полезны.
 Почему?
Почему?Почему важны резонансные структуры?
В соединениях каких типов особенно распространены резонансные структуры?
Численные задачи
Укажите электронную конфигурацию и символ точки Льюиса для следующего. Сколько еще электронов может вместить каждый атом?
- Se
- Кр
- Ли
- Ср
- Х
Укажите электронную конфигурацию и символ точки Льюиса для следующего. Сколько еще электронов может вместить каждый атом?
- Нет данных
- Бр
- Не
- С
- Га
На основе символов точек Льюиса предскажите предпочтительную степень окисления Be, F, B и Cs.
На основе точечных символов Льюиса предскажите предпочтительную степень окисления Br, Rb, O, Si и Sr
На основе точечных символов Льюиса предскажите, сколько связей галлий, кремний и селен образуют в своих нейтральных соединениях.

Определите общее количество валентных электронов в следующем.
- Кр
- Cu +
- № +
- XEF 2
- Бр 2
- CH 2 Класс 2
- НЕТ 3 −
- Н 3 О +
Определите общее количество валентных электронов в следующем.
- Ag
- Pt 2 +
- Н 2 С
- ОХ −
- I 2
- СН 4
- СО 4 2−
- НХ 4 + .
Нарисуйте электронные структуры Льюиса для следующего.
- Ф 2
- СО 2
- AlCl 4 −
- СО 3 2−
- БрКл
- XEF 4
- № +
- ПКл 3
Нарисуйте электронные структуры Льюиса для следующего.

- Бр 2
- СН 3 Бр
- СО 4 2−
- О 2
- С 2 2−
- БФ 3
Нарисуйте электронные структуры Льюиса для CO 2 , NO 2 − , SO 2 и NO 2 + . По вашей диаграмме предскажите, какие пары соединений имеют сходную электронную структуру.
Напишите символы точек Льюиса для каждой пары элементов. Для реакции между каждой парой элементов предскажите, какой элемент является окислителем, какой элемент является восстановителем, и окончательную стехиометрию образовавшегося соединения.
- К, С
- Ср, Бр
- Ал, О
- мг, кл
Напишите символы точек Льюиса для каждой пары элементов.
 Для реакции между каждой парой элементов предскажите, какой элемент является окислителем, какой элемент является восстановителем, и окончательную стехиометрию образовавшегося соединения.
Для реакции между каждой парой элементов предскажите, какой элемент является окислителем, какой элемент является восстановителем, и окончательную стехиометрию образовавшегося соединения.- Ли, Ф
- Цз, Бр
- Са, Cl
- Б, Ф
Используйте символы точек Льюиса, чтобы предсказать, будут ли ICl и NO 4 − являются химически обоснованными формулами.
Нарисуйте правдоподобную электронную структуру Льюиса для соединения с молекулярной формулой Cl 3 PO.
Нарисуйте правдоподобную электронную структуру Льюиса для соединения с молекулярной формулой CH 4 O.
Просматривая свои записи, ученица заметила, что она нарисовала в своей тетради следующую структуру для уксусной кислоты:
Почему эта структура невозможна? Нарисуйте приемлемую структуру Льюиса для уксусной кислоты.
 Укажите формальные заряды всех неводородных атомов как в правильных, так и в неправильных структурах.
Укажите формальные заряды всех неводородных атомов как в правильных, так и в неправильных структурах.Студент предложил следующую структуру Льюиса, показанную для ацетальдегида.
Почему эта структура невозможна? Нарисуйте приемлемую структуру Льюиса для ацетальдегида. Укажите формальные заряды всех неводородных атомов как в правильных, так и в неправильных структурах.
Нарисуйте наиболее вероятную структуру HCN на основе формальных зарядов, показав формальный заряд каждого атома в вашей структуре. Имеет ли это соединение какие-либо вероятные резонансные структуры? Если да, нарисуйте один.
Нарисуйте наиболее правдоподобную структуру Льюиса для NO 3 − . Есть ли у этого иона другие резонансные структуры? Нарисуйте хотя бы еще одну структуру Льюиса для нитрат-иона, которая неправдоподобна на основании формальных зарядов.
Для BCl 3 можно нарисовать не менее двух структур Льюиса.
 Используя аргументы, основанные на формальных зарядах, объясните, почему наиболее вероятной структурой является структура с тремя одинарными связями B–Cl.
Используя аргументы, основанные на формальных зарядах, объясните, почему наиболее вероятной структурой является структура с тремя одинарными связями B–Cl.Используя аргументы, основанные на формальных зарядах, объясните, почему наиболее вероятная структура Льюиса для SO 4 2− имеет две двойные связи сера-кислород.
Для N 9 можно нарисовать как минимум две различные структуры Льюиса.0040 3 − . Используйте аргументы, основанные на формальных обвинениях, чтобы объяснить, почему наиболее вероятная структура содержит двойную связь азот-азот.
Является ли H–O–N=O подходящей структурой для соединения HNO 2 ? Обоснуйте свой ответ, используя структуры электронных точек Льюиса.
Является ли H–O=C–H подходящей структурой для соединения с формулой CH 2 O? Используйте структуры электронных точек Льюиса, чтобы обосновать свой ответ.

Объясните, почему следующая структура Льюиса для SO 3 2− является или не является разумной.
Нарисуйте все резонансные структуры для каждого иона.
- ХСО 4 −
- ХСО 3 −
Ответы
- [Ar]4 с 2 3 д 10 4 р 4 Селен
может разместить еще два электрона, давая ион Se 2−.
- [Ar]4 s 2 3 d 10 4 p 6
Криптон имеет электронную конфигурацию с закрытой оболочкой, поэтому он не может вместить дополнительные электроны.
- 1 с 2 2 с 1
Литий может разместить один дополнительный электрон в своих 2 s орбиталь, что дает ион Li — .

- [Кр]5 с 2
Стронций имеет заполненную подоболочку 5 s , и дополнительные электроны должны быть помещены на орбиталь с более высокой энергией. Таким образом, стронций не имеет тенденции принимать дополнительный электрон.
- 1 с 1
Водород может разместить один дополнительный электрон на своей орбитали 1 с , что дает H − ион.
- [Ar]4 с 2 3 д 10 4 р 4 Селен
Be 2 + , F − , B 3 + , Cs +
- 11
- 8
- 8
- 8
- 14
- 8
- 32
- 8
К – восстановитель; S — окислитель.
 Конечная стехиометрия K 2 S.
Конечная стехиометрия K 2 S.Sr – восстановитель; Br – окислитель. Конечная стехиометрия SrBr 2 .
Al – восстановитель; О является окислителем. Конечная стехиометрия Al 2 О 3 .
Mg – восстановитель; Cl — окислитель. Конечная стехиометрия MgCl 2 .
Единственная структура, которая дает кислороду и углероду по октету электронов, это следующая структура:
Предложенная студентом структура имеет два недостатка: атом водорода с двойной связью имеет четыре валентных электрона (H может разместить только два электрона), а углерод, связанный с кислородом, имеет только шесть валентных электронов (у него должен быть октет).
 Приемлемая структура Льюиса
Приемлемая структура ЛьюисаФормальные сборы за правильные и неправильные конструкции следующие:
Наиболее вероятная структура Льюиса для NO 3 − :
Существуют три эквивалентные резонансные структуры для нитрата (показана только одна), в которых азот связан двойной связью с одним из трех атомов кислорода. В каждой резонансной структуре формальный заряд N равен +1; для каждого одинарно связанного О это -1; а для кислорода с двойной связью — 0,9.0044
Ниже приведен пример структуры Льюиса, которая не правдоподобна:
Эта структура азота имеет шесть связей (азот может образовывать только четыре связи) и формальный заряд –1.
С четырьмя одинарными связями S–O каждый кислород в SO 4 2− имеет формальный заряд -1, а центральная сера имеет формальный заряд +2. При наличии двух двойных связей S=O только два атома кислорода имеют формальный заряд –1, а сера имеет формальный заряд, равный нулю.
 Структуры Льюиса, которые минимизируют формальные заряды, как правило, имеют самую низкую энергию, что делает структуру Льюиса с двумя двойными связями S=O наиболее вероятной.
Структуры Льюиса, которые минимизируют формальные заряды, как правило, имеют самую низкую энергию, что делает структуру Льюиса с двумя двойными связями S=O наиболее вероятной.Да. Это разумная структура Льюиса, поскольку формальный заряд всех атомов равен нулю, а каждый атом (кроме H) имеет октет электронов.
Авторы
- Анонимно
Изменено Джошуа Халперном
Эта страница под названием 8.5: Lewis Structures распространяется под лицензией CC BY-NC-SA 3.0 и была создана, изменена и/или курирована Anonymous.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Аноним
- Встроить Hypothes.
 is?
is? - да
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- да на странице
- Теги
- источник[1]-хим-17559
- источник[2]-chem-17559
Гибридизация этана, молекулярная геометрия и форма
Структура Льюиса
- Автор: Priyanka
26 января
Этан — органическое соединение с химической формулой C2H6. Это бесцветная молекула без запаха, существующая в виде газа при стандартной комнатной температуре. Это соединение является одним из простейших существующих углеводородов, имеющих одинарную связь между атомами углерода. Этан имеет довольно много применений в различных отраслях промышленности и имеет одну из самых простых углеводородных структур. Его также называют метилметаном, биметилом и диметилом. Как правило, имя Этан используется чаще, чем другие имена.
Это соединение является одним из простейших существующих углеводородов, имеющих одинарную связь между атомами углерода. Этан имеет довольно много применений в различных отраслях промышленности и имеет одну из самых простых углеводородных структур. Его также называют метилметаном, биметилом и диметилом. Как правило, имя Этан используется чаще, чем другие имена.
Чтобы понять его физические и химические свойства, необходимо знать его структуру по Льюису, образование связей, форму и многое другое. Продолжайте читать этот пост в блоге, чтобы найти все подробности о структуре точек Льюиса Этана, ее молекулярной геометрии и гибридизации.
| Name of molecule | Ethane ( C2H6) |
| No of Valence Electrons in the molecule | 14 |
| Hybridization of C2H6 | sp3 hybridization |
| Bond Angles | 109. 5 degrees 5 degrees |
| Molecular Geometry of C2H6 | Trigonal Pyramidal |
Содержимое
C2H6 Валентные электроныЭтан содержит два атома углерода и шесть атомов водорода. Чтобы узнать структуру Льюиса молекулы, жизненно важно знать общее количество валентных электронов этана.
У углерода четыре валентных электрона, а у каждого атома водорода один валентный электрон.
Общее количество валентных электронов в этане – валентные электроны углерода + валентные электроны водорода
= 2* 4 + 6*1 (так как есть два атома углерода и шесть атомов водорода, мы будем учитывать их все, чтобы получить общее число валентных электронов)
= 14
Следовательно, в этане 14 валентных электронов.
Структура Льюиса C2H6 Структура Льюиса помогает понять расположение атомов в структуре вместе с ее валентными электронами. В этой структуре показано, что отдельные атомы со всеми их валентными электронами знают формирование связи, молекулярную геометрию и форму молекулы.
В этой структуре показано, что отдельные атомы со всеми их валентными электронами знают формирование связи, молекулярную геометрию и форму молекулы.
Теперь, когда у нас есть общее количество валентных электронов, мы можем начать рисовать точечную структуру Льюиса Этана.
Оба атома углерода будут размещены в центре, так как атомы водорода никогда не могут быть в центре. Итак, поместите оба атома углерода вместе с их четырьмя валентными электронами вот так.
Теперь поместите все атомы водорода вокруг атомов углерода вместе с их валентными электронами.
После размещения всех атомов вы можете заметить, что каждому атому водорода нужен один электрон, чтобы достичь стабильной структуры . Точно так же углероду нужно еще четыре электрона, чтобы завершить свой октет.
Каждый атом углерода образует связи с тремя атомами водорода и разделяет электроны. Благодаря этому каждый атом водорода теперь имеет два электрона на внешней оболочке, что делает его стабильным.
Оба атома углерода также образуют одинарные связи друг с другом и делят свои электроны, завершая свой октет. Здесь, в этане, углерод образует связи с атомами водорода, что помогает этим атомам достичь стабильной структуры и в то же время формировать связь с другим атомом каброна, чтобы завершить их октет.
Все валентные электроны используются для создания стабильной структуры молекулы, поэтому в ней нет неподеленных или несвязывающих пар электронов. Расположение электронов и атомов в этой молекуле симметрично.
Это точечная структура Льюиса C2H6, использующая все четырнадцать валентных электронов.
Гибридизация C2H6 Во время образования связи орбитали атомов гибридизуются, чтобы разделить электроны с другим атомом. Здесь каждый атом углерода образует три сигма-связи с атомами водорода и одну сигма-связь с атомом углерода. В результате четыре орбитали, то есть орбитали 1s, px, py и pz, гибридизуются в каждом атоме углерода. Среди этих гибридных орбиталей одна гибридная орбиталь будет перекрываться с 1s-орбиталью атома водорода, которая образует сигма-связь между атомами водорода и углерода. Образование таких гибридизованных орбиталей приводит к sp3-гибридизации.
Образование таких гибридизованных орбиталей приводит к sp3-гибридизации.
Таким образом, C2H6 представляет собой sp3-гибридизацию.
C2H6 Молекулярная геометрияЕсли вы посмотрите на расположение атомов в молекуле, вы заметите, что все атомы водорода расположены вокруг атомов углерода в тетраэдрической геометрии. Следовательно, C2h6 имеет тетраэдрическую молекулярную геометрию.
Валентные углы C2H6Молекулы с тетраэдрической молекулярной геометрией имеют валентные углы 109,5 градусов, на которые обычно влияют неподеленные пары электронов. Неделеные пары электронов могут изменять валентные углы за счет своих сил отталкивания, но здесь в C2H6, поскольку в молекуле нет неподеленных пар, валентные углы в C2H6 равны 109.5 градусов.
Форма C2H6 Как упоминалось выше, молекула имеет тетраэдрическую геометрию без каких-либо неподеленных пар. Однако электронных облаков , находящихся на обоих атомах углерода, будут отталкиваться друг от друга. Эти силы приводят к образованию треугольной пирамидальной формы этой молекулы.
Эти силы приводят к образованию треугольной пирамидальной формы этой молекулы.
Таким образом, C2H6 имеет форму тригональной пирамиды.
Заключительные замечания
Этан по своей структуре является одним из простейших углеводородов. Он имеет только два атома углерода и симметричное распределение молекул с неподеленными парами. Можно легко понять точечную структуру Льюиса этой молекулы. Этан широко используется в нефтехимической промышленности и для производства этилена. Он также используется при приготовлении других химических веществ, таких как клеи, краски и т. д.
Я надеюсь, что эта статья поможет вам с легкостью понять структуру Льюиса C2H6.
Дайте нам знать, структуру Льюиса какой другой молекулы вы хотели бы узнать в комментариях ниже.
Как рассчитать формальный заряд
Как рассчитать формальный заряд
Чтобы вычислить формальный заряд атома, мы начнем с:
- оцениваем число валентных электронов атом (например, 3 для бора, 4 для углерода, 5 для азота и т.
 д.). (примечание: это также эквивалентно эффективному заряду ядра Z eff , числу протонов, которые «видит» электрон на валентной орбитали из-за экранирования электронами внутренних оболочек.)
д.). (примечание: это также эквивалентно эффективному заряду ядра Z eff , числу протонов, которые «видит» электрон на валентной орбитали из-за экранирования электронами внутренних оболочек.) - считая число несвязанные валентные электроны (NBE) на атоме. Каждая неподеленная пара считается как 2 , а каждый неспаренный электрон считается как 1.
- при подсчете количества связей (B) с атомом или, альтернативно, при подсчете количества связывающих электронов и , разделив это на 2 .
Формальный сбор FC затем рассчитывается путем вычитания NBE и B из VE .
FC = VE – (NBE + B)
что эквивалентно
FC = VE – NBE – B
ты. Однако, для краткости, во многих случаях Одиночные пары и Связи C-H являются явно не вытянутыми .
Таким образом, часть трюка для вас будет состоять в том, чтобы рассчитать формальную плату в ситуациях, когда вы должны учитывать неявных одиночных пар и связей C-H.
В статье ниже мы рассмотрим многие из этих ситуаций. Мы также предупредим вас о ситуациях, когда рассчитанный формальный заряд атома не обязательно является хорошим ключом к его реакционной способности , что чрезвычайно важно в будущем.
СОДЕРЖАНИЕ
- Формальный заряд
- Простые примеры для элементов первого ряда
- Формальные расчеты заряд Стрелки
- Галогены
- Вывод
- Примечания
- Проверь себя!
- (Дополнительно) Ссылки и дополнительная литература
1. Официальное обвинение
Формальный заряд — это бухгалтерский формализм для присвоения заряда конкретному атому.
Для получения формального заряда атома начнем с подсчета числа валентных электронов [Примечание 1] для нейтрального атома , а затем вычтем из него число электронов, которыми он « владеет » ( , т. е. электроны в неподеленных парах или по отдельности занятые орбитали ) и половина электронов, которые он разделяет ( половина числа связывающих электронов, что эквивалентно числу связей )
е. электроны в неподеленных парах или по отдельности занятые орбитали ) и половина электронов, которые он разделяет ( половина числа связывающих электронов, что эквивалентно числу связей )
Простейший способ записать формулу формального заряда ( FC) : NBE – B
где
- VE соответствует числу электронов вокруг нейтрального атома (3 для бора, 4 для углерода, 5 для азота, 6 для кислорода, 7 для фтора)
- 0 NBE соответствует количеству несвязанных электронов вокруг атома (2 для неподеленной пары, 1 для одной занятой орбитали, 0 для пустой орбитали) вокруг атома (эквивалентно половине числа связывающих электронов)
Это называется « формальный » заряд, поскольку предполагается, что все связывающие электроны являются общими поровну . Он не учитывает различия в электроотрицательности (т. е. диполи).
е. диполи).
По этой причине формальный заряд не всегда является хорошим показателем того, где на самом деле находятся электроны и в молекуле, и может быть ненадежным показателем реактивности. Мы еще поговорим об этом ниже.
2. Простые примеры для элементов первого ряда
Когда для вас вытянуты все неподеленные пары, вычислить формальную плату довольно просто.
Давайте рассмотрим первый пример викторины ниже.
- В ион гидроксония (H 3 O) центральный атом кислорода , который имеет 6 валентных электронов в нейтральном атоме
- Центральный атом имеет 2 неспаренных электронов и 3 связей
- 2 – 3 = +1 ] дает нам H 3 O +
Посмотрите, можете ли вы заполнить остальные для примеров ниже.
Если все прошло хорошо, вы можете попробовать заполнить формальные расходы для всех примеров в этой таблице.
Потребуется некоторое время, чтобы привыкнуть к формальному заряду, но через некоторое время предполагается , что вы понимаете, как вычислять формальный заряд, и что вы можете распознавать структуры, в которых атомы будут иметь формальный заряд.
Давайте рассмотрим несколько более сложных случаев.
3. Формальные расчеты расходов, когда вам не известны все подробности
Когда мы рисуем фигурку человека и не рисуем его пальцы, это не значит, что мы рисуем кого-то, у кого был плохой день работы с настольной пилой . Мы просто предполагаем , что вы могли бы вставить пальцы, если бы вам это действительно нужно, но вы пропускаете это просто для экономии времени.
Чертежи химических линий похожи на фигурки из палочек. Они опускают много деталей, но все же предполагают, что вы знаете, что там есть определенные вещи.
- С углеродом мы часто опускаем рисование водорода .
 Вы по-прежнему должны знать, что они там есть, и добавлять столько водородов, сколько необходимо, чтобы получить полный октет (или секстет, если это карбокатион).
Вы по-прежнему должны знать, что они там есть, и добавлять столько водородов, сколько необходимо, чтобы получить полный октет (или секстет, если это карбокатион). - Если на углероде есть неподеленная пара или неспаренный электрон, он всегда рисуется в .
Одно примечание. Если мы нарисуем фигурку, и мы делаем нарисуем пальцы, и потратим время только на то, чтобы нарисовать только 3 , то мы можем с уверенностью предположить, что у человека действительно только 3 пальца . Таким образом, в последних двух примерах этого теста нам пришлось рисовать водороды, чтобы вы знали, что это карбокатион, иначе вам пришлось бы предположить, что у него есть полный октет!
Кислород и азот (и галогены) рассматриваются несколько иначе.
- Связи с водородом всегда втягиваются.
- Одиночные пары , которые часто опускаются.
- Азот и кислород всегда будут иметь полные октеты .
 Всегда. [Примечание 2 – ОК, два исключения ]
Всегда. [Примечание 2 – ОК, два исключения ]
Таким образом, даже если одинокие пары не нарисованы, предполагает, что их достаточно для создания полного октета . А когда связей этих атомов с водородом отсутствует , это означает именно то, что кажется: водорода на самом деле нет!
Попробуйте эти примеры:
Теперь посмотрите, сможете ли вы собрать эти примеры вместе!
(Обратите внимание, что некоторые из них не являются стабильными молекулами, а вместо этого представляют собой — это резонансные формы, с которыми вы столкнетесь в различные моменты курса!)
точно такая же формула формального заряда, приведенная выше, вместе с правилами для неявных неподеленных пар и водородов, чтобы выяснить формальный заряд атомов в некоторых довольно экзотических молекулах.
Вот несколько классических формальных задач начисления.
Обратите внимание: хотя структура может выглядеть странно, формальная формула оплаты остается прежней.
Формула формального начисления может быть применена даже к некоторым довольно экзотическим реакционноспособным промежуточным продуктам, с которыми мы познакомимся позже в этом семестре.
Не пугайтесь. Просто посчитайте электроны и связи, и это приведет вас к правильному ответу.
5. Формальные обвинения и изогнутые стрелки
Мы используем изогнутые стрелки, чтобы показать движение электронных пар в реакциях и в резонансных структурах. ( См. сообщение: Изогнутые стрелки для реакций )
Например, вот изогнутая стрелка, которая показывает реакцию гидроксид-иона HO(-) с протоном (H+).
Стрелка показывает перемещение двух электронов от кислорода с образованием новой связи O–H .
Изогнутые стрелки также полезны для отслеживания изменений в официальном обвинении. Обратите внимание, что официальное обвинение в начальный хвост изогнутой стрелки (кислород) становится на более положительным (от -1 до 0), а формальный заряд на конечном хвосте (H+) становится на более отрицательным (от +1 до 0) .
При добавлении кислоты к воде образуется ион гидроксония H 3 O + .
Вот викторина. Посмотрите, сможете ли вы нарисовать изогнутую стрелку, идущую от иона гидроксида к H 3 O+.
Если вам это удалось — поздравляем!
Но я готов поспорить, что по крайней мере небольшой процент из вас нарисовал стрелку, идущую к положительно заряженному кислороду .
Что в этом не так?
На кислороде нет пустой орбитали, которая могла бы принять неподеленную пару. Если вы будете следовать логике изогнутых стрелок, это приведет к новой связи O–O и 10 электронам на кислороде, что нарушит правило октета.
Подождите минутку, скажете вы. « Я думал, что кислород заряжен положительно? я f не реагирует на кислород, где он должен реагировать ?»
На водороды! В конце концов, H 3 O+ — это кислота Бренстеда. Верно?
Верно?
Это отличная иллюстрация того, почему он называется « формальный заряд », и почему формальный заряд не совпадает с электростатическим зарядом (он же «частичные заряды» или «электронная плотность»).
Формальное обвинение — это, в конечном счете, бухгалтерский формализм, немного похожий на присвоение «выигрыша» одному из 5 питчеров в бейсбольном матче. [Примечание 3] Он не принимает во внимание тот факт, что электроны в кислородно-водородной связи распределены неравномерно, с существенным диполем.
Итак, хотя мы рисуем «формальный» заряд кислорода, все частичные положительные заряды относятся к водороду. Несмотря на формальный положительный заряд , несет частично отрицательный электростатический заряд.
Вот почему такие основания, как HO(-), реагируют на H, а не на кислород.
Повторюсь:
- Положительные заряды на кислорода и азота не представляют собой пустую орбиталь.
 Предположим, что кислород и азот имеют полные октеты! [Примечание 2]
Предположим, что кислород и азот имеют полные октеты! [Примечание 2] - Напротив, положительные заряды углерода от до представляют собой пустые орбитали.
6. Галогены
Положительные формальные обвинения в отношении галогенов делятся на две основные категории.
Мы часто рисуем ионов галония Cl+ , Br+ и I+ как частицы с шестью валентными электронами и пустой орбиталью ( , но никогда не F+ — это хищный зверь )
Можно считать, что эти виды имеют пустую орбиталь , поскольку они большие и относительно поляризуемые . Они могут распределять положительный заряд по своему относительно большому объему.
Эти виды могут принимать неподеленную пару электронов от основания Льюиса, что приводит к полному октету.
Cl, Br и I также могут нести положительный формальный заряд в результате связи с двумя атомами.
В этих случаях важно понимать, что галоген имеет полный октет , а не пустую орбиталь. Поэтому они не будут напрямую принимать пару электронов от оснований Льюиса; часто бывает так, что атом , соседний с атомом галогена, принимает электроны.
Поэтому они не будут напрямую принимать пару электронов от оснований Льюиса; часто бывает так, что атом , соседний с атомом галогена, принимает электроны.
7. Заключение
Если вы дошли до конца и прошли все викторины, вы должны быть хорошо подготовлены ко всем примерам формального обвинения, которые вы увидите в остальной части курса.
- Формальный заряд можно рассчитать по формуле FC = VE – NBE – B
- На чертежах часто не показаны неподеленные пары и связи C-H. Будьте внимательны к этим ситуациям при расчете формальных сборов.
- Положительно заряженный углерод имеет пустую орбиталь, но предположим, что положительно заряженный азот и кислород имеют полные октеты.
- Пример иона гидроксония H 3 O+ показывает опасность использования формального заряда для понимания реакционной способности. Обратите особое внимание на различия в электроотрицательности между атомами и вытяните диполи, чтобы получить истинное представление об их реактивности.

Примечания
Связанные статьи
- Как использовать электроотрицательность для определения плотности электронов (и почему не доверять формальному заряду)
- Частичные зарядки. чтобы понять реактивность
- Может быть, они должны называть их «формальными победами»?
Примечание 1. Используя «валентные электроны», вы получите правильный ответ. Но если подумать, то это не совсем понятно. Откуда берутся положительные заряды? Из положительно заряженных протонов в ядре, конечно же!
Таким образом, «валентные электроны» в этом уравнении правильнее рассматривать как заменитель валентных протонов — что является другим способом сказать « эффективный ядерный заряд» ; заряд, ощущаемый каждым валентным электроном от ядра, не считая заполненных внутренних оболочек.
Примечание 2. Нитрены являются исключением. Другим исключением является случай, когда мы хотим нарисовать плохих резонансных форм.
Другим исключением является случай, когда мы хотим нарисовать плохих резонансных форм.
Примечание 3 . В бейсболе каждая игра заканчивается победой или поражением команды . Еще во времена Старого Хосса Рэдборна, когда полные игры были нормой, логичным продолжением этого было присуждение победы отдельному питчеру . В сегодняшнюю эпоху, когда есть несколько запасных питчеров, существуют правила для определения того, какой питчер получит победу. Вполне возможно, что питчер полностью разлетится на насыпи, и все же, благодаря случайному стечению обстоятельств, ему все равно будет засчитана победа. См. сообщение: Может быть, они должны называть их «формальными победами»?
Таким же образом кислород получает индивидуальный кредит +1 на ион гидроксония , H 3 O+, хотя фактический положительный электростатический заряд распределяется между атомами водорода.
Примечание 4. Это изображение из предыдущего воплощения этого поста демонстрирует некоторые соотношения для геометрии различных соединений элементов первого ряда.
Проверьте себя! (расширенный) Ссылки и дополнительная литература
1. Валентность, число окисления и формальный заряд: три взаимосвязанных, но принципиально разных понятия
Gerard Parkin
Journal of Chemical Education8 200 , 791
DOI : 10.1021/ed083p791
2. Структуры Льюиса, формальный заряд и степени окисления: более удобный подход
Джон Э. Пакер и Шейла Д. Вудгейт
Журнал химического образования 1991 68 (6), 456
DOI : 10.1021/ED068P456
4444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444449004. 3 164 результатов использует простую структуру и модели связи для учета каждого из следующего: A. длина связи между двумя атомами углерода короче в C2h5, чем в c2h6. B. Длина связи в SO3 одинакова и короче, чем одинарная связь серы и кислорода. С. Что из следующего происходит при образовании ионной связи? А. Один атом оттягивает электрон от другого атома. Б. Два атома достигают одинаковой электроотрицательности. C. Один атом становится более электроотрицательным, чем другой атом. D. Два атома имеют общий электрон. — Какой Присутствие 11-цис-ретиналя C20h38O в клетках глаза важно для зрения. Используйте энергию связи, чтобы ответить на вопрос. H–H = 432 H–O = 467 O–O = 146 O=O = 495 ч3 (H–H) соединяется с O2 (O=O) с образованием перекиси водорода (h3O2), связанной как таковая: H–O–O -ЧАС. Какой вариант показывает разницу в общей энергии связи между Расположите связи углерод-углерод в порядке уменьшения длины связи. Расположите углерод-углеродные связи от наибольшей длины связи к наименьшей. Чтобы ранжировать облигации как эквивалентные, наложите их друг на друга. Два инвестора выпускают по одной облигации с одинаковой номинальной стоимостью, датой погашения и доходностью. После того, как обе облигации достигли срока погашения, обнаруживается, что один из держателей облигаций получил большую общую прибыль от своих инвестиций. Если бы все ожидаемые платежи были Это верные и ложные вопросы, и я хочу убедиться, что правильно на них ответил. 1. Молекула воды удерживается вместе двумя одинарными полярными ковалентными связями. Неверно 2. Поскольку кислород имеет большую электроотрицательность, чем водород, молекулы воды полярны с Верно, неверно или иногда верно 1) Связь, в которой один атом вносит вклад в оба связывающих электрона, называется многоатомной ковалентной связью. Какова стандартная теплота реакции (H0) сгорания этана C2H6(g) с образованием углекислого газа и воды? 2C2H6(г) + 7O2(г) → 4CO2(г) + 6h3O(ж) Стандартные теплоты образования (∆Hf⁰): C2H6 = –84,68 кДж O2(г) = 0,00 кДж CO2(г) = –393,5 Антрацен представляет собой желтое кристаллическое твердое вещество, содержащееся в каменноугольной смоле. Завершите эту структуру для антрацена, C14h20, добавив связи и атомы водорода по мере необходимости. Какой тип гибридных орбиталей используется углеродом в антрацене? >>sp3 Сколько σ-связей и π Выберите наиболее правильное утверждение из приведенных ниже, которое объясняет, почему все три связи в NO31- имеют одинаковую длину, а длина двойной связи отличается от одинарной связи между N и атомами кислорода. Это верные и ложные вопросы, и я хочу убедиться, что правильно на них ответил. 1. Молекула воды удерживается вместе двумя одинарными полярными ковалентными связями. Неверно 2. Поскольку кислород имеет большую электроотрицательность, чем водород, молекулы воды полярны с Это верные и ложные вопросы, и я хочу убедиться, что правильно на них ответил. 1. Молекула воды удерживается вместе двумя одинарными полярными ковалентными связями. Неверно 2. Поскольку кислород имеет большую электроотрицательность, чем водород, молекулы воды полярны с Метан (Ch5) — это газ, который содержится в небольших количествах в атмосфере Земли. 1. Какой тип связи удерживает атомы вместе в одной молекуле воды? а. Водородные связи б. Неполярные ковалентные связи c. Полярные ковалентные связи *** d. Ионные связи 2. Где встречаются ковалентные связи? а. Как между, так и внутри органических и неорганических Используйте информацию о реакции и связи, чтобы ответить на вопрос. C2H6 → C2h5 + h3 Энергии связи реагентов: H–C = 413 кДж/моль, одинарная связь C–C = 347 кДж/моль Энергии связи продукта: H–C = 413 кДж/моль, двойная связь C=C = 614 кДж/моль моль, H–H = 432 кДж/моль Исходя из Я совсем не понимаю полярные и неполярные молекулы. Вещество в твердом состоянии при комнатной температуре. Он не может проводить электричество в твердом состоянии, но может проводить электричество в жидком состоянии. Это соединение плавится при 755 градусах Цельсия. Вы ожидаете, что это соединение будет иметь ионную связь, металлическую связь или ковалентную связь Металл x с относительной атомной массой 56 образует оксид с формулой X2O3. Почему два атома образуют ковалентную связь вместо ионной связи? Оба атома в связи имеют одинаковую электроотрицательность; таким образом, ни один из атомов не желает передавать свои электроны. Вместо этого оба атома имеют общие электроны, чтобы удовлетворить правилу октетов. Оба атома Покажите, пожалуйста, как работать! Этан C2H6(г) можно получить реакцией газообразного водорода с ацетиленом C2h3(г). стандартные энтальпии образования этана и ацетилена равны -84,68 и +226,73 кДж моль-1 соответственно. Чем отличается температура кипения этана (Ch4Ch4) от точки кипения этанола (Ch4Ch3OH)? 1. Температура кипения этана выше, потому что у него более сильные лондоновские дисперсионные силы. 2. Температура кипения этана выше, потому что у него более сильный диполь-диполь Вопрос заключается в том, чтобы рассчитать общее изменение энергии при сгорании этана (C2H6). Вот что я сделал: Сбалансированное уравнение: C2H6 + 6 O2 —> 2 CO2 + 3 h3O (6) 411 + 346 + (6) 494 —> (2) 799 + (3) 459 2466 + 346 + 2964 —> 1598 + 1377 Формулы для этана, этена и этина: C2H6, C2h5 и C2h3 соответственно. Используйте свои знания о валентных электронах и о том, как они влияют на связи, чтобы выяснить, как углерод (группа 14) и кислород (группа 16) будут связаны друг с другом. В двуокиси углерода (CO2) как устроено соединение? (Используйте «–» для обозначения простой связи Указания: Используйте принципы атомной структуры и/или химической связи, чтобы объяснить каждое из следующего. В каждой части ваш ответ должен включать ссылки на оба вещества. Проблема: Энергия связи углерод-углерод в c2h5 больше, чем в Примерно какую разницу в электроотрицательности вы ожидаете для полярной ковалентной связи? Если молярная теплота сгорания этана (C2H6) составляет -1560 кДж/моль. Элементы группы 1 имеют среднюю электроотрицательность 0,84 (не включая водород). Элементы группы 17 имеют среднюю электроотрицательность 2,9.9. Эти две группы часто образуют связи. Учитывая эту информацию, какую связь они, скорее всего, сформируют (ионную или Ученый изучает энергию связи различных соединений, содержащих азот (N). Ученый отмечает, что связи NN в одной группе соединений имеют энергию связи 209кДж/моль, тогда как связи N-N в другой группе соединений имеют энергию связи Ниже приведены три разные пары облигаций и их недавняя доходность. Учитывая следующую информацию об электроотрицательности, какое бинарное соединение будет образовывать ковелантные связи с наибольшей полярностью? Элемент Электроотрицательность H 2.1 Li 1.0 S 2.5 Al 1.5 F 4.0 Cl 3.0 A. HCl B. LiF C. h3S D. Alh4 Привет! Скажите, правильно ли я выбрала варианты домашнего задания по химии? Мои ответы внизу. 1. Для какого типа связи важно электростатическое взаимодействие? A. ионная связь B. тройная ковалентная связь C. одинарная ковалентная связь D. 5,00 г смеси метана (Ch5) и этана (C2H6) сжигают в кислороде с образованием углекислого газа и воды. Если образуется 14,09 г СО2, сколько граммов метана было в исходной 5,00 г смеси? Напишите сбалансированное уравнение сгорания газообразного этана (C2H6) — компонента природного газа, в котором он соединяется с газообразным кислородом с образованием газообразного диоксида углерода и газообразной воды. 1. У компании Garraty два выпуска облигаций в обращении. Годовая процентная ставка по обеим облигациям составляет 100 долларов плюс 1000 долларов при погашении. Облигация L имеет срок погашения 15 лет, а облигация S — 1 год. А). Какова будет стоимость каждой из этих облигаций, когда текущая ставка Пожалуйста, помогите мне решить эту задачу. Ацетилен C2h3 можно превратить в этан C2H6 в процессе, известном как гидрирование. Реакция C2h3(г)+2h3(г)⇌C2H6(г). Учитывая следующие данные при стандартных условиях (все давления равны 1 атм и Кремний — это элемент, который находится непосредственно под углеродом в периодической таблице. Ацетилен, C2h3, может быть преобразован в этан, C2H6, с помощью процесса, известного как гидрирование. Реакция: C2h3(g) + 2h3(g) === C2H6(g) Учитывая следующее, каково Kp для реакции? C2h3(г): 209,2 ΔG˚f (кДж/моль) h3(г): 0 ΔG˚f (кДж/моль) C2H6(г): Химическая потенциальная энергия связи A больше, чем химическая потенциальная энергия связи B. Какое утверждение лучше всего объясняет это наблюдение? (1 балл) a-Атомы в связи A больше, чем атомы в связи B. Реакции органического гидрирования, в которых сочетаются h3 и «ненасыщенное» органическое соединение, используются в пищевой, топливной и полимерной промышленности. В простейшем случае этен (C2h5) и h3 образуют этан (C2H6). Если на моль реагирующего C2h5 выделяется 124 кДж, то Реакции органического гидрирования, в которых сочетаются h3 и «ненасыщенное» органическое соединение, используются в пищевой, топливной и полимерной промышленности. В простейшем случае этен (C2h5) и h3 образуют этан (C2H6). Если на моль реагирующего C2h5 выделяется 144 кДж, то 1. «Учитывая, что энтальпия связи углерод-кислород в монооксиде углерода и диоксиде углерода составляет 1073 кДж/моль и 743 кДж/моль соответственно, а энтальпия связи в молекуле кислорода равна 496 кДж/моль, рассчитать изменение энтальпии сгорания 1 Газообразный этан будет реагировать с газообразным кислородом с образованием газообразного диоксида углерода и газообразной воды. Предположим, что 17 г этана смешано со 107 г кислорода. Нарисуйте структуру Льюиса для NO2-, включая любые действительные резонансные структуры. какие из следующих утверждений верны? а. ион нитрита содержит 2 связи NO, что эквивалентно 1 1/2 связи. б. нитрит-ион содержит 2 двойные связи N=O c. Для образования молекулы кислорода (O little 2) два атома кислорода имеют две общие пары электронов. Какие связи показаны ниже на электронной точечной диаграмме O little 2? Выберите все подходящие. Диаграмма. . . . О = О . . . . A. Ковалентная связь B. Ионная связь C. Одинарная кто-нибудь может дать ответы на Молекулы и структуры Быстрая проверка 1. Эй, ребята, я борюсь, дана реакция 2CO+O2->2CO2. Там говорится, что текущий монооксид и кислород объединяются, чтобы произвести углекислый газ. Суммарная энергия связи продуктов составляет 1472 кДж. Энергия связи каждой углерод-кислородной связи в углекислом газе равна____. Какой вариант описывает то, что вызывает образование ионных связей? (1 балл) большие различия в электроотрицательности малые различия в электроотрицательности реакции замещения реакции горения 1. Какова структура N4O, где 3 связи азота имеют разную длину связи, а связь N=O является двойной связью. я просто не понимаю Электроотрицательность — это понятие, которое полезно наряду с другими понятиями для предсказания полярности связи, определения количества электронов, вовлеченных в связь, формулирования правила октета, определяющего заряд многоатомного иона шесть связей c-h. электроотрицательность
шесть связей c-h. электроотрицательность AP Chem
химия
Химическая помощь!
 Структура ретиналя включает альдегидную группу, циклогексеновое кольцо и длинную алифатическую боковую цепь, в которой между атомами углерода
Структура ретиналя включает альдегидную группу, циклогексеновое кольцо и длинную алифатическую боковую цепь, в которой между атомами углерода наука//химия
Химия
 1,2,3
1,2,3 Экономика
Биология
Химия (Проверить)
 (Верно) 2) Углерод образует четыре одинарные ковалентные связи с другими атомами. (Fales) Правда, Ложь или Иногда Правда 1) Связь, в которой один
(Верно) 2) Углерод образует четыре одинарные ковалентные связи с другими атомами. (Fales) Правда, Ложь или Иногда Правда 1) Связь, в которой один химия
Химия
Химия
 а. длины связей для двойных связей
а. длины связей для двойных связей Биология
Биология
химия
 Какой тип связи имеет метан и почему один атом углерода связан с четырьмя атомами водорода? В трех-пяти предложениях объясните свой ответ с точки зрения валентности
Какой тип связи имеет метан и почему один атом углерода связан с четырьмя атомами водорода? В трех-пяти предложениях объясните свой ответ с точки зрения валентности химия — проверьте
Химия
Химия
 Я действительно не понимаю, как узнать, является ли что-то полярным или нет. Или о полярности связи по сравнению с молекулярной полярностью (чистый дипольный момент). Кроме того, если у него есть одинокая пара, когда вы рисуете структуру Льюиса
Я действительно не понимаю, как узнать, является ли что-то полярным или нет. Или о полярности связи по сравнению с молекулярной полярностью (чистый дипольный момент). Кроме того, если у него есть одинокая пара, когда вы рисуете структуру Льюиса наука
фонтан знаний международная академия
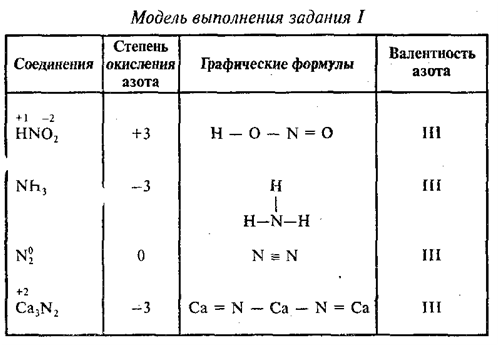 Сколько граммов металлов соединится с 10 г кислорода Этан полностью сгорает в кислороде в соответствии с приведенными ниже уравнениями C2H6+7¡2O2 ~2CO +3h3O каково количество в молях
Сколько граммов металлов соединится с 10 г кислорода Этан полностью сгорает в кислороде в соответствии с приведенными ниже уравнениями C2H6+7¡2O2 ~2CO +3h3O каково количество в молях Химия
Химия
 какова энтальпия реакции
какова энтальпия реакции AP Химия в помощь!!!!!
Биология 12
химия
 Присвойте этим химическим веществам 1, 2, 3 (самое высокое) место с точки зрения силы IMF и объясните структуру трех молекул. Я оцениваю эти три по длине связи, поэтому я получил C2h3,
Присвойте этим химическим веществам 1, 2, 3 (самое высокое) место с точки зрения силы IMF и объясните структуру трех молекул. Я оцениваю эти три по длине связи, поэтому я получил C2h3, Наука
Chem
химия
Химия
 Теплота, выделяемая при сгорании 111 г этана, составляет a.bc МДж.
Теплота, выделяемая при сгорании 111 г этана, составляет a.bc МДж. химия
Химия
финансы
 Выберите одну пару и создайте тему на форуме, где 1) используя учебник и другие справочные материалы, вы объясните основные факторы, влияющие на получение результатов
Выберите одну пару и создайте тему на форуме, где 1) используя учебник и другие справочные материалы, вы объясните основные факторы, влияющие на получение результатов химия
Химия
 двойная ковалентная связь
двойная ковалентная связь Химия
Химия
химия: проверьте ответы.
 Сколько валентных электронов имеет атом углерода? А) 1 Б) 2 В) 3 Г) 4
Сколько валентных электронов имеет атом углерода? А) 1 Б) 2 В) 3 Г) 4 Math
Химия
Химия
 Кремний может образовывать связи, подобные углероду. Для разрыва одинарных кремний-кремниевых связей требуется 222 кДж/моль энергии. Основываясь на утверждениях, сколько энергии потребуется, чтобы сломать
Кремний может образовывать связи, подобные углероду. Для разрыва одинарных кремний-кремниевых связей требуется 222 кДж/моль энергии. Основываясь на утверждениях, сколько энергии потребуется, чтобы сломать Химия
Химия
 b — Атомы в связи А имеют меньше связей
b — Атомы в связи А имеют меньше связей Химия
хим 211
Химия: Пожалуйста, проверьте ответы
 Какое из следующих соединений является ненасыщенным углеводородом? метан *пропин нонан метил 2. Общее название углеводородов, содержащих хотя бы одну тройную ковалентную связь, ____. алкены алкилы алканы *алкины 3. Как называется самый маленький
Какое из следующих соединений является ненасыщенным углеводородом? метан *пропин нонан метил 2. Общее название углеводородов, содержащих хотя бы одну тройную ковалентную связь, ____. алкены алкилы алканы *алкины 3. Как называется самый маленький Химия
Химия 111
 Вычислите наименьшую массу этана, которая может остаться в результате химической реакции. Будьте уверены, что ваш
Вычислите наименьшую массу этана, которая может остаться в результате химической реакции. Будьте уверены, что ваш chem
Наука!
Физические науки
 Какие типы связей показаны на этой диаграмме? На диаграмме показано несколько кругов, каждый из которых отмечен знаком «+», окруженных несколькими меньшими синими шариками. Стрелки, похоже, указывают на то, что
Какие типы связей показаны на этой диаграмме? На диаграмме показано несколько кругов, каждый из которых отмечен знаком «+», окруженных несколькими меньшими синими шариками. Стрелки, похоже, указывают на то, что Химия
Химия
математика
 Используя таблицу, ответьте на вопрос: Связь Энергия связи H–H 432 Br–Br 193 I–I 149 H–Br 363 H–I 295 Бромоводород распадается на двухатомный водород и бром по следующей реакции: 2HBr → h3 + Br2 Иодоводород образуется из
Используя таблицу, ответьте на вопрос: Связь Энергия связи H–H 432 Br–Br 193 I–I 149 H–Br 363 H–I 295 Бромоводород распадается на двухатомный водород и бром по следующей реакции: 2HBr → h3 + Br2 Иодоводород образуется из Химия
химия
 Длина связи O-H в воде составляет 95,8 пм, а длина связи S-H в сероводороде составляет 135 пм. Почему связи S-H длиннее, чем связи O-H? Это потому, что масса серы больше массы кислорода? Пожалуйста, исправьте
Длина связи O-H в воде составляет 95,8 пм, а длина связи S-H в сероводороде составляет 135 пм. Почему связи S-H длиннее, чем связи O-H? Это потому, что масса серы больше массы кислорода? Пожалуйста, исправьте
- спросил 🙂
- 2 063 просмотра
ap физика помогите пожалуйста
В молекуле метана Ch5 каждый атом водорода находится в углу правильного тетраэдра с атомом углерода в центре. В координатах, для которых одна из связей C-H находится в направлении i + j + k, соседняя связь C-H находится в направлении i — j — k.
- спросил tyger2020
- 8 002 просмотра
Химия
Используйте данные из этой таблицы термодинамических свойств для расчета максимального количества работы, которое может быть получено при сгорании 1,00 моль этана, Ch4Ch4(g), при 25 °C и стандартных условиях. на графике указано, что этан (C2H6) равен -84,0. В
на графике указано, что этан (C2H6) равен -84,0. В
- спросил Алексис
- 5 101 просмотр
Химия
Что характерно для ионной связи и химической связи? Ответ ниже для характеристики ионных связей. Я не понимаю характеристик химической связи, поскольку ионная связь является химической связью. Возможно, вы сможете перефразировать свой вопрос. Для моего
- спросила Красотка в розовом
- 862 просмотра
химия
Используйте энергию связи, чтобы предсказать молярную энтальпию сгорания газообразного ацетилена. 2C2h3 + 5O2—> 4CO2 + 2h3O Я не понимаю, как сделать 2C2h3 по отношению к связям? сколько связей с-с будет, или это будут тройные связи?
- спросил Бен
- 1 788 просмотров
CHEMISTRY-HELP
Электроотрицательность элементов: H=2,1, O=3,5, F=4,0, S=2,5, Cl=3,0. Определите (вычислите) разность электроотрицательностей для следующих молекул и объясните, как они расположены в следующем порядке: h3, O2, HCl, HF, h3O и расположите их в ряду
Определите (вычислите) разность электроотрицательностей для следующих молекул и объясните, как они расположены в следующем порядке: h3, O2, HCl, HF, h3O и расположите их в ряду
- спросил Бран
- 1 818 просмотров
Наука
Изменение энергии реагента и продукта Быстрая проверка 1. Какое действие должно произойти, чтобы произошла реакция? (1 балл) Молекулы должны делиться при достаточно низкой энергии, чтобы разорвать связи. Молекулы должны сталкиваться при достаточно высокой энергии, чтобы разорвать связи. Молекулы должны
- спросил Мне очень нужна помощьpp
- 3 373 просмотра
chem
Используйте энергию связи для оценки изменения энтальпии для следующей реакции C2h3 + h3-> C2h5 i вычислил, что разорваны связи: 1 C тройная связь C 1 (812 кДж/моль) 2 C-H 2 (414 кДж/моль) 1 H-H 1(435 кДж/моль) Образующиеся связи 1 C=C 1(590 кДж/моль) 4 C-H 4(435 кДж/моль) Is this
- спросил tomi
- 2 499 просмотров
Финансы
Miller Corporation имеет премиальные облигации с полугодовыми платежами. По облигациям выплачивается 8-процентный купон, доходность до погашения составляет 6 процентов, а срок погашения составляет 13 лет. Компания Модильяни имеет дисконтную облигацию с полугодовыми платежами. По облигации выплачивается 6 процентов
По облигациям выплачивается 8-процентный купон, доходность до погашения составляет 6 процентов, а срок погашения составляет 13 лет. Компания Модильяни имеет дисконтную облигацию с полугодовыми платежами. По облигации выплачивается 6 процентов
- спросил Томми
- 342 просмотра
химия
используйте следующие данные для расчета средних значений энтальпии связей C-H и C-C. Ch5(г)-C(г) + 4H(г) стандартное изменение энтальпии +1648 кДж/моль C2H6(г)-2C(г) + 6H(г) стандартное изменение энтальпии +2820 кДж/моль
- спросил Блисс
- 882 просмотра
Химия
При полном сгорании образца углеводорода в присутствии избытка кислорода образуются равные молярные количества углекислого газа и воды. Что из следующего может быть молекулярной формулой соединения? а. С4h5 б. C2H6 в. C6H6 д. C8H8 е. C8h26 я
С4h5 б. C2H6 в. C6H6 д. C8H8 е. C8h26 я
- спросил Аноним
- 1 323 просмотра
бухгалтерия
У Ферги есть выбор между инвестированием в облигации штата Нью-Йорк под 5,8% и в облигации Surething под 9,2%. Предполагая, что обе облигации имеют одинаковые неналоговые характеристики и что Fergie имеет предельную налоговую ставку в размере 30 процентов, какая процентная ставка
- спросил Шерианна Джонсон
- 1 038 просмотров
Наука
Какая величина помогает определить абсолютный возраст горных пород и окаменелостей? (1 балл) A. Отношение углерода-12 к углероду-14 B. Отношение протонов к нейтронам в углероде-14 C. Разница между количества углерода-12 и углерода-14 D. разница
- спросил Зара
- 1 027 просмотров
биология
Все живые существа состоят из четырех категорий биомолекул, которые вы видите здесь. Эти молекулы также называют макромолекулами, потому что они очень большие. Функция биомолекулы определяется ее структурой. Некоторые строительные блоки, некоторые
Эти молекулы также называют макромолекулами, потому что они очень большие. Функция биомолекулы определяется ее структурой. Некоторые строительные блоки, некоторые
- спросила Элиза
- 3 296 просмотров
Финансы
Предположим, что сентябрьский фьючерсный контракт на казначейские облигации CBOT имеет котировку 89-09. Какова подразумеваемая годовая процентная ставка по этому фьючерсному контракту? Предположим, что этот контракт основан на 20-летней казначейской облигации с полугодовыми процентными выплатами.
- спросил Ма
- 2 466 просмотров
Химия
В правильной структуре Льюиса для SO3, показанной ниже, имеются две одинарные связи S-O и одна двойная связь S-O. Объясните, почему длины связей S-O одинаковы.
- спросил Аноним
- 379 просмотров
Химия
Смесь метана (Ч5) и этана (С2Н6) массой 13,43г полностью сгорает в кислороде. Если общая масса образовавшихся CO2 и h3O составляет 64,84 г, рассчитайте долю Ch5 в смеси. Ch5 + C2H6 стрелка CO2 + h3O 13,43 г 64,84 г Я бы сделал
Если общая масса образовавшихся CO2 и h3O составляет 64,84 г, рассчитайте долю Ch5 в смеси. Ch5 + C2H6 стрелка CO2 + h3O 13,43 г 64,84 г Я бы сделал
- спросила Эми~
- 2 318 просмотров
Химия
Рассчитайте энтальпию реакции C2h5 + h3 с получением C2H6. Энтальпии сгорания этилена, h3 и этана составляют -1410, -286, -15,60 кДж/моль соответственно
- спросил Шайка
- 2 347 просмотров
math
Г-н X вложил часть своих инвестиций в 10-процентные облигации A и часть в 15-процентные облигации B. Его процентный доход в течение первого года составляет 4000 рупий. Если он вложит на 20% больше в 10%-ную облигацию А и на 10% больше в 15%-ную облигацию В, его доход в течение второго года увеличится на 500 рупий.
- спросил луна
- 4 661 просмотров
Химия
Если 152 грамма этана (C2H6) вступают в реакцию с 231 граммом газообразного кислорода, какой будет избыток реагента? 2C2H6 + 7O2(г) → 4CO2(г) + 6h3O(г)
- спросил Рохит
- 2 569 просмотров
Химия
Образец природного газа содержит 85,2% метана, Ч5, и 14,8% этана, С2Н6, по массе. Какова плотность этой смеси при 18С и 748мм рт.ст. поэтому я знаю, что мне нужно использовать эту формулу d=(PM)/(RT), но я не знаю, как преобразовать проценты в г/моль
Какова плотность этой смеси при 18С и 748мм рт.ст. поэтому я знаю, что мне нужно использовать эту формулу d=(PM)/(RT), но я не знаю, как преобразовать проценты в г/моль
- спросил Генри
- 833 просмотра
Финансы
И Bond Sam, и Bond Dave имеют 9-процентные купоны, осуществляют полугодовые платежи и оцениваются по номинальной стоимости. Бонд Сэм имеет 3 года до погашения, в то время как Бонд Дейв имеет 20 лет до погашения. Если процентные ставки внезапно вырастут на 2 процента, процентное значение изменится на
.- спросил Том
- 788 просмотров
наука
Во время клеточного дыхания ковалентные связи молекулы разрушаются с образованием продуктов. Какая молекула расщеплена? АДФ, углекислый газ, вода, сахар*** Во время клеточного дыхания при образовании пировиноградной кислоты образуется четыре АТФ. Что
Что
- спросил Nunya
- 14 303 просмотра
Химия
2C2H6(г) + 7O2(г) → 4CO2(г) + 6h3O(г) В уравнении, если 14 л этана (C2H6) и 14 л кислорода (O2) объединились и сгорели до конца, что газ останется после реакции, и каков объем этого газа остается?
- спросил Жизель Меза
- 6 651 просмотров
Химия
Если молярная энтальпия сгорания этана равна -1,56 МДж/моль, сколько тепла выделяется при сгорании этана; а) 5,0 моль этана б) 45 г этана
- спросил Hate Chemistry 🙁
- 1 074 просмотра
Наука
Какого порядка длин связей C-H вы ожидаете в c2h6, c2h5, c2h3?
- спросил Сурой
- 679 просмотров
биология
Во время клеточного дыхания ковалентные связи молекулы разрушаются с образованием продуктов. Какая молекула расщепляется? (1 балл) сахар АДФ углекислый газ***** вода Во время клеточного дыхания образуется четыре АТФ, когда пировиноградная кислота составляет
Какая молекула расщепляется? (1 балл) сахар АДФ углекислый газ***** вода Во время клеточного дыхания образуется четыре АТФ, когда пировиноградная кислота составляет
- спросил ребенок из школьного автобуса
- 3 433 просмотра
CHEM
смесь 10 см3 метана и 10 см3 энтана вспыхивали с избытком кислорода. после охлаждения до комнатной температуры остаточный газ пропускали через водный раствор КОН. какой объем газа поглотила щелочь? Напишите уравнения для Ch5 + O2 и C2H6 + O2.
- спросил Pet
- 2 389 просмотров
Math
В отличие от облигаций, выпущенных компанией, по сберегательным облигациям серии EE не выплачиваются проценты, пока вы их держите. Вместо этого они накапливают проценты и увеличивают свою стоимость. Верно* Неверно Большинство публично торгуемых компаний имеют в обращении миллионы облигаций, поэтому одна облигация
- спросил Му
- 410 просмотров
Инженерная экономика
Компания General Electric выпустила 1000 долговых обязательств 3 года назад номинальной стоимостью 5000 долларов каждая и процентной ставкой по облигациям 8% в год с выплатой раз в полгода. Облигации имеют срок погашения 20 лет с даты их выпуска. Если процентная ставка в
Облигации имеют срок погашения 20 лет с даты их выпуска. Если процентная ставка в
- спросил Мария
- 582 просмотра
Финансы
Инвестор с 28-процентной налоговой ставкой пытается решить, какую из двух облигаций выбрать: одна — 5,5-процентная облигация Министерства финансов США, продающаяся по номиналу; другая — муниципальная облигация с купоном 4,25%, которая также продается по номиналу. Какой из этих двух
- спросил Брент
- 533 просмотра
Химия
Какое из утверждений правильно описывает цис-изомеры? Углеродная цепь входит и выходит из одинарной связи на противоположных сторонах молекулы. Углеродная цепь входит и выходит из одинарной связи на одной стороне молекулы. Углеродная цепь входит и
- спросил Рене
- 464 просмотра
Физические науки
Соляная кислота и гидроксид натрия реагируют с образованием воды и хлорида натрия в результате эндотермической реакции. Какое утверждение должно быть верным для реакции? Суммарная энергия связи воды и хлорида натрия больше суммарной энергии связи
Какое утверждение должно быть верным для реакции? Суммарная энергия связи воды и хлорида натрия больше суммарной энергии связи
- спросил Аноним
- 1 553 просмотра
Физические науки
Соляная кислота и гидроксид натрия реагируют с образованием воды и хлорида натрия в результате эндотермической реакции. Какое утверждение должно быть верным для реакции? A. Общая энергия связи воды и хлорида натрия больше, чем общая энергия связи
- спросил Аноним
- 380 просмотров
Наука
Металлические связи отвечают за многие свойства металлов, такие как проводимость. A. Создается притяжение между положительным зарядом и отрицательным зарядом. B. Два металла, соединенных вместе, будут более проводящими, чем металл, соединенный с
.
- спросила девушка связи
- 9 049 просмотров
биология
Углеводы и липиды имеют много углерод-водородных связей; следовательно, они оба запасают энергию в этих связях. легко растворяются в воде. растворить только в уксусе. существуют только в клетках растений.
- спросил ballamoney1
- 1 056 просмотров
химия
Энтальпия образования C2H5OH составляет -238,7 кДж/моль. Какую информацию это дает о связях в молекуле? A. Образование связи в C2H5OH из его элементов происходит только при низких температурах. Б. Образование связи в C2H5OH из его элементов не
- спросил Морган
- 2 952 просмотра
финансовый менеджмент
1. Dooley, Inc. имеет в обращении облигации на сумму 100 миллионов долларов США (номинальной стоимостью), по которым выплачивается годовая купонная ставка в размере 10,5 процентов. Номинальная стоимость каждой облигации составляет 1000 долларов. Срок погашения облигаций составляет 20 лет. Из-за повышенного риска Дули инвесторы теперь
Dooley, Inc. имеет в обращении облигации на сумму 100 миллионов долларов США (номинальной стоимостью), по которым выплачивается годовая купонная ставка в размере 10,5 процентов. Номинальная стоимость каждой облигации составляет 1000 долларов. Срок погашения облигаций составляет 20 лет. Из-за повышенного риска Дули инвесторы теперь
- спросил Аноним
- 1 068 просмотров
CHEM-Электронная плотность
Для каждой из следующих пар определите, какой элемент имеет тенденцию притягивать электронную плотность от другого в ковалентной связи, и введите четыре буквы, соответствующие этим вариантам (например, ACEG, BDFH и т. д.) A) O и B) C C) O и D) H E) Hg и F) C G) Si
- спросила Михаэла
- 1 245 просмотров
Наука
Чтобы образовать молекулу кислорода (O2), два атома кислорода разделяют две пары электронов. О какой связи свидетельствует это? Выберите все подходящие. Ионная связь Одинарная связь Двойная связь Ковалентная связь Тройная связь C и D?
О какой связи свидетельствует это? Выберите все подходящие. Ионная связь Одинарная связь Двойная связь Ковалентная связь Тройная связь C и D?
- спросил Аноним
- 2 516 просмотров
наука
Какие типы связей показаны на этой диаграмме металлические связи ионные связи водородные связи ковалентные связи
- спросил 1
- 364 просмотра
Химия
Энергия связи молекулы O2 равна 495. а) рассчитайте минимальную частоту и максимальную длину волны света, необходимые для разрыва этой связи. б) сколько фотонов этой длины волны потребуется, чтобы разорвать связи всех молекул кислорода в
- спросил Карен
- 1410 просмотров
Химия
Три газа (8,00 метана, Ch5, 18,0 этана, C2H6 и неизвестное количество пропана, C3H8) добавляли в один и тот же 10,0-литровый контейнер. При температуре 23,0 градуса Цельсия общее давление в баллоне составляет 3,90 атм. Рассчитайте парциальное давление каждого газа
При температуре 23,0 градуса Цельсия общее давление в баллоне составляет 3,90 атм. Рассчитайте парциальное давление каждого газа
- спросила Сара
- 1 146 просмотров
Химия
Энтальпия атомизации представляет собой изменение энтальпии при разрыве связей 1 моля газообразного соединения на составляющие его атомы. Используя приведенную ниже таблицу средних энтальпий связи, рассчитайте энтальпию атомизации этилена (C2h5): Bond Average
- спросил Джек
- 952 просмотра
химия
1- Используйте реакцию, чтобы закончить предложение. 2CO + O2 → 2CO2 Угарный газ и кислород соединяются с образованием двуокиси углерода. Суммарная энергия связи продуктов составляет 1472 кДж. Энергия связи каждой связи углерод-кислород в углекислом газе равна _____. (1
(1
- спросил Гайя
- 7 195 просмотров
science
Синтезируется ли АТФ при образовании химических связей между атомами углерода во время фотосинтеза ИЛИ при высвобождении энергии, запасенной в химических связях, во время клеточного дыхания?
- спросил ари
- 727 просмотров
Глава 7 – Алканы и галогенированные углеводороды – Химия
Глава 7: Алканы и галогенированные углеводородыЭтот текст опубликован в соответствии с лицензией Creative Commons, для ссылки и адаптации, пожалуйста, нажмите здесь.
Opening Essay 7.1 Recognition of Organic Structures 7.2 Introduction to Alkanes Straight Chain Alkanes Branched Chain Alkanes Cycloalkanes Classification of Carbon Облигации 7. 3 Properties of Alkanes Melting Points and Boiling Points Solubility Alkane Properties and Environmental Hazards: A Closer Look 7.4 Chemical Reactivity of Alkanes Combustion Reactions Реакции галогенирования (тип замещения) Алканы крекинга 7.5 Резюме главы 7.6 Упражнения в конце главы 7,7 Ссылки
3 Properties of Alkanes Melting Points and Boiling Points Solubility Alkane Properties and Environmental Hazards: A Closer Look 7.4 Chemical Reactivity of Alkanes Combustion Reactions Реакции галогенирования (тип замещения) Алканы крекинга 7.5 Резюме главы 7.6 Упражнения в конце главы 7,7 Ссылки Открытие эссе . Эти эффекты зависят от размера молекул углеводородов и от того, где они применяются в организме. Алканы с низкой молекулярной массой, содержащие от 1 до примерно 10 атомов углерода, представляют собой газы или легкие жидкости, которые действуют как анестетики. Вдыхание («вдыхание») этих углеводородов в бензине или аэрозольных пропеллентах из-за их опьяняющего эффекта является серьезной проблемой для здоровья, которая может привести к повреждению печени, почек или головного мозга или к немедленной смерти от удушья при исключении кислорода.
 Канистры с пропаном и бутаном под давлением, оба из которых предназначены для использования в качестве топлива, используются в качестве ингалянтов.
Канистры с пропаном и бутаном под давлением, оба из которых предназначены для использования в качестве топлива, используются в качестве ингалянтов.Рисунок 7.1. Ряд продуктов на основе нефти, которыми можно злоупотреблять в качестве ингалянтов . Фото: Lance Cpl. Мэтью К. Хакер
Проглатывание жидких алканов мало вредит желудку. Однако в легких они вызывают «химическую» пневмонию, растворяя жироподобные молекулы клеточных мембран в крошечных воздушных мешочках (альвеолах). Легкие перестают выталкивать жидкости, как при пневмонии, вызванной бактериями или вирусами. Людей, которые проглатывают бензин или другие жидкие смеси алканов, нельзя вызывать рвоту, так как это увеличивает вероятность попадания алканов в легкие. (Не существует противоядия для домашнего лечения отравления бензином; позвоните в токсикологический центр.)
Жидкие алканы, содержащие примерно 5–16 атомов углерода на молекулу, смывают естественные кожные жиры и вызывают высыхание и растрескивание кожи, в то время как более тяжелые жидкие алканы (содержащие примерно 17 или более атомов углерода на молекулу) действуют как смягчающие средства (смягчители кожи) . В качестве защитной пленки можно применять такие смеси алканов, как минеральное масло и вазелин. Вода и водные растворы, такие как моча, не растворяют такую пленку, что объясняет, почему вазелин защищает нежную кожу ребенка от опрелостей.
В качестве защитной пленки можно применять такие смеси алканов, как минеральное масло и вазелин. Вода и водные растворы, такие как моча, не растворяют такую пленку, что объясняет, почему вазелин защищает нежную кожу ребенка от опрелостей.
В этой главе мы будем исследовать алканы, соединения, содержащие только два элемента, углерод и водород, и имеющие только одинарные связи. Мы также будем исследовать алканы, в структуру которых входят галогены. Напомним, что галогены являются элементами семейства 7A в периодической таблице и содержат репрезентативные элементы, такие как хлор, фтор, йод и бром. Существует несколько других видов углеводородов, отличающихся типами связи между атомами углерода и свойствами, возникающими в результате этой связи. В главе 8 мы рассмотрим углеводороды с двойными связями, с тройными связями и с особым типом связи, называемым 9.0047 ароматичность . Затем в главе 9 мы изучим некоторые соединения, которые считаются производными от углеводородов путем замены одного или нескольких атомов водорода кислородсодержащей группой. Глава 10 посвящена органическим кислотам и основаниям.
Глава 10 посвящена органическим кислотам и основаниям.
7.1 Распознавание органических структур Цель обучения 9000
Ученые 18 и начала 19 веков изучали соединения, полученные из растений и животных, и обозначили их как органические , потому что они были выделены из «организованных» (живых) систем. Соединения, выделенные из неживых систем, таких как горные породы и руды, атмосфера и океаны, были обозначены как неорганические . Многие годы ученые считали, что органические соединения могут образовываться только живыми организмами, потому что они обладают жизненной силой, присущей только живым системам. Теория жизненной силы начала приходить в упадок в 1828 году, когда немецкий химик Фридрих Вёлер синтезировал мочевину из неорганических исходных материалов. Он прореагировал с цианатом серебра (AgOCN) и хлоридом аммония (NH 4 Cl), рассчитывая получить цианат аммония (NH 4 OCN). То, что он ожидал, описывается следующим уравнением.
То, что он ожидал, описывается следующим уравнением.
AgOCN + NH 4 Cl → AgCl + NH 4 OCN
Вместо этого он обнаружил, что продукт представляет собой мочевину (NH 2 CONH 2 ), хорошо известное органическое вещество, которое легко выделяют из мочи. Этот результат привел к серии экспериментов, в которых большое разнообразие органических соединений было получено из неорганических исходных материалов. Теория жизненной силы постепенно ушла в прошлое, когда химики узнали, что они могут создавать многие органические соединения в лаборатории.
Сегодня органическая химия была реклассифицирована как изучение соединений, содержащих углерод, а неорганическая химия является изучением химии всех других элементов. Может показаться странным, что мы делим химию на две ветви — одну, которая рассматривает соединения только одного элемента, и другую, которая охватывает более 100 остальных элементов. Однако такое деление представляется более разумным, если учесть, что из десятков миллионов охарактеризованных соединений подавляющее большинство составляют соединения углерода.
Слово органический имеет разные значения. Органические удобрения, такие как коровий навоз, являются органическими в первоначальном смысле; он получен из живых организмов. Органические продукты – это продукты, выращенные без синтетических пестицидов или удобрений. Органическая химия – это химия соединений углерода. Углерод уникален среди других элементов тем, что его атомы могут образовывать устойчивые ковалентные связи друг с другом и с атомами других элементов во множестве вариаций. Образовавшиеся молекулы могут содержать от одного до миллионов атомов углерода.
Органические соединения, как и неорганические соединения, подчиняются всем законам природы. Часто нет четкого различия в химических или физических свойствах органических и неорганических молекул. Тем не менее, полезно сравнить типичных членов каждого класса, как в Таблице 7.1 (помните, однако, что есть исключения для каждой категории в этой таблице). Чтобы дополнительно проиллюстрировать типичные различия между органическими и неорганическими соединениями, Таблица 7. 1 также перечислены свойства неорганического соединения хлорида натрия (поваренная поваренная соль, NaCl) и органического соединения гексана (C 6 H 14 ), растворитель, который используется для извлечения соевого масла из соевых бобов (среди прочего). Многие соединения можно классифицировать как органические или неорганические по наличию или отсутствию некоторых типичных свойств, как показано в таблице 7.1. Таблица 7.1. Общие контрастирующие свойства и примеры органических и неорганических соединений0031 Key Takeaway
1 также перечислены свойства неорганического соединения хлорида натрия (поваренная поваренная соль, NaCl) и органического соединения гексана (C 6 H 14 ), растворитель, который используется для извлечения соевого масла из соевых бобов (среди прочего). Многие соединения можно классифицировать как органические или неорганические по наличию или отсутствию некоторых типичных свойств, как показано в таблице 7.1. Таблица 7.1. Общие контрастирующие свойства и примеры органических и неорганических соединений0031 Key Takeaway
- Органическая химия изучает соединения углерода, почти все из которых также содержат атомы водорода.
Классифицируйте каждое соединение как органическое или неорганическое.
- С 6 Н 10
- CoCl 2
- С 12 Н 22 О 11
Классифицируйте каждое соединение как органическое или неорганическое.

- CH 3 NH 2
- NaNH 2
- Cu(NH 3 ) 6 Cl 2
Какой член каждой пары имеет более высокую температуру плавления?
- CH 3 ОН и NaOH
- CH 3 Cl и KCl
Какой член каждой пары имеет более высокую температуру плавления?
- C 2 H 6 и CoCl 2
- CH 4 и LiH
- органический
- неорганический
- органический
- NaOH
- KCl
(Вернуться к началу)
7.2 Введение в алканы
Алканы представляют собой органические соединения, полностью состоящие из атомов углерода и водорода с одинарной связью и лишенные каких-либо других функциональных групп.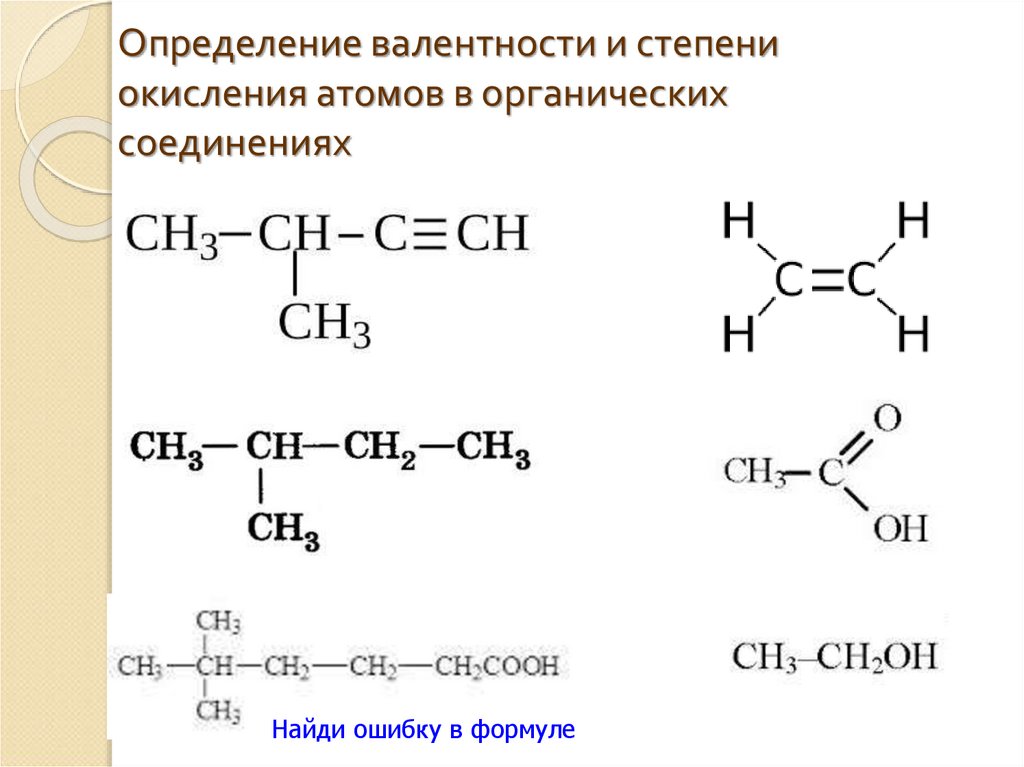 Алканы имеют общую формулу C n H 2n +2 и могут быть подразделены на следующие три группы: линейные алканы с прямой цепью, разветвленные алканы и циклоалканы (рис. 7.2). Алканы также являются насыщенными углеводородами, , то есть все атомы углерода «насыщены» атомами водорода и не содержат двойных или тройных углерод-углеродных связей. Алканы — это простейшие и наименее реакционноспособные виды углеводородов, содержащие только углерод и водород. Они очень важны с коммерческой точки зрения, так как являются основным компонентом бензина и смазочных масел и широко используются в органической химии; хотя роль чистых алканов (например, гексанов) отводится в основном растворителям. Отличительной чертой алкана, отличающей его от других соединений, которые также содержат исключительно углерод и водород, является отсутствие ненасыщенности. Другими словами, он не содержит двойных или тройных связей, которые очень реакционноспособны в органической химии. Хотя они не полностью лишены реакционной способности, отсутствие у них реакционной способности в большинстве лабораторных условий делает их относительно неинтересными, хотя и очень важными компонентами органической химии.
Алканы имеют общую формулу C n H 2n +2 и могут быть подразделены на следующие три группы: линейные алканы с прямой цепью, разветвленные алканы и циклоалканы (рис. 7.2). Алканы также являются насыщенными углеводородами, , то есть все атомы углерода «насыщены» атомами водорода и не содержат двойных или тройных углерод-углеродных связей. Алканы — это простейшие и наименее реакционноспособные виды углеводородов, содержащие только углерод и водород. Они очень важны с коммерческой точки зрения, так как являются основным компонентом бензина и смазочных масел и широко используются в органической химии; хотя роль чистых алканов (например, гексанов) отводится в основном растворителям. Отличительной чертой алкана, отличающей его от других соединений, которые также содержат исключительно углерод и водород, является отсутствие ненасыщенности. Другими словами, он не содержит двойных или тройных связей, которые очень реакционноспособны в органической химии. Хотя они не полностью лишены реакционной способности, отсутствие у них реакционной способности в большинстве лабораторных условий делает их относительно неинтересными, хотя и очень важными компонентами органической химии. Как вы узнаете позже, энергия, заключенная в связи углерод-углерод и связь углерод-водород, довольно высока, и их быстрое окисление производит большое количество тепла, обычно в форме огня.
Как вы узнаете позже, энергия, заключенная в связи углерод-углерод и связь углерод-водород, довольно высока, и их быстрое окисление производит большое количество тепла, обычно в форме огня.
Рисунок 7.2. Examples of Alkanes
Straight Chain Alkanes
The straight chain alkanes, methane (CH 4 ), ethane (C 2 H 6 ), and propane (C 3 H 8 ) представляют собой начало ряда соединений, в которых любые два члена в последовательности отличаются одним атомом углерода и двумя атомами водорода, а именно звено CH 2 (рис. 7.3)
Рисунок 7.3 Три простейших Алканы
Первые 10 членов этого ряда приведены в таблице 7.2. Обратите внимание, что по мере увеличения длины углеродной цепи количество возможных различных структурных изомеров также увеличивается.
Таблица 7.2. Первые 10 алканов с прямой цепью 2 единиц по мере продвижения вверх по ряду (рис. 7.4). Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором (здесь CH 2 группа) называется гомологическим рядом и может быть определена математически. Члены такого ряда называются гомологами . В органической химии свойства гомологов изменяются закономерным и предсказуемым образом. Таким образом, принцип гомологии дает организацию органической химии почти так же, как таблица Менделеева дает организацию неорганической химии. Вместо сбивающего с толку множества отдельных соединений углерода мы можем изучить несколько членов гомологического ряда и вывести из них некоторые свойства других соединений этого ряда.
7.4). Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором (здесь CH 2 группа) называется гомологическим рядом и может быть определена математически. Члены такого ряда называются гомологами . В органической химии свойства гомологов изменяются закономерным и предсказуемым образом. Таким образом, принцип гомологии дает организацию органической химии почти так же, как таблица Менделеева дает организацию неорганической химии. Вместо сбивающего с толку множества отдельных соединений углерода мы можем изучить несколько членов гомологического ряда и вывести из них некоторые свойства других соединений этого ряда.
Рисунок 7.4 Члены гомологического ряда
На рисунке 7.4 обратите внимание, что каждая последующая формула включает на один атом углерода и два атома водорода больше, чем предыдущая формула. Принцип гомологии позволяет написать общую формулу алканов: С n H 2 n + 2 . Используя эту формулу, мы можем написать молекулярную формулу любого алкана с заданным числом атомов углерода. Например, алкан с восемью атомами углерода имеет молекулярную формулу C 8 Н (2 × 8) + 2 = С 8 Н 18 .
Используя эту формулу, мы можем написать молекулярную формулу любого алкана с заданным числом атомов углерода. Например, алкан с восемью атомами углерода имеет молекулярную формулу C 8 Н (2 × 8) + 2 = С 8 Н 18 .
В гомологическом ряду алканов, какова молекулярная формула члена чуть выше C 8 H 18 ?
Используйте общую формулу алканов, чтобы написать молекулярную формулу алкана с 12 атомами углерода.
С 9 Н 20
C 12 H 26
(наверх)
Алканы с разветвленной цепью
Мы можем записать структуру бутана (C 4 H 10 ), нанизав четыре атома углерода в ряд,
–C–C–C–C–
4 и затем добавление достаточного количества атомов водорода, чтобы дать каждому атому углерода четыре связи:
Соединение бутана имеет такую структуру, но есть и другой способ соединения 4 атомов углерода и 10 атомов водорода.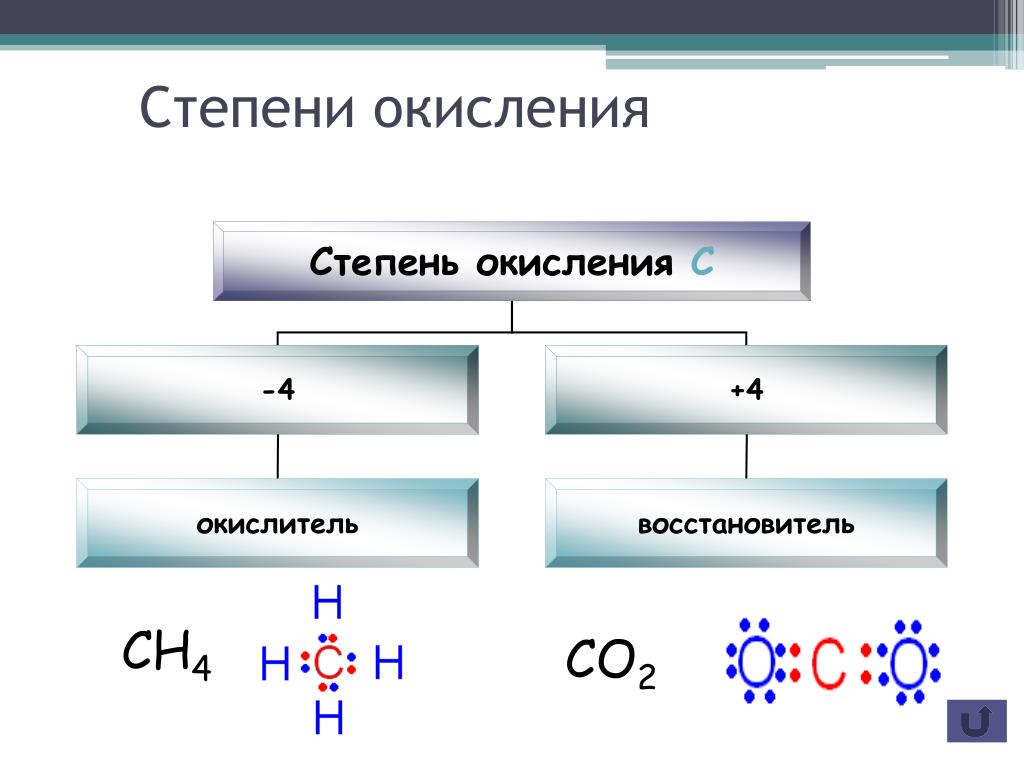 Поместите 3 атома углерода в ряд, а затем разветвите четвертый атом от среднего атома углерода:
Поместите 3 атома углерода в ряд, а затем разветвите четвертый атом от среднего атома углерода:
Теперь мы добавляем достаточное количество атомов водорода, чтобы дать каждому углероду четыре связи.
Существует углеводород, который соответствует этой структуре, а это означает, что два разных соединения имеют одинаковую молекулярную формулу (C 4 H 10 ), но разное расположение атомов в пространстве. Напомним, что соединения, имеющие одинаковую молекулярную формулу, но разное расположение в пространстве, называются структурные изомеры . Структурные изомеры обладают разными химическими и физическими свойствами. На рис. 7.5 показана модель шара и стержня для бутана с прямой цепью и разветвленного изомера изобутана.
Рисунок 7.5 Бутан и изобутан. Шарико-стержневые модели этих двух соединений показывают, что они являются изомерами; оба имеют молекулярную формулу C 4 H 10 .
Обратите внимание, что C 4 H 10 изображен с изогнутой цепью на Рисунке 7.5. Четырехуглеродная цепь может быть изогнута по-разному, поскольку группы могут свободно вращаться вокруг связей С-С. Однако это вращение не меняет идентичности соединения. Важно понимать, что сгибание цепи делает , а не меняют состав соединения; все следующие представляют одно и то же соединение:
Формула изобутана показывает непрерывную цепь только из трех атомов углерода, с четвертым присоединенным ответвлением от среднего атома углерода непрерывной цепи.
В отличие от C 4 H 10 , соединения метана (CH 4 ), этана (C 2 H 6 ) и пропана (C 3 H 8 900) не существуют в 0 H 890 изомерные формы, потому что в каждой формуле атомы можно расположить только одним способом, чтобы каждый атом углерода имел четыре связи.
Примечание
Непрерывную (неразветвленную) цепь атомов углерода часто называют прямой цепью , хотя тетраэдрическое расположение каждого атома углерода придает ей зигзагообразную форму. Алканы с прямой цепью иногда называют нормальными алканами , а их названиям дают префикс n -. Например, бутан называется n -бутан.
Алканы с прямой цепью иногда называют нормальными алканами , а их названиям дают префикс n -. Например, бутан называется n -бутан.
Может ли в алканах быть двухуглеродная ветвь от второго атома углерода четырехуглеродной цепи? Объяснять.
Студента просят написать структурные формулы двух различных углеводородов, имеющих молекулярную формулу C 5 H 12 . Она пишет одну формулу со всеми пятью атомами углерода в горизонтальной линии, а другую с четырьмя атомами углерода в линии, с группой CH 3 , идущей вниз от первого присоединенного к третьему атому углерода. Представляют ли эти структурные формулы разные молекулярные формулы? Объясните, почему да или почему нет.
№; ответвление составило бы самую длинную непрерывную цепь из пяти атомов углерода.

№; обе представляют собой пятиуглеродные непрерывные цепи.
- Алканы с четырьмя и более атомами углерода могут существовать в изомерных формах.
Кратко укажите важные различия между алканом с прямой цепью и алканом с разветвленной цепью.
Нарисуйте структурные изомеры следующих алканов.
Укажите, представляют ли структуры в каждом наборе одно и то же соединение или изомеры.
CH 3 CH 2 CH 2 CH 3 и
CH 3 CH 2 CH 2 CH 2 CH 3 и
Алканы с прямой цепью и алканы с разветвленной цепью имеют разные свойства, а также разную структуру.

- №
- да
Напишите сокращенную структурную формулу для каждой структурной формулы.
Сокращенная структурная формула изогексана может быть записана как (CH 3 ) 2 CHCH 2 CH 2 CH 3 . Нарисуйте формулу угла линии для изогексана.
Нарисуйте формулу линии-угла для соединения CH 3 CH 2 CH(CH 3 )CH 2 CH 2 CH 3 .
Назовите структурную формулу соединения, представленного этой формулой угла линии:
(наверх)
Циклоалканы
Циклоалканы очень важны для компонентов пищевых продуктов, фармацевтических препаратов и многого другого. Однако, чтобы использовать циклоалканы в таких приложениях, мы должны знать эффекты, функции, свойства и структуру циклоалканов. Циклоалканы представляют собой алканы в форме кольца; следовательно, префикс цикло- используется для обозначения этих алканов. Стабильные циклоалканы не могут быть образованы с углеродными цепями любой длины. Напомним, что в алканах углерод принимает тетраэдрическую геометрию, в которой углы между связями составляют 109,5°.
Однако, чтобы использовать циклоалканы в таких приложениях, мы должны знать эффекты, функции, свойства и структуру циклоалканов. Циклоалканы представляют собой алканы в форме кольца; следовательно, префикс цикло- используется для обозначения этих алканов. Стабильные циклоалканы не могут быть образованы с углеродными цепями любой длины. Напомним, что в алканах углерод принимает тетраэдрическую геометрию, в которой углы между связями составляют 109,5°.
Источник: Википедия
Для образования некоторых циклоалканов угол между связями должен отклоняться от этого идеального угла, эффект, известный как угловая деформация . Кроме того, некоторые атомы водорода могут приблизиться друг к другу ближе, чем это желательно (затмить себя), эффект, называемый деформация при кручении . Эти дестабилизирующие эффекты, угловая деформация и деформация при кручении вместе известны как кольцевая деформация . Циклоалканы меньшего размера, циклопропан и циклобутан, имеют особенно высокие деформации кольца, потому что их валентные углы существенно отклоняются от 109,5 °, а их атомы водорода затмевают друг друга. Таким образом, обе эти кольцевые конформации крайне неблагоприятны и нестабильны. Циклопентан представляет собой более стабильную молекулу с небольшой степенью деформации кольца, в то время как циклогексан может принимать идеальную геометрию циклоалкана, в которой все углы являются идеальными 109..5° и ни один водород не затмевается; у него вообще нет кольцевой деформации. Циклоалканы большего размера, чем циклогексан, имеют кольцевую деформацию и не так часто встречаются в органической химии. На рис. 7.6 приведены примеры структур циклоалканов.
Циклоалканы меньшего размера, циклопропан и циклобутан, имеют особенно высокие деформации кольца, потому что их валентные углы существенно отклоняются от 109,5 °, а их атомы водорода затмевают друг друга. Таким образом, обе эти кольцевые конформации крайне неблагоприятны и нестабильны. Циклопентан представляет собой более стабильную молекулу с небольшой степенью деформации кольца, в то время как циклогексан может принимать идеальную геометрию циклоалкана, в которой все углы являются идеальными 109..5° и ни один водород не затмевается; у него вообще нет кольцевой деформации. Циклоалканы большего размера, чем циклогексан, имеют кольцевую деформацию и не так часто встречаются в органической химии. На рис. 7.6 приведены примеры структур циклоалканов.
Рисунок 7.6. Репрезентативные циклоалкановые структуры. Указаны средние валентные углы и энергия деформации.
Для вашего здоровья: циклопропан в качестве анестетика
Циклопропан при температуре кипения -33°C представляет собой газ при комнатной температуре. Это также мощный, быстродействующий анестетик с небольшим количеством нежелательных побочных эффектов в организме. Однако в хирургии он больше не используется, так как образует с воздухом взрывоопасные смеси практически при любых концентрациях.
Это также мощный, быстродействующий анестетик с небольшим количеством нежелательных побочных эффектов в организме. Однако в хирургии он больше не используется, так как образует с воздухом взрывоопасные смеси практически при любых концентрациях.
Классификация углеродных связей
Атомы углерода, участвующие в химических связях внутри молекулы, можно классифицировать на основе количества образующихся углерод-углеродных связей.
- первичный атом углерода : один соседний атом углерода
- вторичный атом углерода : два соседа углерода
- третичный атом углерода : три соседа углерода
- четвертичный атом углерода : четыре соседа углерода
Количество углеродных соседей, которые имеет атом углерода, может помочь определить реакционную способность этого углеродного положения. Таким образом, важно уметь распознавать, является ли атом углерода первичным, вторичным, третичным или четвертичным по своей структуре (рис. 7.7).
7.7).
Рисунок 7.7. Классификация атомов углерода на первичные, вторичные, третичные и четвертичные. В приведенных выше молекулах центральный углерод оценивается по количеству атомов углерода, которые связаны непосредственно с центральным углеродом. Первичный углерод связан с одним углеродом, вторичный углерод связан с двумя атомами углерода, третичный углерод связан с тремя атомами углерода, а четвертичный углерод связан с четырьмя атомами углерода.
В любой данной молекуле каждый атом углерода может быть классифицирован (рис. 7.8).
Рисунок 7.8. Классификация атомов углерода в молекуле
(Вернуться к началу)связи и углерод-углеродные одинарные связи. Алканы не очень реакционноспособны и обладают небольшой биологической активностью; все алканы бесцветны и не имеют запаха. Поскольку алканы обладают относительно предсказуемыми физическими свойствами и подвергаются относительно небольшому количеству химических реакций, кроме горения, они служат основой для сравнения свойств многих других семейств органических соединений.
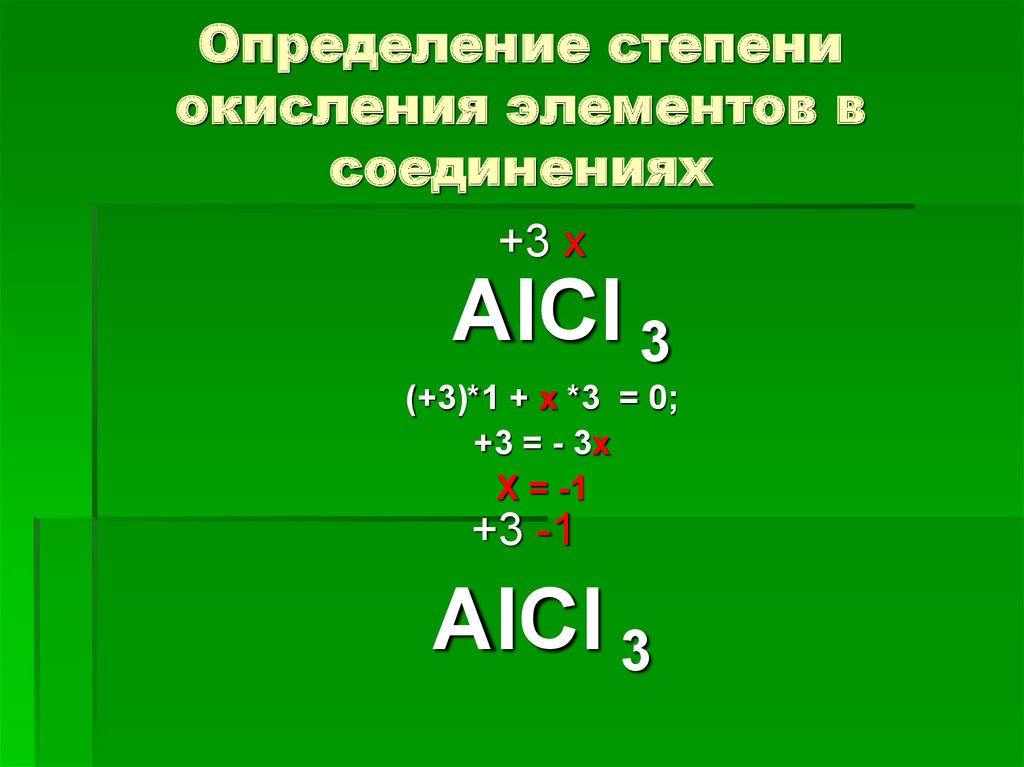 Сначала рассмотрим их физические свойства.
Сначала рассмотрим их физические свойства.В таблице 7.3 описаны некоторые свойства некоторых из первых 10 алканов с прямой цепью. Почти все алканы имеют плотность менее 1,0 г/мл и, следовательно, менее плотны, чем вода (плотность H 2 O составляет 1,00 г/мл при 20°C).
Таблица 7.3 Физические свойства некоторых алканов Природный газ состоит в основном из метана, который имеет плотность около 0,67 г/л. Плотность воздуха около 1,29.г/л. Поскольку плотность природного газа меньше плотности воздуха, он поднимается вверх. Когда утечка природного газа обнаружена и перекрыта в помещении, газ можно удалить, открыв верхнее окно. С другой стороны, баллонный газ может быть либо пропаном (плотность 1,88 г/л), либо бутанами (смесь бутана и изобутана, плотность около 2,5 г/л). Оба вещества намного тяжелее воздуха (плотность 1,2 г/л). Если баллонный газ попадает в здание, он скапливается у пола. Это представляет гораздо более серьезную опасность возгорания, чем утечка природного газа, потому что из комнаты труднее избавиться от более тяжелого газа.
Точки плавления и кипения
Точки плавления и кипения алканов характеризуют межмолекулярные силы, возникающие между молекулами. Разница электроотрицательностей между углеродом и водородом (2,1 – 1,9 = 0,2) невелика; поэтому связь C-H неполярна, а это означает, что единственными притяжениями между одной молекулой и ее соседями будут лондонские дисперсионные силы. Эти силы будут очень малы для такой молекулы, как метан, но будут увеличиваться по мере увеличения размера молекул. Следовательно, температуры плавления и кипения алканов увеличиваются с увеличением размера молекул из-за увеличения лондоновских дисперсионных сил. (т. е. межмолекулярные силы сильнее в более крупных углеводородах, поэтому требуется больше энергии, чтобы вызвать фазовые переходы). Рисунок 7.9показаны тренды температуры плавления и кипения для первых 16 углеводородов. Обратите внимание, что первые четыре алкана являются газами при комнатной температуре, а твердые вещества не начинают появляться примерно до C 17 H 36 .
Рисунок 7.9. Температуры плавления и температуры кипения алканов с прямой цепью
Адаптировано из: Techstepp
Что касается изомеров, чем более разветвлена цепь, тем ниже температура кипения. Лондонские дисперсионные силы меньше для более коротких молекул и действуют только на очень коротких расстояниях между одной молекулой и ее соседями. Коротким громоздким молекулам (со значительным количеством разветвлений) труднее располагаться близко друг к другу (компактно) по сравнению с длинными тонкими молекулами. Циклоалканы похожи на алканы по своим общим физическим свойствам, но имеют более высокие температуры кипения, температуры плавления и плотности, чем алканы. Это связано с более сильными лондонскими силами, потому что форма кольца обеспечивает большую площадь контакта.
(Вернуться к началу) Растворимость
Алканы (как нормальные, так и циклоалканы) практически нерастворимы в воде, но растворяются в органических растворителях. Жидкие алканы являются хорошими растворителями для многих других ковалентных соединений. Когда молекулярное вещество растворяется в воде, должно происходить следующее:
Жидкие алканы являются хорошими растворителями для многих других ковалентных соединений. Когда молекулярное вещество растворяется в воде, должно происходить следующее:
- нарушение межмолекулярных сил внутри вещества. В случае алканов это лондонские дисперсионные силы.
- разрыв межмолекулярных сил в воде, чтобы вещество могло поместиться между молекулами воды. В воде основным межмолекулярным притяжением являются водородные связи.
Чтобы разрушить любое из этих притяжений, требуется энергия, хотя количество энергии, необходимое для разрушения лондонских дисперсионных сил в соединении, таком как метан, относительно незначительно; это не относится к водородным связям в воде. Напомним, что водородные связи намного прочнее.
Проще говоря, вещество будет растворяться, если при образовании новых связей между веществом и водой высвобождается достаточно энергии, чтобы компенсировать энергию, необходимую для разрушения первоначальных притяжений. Единственным новым притяжением между алканом и молекулами воды являются лондонские дисперсионные силы. Эти силы не выделяют достаточного количества энергии, чтобы компенсировать энергию, необходимую для разрыва водородных связей в воде. Следовательно, алкан не растворяется, как показано на рисунке 7.10.
Эти силы не выделяют достаточного количества энергии, чтобы компенсировать энергию, необходимую для разрыва водородных связей в воде. Следовательно, алкан не растворяется, как показано на рисунке 7.10.
Рисунок 7.10. Углеводороды с длинной цепью нерастворимы в воде. Ни насыщенные, ни ненасыщенные углеводороды в этом подсолнечном масле не обладают достаточно сильными межмолекулярными силами, чтобы разрушить водородные связи между молекулами воды. Таким образом, масло не растворяется в воде и образует пузырьки масла на поверхности раздела вода/нефть. В этом случае нефть менее плотна, чем вода, и будет плавать поверх водного слоя.
Растворимость в органических растворителях В большинстве органических растворителей основными силами притяжения между молекулами растворителя являются лондонские дисперсионные силы. Следовательно, когда алкан растворяется в органическом растворителе, лондонские дисперсионные силы разрушаются и заменяются новыми лондонскими дисперсионными силами между смесью. Два процесса более или менее энергетически компенсируют друг друга; таким образом, нет никаких препятствий для растворимости.
Два процесса более или менее энергетически компенсируют друг друга; таким образом, нет никаких препятствий для растворимости.
Свойства алканов и опасность для окружающей среды: более пристальный взгляд
Из-за растворимости и плотности алканов разливы нефти в океан или другие водоемы могут иметь разрушительные последствия для окружающей среды. Нефть не может растворяться или смешиваться с водой, и поскольку она менее плотная, чем вода, она плавает на поверхности воды, создавая нефтяное пятно, как показано на рис. 7.11. Поскольку нефтяное пятно остается на поверхности воды, от нефтяных пятен больше всего страдают организмы, обитающие на поверхности океана или вблизи береговой линии, включая морских выдр и морских птиц. Химические компоненты масла токсичны при приеме внутрь, вдыхании, раздражении кожи и глаз.
Рисунок 7.11 Разливы нефти. Сырая нефть покрывает поверхность воды в Мексиканском заливе после того, как нефтяная платформа Deepwater Horizon затонула в результате взрыва. Утечка произошла на милю ниже поверхности, что затрудняет оценку размера разлива. Один литр нефти может создать пятно размером 2,5 га (6,3 акра). Этот и подобные разливы служат напоминанием о том, что углеводороды и вода не смешиваются.
Утечка произошла на милю ниже поверхности, что затрудняет оценку размера разлива. Один литр нефти может создать пятно размером 2,5 га (6,3 акра). Этот и подобные разливы служат напоминанием о том, что углеводороды и вода не смешиваются.
Источник: Фото предоставлено NASA Goddard / MODIS Rapid Response Team.
Упражнения по обзору концепцииНе обращаясь к таблице, угадайте, что имеет более высокую температуру кипения — гексан или додекан. Объяснять.
Если к 100 мл воды в стакане добавить 25 мл гексана, что из следующего вы ожидаете? Объяснять.
- Гексан растворяется в воде.
- Гексан не растворялся в воде и всплывал на поверхность.
- Гексан не растворяется в воде и оседает на дно контейнера.
додекан из-за его большей молекулярной массы
б; гексан нерастворим в воде и менее плотен, чем вода.

- Алканы представляют собой неполярные соединения с низкой температурой кипения и нерастворимы в воде.
Не обращаясь к таблице или другой справке, предскажите, какой член каждой пары имеет более высокую температуру кипения.
- пентан или бутан
- гептан или нонан
Для какого члена каждой пары гексан является хорошим растворителем?
- пентан или вода
- натрия хлорид или соевое масло
- пентан
- нонан
(Вернуться к началу) 7.4 Химическая активность алканов
Алканы содержат прочные углерод-углеродные одинарные связи и прочные углерод-водородные связи. Обе эти связи неполярны. Следовательно, нет части молекулы, которая несет значительное количество положительного или отрицательного заряда, необходимого для притяжения к ней других ионных и полярных молекул. Поэтому алканы обычно не реагируют с ионными соединениями, такими как большинство лабораторных кислот, оснований, окислителей или восстановителей. Рассмотрим бутан в качестве примера:
Обе эти связи неполярны. Следовательно, нет части молекулы, которая несет значительное количество положительного или отрицательного заряда, необходимого для притяжения к ней других ионных и полярных молекул. Поэтому алканы обычно не реагируют с ионными соединениями, такими как большинство лабораторных кислот, оснований, окислителей или восстановителей. Рассмотрим бутан в качестве примера:
Ни положительные, ни отрицательные ионы не притягиваются к неполярной молекуле. На самом деле алканы вступают в так мало реакций, что их иногда называют парафинами , от латинского parum affinis , что означает «малое сродство».
В результате алканы обладают очень низкой реакционной способностью и подвергаются только трем основным типам реакций, включая следующие:
- Реакции горения – сжечь их – разрушив целую молекулу;
- Реакции галогенирования (типа замещения) – реагируют с некоторыми галогенами, разрывая углерод-водородные связи;
- Реакции крекинга – используют тепло и/или катализатор для крекинга алканов, разрывая углерод-углеродные связи.

Реакции горения
Горение соединений углерода, особенно углеводородов, было самым важным источником тепловой энергии для человеческих цивилизаций на протяжении всей истории человечества. Практическое значение этой реакции нельзя отрицать, но массовые и неконтролируемые химические изменения, происходящие при горении, затрудняют вывод механизмов. Используя в качестве примера горение пропана, мы видим из следующего уравнения, что каждая ковалентная связь в реагентах была разорвана, и в продуктах образовался совершенно новый набор ковалентных связей. Никакая другая обычная реакция не вызывает столь глубоких и всеобъемлющих изменений, а механизм горения настолько сложен, что химики только начинают изучать и понимать некоторые его элементарные особенности.
CH 3 CH 2 CH 3 +5O 2 → 3CO 2 +4H 2 O +HEAT
ПРИМЕЧА стрелки называются субстратами или реагентами , а соединения справа от стрелки являются продуктами реакции. Энергия, чаще всего выделяющаяся в виде тепла, может быть либо субстратом, либо продуктом реакции, в зависимости от участвующих соединений. Также обратите внимание, что ни один из атомов не теряется в данных химических уравнениях. Закон сохранения массы гласит, что материя не может быть ни создана, ни уничтожена. Таким образом, уравнение должно быть сбалансированным и иметь такое же количество атомов в левой части уравнения, как и в правой. Напомним, что коэффициенты уравнения определяют, сколько молей соединения присутствует, и что если коэффициент не показан, по умолчанию он равен единице. Например, приведенное выше уравнение будет читаться так: 1 моль пропана (CH 3 CH 2 CH 3 ) реагирует с 5 молями кислорода (O 2 ) с образованием 3 молей диоксида углерода (CO 2 ) и 4 молей воды (H 2 O) с выделением тепла.
Энергия, чаще всего выделяющаяся в виде тепла, может быть либо субстратом, либо продуктом реакции, в зависимости от участвующих соединений. Также обратите внимание, что ни один из атомов не теряется в данных химических уравнениях. Закон сохранения массы гласит, что материя не может быть ни создана, ни уничтожена. Таким образом, уравнение должно быть сбалансированным и иметь такое же количество атомов в левой части уравнения, как и в правой. Напомним, что коэффициенты уравнения определяют, сколько молей соединения присутствует, и что если коэффициент не показан, по умолчанию он равен единице. Например, приведенное выше уравнение будет читаться так: 1 моль пропана (CH 3 CH 2 CH 3 ) реагирует с 5 молями кислорода (O 2 ) с образованием 3 молей диоксида углерода (CO 2 ) и 4 молей воды (H 2 O) с выделением тепла.
Химические связи также обладают потенциальной энергией. Если вы думаете о природе связи, она удерживается вместе энергией притяжения. Для разрыва связей на стороне реагента в уравнении требуется энергия, в то время как образование связей на стороне продукта высвобождает энергию. Если энергия, выделяемая при образовании связи, выше, чем энергия, необходимая для диссоциации связи, в результате реакции будет выделяться энергия. Эта энергия обычно измеряется как теплота реакции, которая называется энтальпия .
Для разрыва связей на стороне реагента в уравнении требуется энергия, в то время как образование связей на стороне продукта высвобождает энергию. Если энергия, выделяемая при образовании связи, выше, чем энергия, необходимая для диссоциации связи, в результате реакции будет выделяться энергия. Эта энергия обычно измеряется как теплота реакции, которая называется энтальпия .
В отношении этой реакции важны два момента:
- Поскольку все ковалентные связи в молекулах реагентов разорваны, количество тепла, выделяющегося в этой реакции, связано с прочностью этих связей (и, конечно, силой связи, образующиеся в продуктах). Эти теплоты можно оценить с помощью энергий диссоциации/образования связи (энергия, необходимая для разрыва связи на стороне реагента уравнения, и энергия, выделяемая при образовании связи на стороне продукта уравнения).
- Также важна стехиометрия реагентов. Если подается недостаточно кислорода, некоторые из продуктов будут состоять из менее окисленного газообразного монооксида углерода (СО).

Например, если бы присутствовало только 4 моля кислорода, при сгорании одного моля пропана образовался бы только 1 моль двуокиси углерода и 2 моля окиси углерода.
CH 3 CH 2 CH 3 + 4O 2 → CO 2 + 2CO + 4H 2 O + тепло
(Вернуться к началу)
Энергия связи
Атомы связываются друг с другом, образуя соединения, потому что при этом они достигают более низких энергий, чем у отдельных атомов. Количество энергии, равное разности энергий связанных атомов и энергий разъединенных атомов, выделяется обычно в виде тепла. То есть связанные атомы имеют более низкую энергию, чем отдельные атомы как отдельные атомы. Когда атомы объединяются в соединение, всегда выделяется энергия, и соединение имеет более низкую общую энергию.
Когда происходит химическая реакция, молекулярные связи разрываются и образуются другие связи, образующие другие молекулы. Например, связи двух молекул воды разрываются с образованием водорода и кислорода.
Например, связи двух молекул воды разрываются с образованием водорода и кислорода.
2H 2 O → 2H 2 + O 2
Для разрыва связи всегда требуется энергия, известная как энергия связи . Хотя концепция может показаться простой, энергия связи служит очень важной цели при описании структуры и характеристик молекулы. Его можно использовать для определения наиболее подходящей точечной структуры Льюиса при наличии нескольких точечных структур Льюиса.
Ключевые выводы:- Чтобы разорвать связь, всегда требуется энергия.
- Энергия всегда высвобождается при создании связи.
Хотя каждая молекула имеет свою характеристическую энергию связи, возможны некоторые обобщения. Например, хотя точное значение энергии связи С–Н зависит от конкретной молекулы, все связи С–Н имеют энергию связи примерно одинакового значения, поскольку все они являются связями С–Н. Чтобы разорвать 1 моль связи С-Н, требуется примерно 100 ккал энергии, поэтому мы говорим об энергии связи связи С-Н, равной примерно 100 ккал/моль. Связь C – C имеет приблизительную энергию связи 80 ккал / моль, а C = C имеет энергию связи около 145 ккал / моль. Мы можем рассчитать более общую энергию связи, найдя среднее значение энергии связи конкретной связи в разных молекулах, чтобы получить среднюю энергию связи. В таблице 7.2 приведен список средних энергий связи для обычных органических связей. Помните, что энергия может быть выражена в ккал или кДж и что коэффициент преобразования между ними составляет: 4,184 кДж = 1 ккал
Связь C – C имеет приблизительную энергию связи 80 ккал / моль, а C = C имеет энергию связи около 145 ккал / моль. Мы можем рассчитать более общую энергию связи, найдя среднее значение энергии связи конкретной связи в разных молекулах, чтобы получить среднюю энергию связи. В таблице 7.2 приведен список средних энергий связи для обычных органических связей. Помните, что энергия может быть выражена в ккал или кДж и что коэффициент преобразования между ними составляет: 4,184 кДж = 1 ккал
| Одиночные облигации | Множественные облигации | ||||||
|---|---|---|---|---|---|---|---|
| В—В | 432 | Н—Х | 391 | Я—Я | 149 | С = С | 614 |
| В—Ф | 565 | Н—Н | 160 | I—Кл | 208 | С ≡ С | 839 |
| H—Cl | 427 | Н—Ф | 272 | И—Бр | 175 | О = О | 495 |
| H—Br | 363 | Н—Кл | 200 | С = О* | 745 | ||
| Н—Я | 295 | Н—Бр | 243 | Ш-В | 347 | С ≡ О | 1072 |
| № | 201 | С-Ф | 327 | Н = О | 607 | ||
| С—Н | 413 | О—Н | 467 | S—Cl | 253 | Н = Н | 418 |
| К—К | 347 | О—О | 146 | С—Бр | 218 | Н ≡ Н | 941 |
| C—N | 305 | О-Ф | 190 | С-С | 266 | С ≡ N | 891 |
| К—О | 358 | О—Cl | 203 | С = Н | 615 | ||
| C—F | 485 | О—Я | 234 | Si—Si | 340 | ||
| C—Cl | 339 | Si—H | 393 | ||||
| C—Br | 276 | Ф—Ф | 154 | Si-C | 360 | ||
| К—Я | 240 | F — класс | 253 | Si-O | 452 | ||
| К—С | 259 | Ф—Бр | 237 | ||||
| Кл—Кл | 239 | ||||||
| Кл—Бр | 218 | ||||||
| Бр—Бр | 193 | ||||||
*C = O в (CO 2 ) = 799 | |||||||
Когда связь прочная, энергия связи выше, поскольку для ее разрыва требуется больше энергии. Это коррелирует с порядком связи и длиной связи. Когда порядок связи выше, длина связи короче, и чем короче длина связи, тем больше энергия связи из-за увеличения электрического притяжения. Как правило, чем короче длина связи, тем больше энергия связи.
Это коррелирует с порядком связи и длиной связи. Когда порядок связи выше, длина связи короче, и чем короче длина связи, тем больше энергия связи из-за увеличения электрического притяжения. Как правило, чем короче длина связи, тем больше энергия связи.
Разрыв и образование связи
Когда происходит химическая реакция, атомы в реагентах перестраивают свои химические связи с образованием продуктов. Новое расположение связей не имеет такой же полной энергии, как связи в реагентах. Следовательно, когда происходят химические реакции, всегда будет сопровождать изменение энергии . Изменение энергии реакции или теплоты реакции называется энтальпией . Он представлен математическим символом ΔH и рассчитывается как разница между энергией, необходимой для разрыва связей реагентов, и энергией, высвобождаемой при образовании связей в продуктах.
ΔH = энергия реагентов – энергия продуктов
Рисунок 7. 12: Энтальпия реакции. (верхняя реакция) Экзотермические реакции. При экзотермической химической реакции энергия выделяется по мере того, как реагенты превращаются в продукты. (нижняя реакция) Эндотермические реакции. Для эндотермической химической реакции энергия поглощается по мере того, как реагенты превращаются в продукты.
12: Энтальпия реакции. (верхняя реакция) Экзотермические реакции. При экзотермической химической реакции энергия выделяется по мере того, как реагенты превращаются в продукты. (нижняя реакция) Эндотермические реакции. Для эндотермической химической реакции энергия поглощается по мере того, как реагенты превращаются в продукты.
В некоторых реакциях энергия образующихся продуктов ниже энергии реагентов. Таким образом, в ходе реакции избыточная энергия, выделяемая при образовании продукта, будет выделяться в окружающую среду. Такие реакции являются экзотермическими и могут быть представлены 9Диаграмма уровней энергии 0047 на рисунке 7.12 (вверху). В большинстве случаев энергия выделяется в виде тепла (хотя в некоторых реакциях энергия выделяется в виде света). В химических реакциях, где продукты имеют более высокую энергию, чем реагенты, реагенты должны поглощать энергию из окружающей среды, чтобы иметь возможность реагировать. Эти реакции являются эндотермическими и могут быть представлены диаграммами энергетических уровней, подобными рис. 7.12 (ниже).
7.12 (ниже).
Экзотермические и эндотермические реакции можно рассматривать как имеющие энергию либо как «продукт» реакции, либо как «реагент» соответственно. Экзотермические реакции высвобождают энергию, поэтому энергия является продуктом. Эндотермические реакции требуют энергии, поэтому энергия является реагентом.
Экзотермические реакции будут иметь отрицательную общую энтальпию, а эндотермические реакции будут иметь положительную общую энтальпию.
ΔH = Энергия реагентов – Энергия продуктов
Энергию реакции можно рассматривать стехиометрически в рамках реакции точно так же, как любое из соединений в реакции. При сгорании метана CH 4 каждый сожженный моль выделяет 824 кДж энергии. Таким образом, легко подсчитать, сколько энергии выделяется при любом количестве CH 4 который сгорел. Мы также можем легко подсчитать, сколько CO 2 образуется на каждый моль сгоревшего CH 4 , поскольку на каждый моль сгоревшего CH 4 производится один моль CO 2 .
Полное сжигание
Полное сжигание (приведенный достаточный кислород) любого углевородого Carbon Dioxide (CO 2 4141) Carbon Dioxide (CO 40 2 414141) Carbon Dioxide (CO 2 41414141414141414141414 гг.0047 вода (H 2 O) . Очень важно, чтобы вы могли написать правильно сбалансированные уравнения для этих реакций, потому что они часто возникают как часть термохимических расчетов. Некоторые легче, чем другие. Например, алканы с четным числом атомов углерода немного тверже, чем с нечетным!
Пример 1: сжигание пропана
Например, с пропаном (C 3 H 8 ) вы можете сбалансировать углерод и водород, записывая уравнение. Ваш первый черновик будет:
C 3 H 8 +? O 2 → 3CO 2 +4H 2 O
Подсчет оксигены непосредственно к финальной версии:
C 3 0410404040404104040410404041040410410410410410410410404104104104041041041041041041041041041041. 5O 2 → 3CO 2 + 4H 2 O
5O 2 → 3CO 2 + 4H 2 O
Пример 2. Сжигание бутана
С бутаном (C 4 H 10 ), и водород снова запишется, как вы можете уравновесить уравнения углеродом 10 вниз.
С 4 H 10 + ?O 2 → 4CO 2 + 5H 2 O
Подсчет кислорода приводит к небольшой проблеме – 13 справа. Наличие нечетного количества кислорода на стороне продукта делает невозможным балансирование с четным числом на стороне реагента. В подобных случаях начните пытаться сбалансировать уравнение, изменив кофактор перед алканом на 2. Затем сбалансируйте углерод и водороды на стороне продукта. В этом случае число кислорода должно стать положительным, и теперь вы сможете сбалансировать уравнение.
2C 4 H 10 + 13O 2 → 8CO 2 + 10H 2 O
становится труднее получить молекулы углеводорода. Это связано с тем, что более крупные молекулы не так легко испаряются — реакция идет намного лучше, если кислород и углеводород хорошо перемешаны в виде газов. Если жидкость не очень летучая, только те молекулы, которые находятся на поверхности, могут реагировать с кислородом. Молекулы большего размера имеют большее притяжение Ван-дер-Ваальса, что затрудняет их отрыв от своих соседей и превращение в газ.
Это связано с тем, что более крупные молекулы не так легко испаряются — реакция идет намного лучше, если кислород и углеводород хорошо перемешаны в виде газов. Если жидкость не очень летучая, только те молекулы, которые находятся на поверхности, могут реагировать с кислородом. Молекулы большего размера имеют большее притяжение Ван-дер-Ваальса, что затрудняет их отрыв от своих соседей и превращение в газ.
При полном сгорании все углеводороды будут гореть синим пламенем. Однако сгорание имеет тенденцию быть менее полным по мере увеличения числа атомов углерода в молекулах. Это означает, что чем крупнее углеводород, тем больше вероятность того, что вы получите желтое дымное пламя.
Неполное сгорание
Неполное сгорание (при недостатке кислорода) может привести к образованию углерода или монооксида углерода. Проще говоря, водород в углеводороде получает первый шанс на образование воды в продукте, а углерод получает все, что осталось! Когда образуется только углерод, присутствие светящихся частиц углерода в пламени окрашивает его в желтый цвет, а в дыме часто виден черный углерод. Если некоторое количество кислорода может взаимодействовать с углеродом, но недостаточно для образования углекислого газа (CO 2 ), то монооксид углерода (CO) вырабатывается в виде бесцветного ядовитого газа.
Если некоторое количество кислорода может взаимодействовать с углеродом, но недостаточно для образования углекислого газа (CO 2 ), то монооксид углерода (CO) вырабатывается в виде бесцветного ядовитого газа.
Почему угарный газ ядовит: Кислород переносится кровью гемоглобином, белком, содержащимся в красных кровяных тельцах. Углекислый газ также связывается с гемоглобином. Гемоглобин переносит кислород из легких в каждую клетку вашего тела, где он выделяет кислород, собирает углекислый газ и переносит его обратно в легкие. Затем гемоглобин заменяет углекислый газ на кислород в воздухе, которым вы дышите. Когда вы выдыхаете, вы выделяете углекислый газ. Угарный газ также может связываться с гемоглобином. Разница в том, что монооксид углерода связывается необратимо (или очень сильно), что делает эту конкретную молекулу гемоглобина бесполезной для переноса кислорода. Если вы вдохнете достаточно угарного газа, вы умрете от внутреннего удушья!
Теплота сгорания
Теплота сгорания, ΔH c , определяется как полная энергия, выделяемая в виде тепла, когда вещество подвергается полному сгоранию с кислородом при наборе стандартных условий. Он рассчитывается так же, как и энтальпия, однако он специфичен для набора стандартных условий. Теплота сгорания является полезной величиной, поскольку это постоянная величина для типа сжигаемого материала, и ее можно использовать для сравнения эффективности и полезности различных источников топлива, наиболее часто используемых в обществе (нефть, бензин, природный газ, дизельное топливо, уголь). , древесина, водород, этанол и т. д.). В Соединенных Штатах показатели нагрева обычно указываются в британских тепловых единицах (БТЕ) на фунт материала. Обычное преобразование в метрические единицы:
Он рассчитывается так же, как и энтальпия, однако он специфичен для набора стандартных условий. Теплота сгорания является полезной величиной, поскольку это постоянная величина для типа сжигаемого материала, и ее можно использовать для сравнения эффективности и полезности различных источников топлива, наиболее часто используемых в обществе (нефть, бензин, природный газ, дизельное топливо, уголь). , древесина, водород, этанол и т. д.). В Соединенных Штатах показатели нагрева обычно указываются в британских тепловых единицах (БТЕ) на фунт материала. Обычное преобразование в метрические единицы:
БТЕ/фунт = (кДж/кг)*2,326
Теплота сгорания, ΔHc, значения общих источников топлива и связанные с ними выбросы CO2 указаны в таблице 7.5
Таблица 7.5 Теплота сгорания и выбросы CO2 Common FuelsАдаптировано из: EPA — (2014) и Википедии – Теплота сгорания
Нефть (от греческого: петра: «камень» + олеум : «нефть») представляет собой встречающееся в природе, жидкость от желтого до черного цвета, обнаруженная в геологических формациях под поверхностью Земли, которая обычно перерабатывается в различные виды топлива. Он состоит в основном из алканов, циклоалканов и алкенов различной длины и некоторых дополнительных второстепенных органических соединений. Алканы с пятью или более атомами углерода являются жидкостями и встречаются в качестве обычных компонентов нефти (также называемых сырая нефть ). Многие циклоалканы также содержатся в нефтепродуктах, включая бензин, керосин, дизельное топливо, моторное масло и многие другие тяжелые масла. С другой стороны, природный газ состоит преимущественно из метана (CH 4 ), но также содержит этан (C 2 H 6 ), пропан (C 3 H 8 ) и бутан ( С 4 Н 10 ). Природный газ также содержит следовые количества азота, двуокиси углерода (CO 2 ) и сероводорода (H 2 S).
Он состоит в основном из алканов, циклоалканов и алкенов различной длины и некоторых дополнительных второстепенных органических соединений. Алканы с пятью или более атомами углерода являются жидкостями и встречаются в качестве обычных компонентов нефти (также называемых сырая нефть ). Многие циклоалканы также содержатся в нефтепродуктах, включая бензин, керосин, дизельное топливо, моторное масло и многие другие тяжелые масла. С другой стороны, природный газ состоит преимущественно из метана (CH 4 ), но также содержит этан (C 2 H 6 ), пропан (C 3 H 8 ) и бутан ( С 4 Н 10 ). Природный газ также содержит следовые количества азота, двуокиси углерода (CO 2 ) и сероводорода (H 2 S).
Компоненты нефти разделяют по размеру с помощью метода, называемого фракционной перегонкой. Полученные образцы включают бензин с алканами длиной от пяти до десяти атомов углерода и керосин со смесью алканов длиной от десяти до семнадцати атомов углерода. Алканы с более длинными углеродными цепями встречаются в дизельном топливе, мазуте, вазелине, парафине, моторных маслах, а самая большая длина цепи используется в асфальте. Подсчитано, что в мире используется около 95 миллионов баррелей нефти каждый день! По оценкам Агентства по охране окружающей среды, каждый баррель нефти производит 0,43 метрических тонны CO 2 . Обратите внимание, что метрическая тонна эквивалентна 1000 кг. Это означает, что 40 850 000 метрических тонн CO 2 или 40 850 000 000 кг CO 2 ежедневно выбрасываются в атмосферу только в результате потребления нефти! Это почти 15 миллиардов метрических тонн CO 2 в год! Этот расчет включает только потребление сырой нефти, а не других распространенных источников топлива, таких как природный газ, уголь, древесина и возобновляемые источники энергии, такие как этанол и биодизель.
Алканы с более длинными углеродными цепями встречаются в дизельном топливе, мазуте, вазелине, парафине, моторных маслах, а самая большая длина цепи используется в асфальте. Подсчитано, что в мире используется около 95 миллионов баррелей нефти каждый день! По оценкам Агентства по охране окружающей среды, каждый баррель нефти производит 0,43 метрических тонны CO 2 . Обратите внимание, что метрическая тонна эквивалентна 1000 кг. Это означает, что 40 850 000 метрических тонн CO 2 или 40 850 000 000 кг CO 2 ежедневно выбрасываются в атмосферу только в результате потребления нефти! Это почти 15 миллиардов метрических тонн CO 2 в год! Этот расчет включает только потребление сырой нефти, а не других распространенных источников топлива, таких как природный газ, уголь, древесина и возобновляемые источники энергии, такие как этанол и биодизель.
По оценкам, в Орегоне в зимние месяцы для обогрева среднего хорошо изолированного дома требуется около 40 БТЕ в час на квадратный фут. Если бы вы владели домом площадью 2000 квадратных футов, сколько БТЕ вам потребовалось бы для обогрева собственного дома в течение 1 месяца? (примерно 31 день в месяце). Если бы у вас был выбор обогрева дома природным газом, углем (лигнитом) или дровами, сколько кг каждого из этих видов топлива потребовалось бы для обогрева вашего дома в течение одного месяца? Сколько CO2 будет производиться каждым топливом каждый зимний месяц?
Если бы вы владели домом площадью 2000 квадратных футов, сколько БТЕ вам потребовалось бы для обогрева собственного дома в течение 1 месяца? (примерно 31 день в месяце). Если бы у вас был выбор обогрева дома природным газом, углем (лигнитом) или дровами, сколько кг каждого из этих видов топлива потребовалось бы для обогрева вашего дома в течение одного месяца? Сколько CO2 будет производиться каждым топливом каждый зимний месяц?
(Вернуться к началу)
Реакции галогенирования (тип замещения)
В присутствии тепла или света алканы могут реагировать с галогенами с образованием 0 0 0 галоидалкилов).
Этот тип реакции называется реакцией замещения , потому что атом галогена занимает место (или замещает) один из атомов водорода в структуре алкана. Следует отметить, что не все галогены одинаково реагируют с алканами.- Реакция между алканами и фтором: Эта реакция взрывоопасна даже на холоде и в темноте, и вы скорее получите углерод и фтористый водород, чем желаемую реакцию замещения.
 Для химиков-органиков это не представляет особого интереса, так как реакция может быть очень опасной и не дает желаемого продукта. Например, желаемым продуктом будет алкилфторид:
Для химиков-органиков это не представляет особого интереса, так как реакция может быть очень опасной и не дает желаемого продукта. Например, желаемым продуктом будет алкилфторид:
CH 4 + F 2 → CH 3 F + HF
But the reaction goes so fast, that this is the result:
CH 4 + 2F 2 → C + 4HF
- The reaction between alkanes and iodine: Йод никак не реагирует с алканами – по крайней мере, в нормальных лабораторных условиях. Так что эта реакция тоже бесполезна.
- Реакции между алканами и хлором или бромом: В темноте реакция не идет, но при наличии света и тепла реакция даст нужные алкилгалогениды. Таким образом, мы сосредоточим наше обсуждение на реакциях галогенирования с хлором и бромом.
В присутствии пламени реакции подобны реакции с фтором – образуется смесь углерода и галогеноводорода. Интенсивность реакции значительно падает по мере перехода от фтора к хлору и к брому. Интересные реакции происходят в присутствии ультрафиолетового света (подойдет солнечный свет). Это фотохимические реакции, которые происходят при комнатной температуре. Рассмотрим реакции с хлором, хотя реакции с бромом аналогичны, но развиваются медленнее.
Интенсивность реакции значительно падает по мере перехода от фтора к хлору и к брому. Интересные реакции происходят в присутствии ультрафиолетового света (подойдет солнечный свет). Это фотохимические реакции, которые происходят при комнатной температуре. Рассмотрим реакции с хлором, хотя реакции с бромом аналогичны, но развиваются медленнее.
В реакции замещения атом водорода в метане заменяется атомом хлора. Это может происходить несколько раз, пока не будут заменены все атомы водорода. В конечном счете, чем дольше протекает реакция, тем больше атомов водорода в алкане заменяется. Таким образом, вы получите смесь хлорметана (CH 3 Cl), дихлорметана (CH 2 Cl 2 ), трихлорметана (CHCl 3 ) и тетрахлорметана (CCl 4 ).
Исходная смесь бесцветного газа (CH 4 ) и зеленого газа (Cl 2 ) должна производить пары хлористого водорода (HCl) и туман органических жидкостей (смесь хлорированного метана). Все органические продукты являются жидкими при комнатной температуре, за исключением хлорметана (CH 3 Cl), который представляет собой газ.
Все органические продукты являются жидкими при комнатной температуре, за исключением хлорметана (CH 3 Cl), который представляет собой газ.
Эта реакция замещения является примером радикальной реакции, когда за один раз переносится только один электрон. Тепло или свет инициируют реакцию, разрывая связь между двумя атомами Cl в ионе хлорида. Это образует два радикалы . Радикал – это атом, молекула или ион с неспаренными валентными электронами. Таким образом, они очень нестабильны и реактивны. На приведенной ниже диаграмме показана первая стадия реакции галогенирования. Это называется посвящением .
Реакция инициирования0040 4 ), и создать новый углеродный радикал. Эта стадия реакции называется размножением , поскольку один вид радикала создает или размножает другой радикал. Реакция распространения Для реакции метан-хлор это образование хлорметана (СН 3 кл.
 ). Реакция прекращения
). Реакция прекращения В кратчайшие сроки встречаются радикальные реакции на трех этапах:
- Инициация — , где генерируются радикальные виды, в целом тепло, свет, или другой каталитический процесс.
- Размножение — , когда одна радикальная разновидность взаимодействует с другой молекулой с образованием другой радикальной разновидности.
- Окончание – , где два радикала взаимодействуют и гасят радикальную реакцию, образуя стабильный продукт.
Как видно из примера с метаном, если вы галогенируете более крупные алканы, вы снова получите смесь стоит просто кратко взглянуть на то, что происходит, если только один из атомов водорода замещается (монозамещение) — просто чтобы показать, что все не так просто, как кажется! Например, с пропаном можно получить один из двух изомеров:
Если бы единственным фактором была случайность, вы бы ожидали получить в три раза больше изомера с хлором на конце. Есть 6 атомов водорода, которые могут быть заменены на концевых атомах углерода, по сравнению только с двумя в середине. На самом деле вы получаете примерно одинаковое количество каждого из двух изомеров. Если вы используете бром вместо хлора, большая часть продукта образуется там, где бром присоединен к центральному атому углерода. Почему это происходит?
Есть 6 атомов водорода, которые могут быть заменены на концевых атомах углерода, по сравнению только с двумя в середине. На самом деле вы получаете примерно одинаковое количество каждого из двух изомеров. Если вы используете бром вместо хлора, большая часть продукта образуется там, где бром присоединен к центральному атому углерода. Почему это происходит?
Это связано со стабильностью промежуточного углеродного радикала, который образуется во время реакции. Углерод, который имеет больше углеродных соседей, будет легче терять водород и образовывать промежуточный углеродный радикал. Соседние атомы углерода, будучи больше, чем соседние атомы водорода, могут помочь стабилизировать образование углеродного радикала. Таким образом, в реакции галогенирования третичные углероды будут наиболее реакционноспособными, за ними следуют вторичные углероды и, наконец, первичные углероды. Четвертичные углероды нереакционноспособны, так как у них нет доступных атомов водорода, которые могут быть заменены галогеном.
Реакции галогенирования с циклоалканами
Реакции циклоалканов обычно такие же, как и у алканов, с атомами водорода в циклической кольцевой структуре, замещенными атомом галогена. Например, в присутствии УФ-излучения циклопропан будет вступать в реакцию замещения с хлором или бромом точно так же, как нециклический алкан.
Однако небольшие кольцевые структуры, особенно циклопропан, также способны реагировать в темноте. В отсутствие УФ-света циклопропан может вступать в реакции присоединения, в которых цикл разрывается. Например, с бромом циклопропан дает следующее линейное соединение.
Это все еще может происходить в присутствии УФ-излучения, но вы также получите смесь реакций замещения. Кольцо сломано, потому что циклопропан сильно страдает от деформации кольца. Напомним, что валентные углы в кольце составляют 60°, а не обычное значение около 109,5°, когда углерод образует четыре одинарные связи.
Почему алканы иногда называют парафинами?
Какой галоген наиболее легко реагирует с алканами? Что реагирует наименее легко?
Алканы не реагируют со многими обычными химическими веществами. Их иногда называют парафинами, от латинского parum affinis , что означает «мало родства».
наиболее легко: F 2 ; наименее охотно: I 2
Множество интересных и часто полезных соединений содержат один или несколько атомов галогена на молекулу. Например, метан (СН 4 ) может реагировать с хлором (Cl 2 ), заменяя один, два, три или все четыре атома водорода на атомы Cl. Несколько галогенированных продуктов, полученных из метана и этана (CH 3 CH 3 ), перечислены в Таблице 7.6 вместе с некоторыми из их применений.
Для вашего здоровья: галогенированные углеводороды
) Когда-то также широко использовались канцерогены в потребительских товарах вызывать тяжелые поражения печени. Примером является четыреххлористый углерод (CCl 4 ), когда-то использовавшийся в качестве растворителя для химической чистки и в огнетушителях, но больше не рекомендуемый ни для того, ни для другого. Даже в небольших количествах его пары могут вызвать серьезное заболевание при длительном воздействии. Кроме того, он реагирует с водой при высоких температурах с образованием смертельно опасного газа фосгена (COCl 2 ), что делает использование CCl 4 в огнетушителях особенно опасным.
Этилхлорид, напротив, используется в качестве наружного местного анестетика. При распылении на кожу он быстро испаряется, охлаждая участок настолько, что он становится нечувствительным к боли. Его также можно использовать в качестве экстренного общего анестетика.
Его также можно использовать в качестве экстренного общего анестетика.
Бромсодержащие соединения широко используются в огнетушителях и в качестве антипиренов для одежды и других материалов. Поскольку они также токсичны и оказывают неблагоприятное воздействие на окружающую среду, ученые занимаются разработкой более безопасных заменителей для них, как и для многих других галогенсодержащих соединений.
Для вашего здоровья: хлорфторуглероды и озоновый слой
Алканы, замещенные атомами фтора (F) и хлора (Cl), использовались в качестве диспергирующих газов в аэрозольных баллончиках, в качестве пенообразователей для пластмасс и как хладагенты. Два наиболее известных из этих хлорфторуглеродов (ХФУ) перечислены в таблице 7.6.
Хлорфторуглероды способствуют возникновению парникового эффекта в нижних слоях атмосферы. Они также диффундируют в стратосферу, где разрушаются ультрафиолетовым (УФ) излучением с высвобождением атомов Cl. Они, в свою очередь, разрушают молекулы озона (O 3 ), которые защищают Землю от вредного ультрафиолетового излучения. Действия во всем мире привели к сокращению использования ХФУ и родственных соединений. ХФУ и другие хлор- или бромсодержащие озоноразрушающие соединения заменяются более безопасными веществами. Гидрофторуглероды (ГФУ), такие как CH 2 FCF 3 , которые не содержат Cl или Br для образования радикалов, являются одной из альтернатив. Другим примером являются гидрохлорфторуглероды (ГХФУ), такие как CHCl 2 CF 3 . Молекулы ГХФУ легче разрушаются в тропосфере, и меньше озоноразрушающих молекул достигает стратосферы.
Они, в свою очередь, разрушают молекулы озона (O 3 ), которые защищают Землю от вредного ультрафиолетового излучения. Действия во всем мире привели к сокращению использования ХФУ и родственных соединений. ХФУ и другие хлор- или бромсодержащие озоноразрушающие соединения заменяются более безопасными веществами. Гидрофторуглероды (ГФУ), такие как CH 2 FCF 3 , которые не содержат Cl или Br для образования радикалов, являются одной из альтернатив. Другим примером являются гидрохлорфторуглероды (ГХФУ), такие как CHCl 2 CF 3 . Молекулы ГХФУ легче разрушаются в тропосфере, и меньше озоноразрушающих молекул достигает стратосферы.
Крекинг Алканы
Что такое крекинг? Крекинг — это название, данное разбиению больших молекул углеводородов на более мелкие и более полезные фрагменты. Это достигается за счет использования высоких давлений и температур без катализатор или более низкие температуры и давления в присутствии катализатора . Катализатор — это вещество, которое увеличивает скорость химической реакции, не претерпевая при этом каких-либо необратимых химических изменений.
Катализатор — это вещество, которое увеличивает скорость химической реакции, не претерпевая при этом каких-либо необратимых химических изменений.
Источником больших молекул углеводородов часто является фракция нафты или фракция газойля, образующаяся при фракционной перегонке сырой нефти (нефти). Эти фракции получают в процессе дистилляции в виде жидкостей, но перед крекингом повторно испаряют в газообразную фазу. В взломщике не происходит ни одной уникальной реакции. Молекулы углеводородов распадаются довольно случайным образом, образуя смеси более мелких углеводородов, некоторые из которых имеют двойные углерод-углеродные связи. Одна возможная реакция с участием углеводорода C 15 H 32 might be:
C 15 H 32 → 2C 2 H 4 + C 3 H 6 + C 8 H 18
Or , более ясно показывающий, что происходит с различными атомами и связями:
Это только один из способов распада данной конкретной молекулы. Обратите внимание, что помимо образования более мелких алканов в результате реакции крекинга также могут образовываться алкены с двойными связями. В этом случае алкены – этен (C 2 H 4 ) и пропилен (C 3 H 6 ) – важные материалы для производства пластмасс или других органических химических веществ. Октан является одной из молекул, обнаруженных в бензине (бензине).
Обратите внимание, что помимо образования более мелких алканов в результате реакции крекинга также могут образовываться алкены с двойными связями. В этом случае алкены – этен (C 2 H 4 ) и пропилен (C 3 H 6 ) – важные материалы для производства пластмасс или других органических химических веществ. Октан является одной из молекул, обнаруженных в бензине (бензине).
Более пристальный взгляд: Алкановая основа свойств других соединений газ, растворители, пластмассы и многое другое — состоят в основном из алканов. Это понимание важно еще и потому, что оно является основой для описания свойств других семейств органических и биологических соединений. Например, большая часть структур липидов состоит из неполярных алкильных групп. Липиды включают пищевые жиры и жироподобные соединения, называемые фосфолипидами и сфинголипидами, которые служат структурными компонентами живых тканей. Эти соединения имеют как полярные, так и неполярные группы, что позволяет им ликвидировать разрыв между водорастворимыми и водонерастворимыми фазами.
 Эта характеристика необходима для избирательной проницаемости клеточных мембран. 7.5 Резюме главы
Эта характеристика необходима для избирательной проницаемости клеточных мембран. 7.5 Резюме главы Чтобы убедиться, что вы поняли материал этой главы, вам следует просмотреть значения следующих выделенных жирным шрифтом терминов в кратком изложении и спросить себя, как они связаны с темами этой главы.
Органическая химия — химия соединений углерода, а неорганическая химия — химия всех остальных элементов. Атомы углерода могут образовывать прочные ковалентные связи с другими атомами углерода и с атомами других элементов, и это свойство позволяет образовывать десятки миллионов органических соединений. Углеводороды содержат только атомы водорода и углерода.
Углеводороды, в которых каждый атом углерода связан с четырьмя другими атомами, называются алканами или насыщенными углеводородами . Они имеют общую формулу C n H 2 n + 2 . Любой данный алкан отличается от следующего в ряду единицей CH 2 . Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным множителем, называется гомологический ряд .
Любой данный алкан отличается от следующего в ряду единицей CH 2 . Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным множителем, называется гомологический ряд .
Атомы углерода в алканах могут образовывать прямые или разветвленные цепи. Два или более соединений, имеющих одинаковую молекулярную формулу, но разные структурные формулы, являются изомерами друг друга. Для трех самых маленьких алканов нет изомерных форм; начиная с C 4 H 10 , все остальные алканы имеют изомерные формы.
Циклоалканы представляют собой углеводороды, молекулы которых представляют собой замкнутые кольца, а не прямые или разветвленные цепи. А циклический углеводород представляет собой углеводород с кольцом атомов углерода.
Напомним, что структурная формула показывает все атомы углерода и водорода и то, как они связаны друг с другом. Сокращенная структурная формула показывает атомы водорода рядом с атомами углерода, к которым они присоединены. Формула линия-угол — это формула, в которой атомы углерода подразумеваются в углах и концах линий. Подразумевается, что каждый атом углерода связан с достаточным количеством атомов водорода, чтобы дать каждому атому углерода четыре связи
Формула линия-угол — это формула, в которой атомы углерода подразумеваются в углах и концах линий. Подразумевается, что каждый атом углерода связан с достаточным количеством атомов водорода, чтобы дать каждому атому углерода четыре связи
Физические свойства алканов отражают тот факт, что молекулы алканов неполярны. Алканы нерастворимы в воде и менее плотны, чем вода.
Алканы обычно не вступают в реакцию с лабораторными кислотами, основаниями, окислителями и восстановителями. Они горят (проходят реакций горения ).
Алканы реагируют с галогенами, замещая атомы водорода одним или несколькими атомами галогена с образованием галогенированных углеводородов. Эта реакция называется галогенирование . Алкилгалогенид (галогеналкан) представляет собой соединение, полученное в результате замены атома водорода алкана атомом галогена.
Более крупные алканы можно разбить на более мелкие алканы и алкены с помощью высокой температуры или катализаторов. Эти реакции называются реакциями крекинга .
Эти реакции называются реакциями крекинга .
7.6 Упражнения в конце главы
Вы нашли банку без этикетки, содержащую твердое вещество, плавящееся при 48°C. Он легко воспламеняется и легко горит. Вещество нерастворимо в воде и плавает на поверхности. Является ли вещество органическим или неорганическим?
В чем опасность проглатывания жидкого алкана?
- Различают более легкие и более тяжелые жидкие алканы с точки зрения их воздействия на кожу.
Ниже приведена линейная формула алкана. Нарисуйте сжатую структуру.
Напишите уравнения полного сгорания каждого соединения.
- бутан, C 4 H 10 (обычная жидкость для зажигалок) Октан
- , C 8 H 18 (типичный углеводород в бензине).
Плотность образца бензина составляет 0,690 г/мл.
 На основе полного сгорания октана рассчитайте количество в граммах двуокиси углерода (CO 2 ) и воды (H 2 O), образующихся на галлон (3,78 л) бензина при использовании в автомобиле.
На основе полного сгорания октана рассчитайте количество в граммах двуокиси углерода (CO 2 ) и воды (H 2 O), образующихся на галлон (3,78 л) бензина при использовании в автомобиле.Нарисуйте структуры четырех из девяти изомерных гексанов (C 7 H 16 ).
Укажите, представляют ли структуры в каждом наборе одно и то же соединение или изомеры.
Рассмотрите приведенные здесь формулы линейного угла и ответьте на вопросы.
- Какая пара формул представляет изомеры? Нарисуйте каждую структуру.
- Какая формула представляет алкилгалогенид? Напишите его сокращенную структурную формулу.
- Какая формула представляет собой циклический алкан?
- Это молекулярная формула соединения, представленного (i)?
(Вернуться к началу) 7.
 7 Ссылки
7 Ссылки Текст для этой главы был адаптирован из ресурсов Creative Commons, перечисленных ниже, если в тексте не указано иное.
- Органическая химия (2016) Libretexts, UC Дэвис, Лицензия: Creative Commons Attribution-Noncommercial-Share Alike 3.0 United States License. Доступно по адресу: https://chem.libretexts.org/Core/Organic_Chemistry
- Ингалант. (2017, 12 февраля). В Википедии, Свободной энциклопедии . Получено 01:21, 13 февраля 2017 г., с https://en.wikipedia.org/w/index.php?title=Inhalant&oldid=765135147 .
- Аноним. (2012) Введение в химию: общая, органическая и биологическая (V1.0). Опубликовано Creative Commons by-nc-sa 3.0. Доступно по адресу: http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/index.html .
- Физическая и теоретическая химия (2017) Libretexts, UC Дэвис, Лицензия: Creative Commons Attribution-Noncommercial-Share Alike 3.0 United States License. Доступно по адресу: https://chem.
 libretexts.org/Core/Physical_and_Theoretical_Chemistry/Chemical_Bonding/General_Principles_of_Chemical_Bonding/Bond_Energies.
libretexts.org/Core/Physical_and_Theoretical_Chemistry/Chemical_Bonding/General_Principles_of_Chemical_Bonding/Bond_Energies. - Нефть. (2017, 14 февраля). В Википедии, Свободной энциклопедии . Получено 06:29, 16 февраля 2017 г., с https://en.wikipedia.org/w/index.php?title=Petroleum&oldid=765440823 .
- Болл, Д.В., Хилл, Дж.В., и Скотт, Р.Дж. (2016) КАРТА: Основы общей, органической и биологической химии . Свободные тексты. Доступно по ссылке: https://chem.libretexts.org/Textbook_Maps/Introductory_Chemistry_Textbook_Maps/Map%3A_The_Basics_of_GOB_Chemistry_(Ball_et_al.)
Стехиометрическая конверсия метана в этан с использованием фотохимической петли при температуре окружающей среды
%PDF-1.4
%
1 0 объект
>
эндообъект
10 0 объект
/Заголовок
/Предмет
/Автор
/Режиссер
/CreationDate (D:20221002013418-00’00’)
/CrossMarkDomains#5B1#5D (springer.com)
/CrossMarkDomains#5B2#5D (springerlink.com)
/Ключевые слова ()
/ModDate (D:20201218142133+01’00’)
/doi (10. 1038/s41560-020-0616-7)
>>
эндообъект
2 0 объект
>
эндообъект
3 0 объект
>
эндообъект
4 0 объект
>
эндообъект
5 0 объект
>
эндообъект
6 0 объект
>
эндообъект
7 0 объект
>
ручей
приложение/pdfdoi:10.1038/s41560-020-0616-7
1038/s41560-020-0616-7)
>>
эндообъект
2 0 объект
>
эндообъект
3 0 объект
>
эндообъект
4 0 объект
>
эндообъект
5 0 объект
>
эндообъект
6 0 объект
>
эндообъект
7 0 объект
>
ручей
приложение/pdfdoi:10.1038/s41560-020-0616-7
 com
com adobe.com/xap/1.0/mm/xmpMMXMP Схема управления мультимедиа
adobe.com/xap/1.0/mm/xmpMMXMP Схема управления мультимедиа MajorVersionDateText
MajorVersionDateText Если в качестве требуемого dc:identifier используется альтернативный уникальный идентификатор, то DOI следует указывать как голый идентификатор только в пределах prism:doi.
Если необходимо указать URL-адрес, связанный с DOI, то prism:url можно использовать вместе с prism:doi для предоставления конечной точки службы (т. е. URL-адреса).
текст
Если в качестве требуемого dc:identifier используется альтернативный уникальный идентификатор, то DOI следует указывать как голый идентификатор только в пределах prism:doi.
Если необходимо указать URL-адрес, связанный с DOI, то prism:url можно использовать вместе с prism:doi для предоставления конечной точки службы (т. е. URL-адреса).
текст

 10.2020 XLIII Турнир Ломоносова задания и ответы
10.2020 XLIII Турнир Ломоносова задания и ответы 12.17 Ответы и задания по русскому языку 11 класс СтатГрад варианты РЯ10701-РЯ10702
12.17 Ответы и задания по русскому языку 11 класс СтатГрад варианты РЯ10701-РЯ10702 10.17 Физика 11 класс СтатГрад задания и ответы варианты ФИ10101-ФИ10104
10.17 Физика 11 класс СтатГрад задания и ответы варианты ФИ10101-ФИ10104 10.2017 Обществознание 11 класс работа СтатГрад задания и ответы ОБ10101-ОБ10104
10.2017 Обществознание 11 класс работа СтатГрад задания и ответы ОБ10101-ОБ10104 09.2017 Биология 9 класс тренировочная работа «СтатГрад» БИ90101-БИ90104 ответы и задания
09.2017 Биология 9 класс тренировочная работа «СтатГрад» БИ90101-БИ90104 ответы и задания 09. Математика 10 класс задания и ответы
09. Математика 10 класс задания и ответы 09 Входная контрольная работа русский язык 7 класс для 56 региона задания и ответы
09 Входная контрольная работа русский язык 7 класс для 56 региона задания и ответы 10 Задания и ответы олимпиады по литературе 7-11 класс муниципальный этап 2017
10 Задания и ответы олимпиады по литературе 7-11 класс муниципальный этап 2017 09.17 Математика 11 класс мониторинговая работа ЕГЭ 3 варианта задания и ответы
09.17 Математика 11 класс мониторинговая работа ЕГЭ 3 варианта задания и ответы 04.2019
04.2019 11.17 Математика 9 класс работа «СтатГрад» задания и ответы варианты МА90201-МА90204
11.17 Математика 9 класс работа «СтатГрад» задания и ответы варианты МА90201-МА90204 11
11 09.2017 Варианты и ответы контрольной работы математика 8 класс для 56 региона
09.2017 Варианты и ответы контрольной работы математика 8 класс для 56 региона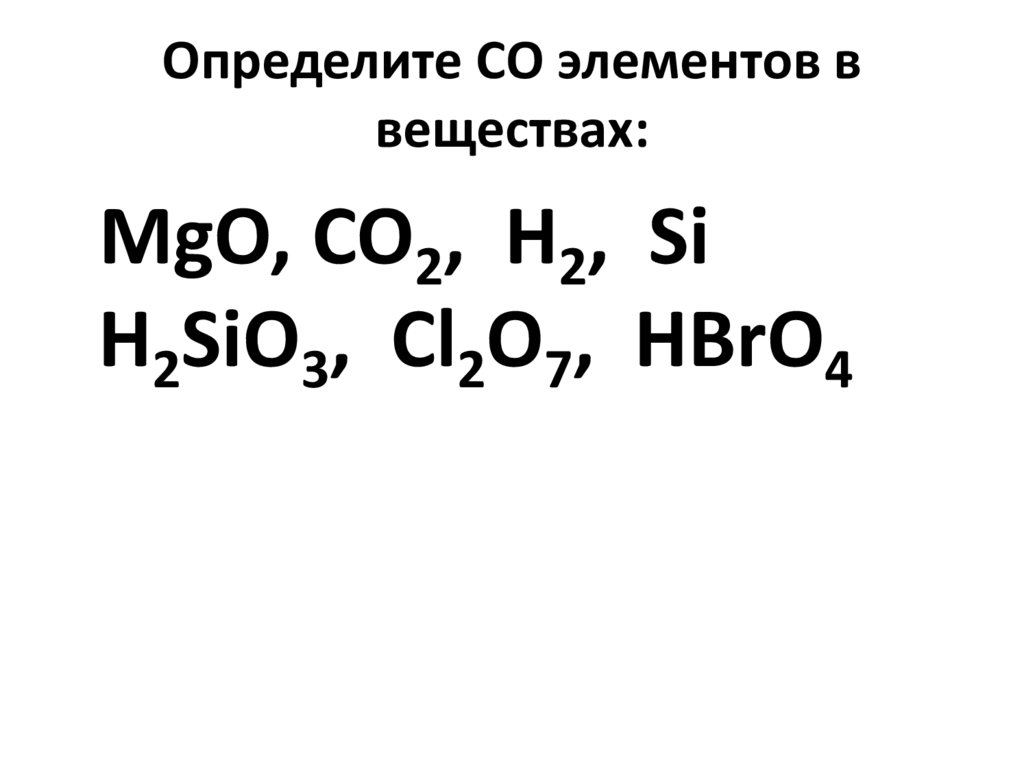 10.2018
10.2018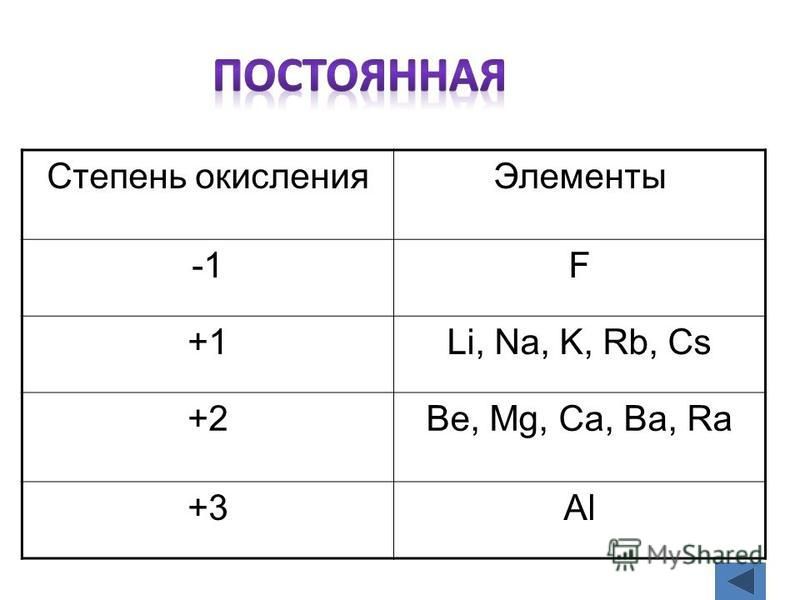 05
05 05
05 05
05 Я
Я П
П В. Быкову
В. Быкову яз 18.11
яз 18.11 12
12 11
11 03
03 04
04 12.2018
12.2018 04
04 05
05 03.2018
03.2018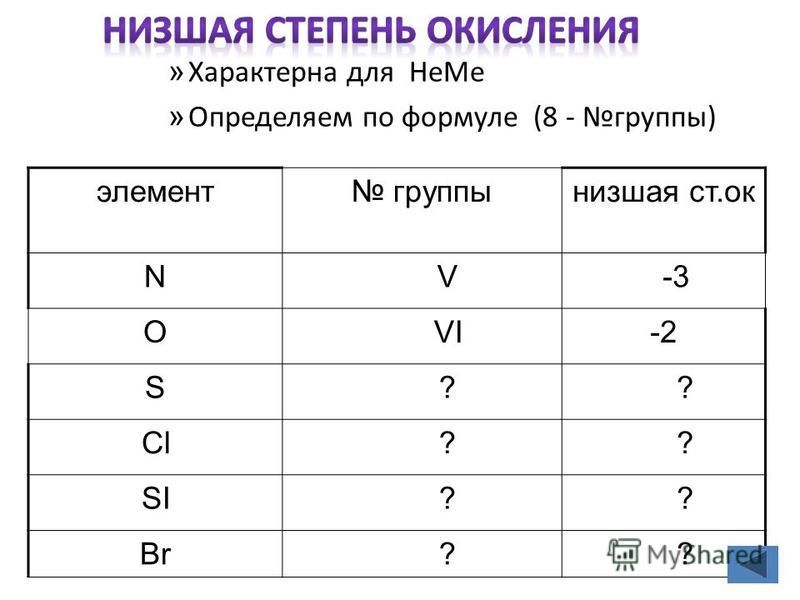 03.2018
03.2018 04
04 02
02 12.2018
12.2018 03
03 03.2019
03.2019 04.2018
04.2018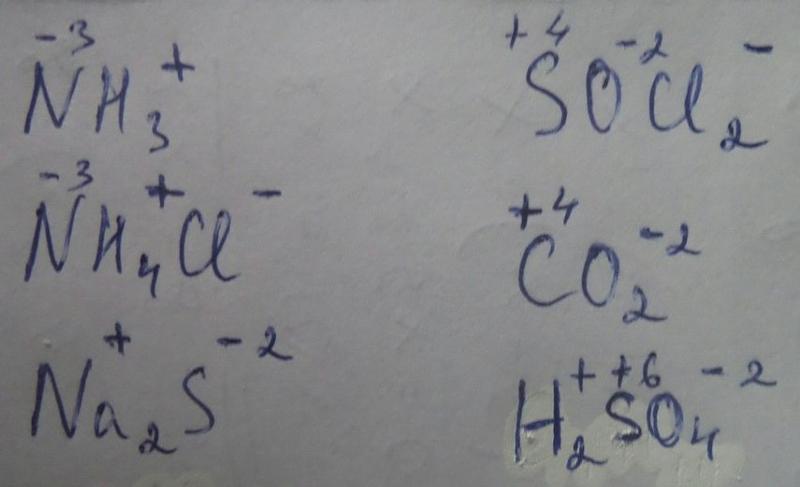 04.2018
04.2018 09
09 04.18
04.18 04.18
04.18 04.18
04.18 12.2018
12.2018 05
05 02
02 02
02 05
05 11.2018
11.2018 09
09 05 ответы
05 ответы 12.2018
12.2018 05
05 03
03 03.2020 XLII Заключительный тур Ломоносова по биологии задания и ответы
03.2020 XLII Заключительный тур Ломоносова по биологии задания и ответы 04
04 05 СтатГрад ответы
05 СтатГрад ответы
 Мы могли бы использовать одиночную пару либо на O, либо на Cl. Поскольку мы видели много структур, в которых O образует двойную связь, но ни одной с двойной связью с Cl, разумно выбрать неподеленную пару из O, чтобы получить следующее:
Мы могли бы использовать одиночную пару либо на O, либо на Cl. Поскольку мы видели много структур, в которых O образует двойную связь, но ни одной с двойной связью с Cl, разумно выбрать неподеленную пару из O, чтобы получить следующее: Почему?
Почему?

 Для реакции между каждой парой элементов предскажите, какой элемент является окислителем, какой элемент является восстановителем, и окончательную стехиометрию образовавшегося соединения.
Для реакции между каждой парой элементов предскажите, какой элемент является окислителем, какой элемент является восстановителем, и окончательную стехиометрию образовавшегося соединения. Укажите формальные заряды всех неводородных атомов как в правильных, так и в неправильных структурах.
Укажите формальные заряды всех неводородных атомов как в правильных, так и в неправильных структурах. Используя аргументы, основанные на формальных зарядах, объясните, почему наиболее вероятной структурой является структура с тремя одинарными связями B–Cl.
Используя аргументы, основанные на формальных зарядах, объясните, почему наиболее вероятной структурой является структура с тремя одинарными связями B–Cl.

 Конечная стехиометрия K 2 S.
Конечная стехиометрия K 2 S. Приемлемая структура Льюиса
Приемлемая структура Льюиса Структуры Льюиса, которые минимизируют формальные заряды, как правило, имеют самую низкую энергию, что делает структуру Льюиса с двумя двойными связями S=O наиболее вероятной.
Структуры Льюиса, которые минимизируют формальные заряды, как правило, имеют самую низкую энергию, что делает структуру Льюиса с двумя двойными связями S=O наиболее вероятной. is?
is? д.). (примечание: это также эквивалентно эффективному заряду ядра Z eff , числу протонов, которые «видит» электрон на валентной орбитали из-за экранирования электронами внутренних оболочек.)
д.). (примечание: это также эквивалентно эффективному заряду ядра Z eff , числу протонов, которые «видит» электрон на валентной орбитали из-за экранирования электронами внутренних оболочек.)  Вы по-прежнему должны знать, что они там есть, и добавлять столько водородов, сколько необходимо, чтобы получить полный октет (или секстет, если это карбокатион).
Вы по-прежнему должны знать, что они там есть, и добавлять столько водородов, сколько необходимо, чтобы получить полный октет (или секстет, если это карбокатион).  Всегда. [Примечание 2 – ОК, два исключения ]
Всегда. [Примечание 2 – ОК, два исключения ] Предположим, что кислород и азот имеют полные октеты! [Примечание 2]
Предположим, что кислород и азот имеют полные октеты! [Примечание 2]