Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Химическое соединение массой 100 г, состоящее из атомов двух элементов, содержит 34.
Рассчитайте количество теплоты, выделившееся при сжигании некоторого объема анилина, если продукты его сгорания создают при температуре 25 °С в
Решено
гидролиз sbcl3+h3o
Структурная формула всех изомеров С7Н16
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
Пользуйтесь нашим приложением
kno3 caso4 fe(oh)3 mg co2 n2o5
Химия, 30.07.2019 02:00, virudskaya
Всего ответов: 3
Посмотреть ответы
Другие вопросы по Химии
Химия, 02.03.2019 01:30, kseniatrof
Запишіть реакцію перетвореня кальцій гідрогенкарбонату в кальцій карбонат.
Ответов: 3
Посмотреть
Химия, 02.03.2019 04:10, Aleijv
Определите массы 20%-ного раствора и воды, необходимых для приготовления 600г 8%-ного раствора.
Ответов: 3
Посмотреть
Химия, 02.03.2019 15:50, sesew228
1)уравнение реакции разложения: а. cao+sio2=casio3 б. 2h3+o2=2h3o в. fes+2hci=fecl2+h3s г.2kno3=2kno2+o2 2.сумма всех коэффициентов в уравнении реакции, схема которой ca+> cacl2+h3 равна: а.3, б.4, в.5 г.7 3)схема, являющаяся уравнением рекции: а. cac2+> ca(oh)2+c2h3 б. ca+>
cao в. mg+> mgcl2+h3 г. cu+> cuo
Ответов: 2
Посмотреть
Химия, 02.03.2019 17:30, Принцеска96
Яким було б життя, якби люди не знали хімію?
Ответов: 4
Посмотреть
Химия, 02.03.2019 18:30, astahovanadezh
Написать структурную формулу 1) 2,3-диметилбутадиен-1,3 2) 3,4-диэтилгексин-1
Ответов: 2
Посмотреть
Химия, 02.03.2019 20:20, НастяО11
1)как нужно изменить концентрацию веществ, температуру и давление реакции синтеза йодоводорода: н2(газ)+i2(газ)=2hi+q что бы сместить вправо? 2)выберете уравнения обратимых реакций, в которых изменение давления не вызовет
 3 график которой проходит через точку м (1.-1)…
3 график которой проходит через точку м (1.-1)…Русский язык, 11.06.2019 10:30
Существительное+существительное вид словосочитаний….
Русский язык, 11.06.2019 10:30
Какая грамматическая основа в предложении: в ночной тишине леса то и дело слышались шорохи, шелест листьев, потрескивание веток….
История, 11.06.2019 10:30
Сочинение на тему письмо родителям умоляю завтроо надо…
Алгебра, 11.06.2019 10:30
Решить уравнение 3х + 4 = 2х — 2 _ 3…
Химия, 11.06.2019 10:30
Одинаковую или разную массу имеют 3,01×10²³ молекул водорода истолько же молекул кислорода? ответ подтвердите расчетом…
Алгебра, 11.06.2019 10:30
Надо. в первый день отряд км во второй на b км меньше, а в третий день 80% пути, пройденного в первый день. какой путь туристы, если a=30,b=5…
Русский язык, 11.06.2019 10:30
Определить падеж слов в предложениях снег , ветер, день дует холодный снег..трудно теперь птицам и ,целый день ищут они пищу. ….
….
Математика, 11.06.2019 10:30
Всреднем сердце человека делает 75 ударов в минуту сколько ударов делает сердце в течение суток сколько литров крови оно перекачивает за 1 мин. если сердце перекачивает за сутки 86…
Математика, 11.06.2019 10:30
Как записать в столбик пример 960-640: (4+4)умножить на 2…
Больше вопросов по предмету: Химия Случайные вопросы
Определение, правила, способы определения и примеры
- Что такое число окисления
- Правила числа окисления [1-6]
- Как найти число окисления
- Часто задаваемые вопросы
Что такое число окисления 9 00113 Число окисления 9 это число, которое присваивается атому, чтобы указать его состояние окисления или восстановления во время химической реакции. Каждому атому в окислительно-восстановительной реакции присваивается степень окисления, чтобы понять его способность отдавать, принимать или делиться электронами. Он показывает общее количество электронов, которые были удалены или присоединены к элементу, чтобы получить его нынешнее состояние.
 Например, в Fe 2 O 3 , степень окисления Fe +3, а FeO +2. Потеря электронов соответствует увеличению степени окисления. С другой стороны, прирост электронов соответствует уменьшению степени окисления [1-4] .
Например, в Fe 2 O 3 , степень окисления Fe +3, а FeO +2. Потеря электронов соответствует увеличению степени окисления. С другой стороны, прирост электронов соответствует уменьшению степени окисления [1-4] .Правила номеров окисления
[1-6]Чтобы присвоить номера окисления атомам, мы должны следовать набору правил.
1. Степень окисления элемента в свободном состоянии равна нулю.
Пример : Степень окисления Zn, Al, H 2 , O 2 и Cl 2 равна нулю
2. Степень окисления одноатомного иона такая же, как и заряд иона.
Пример : Степень окисления Na + равна +1, Mg 2+ равна +2, Al 3+ равна +3, Cl -1 равна -1, и O 2- это -2.
3. Сумма всех степеней окисления в нейтральном соединении равна нулю. Сумма всех степеней окисления многоатомного иона равна заряду иона.
Пример : В Fe 2 O 3 степень окисления Fe равна +3, а степень окисления O равна -2. Сумма всех степеней окисления: +3 x 2 + (-2) x 3 = 0. Результат ожидается, поскольку Fe 2 O 3 является нейтральным.
4. Степень окисления щелочного металла в соединении +1, щелочноземельного металла в соединении +2.
Пример : В NaCl Na является щелочным металлом, и его степень окисления равна +1. В MgO Mg является щелочноземельным металлом, и его степень окисления равна +2.
5. Степень окисления кислорода в соединении обычно равна -2. Однако, если кислород относится к категории соединений, называемых пероксидами, его степень окисления равна -1. Если кислород связан с фтором, число равно +1 или +2, в зависимости от соединения.
Пример : Степень окисления O в H 2 O равна -2, в H 2 O 2 равна -1, в OF 2 равна +2, а в O 2 F 2 равно +1
6. Степень окисления водорода в соединении обычно равна +1. В случае бинарного гидрида металла степень окисления равна -1.
Степень окисления водорода в соединении обычно равна +1. В случае бинарного гидрида металла степень окисления равна -1.
Пример : Степень окисления H равна +1 в H 2 O и -1 в NaH.
7. Степень окисления фтора всегда равна -1.
Пример : Степень окисления F в NaF равна -1.
8. Хлор, бром и йод обычно имеют степень окисления -1, если они не связаны с кислородом или фтором.
Пример : Степень окисления Cl в NaCl равна -1, в ClO 2 равна +4, а в FCl равна +1.
Степень окисленияКак найти степень окисления
Степень окисления атома в ионе или соединении можно определить, используя приведенные выше правила. Давайте посмотрим на несколько примеров [1-6] .
1. Серная кислота (H
2 SO 4 ) Степень окисления водорода (H) и кислорода (O) равна +1 и -2 соответственно. Серная кислота является нейтральным соединением.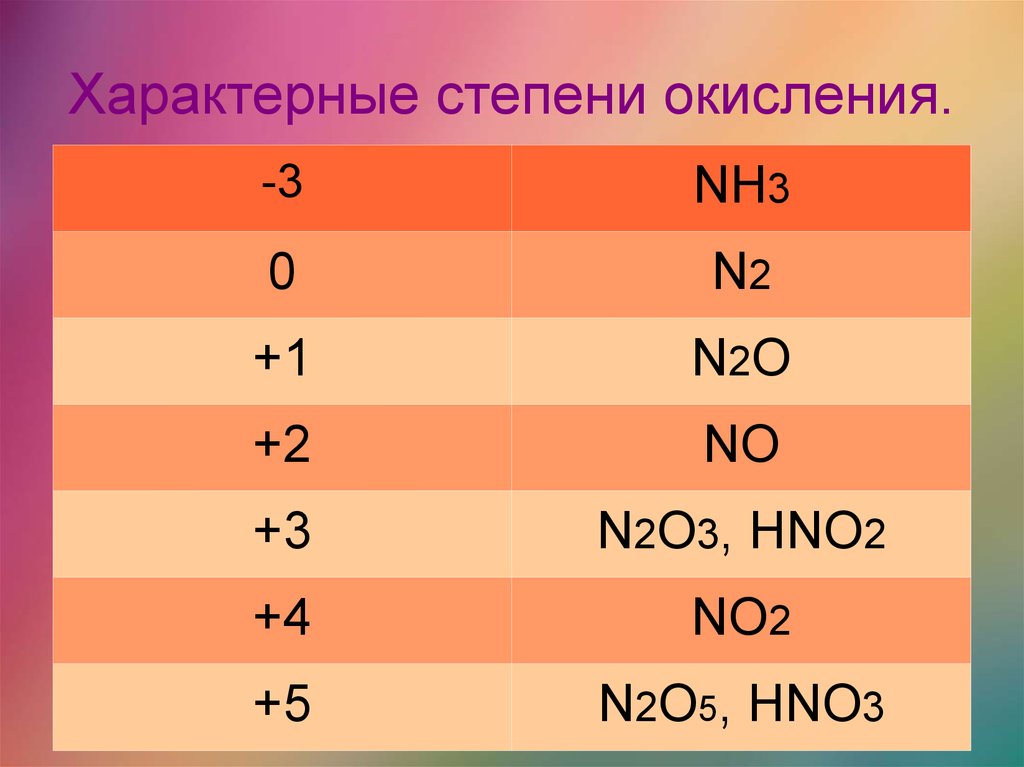 Пусть x будет степенью окисления серы (S). Следовательно,
Пусть x будет степенью окисления серы (S). Следовательно,
(+1) х 2 + х + (-2) х 4 = 0
Или 2 + х – 8 = 0
Или, x = +6
2. Азотная кислота (HNO
3 )Степени окисления водорода (H) и кислорода (O) равны +1 и -2 соответственно. Азотная кислота является нейтральным соединением. Пусть x будет степенью окисления азота (N). Следовательно,
+1 + x + (-2) x 3 = 0
Или +1 + x – 6 = 0
Или, x = +5
3. Перманганат калия (KMnO
4 )Степень окисления калия (К) равна +1, а кислорода (О) равна -2. КМно 4 представляет собой нейтральное соединение. Пусть x будет степенью окисления магния (Mn). Следовательно,
+1 + x + (-2) x 4 = 0
Или +1 + x – 8 = 0
Или, x = +7
4. Дихромат-ион (Cr
2 O 7 2- ) Дихромат представляет собой комплексный ион. Степень окисления кислорода (O) равна -2. Заряд Cr 2 O 7 2- равен -2. Пусть x будет степенью окисления хрома (Cr).
Пусть x будет степенью окисления хрома (Cr).
2x + (-2) x 7 = -2
Или, 2x -14 = -2
Или, x = +6
5. Карбонат (CO
3 2- )Степень окисления кислорода (O) равна -2, а заряд CO 3 2- это -2. Пусть x будет степенью окисления углерода (O). Следовательно,
х + (-2) х 3 = -2
Или, х – 6 = -2
Или, х = +4
6. Фосфит (PO
3 3- ) Степень окисления кислорода (O) равна -2 и заряд PO 3 3- это -3. Пусть x будет степенью окисления фосфора (P). Следовательно,x + (-2) x 3 = -3
Или, x – 6 = -3
Или, x = +3
7. Перхлорат калия (KClO
4 )Степени окисления калия (K) и кислорода (O) равны +1 и -2 соответственно. Пусть x будет степенью окисления хлора (Cl). KClO 4 представляет собой нейтральное соединение. Следовательно,
+1 + х + (-2) х 4 = 0
Или 1 + х – 8 = 0
Или, x = +7
8.
 Нитрат калия (KNO 3 )
Нитрат калия (KNO 3 )Степень окисления калия (K) и кислорода (O) равна +1 и -2 соответственно. KNO 3 представляет собой нейтральное соединение. Пусть x будет степенью окисления азота (N). Следовательно,
+1 + x + (-2) x 3 = 0
Или 1 + x – 6 = 0
Или x = +5
На следующем рисунке показана диаграмма, состоящая из степеней окисления элементы периодической таблицы [7].
Периодическая таблица со степенями окисленияЧасто задаваемые вопросы
Q.1. В чем разница между валентностью и степенью окисления?
Ответ. Разница между валентностью и степенью окисления заключается в том, что валентность — это максимальное количество электронов, которое атом может отдать, принять или разделить, чтобы стать стабильным. Напротив, степень окисления — это количество электронов, которые атом может отдать или принять для образования связи с другим атомом.
Q.2. Почему элементы d-блока имеют переменную степень окисления?
Ответ. D-блок или трансляционные элементы имеют неполные d- и s-подоболочки. Валентные электроны присутствуют в обеих этих подоболочках. Именно по этой причине они могут образовывать различные степени окисления.
References
- Chem.libretexts.org
- Chemistrytalk.org
- Khanacademy.org
- Mccord.cm.utexas.edu
- Courses.lumenlearning.com
- Chemguide.co.uk
- Internetchemistry. ком
Нитрат калия | Определение, формула, использование и факты
нитрат калия
См. все носители
- Связанные темы:
- селитра нитрат
См. всю соответствующую информацию →
нитрат калия (KNO 3 )
 Использование нитрата калия включает производство удобрений, пестицидов, стекла, фейерверков, взрывчатых веществ и ракетного топлива. Он также используется в качестве пищевого консерванта, а при добавлении к мясу вызывает реакцию между миоглобином и гемоглобином в крови, в результате чего мясо приобретает красный цвет. Он также используется в качестве добавки в некоторые зубные пасты для снижения чувствительности зубов. Нитрат калия токсичен для человека в больших количествах, поэтому его использование тщательно контролируется, когда речь идет о потреблении человеком.
Использование нитрата калия включает производство удобрений, пестицидов, стекла, фейерверков, взрывчатых веществ и ракетного топлива. Он также используется в качестве пищевого консерванта, а при добавлении к мясу вызывает реакцию между миоглобином и гемоглобином в крови, в результате чего мясо приобретает красный цвет. Он также используется в качестве добавки в некоторые зубные пасты для снижения чувствительности зубов. Нитрат калия токсичен для человека в больших количествах, поэтому его использование тщательно контролируется, когда речь идет о потреблении человеком. Он встречается в нечистой форме, часто называемой селитрой (также называемой селитрой), его название происходит от латинских слов sal patrae , означающих «соль скалы», так как он часто встречается в виде белого вещества, отложившегося на поверхность скал. Селитра может образовываться на поверхности почвы в различных местах с теплым климатом, в том числе в Египте, Испании и Иране. В таких местах фекалии, моча и гниющие растения вступают в реакцию с влагой и щелочной почвой с образованием нитратов.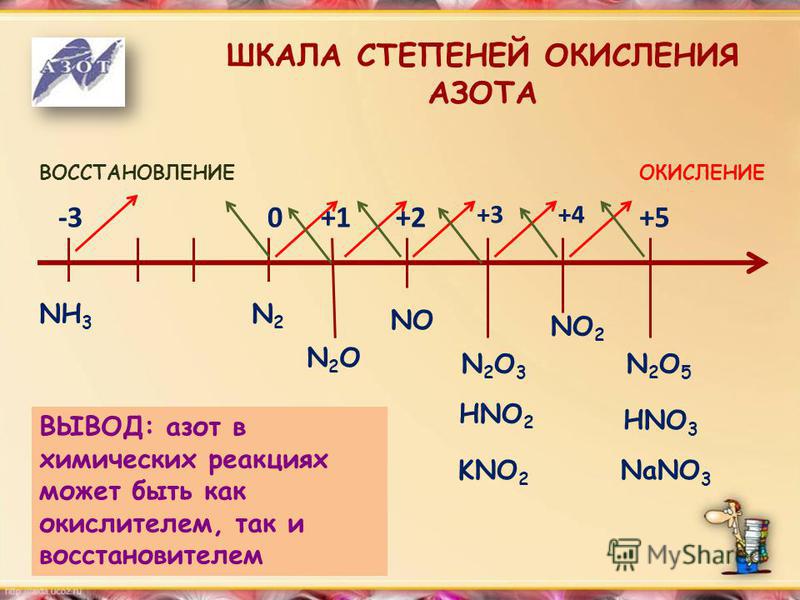 Эти нитраты растворяются в дождевой воде, и при испарении этой воды остаются белые отложения нитрата калия. Многие пещеры по всему миру имеют большие залежи селитры из-за большого количества гуано и мочи летучих мышей, найденных там.
Эти нитраты растворяются в дождевой воде, и при испарении этой воды остаются белые отложения нитрата калия. Многие пещеры по всему миру имеют большие залежи селитры из-за большого количества гуано и мочи летучих мышей, найденных там.
История и производство
В 9 веке китайские химики обнаружили, что смесь нитрата калия, серы и древесного угля может самопроизвольно образовывать дым и пламя. К 11 веку китайцы включали смесь, порох, в дымовые шашки, чтобы помочь отбиваться от врагов, а в 13 и 14 веках они использовали эту взрывную силу, чтобы метать предметы во врагов с помощью оружия.
Исторически сложилось так, что в Соединенных Штатах с начала до середины 19 века в пещерах в Кентукки, Теннесси и Западной Вирджинии широко добывалась селитра, которая использовалась для производства пороха. По мере открытия новых областей применения нитрата калия спрос на это химическое соединение возрастал. Возросший спрос переместил его производство из пещер, где можно было производить лишь ограниченное количество химикатов, в промышленные лаборатории с гораздо более высокими производственными возможностями. Наиболее распространенный метод промышленного производства использует хлорид калия в реакции двойного замещения азотной кислотой.
Наиболее распространенный метод промышленного производства использует хлорид калия в реакции двойного замещения азотной кислотой.
Химические свойства
Нитрат калия имеет молярную массу 101,10 грамм на моль. Он имеет температуру кипения 400 ° C (752 ° F), точку плавления 334 ° C (633 ° F) и плотность 2,11 грамма на кубический сантиметр при 25 ° C (70 ° F). Он растворим в воде в количестве 38,3 г на 100 миллилитров при 25 ° C, но лишь незначительно растворим в большинстве спиртов. Он нерастворим в этаноле.
Хотя нитрат калия сам по себе не является горючим, он ускоряет горение горючих материалов. Нитрат калия является сильным окислителем и при нагревании разлагается на нитрит калия и кислород, что способствует процессу горения во взрывчатых веществах. По этой причине нитрат калия называют окислителем. Он имеет множество применений, в том числе в производстве удобрений, лекарств, пороха, фейерверков и взрывчатых веществ.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.

 11.16
11.16