Окислительно- восстановительные процессы — презентация онлайн
1. Окислительно- восстановительные процессы
Окислительновосстановительныепроцессы
2. Что читать?
• А.П. Чупахин«ИОННЫЕ ПРОЦЕССЫ В ВОДНЫХ РАСТВОРАХ
ЧАСТЬ 2»
НГУ, 2015
• И.В. Морозов, А.И. Болталин, Е.В. Карпова ,
«ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ»
Москва, МГУ, 2003
• http://www.chem.msu.su/rus/teaching/karpova/okisl-vosst.pdf
3. ОВР = окислительно- восстановительные реакции
ОВР = окислительновосстановительные реакции• Окислительно-восстановительные
реакции (ОВР) – это такие химические
реакции,
в
которых
происходит
передача электронов от одних частиц
(атомов, молекул, ионов) к другим, в
результате чего степень окисления
атомов, входящих в состав этих частиц,
изменяется.
4. Важные понятия!
• Степень окисления (СО) – формальный заряд,который можно приписать атому, входящему в
состав какой-либо частицы (молекулы, иона),
исходя из предположения о чисто ионном
характере связи в данной частице (частица
состоит из ионизированных атомов).

СО – формальная величина. Истинные заряды атомов редко
Следует помнить,
величина СО
выражается
не в в
превышают
±1.2. Такчто
например,
согласно
расчёту,
кулонах,
а в количестве
отданных (принятых)
комплексном
катионе
[Cr(h3O)6]3+ эффективные
заряды атомов
Заряд
одного
равен –1.60218·10Cr, электронов.
H, O составляют
+2.12,
+0.59.электрона
-1.03, соответственно.
19Кл.
5. Важные понятия!
• Окислитель (Ox) – частица, которая в ходе ОВРприобретает электроны.
• Восстановитель (Red) – частица, которая в ходе
ОВР отдаёт электроны.
6. Важные понятия!
• Восстановление – процесс, в ходе которогоокислитель
приобретает
электроны и переходит в
•Окислитель
– восстанавливается
сопряжённую восстановленную форму.
•Восстановитель
– окисляется
• Окисление
– процесс, в ходе
которого
восстановитель отдаёт электроны и переходит в
сопряжённую окисленную форму.

7. Важные понятия!
• В любой ОВР всегда принимаютучастие две пары конкурирующих за
электроны сопряженных окислителей
и восстановителей (редокс пары)
8. Правила расчета степени окисления
предпочтениеотдают
элементу, который
Правила
расчета
степени
окисления
располагается в таблице выше
Сумма СО всех атомов в частице равна
заряду этой частицы (в простых
веществах СО всех атомов равна 0).
В соединениях более
электроотрицательным атомам
соответствует более низкая СО.
Атомы, приведённые в таблице, в
большинстве своих соединений
проявляют постоянную СО. При
определении СО предпочтение отдают
элементу, который располагается в
таблице выше. Например, в CaO2:
СО(Сa)= +2, СО(О)= -1.
Максимальная СО равна номеру группы
(короткий вариант ПС), кроме элементов,
входящих в VIIIБ и IБ-подгруппы, и
некоторых f-элементов. Минимальная СО
неметаллов = Nгруппы-8. Например: Mn7+,
P5+, P3-, S6+, S2-.
CO
Щелочные мет.
+1
Be, Mg, Ca, Sr, Ba, +2
Zn, Cd
F
-1
H
+1, -1
O
-2
Cl, Br
-1
B, Al, Ga, In, Sc,
Y, La b и
больш.
лантоноидов
+3
9. Уравнивание ОВР
• Электронный баланс.• Метод полуреакций.
Разберем на примерах.
10. Алгоритм метода электронного баланса
• Найти атомы у которых меняютсястепени окисления.
• Уровнять электронный баланс.
(умножить на коэффициент атом,
меняющий СО, который равен
количеству переданных электронов
сопряженным атомом)
• Уровнять материальный баланс.
11. FeSO4 + KMnO4 + h3SO4 → Fe2(SO4)3 + MnSO4 + KHSO4
2+6+ 2-
+ 7+
2-
+ 6+ 2-
3+
6+ 2-
2+ 6+ 2-
+ + 6+ 2-
FeSO4 + KMnO4 + h3SO4 → Fe2(SO4)3 + MnSO4 + KHSO4
Найти степени окисления всех атомов!
• Fe2+
• Mn7+
→
→
-e
+ 5e
+9
x5
x1
→ 55 Fe2(SO4)3 + 21 MnSO4 + 2 KHSO4
10
5 FeSO4 + 2
1 KMnO4 + 9h3SO4
10
Fe3+
Mn2+
=
19 = 5×3 +
+16
8 H+2O
2×1
2×1
2
18
18-2 = 16
10 x 4 + 2 x 4 + 9 x 4 = 84
5 x 3 x 4 + 2 x 4 + 2 x 4 + 16
8 xx11==84
92
12.
 CoS + O2 → Co3O4 + SO22+ 2-
CoS + O2 → Co3O4 + SO22+ 2-0
8/3+ 2-
+4 2-
3 CoS + 5 O2 → 1 Co3O4 + 3 SO2
X4
x1• Co2+
2
S
x20
x5
• O0
→
→
→
— 2/3e
— 6e
+ 2e
Co8/3+
S4+
O2-
X3
X3
X2
3Co2+ + 3 S2- — 20e
→ 3Co8/3+ + 3 S4+
O2
→ 2O2-
+ 4e
13. CoS + O2 → Co3O4 + SO2
3 CoS CoS1 CoO•Co
+ + 5O
O22 →→ Co
SO
3 2 + 3 SO2
3O 4 + 2O
Co3O4 = CoO•Co2O3
• S2-
-e
— 6e
→
→
Co3+
S4+
X2
• O0
+ 2e
→
O2-
X2
Co2+
X3
2Co2+ + 3S2-
-20e →
2Co3+ + S4+
X1
O2
+4e →
2O2-
X5
14. Метод полуреакций
• Найти атомы у которых меняютсястепени окисления.
• Составить (а лучше выписать из
справочника) полуреакции.
• Уровнять электронный баланс.
• Уровнять материальный баланс,
добавляя сопряженные ионы.
15. Na2SO3 + Na2Cr2O7 + h3SO4 → Na2SO4 + Cr2(SO4)3 + h3O
Na2SO3 +Na2Cr2O7 +
h3SO4 →
Na2SO4 +
Cr2(SO4)3 +
H 2O
• Для составления полуреакций в водной
среде необходимо оперировать
частицами H+, OH-, h3O
Cr2O72- + 14 H+ +6e
→ 2Cr3+
+14OH7
Cr2O72- + 14h3O + 6e
+ 7 H 2O
+14OH —
→
2Cr3+ + 7h3O + 14OH-
Na2SO3 +
h3SO4 →
Na2Cr2O7 +
• Cr2O72- + 14H+ + 6e
• SO32- + h3O
— 2e
3SO3
2-
6Na+
3Na2SO3 +
+
2-
Cr2O7 +
2Na+
8
14H+
1Na2Cr2O7 +
Cr2(SO4)3 +
H 2O
→ 2Cr3+ + 7h3O X1
→ SO42- + 2H+ X3
+ 3h3O →
6H+
4SO42-
Na2SO4 +
3SO4 +
2-
→ 6Na+
4h3SO4 →
4Na2SO4 +
2Cr3+ +
2Na+
4
7h3O +
4SO42-
1Cr2(SO4)3 + 4 h3O
17.
 Диспропорционирование КопропорционированиеCl+
Диспропорционирование КопропорционированиеCl+Cl2
Cl-
Cl2 + 2KOH = KClO + KCl + h3O
KClO + 2HCl = Cl2 + KCl + h3O
18. Электрохимия
• Характерная особенность ОВР, отличающая этотвид химических реакций от других, состоит в том, что
процессы окисления и восстановления можно
пространственно разделить
CuSO4 + Zn → Cu + ZnSO4
19. Вперед – гальванический, Назад — электролитический
• Если ОВР в электрохимической цепи протекаетсамопроизвольно, то такая цепь называется
гальваническим элементом.
• Гальванические элементы находят применение в
качестве химических источников тока.
• Если ОВР идёт под внешним воздействием в
направлении, противоположном самопроизвольному,
то такая электрохимическая цепь называется
электролитической ячейкой. В ней протекает
электролиз.
20. Классификация ХИТов
ХИТ = химический источник тока• гальванические элементы (первичные ХИТ), которые
из-за необратимости протекающих в них реакций,
невозможно перезарядить;
• электрические аккумуляторы (вторичные ХИТ) —
перезаряжаемые гальванические элементы, которые
с помощью внешнего источника тока (зарядного
устройства) можно перезарядить;
• топливные элементы (электрохимические
генераторы) — устройства, подобные
гальваническому элементу, но отличающееся от него
тем, что вещества для электрохимической реакции
подаются в него извне, а продукты реакций
удаляются из него, что позволяет ему
функционировать непрерывно.

21. Измерение ЭДС
• Электрический потенциал – работавнешних электростатических сил по
перемещению единичного заряда из точки с ϕ
= 0 в данную точку
• (Абсолютные потенциалы измерить
невозможно.
• Разность потенциалов можно определить
экспериментально. Так, электродвижущая
сила (ЭДС) элемента Cu/Zn, измеренная при
стандартных условиях:
E = ϕ(Cu2+/Cu0) – ϕ (Zn2+/Zn0) = 1.1 В.
22. ЭДС и работа(энергия)
• При взаимодействии 1 моль Zn и 1 моль CuSO4переносится n = 2 моль электронов, система
совершает работу Аэ/х= Q·E = n·e·NA·E (где Q=
n·e·NA – общий заряд n моль электронов,
прошедших от анода к катоду, e – заряд одного
электрона, NA – число Авогадро) :
Аэ/х = n·F·E
• Число Фарадея F — это фундаментальная
постоянная, равная заряду одного моля электронов.
F = e·NA = 1.60218·10-19Кл·6.022045·1023моль-1 =
96484.6 Кл/моль ≈ ≈ 96500 Кл/моль
23. ЭДС и энергия Гиббса
• ΔG = -Аэ/х• ΔG = -n·F·ΔE
Определение направления
процесса
• ΔG < O
• ΔE > O
Процесс разрешен (идет
прямо, идет слева направо)
24.
 Установление «нуля»мне точку
Установление «нуля»мне точкуи
2H+ + 2e«Дайте
= h3
Eo = опоры
0
я переверну Землю»
АРХИМЕД
Archimedes
ок. 287 — 212 до н.э.
Греческий механик,
физик, математик, инженер
25. Пример определения направления процесса
• 2FeCl3 + Cu→ CuCl2 + 2FeCl2
• 2Fe3+ + Cuo
→ Cu2+
+ 2Fe2+
• Ox1
+ Red2
→ Ox2
+ Red1
• E = E(Fe3+/Fe2+) – E(Cu2+/Cu0)
• Fe3+ + e
→ Fe2+ E0 = 0.77 В
0
0
= ϕ(Ox1/Red1 ) –→
ϕ (OxCu
• Cu2+ +E 2e
2/Red2) E = 0.34 В
• Е0 = 0,77 — 0,34 = 0,43 В > O
+/H )) – (ϕ (Ox /Red ) — ϕ (H+/H ))
E• = Реакция
(ϕ(Ox1/Redпойдет
)
–
ϕ
(H
прямо
при стандартных
1
2
2
2
2
условиях
E = E(Ox1/Red1 ) – E (Ox2/Red2)
26. Энергия Гиббса и К
2FeCl3 + Cu
→ CuCl2 + 2FeCl2
Е0 = 0,77 — 0,34 = 0,43 В
ΔG0 = -nFE0 = — 2 x 96500 x 0.43 = -83,0 кДж/моль
K = exp(- ΔG0/RT)=exp(nFE0/RT)=3.6*1014
Величина (RT)/F = const, от натурального логарифма
удобно перейти к десятичному (lnK=2.
 303lgK)
303lgK)E0
= 0.059/n * lgK
K = 10
nE0/0.059
RT
0.0592 = 2.303*
F
27. Расчет неизвестного E0, исходя из известных E0
ΔG1 = -n1FE1• A + n1 e = B
• B + n2 e = C
ΔG2 = -n2FE2
A +(n1+n2) = C ΔG3 = ΔG1 + ΔG2 = -n1FE1 – n2FE2 = -n3FE3
n1FE1 + n2FE2 = n3FE3
n1E1 + n2E2 = (n1+ n2)E3
E3 =
n1E1 + n2E2
n1 + n 2
28. Пример расчета Е0
3IO- + 3h3O + 4e
3I- 2e
IO- + h3O + 2e
3IO- + 3h3O + 6e
→ I3- + 6OH→ I 3→ I- + 2OH→ 3I- + 6OH-
E10 = -0.55
E20 = 0.49
E20 = 0.49
4 E0(иск) = 2*-0,55 +6*(0,49)
E0(иск) = (-2*0,55 +6*(0,49))/4 = 0,46В
1. Знак перед коэффициентом, указывающим количество электронов не
важен. Важно количество электронов. Мы уже поменяли знак у Е.
2. При умножении реакции (полуреакции) на любой множитель E не
меняется. Меняется ΔG0 , K.
29. Диаграмма Латимера
Wendell Mitchell Latimer,1893-1955
Professor of Chemistry
UC Berkeley
30.
 Диаграмма ЛатимераMn
Диаграмма ЛатимераMnMnO4
2+ Mn2+ + 2e = Mn
4+ MnO2 + 2e + 4H+ = Mn2+ + 2h3O 0,02
6+ MnO42 + 2e + 4H+ = MnO2 + 2h3O
6+ MnO42 + 2e + 2h3O = MnO2 + 4OH
7+ MnO4 + 5e + 8H+ = Mn2+ + 4h3O
7+ MnO4 + 3e + 4H+ = MnO2 + 2h3O
7+ MnO4 + 3e + 2h3O = MnO2 + 4OH
* 2 = 1.69 * 3
7+ 0.56
MnO4* +1e+= 2.26
MnO42
—
1,19
1,23
2,26
0,6
1,51
1,69
0,60
0,56
0,56
2,26 = X * 4 1,23
-1,19
22+
2
*
1,23
+
2
*
-1,19
→ MnO4
→ MnO2 → Mn → Mn0
X = (2*1,23
1,69 – 2*1,19)/4 = 0,02
В кислой среде (Н+)
В щелочной (ОН-)
Не зависит от рН
Диаграмма Латимера
Mn
2+ +2 2e
1.Mn
MnO
+ 4e
+ 4H+
=
Mn0 + 2h3O
=
Mn
2+2.
4H+2O 2+=
4H+ + 4Oh3e + 4H = Mn + 2h3O 0
2 ++
MnO
4e +2h3O =
Mn + 4Oh5+3.MnO
2
— 0,27
2 + 2e + 4H+ = MnO + 2H O
MnO
4
2
2
6+
MnO42 + 2e + 2h3O = MnO2 + 4OH
6+
7+ MnO4 + 5e + 8H+ = Mn2+ + 4h3O
+ 3e + 4H+ = MnO + 2H O
MnO
4
2
2
7+
7+ MnO4 + 3e + 2h3O = MnO2 + 4OH
+ e = MnO 2
MnO
4
7+
2 * X + 2 * (-1,55)4 = 4*(-0,91)
ΔG3 = ΔG1+ ΔG2 = -nFE + ΔG2
0,56
0,6= — 0,27
-14/55,6)
= -0,91*2+1,55
ΔG2 =
-RTlnK
= -8,31*298*4*ln(10
-X
2-
MnO4
→
MnO4
→
MnO2 →
1,19
1,23
2,26
0,6
1,51
-0,91
1,69
0,60
0,56
-1,55
Mn(OH)2 → Mn0
ΔG3 = -4*96500*0,02 — 8,31*298*4*ln(10-14/55,6) = 351400 Дж
E3 = -ΔG3/nF0,60
= -351400/(4*96500)= -0.
 91
91В щелочной (ОН-)
32. Диспропорционирование Копропорционирование по диаграмме Латимера
MnO4—
0,56
→
MnO4
2-
2,26
→
1,23
MnO2 →
Mn2+
-1,19
→ Mn0
1,69
E = 2.26 – 0.59 = 1.6 > 0
E = 1.23 – 2.26 = -1.06 < 0
33. Как при помощи Е рассчитывают ПР (KL) ?
ПР(HgS) = 4*10-53
C(Hg2+)=C(S2-)= 6.3*10-27 М
В одном литре находится 1/1000 иона.
Современные самые точные методы
позволяют обнаруживать С=10-9 М
34. Как при помощи Е рассчитывают ПР (KL) ?
Хлорсере́бряный электро́д (ХСЭ)благодаря стабильности потенциала и
простоте конструкции является одним из
наиболее часто употребляемых в
лабораторной практике электродов
сравнения. Представляет собой
серебряную пластинку или проволочку,
покрытую слоем
малорастворимой соли серебра (обычно
— хлорида) и опущенной в
насыщенный раствор хлорида калия.
Каломельный электрод
35. Как при помощи Е рассчитывают ПР (KL) ?
HgHg2+ + 2e = Hg
0,85
2+ +12e
-nFE3Hg
= -nFE
+ ΔG
= 22Hg
0,79
2
ΔGискомое
–E
Дж
3) =2+2*96500*(0.
 85-(-0.7))= 2992000,91
85-(-0.7))= 2992000,912Hg=2+nF(E
+ 2e1 =
Hg
2
0/RT) = exp(-299200/(8.31*298))
K = exp(= 3.4*10-53
HgSΔG
+ 2e
= Hg + S2
0,7
Hg2Cl2 + 2e = 2Hg + 2Cl
0,27
Hg2I2 + 2e = 2Hg + 2I
0,04
Hg2+ + 2e = Hg
HgS = Hg2+ + S2-
E0 = 0.85
ΔG = неизвестно
HgS + 2e = Hg + S2 E0 = -0,7
36. Уравнение Нернста
Вальтер Герман НернстWalther Hermann Nernst,
1864, — 1941
Лауреат Нобелевской премии
37. Уравнение Нернста
• Электрохимический вариант уравненияизотермы химической реакции.
• ΔG = ΔG0 + RTlnП
• E = E0 –
RT
nF
lnП = E0 –
0,059
n
lg П
38. Зависимость Е от рН.
Одним из наиболее важных факторов,влияющих на величину электродного
потенциала, является кислотность
среды (рН). Особенно чувствительны к
величине рН электродные потенциалы
пар, включающих оксоанионы.
Например, для пары бромат-ион – бром:
BrO3- + 6H+ + 5e ↔ ½ Br2 + 3 h3O
39.
 Определение диапазона рН, в котором будет копропорционировать бром:BrO3- + 5Br — + 6H+ ↔ 3Br2 + 3h3O
Определение диапазона рН, в котором будет копропорционировать бром:BrO3- + 5Br — + 6H+ ↔ 3Br2 + 3h3O— + 6H+ + 5e ↔ ½ Br + 3 H O
BrO3Копропорционировать
2
это 2…
½ Br2 + e ↔ Br-
Eo = 1.52 В
Eo = 1.07 В
Диспропорционировать это …
pH = 6.4
1. Горение (полное окисление)
Спирты горят на воздухе с выделением большого количества тепла. С увеличением массы углеводородного радикала – пламя становится всё более коптящим.
При сгорании спиртов выделяется большое количество тепла:
Благодаря высокой экзотермичности реакции горения этанола, он считается перспективным и экологически чистым заменителем бензинового топлива в двигателях внутреннего сгорания. В этом случае энергия химических связей переходит в тепловую энергию, а затем в механическую, что позволяет двигаться автомобилям. В лабораторной практике этанол применяется как горючее для «спиртовок».
2. Неполное окисление
1). В присутствии окислителей [O] – K2Cr2O7 или KMnO4 спирты окисляются до карбонильных соединений:
Первичные
спирты при окислении образуют альдегиды,
которые затем легко окисляются до
карбоновых кислот.
При окислении вторичных спиртов образуются кетоны.
Например:
Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с меньшей молекулярной массой).
Качественные реакции на спирты
1. Окисление спиртов дихроматом (Na2Cr2o7) или перманганатом (кMnО4)
Качественная реакция на первичные и вторичные спирты!
В кислой среде
Окисление Na2Cr2O7
Для первичных и вторичных одноатомных спиртов качественной реакцией является взаимодействие их с раствором дихромата натрия. Для повышения скорости реакции ее проводят при нагревании, для создания кислой среды добавляют серную кислоту.
Первичные
спирты окисляются
дихроматом натрия до альдегидов.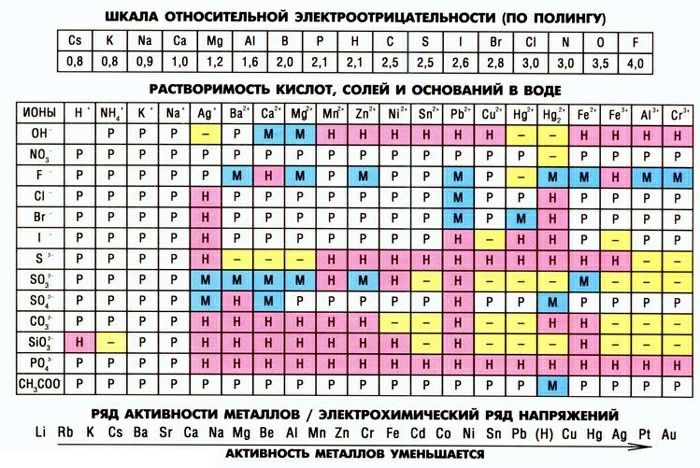
Растворы дихроматов имеют оранжевый цвет и содержат хром в степени окисления +6. В кислой среде они переходят в растворы солей хрома в степени окисления +3 и приобретают зеленый цвет.
На изменении цвета соединений хрома также основана работа алкотестеров, когда пары спирта, содержащиеся в выдыхаемом водителем воздухе, восстанавливают дихромат в стеклянной трубочке.
Вторичные спирты окисляются дихроматом натрия до кетонов.
Третичные спирты в реакции с дихроматами не вступают.
Окисление KМnO4
Т.к. перманганат калия в кислой среде более сильный окислитель, чем дихромат, то окисление спирта не останавливается на стадии альдегида и продолжается дальше до карбоновой кислоты.
Раствор
перманганата калия содержит марганец
в степени окисления +7 и имеет
розово-фиолетовый цвет. Если спирт взять
в достаточном количестве, то произойдет
обесцвечивание раствора. В кислой среде
марганец перейдет в степень окисления
+2.
Также как и дихроматом натрия, перманганатом калия вторичные спирты могут окисляться до кетонов. Далее возможна деструкция, т.е. разрушение органической молекулы и получение смеси веществ, которые не имеют практического применения.
В жёстких условиях с перманганатом калия третичные спирты окисляются с расщеплением связей С-С и образованием смеси веществ.
Метиловый спирт окисляется перманганатом калия до углекислого газа.
Какова степень окисления подчеркнутых атомов в следующих веществах: (a) Na(2)Cr(2)O(7) (b) Na(3)PO(4)
Вопрос
Обновлено:10/ 05/2021
AAKASH INSTITUTE ENGLISH-REDOX REACTIONS-Try Yourself
20 видеоРЕКЛАМА
लिखित उत्तर
0 Проверено экспертами
0 (03a) +0
015 (b) +5
Был ли этот ответ полезен?
986
Расшифровка
Привет всем, ежегодный вопрос, какова степень окисления подчеркнутого атома в блоге, это ошибка, что основной атом — это хром, и здесь, на этом форуме, поэтому мы должны вычислить в единицах и в сети к cr2 O7 София, чтобы рассчитать атомную степень окисления CR, чтобы мы знали, что заряд энергии + 1, поэтому мы пишем здесь, чтобы в работу, потому что я президент натрия, атом натрия — это наш подарок, пусть это будет хром BF, поэтому советы и мы знаем что окисление а -2 советская 7 в минус 2 и напряжение равно нулю так вот оно 2х равно минус 14 + 2 равно минус 12 2008 на 2012 и значит х равно 6 значит
номер станции хрома плюс 6 башня-б то есть Nh4 по тяжелому узнать степень окисления госпиталя в а + 1 х х и кислород и минус 4 х минус 2 в 4 так что здесь 3 х равно минус b + 3 x минус 5 равно вам, поэтому здесь равно плюс 5, поэтому степень окисления спасибо
Ab Padhai karo bina ads ke
Khareedo DN Pro и dekho sari videos bina kisi ad ki rukaavat ke!
संबंधित वीडियो
Что происходит при окислении фенола Na_(2)Cr_(2)O_(7)//H_(2)SO_(4)?
41275913
Какова степень окисления подчеркнутых атомов в следующих соединениях:
(a) Na2Cr2O7
(b) Na3PO4 B)→Na2Cr2O7
Na2Cr2O7+XΔ−−→Cr2O3
Cr2O3+YΔ−−→Cr
)+(B)→Na2Cr2O7
Na2Cr2O7+XΔ−−→Cr2O3
Cr2O3+YΔ−−→Cr
(X) и (Y):
1356
Na2CrO4+HCl→h3Cr2O7+Na2SO4
140291589
FeCr2O4+NaOH+воздух→(A)+Fe2O3
(A)+(B)→Na2Cr2O7
Na2Cr2O7+X+ΔCr−−→Cr21O3
Соединения (A) и (B):
357211196
FeCr2O4+NaOH+воздух→(A)+Fe2O3
(A)+(B)→Na2Cr2O7
Na2Cr2O7+XΔ−−→Cr2O3
+Y Cr2O3 −→Cr
(X) и (Y):
357211202
Na2CrO4+HCl→h3Cr2O7+Na2SO4
357213620
Найти степень окисления Cr в Na2Cr2O7
427761517
Текст Раствор
FeCr_(2)O_(4)+NaOH+»воздух» в (A)+Fe_(2)O_(3)(A)+(B) в Na_(2)Cr_(2) )O_(7) Na_(2)Cr_(2)O_(7)+X смещен(Delta) в Cr_(3),O_(3) Cr_(3)+Y(Delta) в Cr Соединения (A) и ( B) являются:
628566253
FeCr2O4+NaOH+воздух→(A)+Fe2O3(A)+(B)→Na2Cr2O7
Na2Cr2O7+XΔ−−→Cr3,O3Cr3+Y(Δ)→Cr
(X) и (Y) составляют:
628566256
Что происходит, когда фенол окисляется Na2Cr2O7/h3SO4?
642519966
Что такое степень окисления? Укажите рабочие правила, используемые для расчета степени окисления атома в данном веществе. Рассчитайте степень окисления S в Na_(2)S,Na_(2)SO_(3),Na_(2)SO_(4),Na_(2)S_(2)O_(3) и Na_(2)S_( 4)О_(6) .
Рассчитайте степень окисления S в Na_(2)S,Na_(2)SO_(3),Na_(2)SO_(4),Na_(2)S_(2)O_(3) и Na_(2)S_( 4)О_(6) .
643550124
FeCr_(2)O_(4)+NaOH+»воздух» в (A)+Fe_(2)O_(3) (A)+(B) в Na_(2)Cr_(2)O_(7) ) Na_(2)Cr_(2)O_(7)+X избыточно (Delta) в Cr_(2)O_(3) Cr_(2)O_(3)+Y избыточно (Delta) в соединение Cr (A) и ( B) являются:
644083865
FeCr2O4+NaOH+воздух→(A)+Fe2O3
(A)+(B)→Na2Cr2O7
Na2Cr2O7+X∆−−→Cr2O3
Cr2O3+Y∆−−→Cr
(X) и (Y) представляют собой:
644083866
Na2CrO4+HCl→9O2Cr2O7 2 644084360
T3DB: бихромат натрия
| Информация о записи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Версия | 2.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Дата создания 13 Дата создания 13 2009-03-26 21:21:31 UTC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Дата обновления | 2014 -12-24 20:22:38 UTC | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Регистрационный номер | T3D0711 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Обозначение | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Общее название | Дихромат натрия | 0136 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Описание | Дихромат натрия представляет собой химическое соединение натрия и шестивалентного хрома. Он образуется при переработке хромовой руды и может быть использован в органическом синтезе. Шестивалентный хром относится к химическим соединениям, содержащим элемент хром в степени окисления +6. Хром (VI) более токсичен, чем другие степени окисления атома хрома, из-за его большей способности проникать в клетки и более высокого окислительно-восстановительного потенциала. (6, 9) Он образуется при переработке хромовой руды и может быть использован в органическом синтезе. Шестивалентный хром относится к химическим соединениям, содержащим элемент хром в степени окисления +6. Хром (VI) более токсичен, чем другие степени окисления атома хрома, из-за его большей способности проникать в клетки и более высокого окислительно-восстановительного потенциала. (6, 9) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тип соединения |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Химическая структура | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Синонимы |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Химическая формула| Средняя молекулярная масса | 261,968 г/моль | Масса моноизотопа | 261,825 г/моль | Регистрационный номер CAS | 6 19103-10589-01-01 28 | Название ИЮПАК | тетраоксо-2,4,6-триокса- 3,5-дихрома-1,7-дисодагептан | Традиционное название | тетраоксо-2,4,6-триокса-3,5-дихрома-1,7-дисодагептан | SMILES | [Na]O[Cr](=O)(=O )O[Cr](=O)(=O)O[Na] | Идентификатор ИнЧИ | ИнЧИ=1S/2Cr. |  2Na.7O 2Na.7O Ключ ИнЧИ | 0136 | Химическая таксономия | Описание | принадлежит к классу неорганических соединений, известных как разные хроматы. Это неорганические соединения, в которых наибольшим металлическим оксоанионом является хромат, с которым либо не связан атом, либо атом неметалла. | Королевство | Неорганические соединения | Суперкласс | Смешанные соединения металлов и неметаллов | Класс | смешанные металлы 90-30 131 | Подкласс | Прочие оксоанионные соединения металлов | Прямые родительские компоненты | Прочие хроматы | Альтернативные родительские компоненты |
Заместители |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 1
1 1
1 02.2019
02.2019 Было показано, что он вызывает канцерогенез за счет чрезмерной стимуляции клеточных регуляторных путей и повышения уровня перекиси путем активации определенных митоген-активируемых протеинкиназ. Он также может вызывать репрессию транскрипции за счет перекрестного связывания комплексов гистондеацетилазы 1-ДНК-метилтрансферазы 1 с хроматином промотора CYP1A1, ингибируя модификацию гистонов. Хром может повышать собственную токсичность, модифицируя фактор транскрипции 1, регулирующий металл, вызывая ингибирование транскрипции металлотионеина, индуцированной цинком. (1, 6, 2, 3, 4)
Было показано, что он вызывает канцерогенез за счет чрезмерной стимуляции клеточных регуляторных путей и повышения уровня перекиси путем активации определенных митоген-активируемых протеинкиназ. Он также может вызывать репрессию транскрипции за счет перекрестного связывания комплексов гистондеацетилазы 1-ДНК-метилтрансферазы 1 с хроматином промотора CYP1A1, ингибируя модификацию гистонов. Хром может повышать собственную токсичность, модифицируя фактор транскрипции 1, регулирующий металл, вызывая ингибирование транскрипции металлотионеина, индуцированной цинком. (1, 6, 2, 3, 4) Внутри клетки шестивалентный хром восстанавливается сначала до пятивалентного, а затем до трехвалентного хрома многими веществами, включая аскорбат, глутатион и никотинамидадениндинуклеотид. Хром практически полностью выводится с мочой. (1, 6)
Внутри клетки шестивалентный хром восстанавливается сначала до пятивалентного, а затем до трехвалентного хрома многими веществами, включая аскорбат, глутатион и никотинамидадениндинуклеотид. Хром практически полностью выводится с мочой. (1, 6) Хроническое вдыхание особенно связано с раком легких. Также известно, что шестивалентный хром вызывает дефекты репродуктивной функции и развития. (1)
Хроническое вдыхание особенно связано с раком легких. Также известно, что шестивалентный хром вызывает дефекты репродуктивной функции и развития. (1) pdf
pdf