Примеры решения задач — HimHelp.ru
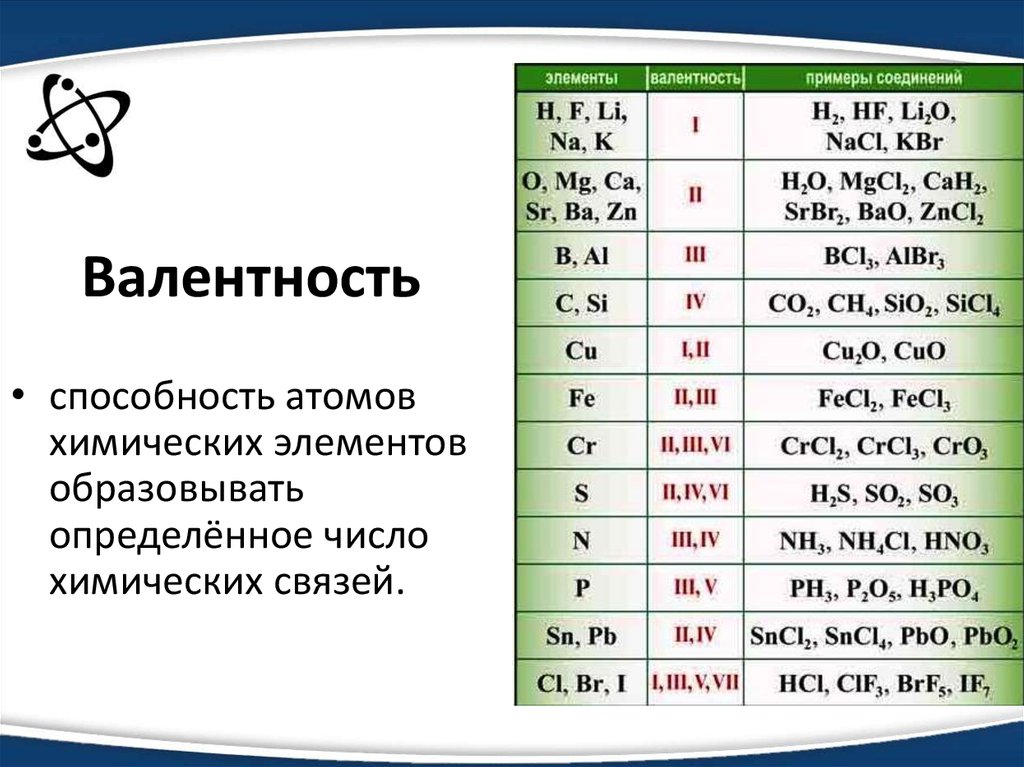
Задача 1. Определите, как изменяется прочность соединений в ряду: HF, НСl, НВr, HI.
Решение. У этих двухатомных молекул прочность связи зависит от длины связи. А поскольку радиус атома при переходе от фтора к иоду возрастает, то длина связи Н — галоген в этом направлении возрастает, т.е. прочность соединений при переходе от фтора к иоду уменьшается.
Задача 2. Сколько электронов и протонов содержат следующие молекулы и ионы: а) AlH4— ; б) NF3?
Решение
а) Число протонов в атоме элемента равно порядковому номеру элемента, поэтому атом алюминия содержит 13 протонов, атом водорода — один протон. Всего в ионе содержится 17 протонов. Заряд иона равен -1, поэтому число электронов на единицу превышает число протонов и равно 18.
б) Атом азота содержит 7 протонов, атом фтора — 9 протонов. Всего в молекуле NF3 содержится 7+3•9 = 34 протона. Заряд молекулы равен 0, поэтому число электронов равно числу протонов.
Ответ. а) 17 протонов, 18 электронов; б) 34 протона, 34 электрона.
Задача 3. Каковы валентность и степень окисления азота: а) в азотной кислоте; б) в хлориде аммония?
Решение.
а) Структурную формулу азотной кислоты иногда изображают с пятивалентным азотом следующим образом:
O
//
H - O - N
\\
O
В действительности, пятивалентный азот не существует, поскольку для этого атом азота должен иметь пять неспаренных электронов.
Распаривание 2s-электронов азота требует очень большой затраты энергии и практически не происходит. Атом азота в азотной кислоте имеет валентность IV. Три ковалентные связи N-О образованы за счет неспаренных электронов, и одна — за счет неподеленной пары электронов азота. Структурную формулу азотной кислоты можно писать так:
O
/
H - O - N
\\
O
где стрелочка обозначает донорно-акцепторную связь. Степень окисления водорода равна +1, кислорода -2, а сумма степеней окисления атомов в молекуле равна 0, поэтому на долю атома азота приходится условный заряд +5.
Степень окисления водорода равна +1, кислорода -2, а сумма степеней окисления атомов в молекуле равна 0, поэтому на долю атома азота приходится условный заряд +5.
б) Валентность азота в ионе равна IV. Три ковалентные связи N-Н образованы за счет неспаренных электронов азота, и одна — за счет неподеленной пары электронов.
Степень окисления водорода равна +1, а сумма степеней окисления атомов в ионе равна заряду иона (-1), поэтому на долю атома азота приходится условный заряд -3.
Ответ. а) валентность IV, степень окисления +5. б) валентность IV, степень окисления -3.
Задача 4. Определите степени окисления элементов в следующих соединениях: К2MnО4; Ba(ClO3)2; F2O; Ca(NO2)2; H2SiF6; H2
Решение. Используем следующие правила определения степеней окисления: 1) сумма степеней окисления атомов в молекуле равна 0; 2) степень окисления Н равна +1 в соединениях с неметаллами; 3) степень окисления О равна -2, кроме соединений со фтором и перекисных соединений; 4) степень окисления F фтора равна -1; 5) степень окисления металла равна заряду иона металла. Используя эти правила, находим:
Используя эти правила, находим:
1) K2MnO4: K+1, Mn+6, O-2;
2) Ba(ClO3)2: Ba+2, Cl+5, O-2;
3) F2O: F-1, O+2;
4) Ca(NO2)2: Ca+2, N+3, O-2;
5) H2SiF2: H+1, Si+4, F -1;
6) H2O2: H+1, O-1;
7) Cr2(SO4)3: Cr+3, S+6, O-2.
Задача 5. Приведите структурную формулу 3-аминобензойной кислоты. Укажите характер химических связей, валентности и степени окисления элементов.
Решение. Все связи в молекуле 3-аминобензойной кислоты — ковалентные полярные, кроме связей С-С в бензольном кольце, которые являются ковалентными неполярными:
Валентности элементов равны: С — IV, О — II, Н — I, N — III. Степени окисления: Н+1, О-2, N-3. Степени окисления атомов углерода различны. Атомы С в бензольном кольце при связях С-Н имеют степень окисления -1 (т.к. углерод — более электроотрицательный элемент, чем водород), атом С при связи С-N имеет степень окисления +1 (азот более электроотрицателен, чем углерод), атом С при связи С-С — степень окисления 0 (связь между одинаковыми атомами). Наконец, атом С в группе СООН связан тремя связями с более электроотрицательными атомами О и имеет степень окисления +3.
Степени окисления: Н+1, О-2, N-3. Степени окисления атомов углерода различны. Атомы С в бензольном кольце при связях С-Н имеют степень окисления -1 (т.к. углерод — более электроотрицательный элемент, чем водород), атом С при связи С-N имеет степень окисления +1 (азот более электроотрицателен, чем углерод), атом С при связи С-С — степень окисления 0 (связь между одинаковыми атомами). Наконец, атом С в группе СООН связан тремя связями с более электроотрицательными атомами О и имеет степень окисления +3.
Степень — окисление — азот
Cтраница 3
Тетраоксид азота и диоксид азота, являясь кислотными оксидами, реагируют со щелочами, при этом получают две соли, в одной из которых степень окисления азота 5 — нитрат, в другой 3 — нитрит. [31]
Отсюда видно, что в результате реакции восстанавливается лишь часть азотной кислоты, другая часть ее идет на образование нитрата меди ( II) без изменения степени окисления азота. [32]
[32]
Отсюда видно, что в результате реакции восстанавливается лишь часть азотной кисло ] ы, другая часть ее идет на образование нитрата меди ( П) без изменения степени окисления азота. [33]
Гидроксиламин Nh3OH рассматривают как продукт замещения гидроксогруппой атома водорода в молекуле аммиака. Степень окисления азота в нем равна — 1, поэтому гидроксиламин может проявлять как окислительные, так и восстановительные свойства, но последние выражены сильнее. Азот гидроксиламина имеет неподеленную электронную пару и может играть роль донора. Поэтому гидроксиламин, как и аммиак, проявляет свойство образовывать комплексные соединения. Это кристаллическое, хорошо растворимое вещество применяют в лабораторной практике и в органическом синтезе. [34]
Как уже отмечалось, аммиак проявляет свойства очень слабого окислителя и очень медленно окисляет растворенные в нем щелочные и щелочно-земельные металлы с выделением водорода. Степень окисления азота при этом не изменяется. Вместе с тем известно большое число реакций, в которых Nh4 и катион NH проявляют восстановительные свойства и окисляются до соединений с более высокими степенями окисления атома азота.
[35]
Степень окисления азота при этом не изменяется. Вместе с тем известно большое число реакций, в которых Nh4 и катион NH проявляют восстановительные свойства и окисляются до соединений с более высокими степенями окисления атома азота.
[35]
Гидроксиламин Nh3OH рассматривают как продукт замещения гидроксогруп-пой атома водорода в молекуле аммиака. Степень окисления азота в нем равна — 1, поэтому гидроксиламин может проявлять как окислительные, так и восстановительные свойства, которые выражены сильнее. Азот гидроксиламина имеет неподеленную электронную пару и может выполнять роль донора. Поэтому гидроксиламин, как и аммиак, образует комплексные соединения. Это кристаллическое, хорошо растворимое вещество применяют в лабораторной практике и в органическом синтезе. [36]
На примере образования иона аммония из молекулы аммиака можно убедиться в том, что валентность азота возрастает на единицу, а степень окисления остается неизменной; это указывает на схожесть окислительно-восстановительных свойств азота в этих частицах.
Образование соединений с более низкой степенью окисления азота, в том числе газообразного N2, зависит от условий опыта. Примеры восстановления нитрат-иона в неводных растворах неизвестны. Изучение этой реакции в некоторых растворителях осложняется плохой растворимостью солей; для восстановления нитрат-иона требуется очень отрицательный потенциал. Большинство солей азотной кислоты, катионы которых на катоде не восстанавливаются — соли щелочных металлов и четвертичного аммония, очень слабо растворяются в ацето-нитриле и, вероятно, в других нитрилах. Нитраты растворимы в диметилсульфоксиде; на ртутных катодах могут быть достигнуты следующие потенциалы: для нитрата натрия — 1 91 В, для нитрата тетраэтиламмония — 2 74 В и для тетраэтиламмоний перхлората — 2 77 В отн.
Однако здесь следует еще раз подчеркнуть существенную разницу в понятиях степень окисления и валентность элемента ( подробно см. § 6, гл. III): так, формально степень окисления азота в различных его соединениях может быть ( 5) ( НМОз, N2O5), однако валентность азота в этих соединениях не может быть больше четырех. [39]
Можно привести ряд соединений, в которых степень окисления азота имеет промежуточное значение между указанными крайними значениями. [40]
Азот, входящий в состав аммиака, может выступать только в качестве восстановителя, азот азотной кислоты — только в качестве окислителя. Азотистая же кислота HN02 и ее соли, где степень окисления азота равна 3, вступают в реакции как с сильными окислителями, так и с сильными восстановителями. [41]
У азота электроотрицательность меньше, чем у фтора и кислорода, в связи с чем по отношению к этим элементам он выступает в качестве электроположительного элемента, в соединениях же с остальными элементами он проявляет отрицательную степень окисления. При высокой температуре азот непосредственно соединяется с водородом, образуя соединения, в которых степень окисления азота равна — 3, и с кислородом, где он проявляет положительную степень окисления.
[42]
При высокой температуре азот непосредственно соединяется с водородом, образуя соединения, в которых степень окисления азота равна — 3, и с кислородом, где он проявляет положительную степень окисления.
[42]
Здесь решается несколько проблем. Объяснить, например, какая существует зависимость между полярной связью в молекуле аммиака и его взаимодействием с водой и кислотами, предположить, исходя из степени окисления азота
Восстановителем является медь, окислителем — азотная кислота. Следует отметить, что не вся азотная кислота, участвующая в реакции, является окислителем: часть ее расходуется на образование нитрата меди ( II) без изменения степени окисления азота. [44]
Восстановителем является медь, окислителем — азотная кислота. Следует отметить, что не вся азотная кислота, участвующая в реакции, является окислителем: часть ео расходуется на образование нитрата меди ( II) без изменения степени окисления азота. [45]
[45]
Страницы: 1 2 3 4
Трифторид азота (NF3) Свойства (25 полезных фактов) —
Нандита Бисвас
Трифторид азота представляет собой газообразную молекулу с тригонально-пирамидальной структурой и тетраэдрической геометрией. Давайте узнаем дополнительные факты в деталях ниже.
Трифторид азота является парниковым газом. Он имеет множество промышленных применений, таких как фотогальваника, светоизлучающие диоды, солнечные элементы и т. д. Он имеет отрицательную свободную энергию Гиббса и очень низкую стандартную молярную энтальпию. Теплоемкость трехфтористого азота близка к 53,3 Дж/моль К9.0008
Трифторид азота имеет очень низкую растворимость в воде или любых других полярных растворителях или кислотах из-за своей неполярной природы. Давайте изучим такие факты, как название IUPAC, молярная масса, плотность ниже.
NF
3 Название ИЮПАК Номенклатура ИЮПАК NF 3 – трифторид азота.
NF
3 химическая формулаХимическая формула трехфтористого азота: NF 3 . Треугольная пирамидальная структура из NF 3 с тремя сигма-связями.
NF
3 Номер CASНомер CAS (Chemical Abstracts Service) NF 3 — 77830-54-2 в базе данных реестра CAS.
NF
3 CHEMSPIDER IDID CHEMSPIDE подробно ниже .
- NF 3 представляет собой неорганическую молекулу.
- NF 3 — негорючий бесцветный газ.
- NF 3 газ с неприятным запахом.
- NF 3 является парниковым газом.
- NF 3 имеет тригонально-пирамидальную структуру.
NF
3 молярная масса Молярная масса NF 3 составляет 71,00 г/моль. Это сумма относительных масс азота и трех атомов фтора.
Это сумма относительных масс азота и трех атомов фтора.
NF
3 цветNF 3 бесцветный. Он не имеет цвета из-за того, что находится в газообразном состоянии.
NF
3 вязкостьВязкость NF 3 широко не изучалась из-за его низкой термической стабильности.
NF
3 молярная плотностьМолярная плотность NF 3 составляет 3,00 кг/м 3 . Он имеет большую плотность, чем вода, и он тяжелее по весу.
NF
3 температура плавленияТемпература плавления NF 3 составляет -207,15 0 C/ 66 K/ -340,9 0 F и очень низкая по сравнению с 0 F.
NF
3 температура кипения Температура кипения NF 3 составляет 129,06 0 C/ 144,09 K/ -200,31 0 F, что объясняет низкое значение термической стабильности.
NF
3 состояние при комнатной температуреNF 3 при комнатной температуре находится в газообразном состоянии. Низкие температуры плавления и кипения объясняют газообразное состояние NF 3 .
NF
3 ковалентная связьNF 3 представляет собой молекулу с ковалентными связями. Разница в электроотрицательности между N и F составляет 0,9, что меньше 1,5, поэтому в соответствии с правилом Фаяна ковалентные связи полярны по своей природе.
NF
3 ковалентный радиусNF 3 имеет ковалентный радиус, так как связь образуется между двумя неметаллами с разницей электроотрицательностей менее 1,5. Ковалентный радиус каждой связи NF в NF 3 приблизительно равен 140 пм.
NF
3 электронные конфигурации Электронная конфигурация NF 3 представлена электронным состоянием N и связывающих атомов F. Давайте проверим подробности ниже.
Давайте проверим подробности ниже.
Электронная конфигурация N в NF 3 1s 2 2s 2 2p 3 и три атома фтора имеют 1s 2 2s 2 2p 7 . Три неспаренных электрона в N образуют три сигма-связи с тремя атомами фтора. При этом завершается октет атомов N и F.
NF
3 степень окисленияСтепень окисления или заряд NF 3 в целом нейтральный, но катионная и анионная части имеют разные степени окисления. N из-за своей трехвалентности имеет степень окисления +3, а фтор, будучи наиболее электроотрицательным, имеет заряд -1.
NF
3 щелочнойNF 3 является щелочным по своей природе из-за присутствия 2 неподеленных пар электронов в N, которые могут проявлять основной характер для увеличения его щелочности.
Имеет ли NF
3 запах? NF 3 не имеет запаха, так как имеет слабый запах, что объясняется присутствием в молекуле азота.
Является ли NF
3 парамагнитным?Парамагнетики — это материалы, проявляющие парамагнетизм благодаря наличию неспаренных электронов в своей области. Давайте разберемся в деталях ниже.
NF 3 не является парамагнитным, так как молекула не имеет неспаренных электронов на своих орбиталях. Пять валентных электронов N образуют 3 сигма-связи с 3 атомами фтора, а оставшиеся два электрона N остаются в виде спаренной неподеленной пары электронов.
NF
3 гидратыNF 3 образуют гидраты благодаря наличию электроотрицательных атомов N и F, которые могут образовывать межмолекулярные Н-связи, как показано ниже на примере.
- NF 3 + 4H 2 O -> NF 3. 4H 2 O
NF
3 Структура Кристал Кристальная конструкция . является орторомбическим с параметрами решетки a, b и c, не равными друг другу, и углами альфа = бета = гамма = 90 0 .
NF
3 полярность и проводимость- Полярность NF 3 равно u = 0,24 D, где D = момент Дебая.
- Низкое значение полярности обусловлено компенсацией векторов дипольного момента неподеленной пары на 3 вектора связей N-F.
- Проводимость NF 3 плохая.
- NF 3 точное оценочное значение, однако, широко не изучалось.
NF
3 реакция с кислотойNF 3 реагирует с кислотой, так как является основанием Льюиса в газообразном состоянии и реагирует с амфотерной молекулой, такой как H 2 O, как показано ниже.
- 2NF 3 (g) + 3H 2 O (g) -> 6HF (g) + NO (g) + NO 2 (g)
NF
3 реакция с основанием NF 3 обычно не реагируют с основаниями, так как уже имеет щелочную природу, что делает его нереакционноспособным по отношению к основаниям.
NF
3 реакция с оксидомРеакция NF 3 с оксидами обычно оксиды металлов дает фториды металлов, N 9Газ 0013 2 , газ O 2 и несколько газообразных частиц NOx, где x = 1, 2. Общая реакция показана ниже.
- NF 3 + MgO -> N 2 + O 2 + NOx
NF
3 reaction with metalThe reaction of NF 3 with metal are shown below с примерами.
- R-MgX + NF 3 -> R-NF 2 + R-R
- R-Li + NF 3 -> R-R + R-NF 2
- R-CU + NF 3 -> R-R
- NF 3 REACTS с REACTS с ALACALI и ALLISITIARI и ALAKALI и ALLISITIARI и ALAKALI и ALLISITIARITIARITI металлы очень избирательно.
NF 3 представляет собой тригонально-пирамидально-ромбическую кристаллическую структуру с неприятным запахом. Он существует в газообразном состоянии с очень низкой температурой плавления и кипения.
Он существует в газообразном состоянии с очень низкой температурой плавления и кипения.
Степени окисления N в NH(2)OH, NO и HNO(3) равны -1, +2 и +5 соответственно.
Ответить
Пошаговое решение от экспертов, которое поможет вам в разрешении сомнений и получении отличных оценок на экзаменах.
Стенограмма
утверждение правильное Степень окисления азота в Nh4 и nf3 и и 2-4 задается как 3 минус 1 на 3 и минус 2 допустим, что пусть степень окисления азота равна X, поэтому мы рассматриваем это для о каждом из них так всегда говорили в первую очередь Nh4 и nf3 есть все эти на самом деле ньютоновские сумма их зарядов будет равна нулю для ns3 мы берем а в качестве X и мы знаем что для водорода это на самом деле 3.2 плюс один, поэтому значение x равно -3 супер скорость NSE равна -3 аналогично мы вычисляем для hm 33 он равен плюс один и фауна 33 X и они должны быть причиной
отсюда значение куба х равно минус 1 на 3 а теперь если мы говорили о и к h5n 284 так для CL 2 X + всего раз один для HCL так что равно равно 200 мл равно 4 на что равно тому, что равно тому, как писать SO2 + 2, но в этом вопросе говорится, что это -2, это неверно, не подходит к нашему второму варианту, поскольку вариант говорит, что степень окисления азота в NO2 и и предложить и NO2 минус читай их +1+1+3 так что если говорить про автосалон тут то плюс за азот и использование тех же
в-третьих, мы снова рассчитали это правильно и степень окисления n2o, если мы рассчитаем скорость, так что это на самом деле = u + 4 снова, а для NO2 минус скорости калькулятор FD для конца в конец a 2 — так как заряд равен -1, поэтому мы берем азот и кислород, это 2 x минус 2, равное минус 4, и должно быть равно -1, значение x должно быть равно плюс 3, пока заряды + 3 показывают правильный ответ.