Электроотрицательность. Степень окисления. Валентность — презентация онлайн
Похожие презентации:
Валентность и степень окисления. Химическая связь
Валентность и степень окисления
Степень окисления. Определение степени окисления в соединениях
Валентность и степень окисления
Валентность. Степень окисления. Составление электронных конфигураций. Типы химической связи
Валентность и степень окисления
Валентность и степень окисления
Валентность и степень окисления. Правила определения степеней окисления элементов
Степень окисления
Валентность и степень окисления атомов в молекуле
Электроотрицательность.
Степень окисления. Валентность.
ЭО – сила (кто сильнее, тот и забирает)
ЭО – способность атомов в молекуле смещать к
себе электронную плотность от соседних атомов.
ЭО – мера неметалличности элементов
(у неметаллов ЭО всегда больше, чем у металлов)
Закономерности — для элементов главных подгрупп
Всего 23 неметалла, из них 7 двухатомные:
30,4%
Лидеры по ЭО
O F
N
Какое место (между какими элементами) должен
занимать Н по электроотрицательности в ПС?
«Химический баттл»
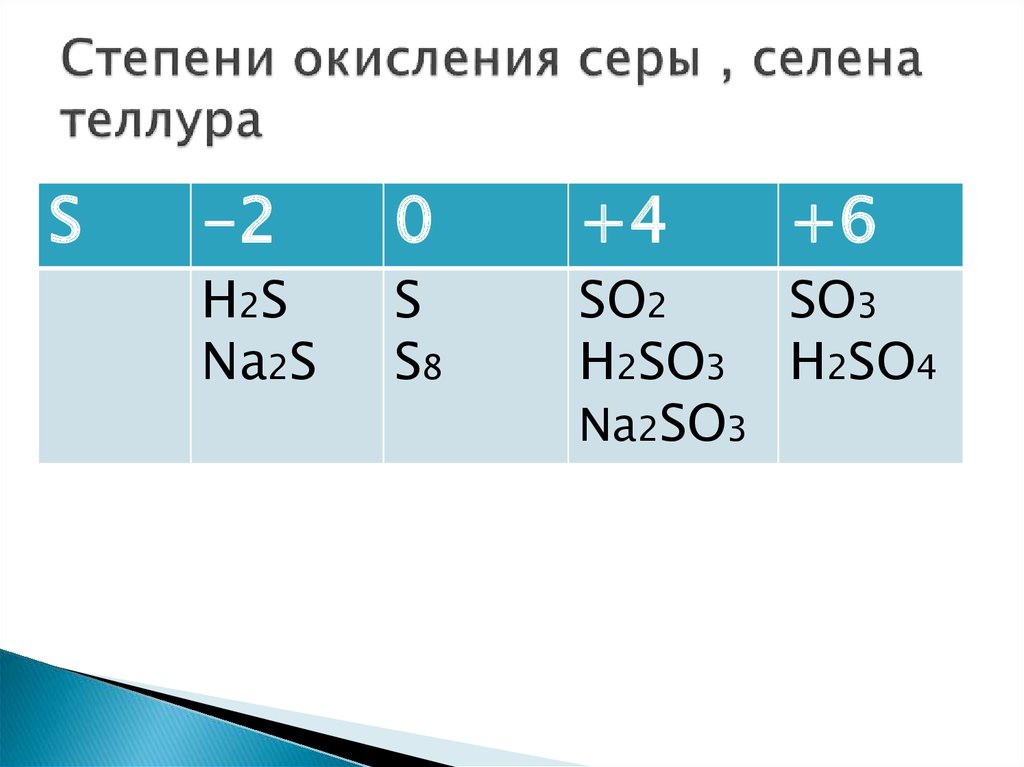
Степень окисления
Заряд иона
условный заряд атома в
соединении в предположении, что
все связи в этом соединении
ионные
(электронные пары полностью
смещены к атому с большей ЭО)
реальная физическая величина,
которым обладает катион или анион
формальный заряд,
вычисленный по правилам
экспериментально измеренный,
значения в таблице растворимости
сначала знак заряда (+/-), потом
цифра
сначала цифра, потом знак (+/-)
В единичных зарядах только знак
Cu +2 — атом меди со степенью
окисления +2
Cu 2+ — катион меди с зарядом 2+
Степень окисления/заряд иона
Чем ограничены?
Правила определения степени окисления
У металлов низшая степень окисления всегда равна нулю, всегда положительная
Определите высшую СО у
следующих элементов:
N+5, V+5, Cr+6, B+3, Mn+7
Определите низшую СО у
следующих элементов:
S-2, O-2, N-3, P-3, Si-4, C-4, Cl-1
Na 0, Mg 0
Определить СО
NaF, AlCl3, NaCl, BaO2, Al4C3, Al2(SO4)3,
h3SO4, SCl2, Nh5F, LiAlh5, KBrO3, K2MnO4,
HClO, SO32-, Mg3N2, KHSO3, S2Cl2, SO2Br2,
NaH, Sih5,Na2O2, NaIO, Bah3, CaC2, Al2S3,
NaNh3, OF2, (Nh5)2Cr2O7, Nh4, COS,
O2F2, h3O, NO3-, Nh5+, KMnO4 , Nh5NO2
В порядке уменьшения: от большего к меньшему
В порядке увеличения: от меньшего к большему
Валентность – это способность атомов
элемента образовывать химические связи.

Не имеет
знака
Не всегда
совпадает
со степенью
окисления
(соединения с
ковалентной
связью)
Валентность С
в органических соединениях IV
Степень окисления
первичного атома углерода
минус три, вторичного минус
два, третичного минус один,
четвертичного — ноль
в органических соединениях
высшей валентности равной номеру группы?
N (III, IV) – в пятой группе
O (II) – в шестой группе
F (I) – в седьмой группе
Какие из элементов второго периода не проявляют
высшей степени окисления равной номеру группы?
O (+2) – в шестой группе
F (0) – в седьмой группе
15
35
35
25
235
25
45
15
25
English Русский Правила
25)Мышьяк, сурьма, висмут. Нахождение в природе, степени окисления, получение, св-ва. Соединения с водородом.
As:
-3;+3; +5; Sb:
-3; +3; +5; Bi:
-3; +3. Минералы: Арсенопирит – FeAsS,
As4S4
– реальгар, Sb2S3
– сурьмяной блеск, Bi2S3
– висмутовый блеск. Получ.:
FeAsS-(t)-FeS+As, As2O3+C—As+CO. Св-ва.
As
бывает серый, желт, черн. Наиболее
устойчив серый. Sb
устойчива серебристо-белая, черная,
желт. Bi
– нет модификаций. Все соединения
ядовиты. Наиболее опасны соединения
мышьяка. 1) 2Sb+3Cl2—2SbCl3,
2Sb+5Cl2—2SbCl5;
2)As+S—As2S3;
3)C
Me:
Ca+As—Ca3As2
– арсенид, Ca3Sb2
– стибид, Ca3Bi2-
висмутид; 4)C
кислотами: As+HNO3(конц)+h3O—h3AsO4+NO,
Sb+HNO3(конц)—Sb2O5+NO2+h3O,
Bi+HNO3(конц)+NO2+h3O.
As-Sb-Bi
– усиливаются металлические св-ва. As
серый обладает электр. проводимостью.
Sb,
Bi
имеют металич. блеск. Свинец, содержащий
Sb,
обладает повышенной твердостью. Соединения
с водородом. Непосредственно не соединяется. Ash4,
Sbh4,
Bih4
получают по реакциям. Mg3Sb2+HCl—Sbh4+MgCl2,
Ca3As2+HCl—CaCl2+Ash4.
Получ.:
FeAsS-(t)-FeS+As, As2O3+C—As+CO. Св-ва.
As
бывает серый, желт, черн. Наиболее
устойчив серый. Sb
устойчива серебристо-белая, черная,
желт. Bi
– нет модификаций. Все соединения
ядовиты. Наиболее опасны соединения
мышьяка. 1) 2Sb+3Cl2—2SbCl3,
2Sb+5Cl2—2SbCl5;
2)As+S—As2S3;
3)C
Me:
Ca+As—Ca3As2
– арсенид, Ca3Sb2
– стибид, Ca3Bi2-
висмутид; 4)C
кислотами: As+HNO3(конц)+h3O—h3AsO4+NO,
Sb+HNO3(конц)—Sb2O5+NO2+h3O,
Bi+HNO3(конц)+NO2+h3O.
As-Sb-Bi
– усиливаются металлические св-ва. As
серый обладает электр. проводимостью.
Sb,
Bi
имеют металич. блеск. Свинец, содержащий
Sb,
обладает повышенной твердостью. Соединения
с водородом. Непосредственно не соединяется. Ash4,
Sbh4,
Bih4
получают по реакциям. Mg3Sb2+HCl—Sbh4+MgCl2,
Ca3As2+HCl—CaCl2+Ash4.
26) Оксиды и кислоты мышьяка и сурьмы, гидролиз солей. Сульфиды и тиосоли элементов V главной подгруппы.
Оксиды
Э2О3 – это кристаллический вещ-ва.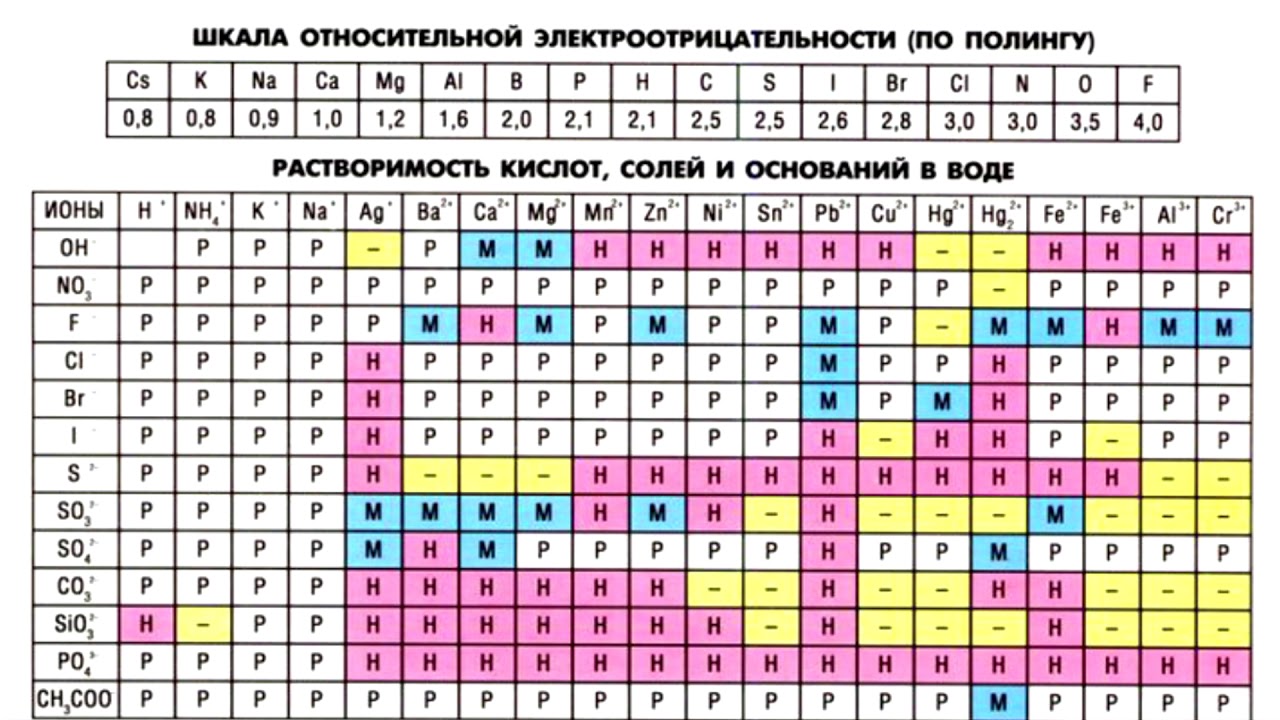 As2O3-Sb2O3-Bi2O3
– уменьшение растворимости в воде.
As2O3+h3O—HasO2
— метамышъяковистая к-та. Мышъяковистая
к-та и ее соли арсениты – восстановители.
HAsO2+Y2+h3O—h4AsO4+HY,
HAsO2+HCl—AsCl3+h3O.;
Sb(OH)3+HCl—SbCl3+h3O.
Bi(OH)3
– основной гидроксид.Соли As,
Sb,
Bi
подвергаются гидролизу. AsCl3+h3O—h3AsO3+HCl,
SbCl3+h3O—Sb(OH)2Cl+HCl,
Sb(OH)2Cl—SbOCl+h3O,
Bi(NO3)3+h3O—BiO(NO3)+HNO3.
As2O3-Sb2O3-Bi2O3
– уменьшение растворимости в воде.
As2O3+h3O—HasO2
— метамышъяковистая к-та. Мышъяковистая
к-та и ее соли арсениты – восстановители.
HAsO2+Y2+h3O—h4AsO4+HY,
HAsO2+HCl—AsCl3+h3O.;
Sb(OH)3+HCl—SbCl3+h3O.
Bi(OH)3
– основной гидроксид.Соли As,
Sb,
Bi
подвергаются гидролизу. AsCl3+h3O—h3AsO3+HCl,
SbCl3+h3O—Sb(OH)2Cl+HCl,
Sb(OH)2Cl—SbOCl+h3O,
Bi(NO3)3+h3O—BiO(NO3)+HNO3.
 Все
сульфиды нерастворимы в воде и кислотах
не яв-ся окислителями, но растворяются
в концентрированных кислотах окислителях.
As2S3+HNO3(конц)—h4AsO4+h3SO4+NO.
Э2S3+KOH—K2ЭО3+К2ЭS3+h3O.
Все
сульфиды нерастворимы в воде и кислотах
не яв-ся окислителями, но растворяются
в концентрированных кислотах окислителях.
As2S3+HNO3(конц)—h4AsO4+h3SO4+NO.
Э2S3+KOH—K2ЭО3+К2ЭS3+h3O. 27) Углерод, строение атома, физ и хим св-ва. Оксиды. Угольная к-та. Соединения углерода с серой и азотом.
Модификации:
в свободном состоянии встречается в
виде алмаза, графита. Хим. свойства углерода: C+O2—CO2, C+h3—Ch5, C+N2—C2N2, C+Al—Al4C3, CaO+C—CaC2+CO,
ZnO+C—Zn+CO, C+h3SO4(конц)—CO2+SO2+h3O,
C+S—CS2. CO2—диоксид
углерода – угольная к-та, образуется при дыхании,
сжигании топлива и тд.Вдыхание воздуха
с 10% содержанием CO2
вызывает паралич дыхания. CaCO3-(t)-CaO+CO2,
CaCO3+HCl—CaCl2+CO2, CO2+h3O=h3CO3, CO2+CaO—CaCO3,
NaOH+CO2—Na2CO3+h3O, Na2O2+CO2—Na2CO3+O2. Соли:
карбонаты,
гидрокарбонаты.
Получают:
NaOH+CO2—NaHCO3,
NaOH+Na2CO3—Na2CO3+h3O.
При нагревании все карбонаты кроме
карбонатов щелочных Me
разлагаются.
Соединения с серой степени окисления 2
Перейти к основному содержанию
Авторы:
- Н. Бауманн,
- Х.
 -Дж. Фахманн,
-Дж. Фахманн, - Р. Джоттер
Редакторы:
- Н. Бауманн,
- Х.-Дж. Фахманн,
- Р. Джоттер,
- …
- А. Кубный
- Н. Бауманн
Посмотреть публикации автора
Вы также можете искать этого автора в пабмед Google ученый
- Х.
 -Дж. Фахманн
-Дж. ФахманнПосмотреть публикации автора
Вы также можете искать этого автора в пабмед Google ученый
- Р. Джоттер
Посмотреть публикации автора
Вы также можете искать этого автора в пабмед Google ученый
- Н.
 Бауманн
БауманнПросмотр публикаций редактора
Вы также можете найти этот редактор в пабмед Google ученый
- Х.-Дж. Фахманн
Просмотр публикаций редактора
Вы также можете найти этот редактор в пабмед Google ученый
- Р.
 Джоттер
ДжоттерПросмотр публикаций редактора
Вы также можете найти этот редактор в пабмед Google ученый
- А. Кубный
Просмотр публикаций редактора
Вы также можете найти этот редактор в пабмед Google ученый
Часть книжной серии: Справочник Гмелина по неорганической и металлоорганической химии — 8-е издание (GMELIN, том S/S-N/9)
Входит в подсерию книг:
С.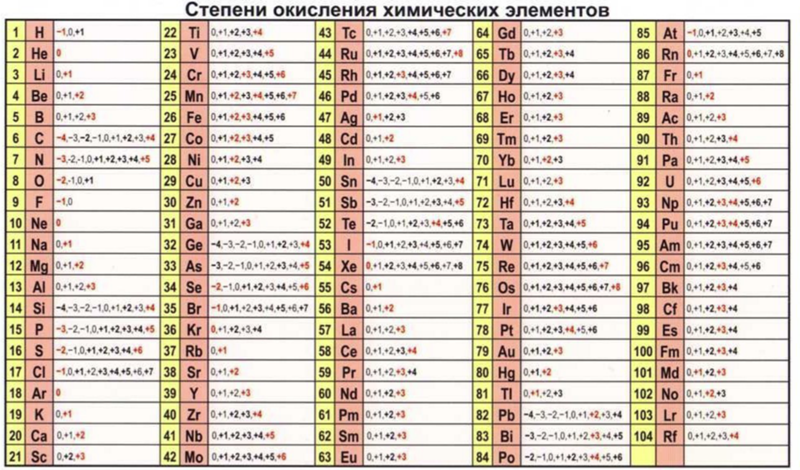 Швефель. Сера (Система-№ 9) (2053)
Швефель. Сера (Система-№ 9) (2053)
Об этой книге
В настоящем томе серии Соединения серы и азота описываются кольцевые системы сера(II)-азот и сера(II)-азот-элемент. Соединения расположены по размеру кольца: Трехатомное кольцо S(NR)2 и пятиатомное кольцо S3(NR)2-3,5, где R = C2F5, CF2Cl, получают фотолизом смесей RN= НР и S2Cl2. Шестиатомные кольца S2(NR)4-2,3,5,6, S4(NR)2-3,6,S4(NR)2-5,6 и S4(NR)2-4,6, где R = органил, может быть синтезирован из SxCl2 (x = от 1 до 3) и аминов, гидразинов или дииминов. Восьмиатомные кольца S7NH, S6(NH)2 и S5(NH)3 получают реакцией S2Cl2 и Nh4 в ДМФА. Известное кольцо S4(NH)4-2,4,6,8 было впервые получено в 1908 восстановлением S4N4 с помощью SnCl2.2·h3O. Также рассматриваются многочисленные органические и неорганические производные этих восьмиатомных колец S-N, включая анион S7N-, аддукты, полимеры и комплексы металлов. Большая часть тома посвящена кольцевым системам сера(II)-азот-элемент. Кольца S-N-C обладают биологической активностью.
Большая часть тома посвящена кольцевым системам сера(II)-азот-элемент. Кольца S-N-C обладают биологической активностью.
Наверх
Наверх
Хлориды Периода 3 Элементы
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3666
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице обсуждаются структуры хлоридов элементов 3-го периода (от натрия до серы), их физические свойства и их реакции с водой. Хлор и аргон опущены — хлор, потому что бессмысленно говорить о «хлориде хлора», а аргон, потому что он инертен и не образует хлорида.
Краткий обзор тенденций
Интересующие хлориды приведены в таблице ниже:
| NaCl | MgCl 2 | AlCl 3 | SiCl 4 | ПКл 5 | С 2 Класс 2 |
| ПКл 3 |
Сера образует три хлорида, но наиболее распространен S 2 Cl 2 . Хлорид алюминия также существует при некоторых условиях в виде димера, Al 2 Cl 6 .
- Структуры : хлорид натрия и хлорид магния являются ионными и состоят из крупных ионных решеток при комнатной температуре. Хлорид алюминия и хлорид фосфора (V) более сложны.
 Они меняют свою структуру с ионной на ковалентную по мере перехода их твердых тел в жидкости или пары. Это обсуждается более подробно ниже. Другие хлориды представляют собой простые ковалентные молекулы.
Они меняют свою структуру с ионной на ковалентную по мере перехода их твердых тел в жидкости или пары. Это обсуждается более подробно ниже. Другие хлориды представляют собой простые ковалентные молекулы. - Точки плавления и кипения: Хлориды натрия и магния представляют собой твердые вещества с высокими температурами плавления и кипения из-за большого количества тепла, необходимого для разрушения сильного ионного притяжения.
- Остальные представляют собой жидкости или твердые вещества с низкой температурой плавления. Оставляя в стороне случаи хлорида алюминия и хлорида фосфора (V), где ситуация довольно сложная, притяжение в других случаях будет гораздо более слабыми межмолекулярными силами, такими как дисперсионные силы Ван-дер-Ваальса. Они различаются в зависимости от размера и формы молекулы, но всегда будут намного слабее, чем ионные связи.
- Электропроводность: Хлориды натрия и магния являются ионными, поэтому в расплавленном состоянии подвергаются электролизу.
 Электричество переносится движением ионов и их разрядом на электродах (не электронами). В случаях хлорида алюминия и хлорида фосфора (V) твердое вещество не проводит электричество, потому что ионы не могут свободно двигаться. В жидкости (там, где она существует — и то, и другое возвышается при обычном давлении) они перешли в ковалентную форму и поэтому тоже не проводят. Остальные хлориды не проводят электричество ни в твердом, ни в расплавленном состоянии, потому что в них нет ни ионов, ни подвижных электронов.
Электричество переносится движением ионов и их разрядом на электродах (не электронами). В случаях хлорида алюминия и хлорида фосфора (V) твердое вещество не проводит электричество, потому что ионы не могут свободно двигаться. В жидкости (там, где она существует — и то, и другое возвышается при обычном давлении) они перешли в ковалентную форму и поэтому тоже не проводят. Остальные хлориды не проводят электричество ни в твердом, ни в расплавленном состоянии, потому что в них нет ни ионов, ни подвижных электронов. - Реакции с водой : Приблизительно простые ионные хлориды (хлориды натрия и магния) просто растворяются в воде. Хотя все другие хлориды реагируют с водой различными способами, описанными ниже для каждого отдельного хлорида. Реакция с водой известна как гидролиз.
Хлорид натрия (NaCl)
Хлорид натрия представляет собой ионное соединение, состоящее из гигантского массива ионов натрия и хлора. Небольшая репрезентативная часть решетки хлорида натрия выглядит следующим образом:
Обычно это изображается в развернутом виде:
Сильное притяжение между положительными и отрицательными ионами требует большого количества тепловой энергии для разрыва, поэтому хлорид натрия имеет высокие температуры плавления и кипения. Соединение не проводит электричество в твердом состоянии, потому что в нем нет подвижных электронов, а ионы ограничены кристаллической решеткой. Однако, когда он плавится, он подвергается электролизу. Хлорид натрия растворяется в воде с образованием нейтрального раствора.
Соединение не проводит электричество в твердом состоянии, потому что в нем нет подвижных электронов, а ионы ограничены кристаллической решеткой. Однако, когда он плавится, он подвергается электролизу. Хлорид натрия растворяется в воде с образованием нейтрального раствора.
Хлорид магния (MgCl
2 )Как и хлорид натрия, хлорид магния также образует ионное твердое вещество, но с более сложной кристаллической структурой ионов, чтобы вместить вдвое больше ионов хлорида, чем ионов магния. Как и в случае с хлоридом натрия, для преодоления притяжения между ионами требуется большое количество тепловой энергии (из-за высокой энтальпии решетки соединения), поэтому температуры плавления и кипения также высоки. Твердый хлорид магния не является проводником электричества, потому что ионы ограничены. Однако при плавлении соединение подвергается электролизу.
Хлорид магния растворяется в воде с образованием слегка кислого раствора (с pH приблизительно 6). Когда ионы магния сольватируются из твердой решетки, между ионами 2+ и молекулами воды возникает достаточное притяжение для образования координированных (дативных ковалентных) связей между ионами магния и неподеленными парами на окружающих молекулах воды. -_{(водн.)}\] 9+_{(aq)}\]
-_{(водн.)}\] 9+_{(aq)}\]
Если уравнение написано таким образом, необходимо включить символы состояния.
Хлорид алюминия (AlCl
3 )Электроотрицательность увеличивается в течение периода; алюминий и хлор недостаточно различаются по электроотрицательности, чтобы образовать простую ионную связь. Структура хлорида алюминия изменяется с температурой. При комнатной температуре алюминий имеет 6-координацию (т. е. каждый алюминий окружен 6 атомами хлора). Структура представляет собой ионную решетку, но имеет много ковалентного характера.
При атмосферном давлении хлорид алюминия возгоняется при температуре около 180°C. Если давление увеличить до чуть более 2 атмосфер, вместо этого он плавится при температуре 192°C.
Обе эти температуры намного ниже ожидаемого диапазона для ионного соединения. Они предполагают сравнительно слабое притяжение между молекулами вместо сильного притяжения между ионами. Это связано с тем, что координация алюминия изменяется при этих температурах. Он становится 4-координированным — каждый алюминий окружен 4 атомами хлора, а не 6. Исходная решетка превращается в Al 2 Cl 6 расположение молекул. Структура показана ниже:
Он становится 4-координированным — каждый алюминий окружен 4 атомами хлора, а не 6. Исходная решетка превращается в Al 2 Cl 6 расположение молекул. Структура показана ниже:
При конверсии весь ионный характер теряется, что приводит к испарению или плавлению хлорида алюминия (в зависимости от давления). Эти димеры и простые молекулы AlCl 3 существуют в равновесии. При дальнейшем повышении температуры положение равновесия все более и более смещается вправо следующей системы:
\[ Al_2Cl_6 \rightleftharpoons 2AlCl_3\]
Резюме AlCl
3- При комнатной температуре твердый хлорид алюминия имеет ионную решетку со значительным ковалентным характером.
- При температуре около 180–190°C (в зависимости от давления) хлорид алюминия превращается в молекулярную форму Al 2 Cl 6 . Это заставляет его плавиться или испаряться из-за сравнительно слабого межмолекулярного притяжения.

- При дальнейшем повышении температуры образуется больше молекул AlCl 3 .
Твердый хлорид алюминия не проводит электричество при комнатной температуре, поскольку ионы не могут свободно двигаться. Расплавленный хлорид алюминия (возможен только при повышенных давлениях) также является непроводящим, так как потерял свой ионный характер.
Хлорид алюминия резко реагирует с водой. Капля воды, помещенная на твердый хлорид алюминия, образует паровые облака газообразного хлороводорода. Твердый хлорид алюминия в избытке воды еще брызгает, но вместо этого образуется кислый раствор. Раствор хлорида алюминия обычной концентрации (около 1 моль дм 9- (aq)\]
Это очень похоже на уравнение хлорида магния, приведенное выше, с той лишь разницей, что это заряд иона. Больший заряд довольно сильно притягивает электроны в молекулах воды к алюминию, делая атомы водорода более положительными и, следовательно, легче удаляемыми из иона. Следовательно, этот ион намного более кислый, чем в соответствующем случае магния.
Кислотно-щелочное равновесие для этой реакции лежит правее, чем для магния, поэтому образующийся раствор более кислый — образуется больше ионов гидроксония, как показано на рисунке: 9+ \]
Если воды мало, образуется газообразный хлористый водород. Из-за тепла, выделяющегося в реакции, и концентрации образующегося раствора ионы водорода и ионы хлора в смеси объединяются в молекулы хлороводорода (\(HCl\)) и выделяются в виде газа. При большом избытке воды температура никогда не бывает достаточно высокой, чтобы это произошло; ионы остаются сольватированными.
Тетрахлорид кремния (SiCl
4 ) Тетрахлорид кремния представляет собой простой ковалентный хлорид, не требующий особых усилий. Между кремнием и хлором недостаточно разницы в электроотрицательности для образования ионных связей. Тетрахлорид кремния представляет собой бесцветную жидкость при комнатной температуре, дымящую на влажном воздухе. Единственным притяжением между молекулами являются дисперсионные силы Ван-дер-Ваальса.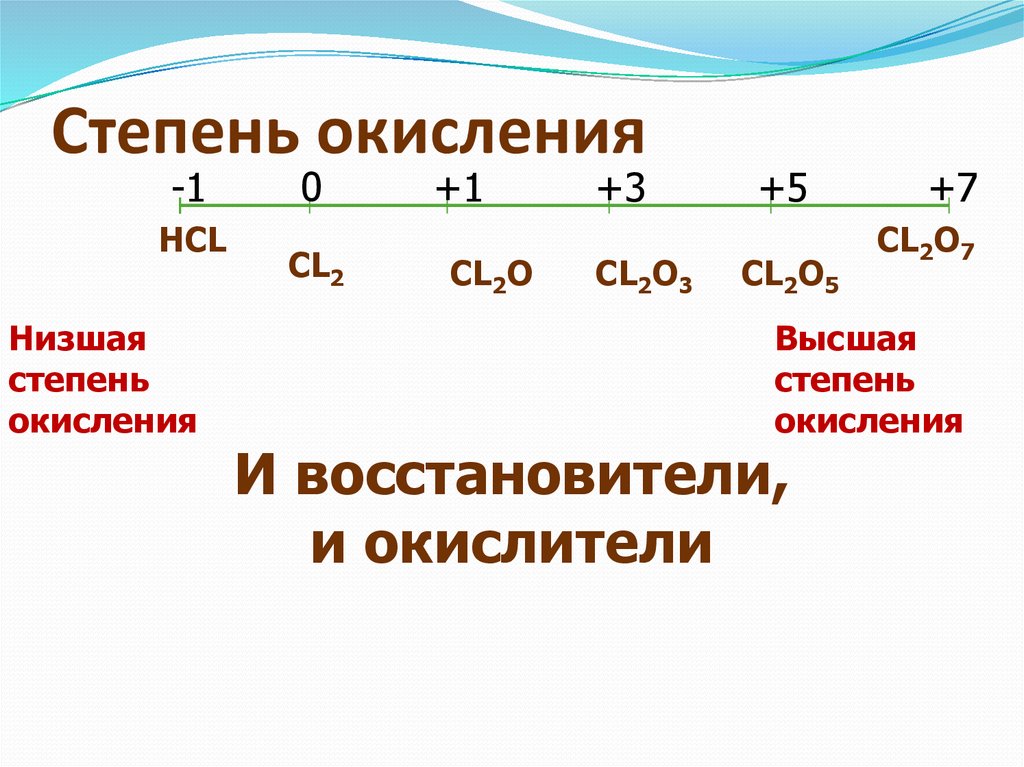 Он не проводит электричество из-за отсутствия ионов или мобильных электронов.
Он не проводит электричество из-за отсутствия ионов или мобильных электронов.
Он дымится во влажном воздухе, потому что реагирует с водой в воздухе с образованием хлороводорода. Если к четыреххлористому кремнию добавить воду, произойдет бурная реакция с образованием двуокиси кремния и паров хлористого водорода. В большом избытке воды хлористый водород, конечно, растворяется с образованием сильнокислого раствора, содержащего соляную кислоту.
\[ SiCl_4 + 2H_2O \rightarrow SiO_2 + 4HCl\]
Хлориды фосфора
Есть два хлорида фосфора: хлорид фосфора(III), PCl 3 и хлорид фосфора(V), PCl 5 .
Фосфор(III) хлорид (PCl
3 ) Этот простой ковалентный хлорид существует в виде дымящейся жидкости при комнатной температуре, поскольку между молекулами действуют только ван-дер-ваальсовые дисперсионные силы и диполь-дипольное притяжение. Жидкость не проводит электричество из-за отсутствия ионов или подвижных электронов.
Хлорид фосфора(III) бурно реагирует с водой с образованием фосфористой кислоты, H 3 PO 3 , и пары хлористого водорода (или раствор, содержащий соляную кислоту в избытке воды):
\[ PCl_3 + 3H_2O \rightarrow H_3PO_3 + 3HCl\]
Фосфор(V) хлорид (PCl
5 )Хлорид фосфора(V) имеет более сложную структуру, чем хлорид фосфора(III). При комнатной температуре он образует белое твердое вещество, которое возгоняется при 163°С. Повышение температуры выше точки сублимации диссоциирует (обратимо разделяет) больше хлорида фосфора (V) на хлорид фосфора (III) и хлор:
\[ PCl_5 \rightleftharpoons PCl_3 + Cl_2\]
Хлорид фосфора(V) представляет собой ионное твердое вещество. В образовании ионов принимают участие две молекулы PCl 5 . Ион хлора переходит от одной исходной молекулы к другой, оставляя положительный ион [PCl 4 ] + и отрицательный ион [PCl 6 ] — .
При 163°C хлорид фосфора(V) превращается в молекулярную форму, содержащую молекулы PCl 5 . Поскольку между этими молекулами существуют только дисперсионные силы Ван-дер-Ваальса, частицы испаряются. Твердый хлорид фосфора(V) не проводит электричество.
Хлорид фосфора(V) бурно реагирует с водой с образованием паров хлороводорода. Как и в случае с другими ковалентными хлоридами, при наличии достаточного количества воды они растворяются с образованием раствора соляной кислоты.
Реакция протекает в две стадии. Первый происходит в холодной воде; оксихлорид фосфора, POCl 3 , производится вместе с HCl:
\[ PCl_5 + 4H_2O \rightarrow POCl_3 + 2HCl\]
При кипении раствора хлорид фосфора(V) вступает в дальнейшую реакцию с образованием фосфорной (V) кислота и еще HCl. Фосфорная (V) кислота также известна как фосфорная кислота или ортофосфорная кислота:
\[ POCl_3 + 3H_2O \rightarrow H_3PO_4 + 3HCl\]
Объединение этих уравнений дает общую реакцию в кипящей воде: Cl 2 )
Дихлорид дисульфура является одним из трех хлоридов серы и представляет собой соединение, образующееся при реакции хлора с горячей серой.

 -Дж. Фахманн,
-Дж. Фахманн, -Дж. Фахманн
-Дж. Фахманн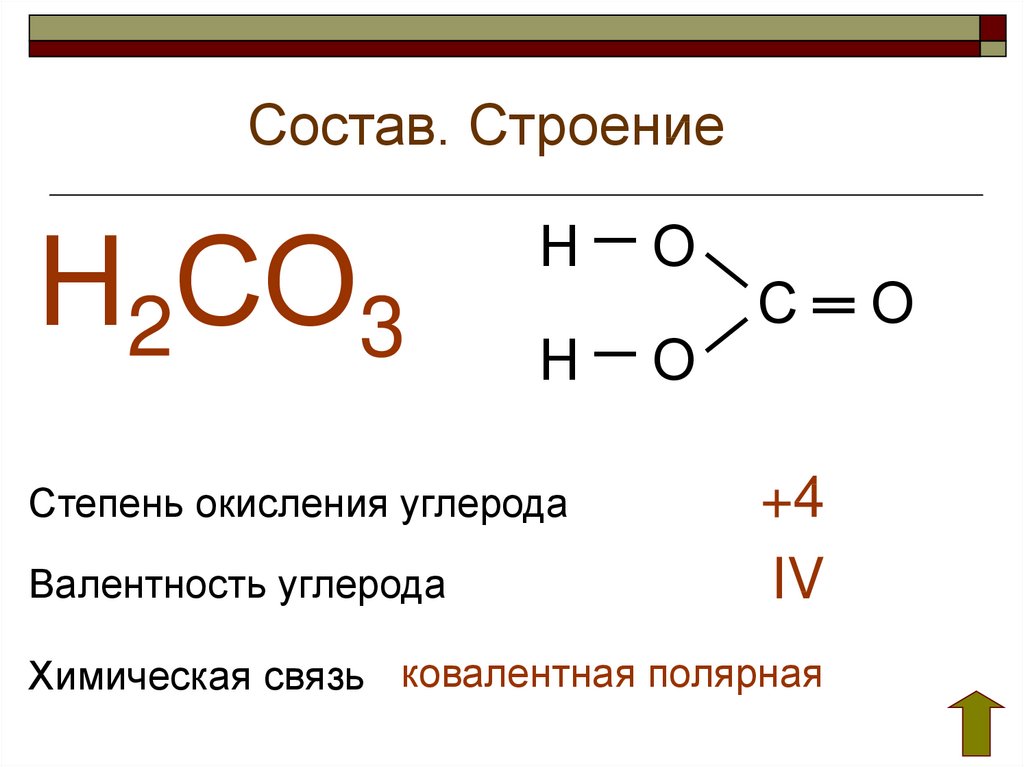 Бауманн
Бауманн Джоттер
Джоттер Они меняют свою структуру с ионной на ковалентную по мере перехода их твердых тел в жидкости или пары. Это обсуждается более подробно ниже. Другие хлориды представляют собой простые ковалентные молекулы.
Они меняют свою структуру с ионной на ковалентную по мере перехода их твердых тел в жидкости или пары. Это обсуждается более подробно ниже. Другие хлориды представляют собой простые ковалентные молекулы. Электричество переносится движением ионов и их разрядом на электродах (не электронами). В случаях хлорида алюминия и хлорида фосфора (V) твердое вещество не проводит электричество, потому что ионы не могут свободно двигаться. В жидкости (там, где она существует — и то, и другое возвышается при обычном давлении) они перешли в ковалентную форму и поэтому тоже не проводят. Остальные хлориды не проводят электричество ни в твердом, ни в расплавленном состоянии, потому что в них нет ни ионов, ни подвижных электронов.
Электричество переносится движением ионов и их разрядом на электродах (не электронами). В случаях хлорида алюминия и хлорида фосфора (V) твердое вещество не проводит электричество, потому что ионы не могут свободно двигаться. В жидкости (там, где она существует — и то, и другое возвышается при обычном давлении) они перешли в ковалентную форму и поэтому тоже не проводят. Остальные хлориды не проводят электричество ни в твердом, ни в расплавленном состоянии, потому что в них нет ни ионов, ни подвижных электронов.