ОглавлениеПРЕДИСЛОВИЕ К ПЕРВОМУ ИЗДАНИЮПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ ПРЕДИСЛОВИЕ К ТРЕТЬЕМУ ИЗДАНИЮ ВВЕДЕНИЕ § 1. Анализ и синтез § 2. Предмет аналитической химии § 3. Развитие аналитической химии § 4. Качественный и количественный анализ ГЛАВА I. ПРИМЕНЕНИЕ ЗАКОНА ДЕЙСТВИЯ МАСС В АНАЛИТИЧЕСКОЙ ХИМИИ § 1. Влияние среды на состояние ионов в растворах § 2. Обратимые и необратимые аналитические реакции § 3. Направление аналитических реакций; правила обменного разложения § 4. Закон действия масс и следствие из него § 5. Границы применимости закона действия масс § 6. Сильные и слабые электролиты § 7. Активность § 8. Коэффициент активности и ионная сила Б. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ (В ГОМОГЕННЫХ СИСТЕМАХ) § 9. Гомогенные и гетерогенные системы § 10. Ионное произведение воды § 11. Ионы гидроксония § 12. Равновесие ионов в водных растворах; понятие о pH § 13.  Равновесие в водных растворах слабых электролитов Равновесие в водных растворах слабых электролитов§ 14. Влияние сильных кислот или сильных оснований на степень электролитической диссоциации слабых электролитов § 15. Приближенные формулы для расчета [H+] и [OH-] в водных растворах кислот и оснований В. РАВНОВЕСИЯ В БУФЕРНЫХ РАСТВОРАХ § 16. Буферные растворы § 17. Применение буферных растворов в химическом анализе Г. РАВНОВЕСИЯ В РАСТВОРАХ ГИДРОЛИЗУЮЩИХСЯ СОЛЕЙ § 18. Теоретические основы гидролиза § 19. Механизм гидролитического расщепления § 20. Подавление и усиление гидролиза солей Д. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ ТИПИЧНО АМФОТЕРНЫХ ЭЛЕКТРОЛИТОВ § 21. Поведение амфотерных гидроокисей в водных растворах § 22. Константы электролитической диссоциации амфотерных гидроокисей Е. РАВНОВЕСИЯ В СИСТЕМАХ: ОСАДОК-НАСЫЩЕННЫЙ РАСТВОР § 23. Осаждение как один из основных методов химического анализа § 25. Произведение активностей § 26. Вычисление растворимости электролитов в воде по величине произведения растворимости § 27. 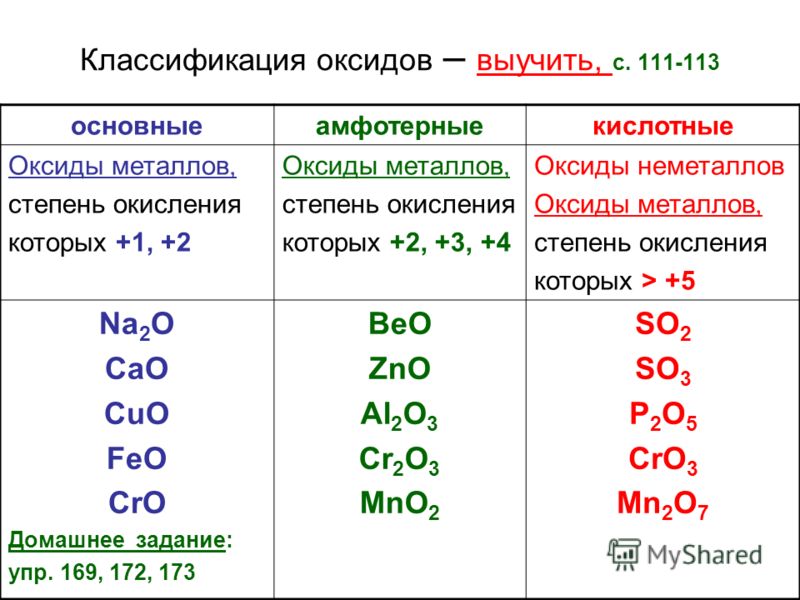 Влияние различных факторов на растворимость малорастворимых электролитов Влияние различных факторов на растворимость малорастворимых электролитовЖ. ОСНОВЫ ТЕОРИИ ОБРАЗОВАНИЯ И РАЗЛОЖЕНИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИИ, ПРИМЕНЯЕМЫХ В АНАЛИТИЧЕСКОЙ ХИМИИ § 28. Характеристика комплексных соединений, имеющих значение в химическом анализе § 29. Квантовомеханические представления о строении комплексов § 30. Равновесия в растворах комплексных соединений § 31. Константы нестойкости комплексов § 32. Внутрикомплексные соединения § 33. Методы разложения и образования комплексов, применяемых в аналитической химии § 34. Применение метода комплексообразования в химическом анализе ГЛАВА II. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ, ПРИМЕНЯЕМЫХ В АНАЛИТИЧЕСКОЙ ХИМИИ § 1. Окисление—восстановление как один из основных методов химического анализа § 2. Направление реакций окисления—восстановления § 3. Окислительно-восстановительные потенциалы § 4. Зависимость между величинами окислительно-восстановительных потенциалов и условиями, в которых протекают реакции окисления—восстановления § 5.  Вычисление окислительно-восстановительных потенциалов Вычисление окислительно-восстановительных потенциалов§ 6. Вычисление окислительно-восстановительных потенциалов с учетом коэффициентов активности ГЛАВА III. ВВЕДЕНИЕ В КАЧЕСТВЕННЫЙ АНАЛИЗ § 1. Обнаружение отдельных элементов § 2. Анализ мокрым и сухим путем § 3. Химические и физические методы качественного анализа § 4. Макро-, полумикро- и микрометоды § 5. Капельный анализ § 6. Микрокристаллоскопический анализ § 7. Метод растирания порошков § 8. Методы анализа, основанные на нагревании и сплавлении веществ § 10. Хроматографический метод анализа § 11. Кинетические методы анализа Б. УСЛОВИЯ ВЫПОЛНЕНИЯ КАЧЕСТВЕННЫХ РЕАКЦИЙ § 12. Специфичность и чувствительность реакций § 13. Максимальная чувствительность аналитических реактивов § 14. Способы повышения чувствительности реакций § 15. Маскировка мешающих ионов § 16. Определение pH среды § 17. Регулирование pH среды в процессе аналитических определений В.  РЕАКТИВЫ РЕАКТИВЫ§ 18. Понятие о химических реактивах § 19. Концентрация применяемых реактивов § 20. Техника пользования реактивами Г. ПОСУДА И ПРИБОРЫ, ПРИМЕНЯЕМЫЕ В КАЧЕСТВЕННОМ АНАЛИЗЕ § 21. Химическая посуда § 22. Приборы Д. АНАЛИТИЧЕСКИЕ ГРУППЫ § 23. Дробный и систематический анализ § 24. Аналитическая классификация катионов § 25. Сводные таблицы действия реактивов на катионы и анионы Е. ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА И АНАЛИТИЧЕСКАЯ КЛАССИФИКАЦИЯ ИОНОВ § 26. Значение периодического закона в аналитической химии § 27. Периодическая система элементов Д. И. Менделеева как классификация атомов по их строению § 28. Зависимость некоторых химических свойств элементов от положения их в периодической системе Д. И. Менделеева § 29. Растворимость химических соединений в связи с положением элементов в периодической системе Д. И. Менделеева § 30. Открытие новых аналитических реакций § 31. Аналитические группы и периодическая система элементов Д.  И. Менделеева И. МенделееваОБНАРУЖЕНИЕ ИНДИВИДУАЛЬНЫХ КАТИОНОВ И АНАЛИЗ СМЕСЕЙ КАТИОНОВ § 1. Характеристика первой аналитической группы катионов § 2. Общие реакции катионов первой аналитической группы РЕАКЦИИ КАТИОНОВ 1-й ПОДГРУППЫ § 3. Обнаружение NН-ионов § 4. Методы разложения и удаления солей аммония § 6. Обнаружение Rb-ионов § 7. Обнаружение Cs-ионов § 8. Анализ смеси катионов первой подгруппы РЕАКЦИИ КАТИОНОВ 2-й ПОДГРУППЫ § 9. Обнаружение Li-ионов § 10. Обнаружение Na-ионов § 11. Обнаружение Mg-ионов § 12. Обзор действия реактивов на катионы первой аналитической группы § 13. Анализ смеси катионов второй подгруппы § 14. Анализ смеси ионов § 15. Анализ смеси ионов ГЛАВА V. ВТОРАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ § 1. Характеристика второй аналитической группы катионов § 2. Общие реакции катионов второй аналитической группы § 3. Обнаружение Ca-ионов § 4. Обнаружение Sr-ионов § 5.  Обнаружение Ba-ионов Обнаружение Ba-ионов§ 6. Обзор действия реактивов на катионы второй аналитической группы § 7. Основы теории осаждения катионов второй аналитической группы групповым реактивом—карбонатом аммония § 8. Систематический ход анализа смеси катионов первой и второй аналитических групп § 9. Систематический ход анализа смеси катионов первой и второй аналитических групп в присутствии ионов § 10. Теоретические основы перевода сульфатов катионов второй аналитической группы в карбонаты ГЛАВА VI. ТРЕТЬЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ § 1. Характеристика третьей аналитической группы катионов § 2. Общие реакции катионов третьей аналитической группы § 3. Обнаружение Be-ионов § 4. Обнаружение Al-ионов § 5. Обнаружение ионов титана (IV) § 6. Обнаружение Cr-ионов § 7. Обнаружение Mn-ионов § 8. Обнаружение Fe-ионов § 9. Обнаружение Fe-ионов § 10. Обнаружение Co-ионов § 13. Обнаружение ионов циркония (IV) § 14. Обнаружение UO-ионов § 15.  Обзор действия реактивов на катионы третьей аналитической группы Обзор действия реактивов на катионы третьей аналитической группы§ 16. Использование коллоидных систем в химическом анализе § 18. Теоретические основы применения органических реактивов в качественном анализе неорганических веществ § 19. Методы разделения некоторых катионов третьей аналитической группы § 20. Систематический ход анализа смеси катионов третьей аналитической группы § 21. Систематический ход анализа смеси катионов первой, второй и третьей аналитических групп § 22. Систематический ход анализа смеси катионов первой, второй и третьей аналитических групп в присутствии PO-ионов ГЛАВА VII. ЧЕТВЕРТАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ § 1. Характеристика четвертой аналитической группы катионов § 2. Общие реакции катионов четвертой аналитической группы РЕАКЦИИ КАТИОНОВ ПЕРВОЙ ПОДГРУППЫ (ПОДГРУППЫ МЕДИ) § 3. Обнаружение Hg-ионов § 4.  Обнаружение Cu-ионов Обнаружение Cu-ионов§ 5. Обнаружение Cd-ионов § 6. Обнаружение Bi-ионов РЕАКЦИИ КАТИОНОВ ВТОРОЙ ПОДГРУППЫ (ПОДГРУППЫ МЫШЬЯКА) § 7. Обнаружение ионов мышьяка (III) § 8. Обнаружение ионов мышьяка (V) § 9. Общие реакции обнаружения § 10. Обнаружение ионов сурьмы (III) § 11. Обнаружение ионов сурьмы (V) § 12. Общие реакции обнаружения Sb § 13. Обнаружение ионов олова (II) § 14. Обнаружение ионов олова (IV) § 15. Общие реакции обнаружения ионов олова (II) и олова (IV) § 16. Отделение ионов олова от других ирнов четвертой аналитической группы § 17. Обнаружение ионов германия (IV) § 18. Отделение ионов германия от других ионов четвертой аналитической группы § 19. Обзор действия реактивов на катионы четвертой аналитической группы § 20. Основы теории осаждения сульфидов катионов четвертой аналитической группы групповым реактивом — сероводородом § 21. Систематический ход анализа смеси катионов четвертой аналитической группы  ПЯТАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ (ГРУППА СЕРЕБРА) ПЯТАЯ АНАЛИТИЧЕСКАЯ ГРУППА КАТИОНОВ (ГРУППА СЕРЕБРА)§ 1. Характеристика пятой аналитической группы катионов § 2. Общие реакции катионов пятой аналитической группы § 3. Обнаружение Ag-ионов § 4. Обнаружение [Hg]-ионов § 5. Обнаружение Pb-ионов § 6. Обзор действия реактивов на катионы пятой аналитической группы § 7. Систематический ход анализа смеси катионов пятой аналитической группы ГЛАВА IX. АНАЛИЗ СМЕСИ ИОНОВ ВСЕХ ПЯТИ АНАЛИТИЧЕСКИХ ГРУПП § 1. Сероводородный метод анализа § 2. Недостатки сероводородного метода анализа § 3. Ошибки, возникающие при анализе смеси ионов пяти аналитических групп § 4. Бессероводородные методы анализа ОБНАРУЖЕНИЕ ИНДИВИДУАЛЬНЫХ АНИОНОВ И АНАЛИЗ СМЕСЕЙ АНИОНОВ § 1. Аналитическая классификация анионов § 2. Групповые реактивы на анионы § 3. Классификация методов анализа анионов ГЛАВА XI. ПЕРВАЯ АНАЛИТИЧЕСКАЯ ГРУППА АНИОНОВ § 1. Характеристика первой группы анионов § 2. Реакции анионов первой группы § 3. 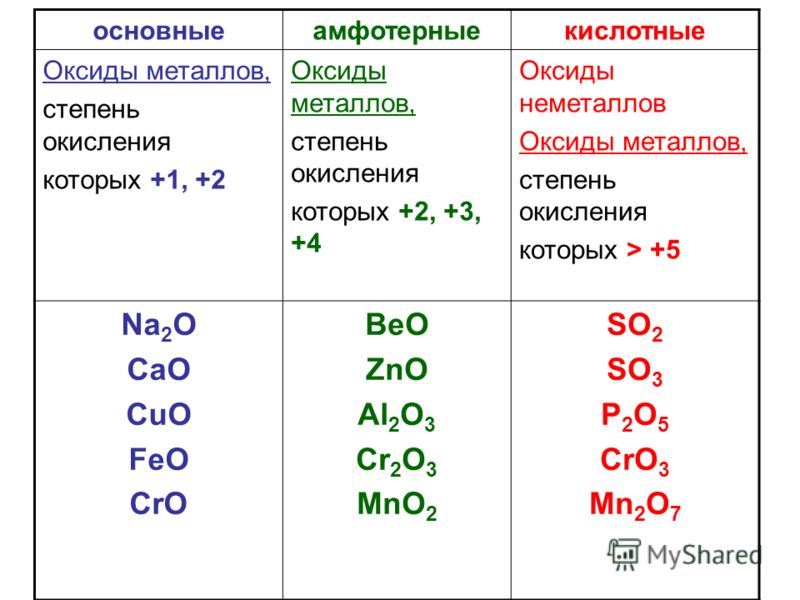 Обнаружение CI-ионов Обнаружение CI-ионов§ 4. Обнаружение Br-ионов § 5. Обнаружение I-ионов § 6. Обнаружение CN-ионов § 7. Обнаружение SCN-ионов § 8. Обнаружение [Fe(CN)]-ионов § 9. Обнаружение Fe(CN)-ионов § 10. Обнаружение NO-ионов § 11. Обнаружение NO2-ионов § 12. Обнаружение S-ионов § 13. Обнаружение Ch4COOO-ионов § 14. Обнаружение BrO3-ионов § 15. Обнаружение ClO3-ионов § 16. Обнаружение ClO4-ионов § 17. Обзор действия реактивов на анионы первой группы МЕТОДЫ АНАЛИЗА НЕКОТОРЫХ СМЕСЕЙ АНИОНОВ § 18. Анализ смеси Cl, Br и I-ионов § 19. Анализ смеси Cl, Br, I и SCN-ионов § 20. Анализ смеси Cl, ClO3 и ClO4-ионов § 21. Анализ смеси NO2 и NO3-ионов § 22. Анализ смеси анионов первой группы ГЛАВА XII. ВТОРАЯ АНАЛИТИЧЕСКАЯ ГРУППА АНИОНОВ § 1. Характеристика второй группы анионов § 2. Общие реакции анионов второй группы § 3. Обнаружение SO3-ионов § 4. Обнаружение S2O3-ионов § 5. Обнаружение S2O3 в присутствии SO3-ионов § 6.  Обнаружение SO4-ионов Обнаружение SO4-ионов§ 7. Обнаружение CO3-ионов § 8. Обнаружение CO3-ионов в присутствии SO3 и S2O3-ионов § 9. Обнаружение PO4-ионов § 10. Обнаружение CrO4-ионов § 11. Обнаружение AsO3-ионов § 12. Обнаружение AsO4-ионов § 13. Обнаружение BO2 и BO3-ионов § 14. Обнаружение SiO3-ионов § 15. Обнаружение F-ионов § 16. Обнаружение C2O4-ионов § 17. Обнаружение VO3-ионов § 18. Обнаружение MoO4-ионов § 19. Обнаружение WO4-ионов § 20. Обзор действия реактивов на анионы второй группы МЕТОДЫ АНАЛИЗА НЕКОТОРЫХ СМЕСЕЙ АНИОНОВ § 21. Анализ смеси ионов § 22. Анализ смеси SO3, SO4, S2O3 и CO3-ионов § 23. Анализ смеси VO2, MoO4 и WO4-ионов § 24. Анализ смеси анионов второй группы § 25. Анализ смеси анионов первой и второй групп ГЛАВА XIII. ОБНАРУЖЕНИЕ СВОБОДНЫХ МЕТАЛЛОВ И НЕМЕТАЛЛОВ, ИДЕНТИФИЦИРОВАНИЕ СОЛЕЙ И ДРУГИХ ИНДИВИДУАЛЬНЫХ СОЕДИНЕНИЙ И АНАЛИЗ ИХ СМЕСЕЙ § 1. Подготовка вещества к анализу § 2. Предварительные испытания § 3. 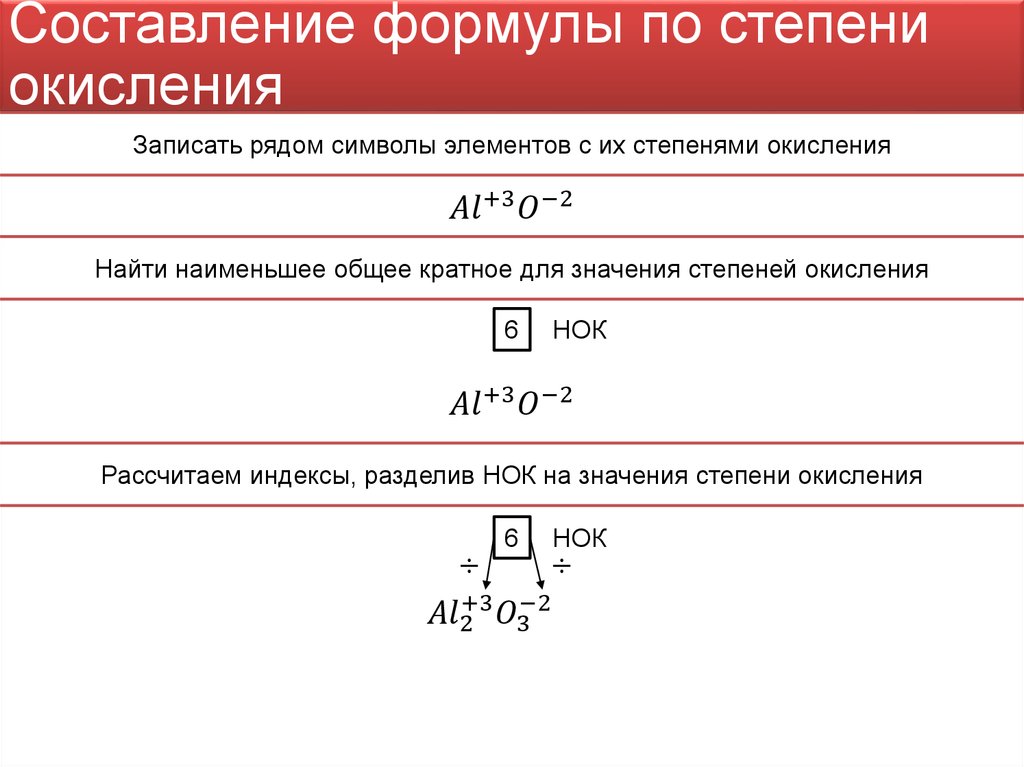 Растворение анализируемого вещества в воде, кислотах и щелочах Растворение анализируемого вещества в воде, кислотах и щелочах§ 4. Переведение в растворимое состояние веществ, нерастворимых в воде, кислотах и щелочах § 5. Анализ неизвестного вещества § 6. Обнаружение свободных элементов § 7. Идентифицирование солей и других индивидуальных соединений § 8. Обнаружение микропримесей § 9. Анализ сплавов § 10. Анализ силикатов и алюмосиликатов § 11. Анализ смеси неорганических веществ § 12. Экспрессный метод анализа смесей катионов и анионов § 13. Идентифицирование нерастворимых веществ ЛИТЕРАТУРА |
Химические свойства
Тиосерная
кислота (h3S2O3)
в присутствии воды разлагается:
h3S2O3 →
S + SO2 +
h3O,
поэтому
её выделение из водного раствора
невозможно. Свободная тиосерная кислота
может быть получена при взаимодействии
хлорсульфоновой кислоты с сероводородом
при низкой температуре:
HSO3Cl
+ h3S → h3S2O3 +
HCl.
Выше 0 °C
свободная тиосерная кислота необратимо
разлагается:
h3S2O3 →
SO2 +
S + h3O.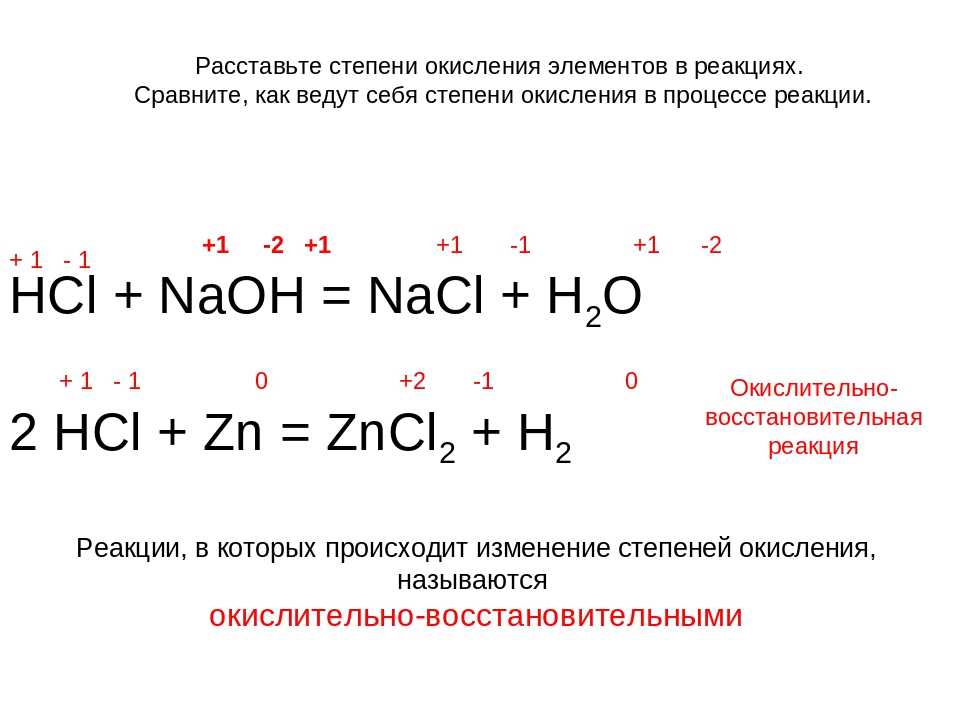 Благодаря
наличию серы в степени
окисления −2
тиосульфат-ион обладает восстановительными свойствами.
Слабыми окислителями (I2,
Fe3+) тиосульфаты
окисляются до тетратионатов:
2S2O32− +
2Fe3+ →
S4O62− +
2Fe2+
2S2O32− +
I2 →
S4O62− +
2I−
Более
сильные окислители окисляют
тиосульфаты до сульфатов:
S2O32− +
4Cl2 +
5h3O → SO42− +
8Cl− +
10H+
Сильные восстановители восстанавливают
тиосульфат-ион до сульфида,
например:
3S2O32− +
8Al + 14OH− +
9h3O → 6S2− +
8[Al(OH)4]−
Тиосульфат-ион
также является сильным
комплексообразователем:
Ag+ +
2S2O32− →
[Ag(S2O3)2]3−
Так
как тиосульфат-ион координируется
с металлами через
атом серы в степени
окисления −2,
в кислой среде тиосульфатные комплексы
легко переходят в сульфиды:
2[Ag(S2O3)2]3− +
2H+ →
Ag2S + 2SO2 +
h3O
Из-за
наличия атомов серы в
разных степенях
окисления в
кислой среде тиосульфаты склонны
к реакциям конпропорционирования:
S2O32− +
2H+ →
S + SO2 +
h3O
Благодаря
наличию серы в степени
окисления −2
тиосульфат-ион обладает восстановительными свойствами.
Слабыми окислителями (I2,
Fe3+) тиосульфаты
окисляются до тетратионатов:
2S2O32− +
2Fe3+ →
S4O62− +
2Fe2+
2S2O32− +
I2 →
S4O62− +
2I−
Более
сильные окислители окисляют
тиосульфаты до сульфатов:
S2O32− +
4Cl2 +
5h3O → SO42− +
8Cl− +
10H+
Сильные восстановители восстанавливают
тиосульфат-ион до сульфида,
например:
3S2O32− +
8Al + 14OH− +
9h3O → 6S2− +
8[Al(OH)4]−
Тиосульфат-ион
также является сильным
комплексообразователем:
Ag+ +
2S2O32− →
[Ag(S2O3)2]3−
Так
как тиосульфат-ион координируется
с металлами через
атом серы в степени
окисления −2,
в кислой среде тиосульфатные комплексы
легко переходят в сульфиды:
2[Ag(S2O3)2]3− +
2H+ →
Ag2S + 2SO2 +
h3O
Из-за
наличия атомов серы в
разных степенях
окисления в
кислой среде тиосульфаты склонны
к реакциям конпропорционирования:
S2O32− +
2H+ →
S + SO2 +
h3O
Фтороводород
в жидком и газообразном состояниях
имеет
большую склонность к ассоциации
вследствие образования сильных водородных
связей. Энергия водородных связей FH•••FH
приблизительно составляет 42 кДж/моль,
а средняя степень полимеризации в
газовой фазе (при температуре кипения)
≈4. Даже в газообразном состоянии,
фтороводород состоит из смеси полимеров
h3F2, h4F3, h5F4, H5F5, H6F6. Простые молекулы HF
существуют лишь при температурах выше
90 °C. Вследствие высокой прочности
связи, термический распад фтороводорода
становится заметным лишь выше 3500 °C
(что выше температуры плавления вольфрама —
самого тугоплавкого из металлов). Для
сравнения — у водытермический
распад становится заметным при
температурах выше 2000 °C.
Энергия водородных связей FH•••FH
приблизительно составляет 42 кДж/моль,
а средняя степень полимеризации в
газовой фазе (при температуре кипения)
≈4. Даже в газообразном состоянии,
фтороводород состоит из смеси полимеров
h3F2, h4F3, h5F4, H5F5, H6F6. Простые молекулы HF
существуют лишь при температурах выше
90 °C. Вследствие высокой прочности
связи, термический распад фтороводорода
становится заметным лишь выше 3500 °C
(что выше температуры плавления вольфрама —
самого тугоплавкого из металлов). Для
сравнения — у водытермический
распад становится заметным при
температурах выше 2000 °C.
Водородные соединения галогенов:получение,св-ва.F2+h3=2HF со взрывом,но получают HF:
CaF2+h3SO4=2HF+CaSO4.В обычных условиях газ с резким запахом,сжижается при t=+19,9 с образоанием жизкости.Многие в-ва хорошо раство=римы в этом р-ре.Св-ва:
Жидкий HF — сильный ионизирующий растворитель:
HCl + 2HF ↔ Clh3+ + HF2−
В жидком фтороводороде кислотные свойства проявляют соединения, которые являются акцепторами фторид ионов, например BF3, SbF5:
BF3 + 2HF → Fh3+ + BF4−
Амфотерными соединениями в среде жидкого фтороводорода являются, например, фториды алюминия и хрома(III):
3NaF + AlF3 → 3Na+ + AlF6−
(AlF3 — как кислота)
AlF3 + 3BF3 → Al3+ + 3BF4−
(AlF3 — как основание)
HF (плавиковая
кислота) является кислотой средней
силы. Соли плавиковой кислоты
называются фторидами.
Соли плавиковой кислоты
называются фторидами.
В лабораторных условиях хлороводород получают:
NaCl(тверд.) + h3SO4(конц.) = NaHSO4 + HCl↑(t)
При действии сильных окислителей или при электролизе хлороводород проявляет восстановительные свойства:
MnO2 + 4 HCl → MnCl2 + Cl2↑ + 2 h3O
При нагревании хлороводород окисляется кислородом (катализатор — хлорид меди(II) CuCl2):
4 HCl + O2 → 2 h3O +2 Cl2↑
Однако, концентрированная соляная кислота реагирует с медью, при этом образуется комплекс одновалентной меди:
2 Cu + 4 HCl → 2 H[CuCl2] + h3↑
Соляная кислота является сильной одноосновной кислотой, она энергично взаимодействует со всеми металлами, стоящими в ряду напряжений левее водорода, с основными и амфотерными оксидами, основаниями и солями, образуя соли — хлориды:
Mg + 2 HCl → MgCl2 + h3↑
FeO + 2 HCl → FeCl2 + h3O
Благодаря высокой концентрации хлорид-ионов в растворе металл связывается в хлоридный комплекс, что способствует его растворению:
3 Pt + 4 HNO3 + 18 HCl → 3 h3[PtCl6] + 4 NO↑ + 8 h3O
В промышленности HI получают по реакции иода с гидразином:
2 I2 + N2h5 → 4 HI + N2
HI способен восстанавливать концентрированную серную кислоту до сероводорода:
8HI + h3SO4 → 4I2 + h3S + 4h3O
Подобно другим галогенводородам, HI присоединяется к кратным связям (реакция электрофильного присоединения):
HI + h3C=Ch3 → h4CCh3I
Водный раствор бромистого водорода образует сильную одноосновную кислоту:
Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5 % молекул:
Как кислота реагирует с металлами, их оксидами, основаниями:
Является восстановителем, медленно окисляется на воздухе, из-за чего водные растворы, со временем, окрашиваются в бурый цвет:
Присвойте степени окисления каждому элементу следующих ионов.
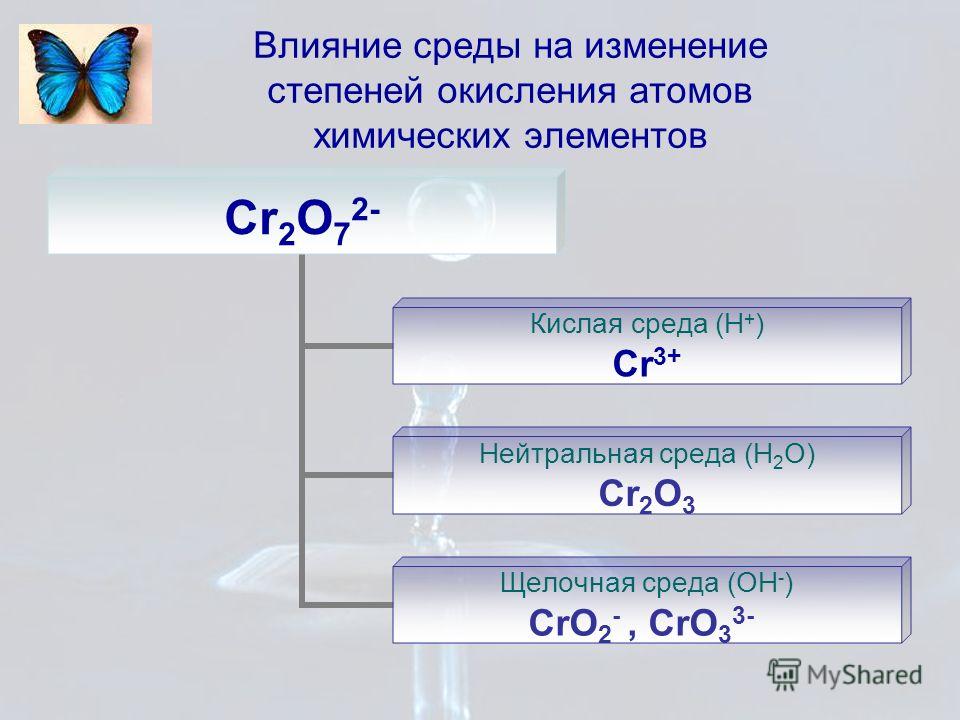 …
…Recent Channels
- General Chemistry
Chemistry
- General Chemistry
- Organic Chemistry
- Analytical Chemistry
- GOB Chemistry
- Biochemistry
Biology
- General Biology
- Microbiology
- Анатомия и физиология
- Генетика
- Клеточная биология
Math
- College Algebra
- Trigonometry
- Precalculus
Physics
- Physics
Business
- Microeconomics
- Macroeconomics
- Financial Accounting
Social Sciences
- Psychology
Начните вводить текст, затем используйте стрелки вверх и вниз, чтобы выбрать вариант из списка.
Общая химия6. Химические количества и водные реакцииРасчет степеней окисления
6:23
минуты
Задача 111d
Вопрос из учебника
Проверенное решение
Наши преподаватели рекомендовали это видео-решение как полезное для решения описанной выше задачи.
64просмотров
Было ли это полезно?
Смотреть дальше
Master Расчет числа окисления с небольшим видео-объяснением от Жюля Бруно
Начать обучение
Похожие видео
Связанные практики
Расчет степени окисления
Leah5sci MCAT
178views
Как рассчитать степень окисления или степень окисления? Easy Trick
Академия Najam
285просмотров
Вычисление числа окисления
Не думайте слишком много! с Praxis Academic
142 просмотров
Расчет чисел окисления
Жюль Брюно
360 просмотров
Как рассчитать степень окисления переходных металлов в координационных соединениях
Полное руководство ко всему
116views
Как вычислять номера окисления — базовое введение — DR K
Хемсимплифицированные
108Views
Оценки окисления — Учебник по химии
. Практические задачи
Практические задачи
Тайлер ДеВитт
187 просмотров
Как найти числа окисления (правила и примеры)
Уэйн Бреслин
136views
Calculate Oxidation Numbers Example 1
Jules Bruno
237views
Calculate Oxidation Numbers
Jules Bruno
197views
Calculate Oxidation Numbers Example 2
Jules Bruno
153views
Calculate Oxidation Numbers
Jules Bruno
238views
Расчет степеней окисления Пример 3
Jules Bruno
144views
Расчет степеней окисления
Жюль Бруно
119Views
Рассчитайте номера окисления. Пример 4
Жюль Бруно
171Views
Тест для ионов Thiosulfate (S2O3 2-).
О 3 2-). В зависимости от катиона металла тиосульфатные соединения могут представлять собой водные растворы или осадки. Кроме того, некоторые тиосульфатные соединения имеют специфические цвета, что является важным фактом в идентификации тиосульфата от других анионов. Ион тиосульфата содержит два атома серы и
три атома кислорода, но два атома серы имеют разные степени окисления, 0 и +4.
Ион тиосульфата содержит два атома серы и
три атома кислорода, но два атома серы имеют разные степени окисления, 0 и +4.В этом уроке мы изучим следующее.
Числа окисления тиосульфат-иона и окислительно-восстановительные реакции
В соответствии со структурой Льюиса S 2 O 3 2- ион, имеются две двойные связи. Одна двойная связь расположена между атомами серы другая двойная связь расположена между средним атомом серы и одним атомом кислорода. (С=О). Электроотрицательность кислорода выше, чем серы. Следовательно, атомы кислорода должны иметь отрицательные степени окисления. Степень окисления всех атомов кислорода равна -2. Однако один атом серы имеет степень окисления +4, а другой — 0,9.0005
Максимальная степень окисления серы +6. Поэтому тиосульфат-ион может быть окислен или восстановлен до другой степени окисления.
Следовательно, тиосульфат можно превратить в ион серы или сульфата в реакциях, которые можно применить для идентификации тиосульфата. ион в качественном анализе.
ион в качественном анализе.
Тесты на тиосульфат ион
- Тиосульфат и йод с Farina
- Agno 3 + S 2 O 3 2- Реакция
- 555.0008
- S 2 O 3 2- с хлоридом железа или ацетатом свинца
Тест на тиосульфат-ион: йод с фарином
Добавьте немного фарина в раствор йода. Раствор окрасится в синий цвет.
Затем добавьте сульфит натрия (Na 2 S 2 O 3 ) к этому синему цветовому решению. Вы можете видеть, что синий цвет исчезают из раствора из-за потери I 2 , потому что I 2 восстанавливается до иодид-ионов (I — ) и тиосульфат-ион окисляется до тетратионата (S 4 O 6 2-). Эти физические наблюдения подтверждают, что может быть тиосульфат-ионами в водном растворе.
Тест на тиосульфат-ион с нитратом серебра
- Добавить раствор нитрата серебра (AgNO 3 )
количества.
 Вы можете увидеть белый осадок тиосульфата серебра.
(Ag 2 S 2 O 3 ) образуется в растворе.
Вы можете увидеть белый осадок тиосульфата серебра.
(Ag 2 S 2 O 3 ) образуется в растворе.
- Добавьте больше раствора тиосульфат-иона (S 2 O 3 2-) к раствору Ag 2 S 2 O 3 осадок есть. Теперь вы можете видеть, что осадок начал растворяться и образовывать бесцветный раствор.
- But Ag 2 S 2 O 3 представляет собой нестабильное соединение. Поэтому он превращается в черный сульфид серебра. (Аг 2 С) .
Тест на тиосульфат-ион с перманганатом калия
Перманганат калия (KMnO 4 ) является сильным окислителем и водный раствор фиолетового цвета при растворении в воде. Перманганат калия реагирует с ионом S 2 O 3 2- двумя путями с образованием различных продуктов.
Ион тиосульфата с перманганатом калия в кислой среде
Перманганат калия восстанавливается до марганца +2
катион (Mn 2+ ) катионы по S 2 O 3 2- в кислых растворах.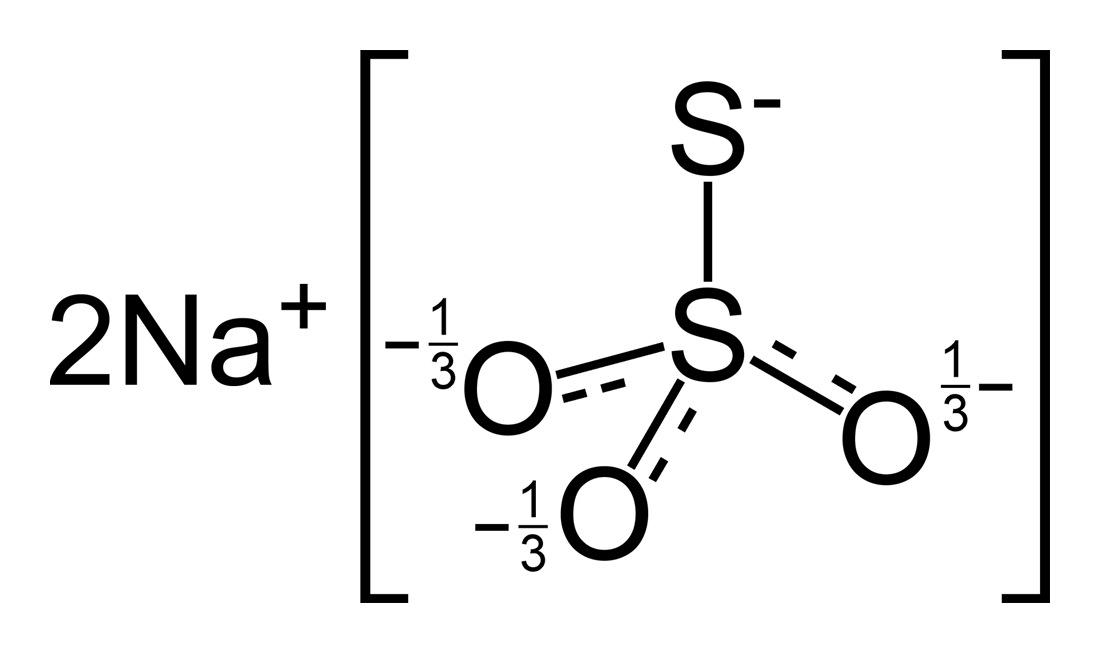 Вы можете увидеть фиолетовый цвет
водный раствор перманганата калия становится розовым или бесцветным за счет катиона Mn 2+ .
Вы можете увидеть фиолетовый цвет
водный раствор перманганата калия становится розовым или бесцветным за счет катиона Mn 2+ .
В качестве полуреакции окисления в этих реакциях образуются сульфаты и тетратионаты.
Ион тиосульфата с перманганатом калия в щелочной среде
Перманганат калия восстанавливается до двуокиси марганца (MnO 2 ) с помощью S 2 O 3 2-90 в щелочной среде2. Диоксид марганца MnO 2 представляет собой черный осадок, не растворимый в воде.
Тест на тиосульфат-ион с хлоридом железа
Хлорид железа (FeCl 3 ) дает темно-фиолетовый цвет окрашивание растворами тиосульфат-иона. Цвет быстро исчезает. Вероятно, это связано к образованию тиосульфатов железа (или соответствующего комплекса). Цвет тускнеет из-за восстановления иона трехвалентного железа (Fe 3+ ) к иону двухвалентного железа (Fe 2+ ).
Тест на тиосульфат-ион с кислотой
В присутствии разбавленной кислоты высвобождается тиосульфат-ион
диоксид серы (SO 2 ) газ и
сера. Из-за этого образования вы можете увидеть выделение бесцветного газа (SO 2 ) и белый/желтый осадок (сера).
В обоих продуктах атом серы в сере находится в состоянии 0, а атом серы в газообразном диоксиде серы находится в степени окисления +4. Итак, эта реакция
не является окислительно-восстановительной реакцией, поскольку степени окисления соответствующих атомов серы в ходе реакции не изменяются.
Из-за этого образования вы можете увидеть выделение бесцветного газа (SO 2 ) и белый/желтый осадок (сера).
В обоих продуктах атом серы в сере находится в состоянии 0, а атом серы в газообразном диоксиде серы находится в степени окисления +4. Итак, эта реакция
не является окислительно-восстановительной реакцией, поскольку степени окисления соответствующих атомов серы в ходе реакции не изменяются.
Тест на тиосульфат-ион с ацетатом свинца
Образуется белый осадок тиосульфата свинца (PbS 2 O 3 ). Но этот PbS 2 O 3 является нестабильным соединением. При кипячении выпадает черный осадок сульфида свинца (PbS).
Осадки ионов тиосульфата и красители
- Ag 2 S 2 O 3 : белый осадок, но он нестабилен и меняет цвет на черный Сульфид серебра.
- PbS 2 O 3 : белый осадок. Это также нестабильное соединение, которое легко превращается в сульфид свинца (PbS).
 черный осадок.
черный осадок.
Краткое изложение испытаний тиосульфат-иона и реакций
Молекулярная форма тиосульфат-иона
Один атон серы является центральным атомом в тиосульфат-ионе. Вокруг центрального атома имеется четыре сигма-связи и ноль неподеленных пар. Следовательно, молекулярная форма тиосульфат-иона тетраэдрическая.
Получение тиосульфат-иона
Реакция серы и сульфит-иона
Реакция ромбической формы серы с сульфит-ионом дает тиосульфат-ион.
SO 3 2- + S → S 2 O 3 2-
Окислительный номер S
2 O 3 2- it 9007. найдем степень окисления атомов серы в ионе S 2 O 3 2- по уравнению. Предполагается, что степени окисления атомов серы одинаковы. Степень окисления атомов кислорода принята равной -2.Степень окисления s принимается за x.
2*x + (-2)*3 = -6
x = +3
Но, рассчитав степень окисления по рисунку формы молекулы, мы получили степени окисления атомов серы +4 и 0.


 Вы можете увидеть белый осадок тиосульфата серебра.
(Ag 2 S 2 O 3 ) образуется в растворе.
Вы можете увидеть белый осадок тиосульфата серебра.
(Ag 2 S 2 O 3 ) образуется в растворе. черный осадок.
черный осадок.