Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
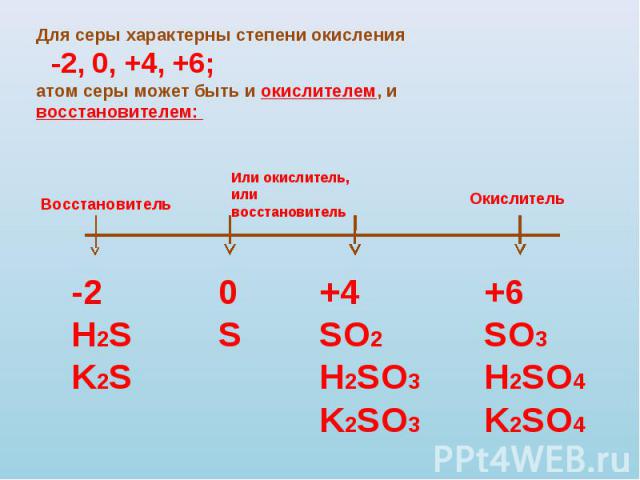
h3SO4+Ba(OH)2=BaSO4+h3O
Определите стандартную теплоту образования сероуглерода. ..
..
Решено
В сосуде находится смесь водорода…
Надо срочно решить!
Как очистить воду от нефти?
Пользуйтесь нашим приложением
Свойства триоксида серы (SO3) (25 фактов, которые вы должны знать)
Триоксид серы негорюч и образуется в результате реакции окисления диоксида серы. Рассмотрим подробно трехокись серы.
Триоксид серы является одним из компонентов кислотных дождей. Газообразная форма триоксида серы считается наиболее загрязняющим химическим соединением. Он также представляет опасность возгорания при контакте с органическими материалами, такими как ДВП, хлопок и дерево.
В этой статье обсуждается факты и свойства серы триоксид, такой как химическая формула, молярная плотность, вязкость, плотность, структура и реакция с основанием.
SO3 ИЮПАККомпания IUPAC название SO3 представляет собой трехокись серы.
Химическая формула триоксид серы ТАК3. Он состоит из двух компонентов, серы и кислорода, в которых три атома кислорода окружают центральный атом серы.
SO3 CAS номерCAS-номер SO3 7446-11-9.
SO3 Идентификатор ChemSpiderИдентификатор ChemSpider для SO3 это 23080.
SO3 химическая классификацияХимическая классификация триоксида серы выглядит следующим образом.,
- Триоксид серы представляет собой неорганический ангидрид.
- SO3 существует в виде кристаллического тримера, газообразного мономера и твердого полимера.
- SO3 является высокореакционноспособным веществом, а его паровая форма вызывает сильную коррозию.

- SO3 является сильным окислителем.
Молярная масса триоксида серы составляет 80.06 г/моль, в котором атомы серы и кислорода имеют молярная масса 32.065 г/моль и 16.00 г/моль соответственно.
SO3 цветТриоксид серы представляет собой бесцветную жидкость.
SO3 вязкостьКомпания вязкость of SO3 составляет 1.3 сП при 38 ⁰C.
SO3 молярная плотностьМолярная плотность SO3 1.92 г / см3 при 20 ⁰С.
SO3 температура плавленияТемпература плавления SO3 составляет 16.9 ⁰С.
SO3 точка кипенияТочка кипения SO3 составляет 45 ⁰С.
SO3 это жидкость, которая дымится на воздухе при комнатной температуре. Он превращается в белое кристаллическое твердое вещество при температуре ниже комнатной.
SO3 Ковалентная связьВ триоксиде серы их 3. ковалентные связи между атомами серы и кислорода, которые связаны друг с другом двойной связью. Здесь электроны поровну распределены между двумя неметаллами; Атомы серы и кислорода образуют ковалентные связи.
SO3 ковалентный радиусКовалентный радиус серы и кислорода составляет 104 пм и 74 пм соответственно.
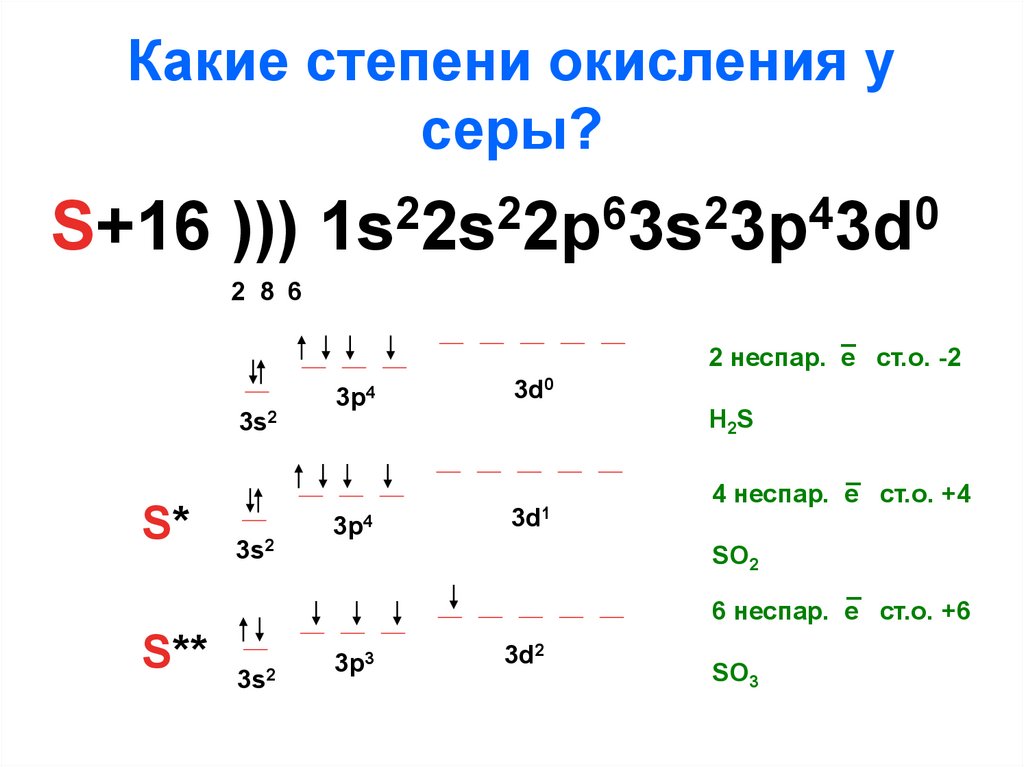
SO3 электронные конфигурацииКомпания электронная конфигурация представляет, сколько электронов распределено по орбитальным оболочкам. Обсудим электронную конфигурацию атомов SO3.
- Электронная конфигурация серы: [Ne] 3s.
 2 3p4
2 3p4 - Электронная конфигурация кислорода: [He] 2s.2 2p4
Атом серы имеет степень окисления +6, а кислород несет заряд -2 в молекулах триоксида серы. Поэтому триоксид серы является сильным окислителем.
SO3 кислотностьSO3 является кислым. Он бурно реагирует с водой, образуя сильную кислоту, например серную кислоту, которая окрашивает лакмусовый раствор в красный цвет.
ТАК3 без запаха?SO3 кислотный туман не имеет запаха и находится в парообразном состоянии. Имеет резкий запах.
ТАК3 парамагнитный?Магнитное поле слабо притягивает парамагнитные вещества, и они приобретают слабый магнетизм в том же направлении, что и магнитное поле.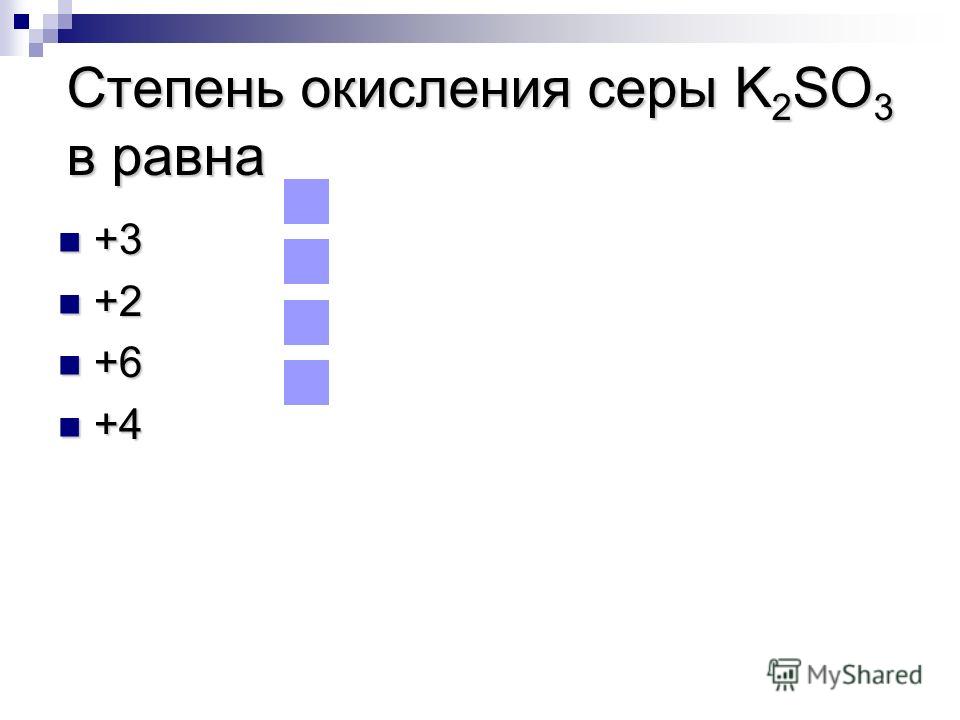 Давайте посмотрим на магнитное свойство SO3.
Давайте посмотрим на магнитное свойство SO3.
SO3 является диамагнитным. Самая внешняя оболочка атома серы и кислорода имеет 6 и 12 электронов соответственно. Общее количество электронов равно 18; следовательно, молекула имеет спаренные электроны.
SO3 гидратыSO3 представляет собой ангидрид серной кислоты. Он быстро гидратируется в присутствии влаги атмосферного воздуха с образованием серной кислоты.
- SO3 + H2О → Н2SO4
SO3 имеет тригональную планарную геометрию. Он подвергается зр.2 гибридизация, валентный угол OSO составляет 120⁰.
Тригональная плоская геометрия триоксида серыSO3 полярность и проводимость- SO3 является неполярным.
 Это связано с его тригональной плоской геометрией. Три связи между атомами серы и кислорода расположены под углом 120⁰ друг к другу, что отменяет их общую полярность и делает молекулу неполярной.
Это связано с его тригональной плоской геометрией. Три связи между атомами серы и кислорода расположены под углом 120⁰ друг к другу, что отменяет их общую полярность и делает молекулу неполярной. - SO3 проявляет проводимость при добавлении к раствору SbF5 и ХСО3F.
SO3 реагирует с соляной кислотой с образованием хлорсульфоновой кислоты (HSO3Cl), сильная кислота.
- HCl (водн.) + SO3 (л) → HSO3Кл (л)
SO3 реагирует с основанием, таким как гидроксид натрия, с образованием гидросульфата натрия.
- SO3+NaOH→NaHSO4
SO3 реагирует с оксидом, таким как оксид кальция, с образованием сульфата кальция.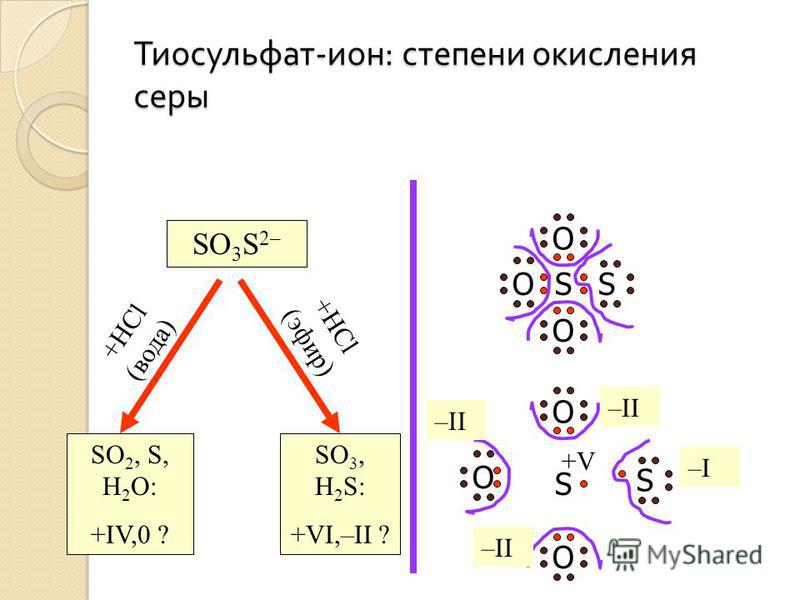 Это кислотно-щелочная реакция, используемая для удаления дыма от горящего угля, содержащего серу.
Это кислотно-щелочная реакция, используемая для удаления дыма от горящего угля, содержащего серу.
- СаО (т) + SO3 (ж) →CaSO4 (S)
SO3 реагирует с соединением металла, таким как триалкилфосфин, с образованием аддукта.
- R3Р+СО3 → Р3P+-ТАК3–
Триоксид серы представляет собой бесцветную жидкость, которая очень реакционноспособна. Он действует как сильный окислитель. Он подвергается зр.2 гибридизация с тригональной планарной геометрией.
Окисление диоксида серы одинарным и двойным путями переноса кислорода
Сохранить цитату в файл
Формат: Резюме (текст)PubMedPMIDAbstract (текст)CSV
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Добавить в мою библиографию
- Моя библиография
Не удалось загрузить делегатов из-за ошибки
Повторите попытку
Ваш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Эл. адрес:
(изменить)
адрес:
(изменить)
Который день? Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый рабочий день
Который день? ВоскресеньеПонедельникВторникСредаЧетвергПятницаСуббота
Формат отчета: РезюмеРезюме (текст)АбстрактАбстракт (текст)PubMed
Отправить максимум: 1 шт. 5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
Полнотекстовые ссылки
Уайли
Полнотекстовые ссылки
. 2014 15 сентября; 15 (13): 2723-31.
2014 15 сентября; 15 (13): 2723-31.
doi: 10.1002/cphc.201402306. Epub 2014 20 июня.
Анна Трояни 1 , Марцио Рози, Кьяра Сальвитти, Джулия де Петрис
принадлежность
- 1 Dipartimento di Chimica e Tecnologie del Farmaco, Римский университет «Сапиенца», P.le Aldo Moro 5, 00185 Roma (Italy), факс: 0039-06-49913604. [email protected].
- PMID: 24953698
- DOI: 10.1002/cphc.201402306
Анна Трояни и др.
Химфиз.
. 2014 15 сентября; 15 (13): 2723-31.
doi: 10.1002/cphc.201402306. Epub 2014 20 июня.
Авторы
Анна Трояни 1 , Марцио Рози, Кьяра Сальвитти, Джулия де Петрис
принадлежность
- 1 Dipartimento di Chimica e Tecnologie del Farmaco, Римский университет «Сапиенца», P.le Aldo Moro 5, 00185 Roma (Italy), факс: 0039-06-49913604. [email protected].
- PMID: 24953698
- DOI:
10.
 1002/cphc.201402306
1002/cphc.201402306
Абстрактный
Окисление SO2 оксоанионами неметаллов в газовой фазе исследуется экспериментальным и теоретическим изучением структуры участвующих частиц, кинетики и механизма реакции. SO3 , SO3(.-) и SO4(.-) эффективно получают реакцией анионов On XO(-) (X=Cl, Br и I; n=0 и 1) с SO2 ; Ионы XO(-) в основном реагируют с образованием SO3 за счет переноса атома кислорода, тогда как ионы OXO(-) в основном дают SO3(.-) за счет переноса аниона кислорода. При восхождении группы галогена от хлора к йоду отношение SO3/SO3(.-) уменьшается и увеличивается для реакций с участием анионов XO(-) и OXO(-) соответственно, тогда как образование SO4(.-) особенно существенно. с ОИО(-). Кинетические факторы играют основную роль в реакциях On XO (-), в зависимости от атома галогена и его степени окисления.
Ключевые слова: функционалы плотности; газофазная химия; ионно-молекулярные реакции; масс-спектрометрии; окисление диоксида серы.
© 2014 WILEY-VCH Verlag GmbH & Co. KGaA, Вайнхайм.
Похожие статьи
Сравнительная кинетика и механизм реакций переноса атомов кислорода и серы с участием бис(дитиоленовых) комплексов молибдена и вольфрама.
Ван Дж.Дж., Крятова О.П., Рыбак-Акимова Е.В., Холм Р.Х. Ван Дж.Дж. и др. Неорг хим. 2004 г., 13 декабря; 43 (25): 8092-101. doi: 10.1021/ic040087f. Неорг хим. 2004. PMID: 15578849
Об окислении трехмерных ароматических соединений [B(12)X(12)](2-) (X=F, Cl, Br, I).
Буре Р.Т., Дерендорф Дж., Йенне С., Кацпрзак С., Кесслер М., Рибау Р., Ридель С., Рёммеле Т.Л., Рюле М., Шерер Х., Вент-Шмидт Т., Варнеке Дж., Вебер С. Буре Р.Т. и др. Химия. 2014 7 апреля; 20 (15): 4447-59.
 doi: 10.1002/chem.201304405. Epub 2014 5 марта.
Химия. 2014.
PMID: 24595990
doi: 10.1002/chem.201304405. Epub 2014 5 марта.
Химия. 2014.
PMID: 24595990Кинетика анионов оксида серы, фторида серы и оксифторида серы с атомарными частицами при 298 и 500 К.
Миди А.Дж., Виджано А.А. Миди А.Дж. и др. J Phys Chem A. 15 марта 2007 г .; 111 (10): 1852-9. doi: 10.1021/jp066198c. Epub 2007, 17 февраля. J Phys Chem A. 2007. PMID: 17305321
Окисление SO2 до SO3 кластерными катионами оксида церия Ce2O4(+) и Ce3O6(.).
Чжоу ZX, Ван Л.Н., Ли ZY, Он С.Г., Ма ТМ. Чжоу ZX и др. J Phys Chem A. 9 июня 2016 г .; 120 (22): 3843-8. doi: 10.1021/acs.jpca.6b00108. Epub 2016 31 мая. J Phys Chem A. 2016. PMID: 27184540
Ионно-ионная химия многозарядных ионов большой массы.

Маклаки С.А., Стефенсон Дж.Л. мл. Маклаки С.А. и др. Mass Spectrom Rev. 1998, ноябрь-декабрь; 17(6):369-407. doi: 10.1002/(SICI)1098-2787(1998)17:63.0.CO;2-J. Масс-спектр, ред. 1998 г. PMID: 10360331 Обзор.
Посмотреть все похожие статьи
Цитируется
Внутрикластерное окисление диоксида серы анионами хлорита натрия: масс-спектрометрическое исследование.
Сальвитти С., Пепи Ф., Трояни А., де Петрис Г. Салвитти С. и др. Молекулы. 2021 24 ноября; 26 (23): 7114. doi: 10,3390/молекулы26237114. Молекулы. 2021. PMID: 34885696 Бесплатная статья ЧВК.
Газофазная реакционная способность карбонат-ионов с диоксидом серы: экспериментальное исследование кластерных реакций.

Трояни А., Сальвитти К., де Петрис Г. Трояни А. и др. J Am Soc Масс-спектр. 201930 (10) октября 1964–1972 гг. doi: 10.1007/s13361-019-02228-0. Epub 2019 8 июля. J Am Soc Масс-спектр. 2019. PMID: 31286448
Полнотекстовые ссылки
Уайли
Укажите
Формат: ААД АПА МДА НЛМ
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Отправить по номеру
WebElements Periodic Table » Сера » триоксид серы
- Формула: SO 3
- Формула системы Hill: O 3 S 1
- Регистрационный номер CAS: [7446-11-9]
- Вес формулы: 80.
 064
064 - Класс: оксид
- Цвет: бесцветный
- Внешний вид: жидкость
- Температура плавления: 16,9°C (гамма-форма)
- Температура кипения: 45°C
- Плотность: 1920 кг·м -3
Ниже приведены некоторые синонимы триоксида серы :
- триоксид серы
- оксид серы(VI)
- оксид серы
- триоксид серы
- оксид серы(VI)
- оксид серы
- триоксид серы
- оксид серы(VI)
Степень окисления серы в трехокиси серы составляет 6 .
Синтез
Недоступно
Твердотельная структура
- Геометрия серы:
- Прототип конструкции:
Элементный анализ
В таблице показано процентное содержание элементов для SO 3 (триоксид серы).
| Элемент | % |
|---|---|
| О | 59,95 |
| С | 40.05 |
Изотопная схема SO
3На приведенной ниже диаграмме показана расчетная изотопная картина для формулы SO 3 с наиболее интенсивным ионом, установленным на 100%.
Ссылки
Данные на страницах этих соединений собраны и адаптированы из основной литературы и нескольких других источников, включая следующие.
- Р.Т. Сандерсон в Chemical Periodicity , Рейнхольд, Нью-Йорк, США, 1960.
- Н.Н. Гринвуд и А. Эрншоу в Chemistry of the Elements , 2-е издание, Butterworth, UK, 1997.
- Ф.А. Коттон, Г. Уилкинсон, К.А. Мурильо и М. Бохманн, в Передовая неорганическая химия , John Wiley & Sons, 1999.
- А. Ф. Тротман-Дикенсон, (редактор) в Комплексная неорганическая химия , Пергамон, Оксфорд, Великобритания, 1973.


 03.14
03.14
 2 3p4
2 3p4 Это связано с его тригональной плоской геометрией. Три связи между атомами серы и кислорода расположены под углом 120⁰ друг к другу, что отменяет их общую полярность и делает молекулу неполярной.
Это связано с его тригональной плоской геометрией. Три связи между атомами серы и кислорода расположены под углом 120⁰ друг к другу, что отменяет их общую полярность и делает молекулу неполярной. 1002/cphc.201402306
1002/cphc.201402306 doi: 10.1002/chem.201304405. Epub 2014 5 марта.
Химия. 2014.
PMID: 24595990
doi: 10.1002/chem.201304405. Epub 2014 5 марта.
Химия. 2014.
PMID: 24595990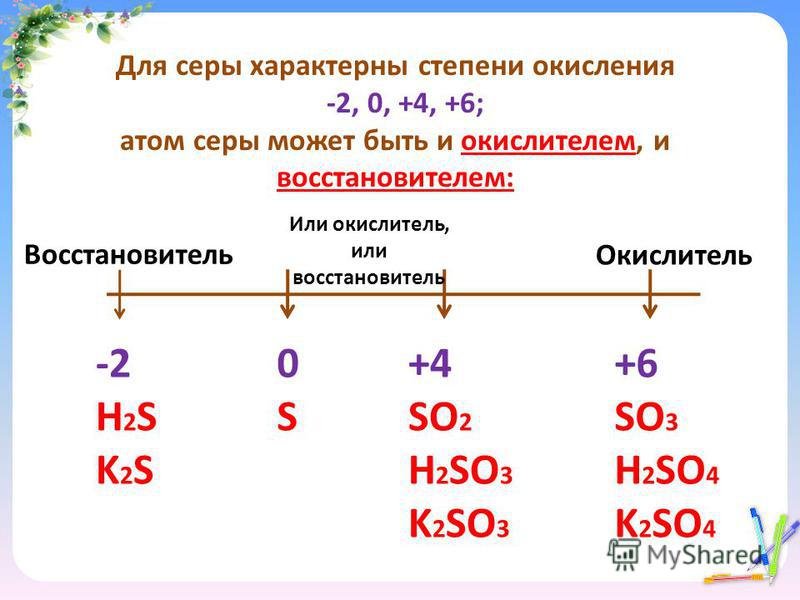
 064
064