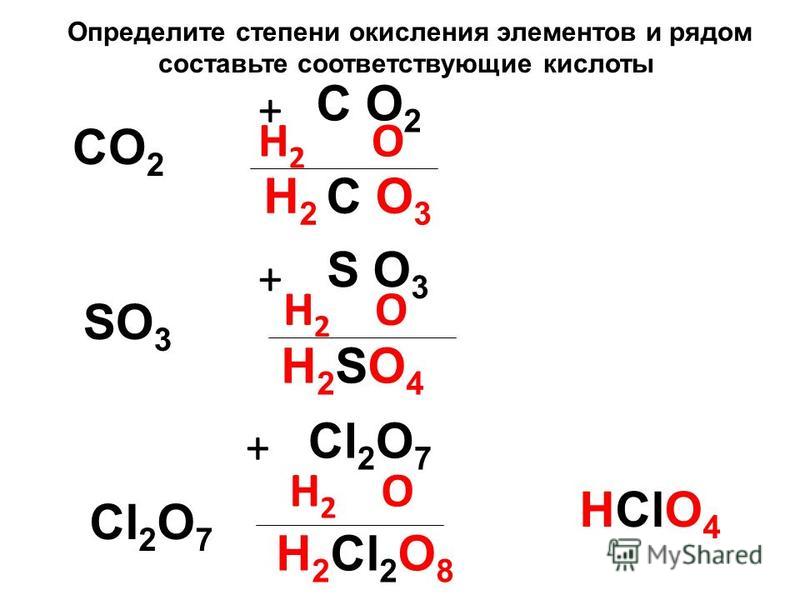
Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Определить степень окисления 1)HBr h3SO4=Br2. ..
..
Cr2O3 +KOH=
Разложение бертолетовой соли
электронный баланс Nh4+O2=NO+h3O
Пользуйтесь нашим приложением
физические и химические свойства, получение и история открытия
Фосфин (Ph4)
Способы получения фосфина
Прямым синтезом Ph4 получить нельзя.
- Фосфин получают путем водного или кислотного гидролиза фосфидов:
Ca3P2 + 6h3O → 3Са(ОН)2 + 2Ph4↑
Mg3P2 + 6HCl → 3MgCl2 + 2Ph4↑
- Реакция диспропорционирования фосфора в щелочах:
4P + 3KOH + 3h3O → 3Kh3PO2 + Ph4↑
- Разложение солей фосфония (Температура выше 80ºС):
P4I ↔ HI+ Ph4↑
Физические свойства фосфина
При нормальной температуре фосфин является бесцветным газом с резким чесночным запахом. В воде малорастворим, хорошо растворим в органических растворителях
В воде малорастворим, хорошо растворим в органических растворителях
Фосфин — Яд!
Химические свойства фосфина
- PH3не реагирует с водой, щелочами, аммиаком.
Ph4— Проявляет свойства сильного восстановителя.
- Вступает в реакции с кислотами – окислителями:
Ph4 + 8h3SO4(конц) = h4PO4 + 8SO2↑ + 3h3O
Ph4 + 8HNO3(конц. гор) = h4PO4 + 8NO2↑ + 4h3O
- С безводными кислотами образует соли:
HI+ Ph4↑ = P4I
- Окисляется кислородом. При Т ~ 150ºС самовозгорается:
РН3 + 2О2 = P2O5 + h3O (Н3РО4)
Практического значения фосфин не имеет.
Фосфиды
Способы получения
Взаимодействие фосфора с металлами:
2P + 3Mg → Mg3P2
2P + 3Ca → Ca3P2
P + 3Na → Na3P
Физические свойства, строение фосфидов
Фосфиды – представляют собой продукты взаимодействия фосфора с металлами.
Фосфиды щелочных и щелочноземельных металлов имеют ионное строение.
Химические свойства фосфидов
Фосфиды крайне неустойчивы и легко подвергаются необратимому гидролизу с образованием РН3:
Ca3P2 + 6h3O → 3Са(ОН)2 + 2Ph4↑
Mg3P2 + 6HCl → 3MgCl2 + 2Ph4↑
Оксид фосфора (III), триоксид фосфора (P2O3)
Способы получения оксида фосфора (III)
- Р2О3 образуется при горении фосфора в недостатке кислорода или его медленном окислении:
4Р + 3О2 = 2Р2О3
Физические свойства оксида фосфора (III)
При комнатной температуре Р2О3 — белая воскообразная масса с неприятным запахом. Легко испаряется, его Тпл = 23,5°С
Пары существует в виде димеров Р4О6.
!Очень ядовит
Химические свойства оксида фосфора (III)
- Р2О3 как кислотный оксид при взаимодействии с водой образует фосфористую кислоту:
Р2О3 + ЗН2О =2h4PO3
- Реакция диспропорционирования происходит очень бурно при растворении Р2О3вгорячей воде:
2Р2О3 + 6Н2О = РН3 + Зh4PO4
- При взаимодействии Р2О3 с щелочами образуются соли фосфористой кислоты:
Р2О3 + 4NaOH = 2Na2HPO3 + Н2О
- При взаимодействии с окислителями P2O3 проявляет восстановительные свойства:
Окисление кислородом воздуха:
Р2О3 + О2 = Р2О5
Окисление галогенами:
Р2О3 + 2Cl2 + 5Н2О = 4HCl + 2h4PO4
Получение
Для получения ортофосфорной кислоты применяются в основном два метода: метод влажного травления и термальный метод. Первый метод является наиболее востребованным для синтеза больших количеств кислоты, он заключается в обработке природных фосфатов минеральными кислотами, в основном серной (азотная и соляная кислоты используются значительно реже). Получаемая таким методом кислота называется влажной фосфатной кислотой.
Первый метод является наиболее востребованным для синтеза больших количеств кислоты, он заключается в обработке природных фосфатов минеральными кислотами, в основном серной (азотная и соляная кислоты используются значительно реже). Получаемая таким методом кислота называется влажной фосфатной кислотой.
Производство кислоты с термальным методом происходит путем окисления фосфора, получаемого из фосфатов, до оксида P 4 O 10 и последующей гидратацией.
Метод влажного травления
Несмотря на то, что принцип пищеварения фосфатов был разработан еще в 1880-х годах, его активное применение началось только после окончания Второй мировой войны — в ответ на стремительный рост спроса на минеральные удобрения.
В качестве основного сырья для пищеварения применяется апатит, который является весьма распространенным минералом:
(x = 0,1 … 2,2)
Для лучшего отделения малорастворимого гидрата сульфата кальция, реакцию обычно проводят в двух температурных режимах: при 70-80 ° C осадок выделяется преимущественно в форме дигидрата CaSO 4 · 2H 2 O, а при 80-90 ° C — в форме гемигидрата CaSO 4 · 0 , 5H 2 O. Вне этих температурных диапазонов осаждения происходит неэффективно.
Вне этих температурных диапазонов осаждения происходит неэффективно.
Дигидратний процесс
Для проведения осаждения за дигидратним методом выходной фосфат размалывают до размера частиц в 150 мкм (не менее 75% гранулометрического состава). Концентрация конечного раствора кислоту варьируется в пределах 28-31% P 2 O 5.
Дигидратний процесс имеет большее применение, поскольку проводится по меньшей температуры, помогает снизить износ оборудования и коррозионные процессы. Также процесс позволяет использование в пищеварении большего количества фосфатных пород. К недостаткам этого способа относят сравнительно невысокую концентрацию раствора кислоты и относительно большие потери оксида (до 4-6%).
Гемигидратний процесс
Гемигидратний процесс значительно дороже в производстве, но позволяет получать растворы с концентрацией 40-50% P 2 O 5. В основном гемигидратний процесс проводится в комплексе с дигидратним. Один из первых Двухстадийная процессов был разработан в Японии, где остро стоял вопрос получения сверхчистого сульфата кальция для производства строительных материалов (в Японии отсутствуют природные залежи гипса).
В зависимости от порядка проведения осаждения за дигидратним (ДГ) и гемигидратним (ГГ) методами, различают:
- ГГ процесс:
концентрация конечного раствора — 40-48% P 2 O 5 одностадийная фильтрация осадок — CaSO 4 · 0,5H 2 O (с примесями)
- ГГ / ДГ процесс без промежуточной фильтрации:
концентрация конечного раствора — 30-32% P 2 O 5 одностадийная фильтрация осадок — CaSO 4 · 2H 2 O (чистый)
- ГГ / ДГ процесс с промежуточной фильтрацией:
концентрация конечного раствора — 40-52% P 2 O 5 двухстадийная фильтрация осадок — CaSO 4 (сверхчистый)
- ДГ / ГГ процесс:
концентрация конечного раствора — 32-36% P 2 O 5 повторяющаяся фильтрация с возвращением фильтрата осадок — CaSO 4 · 0,5H 2 O (сверхчистый)
Термальный метод
Производство ортофосфорной кислоты с термальным методом проводится путем сжигания белого (желтого) фосфора в кислороде воздуха и последующим растворением в воде:
Процесс IG
По методу окисления проводится в цилиндрических реакторах, в которых сверху впрыскивается смесь кислорода и атомизованого фосфора, а внизу находится вода для поглощения образованного оксида. Поскольку сжигание фосфора происходит с большим тепловым эффектом (достигается температура свыше 2000 ° C), по внутренней стороне стенок реактора подается охлажденная фосфатный кислота, которая предотвращает чрезмерное влияния температуры на металл. Все детали реактора производятся из низкоуглеродистой стали или резины — эти материалы не подвергаются воздействию кислоты при температурах до 100 ° C.
Поскольку сжигание фосфора происходит с большим тепловым эффектом (достигается температура свыше 2000 ° C), по внутренней стороне стенок реактора подается охлажденная фосфатный кислота, которая предотвращает чрезмерное влияния температуры на металл. Все детали реактора производятся из низкоуглеродистой стали или резины — эти материалы не подвергаются воздействию кислоты при температурах до 100 ° C.
Концентрация конечной кислоты регулируется подачей воды для смешивания, а также охлаждением реакторов. Конечный продукт может иметь незначительную примесь фосфитнои кислоты (около 0,1%), которая образуется из полностью окисленного оксида фосфора (III).
Процесс TVA
(TVA) была предложена модификация термального метода: сожжение фосфора происходит в отдельной камере, дает больше времени на окисление. Твердые продукты окисления частично оседают на стенках и поглощают часть тепла, выделяемого в результате реакции, а также экранируют металл реактора от чрезмерного воздействия температуры.
Накопленный оксид фосфора растворяется в ортофосфорной кислоте с образованием полифосфатных кислот H n + 2P n O 3n + 1, которые имеют значительно большее содержание P 2 O 5. Так, по методу TVA получают раствор кислот с концентрацией 85% P 2 O 5, что соответствует концентрации ортофосфорной кислоты в 117%. При изготовлении камер для сжигания из графита, накопленный оксид фосфора (V) образует растворы кислот с концентрацией до 92% P 2 O 5.
Концентрирования
Концентрирования ортофосфорной кислоты до значений 40-55% P 2 O 5 видбуваетьcя путем испарения воды в вакууме при температурах около 120 ° C. Для достижения содержания оксида фосфора в 70% (суперфосфатная кислота), нагрев повышают до 200 ° C.
Оксид фосфора (V), пентаоксид фосфора, фосфорный ангидрид (Р2О5)
Способы получения фосфорного ангидрида
Сжигание фосфора в избытке воздуха:
4Р + 5О2 = 2Р2О5
Физические свойства фосфорного ангидрида
При комнатной температуре Р2О5 — белые стеклообразные хлопья без запаха.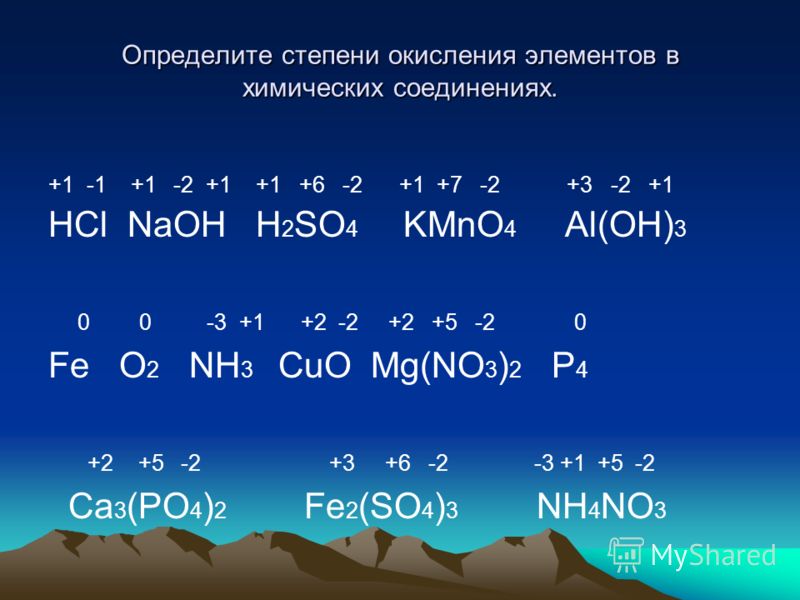 Существует в виде димеров Р4О10.
Существует в виде димеров Р4О10.
Очень гигроскопична, при соприкосновении с воздухом расплывается в сиропообразную жидкость (НРO3). Р2О5 — самое эффективное осушающее средство и водоотнимающий агент. Применяется для осушения нелетучих веществ и газов.
Химические свойства фосфорного ангидрида
Р2О5проявляет кислотные свойства.
Как кислотный оксид Р2О5 взаимодействует:
- с водой, с образованием различных кислот:
Р2О5 + Н2О = 2HPO3 метафосфорная
Р2О5 + 2Н2О = Н4Р2О7 пирофосфориая (дифосфорная)
Р2О5 + ЗН2О = 2h4PO4 ортофосфорная
- с основными оксидами, с образованием фосфатов
Р2О5 + ЗВаО = Ва3(PO4)2
- с щелочами, с образованием средних и кислых солей
Р2О5 + 6NaOH = 2Na3PO4 + ЗН2О
Р2О5 + 4NaOH = 2Na2HPO4 + Н2О
Р2О5 + 2NaOH = 2Nah3PO4 + Н2О
- Фосфорный ангидрид способен отнимать у других веществ не только гигроскопическую влагу, но и химически связанную воду.
 Например, он дегидратирует оксокислоты, что широко используется для получения ангидридов кислот:
Например, он дегидратирует оксокислоты, что широко используется для получения ангидридов кислот:
Р2О5 + 2HNО3 = 2HPO3 + N2О5
Р2О5 + 2НСlО4 = 2HPO3 + Сl2О7
P2O5 + h3SO4 → 2HPO3 + SO3
P2O5 + 2Ch4COOH → 2HPO3 + (Ch4CO)2O
Видеоопыт Взаимодействие оксида фосфора с водой
Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Ортофосфорная кислота |
| 102 | Другие названия | |
| 103 | Латинское название | |
| 104 | Английское название | |
| 105 | Химическая формула | h4PO4 |
| 106 | Тип | Неорганическое вещество |
| 107 | Группа | |
| 108 | Открыт | |
| 109 | Год открытия | |
| 110 | Внешний вид и пр. | |
| 111 | Происхождение | |
| 112 | Модификации | |
| 113 | Аллотропные модификации | |
| 114 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 115 | Конденсат Бозе-Эйнштейна | |
| 116 | Двумерные материалы | |
| 117 | Содержание в атмосфере и воздухе (по массе) | |
| 118 | Содержание в земной коре (по массе) | |
| 119 | Содержание в морях и океанах (по массе) | |
| 120 | Содержание во Вселенной и космосе (по массе) | |
| 121 | Содержание в Солнце (по массе) | |
| 122 | Содержание в метеоритах (по массе) | |
| 123 | Содержание в организме человека (по массе) | |
| 124 | Молярная масса |
Фосфористая кислота ( h4PO3)
Способы получения фосфористой кислоты
- Реакция Р2О3 с водой:
Р2О3 + ЗН2О =2h4PO3
- Гидролиз галогенидов фосфора (III):
PCl3 + ЗН2О = h4PO3+ 3HCl
- Окисление белого фосфора хлором:
2Р + 3Cl2 + 6Н2О = 2h4PO3+ 6HCl
Физические свойства, строение фосфористой кислоты
Для молекулы фосфористой кислоты h4PO3 известны 2 таутомерные формы. В одной из них 2 атома водорода молекулы связаны с кислородом, а один атом водорода связан непосредственно с атомом фосфора. Такой атом водорода не может быть замещен атомами металлов, поэтому кислота является двухосновной.
В одной из них 2 атома водорода молекулы связаны с кислородом, а один атом водорода связан непосредственно с атомом фосфора. Такой атом водорода не может быть замещен атомами металлов, поэтому кислота является двухосновной.
В другой таутомерной форме – все три атома водорода связаны с кислородом.
Формула фосфористой кислоты выглядит следующим образом: Н2[НРО3]
При комнатной температуре h4PO3 – кристаллическое вещество без цвета, хорошо растворимое в воде, Тпл = 74°С.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Химические свойства фосфористой кислоты
Является слабой кислотой.
- Для нее характерны все свойства кислот — взаимодействие с металлами с выделением Н2; с оксидами металлов и с щелочами. При этом образуются одно — или двухзамещенные фосфиты:
Н2[НРО3] + NaOH = NaH[HРО3] + Н2О
Н2[НРО3] + 2NaOH = Na2[HРО3] + 2Н2О
- Кислота является и окислителем и восстановителем, при нагревании вступая в реакции диспропорционирования:
h3HPO3 + h3HPO3 = h4PO4 + Ph4
Кислота и ее соли являются сильными восстановителями:
- Реагируют с сильными окислителями:
h4PO3 + Cl2 + Н2О = h4PO4 + 2HCl
5h4PO3 + 2KMnO4 + 3h3SO4 → 5h4PO4 + K2SO4 + 2MnSO4 + 3h3O
h4PO3 + HgCl2 + h3O → h4PO4 + Hg + 2HCl
- Реагируют с более слабыми окислителями:
h4PO3 + 2AgNO3 + Н2О = h4PO4 + 2Ag↓ + 2HNO3
- В реакции с сильными восстановителями, например, с щелочными и щелочно-земельными металлами, цинковой пылью, кислота восстанавливается до фосфина:
h3HPO3 + 3Zn + 3h3SO4 = 3ZnSO4 + Ph4 + 3Н2О
- При нагревании водного раствора Н3РO3окисляется до h4PO4 с выделением водорода:
h4PO3 + Н2О = h4PO4 + Н2
Кристаллические решётка:
| 300 | Кристаллическая решётка |
| 311 | Кристаллическая решётка #1 |
| 312 | Структура решётки |
| 313 | Параметры решётки |
| 314 | Отношение c/a |
| 315 | Температура Дебая |
| 316 | Название пространственной группы симметрии |
| 317 | Номер пространственной группы симметрии |
Соли фосфористой кислоты (Фосфиты)
Способы получения фосфитов
- Взаимодействие фосфористой кислоты с щелочами:
Н2[НРО3] + NaOH = NaH[HРО3] + Н2О
Н2[НРО3] + 2NaOH = Na2[HРО3] + 2Н2О
- взаимодействие фосфористой кислоты с металлами с выделением Н2
Н2[НРО3] + Ca = Ca[HРО3] + Н2
- взаимодействие фосфористой кислоты с оксидами металлов
Н2[НРО3] + CaO = Ca[HРО3] + Н2O
- диспропорционирование фосфора в горячем, концентрированном растворе щелочи:
P4 + 8NaOH(конц) + 4h3O = Na2[HРО3] + 6h3
- Взаимодействие трихлорида фосфора с разбавленным раствором щелочи:
PCl3 + 5NaOH(разб) = Na2[HРО3] + 3NaCl + 2h3O
Физические свойства фосфитов
Двухосновная фосфористая кислота образует два типа солей:
а) однозамещенные фосфиты (кислые соли), в молекулах которых атомы металлов связаны с анионами Н2РО3, например: Nah3PO3, Са(h3PO3)
б) двухзамещенные фосфиты (средние соли), в молекулах которых атомы металлов связаны с 2 или 1 анионом HPO3, например: Na2HPO3, СаHPO3.
Хорошо растворимы в воде только фосфиты щелочных металлов и кальция, остальные фосфиты плохо растворимы.
Химические свойства фосфитов
Имеют химические свойства, характерные для солей
Требования к упаковке и правила обращения с веществом
На таре, в которую расфасовывается кислота, обязательно должно быть обозначение “Опасно”, “Едкая жидкость”.
Хранить и транспортировать добавку разрешено в такой упаковке:
- полиэтиленовые канистры;
- стеклянные бутыли;
- контейнеры и автоцистерны из нержавеющей стали, которая прошла специальную обработку;
- пластиковые кубы.
Сами емкости для удобства помещают в полиэтиленовые барабаны или дощатые ящики, внутри которых должен быть мягкий наполнитель во избежание повреждения упаковки.
Попадание вещества на кожу или слизистые, в глаза или в дыхательные пути может вызывать ожоги, тошноту, рвоту, головокружение и нарушение целостности тканей. В таком случае необходимо незамедлительно обратиться за врачебной помощью.
В таком случае необходимо незамедлительно обратиться за врачебной помощью.
Кислота является опасной в обращении, поэтому работать с ней можно только вдали от открытых источников огня, в хорошо вентилируемом помещении.
Обязательно наличие защитной спецодежды: перчаток, респиратора, очков, ботинок и костюма для работы с опасными веществами.
Ортофосфорная кислота, фосфорная кислота (Н3РO4)
Способы получения фосфорной кислоты
В промышленности Н3РO4 получают двумя способами:
- Разложением природного соединения – фосфата кальция Са3(РO4)2 серной кислотой:
Са3(РO4)2 + 3h3SO4 = 2Н3РO4 + 3CaSO4↓
- Доменный (термический) 3х-стадийный способ:
1 стадия — восстановление природных фосфоритов коксом
2 стадия – окисление получающихся паров свободного фосфора кислородом воздуха
3 стадия – орошение водой получающейся окиси фосфора:
Лабораторный способ
- Н3РO4 получают окислением фосфора азотной кислотой:
ЗР + 5HNO3 + 2Н2О = ЗН3РO4 + 5NO↑
- Взаимодействием фосфорного ангидрида с водой:
Р2О5 + ЗН2О = 2h4PO4
Физические свойства, строение фосфорной кислоты
При обычной температуре безводная Н3РO4 – прозрачное, легкоплавкое (Тпл = 42°С) кристаллическое вещество. Н3РO4 -очень гигроскопичное вещество и смешивается с водой в любых соотношениях. Н3РO4 с небольшим количеством воды образует сиропообразную, вязкую жидкость.
Н3РO4 -очень гигроскопичное вещество и смешивается с водой в любых соотношениях. Н3РO4 с небольшим количеством воды образует сиропообразную, вязкую жидкость.
Степень окисления фосфора в фосфорной кислоте равна +5, валентность равна V.
При нагревании орто-фосфорной кислоты выше +213 °C, она переходит в пирофосфорную h5P2O7.
При нагревании выше 700°С переходит в метафосфорную кислоту HPO3:
Качественные реакции для обнаружения фосфат-иона
Для обнаружения анионов фосфорной кислоты используют раствор AgNO3, при помощи которого также можно различить мета-, пиро- и ортофосфорные кислоты друг от друга.
При добавлении AgNO3 к кислотам образуются осадки различного цвета:
- метафосфат серебра AgPO3— белый
- пирофосфат серебра Ag4P2O7 – также белый, но он не свертывает яичного белка
- ортофосфат серебра Ag3PO4— желтый:
Н3PO4 + 3AgNO3 → Ag3PO4↓ + 3НNO3
Видео Качественная реакция на фосфат-ион
Химические свойства фосфорной кислоты
Фосфорная кислота H3PO4 – это электролит средней силы и представляет собой трехосновную кислоту.
Диссоциация протекает в основном по 1-й ступени:
Н3РO4 → Н+ + Н2РO4—
По 2-й и 3-й ступеням диссоциация протекает в ничтожно малой степени:
Н2РO4— → Н+ + НРO42-
НРO42- → Н+ + РO43-
- Н3РO4 проявляет все общие свойства кислот — взаимодействует с активными металлами:
2Н3РO4 + 6Na = 2Na3РO4 + 3h3
- с основными оксидами:
2Н3РO4 + ЗСаО = Са3(РO4)2 + ЗН2О
2h4PO4 + 3MgO = Mg3(PO4)2 + 3h3O
- с основаниями образует три ряда солей – одно-, двух- и трехзамещенные (кислые и средние соли):
Н3РO4 + NaOH = Nah3PO4 + Н2О
Н3РO4 + 2NaOH = Na2HPO4 + 2Н2О
Н3РO4 + 3NaOH = Na3PO4 + ЗН2О
- с аммиаком образует соли аммония:
Н3РO4 + Nh4 = Nh5h3PO4
Н3РO4 + 2Nh4 = (Nh5)2HPO4
- Вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также вступает в обменные реакции с солями:
Н3PO4 + 3NaHCO3 → Na3PO4 + CO2 + 3h3O
- При нагревании h4PO4 выше 200°С происходит отщепление молекулы воды с образованием пирофосфорной кислоты h3P2O7:
2h4PO4 → h3P2O7 + h3O
В отличие от аниона NO3— в азотной кислоте, анион РO43- окисляющим действием не обладает.
Глобальный рынок
Многие развивающиеся страны начали сосредотачиваться на увеличении добычи фосфатов и производства фосфатов. Правительства некоторых стран уже сотрудничали с различными поставщиками по всему миру для создания заводов по добыче минералов для производства фосфорной кислоты. В 2021 году объем мирового рынка фосфорной кислоты оценивался в 45,85 миллиарда долларов. Ожидается, что к 2027 году он достигнет более 61 миллиарда долларов, а совокупный годовой темп роста составит 3,7%.
Рынок подразделяется на Азиатско-Тихоокеанский регион, Европу, Северную Америку, Латинскую Америку, Ближний Восток и Африку. Ожидается, что в ближайшем будущем Азиатско-Тихоокеанский регион будет доминировать на мировом рынке. Рост рынка фосфорной кислоты в этих регионах будет дополнительно подпитываться развитым сельскохозяйственным сектором Индии и Китая.
Соли ортофосфорной кислоты (ортофосфаты, фосфаты)
Способы получения фосфатов
Получают кислоты с металлами, оксидами металлов, гидроксидами (см. Химические свойства ортофосфорной кислоты)
Химические свойства ортофосфорной кислоты)
Физические свойства фосфатов
Н3РO4 является 3х-основной кислотой, поэтому образует 3 типа солей:
| Анион соли | Название | Растворимость в воде | Примеры солей |
| PO43- | Фосфат (ортофосфат) | большинство нерастворимы (кроме фосфатов щелочных металлов и аммония) | Na3РO4; Са3(РO4)2 |
| HPO42- | Гидрофосфат | растворимы | Na2НРO4; СаНРО4 |
| Н2РO4— | Дигидрофосфат | очень хорошо растворимы | Nah3PO4; Са(Н2РO4)2 |
Химические свойства фосфатов
- Имеют свойства, характерные для солей.
- Соли щелочных металлов подвержены гидролизу:
Na3РO4 + Н2О = Na2HPO4 + NaOH
- Характерная особенность ортофосфатов – отношение к прокаливанию: однозамещенные соли переходят в метафосфаты, двухзамещенные – в пирофосфаты, из трехзамещенных изменяются только соли аммония:
Nah3PO4 = NaPO3 + h3O
Na2HPO4 = Na4P2O7 + h3O
(Nh5)3PO4 = 3Nh4 + h3O
Фосфорные удобрения
Фосфаты и гидрофосфаты кальция и аммония используются в качестве фосфорных удобрений.
При достаточном количестве фосфора растения быстро растут и хорошо плодоносят. Внесение фосфорных удобрений благоприятствует росту корневой системы растения и повышению урожайности. В связи с этим такие удобрения важны при выращивании овощных, зерновых и плодово-ягодных культур.
В таблице ниже приведены основные виды фосфорных удобрений.
Категории V группа (азот, фосфор), НЕОРГАНИЧЕСКАЯ ХИМИЯ
Применение кислоты в промышленности
На сегодняшний день существует как минимум семь отраслей производства, в которых используется ортофосфатная или ортофосфорная кислота.
Как антиоксидант, разрыхлитель и регулятор кислотности, кислота повсеместно применяется в приготовлении таких пищевых продуктов:
- сладких газированных напитков;
- колбас;
- плавленого сыра;
- сдобы;
- молочных продуктов;
- детского питания;
- некоторых кондитерских изделий.
Добавка придаёт пище кислинку или слегка горьковатое послевкусие.
В сфере химической промышленности вещество используется для изготовления фосфорных солей аммония, марганца и натрия, огнеупорных связующих компонентов, негорючего пенопласта.
Как элемент гидрожидкостей, кислота применяется в авиационной промышленности.
Отрасль сельского хозяйства использует добавку как составляющую минеральных удобрений.
Кроме того, Е338 – элемент производства лакокрасочных изделий, стекла и керамики, моющей продукции, активированного угля, невоспламеняющихся красок.
Медицинская сфера, особенно стоматология, ортофосфорную кислоту применяет в своих целях: для борьбы с мочекаменной болезнью, как реактив для обработки внутренней поверхностей зубных коронок перед их установкой.
Косметологическая отрасль пользуется стабилизирующим свойством кислоты: компонент упрочняет химические связи между составляющими элементами продуктов.
В домашних условиях вещество популярно как средство для удаления ржавчины с металлов.
6.3.
 7: Кислотность оксокислоты определяется электроотрицательностью и степенью окисления центрального атома оксокислоты*
7: Кислотность оксокислоты определяется электроотрицательностью и степенью окисления центрального атома оксокислоты*- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 157377
- Стивен М. Контейкс
- LibreTexts
Оксикислоты (также известные как оксокислоты ) представляют собой соединения общей формулы \(\ce{H_{n}EO_{m}}\), где \(\ce{E}\) — неметалл или ранний переходный металл и кислые атомы водорода присоединены непосредственно к кислороду (не \(\ce{E}\)). К этому классу соединений относятся такие хорошо известные кислоты, как азотная кислота (\(\ce{HNO_2}\)) и фосфорная кислота (\(\ce{H_3PO_4}\)). -\). Таким образом, сила кислоты в таких гомологических рядах увеличивается с увеличением электроотрицательности центрального атома. Это видно из данных для гипогалоидных кислот в таблице \(\PageIndex{1}\), в которых сила кислоты увеличивается с увеличением электроотрицательности галогена, так что порядок кислотности следующий:
-\). Таким образом, сила кислоты в таких гомологических рядах увеличивается с увеличением электроотрицательности центрального атома. Это видно из данных для гипогалоидных кислот в таблице \(\PageIndex{1}\), в которых сила кислоты увеличивается с увеличением электроотрицательности галогена, так что порядок кислотности следующий:
\[\ce{HClO>HBrO>HIO} \nonumber \]
| HOX | Электроотрицательность X | К а |
|---|---|---|
| HCl | 3,0 | 4,0 × 10 −8 |
| ХОБр | 2,8 | 2,8 × 10 −9 |
| HOI | 2,5 | 3,2 × 10 −11 |
Обратите внимание, что влияние электроотрицательности центрального атома на силу оксикислот прямо противоположно наблюдаемому для бинарных гидридов в таблице \(\PageIndex{5}\), для которых кислотность увеличивалась вниз по группе, давая порядок кислотности:
\[\ce{HI>HBr>HCl \gg HF} \nonumber \]
Причина этого в том, что в галогеноводородах разрываемая связь (H-E связь) уменьшалась в силе вниз по группе, в то время как в оксикислотах разрываемой связью всегда является связь ОН, и поэтому ее сила гораздо меньше зависит от электроотрицательности центрального атома.
Тенденция 2: Для оксокислот с данным центральным атомом кислотность увеличивается с увеличением степени окисления центрального элемента или, другими словами, числа атомов кислорода, связанных с центральным атомом. 9{-}}\)) кислотный ряд. В таком ряду чем больше атомов кислорода, тем сильнее кислота. Это можно объяснить несколькими способами. С точки зрения самой кислоты ключевым фактором снова является индуктивный эффект, в данном случае связанный со способностью атомов кислорода, присоединенных к центральному атому, притягивать электронную плотность через связь ОН. Это видно из диаграммы плотности заряда оксокислот хлора, показанной на рисунке \(\PageIndex{1}\), на которой частичный положительный заряд кислого водорода увеличивается с увеличением количества присутствующих атомов кислорода.
Рисунок \(\PageIndex{1}\): Увеличение количества атомов кислорода увеличивает K a , о чем свидетельствует снижение электронной плотности на кислом водороде (который наиболее синий в HClO 4 ). Обратите внимание: K a = 10 -pK a , и поэтому чем больше pK a , тем меньше K a . (CC BY-SA-NC; анонимно)
Обратите внимание: K a = 10 -pK a , и поэтому чем больше pK a , тем меньше K a . (CC BY-SA-NC; анонимно)Повышение кислотности оксокислот с увеличением количества атомов кислорода, связанных с центральным атомом, также можно увидеть, рассматривая стабильность сопряженного оксианиона. То, что стабильность сопряженного основания увеличивается с увеличением количества атомов кислорода, видно из диаграмм распределения заряда и моделей связывания Льюиса для оксианионов хлора, показанных на рисунке \(\PageIndex{2}\) . По мере того, как отрицательный заряд распространяется на большее количество атомов кислорода, он становится все более рассеянным.
Рисунок \(\PageIndex{2}\): Повышенная диффузия заряда в оксианионах хлора с увеличением количества атомов кислорода. Чем больше ион, тем более рассеян заряд и, следовательно, меньше плотность заряда, что делает перхлорат наиболее стабильным анионом в ряду. Даже упрощенное рассмотрение связи, изображенной в резонансных структурах, правильно показывает повышенную дисперсию плотности заряда. (CC BY-SA-NC 3.0; анонимно)
(CC BY-SA-NC 3.0; анонимно)Упражнение \(\PageIndex{1}\)
Сера и селен образуют оксокислоты формулы \(\ce{H_2EO_3}\), где E представляет собой либо S, либо Se. Их называют сернистой и селенистой кислотами соответственно. Какая оксокислота, по вашему мнению, будет более кислой: селенистой или сернистой?
- Ответить
Сернистая кислота должна быть более кислой. Поскольку сера более электроотрицательна, чем селен, сера в большей степени поляризует ОН-связи, делая их более кислыми. Это предсказание подтверждается сравнением значений \(pK_a\) для кислот:
Кислота \(pK_{a1}\) \(pK_{a2}\) сернистая кислота \(H_2SO_3\) 1,85 7,2 селенистая кислота, \(H_2SeO_3\) 2,62 8,32
Тенденция 3: Для полипротонных оксокислот кислотность уменьшается по мере удаления каждого последующего протона
Оксокислоты с несколькими связями ОН называются полипротонными , поскольку они могут отдавать более одного иона водорода. В этом случае ионы водорода удаляются в последовательных реакциях ионизации. Примеры включают фосфорную и угольную кислоту: 9{2-}} \quad \quad pK_{a1} = 10,3 \nonumber \]
В этом случае ионы водорода удаляются в последовательных реакциях ионизации. Примеры включают фосфорную и угольную кислоту: 9{2-}} \quad \quad pK_{a1} = 10,3 \nonumber \]
Константы диссоциации для последовательных констант ионизации уменьшаются примерно на пять порядков между последовательными ионами водорода. Это отражено в правилах Линуса Полинга для оксокислот и их оксианионов:
Правила Полинга
- \(pK_a\) для оксикислоты общей формулы \(\ce{E(OH)_{q}(O)_{ p}}\) определяется как \[pK_a = 8 — 5 \times p \label{PaulingRules} \]
- Когда оксооксид подвергается последовательным ионизациям, \(pK_a\) каждый раз увеличивается на пять.
Центральная тема правил Полинга заключается в том, что чем больше атомов кислорода находится на центральном атоме, тем больше резонансных структур можно построить для сопряженного основания, что увеличивает его стабильность и повышает кислотность кислоты. Однако, поскольку кислоты последовательно ионизируются, они имеют меньше резонансных структур. Правила Полинга феноменологичны (т. е. не основаны на теоретической основе). Однако в качестве эмпирических правил они часто работают достаточно хорошо, но следует иметь в виду, что они приблизительны.
Правила Полинга феноменологичны (т. е. не основаны на теоретической основе). Однако в качестве эмпирических правил они часто работают достаточно хорошо, но следует иметь в виду, что они приблизительны.
Упражнение \(\PageIndex{2}\): Насколько хорошо работают правила Полинга для оксокислот?
Рассчитайте теоретические значения \(pK_a\) для фосфорной и угольной кислот и их диссоциации и сравните результаты с экспериментальными значениями \(pK_a\).
- Ответить
Для фосфорной кислоты правила Полинга (уравнение \ref{PaulingRules}) достаточно хорошо предсказывают значения \(pK_a\):
- \(H_3PO_4\): \(p = 3\) и \(q =1\) и \[pK_{a1, прогноз} = 8 — 5 \times 1 = 3 \nonnumber \] Это немного больше, чем наблюдаемое значение 2,2. 9-\): \[pK_{a2, предсказанное} = pK_{a1, экспериментальное} + 5 = 8,6 \nonnumber \] Это на 1,7 единицы меньше, чем экспериментальное значение 10,3.
В некоторых случаях расхождения между экспериментальными значениями \(pK_a\) и значениями, предсказанными правилами Полинга, позволяют предположить, что при ионизации могут происходить структурные перестройки, или же сообщаемые значения \(pK_a\) на самом деле не отражают рассматриваемую ионизацию, потому что они не полностью учитывают все равновесия, имеющие место в растворе.
 Однако в случае угольной кислоты причина расхождения между предсказанными и экспериментальными значениями \(рК_{а2}\) не совсем ясна.
Однако в случае угольной кислоты причина расхождения между предсказанными и экспериментальными значениями \(рК_{а2}\) не совсем ясна.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Аноним
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.
- Теги
- автор @ Стивен М.
 Контейкс
Контейкс - оксокислоты
- оксикислоты
- Правила Полинга
- автор @ Стивен М.
Химия фосфора в верхних слоях атмосферы планет
Реферат
Фосфор, P, является ключевым биологическим элементом, играющим важную роль в репликации, передаче информации и метаболизме (Maciá, 2005). Частицы межпланетной пыли содержат примерно 0,1% P по весу, а метеорная абляция в области 1 мкбар верхних слоев атмосферы планеты будет выбрасывать в атмосферу P, PO и т. Д. Затем эти виды будут подвергаться атмосферной обработке перед осаждением на поверхность. Ортофосфат (степень окисления +5) является преобладающей формой неорганического фосфора на поверхности Земли; однако из-за низкой растворимости в воде и реакционной способности солей P(+5) они обладают плохой биодоступностью (Redfield, 19).58). Напротив, менее окисленные формы P (особенно степень окисления +3) гораздо более биодоступны. Было высказано предположение, что эти восстановленные формы фосфора могли образоваться из внеземного материала, упавшего на Землю в период тяжелых бомбардировок. Предыдущие исследования были сосредоточены на прямой доставке фосфора на поверхность в метеоритах для обработки через водную фазу. химия (Пасек, 2008). Напротив, атмосферная химия фосфора до сих пор игнорировалась. Большая часть массы внеземного P, попадающего в атмосферу планеты, переносится межпланетными пылевыми частицами (IPD) массой ~5 мкг и радиусом ~100 мкм (Carrillo-Sánchez et al., 2016). Значительная часть этих частиц улетает из-за аэродинамического торможения на высотах около 80 км на Марсе, 92 км на Земле и 115 км на Венере (Carrillo-Sánchez et al., 2020). Затем испаренные атомы фосфора будут подвергаться химической обработке с образованием множества соединений, в которых фосфор может существовать в разных степенях окисления из-за присутствия как окислителей, так и восстановителей в верхних слоях атмосферы планет земной группы.
Было высказано предположение, что эти восстановленные формы фосфора могли образоваться из внеземного материала, упавшего на Землю в период тяжелых бомбардировок. Предыдущие исследования были сосредоточены на прямой доставке фосфора на поверхность в метеоритах для обработки через водную фазу. химия (Пасек, 2008). Напротив, атмосферная химия фосфора до сих пор игнорировалась. Большая часть массы внеземного P, попадающего в атмосферу планеты, переносится межпланетными пылевыми частицами (IPD) массой ~5 мкг и радиусом ~100 мкм (Carrillo-Sánchez et al., 2016). Значительная часть этих частиц улетает из-за аэродинамического торможения на высотах около 80 км на Марсе, 92 км на Земле и 115 км на Венере (Carrillo-Sánchez et al., 2020). Затем испаренные атомы фосфора будут подвергаться химической обработке с образованием множества соединений, в которых фосфор может существовать в разных степенях окисления из-за присутствия как окислителей, так и восстановителей в верхних слоях атмосферы планет земной группы. Здесь мы представляем первое исследование метеоритной абляции фосфора и его последующей химической обработки с образованием различных соединений, включая P в биологически важном состоянии P(+3). Симулятор метеорной абляции в Лидсе, и была разработана новая версия нашей модели химической абляции (CABMOD), включающая термодинамику оксидов фосфора в расплавленном метеороиде (Carrillo-Sánchez et al., 2020). Определение P в безводных хондритных пористых частицах межпланетной пыли было выполнено с помощью спектроскопии рентгеновского поглощения вблизи края K-края (XANES) на алмазном синхротроне; эта работа продемонстрировала, что P в основном встречается в фосфатоподобных доменах. Астрономическая модель пыли, которая предсказывает количество пыли во внутренней части Солнечной системы, создаваемой кометами семейства Юпитера, поясом астероидов и кометами с длинным периодом, затем была объединена с CABMOD для прогнозирования профиля скорости инжекции P, PO и PO2 в атмосферу. Марса, Земли и Венеры — функция метеорного входа (Carrillo-Sánchez et al.
Здесь мы представляем первое исследование метеоритной абляции фосфора и его последующей химической обработки с образованием различных соединений, включая P в биологически важном состоянии P(+3). Симулятор метеорной абляции в Лидсе, и была разработана новая версия нашей модели химической абляции (CABMOD), включающая термодинамику оксидов фосфора в расплавленном метеороиде (Carrillo-Sánchez et al., 2020). Определение P в безводных хондритных пористых частицах межпланетной пыли было выполнено с помощью спектроскопии рентгеновского поглощения вблизи края K-края (XANES) на алмазном синхротроне; эта работа продемонстрировала, что P в основном встречается в фосфатоподобных доменах. Астрономическая модель пыли, которая предсказывает количество пыли во внутренней части Солнечной системы, создаваемой кометами семейства Юпитера, поясом астероидов и кометами с длинным периодом, затем была объединена с CABMOD для прогнозирования профиля скорости инжекции P, PO и PO2 в атмосферу. Марса, Земли и Венеры — функция метеорного входа (Carrillo-Sánchez et al. , 2020). Затем мы измерили кинетику P, PO и OPO с различными атмосферными компонентами, используя метод лазерного импульсного фотолиза/индуцированной лазером флуоресценции ( Дуглас и др., 2019 г.; Дуглас и др., 2020). Расчеты электронной структуры (ab initio квантовые) также были объединены со статистической теорией скоростей для создания сети атмосферной химии для фосфора (рис. 1). Эта сеть показывает пути от OPO к h4PO3 и h4PO4. Затем эти фосфороксикислоты объединяются с металлсодержащими молекулами (например, NaHCO3, FeOH), также образующимися при метеоритной абляции, с образованием фосфитов и фосфатов металлов. Эти соединения полимеризуются в частицы метеоритного дыма размером с нанометр, которые переносятся на поверхность в течение нескольких лет (Dhomse et al., 2013). Этот химический состав вместе с MIF фосфора затем был включен в глобальную химико-климатическую модель WACCM. . На рис. 2 показан прогнозируемый процент P(+3) от общего количества P в частицах метеоритного дыма на высоте более 60 км в зависимости от широты и времени года.
, 2020). Затем мы измерили кинетику P, PO и OPO с различными атмосферными компонентами, используя метод лазерного импульсного фотолиза/индуцированной лазером флуоресценции ( Дуглас и др., 2019 г.; Дуглас и др., 2020). Расчеты электронной структуры (ab initio квантовые) также были объединены со статистической теорией скоростей для создания сети атмосферной химии для фосфора (рис. 1). Эта сеть показывает пути от OPO к h4PO3 и h4PO4. Затем эти фосфороксикислоты объединяются с металлсодержащими молекулами (например, NaHCO3, FeOH), также образующимися при метеоритной абляции, с образованием фосфитов и фосфатов металлов. Эти соединения полимеризуются в частицы метеоритного дыма размером с нанометр, которые переносятся на поверхность в течение нескольких лет (Dhomse et al., 2013). Этот химический состав вместе с MIF фосфора затем был включен в глобальную химико-климатическую модель WACCM. . На рис. 2 показан прогнозируемый процент P(+3) от общего количества P в частицах метеоритного дыма на высоте более 60 км в зависимости от широты и времени года. Это исследование демонстрирует, что биологически важная фосфористая кислота (h4PO3) может образовываться, а затем реагировать с частицами метеоритных металлов с образованием биодоступных водородных фосфитов металлов. Глобальное поступление восстановленного фосфора (+3) на поверхность Земли оценивается примерно в 600 кг в год-1. Рисунок 1. Схематическая диаграмма химического состава фосфора в мезосфере Земли и нижней термосфере. Зеленые и красные стрелки указывают важные пути от OPO к h4PO3 и h4PO4 соответственно. Рисунок 2. Процент P(+3) к общему P в частицах метеоритного дыма на высоте более 60 км в зависимости от широты и месяца (усреднение за 3 года). СсылкиКаррильо-Санчес, Дж.Д., Боунс, Д.Л., Дуглас, К.М., Флинн, Г.Дж., Вирик, С., Фегли, Б., Араки, Т., Каулич, Б., Плейн, JMC, 2020. Введение метеоритного фосфора в планетарные атмосферы. Планета. Космические науки. 187, ст. нет. 104926. Каррильо-Санчес, Х.Д., Несворный, Д., Покорный, П., Янчес, Д., Плейн, J.M.C., 2016. Источники космической пыли в атмосфере Земли.
Это исследование демонстрирует, что биологически важная фосфористая кислота (h4PO3) может образовываться, а затем реагировать с частицами метеоритных металлов с образованием биодоступных водородных фосфитов металлов. Глобальное поступление восстановленного фосфора (+3) на поверхность Земли оценивается примерно в 600 кг в год-1. Рисунок 1. Схематическая диаграмма химического состава фосфора в мезосфере Земли и нижней термосфере. Зеленые и красные стрелки указывают важные пути от OPO к h4PO3 и h4PO4 соответственно. Рисунок 2. Процент P(+3) к общему P в частицах метеоритного дыма на высоте более 60 км в зависимости от широты и месяца (усреднение за 3 года). СсылкиКаррильо-Санчес, Дж.Д., Боунс, Д.Л., Дуглас, К.М., Флинн, Г.Дж., Вирик, С., Фегли, Б., Араки, Т., Каулич, Б., Плейн, JMC, 2020. Введение метеоритного фосфора в планетарные атмосферы. Планета. Космические науки. 187, ст. нет. 104926. Каррильо-Санчес, Х.Д., Несворный, Д., Покорный, П., Янчес, Д., Плейн, J.M.C., 2016. Источники космической пыли в атмосфере Земли. Геофиз. Рез. лат. 43, 11979-11986. Домсе, С.С., Сондерс, Р.В., Тиан, В., Чипперфилд, М.П., Плейн, Дж.М.С., 2013. Наблюдения за плутонием-238 в качестве теста смоделированного переноса и поверхностного осаждения частиц метеоритного дыма. Геофиз. Рез. лат. 40, 4454-4458. Дуглас, К.М., Блиц, М.А., Манган, Т.П., Плейн, JMC, 2019. Экспериментальное исследование удаления атомов фосфора в основном и возбужденном состояниях атмосферно значимыми видами. Дж. Физ. хим. А 123, 9469-9478. Дуглас, К.М., Блиц, М.А., Манган, Т.П., Вестерн, К.М., План, JMC, 2020. Кинетическое исследование реакций PO + O2 и PO2 + O3 и спектроскопия радикала PO. Дж. Физ. хим. A 124, 7911-7926. Macia, E., 2005. Роль фосфора в химической эволюции. Обзоры химического общества 34, 691-701. Пасек, Массачусетс, 2008. Переосмысление геохимии фосфора на ранней Земле. Proceedings of the National Academy of Sciences 105, 853-858. Redfield, AC, 1958. Биологический контроль химических факторов в окружающей среде. Американский ученый 46, 205-221.
Геофиз. Рез. лат. 43, 11979-11986. Домсе, С.С., Сондерс, Р.В., Тиан, В., Чипперфилд, М.П., Плейн, Дж.М.С., 2013. Наблюдения за плутонием-238 в качестве теста смоделированного переноса и поверхностного осаждения частиц метеоритного дыма. Геофиз. Рез. лат. 40, 4454-4458. Дуглас, К.М., Блиц, М.А., Манган, Т.П., Плейн, JMC, 2019. Экспериментальное исследование удаления атомов фосфора в основном и возбужденном состояниях атмосферно значимыми видами. Дж. Физ. хим. А 123, 9469-9478. Дуглас, К.М., Блиц, М.А., Манган, Т.П., Вестерн, К.М., План, JMC, 2020. Кинетическое исследование реакций PO + O2 и PO2 + O3 и спектроскопия радикала PO. Дж. Физ. хим. A 124, 7911-7926. Macia, E., 2005. Роль фосфора в химической эволюции. Обзоры химического общества 34, 691-701. Пасек, Массачусетс, 2008. Переосмысление геохимии фосфора на ранней Земле. Proceedings of the National Academy of Sciences 105, 853-858. Redfield, AC, 1958. Биологический контроль химических факторов в окружающей среде. Американский ученый 46, 205-221.

 02.14
02.14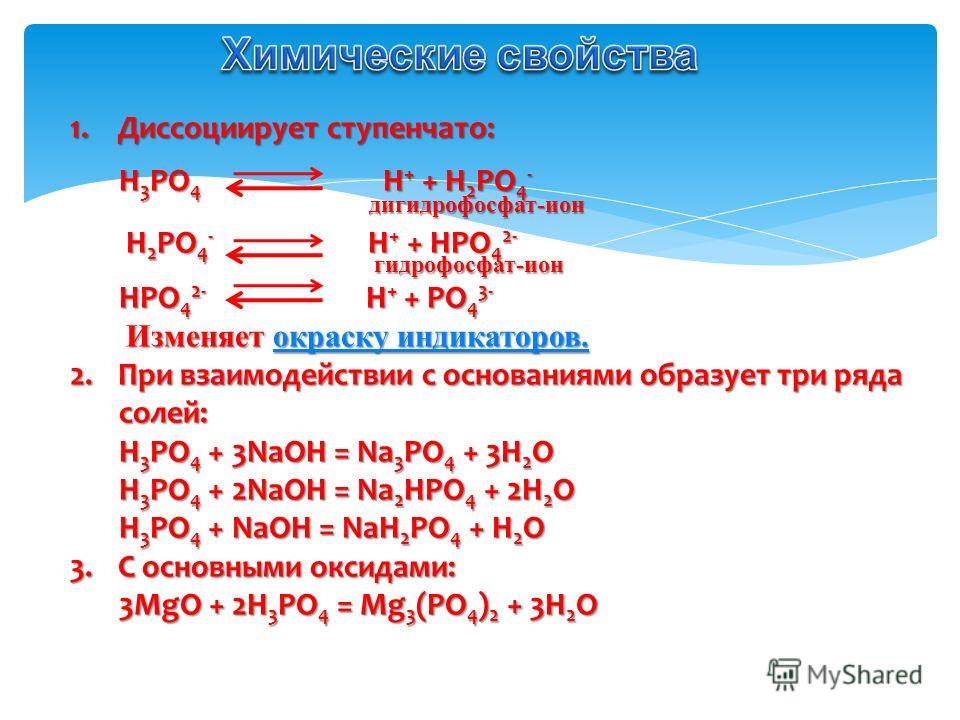 Например, он дегидратирует оксокислоты, что широко используется для получения ангидридов кислот:
Например, он дегидратирует оксокислоты, что широко используется для получения ангидридов кислот: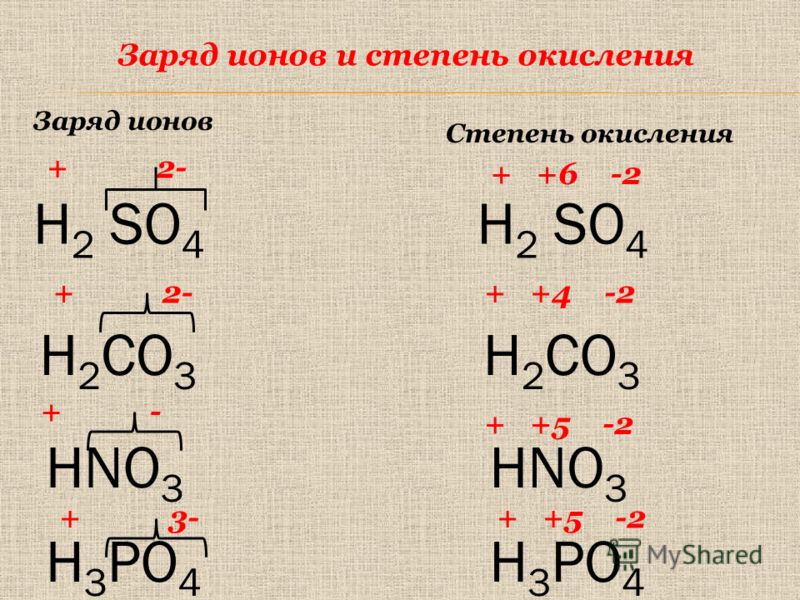 Однако в случае угольной кислоты причина расхождения между предсказанными и экспериментальными значениями \(рК_{а2}\) не совсем ясна.
Однако в случае угольной кислоты причина расхождения между предсказанными и экспериментальными значениями \(рК_{а2}\) не совсем ясна. Контейкс
Контейкс