What, How To Balance & FAQs —
KClO3 представляет собой соль сильного основания, называемого гидроксидом калия, поэтому она может легко реагировать с сильной кислотой, такой как H2SO4. Давайте посмотрим на детали реакции между KClO3 и Н2SO4.
На термическое разложение хлората калия, мы получаем газообразный кислород. Так что это коммерческий реагент для получения O2. Степень окисления калия в KClO3 равно +1, так что это очень сильный окислитель где степень окисления Cl равна +5. Серная кислота также является сильным окислителем.
По реакции между H2SO4 и KClO3, мы можем оценить количество калия. О механизме реакции серной кислоты и хлората калия, энтальпии реакции, типе реакции, образовании продуктов и т.д. поговорим в следующей части статьи.
1. Чему равно произведение H
2SO4 и KClO3?Гидросульфат калия и хлорная кислота образуются в качестве основных продуктов, когда H2SO4 и KClO3 реагируют вместе. Вместе с молекулами воды в качестве побочного продукта образуется некоторое количество диоксида хлора.Продукт реакции между
Вместе с молекулами воды в качестве побочного продукта образуется некоторое количество диоксида хлора.Продукт реакции между
H2SO4 и KClO3
2. Какой тип реакции Н
2SO4 + KClO3?H2SO4 + KClO3 реакция является примером реакции образования кислоты и реакции двойного замещения наряду с окислительно-восстановительный потенциал и реакции осаждения. Здесь в ходе реакции наряду с водой образуются кислые соединения.
3. Как сбалансировать H
2SO4 + KClO3?H2SO4 + KClO3 = ХСО4 + HClO4 +ClO2 + H2O реакция еще не уравновешена, мы должны сбалансировать уравнение следующим образом:
- Во-первых, мы помечаем все реагенты и продукты буквами A, B, C, D, E и F, поскольку для этой реакции получено шесть различных молекул, и реакция выглядит следующим образом.
 : AH2SO4 +В KClO3 = С ХСО4 + Д HClO4 + E ClO2 + ФХ2O
: AH2SO4 +В KClO3 = С ХСО4 + Д HClO4 + E ClO2 + ФХ2O - Приравняйте коэффициенты для однотипных элементов, переставив их.
- После перестановки коэффициентов тех же элементов по их стехиометрической пропорции получим: H = 2A = C = D = 2F, S = A = C, O = 4A = 3B = 4C = 4D = 2E = F, K = B = C, Cl = B = D = E,
- Используя исключение Гаусса и приравнивая все полученные уравнения, A = 3, B = 3, C = 3, D = 1, E = 2 и F = 1,
- Общее сбалансированное уравнение будет,
- 3 H2SO4 +3 KClO3 = 3 ХСО4 + HClO4 + 2 ClO2 + Н2O
4. Ч
2SO4 + KClO3 титрованиеЧтобы оценить количество калия или хлора, мы можем выполнить титрование между KClO3 и Н2SO4.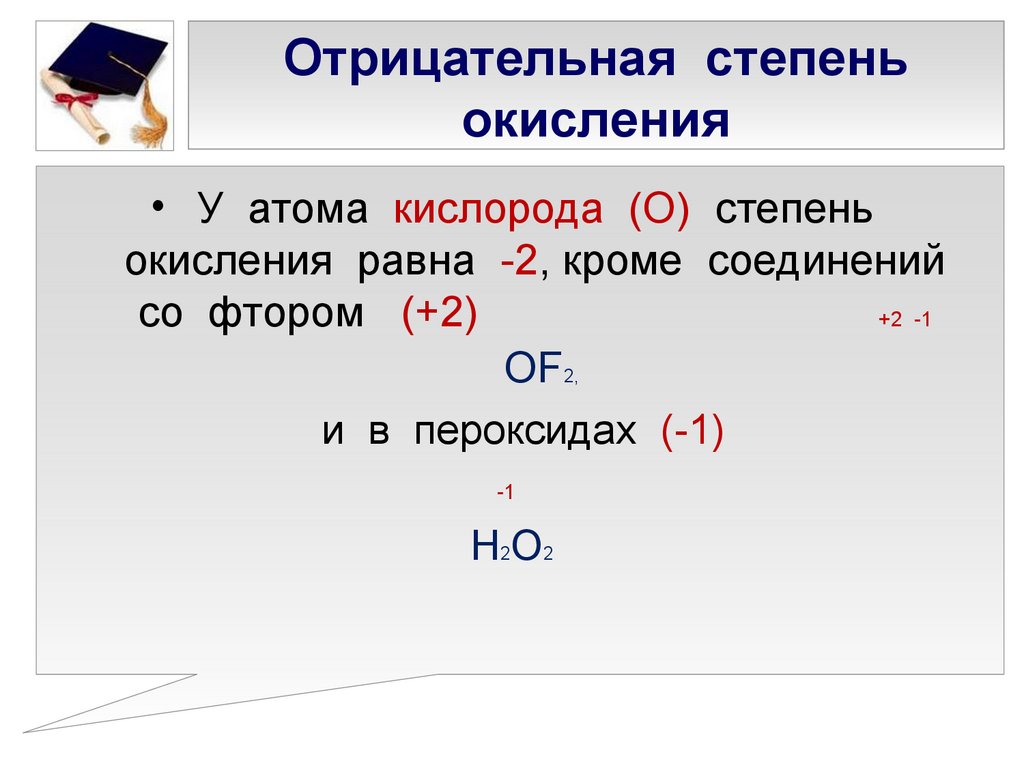
Для этого титрования нам потребуются бюретка, коническая колба, держатель бюретки, мерная колба и стаканы.
Титр и титрантH2SO4 действует как титрант, который берется в бюретку, а анализируемая молекула представляет собой KClO3 который отбирают в коническую колбу.
ИндикаторныеВсе титрование проводится в кислой среде или при кислом pH, поэтому лучше всего подходит индикатор, будет фенолфталеин, который дает отличные результаты для этого титрования при данном рН.
ПроцедураБюретка заполнена стандартизированным H2SO4. KClO3 отбирают в коническую колбу вместе с соответствующими индикаторами. ЧАС2SO4 добавляют по каплям в коническую колбу и колбу постоянно встряхивают.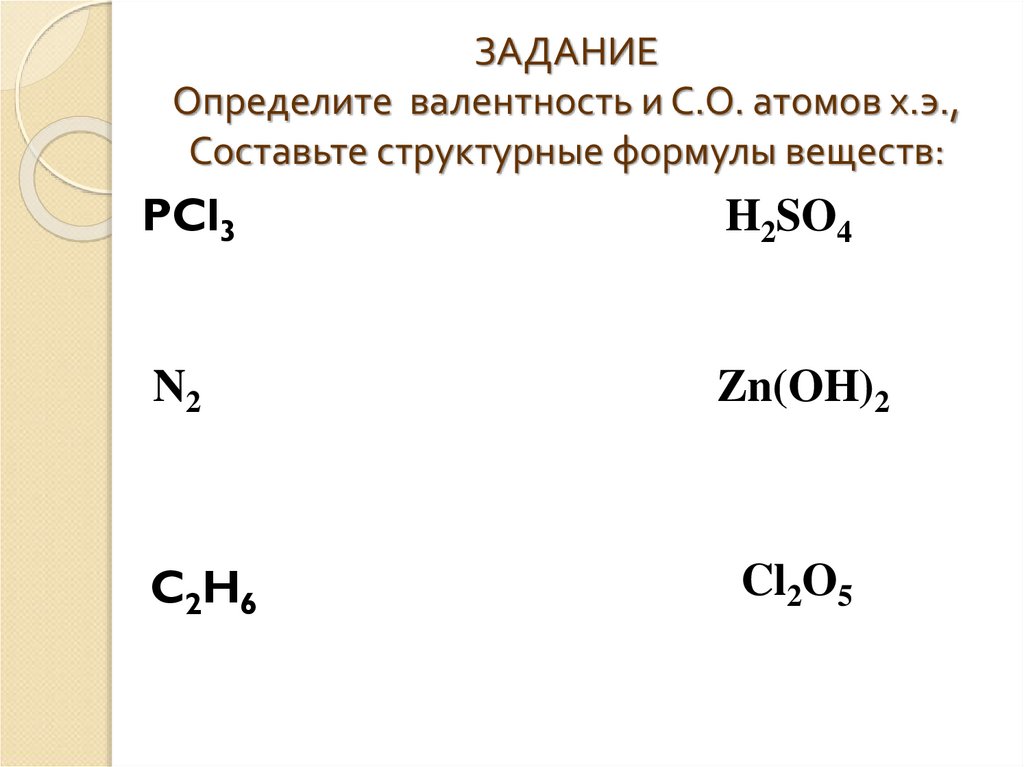 Через определенное время, когда приходит конечная точка, индикатор меняет свой цвет и происходит реакция.
Через определенное время, когда приходит конечная точка, индикатор меняет свой цвет и происходит реакция.
Мы повторяем титрование несколько раз для получения лучших результатов, а затем оцениваем количество калия и хлора по формуле V1S1 V =2S2.
5. Ч
2SO4+ KClO3 чистое ионное уравнениеЧистое ионное уравнение между H2SO4 + KClO3 как следует,
2H+ + ТАК42- + К+ +ClO3– = К+ + ХСО4– + H+ +ClO4– +ClO2 + H+ + OH–
Чтобы получить результирующее ионное уравнение, необходимы следующие шаги:
- H2SO4 будет ионизирован протонными и сульфат-ионами, так как это сильный электролит
- После этого KClO3 также распадается на K+ ион и ClO4– ион, так как он также является сильным электролитом
- В продуктовой части соль KHSO4 также распадается на K+ и ХСО4–, и бисульфат также может быть диссоциирован на H+ и сульфат-ионы.

- Хлорная кислота также ионизируется как H+ и ClO4–.
- И, наконец, вода диссоциирует на протон и гидроксид-ионы.
6. Ч
2SO4+ KClO3 сопряженные парыВ реакции Н2SO4 + KClO3 сопряженные пары будут соответствующими депротонированными и протонированными формами этого конкретного вида, которые перечислены ниже:
- Сопряженная пара H2SO4 = ТАК42-
- Сопряженная пара ОН– = Н2O
- Сопряженная пара ClO4– = HClO4
- Сопряженная пара KHSO4 = КСО4–
7.
 Ч2SO4 и KClO3 межмолекулярные силы
Ч2SO4 и KClO3 межмолекулярные силыМежмолекулярная сила, присутствующая в H2SO4 — электростатическая сила между протонами и ионами сульфата. В KClO3, присутствуют электронные взаимодействия и кулоновская сила.
| молекула | и.о. сила |
| H2SO4 | электростатический, Ван дер Вааль Диполь взаимодействие |
| KClO3 | Сильный электростатический сила и ионное взаимодействие, Кулоновская сила |
| ХСО4 | Электростатическая сила, ионное взаимодействие, |
HCLO. 4 4 | ковалентный, Н-связь, Ван дер Вааль взаимодействие |
| ClO2 | Взаимодействие Ван-дер-Ваала, и ковалентная сила |
| H2O | Н-связь, ионное взаимодействие |
8. ЧАС
2SO4 + KClO3 энтальпия реакцииH2SO4 + KClO3 энтальпия реакции составляет +273.8 кДж/моль, что можно получить по формуле: энтальпия продуктов – энтальпия реагентов. Здесь изменение энтальпии положительно.
| молекула | энтальпия (кДж/моль) |
| KClO3 | -391. 2 2 |
| H2SO4 | -814 |
| ХСО4 | -1163.3 |
| H2O | -68 |
| HCLO.4 | 13.5 |
| ClO2 | 101.3 |
и продукты
9. Н
2SO4 + KClO3 буферный раствор?Реакция между H2SO4 + KClO3 дает буферный раствор KHSO4 и HClO4 потому что они могут контролировать pH реакции, поскольку первая является основной солью, а вторая — кислотной.
10. Н
2SO4 + KClO3 полная реакция?Реакция между H2SO4 + KClO3 является полным, поскольку дает два основных и два побочных продукта.
Реакция H2SO4 + KClO3 является эндотермическим с точки зрения первого закона термодинамики. Эта реакция поглощает больше энергии и температуры из окружающей среды, что помогает завершить реакцию, где δH всегда положителен.
12. Н
2SO4 + KClO3 окислительно-восстановительная реакция?H2SO4 + KClO3 реакция является окислительно-восстановительной реакцией, потому что в этой реакции многие элементы восстанавливаются и окисляются, поскольку K восстанавливается, а S и Cl здесь окисляются.
Окислительно-восстановительная схемаH2SO4 и KClO3 реакция
13. Н
2SO4 + KClO3 реакция осаждения?Реакция между H2SO4 + KClO3 является реакцией осаждения, потому что KHSO4 выпадает в осадок в растворе и не растворяется в реакционной смеси.
14. Н
2SO4 + KClO3 обратимая или необратимая реакция?Реакция между H2SO4+ KClO3 необратим, потому что он производит соль, кислоту и одну газообразную молекулу ClO2 что может увеличить энтропию реакции и сместить равновесие в правую сторону только в прямом направлении.
15. Н
2SO4 + KClO3 реакция смещения?Реакция между H2SO4+ KClO3 является примером реакции двойного замещения, потому что в приведенной выше реакции H + вытеснил K+ из KClO3 и снова К+ смещенный H+ от Н2SO4.Двойная реакция смещения
Заключение
Реакция между H2SO4 и KClO3 дает нам электролитическую соль гидросульфата калия вместе с хлорной кислотой, где мы можем оценить количество хлора. Эта реакция является кислотно-основной и необратимой реакцией. Эта реакция используется для производства хлорной кислоты.
Эта реакция является кислотно-основной и необратимой реакцией. Эта реакция используется для производства хлорной кислоты.
Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Решено
2-метилбутен — 1 Написать уравнения реакций данного алкена с хлором, хлороводородом, водой, кислородом, реакцию Вагнера
решите, пожалуйста. ( Электронный баланс, желательно подробно) Ch4-CH=CH-Ch4 + KMnO4 + h3SO4 = Ch4-COOH + MnSO4 + K2SO4 + h3O.
( Электронный баланс, желательно подробно) Ch4-CH=CH-Ch4 + KMnO4 + h3SO4 = Ch4-COOH + MnSO4 + K2SO4 + h3O.
написать реакцию взаимодействия 1-бутина с перманганатом калия
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
Решено
Составить изомеры ГЕКСИНА. Вывод о том какие типы изомерии характерны для АЛКИНОВ?
Пользуйтесь нашим приложением
Какова степень окисления хлора в $ KCl{O_3} $ ?
Последняя обновленная дата: 16 февраля 2023
•
Общее представление: 204,9K
•
Просмотр сегодня: 1,92K
Ответ
Проверено
204,9K+ виды
HINT: . электроны, которые атом получает или теряет при образовании химической связи с другим атомом, известен как степень окисления, также известная как степень окисления. Когда элемент теряет электроны, он получает положительную степень окисления, а когда он поглощает электроны, он получает отрицательную степень окисления.
Когда элемент теряет электроны, он получает положительную степень окисления, а когда он поглощает электроны, он получает отрицательную степень окисления.
Выполните шаг за шагом Ответ:
Сначала мы вспомним степени окисления щелочных и щелочноземельных металлов и кислорода.
(i) Все элементы группы 1, щелочные металлы проявляют степень окисления $ + 1 $, поскольку они предпочитают терять электрон для достижения более устойчивых полностью заполненных p- или d-орбиталей.
(ii) Точно так же элементы группы 2, щелочноземельные металлы, проявляют степень окисления $ + 2 $ по той же причине.
(iii) Также помните, что обычная степень окисления кислорода составляет $-2$, за исключением случаев, когда он реагирует с более электроотрицательным элементом, которым является $F$.
Теперь мы будем следовать шагам, чтобы найти степень окисления элемента.
а) Назовите элементы, входящие в состав соединения, и запишите степени окисления некоторых из них. Здесь данное соединение $KCl{O_3}$ является ионным соединением. Как видно ранее, степень окисления калия ($K$) равна $+1$, так как он принадлежит к группе 1. А степень окисления $O$ равна $-2$.
Как видно ранее, степень окисления калия ($K$) равна $+1$, так как он принадлежит к группе 1. А степень окисления $O$ равна $-2$.
б) Проверяя природу соединения, мы находим, что это ионное соединение является нейтральным. Таким образом, сумма степеней окисления каждого элемента равна нулю.
c) Пусть $ x $ обозначает степень окисления $ Cl $ в $ KCl{O_3} $ . Тогда из предыдущих обсуждений мы получаем, что $ + 1 + x + 3 \times ( — 2) = 0 $
$ \Rightarrow 1 + x — 6 = 0 $
$ \Rightarrow x — 5 = 0 $
$ \Rightarrow x = + 5 $
Следовательно, степень окисления хлора в $ KCl{O_3} $ равна $ + 5 $ .
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим радиусом атомов Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из перечисленного является истинным пероксидом A rmSrmOrm2 12 класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А класса 11 химии JEE_Main
фосфин получается из следующей руды A Calcium Class 12 Chemistry Jee_main
Трендовые сомнения
Назначение номеров окисления каждому элементу в следующем составлении .
 ..
..Проблема
Соответствующий раствор
70003
. Воспроизвести видео:
Всем привет, с возвращением. Итак, давайте начнем с этого видео. Итак, здесь они хотят, чтобы мы увидели, какова степень окисления каждого элемента в следующем соединении. Хорошо, итак, номер один, у нас есть CH два, C. 02. Итак, тогда элементы см. Возраст, и генеральный директор, мы знаем, что степень окисления для H положительна, а C E O. Отрицательна. Следовательно, мы можем построить уравнение для решения для X, которое будет представлять углерод. Итак, у нас будет Х. Плюс водород нам нужен И его степень окисления положительна. Класс C. L. У нас есть значение наблюдения -1. Общий заряд этого соединения равен нулю. Итак, когда мы решим для X, мы получим ноль, Southern Carbon будет иметь нулевую степень окисления. Хорошо, тогда давайте перейдем к номеру два. Итак, здесь у нас есть И каждый 4 — 04. Так что нам придется разделить это на два. Итак, у нас есть NH четыре, это аммоний, и у нас есть CR 04, это хром восемь.
 Следовательно, поскольку это соединение с нулевым общим зарядом, см. вы также должны быть положительными. Так что видеть вас тоже равно положительному. Хорошо, тогда другим элементом, который у нас есть, является C. И еще раз мы сказали, что кислород имеет степень окисления -2. Итак, что нам нужно сделать, это сероуглерод. Итак, давайте составим уравнение, чтобы мы могли сернистый углерод. Итак, у нас есть X. Который будет представлять углерод плюс три. Там три, кислород. Этот заряд равен -2. Общий заряд карбоната равен двум. Итак, мы находим X. И мы получаем положительное значение, поэтому углерод является положительным. Итак, теперь у нас есть B. A. О, значит, должно быть A. О, тогда о, мы отправили его степень окисления -2. Общий заряд этого соединения равен нулю. Так это -2. Этот тоже должен быть положительным, чтобы они могли компенсироваться и иметь нулевой заряд. Хорошо. И, наконец, у нас есть K two cr 207. Итак, это элемент K. Cr, и мы знаем, что степень окисления кислорода тоже отрицательная.
Следовательно, поскольку это соединение с нулевым общим зарядом, см. вы также должны быть положительными. Так что видеть вас тоже равно положительному. Хорошо, тогда другим элементом, который у нас есть, является C. И еще раз мы сказали, что кислород имеет степень окисления -2. Итак, что нам нужно сделать, это сероуглерод. Итак, давайте составим уравнение, чтобы мы могли сернистый углерод. Итак, у нас есть X. Который будет представлять углерод плюс три. Там три, кислород. Этот заряд равен -2. Общий заряд карбоната равен двум. Итак, мы находим X. И мы получаем положительное значение, поэтому углерод является положительным. Итак, теперь у нас есть B. A. О, значит, должно быть A. О, тогда о, мы отправили его степень окисления -2. Общий заряд этого соединения равен нулю. Так это -2. Этот тоже должен быть положительным, чтобы они могли компенсироваться и иметь нулевой заряд. Хорошо. И, наконец, у нас есть K two cr 207. Итак, это элемент K. Cr, и мы знаем, что степень окисления кислорода тоже отрицательная.

 : AH2SO4 +В KClO3 = С ХСО4 + Д HClO4 + E ClO2 + ФХ2O
: AH2SO4 +В KClO3 = С ХСО4 + Д HClO4 + E ClO2 + ФХ2O
 11.19
11.19