Аммиак — Что такое Аммиак?
, Обновлено 21 января 11:52
165728
Аммиак представляет собой бинарное неорганическое химическое соединение азота и водорода
Аммиак (Ammonia, нитрид водорода) — химическое соединение азота и водорода с формулой NH3, при нормальных условиях — бесцветный газ с резким характерным запахом.
Плотность аммиака почти в 2 раза меньше, чем у воздуха, ПДКр.з. 20 мг/м3 — IV класс опасности (малоопасные вещества) по ГОСТ 12.1.007.
Растворимость Nh4 в воде чрезвычайно велика — около 1200 объемов (при 0°C) или 700 объемов (при 20°C) в объеме воды.
В холодильной технике носит название R717, где R — Refrigerant (хладагент), 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство превышает 180 млн т.
Молекула аммиака имеет форму треугольной пирамиды с атомом азота в вершине. 3 неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами 3х атомов водорода (связи N − H), 4я пара внешних электронов является неподеленной, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония Nh5+.
Несвязывающее 2х-электронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (t пл −77,70 °C), а также меньшие плотность, вязкость (в 7 раз меньше вязкости воды), проводимость (почти не проводит электрический ток) и диэлектрическую проницаемость.
Это в некоторой степени объясняется тем, что прочность водородных связей в жидком аммиаке существенно ниже, чем у воды; а также тем, что в молекуле аммиака имеется лишь одна пара неподеленных электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвленную сеть водородных связей между несколькими молекулами.
Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м3, сильно преломляющую свет.
Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счет образования водородных связей.
Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений.
#Аммиак
Последние новости
Страница не найдена — РОО «Ассоциация победителей олимпиад»
Ваши ФИО*
Ваш email*
Ваш номер телефона*
Какой предмет вы хотели бы преподавать?*
Расскажите кратко о своих олимпиадных достижениях*
Приложите резюме*
Объём файлов не должен превышать 20 Мбайт / Доступные форматы: doc / docx / rtf / pdf / html / txt
Please leave this field empty.
Нажимая на кнопку, вы принимаете положение и согласие на обработку персональных данных.
Ваша электронная почта*
Из какого вы региона?*
Расскажите, как мы могли бы сотрудничать*
Please leave this field empty.
Нажимая на кнопку, вы принимаете положение и согласие на обработку персональных данных.
ФИО*
Ваша электронная почта*
Ваш номер телефона*
Образовательное учреждение*
Расскажите кратко, какая у вас сложилась ситуация с олимпиадным движением в школе и какого результата вы ожидаете от сотрудничества с АПО*
Please leave this field empty.
Нажимая на кнопку, вы принимаете положение и согласие на обработку персональных данных.
Ваш email
Каким предметом вы интересуетесь
Выберите наиболее подходящий статус Статус не выбранУченикРодительПредставитель школыПедагог
Нажимая на кнопку, вы принимаете положение и согласие на обработку персональных данных.
ФИО ученика
Дата рождения ученика
Класс
Образовательное учреждение
Город образовательного учреждения
ФИО родителя
Телефон родителя
Email родителя
Выберите группу Группа не выбрана
Нажимая на кнопку, вы принимаете положение и согласие на обработку персональных данных.
ФИО ученика
Дата рождения ученика
Класс
Образовательное учреждение
Город образовательного учреждения
ФИО родителя
Телефон родителя
Email родителя
Выберите группу Группа не выбрана
Мотивационное письмо Объём файла не должен превышать 2 Мбайт / Доступные форматы: doc / docx / rtf / pdf / html / txt
Нажимая на кнопку, вы принимаете положение и согласие на обработку персональных данных.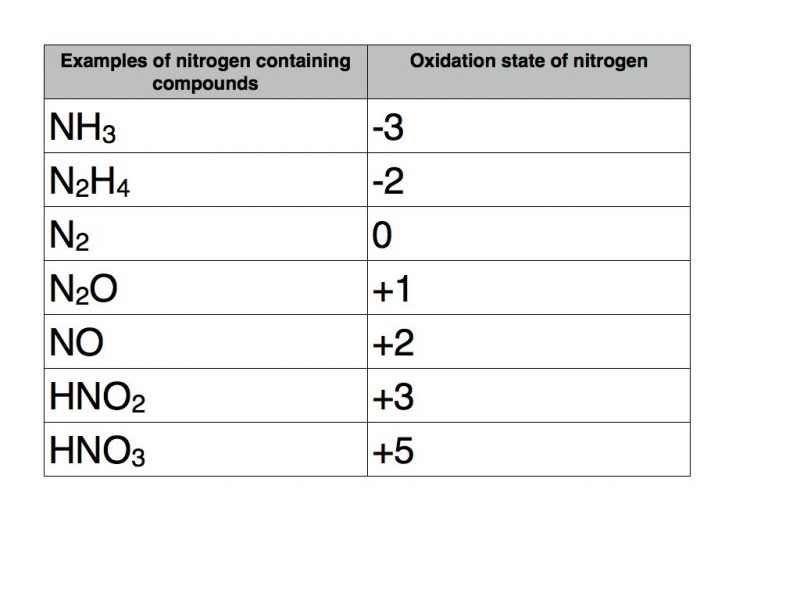
ФИО
Телефон
Образовательное учреждение
Город образовательного учреждения
Нажимая на кнопку, вы принимаете положение и согласие на обработку персональных данных.
ФИО
Телефон
Проект / отдел
Должность
Нажимая на кнопку, вы принимаете положение и согласие на обработку персональных данных.
ФИО ребенка
Название образовательного учреждения
Город образовательного учреждения
ФИО родителя
Телефон родителя
Email родителя
Нажимая на кнопку, вы принимаете положение и согласие на обработку персональных данных.
Войти
Родитель
Буду покупать курсы для своего ребёнка ЗарегистрироватьсяОбучающийся
Сам буду проходить курсы ЗарегистрироватьсяПредставитель школы
Буду заказывать услуги для своего образовательного учреждения и контролировать их исполнение ЗарегистрироватьсяПериодическая таблица WebElements » Водород » аммиак
- Формула: NH 3
- Формула системы холмов: H 3 N 1
- Регистрационный номер CAS: [7664-41-7]
- Вес формулы: 17.
 031
031 - Класс: нитрид
- Цвет: бесцветный
- Внешний вид: газ
- Температура плавления: -77,74°C
- Температура кипения: -33,33°C
- Плотность: Жидкость: 0,6818 при температуре кипения. газ: 0,6175 при 15°С, 7,2 атм.
Ниже приведены некоторые синонимы аммиака :
- аммиак
- нитрид водорода(I)
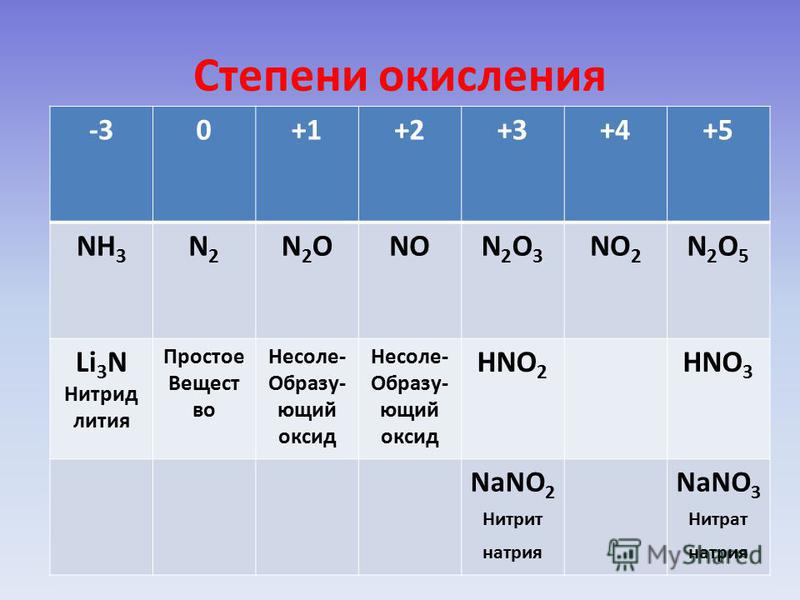
Степень окисления водорода в аммиаке 1 .
Синтез
Нет в наличии
Твердотельная структура
- Геометрия водорода: 1 координата: конечная точка
- Прототип конструкции:
Элементный анализ
В таблице показано процентное содержание элементов для NH 3 (аммиак).
| Элемент | % |
|---|---|
| Н | 17,76 |
| Н | 82,24 |
Изотопная схема для NH
3На приведенной ниже диаграмме показана расчетная изотопная картина для формулы NH 3 с наиболее интенсивным ионом, установленным на 100%.
Ссылки
Данные на страницах этих соединений собраны и адаптированы из основной литературы и нескольких других источников, включая следующие.
- Р.Т. Сандерсон в Chemical Periodicity , Reinhold, New York, USA, 1960.
- Н.Н. Гринвуд и А. Эрншоу в Chemistry of the Elements , 2-е издание, Butterworth, UK, 1997.
- Ф.А. Коттон, Г. Уилкинсон, К.А. Мурильо и М. Бохманн, в Передовая неорганическая химия , John Wiley & Sons, 1999.
- А. Ф. Тротман-Дикенсон, (редактор) в Комплексная неорганическая химия , Пергамон, Оксфорд, Великобритания, 1973.

- Р.В.Г. Wyckoff, в Crystal Structures , том 1, Interscience, John Wiley & Sons, 1963.
- A.R.West в Базовая химия твердого тела Химия , John Wiley & Sons, 1999.
- А. Ф. Уэллс в Структурная неорганическая химия , 4-е издание, Оксфорд, Великобритания, 1975 г.
- Дж.Д.Х. Донней, (редактор) в Определяющие таблицы данных о кристаллах , монография ACA № 5, Американская кристаллографическая ассоциация, США, 1963.
- Д.Р. Лиде, (редактор) в справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 77-е издание, 1996.
- Дж.В. Меллор в Всесторонний трактат по неорганической и теоретической химии , тома 1-16, Longmans, Лондон, Великобритания, 1922-1937.
- Дж. Э. Макинтайр (редактор) в Словаре неорганических соединений , тома 1–3, Chapman & Hall, Лондон, Великобритания, 1992.
Исследуйте периодические свойства по этим ссылкам
Степени окисления | Введение в химию |
Цель обучения
- Предсказать степень окисления обычных элементов по номеру их группы.

Ключевые моменты
- Степень окисления чистого элемента всегда равна нулю.
- Степень окисления чистого иона эквивалентна его ионному заряду.
- Как правило, водород имеет степень окисления +1, а кислород имеет степень окисления -2.
- Сумма степеней окисления всех атомов нейтральной молекулы должна быть равна нулю.
Термины
- уменьшение прироста электронов, вызывающее уменьшение степени окисления
- окислениепотеря электронов, которая вызывает увеличение степени окисления
Степень окисления указывает на степень окисления атома в химическом соединении; это гипотетический заряд, который имел бы атом, если бы все связи с атомами различных элементов были полностью ионными. Степени окисления обычно представляются целыми числами, которые могут быть положительными, отрицательными или нулевыми. В некоторых случаях средняя степень окисления элемента представляет собой долю, например 8/3 для железа в магнетите (Fe 3 O 4 ).
Наивысшая известная степень окисления +8 в тетраоксидах рутения, ксенона, осмия, иридия, хассия и некоторых комплексах с участием плутония; самая низкая известная степень окисления -4 для некоторых элементов углеродной группы.
Степени окисления плутония Здесь плутоний различается по цвету в зависимости от степени окисления.
Повышение степени окисления атома в результате химической реакции называется окислением и включает потерю электронов; уменьшение степени окисления атома называется восстановлением, и оно связано с присоединением электронов.
Общие правила, касающиеся степеней окисления
- Степень окисления свободного элемента (несвязанного элемента) равна нулю.
- Для простого (одноатомного) иона степень окисления равна суммарному заряду иона. Например, Кл — имеет степень окисления -1.
- В большинстве соединений водород имеет степень окисления +1, а кислород — степень окисления -2. Исключением является то, что водород имеет степень окисления -1 в гидридах активных металлов (таких как LiH) и степень окисления -1 в пероксидах (таких как H 2 O 2 ) или -1/ 2 в супероксидах (таких как KO).

- Алгебраическая сумма степеней окисления для всех атомов в нейтральной молекуле должна быть равна нулю. В ионах алгебраическая сумма степеней окисления составляющих их атомов должна быть равна заряду иона.
Прогнозирование степеней окисления
Как правило, степень окисления наиболее распространенных элементов можно определить по номеру их группы в периодической таблице. Это обобщено в следующей таблице:
Типичные степени окисления наиболее распространенных элементов группы Переходные металлы не включены, поскольку они имеют тенденцию проявлять различные степени окисления.
Из приведенной выше таблицы можно сделать вывод, что бор (элемент группы III) обычно имеет степень окисления +3, а азот (элемент группы V) — степень окисления -3. Имейте в виду, что степени окисления могут меняться, и этот метод прогнозирования следует использовать только в качестве общего руководства; например, переходные металлы не придерживаются каких-либо фиксированных правил и имеют тенденцию проявлять широкий диапазон степеней окисления.
Как указано в правиле номер четыре выше, сумма степеней окисления для всех атомов в молекуле или многоатомном ионе равна заряду молекулы или иона. Это помогает определить степень окисления любого элемента в данной молекуле или ионе, предполагая, что мы знаем общие степени окисления всех других элементов. Например, в сульфит-ионе (SO 3 2-) общий заряд иона равен 2-, и предполагается, что каждый кислород находится в своей обычной степени окисления -2. Поскольку в сульфите три атома кислорода, кислород вносит
3×−2=−63\times-2=-63×−2=−6
к общей сумме. Следовательно, сера должна иметь степень окисления +4, чтобы общий заряд сульфита был равен 2-:
(+4−6=−2).(+4−6=-2).(+4−6= −2).
Не путайте формальный заряд атома с его формальной степенью окисления, поскольку они могут быть разными (и часто бывают разными для многоатомных ионов). Например, заряд атома азота в ионе аммония NH 4 + равен 1+, но формальная степень окисления равна -3 — такая же, как у азота в аммиаке.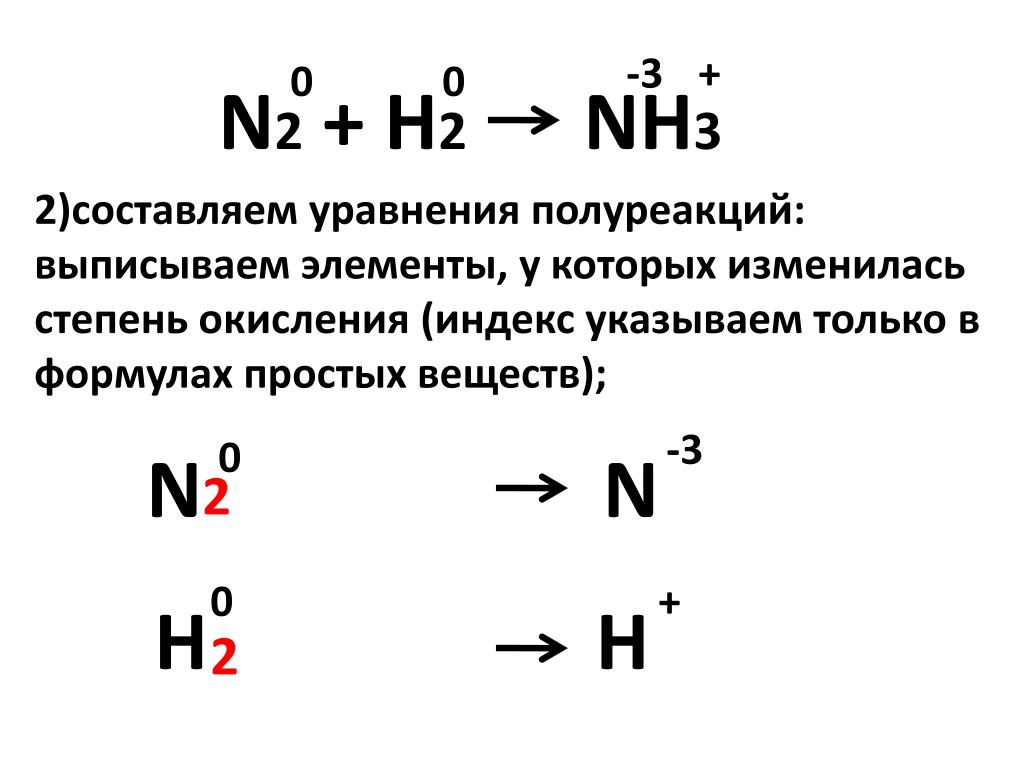 В случае между аммонием и аммиаком формальный заряд атома N меняется, но его степень окисления не меняется.
В случае между аммонием и аммиаком формальный заряд атома N меняется, но его степень окисления не меняется.
Show Sources
Безграничный поиск и выбор высококачественного контента с открытой лицензией со всего Интернета. В данном конкретном ресурсе использованы следующие источники:
«сокращение».
http://en.wiktionary.org/wiki/reduction Викисловарь
CC BY-SA 3.0.
«окисление».
http://en.wiktionary.org/wiki/oxidation
Викисловарь
CC BY-SA 3.0.
«Степень окисления».
http://en.wikipedia.org/wiki/Oxidation_state
Wikipedia
CC BY-SA 3.0.
«Плутоний в растворе».
http://simple.wikipedia.org/wiki/File:Plutonium_in_solution.jpg
Wikipedia
CC BY-SA.
«Ионные заряды».

 031
031