Вариант 2
Главная \ Подготовка к ОГЭ \ Химия \ Разбор вариантов 2017 года \ Вариант 2
Задание №1.
На приведенном рисунке
изображена модель атома
1. Кремния
2. Серы
3. Кислорода
4. Углерода
Объяснение: атом, модель которого приведена на рисунке, имеет два энергетических уровня, на первом уровне находится 2 электрона, а на втором — 4. Значит, это атом элемента №6 в Периодической таблице — углерод. Правильный ответ — 4.
Задание №2.
У химических элементов IVА группы периодической системы с увеличением относительной атомной массы:
1. Усиливаются металлические свойства и увеличивается валентность в водородных соединениях
2. Увеличиваются заряд ядра атома и радиус атома
3. Увеличиваются число электронных слоев в атоме и высшая валентность
4. Усиливаются неметаллические свойства и увеличивается число электронных слоев в атоме
Объяснение: у элементов одной группы валентность в водородных соединениях и высшая валентность. А заряд ядра атома и радиус атома в группе увеличиваются. Например, у углерода заряд ядра — +6, а у кремния — +14. Правильный ответ — 2.
А заряд ядра атома и радиус атома в группе увеличиваются. Например, у углерода заряд ядра — +6, а у кремния — +14. Правильный ответ — 2.
Задание №3.
Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно:
1. Хлор и хлороводород
2. Вода и азот
3. Сероводород и метан
4. Кислород и оксид серы (IV)
Объяснение: ковалентная полярная связь характерна для соединений разных неметаллов, а ковалентная неполярная связь — для двухатомных неметаллов, поэтому выбираем воду и азот. Правильный ответ — 2.
Задание №4.
В веществах, формулы которых: CrO3, CrCl2, Cr(OH)3, хром проявляет степени окисления, соответственно равные:
1. +6, +2, +3
2. +6, +3, +2
3. +3, +2, +3
4. +3, +2, +6
Объяснение: CrO3 — кислород в оксидах имеет степень окисления -2, тогда у хрома — +6, CrCl2 — у хлора степень окисления -1, а у хрома — +2, Cr(OH)3 — у гидроксид-иона степень окисления степень окисления -1, а у хрома — +3. Правильный ответ — 1.
Правильный ответ — 1.
Задание №5.
К сложным веществам относится каждое из веществ, указанных в ряду
1. Углекислый газ, вода, азот, хлор
2. Поваренная соль, сахар, хлороводород, аммиак
3. Сероводород, кальций, хлор, метан
4. Серная кислота, фтор, оксид цинка, алюминий
Объяснение: сложные вещества состоят из атомов двух или более элементов, к ним относятся: поваренная соль, сахар, хлороводород, аммиак. Правильный ответ — 2.
Задание №6.
Образование газа происходит при сливании растворов:
1. Хлорида кальция и нитрата серебра
2. Азотной кислоты и гидроксида калия
3. Карбоната натрия и соляной кислоты
4. Гидроксида железа (III) и серной кислоты
Объяснение: выделение газа возможно при образовании угольной или сернистой кислоты или гидроксида аммония, угольная кислота образуется в третьей реакции. Запишем ее:
Запишем ее:
Na2CO3 + 2HCl = 2NaCl + CO2↑ + h3O
Правильный ответ — 3.
Задание №7.
К электролитам относится каждое из веществ, формулы которых:
1. N2O, KOH, Na2CO3
2. Cu(NO3)2, HCl, Na2SO4
3. Ba(OH)2, Nh4xh3O, h3SiO3
4. CaCl2, Cu(OH)2, SO2
Объяснение: электролит — вещество, проводящее электрический ток при диссоциации на ионы. Сильными электролитами являются щелочи, сильные кислоты и соли. Правильный ответ — 2.
Задание №8.
В соответствии с сокращенным ионным уравнением
Al³+ + 3OH‾ = Al(OH)3
взаимодействует:
1. Сульфат алюминия и гидроксид бария
2. Нитрат алюминия и гидроксид калия
3. Оксид алюминия и гидроксид натрия
4. Фосфат алюминия и гидроксид кальция
Объяснение: данное сокращенное ионное уравнение возможно получить только при реакции, в которой единственным нерастворимым веществом является гидроксид алюминия. В первой реакции сульфат бария нерастворим, в третьей — оксид алюминия, в четвертой — фосфат кальция. Все нитраты и все соли калия растворимы, поэтому выбираем второе уравнение. Правильный ответ — 2.
В первой реакции сульфат бария нерастворим, в третьей — оксид алюминия, в четвертой — фосфат кальция. Все нитраты и все соли калия растворимы, поэтому выбираем второе уравнение. Правильный ответ — 2.
Задание №9.
Железо вытесняет металл из раствора:
1. ZnCl2
2. Cu(NO3)2
3. Al2(SO4)3
4. Mg(NO3)2
Объяснение: железо может вытеснить только более слабый металл, среди перечисленных более слабым металлом является только медь. Правильный ответ — 2.
Задание №10.
Оксид калия взаимодействует с каждым из веществ, указанных в ряду
1. Вода, оксид углерода (II), серная кислота
2. Оксид бария, вода, гидроксид натрия
3. Вода, оксид углерода (IV), соляная кислота
4. Аммиак, кислород, азотная кислота
Объяснение: оксид бария — основный оксид, то есть взаимодействует с веществами с кислотными свойствами, такими, как оксид углерода (IV) и соляная кислота, а с водой с образованием гидроксида калия. Правильный ответ — 3.
Правильный ответ — 3.
Задание №11.
Нерастворимая соль образуется при взаимодействии растворов
1. Хлорида натрия и азотной кислоты
2. Хлорида магния и карбоната натрия
3. Хлорида меди (II) и гидроксида натрия
4. Хлорида алюминия и серной кислоты
Объяснение: в первой реакции образуется растворимая соль — нитрат натрия, во второй — карбонат магния (нерастворимый) и хлорид натрия (растворимый). В третьей — растворимый хлорид натрия, в четвертой — растворимый сульфат алюминия. Правильный ответ — 2.
Задание №12.
Раствор фосфата калия взаимодействует
1. С нитратом кальция
2. С азотной кислотой
3. С сульфатом аммония
4. С гидроксидом натрия
Объяснение: здесь должна пройти реакция обмена, она идет до конца только в случае образования осадка или газа. В первой реакции образуются нитрат калия (все нитраты растворимы) и фосфат кальция (осадок), значит реакция идет до конца. Правильный ответ — 1.
Правильный ответ — 1.
Задание №13.
При смешивании с воздухом взрывоопасным становится каждый из газов:
1. Оксид азота (II) и метан
2. Водород и оксид углерода (II)
3. Оксид серы (IV) и аммиак
4. Метан и водород
Объяснение: в состав воздуха входит кислород, при смешивании кислорода и водорода в определенном объеме происходит реакция со взрывом, а метан — очень энергоемкий газ и на воздухе сгорает с выделением большого количества тепла. Правильный ответ — 4.
Задание №14.
Сера является окислителем в реакции, уравнение которой:
1. 2SO2 + O2 = 2SO3
2. 2h3S + 3O2 = 2h3O + 2SO2
3. h3S + Br2 = 2HBr + S
4. 2Al + 3S = Al2S3
Объяснение: окислитель в окислительно-восстановительной реакции принимает электроны. Рассмотрим изменения степеней окисления серы в приведенных реакция.
1. +4 (-2е) → +6
2. -2 (-6е) → +4
-2 (-6е) → +4
3. -2 (-2е) → 0
4. 0 (+2е) → -2
То есть сера принимает электроны в последней реакции. Правильный ответ — 4.
Задание №15.
Массовая доля кальция в карбонате кальция равна:
1. 0,8
2. 0,4
3. 0,2
4. 0,6
Объяснение: рассчитаем массовую долю кальция по формуле:
ω = (Ar(Ca) x n)/Mr, где n — количество атомов кальция в молекуле.
ω(Ca) = 40/100 = 0,4
Правильный ответ — 2.
Задание №16.
Общим для магния и цинка является
1. Наличие одинакового числа электронных слоев в их атомах
2. Наличие двух электронов на внешнем электронном слое в их атомах
3. Образование ими высших оксидов, которые относятся к основным оксидам
4. То, что они являются восстановителями в реакциях с неметаллами
5. То, что их оксиды хорошо растворяются в воде
Объяснение: магний находится в третьем периоде, во второй А группе и является щелочноземельным металлом, цинк находится в четвертом периоде, второй В группе и является переходным металлом, то есть эти два элемента имею разное количество электронных слоев. Но количество электронов на внешнем уровне у них одно и то же — 2. Оксид цинка является амфотерным, а не основным. А в реакциях с неметаллами являются восстановителями, так как отдают электроны. Их оксиды не растворяются в воде. Правильный ответ — 24.
Но количество электронов на внешнем уровне у них одно и то же — 2. Оксид цинка является амфотерным, а не основным. А в реакциях с неметаллами являются восстановителями, так как отдают электроны. Их оксиды не растворяются в воде. Правильный ответ — 24.
Задание №17.
Для этана характерны следующие утверждения
1. Обесцвечивает бромную воду
2. Вступает в реакцию дегидрирования
3. Атомы углерода в молекуле соединены одинарными связями
4. В состав молекулы входит один атом углерода
5. Относится к кислородсодержащим органическим веществам
Объяснение: этан — предельный углеводород, то есть для него характерны, в основном, реакции замещения. А еще он может дегидрироваться, превращаясь в этилен или ацетилен. Правильный ответ — 23.
Задание №18.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества
Вещества
1. SO3(г) и O2(г)
SO3(г) и O2(г)
2. HNO3(р-р) и Nh4(р-р)
3. BaCO3(тв) и BaO(тв)
Реактив
1. Na2SO4(р-р)
2. Ca(OH)2(р-р)
3. Фенолфталеин
4. HCl(р-р)
Объяснение: первые два газа можно различить в реакции с гидроксидом кальция: оксид серы будет образовывать соль — сульфат кальция, а кислород реагировать не будет. Растворы азотной кислоты и аммиака можно различить при помощи индикатора — фенолфталеина, он будет давать разную окраску: в кислой среде он будет бесцветный, а в слабо-щелочной — розовый. Правильный ответ — 234.
Задание №19.
Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать
Название вещества
А. Сероводород
Б. Оксид серы (VI)
В. Оксид серы (IV)
Реагенты
1. O2, KOH(р-р)
2. Hg, h3O
3. O2, Cu
4. h3O, CaO
Объяснение: сероводород реагирует с кислородом (при недостатке кислорода образуется сера и вода, а при избытке кислорода образуется оксид серы (IV)) и с гидроксидом калия (с образованием сульфида калия и воды). С этими же реагентами реагирует оксид серы (IV). А оксид серы (VI) реагирует с водой с образованием серной кислоты и с оксидом кальция с образованием сульфата кальция. Правильный ответ — 141.
С этими же реагентами реагирует оксид серы (IV). А оксид серы (VI) реагирует с водой с образованием серной кислоты и с оксидом кальция с образованием сульфата кальция. Правильный ответ — 141.
Задание №20.
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
K2MnO4 + HCl(конц) → MnCl2 + KCl + Cl2 + h3O
Определите окислитель и восстановитель.
Объяснение: в данной реакции меняют степень окисления — марганец и хлор.
Запишем баланс:
Mn(+6) +4e → Mn(+2) | 1 — окислитель
2Cl(-1) -2e → Cl2(0) | 2 — восстановитель
Расставим коэффициенты.
K2MnO4 + 8HCl(конц) → MnCl2 + 2KCl + 2Cl2 + 4h3O
Задание №21.
К 400 г раствора силиката калия добавили избыток раствора серной кислоты и получили 19,5 г осадка. Какова массовая доля соли (в %) в исходном растворе?
Объяснение: запишем реакцию.
K2SiO3 + h3SO4 → h3SiO3↓ + K2SO4
Рассчитаем количество вещества кремниевой кислоты.
n(h3SiO3) = 19,5/(2+28+48) = 0,25 моль
n(h3SiO3) = n(K2SiO3) = 0,25 моль
Рассчитаем массу вещества силиката калия.
M(K2SiO3) = 39×2 + 28 + 48 = 154 г/моль
m(K2SiO3) = 0,25 x 154 = 38,5 г
ω(K2SiO3) = 38,5/400 x 100% = 9,625%
Ответ: массовая доля соли в исходном растворе равна 9,625%.
Задание №22.
Даны вещества: ZnSO4, HNO3(конц), Hg, Cu, I2, KOH. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид меди (II). Опишите признаки проведения реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Объяснение: допустим медь прореагирует с концентрированной азотной кислотой.
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2↑ + 2h3O
А затем нитрат меди прореагирует с гидроксидом калия, при этом образуется нерастворимый гидроксид меди.
Cu(NO3)2 + KOH = KNO3 + Cu(OH)2↓
Устойчивость комплексных соединений
Ионы, находящиеся во внешней сфере комплексных соединений, связаны с комплексным ионом в основном силами электростатического взаимодействия. Комплексное соединение при электролитической диссоциации образуют комплексные ионы и ионы внешней сферы как сильные электролиты, например:
Na2[Ni(CN)4] ® 2Na+ + [Ni(CN)4]2–
[Ni(Nh4)6]SO4 ® [Ni(Nh4)6]2+ + SO42–
Комплексные соединения могут быть неэлектролитами. Например, [PtCl2(Nh4)2] – неэлектролит, так как содержит только внутреннюю сферу.
Комплексные ионы подвергаются диссоциации как слабые электролиты. Упрощенно диссоциацию внутренней сферы можно представить таким образом:
[Ni(Nh4)6]2+ « Ni2+ + 6Nh4
[Ni(CN)4]2– « Ni2+ + 4CN–
Применяя закон действующих масс к обратимым процессам диссоциации комплексных ионов, получим выражения константы нестойкости комплексов:
Константа нестойкости комплексного иона характеризует прочность (устойчивость) внутренней сферы комплексного иона. Чем меньше константа нестойкости, тем прочнее комплексный ион.
Чем меньше константа нестойкости, тем прочнее комплексный ион.
Комплекс [Ni(CN)4]2– прочнее, чем [Ni(Nh4)6]2+, так как
1,8•10–14<1,12•10–8.
К комплексным соединениям близко примыкают двойные соли, т.е. соединения с малоустойчивой внутренней сферой. Например, KAl(SO4)2.
Двойные соли в отличие от комплексных соединений диссоциируют на все составляющие их ионы:
KAl(SO4)2 « K+ + Al3+ + 2SO42–
Пример. Напишите молекулярные и ионно-молекулярные уравнения получения комплексных соединений, полученных при взаимодействии раствора ZnSO4 с избытком растворов Nh5OH и NaCN.
Решение. Определяем комплексообразователь и его степень окисления: Zn2+.
Лиганды: CN– и Nh4(Nh5OH « Nh4 + h3O).
Координационное число Zn2+ равно четырем.
Составляем внутреннюю координационную сферу и определяем ее заряд, который равен алгебраической сумме зарядов, образующих его простых ионов (нейтральные молекулы Nh4 не влияют на заряд). Внутреннюю сферу заключаем в квадратные скобки:
[Zn(Nh4)4]2+ — комплексный катион;
[Zn(CN)4]2– — комплексный анион.
Определяем ионы внешней координационной сферы:
SO42– и Na+
Составляем формулы комплексных соединений:
[Zn(Nh4)4]SO4 и Na2[Zn(CN)4]
Молекулярное уравнение получения [Zn(Nh4)4]SO4:
ZnSO4 + 4Nh5OH = [Zn(Nh4)4]SO4 + 4h3O
Ионно-молекулярное уравнение:
Zn2+ + 4Nh5OH = [Zn(Nh4)4]2+ + 4h3O
Молекулярное уравнение получения Na2[Zn(CN)4]:
ZnSO4 + 4NaCN = Na2[Zn(CN)4] + Na2SO4
Ионно-молекулярное уравнение:
Zn2+ + 4CN– = [Zn(CN)4]2–
Пример. Определите заряд комплексного иона, координационное число и степень окисления комплексообразователя в соединениях:
K2[Sn(OH)4]; [Cr(h3O)4Cl2]Cl
Решение. Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число равно числу лигандов, координированных вокруг комплексообразователя. Степень окисления комплексообразователя определяется из того, что алгебраическая сумма степеней окисления всех атомов и молекул в соединении равна нулю. Заряды нейтральных молекул равны нулю.
Заряды нейтральных молекул равны нулю.
Комплексное соединение | Заряд комплексного иона | Координационное число | Степень окисления комплексообразователя |
K2[Sn(OH)4] [Cr(h3O)4Cl2]Cl | [Sn(OH)4]2– [Cr(h3O)4Cl2]+ | 4 6 | Sn+2 Cr+3 |
Ваша оценка?
Петр Иваныч
Возможно этот человек ответит на ваши вопросы
Задать вопрос
В реакции $Zn + FeS{O_4} \\to ZnS{O_4} + Fe:$ A. Zn окисляется B. Fe окисляется C. Zn является окислителем D. Zn и Fe окисляются
Дата последнего обновления: 18 февраля 2023 г.
•
Общее представление: 258,3K
•
Просмотры сегодня: 2,46K
Ответ
Проверенные
258,3K+ виды
Hint: Zn Reacted с Honal Sulphate и Formpht.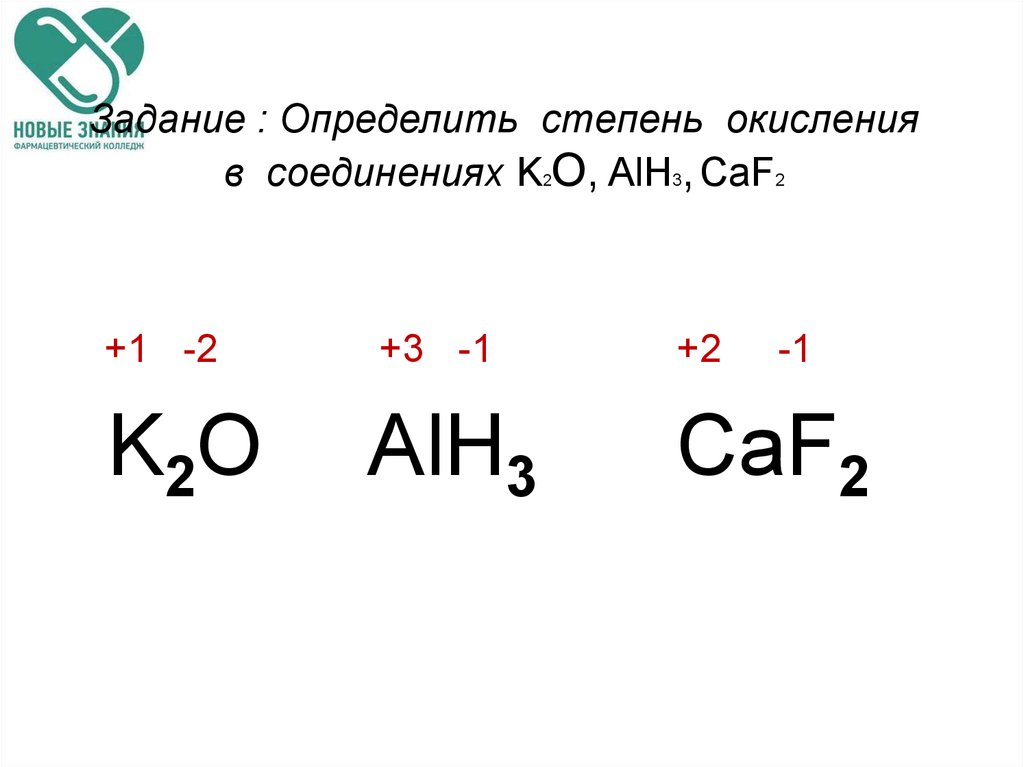 и железо. При добавлении цинка к раствору сульфата железа окраска раствора сульфата железа меняется. Это происходит потому, что цинк более реакционноспособен, чем железо, поэтому он вытесняет железо из своего раствора сернокислого железа и образуется серый осадок железа и бесцветный раствор сернокислого цинка. 90}(\operatorname{Reduction)$
и железо. При добавлении цинка к раствору сульфата железа окраска раствора сульфата железа меняется. Это происходит потому, что цинк более реакционноспособен, чем железо, поэтому он вытесняет железо из своего раствора сернокислого железа и образуется серый осадок железа и бесцветный раствор сернокислого цинка. 90}(\operatorname{Reduction)$
Как мы видим из приведенной выше реакции, степень окисления цинка составляет от 0 до +2. Таким образом, увеличение степени окисления описывает, что реакция становится реакцией окисления. В приведенной выше реакции Zn окисляется, а Fe демонстрирует реакцию восстановления, поскольку степень окисления уменьшается с +2 до 0.
Таким образом, общая реакция приведена ниже:
$ Zn + FeS{O_4} \ to ZnS{O_4} + Fe: $
Где Zn окисляется.
Следовательно, вариант (А) является правильным ответом.
Примечание: Эта реакция является окислительно-восстановительной реакцией. Окислительно-восстановительная реакция включает в себя как реакции окисления, так и реакции восстановления. Здесь zn окисляется и восстанавливает железо. Потеря отрицательно заряженных электронов соответствует увеличению степени окисления, а приобретение электронов соответствует уменьшению степени окисления. Следовательно, Zn подвергается окислению, степень окисления увеличивается, а Fe восстанавливается, степень окисления уменьшается.
Здесь zn окисляется и восстанавливает железо. Потеря отрицательно заряженных электронов соответствует увеличению степени окисления, а приобретение электронов соответствует уменьшению степени окисления. Следовательно, Zn подвергается окислению, степень окисления увеличивается, а Fe восстанавливается, степень окисления уменьшается.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 по химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом A 11 класс по химии JEE_Main
Фосфин получают из следующей руды A Кальций 12 класса по химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 по химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом A 11 класс по химии JEE_Main
Фосфин получают из следующей руды A Кальций 12 класса по химии JEE_Main
Актуальные сомнения
домашнее задание по химии | Wyzant Спросите эксперта
Химия
Энтони Х.
Используйте приведенное ниже уравнение, чтобы ответить на следующие вопросы. Ba + ZnSO4 BaSO4 + Zn
а. Определите степень окисления атомов в реагентах и продуктах уравнения: (6 баллов)
Степень окисления Ba в реагенте:
в продукте:
Состояние окисления Zn в реагенте:
В Продукте:
Состояние окисления S в реагенте:
В продукте:
Состояние окисления o in recegant:
Современное состояние окисления:
Состояние окисления.
В наличии:
Подписаться І 3
Подробнее
Отчет
2 ответа от опытных наставников
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
Джозеф С. ответил 17.12.14
ответил 17.12.14
Репетитор
5,0 (111)
Джозеф, трехъязычный инструктор, Пасо Роблес, Калифорния
Об этом репетиторе ›
Об этом репетиторе ›
Восстановление – это химическое превращение, при котором электроны приобретаются
Окисление – это химическое превращение, при котором электроны теряются
В этой реакции Ва восстанавливается из Ва 0 в Ва ++ , а Zn окисляется из Zn ++ в Zn 909014 0
по определению Кислород фиксируется при O —
в этой реакции S не изменяется
Голосовать за 0 Понизить
Подробнее
Отчет
Дж. Р. С.
ответил 18.12.14
Р. С.
ответил 18.12.14
Репетитор
5,0 (140)
к.т.н. Профессор университета со стажем репетиторства более 10 лет
Об этом репетиторе ›
Об этом репетиторе ›
Ba + ZnSO4 —>BaSO4 + Zn
Ba изменяется от 0 до 2+, поэтому он потерял электроны; он был окислен и является восстановителем
Zn переходит от 2+ к нулю, поэтому он приобрел электроны; он был восстановлен и является окислителем
Степень окисления S равна +6 в реагенте и продукте
Степень окисления O составляет -2 в реагенте и продукте
Голосовать за 0 Понизить
Подробнее
Отчет
Все еще ищете помощи? Получите правильный ответ, быстро.
Задайте вопрос бесплатно
Получите бесплатный ответ на быстрый вопрос.
