10. Серная кислота. Роль в окислительно-восстановительных процессах. Соли серной кислоты. Применение.
h3SO4. Сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). Сильный окислитель, окисляет HI и частично HBr до свободных галогенов, углерод до CO2, S — до SO2, окисляет многие металлы (Cu, Hg и др.). При этом серная кислота восстанавливается до SO2, а наиболее сильными восстановителями — до S и h3S.
Серную кислоту применяют в производстве минеральных удобрений, как электролит в свинцовых аккумуляторах, для получения различных минеральных кислот и солей, химических волокон, красителей, дымообразующих веществ и взрывчатых веществ, в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности.
11. Соединения серы в степени окисления +4. Роль в окислительно-восстановительных процессах (примеры). Применение.
SO2. Относится к
кислотным оксидам.
Растворяется в воде с образованием сернистой кислоты : SO2 + h3O ↔ h3SO3. Со щелочами образует сульфиты: SO2 + 2NaOH → Na2SO3 + h3O.
Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается: SO2 + Br2 + 2h3O → h3SO4 + 2HBr, 2SO2 + O2 → 2SO3 (требуется катализатор и температура 450°), 5SO2 + 2KMnO4 + 2h3O → 2h3SO4 + 2MnSO4 + K2SO4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. SO2 + 2CO → 2CO2 + S↓. Ph4 + SO2 → H(Ph3O2) + S↓
Сероводород в обычных условиях представляет собой бесцветный газ, обладает запахом тухлых яиц. Сильно ядовит, допустимая концентрация в воздухе 0,01 мг/л. В организме животного он может образовываться при введении внутрь высокодисперсной серы.
Сероводороды часто присутствуют в виде примесей в фармацевтических и ветеринарных препаратах.
12. Общая характеристика подгруппы азота.
Главную подгруппу
V группы периодической системы элементов
составляют азот N, фосфор P, мышьяк As,
сурьма Sb и висмут Bi.
13. Аммиак. Получение, химические свойства, применение.
Nh4- газ с резким удушливым запахом
— Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота(процесс Габера): N2(г) + 3h3(г) ↔ 2Nh4(г) + 91,84 кДж
Для получения
аммиака в лаборатории используют
действие сильных щелочей на соли аммония:
Nh5Cl
+ NaOH
= Nh4↑
+ NaCl
+ h3O. Nh5NO3
+ NaOH = Nh4↑ + NaNO3 + h3O.
Nh5NO3
+ NaOH = Nh4↑ + NaNO3 + h3O.
— Аммиак химически очень активен, особенно в реакциях окисления и присоединения.
Аммиак — сильный восстановитель. 4Nh4 + 3O2 = 2N2 + 6h3O
В присутствии катализатора аммиак окисляется до оксида азота (II): 4Nh4 + 5O2 = 4NO + 6h3O
При нагревании с хлором и пероксидом водорода образуются молекулы свободного азота: 2Nh4 + 3Cl2 = N2 + 6HCl . 2Nh4 + 3h3O2 = N2 + 6h3O
Водный раствор аммиака имеет щелочную реакцию, так как при растворении аммиака в воде образуется гидроксид аммония Nh5OH, который диссоциирует: Nh5OH » NH+ + ОН-
Гидроксид аммония неустойчив и распадается на аммиак и воду: Nh5OH = Nh4 + h3O
При нейтрализации раствора аммиака кислотами образуются соли аммония: Nh4 + HCl = Nh5Cl, 2Nh4 + h3SO4 = (Nh5)2SO4
— Аммиак относится
к числу важнейших продуктов химической
промышленности. В основном используется
для производства азотных удобрений
(нитрат и сульфат аммония, мочевина),
взрывчатых веществ и полимеров, азотной
кислоты, соды (по аммиачному методу) и
других продуктов химической промышленности.
Жидкий аммиак используют в качестве
растворителя. Применяют наружно (втирание
в кожу) при спастических коликах,
воспалении сухожилий и сухожильных
влагалищ, хронических артритах,
невралгиях; путем ингаляции – для
возбуждения ЦНС, в частности центров
дыхания и кровообращения; внутрь – для
усиления функций желудка и кишечника.
В основном используется
для производства азотных удобрений
(нитрат и сульфат аммония, мочевина),
взрывчатых веществ и полимеров, азотной
кислоты, соды (по аммиачному методу) и
других продуктов химической промышленности.
Жидкий аммиак используют в качестве
растворителя. Применяют наружно (втирание
в кожу) при спастических коликах,
воспалении сухожилий и сухожильных
влагалищ, хронических артритах,
невралгиях; путем ингаляции – для
возбуждения ЦНС, в частности центров
дыхания и кровообращения; внутрь – для
усиления функций желудка и кишечника.
14. Азотная кислота. Химические свойства. Взаимодействие с металлами. Нитраты. Обнаружение.
— HNO3. Под действием света азотная кислота частично разлагается с выделением NО2 и за счет этого приобретает светло-бурый цвет: 4HNO3 = 4NO2 + 2h3O + O2
Азотная кислота
принадлежит к числу наиболее сильных
кислот, и для нее характерны все реакции,
в которые вступают кислоты, — с
основаниями, основными оксидами и т. д.
Специфическим свойством азотной кислоты
является ее ярко выраженная окислительная
способность. Азотная кислота обладает
окислительной способностью при любой
концентрации, при этом, однако, чем
концентрированнее HNO3, тем менее глубоко
она восстанавливается. Большинство
неметаллов и сложных веществ восстанавливают
HNO3, как правило, до NO (реже до NO2): 3P
+ 5HNO3
= 3h4PO4
+ 5 NO,
S
+ 2HNO3
= h3SO4
+ 2NO,
3C
+ 4HNO3
= 3CO2
+ 4NO
+ 2h3O,
ZnS
+ 8HNO3(конц)
= ZnSO4
+ 8NO2
+ 4 h3O,
6HCl
+ 2HNO3(конц)
= 3Cl2
+ 2NO
+ 3h3O
д.
Специфическим свойством азотной кислоты
является ее ярко выраженная окислительная
способность. Азотная кислота обладает
окислительной способностью при любой
концентрации, при этом, однако, чем
концентрированнее HNO3, тем менее глубоко
она восстанавливается. Большинство
неметаллов и сложных веществ восстанавливают
HNO3, как правило, до NO (реже до NO2): 3P
+ 5HNO3
= 3h4PO4
+ 5 NO,
S
+ 2HNO3
= h3SO4
+ 2NO,
3C
+ 4HNO3
= 3CO2
+ 4NO
+ 2h3O,
ZnS
+ 8HNO3(конц)
= ZnSO4
+ 8NO2
+ 4 h3O,
6HCl
+ 2HNO3(конц)
= 3Cl2
+ 2NO
+ 3h3O
-Азотная кислота взаимодействует со всеми металлами, за исключением Au, Pt, W. Концентрированная HNO3 не взаимодействует при обычных условиях также с Fe, Al и Сr, которые она пассивирует, однако при очень сильном нагревании HNO3 взаимодействует и с этими металлами.
— HNO3 — сильная кислота. Её соли — нитраты — получают действием HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде.
-В колбу, соединенную
с холодильником, конец которого опускают
в колбу с водой, помещают исследуемую
жидкость и медные опилки. Колбу нагревают
на бане с минеральным маслом или на
песчаной бане и жидкость выпаривают
почти досуха. При достаточной концентрации
азотной кислоты происходит восстановление
ее медью в окись азота, которая с
кислородом воздуха образует двуокись
азота (оранжевые пары). Последняя,
растворяясь в воде, дает азотную и
азотистую кислоты, которые и обнаруживаются
химическими реакциями: 3Сu
+ 2HNO3
= ЗСuО
+ 2NO
+ Н2O,
3СuО
+ 6HNO3
= 3Cu(NO3)2
+ 3h3O,
2NO
+ O2
= 2NO2;
2NO2
+ h3O
= HNO2
+ HNO3
Колбу нагревают
на бане с минеральным маслом или на
песчаной бане и жидкость выпаривают
почти досуха. При достаточной концентрации
азотной кислоты происходит восстановление
ее медью в окись азота, которая с
кислородом воздуха образует двуокись
азота (оранжевые пары). Последняя,
растворяясь в воде, дает азотную и
азотистую кислоты, которые и обнаруживаются
химическими реакциями: 3Сu
+ 2HNO3
= ЗСuО
+ 2NO
+ Н2O,
3СuО
+ 6HNO3
= 3Cu(NO3)2
+ 3h3O,
2NO
+ O2
= 2NO2;
2NO2
+ h3O
= HNO2
+ HNO3
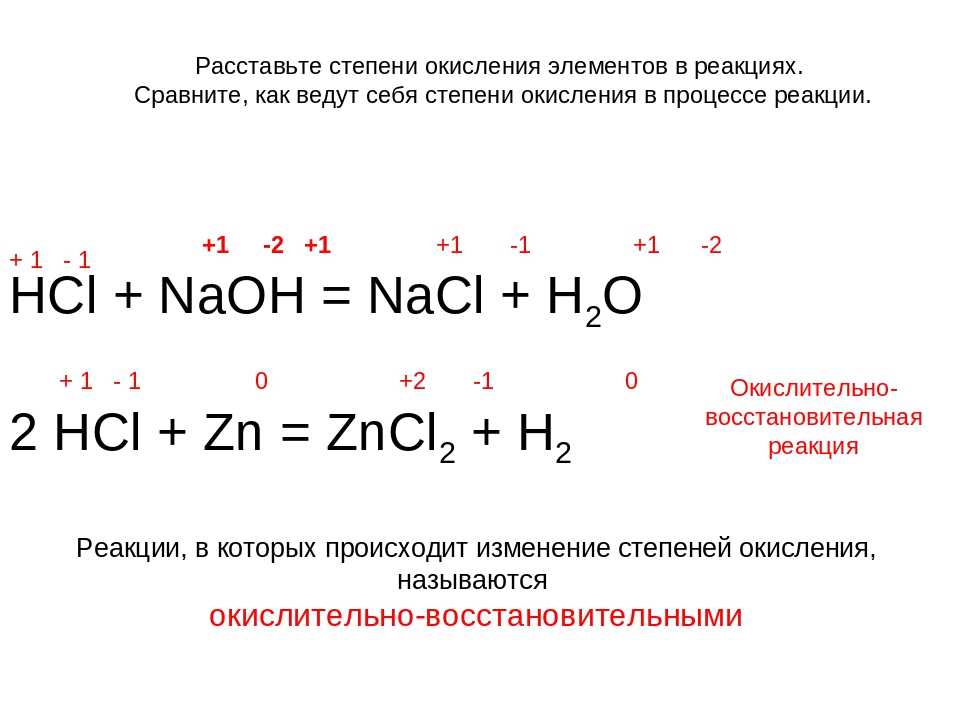
Серная кислота, h3SO4, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Химия ванадия — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3717
- Джим Кларк
- Школа Труро в Корнуолле
Ванадий получил свое название от скандинавской богини Ванадис и был открыт в 1801 году Андресом Мануэлем дель Рио. Он был выделен в 1867 году Генри Роско в виде серебристо-белого металла, несколько тяжелее алюминия, но легче железа. Обладает отличной коррозионной стойкостью при комнатной температуре.
История его открытия интересна. дель Рио отправил свои образцы бурой руды, содержащие то, что он считал новым элементом, в Париж для анализа и подтверждения вместе с кратким двусмысленным объяснением. Полный анализ и описание его работы были потеряны во время кораблекрушения, поэтому парижская лаборатория не увидела ничего, кроме коричневого порошка и короткой запутанной записки. Второй образец, отправленный в Берлин, был ошибочно помечен как хромат свинца. дель Рио сдался, потеряв уверенность в своем открытии. Этот элемент был заново открыт в 1867 году Нильсом Сефстрёмом.
Полный анализ и описание его работы были потеряны во время кораблекрушения, поэтому парижская лаборатория не увидела ничего, кроме коричневого порошка и короткой запутанной записки. Второй образец, отправленный в Берлин, был ошибочно помечен как хромат свинца. дель Рио сдался, потеряв уверенность в своем открытии. Этот элемент был заново открыт в 1867 году Нильсом Сефстрёмом.
Ванадий имеет необычно большое количество стабильных степеней окисления (+2, +3, +4, +5), каждая из которых характеризуется уникальным цветом в растворе. Металл используется в качестве легирующего агента для стали. Он сочетается почти со всеми неметаллами в соединениях.
Оксид ванадия(V) в качестве катализатора
Во время контактного процесса для производства серной кислоты диоксид серы должен быть преобразован в триоксид серы, что осуществляется путем пропускания диоксида серы и кислорода над твердым катализатором на основе оксида ванадия(V) .
\[ SO_2 + \dfrac{1}{2}O_2 \ce{->[V_2O_5]} SO_3\]
Это хороший пример способности переходных металлов и их соединений действовать как катализаторы из-за их способность изменять свою степень окисления (степень окисления). Диоксид серы окисляется до триоксида серы оксидом ванадия (V). При этом оксид ванадия (V) восстанавливается до оксида ванадия (IV).
Диоксид серы окисляется до триоксида серы оксидом ванадия (V). При этом оксид ванадия (V) восстанавливается до оксида ванадия (IV).
\[ SO_2 + V_2O_5 \rightarrow SO_3 + V_2O_4\]
Затем оксид ванадия(IV) повторно окисляется кислородом.
\[ V_2O_4 + \dfrac{1}{2} O_2 \rightarrow V_2O_5\]
Хотя катализатор был временно заменен во время реакции, в конце она химически такая же, как и в начале.
Степени окисления ванадия
Ванадий имеет степени окисления в своих соединениях +5, +4, +3 и +2. В этом разделе рассматриваются способы переключения между ними. Он начинается с небольшого описания, а затем переходит к рассмотрению реакций с точки зрения стандартных окислительно-восстановительных потенциалов (стандартных электродных потенциалов).
Рисунок \(\PageIndex{1}\): Степени окисления ванадия в кислом растворе. Слева направо степень окисления изменяется от +5 до +2. (CC BY-SA 3.0; W. Oelen)Поэтапное восстановление ванадия(V) до ванадия(II)
Обычным источником ванадия в степени окисления +5 является метаванадат аммония, NH 4 VO 3 . Он плохо растворяется в воде и обычно сначала растворяется в растворе гидроксида натрия. Раствор можно восстановить с помощью цинка и кислоты — либо соляной, либо серной, обычно с использованием умеренно концентрированной кислоты. Точный ион ванадия, присутствующий в растворе, очень сложен и зависит от pH раствора. Реакция проводится в кислых условиях, когда основной присутствующий ион равен 9.0066 VO 2 + — называется ионом диоксованадия(V).
Он плохо растворяется в воде и обычно сначала растворяется в растворе гидроксида натрия. Раствор можно восстановить с помощью цинка и кислоты — либо соляной, либо серной, обычно с использованием умеренно концентрированной кислоты. Точный ион ванадия, присутствующий в растворе, очень сложен и зависит от pH раствора. Реакция проводится в кислых условиях, когда основной присутствующий ион равен 9.0066 VO 2 + — называется ионом диоксованадия(V).
Если вы проводите реакцию в маленькой колбе, ее обычно закрывают ватой. Это позволяет водороду (полученному в результате побочной реакции между цинком и кислотой) уйти. В то же время он предотвращает попадание большого количества воздуха. Это предотвращает повторное окисление более низких степеней окисления ванадия (особенно состояния +2) кислородом воздуха. Реакцию обычно подогревают, чтобы изменения происходили в разумные сроки. Снижение показано в два этапа. Показаны некоторые отдельные важные цвета, но процесс представляет собой одно непрерывное изменение от начала до конца.
Снижение с +5 до +4
Важно отметить, что зеленый цвет, который вы видите, на самом деле не является другой степенью окисления. это всего лишь смесь исходного желтого цвета состояния +5 и синего цвета состояния +4. Будьте очень осторожны с формулами двух ионов ванадия — их очень легко спутать!
Снижение с +4 до +2. Изменения цвета продолжаются.
Причина, по которой ион ванадия(III) заключен в кавычки, состоит в том, что это почти наверняка упрощение. Точная природа комплексного иона будет зависеть от того, какую кислоту вы используете в процессе восстановления. Упрощение, вероятно, разумно на этом уровне.
Реокисление ванадия(II)
Ион ванадия(II) очень легко окисляется. Если вынуть вату из колбы и налить раствор в пробирку, он станет зеленым из-за контакта с кислородом воздуха. Он снова окисляется до ванадия (III). Если ему дать постоять в течение длительного времени, раствор в конечном итоге станет синим, поскольку воздух окисляет его обратно до состояния ванадия (IV) — ионы VO 2 + . Добавление азотной кислоты (достаточно сильного окислителя) к исходному раствору ванадия (II) также дает синий VO 9.0069 2 + ионов. Ванадий (II) снова окисляется до ванадия (IV).
Добавление азотной кислоты (достаточно сильного окислителя) к исходному раствору ванадия (II) также дает синий VO 9.0069 2 + ионов. Ванадий (II) снова окисляется до ванадия (IV).
Использование цинка в качестве восстановителя
Рассмотрим первую стадию восстановления — от ВО 2 + к ВО 2 + . Окислительно-восстановительный потенциал полуреакции ванадия определяется формулой:
Соответствующее равновесие для цинка: положительное значение E° сдвинется вправо; тот, у которого более отрицательное (или менее положительное) значение E°, перемещается влево. Если смешать цинк и VO 2 + ионов в присутствии кислоты с получением H + ионов:
Это превращает два равновесия в две односторонние реакции. Вы можете записать их и скомбинировать, чтобы получить ионное уравнение реакции, если хотите.
Другие стадии реакции
Вот значения E° для всех стадий восстановления ванадия(V) в ванадий(II):
. . . и вот снова значение цинка:
. . и вот снова значение цинка:
Помните, что для того, чтобы реакции с ванадием двигались вправо (а это то, чего мы хотим), их значения E° должны быть более положительными, чем то, с чем вы их взаимодействуете. Другими словами, чтобы реакция сработала, цинк всегда должен иметь более отрицательное значение — и это так. Цинк может восстанавливать ванадий на каждом из этих этапов с образованием иона ванадия (II).
Использование других восстановителей
Предположим, вы заменили цинк в качестве восстановителя на олово. Как далеко зайдет набор сокращений на этот раз?
Вот снова значения E°:
. . . а вот значение олова:
Чтобы произошло каждое восстановление, реакция ванадия должна иметь более положительное значение E°, потому что мы хотим, чтобы она шла вправо. Это означает, что олово должно иметь более отрицательное значение.
- В первом уравнении ванадия (от +5 до +4) значение олова более отрицательное.
 Это работает нормально.
Это работает нормально. - Во втором уравнении ванадия (от +4 до +3) значение олова снова более отрицательное. Это тоже работает.
- Но в конечной реакции ванадия (от +3 до +2) олово уже не имеет более отрицательного значения Е°. Олово не восстанавливает ванадий (III) до ванадия (II).
Реокисление ванадия(II)
Степень окисления ванадия(II) легко окисляется до ванадия(III) — или даже выше.
Окисление ионами водорода
Вы помните, что первоначальное восстановление, о котором мы говорили, проводилось с использованием цинка и кислоты в колбе, закрытой ватой для защиты от воздуха. Воздух быстро окисляет ионы ванадия (II), но также и ионы водорода, присутствующие в растворе!
Раствор ванадия(II) стабилен только до тех пор, пока вы не пропускаете воздух и в присутствии цинка. Цинк необходим для снижения содержания ванадия. Что произойдет, если цинка не будет? Посмотрите на эти значения E°:
Реакция с более отрицательным значением E° идет влево; реакция с более положительной (или менее отрицательной) справа. Это означает, что ионы ванадия(II) будут окисляться до ионов ванадия(III), а ионы водорода восстанавливаться до водорода.
Это означает, что ионы ванадия(II) будут окисляться до ионов ванадия(III), а ионы водорода восстанавливаться до водорода.
Пройдет ли окисление дальше, например, до состояния ванадия(IV)? Посмотрите на значения E° и решите:
Чтобы равновесие ванадия сместилось влево, оно должно иметь более отрицательное значение E°. Он не имеет более отрицательного значения Е°, поэтому реакции не происходит.
Окисление азотной кислотой
Подобным образом можно определить, насколько азотная кислота окислит ванадий(II). Вот первый шаг:
Реакция с ванадием имеет более отрицательное значение E° и поэтому будет двигаться влево; азотнокислая реакция движется вправо.
Азотная кислота окисляет ванадий(II) до ванадия(III). На втором этапе используются следующие значения Е°:
Азотная кислота снова имеет более положительное значение Е° и поэтому движется вправо. Более отрицательная (менее положительная) реакция на ванадий смещается влево. Азотная кислота обязательно окислит ванадий (III) до ванадия (IV). Дойдет ли он до ванадия(V)?
Азотная кислота обязательно окислит ванадий (III) до ванадия (IV). Дойдет ли он до ванадия(V)?
Нет, не будет! Чтобы реакция ванадия двигалась влево с образованием иона диоксованадия (V), она должна иметь более отрицательное (менее положительное) значение E°. Он не имеет менее положительного значения, поэтому реакции не происходит.
Точно так же можно определить влияние любого другого окислителя на низшие степени окисления ванадия. Но не думайте, что поскольку значения Е° показывают, что реакция возможна, она обязательно произойдет.
Авторы и авторство
Эта страница под названием «Химия ванадия» распространяется под лицензией CC BY-NC 4.0, ее автором, ремиксом и/или куратором является Джим Кларк.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Джим Кларк
- Лицензия
- CC BY-NC
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- Андрес Мануэль дель Рио
- катализатор
- Генри Роско
- окисление
- степени окисления
- восстановитель
- Ванадис
- ванадий
What, How To Balance & FAQs —
By Debarati Chakraborty
H 2 SO 4 является сильной кислотой, тогда как F 2 является одним из сильнейших окислителей. Давайте исследуем возможность реакции между H 2 SO 4 и F 2 .
Серная кислота (H 2 SO 4 ) обладает высокой коррозионной активностью. С другой стороны, фтор (F 2 ) является одним из наиболее реакционноспособных элементов, который в основном существует в природе в виде его соединений.
С другой стороны, фтор (F 2 ) является одним из наиболее реакционноспособных элементов, который в основном существует в природе в виде его соединений.
В этой статье мы узнаем подробности о возможности реакции между H 2 SO 4 и F 2 . Реакции между серной кислотой и фтором не будет.
Что является продуктом H 2 SO 4 и F 2 ?Реакция H 2 SO 4 + F 2 не происходит, поэтому образования продукта не происходит. Фтор является самым сильным окислителем с потенциалом окисления +2,65 В. И наоборот, степень окисления S в H 2 SO 4 равна +6, что является наивысшей степенью окисления S. Следовательно, H 2 СО 4 не может подвергаться дальнейшему окислению.
Как сбалансировать H 2 SO 4 + F 2 ? H 2 SO 4 + F 2 реакция не может быть уравновешена из-за отсутствия образования продуктов.
A TITRATION Невозможно выполнить между F 2 2 2 2 2 2 2 2 2 2 2 2 2 .0062 2 SO 4 , так как их химическая реакция неизвестна.
H 2 SO 4 + F 2 Чистое ионное уравнениеH 2 SO 4 + F 2 2 SO 4 + F 2 .
H 2 SO 4 + F 2 Конъюгатные парыH 2 SO 4 + F 2 SOMUGRS SO 4 + F 2 9003.0071
- Сопряженная пара H 2 SO 4 представляет собой HSO 4 – .

- Для F 2 не существует сопряженной пары.
H 2 SO 4 + F 2 2 SO 4 + F 2 2 SO 4 + F 2 2 SO 4 + F 2 2 SO 4 + F 2 2 SO 4 + F 2 2 .0003 F 2 является неполярной молекулой, поэтому между молекулами фтора существует слабая сила взаимодействия при стенке Вандера. 0066 F 2 и H 2 SO 4 , нельзя рассчитать 
H 2 SO 4 + F 2 реакция не является буферным раствором и его слабой кислотой, и его слабым основанием, и его сопряженным основанием сопряженная кислота.
IS H 2 SO 4 + F 2 Полная реакцияH 2 SO 4 + F 2 2 SO 4 + F 2 2 SO 4 + F 2 2 SO 4 + F 2 2 SO 4 + F 2 2 . потому что оба они не реагируют друг с другом.
Is H 2 SO 4 + F 2 экзотермическая или эндотермическая реакция ? Н 2 SO 4 + F 2 реакция не может быть экзотермической или эндотермической реакцией, поскольку между ними не происходит никакой реакции.
H 2 SO 4 + F 2 . Режректория AS 4 + F 2 . не реагировать друг на друга.
Is H 2 SO 4 + F 2 реакция осаждения ?H 2 SO 4 + F 2 реакция не может быть осаждением реакцией, потому что между ними не происходит реакции.
Is H 2 SO 4 + F 2 обратимая или необратимая реакция ? H 2 SO 4 + F 2 не является ни реверсивным, ни необратимая реакция, потому что они не реагируют друг с другом.

 Это работает нормально.
Это работает нормально.