Классификация химических реакций » Дистанционные олимпиады Inter Olymp
Укажите схемы реакций соединения:
1) Fe(OH)3 → Fe2O3 + h3O 2) AgNO3 → Ag + NO2 + O2
3) SO2 + O2 → SO3 4) NO2 + O2 + h3O → HNO3
Укажите схемы реакций, для проведения которых обязательно используется катализатор:
1) KOH + h3SO4 → K2SO4 + h3O 2) N2 + h3 → Nh4
3) Nh4 + O2 → NO + h3O 4) Nh4 + O2 → N2 + h3O
Отметьте уравнения или схемы реакций разложения:
1) HNO3 → h3O + NO2 +O2 2) Fe + Cu(NO3)2 = Fe(NO3)2 + Cu
3) NaOH + HCl = NaCl + h3O 4) h3O2 → h3O + O2
Укажите уравнения или схемы реакций замещения:
1) Zn + 2AgNO3 = Zn(NO3)2 + 2Ag 2) Fe + h3SO4 = FeSO4 + h3
3) CaCl2 + Na2CO3 = CaCO3 + 2NaCl 4) CuO + h3 → Cu + h3O
Отметьте уравнения или схемы экзотермических реакций:
1) N2 + h3 → Nh4 + Q 2) SO2 + O2 + Q → SO3
3) C + O2 = CO2 + 369 кДж 4) CaCO3 = CaO + CO2 + 157 кДж
Укажите уравнения или схемы реакций обмена:
1) NaOH + h3SO4 → Na2SO4 + h3O 2) Ba(NO3)2 + K2SO4 → BaSO4 + KNO3
3) N2O5 + h3O → HNO3 4) CuO + 2HNO3 = Cu(NO3)2 + h3O
Число продуктов всегда меньше числа исходных веществ в случае реакций:
1) обмена
2) соединения
3) разложения
4) замещения
Отметьте уравнения или схемы окислительно-восстановительных реакций:
1) Al + Cl2 → AlCl3 2) BaCO3 = BaO + CO2 3) h3O2 → h3O + O2
4) Cu + AgNO3 → Cu(NO3)2 + Ag
Укажите уравнения или схемы необратимых реакций:
1) N2 + 3h3 ⇆ 2Nh4 2) Ba(OH)2 + h3SO4 → BaSO4 + h3O
3) NaOH + HCl = NaCl + h3O 4) SO2 + O2 ⇆ SO3
Число продуктов всегда больше числа исходных веществ в случае реакций:
1) разложения
2) обмена
3) соединения
4) замещения
Окислительно-восстановительной в неорганической химии всегда является реакция:
1) разложения
2) обмена
3) замещения
4) соединения
В неорганической химии реакция замещения протекает:
1) между двумя простыми веществами 2) двумя сложными веществами
3) простым и сложным веществами
4) как двумя простыми, так и двумя сложными веществами
Окислительно-восстановительными могут быть реакции:
1) замещения
2) обмена
3) разложения
4) соединения
Без изменения степени окисления атомов элементов всегда протекают реакции:
1) обмена
2) соединения
3) разложения
4) замещения
В реакцию обмена между собой могут вступать вещества:
1) простое и сложное 2) два простых 3) два сложных
4) как два простых, так и два сложных
В результате реакции разложения могут образоваться:
1) только простые вещества 2) только сложные вещества
3) или только простые, или только сложные вещества
4) одновременно простые и сложные вещества
В реакцию соединения между собой могут вступать вещества:
1) только простые 2) только сложные 3) как простые, так и сложные
4) простое со сложным
Укажите справедливые утверждения:
1) в результате реакции разложения образуется не более двух новых веществ
2) в реакции обмена число различных по составу продуктов всегда равно числу различных по составу исходных веществ
3) в реакции соединения число различных по составу исходных веществ всегда больше, чем продуктов
4) в неорганических реакциях замещения число различных по составу исходных веществ равно числу различных по составу продуктов
Укажите схему или уравнение окислительно-восстановительной реакции разложения:
1) CaCO3 = CaO + CO2 2) h3O2 → h3O + O2 3) Cu + O2 → CuO
4) NaHCO3 → Na2CO3 + h3O + CO2
Отметьте уравнения или схемы окислительно-восстановительных реакций соединения:
1) SO2 + O2 → SO3 2) NO2 + h3O → HNO3 + NO
3) NO2 + O2 + h3O → HNO3 4) SO2 + NaOH = NaHSO3
Укажите схемы или уравнения окислительно-восстановительных реакций замещения:
1) CaCO3 + SiO2 = CaSiO3 + CO2 2) Fe(OH)2 + HCl → FeCl2 + h3O
3) Zn + h3SO4 = ZnSO4 + h3↑ 4) Fe2O3 + h3 → Fe + h3O
Реакция НЕ может быть одновременно:
1) обмена и окислительно-восстановительной
2) окислительно-восстановительной и разложения
3) замещения и окислительно-восстановительной
4) соединения и окислительно-восстановительной
Гомогенными могут быть:
1) только реакции обмена 2) только реакции соединения
3) только реакции разложения
4) все вышеназванные реакции, а также реакции замещения
Одна и та же реакция может быть одновременно:
а) обратимой и экзотермической б) замещения и обмена
в) обмена и разложения г) соединения и разложения
1) а, в, г
2) а, в
3) б, в, г
4) б, г
Отметьте уравнения или схемы гомогенных реакций соединения:
1) CaO (тв) + CO2 (г) = CaCO3 (тв) 2) CO (г) + O2 (г) → CO2 (г)
3) NO2 (г) + h3O (ж) + O2 (г) → HNO3 (ж) 4) SO3 (ж) + h3O (ж) = h3SO4 (ж)
Укажите уравнения или схемы гомогенных окислительно-восстановительных реакций разложения:
1) Cu(NO3)2 (тв) → CuO (тв. ) + NO2 (г) + O2 (г) 2) SO3 (г) → SO2 (г) + O2 (г)
) + NO2 (г) + O2 (г) 2) SO3 (г) → SO2 (г) + O2 (г)
3) Nh5NO3 (тв) → N2O (г) + h3O (ж) 4) 2Nh4 (г) = N2 (г) + 3h3 (г)
Отметьте уравнения или схемы гетерогенных окислительно-восстановительных реакций:
1) Na (тв) + h3O (ж) → NaOH (p-p) + h3 (г)
2) h3 (г) + CuO (тв) = Cu (тв) + h3O (г)
3) NO2 (г) + CO (г) → N2 (г) + CO2 (г)
4) h3 (г) + N2O (г) = N2 (г) + h3O (г)
Укажите схемы или уравнения гомогенных экзотермических реакций обмена:
1) NaOH (p-p) + HCl (p-p) = NaOH (p-p) + h3O (ж) + Q
2) Ba(OH)2 (p-p) + 2HCl (p-p) = BaCl2 (p-p) + 2h3O (ж) + Q
3) N2(г) + h3 (г) → Nh4 (г) + Q 4) h3 (г) + I2 (г) → HI (г) − Q
Даны схемы (уравнения) реакций получения SO2. Из них гетерогенными окислительно-восстановительными будут реакции:
а) FeS2 (тв) + O2 (г) → Fe2O3 (тв) + SO2 (г)
б) NaHSO3 (p-p) + HCl (p-p) → NaCl (p-p) + h3O (ж) + SO2 (г)
в) S (тв) + O2 (г) = SO2 (г)
г) Fe2(SO4)3 (тв) → Fe2O3 (тв) + SO2 (г) + O2(г)
1) а, б, в
2) а, б, г
3) б, в, г
4) а, в, г
Даны реакции: а) обжиг пирита; б) обжиг известняка; в) фотосинтез; г) взаимодействие водных растворов сульфата натрия и хлорида бария. Окислительно-восстановительными из перечисленных будут реакции:
Окислительно-восстановительными из перечисленных будут реакции:
1) а, б
2) а, в
3) а, г
4) б, в
Для описания реакции нейтрализации подходят признаки:
1) всегда гомогенная
2) обмена
3) продукты — как правило, соль и вода
4) может быть гомогенной и гетерогенной
Даны вещества, формулы которых Zn, ZnO, Zn(OH)2, ZnCO3, SO2. Укажите число веществ, которые могут реагировать с h3SO4 (разб.) по типу реакции обмена:
1) 5
2) 4
3) 3
4) 2
Даны вещества, формулы которых Al2O3, Al, Al(OH)3, Na3[Al(OH)6], Al(NO3)3, SO2, P2O5. Число веществ, с которыми KOH (р-р) может реагировать по типу реакции соединения, равно:
1) 6
2) 5
3) 4
4) 3
Укажите формулу вещества, с которым CuSO4 (р-р) реагирует по типу реакции обмена:
1) Zn
2) KNO3
3) KOH
4) HCl
Даны вещества, имеющие формулы Fe2O3, NaHS, Fe(OH)3, Ba(NO3)2, NaHSO4, Na2[Zn(OH)4]. Число веществ, с которыми h3SO4 (разб.) реагирует по типу реакции обмена, равно:
1) 6
2) 5
3) 4
4) 3
К реакциям соединения следует отнести реакции:
1) между K2S (р-р) и h3S 2) Al(OH)3 и NaOH (p-p)
3) K3[Al(OH)6] и HCl (p-p) 4) Al2O3 и KOH (тв)
Укажите экзотермические процессы:
1) F0 (г) + e- → F− (г) 2) h3 (г) → 2H (г) 3) Mg (г) → Mg2+ (г) + 2e-
4) Ca2+ (г) + 2e- = Ca (г)
Написать комментарий
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Практическая работа № 5 стр. 102 Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов
1) Получение оксида углерода (IV) и определение его свойств
а)
Действия: В пробирку кладем несколько кусочков мрамора, добавляем раствор соляной кислоты.
Наблюдения: Выделяется газ.
Уравнения реакции:Выводы:
При действии на мрамор соляной кислотой, она вытесняет из карбоната слабую угольную кислоту, которая затем разлагается на H2O и CO2
б)
: Конец газоотводной трубки помещаем в пробирку с известковой водой.
Наблюдения: Образуется белый осадок, который растворяется.
Уравнения реакции:Выводы:
При пропускании углекислого газа через известковую воду образуется карбонат кальция, который затем растворяется, превращаясь в гидрокарбонат. в)
в)
: Пропускаем углекислый газ через дистиллированную воду. Затем добавляем синий лакмус.
Наблюдения: Лакмус краснеет.
Уравнения реакции:Выводы:
Т.к. синий лакмус краснеет, следовательно, при растворении в воде образуется кислота. г)
Действия: Наливаем в пробирку разбавленный
добавляем фенолфталеин и пропускаем углекислый газ.
: В растворе щелочи фенолфталеин розовеет, при пропускании углекислого газа — обесцвечивается.
Уравнения реакции:Выводы:
Идет реакция между
Это еще раз подтверждает кислотные свойства
2) Распознавание карбонатов.
Даны вещества:
а)
: Ко всем веществам добавляем соляную кислоту.
: В одной из пробирок выделяется газ.
Уравнения реакции:Выводы:
В данной пробирке — карбонат калия, это качественная реакция на карбонат-ион. б)
Наблюдения: В другой пробирке образ. прозрачный осадок.
Уравнения реакции:Выводы:
В данной пробирке — силикат натрия, т.к. происходит образование нерастворимой кремниевой кислоты. в)
: Два оставшихся вещества растворяем водой и добавляем раствор хлорида бария.
Наблюдения:В одной из пробирок образовался белый осадок.
Уравнения реакции:Выводы:
Это качественная реакция на сульфат-ион, значит, в данной пробирке находится сульфат натрия. г)
Действия: В оставшийся р-р добавляем р-р нитрата серебра (I).
: Образовался белый осадок.
Уравнения реакции:Выводы:
Реакция является качественной на хлорид-ион, следовательно, в данной пробирке — хлорид цинка.
Источник: Решебник
по
химии
за 9 класс (Г.Е.Рудзитис, Ф.Г.Фельдман, 1999 год),
задача №0
к главе «Лабораторные и практические работы».
Все задачи
← Лабораторный опыт XI стр. 101 Ознакомление со свойствами и взаимопревращениями карбонатов и гидрокарбонатов
Лабораторный опыт XV стр. 121 Взаимодействия металлов растворами солей →
Для реакции соляной кислоты и карбоната кальция сбалансированное уравнение имеет вид а. Какой реагент является лимитирующим? б. Сколько молей СО2 может образоваться? в. Если действительно образовалось 0,180 моль СО2, то каков выход в процентах?
Вопрос
Пошаговый ответ
AI Рекомендуемый ответ:
Реакция соляной кислоты и карбоната кальция представляет собой сбалансированное уравнение.
Видеоответ:
Решает проверенный эксперт
Для реакции соляной кислоты и карбоната кальция балансовое уравнение имеет вид 2 HCl + CaCO3 → CO2 + h3O + CaCl2 Если 0,400 моль HCl реагирует с 0,300 моль CaCO3: а. Какой реагент является лимитирующим?_______________ б. Сколько молей СО2 может образоваться?_______________ в. Если действительно образовалось 0,180 моль СО2, то каков выход в процентах? ________________
Рекомендуемые видео
Стенограмма
Здравствуйте, студенты, в этом вопросе нам дано уравнение: карбонат кальция реагирует с 2 c l, чтобы дать нам хлорид кальция плюс вода плюс c o 2 балла. Теперь нам дано число молей h, c l как 0,4. Количество молей карбоната кальция указано как 0,3. Теперь из реакции мы знаем, что на 1 моль карбоната кальция нужно 2 моля ск, л, что означает 4,3 моля карбоната кальция. Нам нужно 0,3 умножить на 2 моля scl, значит, нам нужно 0,6 моля cl, но в вопросе указано, что у нас есть только 0,4 моля l. Следовательно, здесь мы можем сказать, что cl является ограничивающим реагентом, поскольку в реакции участвует только 0,4 моля. Сейчас. Вторая часть уравнения попросила нас рассчитать количество молей произведенного CO 2 . Теперь, поскольку h c l является лимитирующим реагентом реакции. Мы можем видеть, что 2 моля cl производят 1 моль co 2 . Это означает, что 0,4 моля cl дадут нам 0,4, умноженное на 1 на 2. Это означает только 0,2 моля co 2 . Следовательно, мы можем сказать, что тупым ответом на вторую часть было бы то, что количество молей CO 2 , образующихся в реакции, составляет 0,02 моля. Теперь третья часть вопроса попросила нас рассчитать процентную доходность. Теперь нам дано, что если фактическое количество CO 2 , которое образуется в реакции, равно 0,18, это означает фактический выход c. O 2 составляет 0,18 моля углекислого газа. Итак, мы знаем формулу расчета процентной доходности — процент.
Нам нужно 0,3 умножить на 2 моля scl, значит, нам нужно 0,6 моля cl, но в вопросе указано, что у нас есть только 0,4 моля l. Следовательно, здесь мы можем сказать, что cl является ограничивающим реагентом, поскольку в реакции участвует только 0,4 моля. Сейчас. Вторая часть уравнения попросила нас рассчитать количество молей произведенного CO 2 . Теперь, поскольку h c l является лимитирующим реагентом реакции. Мы можем видеть, что 2 моля cl производят 1 моль co 2 . Это означает, что 0,4 моля cl дадут нам 0,4, умноженное на 1 на 2. Это означает только 0,2 моля co 2 . Следовательно, мы можем сказать, что тупым ответом на вторую часть было бы то, что количество молей CO 2 , образующихся в реакции, составляет 0,02 моля. Теперь третья часть вопроса попросила нас рассчитать процентную доходность. Теперь нам дано, что если фактическое количество CO 2 , которое образуется в реакции, равно 0,18, это означает фактический выход c. O 2 составляет 0,18 моля углекислого газа. Итак, мы знаем формулу расчета процентной доходности — процент. Урожайность равна фактической урожайности, деленной на туретическую урожайность, умноженной на 100 баллов. Итак, давайте воспользуемся этой формулой для расчета процентного выхода углекислого газа. Мы знаем, что фактическая доходность равна 0,1, и теоретически мы рассчитали, что она равна 0,2. Теперь, подставив их в формулу, мы получим процент выхода диоксида углерода, который получается равным 9.0 процентов. Итак, это наш окончательный ответ. Я надеюсь, что вы найдете видео полезным. Спасибо.
Урожайность равна фактической урожайности, деленной на туретическую урожайность, умноженной на 100 баллов. Итак, давайте воспользуемся этой формулой для расчета процентного выхода углекислого газа. Мы знаем, что фактическая доходность равна 0,1, и теоретически мы рассчитали, что она равна 0,2. Теперь, подставив их в формулу, мы получим процент выхода диоксида углерода, который получается равным 9.0 процентов. Итак, это наш окончательный ответ. Я надеюсь, что вы найдете видео полезным. Спасибо.
Поделиться Вопрос
Добавить в плейлист
Хммм, кажется, у вас нет плейлистов. Пожалуйста, добавьте свой первый плейлист.
`
Известняк (CaCO3) реагирует с соляной кислотой в соответствии с …
Проблема
Соответствующее решение
8 м
Воспроизвести видео:
Всем привет. Эта задача читается уравнением реакции сульфида натрия с соляной кислотой: сульфид натрия плюс соляная кислота дает сероводород плюс хлорид натрия.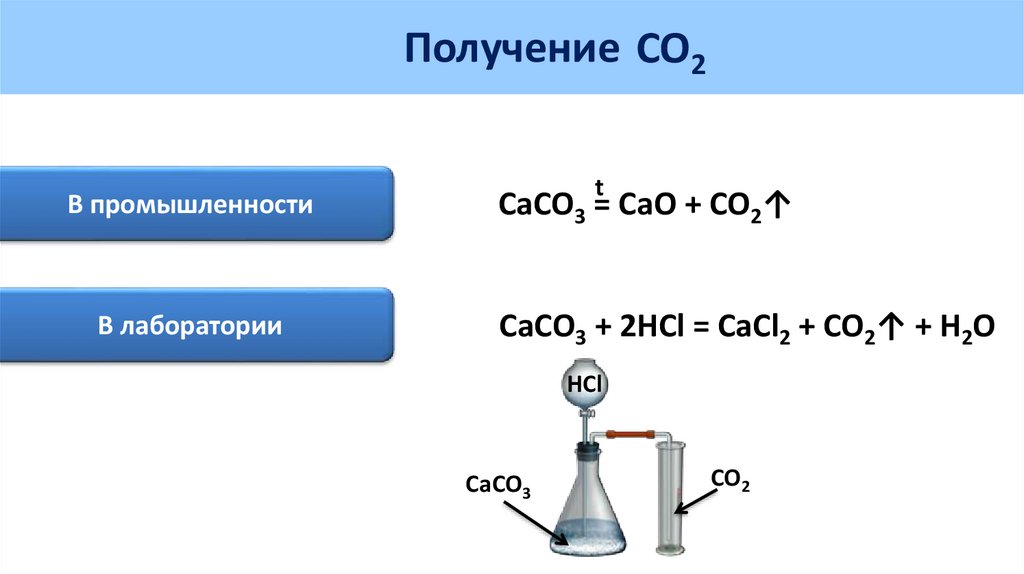 Объем одного моля сероводорода в условиях реакции составляет 30,26 л. Сколько газа и Лидеров образуется на 1.9г сернистого натрия и 1,67 г хлористого водорода. Что такое предельная реактивность? Итак, этот вопрос состоит из двух частей. Первая часть, на которую мы хотим ответить, это то, сколько газа и лидеров образуется, а вторая — что является лимитирующим реагентом? Хорошо. Итак, напомним, что предельный реагент полностью расходуется в реакции и он контролирует количество образующегося продукта, чтобы мы могли рассчитать предельный реагент. Мы собираемся начать с g того, что дано для обоих наших реагентов. Итак, давайте продолжим и начнем с нашего 1. г сульфида натрия. Итак, мы хотим перейти от граммов сульфида натрия к двум молям сероводорода. Итак, вот как мы собираемся вычислить, сколько молей сероводорода образуется при этом. 1,09г сульфида натрия. Хорошо, так что давайте идти вперед и начать там. Итак, мы хотим перейти от граммов сульфида натрия. Два моля сульфида натрия. Итак, нам нужна молярная масса сульфида натрия в одном моле сульфида натрия.
Объем одного моля сероводорода в условиях реакции составляет 30,26 л. Сколько газа и Лидеров образуется на 1.9г сернистого натрия и 1,67 г хлористого водорода. Что такое предельная реактивность? Итак, этот вопрос состоит из двух частей. Первая часть, на которую мы хотим ответить, это то, сколько газа и лидеров образуется, а вторая — что является лимитирующим реагентом? Хорошо. Итак, напомним, что предельный реагент полностью расходуется в реакции и он контролирует количество образующегося продукта, чтобы мы могли рассчитать предельный реагент. Мы собираемся начать с g того, что дано для обоих наших реагентов. Итак, давайте продолжим и начнем с нашего 1. г сульфида натрия. Итак, мы хотим перейти от граммов сульфида натрия к двум молям сероводорода. Итак, вот как мы собираемся вычислить, сколько молей сероводорода образуется при этом. 1,09г сульфида натрия. Хорошо, так что давайте идти вперед и начать там. Итак, мы хотим перейти от граммов сульфида натрия. Два моля сульфида натрия. Итак, нам нужна молярная масса сульфида натрия в одном моле сульфида натрия.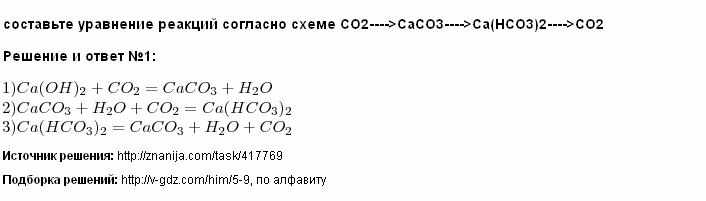
 Итак, у нас есть 1,67 г соляной кислоты. И наша цель перейти от граммов соляной кислоты, Два моля сероводорода. Итак, мы хотим знать, сколько молей сероводорода будет получено из этого. 1,67 г хлористого водорода. Хорошо, так что мы собираемся сделать то же самое. Мы хотим перейти от грамма хлористого водорода к двум молям хлористого водорода. Поэтому мы будем использовать молярную массу. Так в одном моле хлористого водорода Молярная масса равна 36. г хлористого водорода. Наши наши граммы хлороводорода аннулируют. И у нас остались моли хлороводорода. Итак, теперь мы хотим перейти от молей хлороводорода к двум молям сероводорода. Таким образом, мы должны посмотреть на кратное отношение здесь. Итак, мы C в нашем уравнении, что на каждый моль потребленного хлористого водорода приходится один моль произведенного сероводорода, кратное соотношение равно 1-1. Итак, давайте продолжим и запишем это. Итак, убедившись, что наши единицы здесь сокращаются, сокращаются моли хлористого водорода. И у нас остаются моли сероводорода.
Итак, у нас есть 1,67 г соляной кислоты. И наша цель перейти от граммов соляной кислоты, Два моля сероводорода. Итак, мы хотим знать, сколько молей сероводорода будет получено из этого. 1,67 г хлористого водорода. Хорошо, так что мы собираемся сделать то же самое. Мы хотим перейти от грамма хлористого водорода к двум молям хлористого водорода. Поэтому мы будем использовать молярную массу. Так в одном моле хлористого водорода Молярная масса равна 36. г хлористого водорода. Наши наши граммы хлороводорода аннулируют. И у нас остались моли хлороводорода. Итак, теперь мы хотим перейти от молей хлороводорода к двум молям сероводорода. Таким образом, мы должны посмотреть на кратное отношение здесь. Итак, мы C в нашем уравнении, что на каждый моль потребленного хлористого водорода приходится один моль произведенного сероводорода, кратное соотношение равно 1-1. Итак, давайте продолжим и запишем это. Итак, убедившись, что наши единицы здесь сокращаются, сокращаются моли хлористого водорода. И у нас остаются моли сероводорода.

