Составление уравнений МНП
Составление универсальных уравнений метода начальных параметров (МНП) с последующим расчетом угловых и линейных перемещений сечений балки выполняется в следующем порядке:
- Для заданной расчетной схемы балки определяются опорные реакции.
- Выбирается начало координат (НК) балки. За начало координат выбирается одно из крайних сечений балки, при этом желательно, чтобы оно располагалось на опоре. Эта рекомендация основана на том, что на опорах некоторые из перемещений отсутствуют, следовательно, один или оба начальных параметра будут равны нулю, что несколько облегчает решение задачи.
- В случае если действие распределенной нагрузки обрывается, не доходя до конца балки противоположного НК, ее действие продлевается до крайнего сечения и на этом участке добавляется компенсирующая нагрузка той же величины но противоположного направления. Это действие выполняется, потому что в уравнениях МНП переменная «c» учитывает только начало действия распределенной нагрузки.

- Составляются уравнения МНП для заданной балки, в которые последовательно по силовым участкам, начиная от начала координат, записываются внешние нагрузки (включая реакции опор). Правило знаков для нагрузок такое же, как и для изгибающих моментов Mx (нагрузки, стремящиеся сжать верхние слои балки записываются положительными). При этом сосредоточенные силы и моменты, приложенные к концу балки, в уравнения МНП не включаются.
- Из условий закрепления балки в опорах определяются начальные параметры.
- Для расчета угла наклона сечения или прогиба, в соответствующее уравнение МНП подставляется координата сечения z (расстояние от НК) и выбирается часть уравнения с нагрузками расположенными между НК и рассматриваемым сечением балки.
Другие видео
Направление перемещений
Положительные линейные перемещения (прогибы) указывают на то, что рассматриваемое сечение балки перемещается вверх.
Положительное угловое перемещение говорит о том что:
- если начало координат выбрано слева – сечение поворачивается против хода часовой стрелки;
- если НК выбрано справа – сечение поворачивается по ходу ЧС.

Для наглядности, по полученным данным может строится линия изогнутой оси балки.
Пример расчета балки методом начальных параметров >
Краткая теория по сопромату >
Примеры решения задач >
Сохранить или поделиться с друзьями
Вы находитесь тут:
На нашем сайте Вы можете получить решение задач и онлайн помощь
Подробнее
Здесь можно узнать стоимость или заказать решение задач и выполнение учебных работ
Стоимость мы сообщим в течение 5 минут
Если стоимость устроит вы сможете оформить заказ.
НАБОР СТУДЕНТА ДЛЯ УЧЁБЫ
На нашем сайте можно бесплатно скачать:
— Рамки A4 для учебных работ
— Миллиметровки разного цвета
— Шрифты чертежные ГОСТ
— Листы в клетку и в линейку
Сохранить или поделиться с друзьями
Помощь с решением
Поиск формул и решений задач
Решение задач и лекции по технической механике, теормеху и сопромату
Список уравнений реакций (Страница 1)
Список уравнений реакций (Страница 1) — Химические Уравнения Онлайн! Обратно к введению уравнения- Ca(OH)2 + Cl2 = Ca(ClO3)2 + CaCl2 + h3O
- Fe + CuSO4 = Cu + FeSO4
- Cu + HNO3 = Cu(NO3)2 + h3O + NO
- HCl + KMnO4 = Cl2 + MnCl2 + KCl + h3O
- FeSO4 + KMnO4 + h3SO4 = Fe2(SO4)3 + MnSO4 + K2SO4 + h3O
- Ag + HNO3 = AgNO3 + NO + h3O
- Na2B4O7 + HCl + h3O = h4BO3 + NaCl
- CuSO4*5h3O = CuSO4 + h3O
- Cr2O7:2- + H:+ + e:- = Cr:3+ + h3O
- Cr2O3 + KNO3 + KOH = K2CrO4 + KNO2 + h3O
- CuS + HNO3 = Cu(NO3)2 + h3SO4 + NO2 + h3O
- Cu(NO3)2 + K3[Fe(CN)6] = Cu3[Fe(CN)6]2 + KNO3
- KMnO4 + h3O2 + h3SO4 = O2 + MnSO4 + K2SO4 + h3O
- Cu + HNO3 = Cu(NO3)2 + h3O + NO2
- Zn + HCl = ZnCl2 + h3
- Cu2S + HNO3 = Cu(NO3)2 + h3SO4 + NO + h3O
- Zn + HNO3 = Zn(NO3)2 + Nh5NO3 + h3O
- KI + CuSO4 = CuI + I2 + K2SO4
- h3 + O2 = h3O
- Ag + h3SO4 = Ag2SO4 + h3O + SO2
- Fe + HNO3 = Fe(NO3)3 + NO + h3O
- Nh4 + O2 = NO + h3O
- h3SO4 + Cu = CuSO4 + SO2 + h3O
- h3O2 = h3O + O2
- HCl + MnO2 = MnCl2 + Cl2 + h3O
- Fe + HCl = FeCl2 + h3
- P4 + NaOH + h3O = Nah3PO2 + Ph4
- h3O = h3 + O2
- K2Cr2O7 + h3S + h3SO4 = K2SO4 + Cr2(SO4)3 + S + h3O
- C2h3 + O2 = CO2 + h3O
- Na2S2O3 + I2 = Na2S4O6 + NaI
- KMnO4 + (COOH)2 + h3SO4 = K2SO4 + MnSO4 + h3O + CO2
- CaCO3 + HCl = CaCl2 + h3O + CO2
- (Nh5)2Cr2O7 = N2 + h3O + Cr2O3
- h3 + Cl2 = HCl
- h3SO4 + HI = I2 + h3S + h3O
- h3 + N2 = Nh4
- FeSO4 + K2Cr2O7 + h3SO4 = Fe2(SO4)3 + Cr2(SO4)3 + h3O + K2SO4
- FeS2 + O2 = SO2 + Fe2O3
- Br2 + HClO + h3O = HBrO3 + HCl
- Cr2O3 + NaNO3 + NaOH = Na2CrO4 + NaNO2 + h3O
- Ash4 + HNO3 = h4AsO4 + NO2 + h3O
- NaOH + Cl2 = NaClO3 + NaCl + h3O
- I2 + Cl2 + h3O = HIO3 + HCl
- Mg + O2 = MgO
- h3S + SO2 = S + h3O
- Nh4 + Cl2 = Nh5Cl + N2
- KMnO4 = K2MnO4 + MnO2 + O2
- I2 + HNO3 = HIO3 + NO + h3O
- K2MnO4 + h3O = KMnO4 + MnO2 + KOH
Калькулятор молярной концентрации раствора — PhysiologyWeb
Калькулятор молярной концентрации раствора
Предназначенный для использования как в учебной, так и в исследовательской лаборатории, этот калькулятор (см. начиная с твердого материала. Например, известную молекулярную массу химического вещества можно использовать вместе с желаемым объемом раствора и концентрацией растворенного вещества для определения массы химического вещества, необходимого для приготовления такого раствора. С другой стороны, если желаемая концентрация известна, но доступно лишь небольшое количество (т. е. масса) химического вещества (например, при покупке очень небольшого количества, например, 10 мг), то общий объем раствора может рассчитать, в котором твердый материал должен быть растворен для достижения желаемой конечной концентрации.
начиная с твердого материала. Например, известную молекулярную массу химического вещества можно использовать вместе с желаемым объемом раствора и концентрацией растворенного вещества для определения массы химического вещества, необходимого для приготовления такого раствора. С другой стороны, если желаемая концентрация известна, но доступно лишь небольшое количество (т. е. масса) химического вещества (например, при покупке очень небольшого количества, например, 10 мг), то общий объем раствора может рассчитать, в котором твердый материал должен быть растворен для достижения желаемой конечной концентрации.
Если вы хотите выполнить расчеты разведения для растворов с молярностью или процентной концентрацией, используйте наш Калькулятор разбавления — молярность, проценты.
Если вы хотите выполнить расчет коэффициента разбавления или кратного разбавления для растворов с молярностью или процентной концентрацией, используйте наш Калькулятор коэффициента разбавления — Молярность, Проценты.
Уравнение молярной концентрации раствора
- C — молярная концентрация в моль/л (моль или M). Это также упоминается как молярность , что является наиболее распространенным методом выражения концентрации растворенного вещества в растворе. Молярность определяется как количество молей растворенного вещества, растворенного в литре раствора (моль/л = M). 1 М раствор — это раствор, в котором ровно 1 моль растворенного вещества растворяется в общем объеме раствора, равном ровно 1 л. Используя префиксы системы СИ, концентрация может также выражаться в различных долях молярной концентрации, таких как ммоль/л (мМ). , мкмоль/л (мкМ), нмоль/л (нМ), пмоль/л (пМ) и т. д.
- m — масса (т. е. вес) растворенного вещества в граммах (г), которое необходимо растворить в объеме V раствора, чтобы получить желаемую молярную концентрацию (
- V объем раствора в литрах (л), в котором необходимо растворить указанную массу ( m ) растворенного вещества, чтобы получить желаемую молярную концентрацию ( C ).
 Обратите внимание, что V — это конечный или общий объем раствора после добавления растворенного вещества в растворитель.
Обратите внимание, что V — это конечный или общий объем раствора после добавления растворенного вещества в растворитель. - MW – молекулярная масса в г/моль. Молекулярный вес также называют формульным весом, и на самом деле многие ученые предпочитают использовать последний. Молекулярная масса может быть получена из молекулярной формулы, таблиц данных или этикетки на бутылке, содержащей интересующее химическое вещество.
Калькулятор молярной концентрации раствора
Каждая показанная ниже ячейка калькулятора соответствует члену в приведенной выше формуле. Введите соответствующие значения во все ячейки, кроме той, которую вы хотите рассчитать. Таким образом, по крайней мере три ячейки должны содержать значения, и не более одной ячейки может быть пустой . Значение пустой ячейки будет рассчитано на основе других введенных значений. После выполнения вычисления вычисляемая ячейка будет выделена, а последующие вычисления будут вычислять значение выделенной ячейки (без необходимости иметь пустую ячейку). Однако пустая ячейка имеет приоритет над выделенной ячейкой.
Однако пустая ячейка имеет приоритет над выделенной ячейкой.
Для удобства этот рабочий лист позволяет вам выбирать различные единицы измерения массы, объема и концентрации, и для вас выполняются необходимые преобразования, чтобы получить значение пустой ячейки в нужной единице. Обратите внимание, что единицей молекулярной массы должен быть г/моль.
Комментарии и/или инструкции по приготовлению
Опубликовано: четверг, 1 марта 2001 г.
Последнее обновление: суббота, 23 декабря 2017 г.
Главы курса Основы калькулятора Обзор математики Основные понятия
Анализы разделов Предварительное испытание Пост-тест Онлайн-калькуляторы Калькулятор окислительно-восстановительного потенциала Кинетика Аррениуса Калькулятор Калькулятор термодинамики Калькулятор ядерного распада Линейная регрессия методом наименьших квадратов Решатель уравнений методом Ньютона Калькулятор сжимаемости Калькулятор перевода единиц Калькулятор номенклатуры Ссылки на дополнительную информацию Калькуляторы Texas Instruments Калькуляторы Casio Калькуляторы Sharp Калькуляторы Hewlett Packard Связаться с веб-мастером | Стехиометрия — это бухгалтерский учет или математика, стоящая за химией. Имея достаточно информации, можно использовать стехиометрию для расчета масс, молей и процентов в химическом уравнении. Имея достаточно информации, можно использовать стехиометрию для расчета масс, молей и процентов в химическом уравнении. Что такое химическое уравнение Крот Балансировка химических уравнений Ограничивающие реагенты Процентный состав Эмпирические и молекулярные формулы Плотность Концентрация растворов В химии мы используем символы для обозначения различных химических веществ. Успех в химии зависит от прочного знакомства с этими основными символами. Например, символ «С». представляет собой атом углерода, а «Н» представляет собой атом водорода. Чтобы представить молекулу поваренной соли, хлорида натрия, мы будем использовать обозначение «NaCl», где «Na» представляет собой натрий, а «Cl» представляет собой хлор. В этом случае мы называем хлор «хлоридом» из-за его связи с натрием. У вас будет возможность ознакомиться со схемами именования или номенклатура , в более позднем прочтении. Химическое уравнение – это выражение химического процесса. В этом уравнении AgNO 3 смешивается с NaCl. Уравнение показывает, что реагенты (AgNO 3 и NaCl) реагируют посредством некоторого процесса (—>) с образованием продуктов (AgCl и NaNO 3 ). Поскольку они подвергаются химическому процессу, они коренным образом изменяются. Часто записывают химические уравнения, показывающие состояние, в котором находится каждое вещество. Знак (s) означает, что соединение является твердым. Знак (l) означает, что вещество является жидкостью. Знак (aq) обозначает водный раствор в воде и означает, что соединение растворено в воде. Наконец, знак (g) означает, что соединение представляет собой газ. Коэффициенты используются во всех химических уравнениях, чтобы показать относительное количество каждого присутствующего вещества. Это количество может представлять либо относительное число молекул, либо относительное количество молей (описано ниже). В некоторых случаях над или под стрелками будет написана различная информация. Эта информация, такая как значение температуры, показывает, какие условия должны присутствовать для протекания реакции. Например, на графике ниже обозначения над и под стрелками показывают, что для протекания этой реакции нам нужен химикат Fe 2 O 3 , температура 1000 градусов C и давление 500 атмосфер. График ниже иллюстрирует большинство концепций, описанных выше:  Таким образом, у вас есть такое же количество молей Ag
№ 3 , NaCl, AgCl, NaNO 3 . Таким образом, у вас есть такое же количество молей Ag
№ 3 , NaCl, AgCl, NaNO 3 .Преобразование между молями и граммами вещества часто важно. Это преобразование можно легко осуществить, когда атомарные и/или молекулярные массы вещества (веществ) известны. Атомный или молекулярный масса вещества в граммах составляет один моль вещества. Например, кальций имеет атомный вес 40 грамм. Итак, 40 грамм кальция составляет один моль, 80 граммов — два моля и т. д. Однако иногда нам нужно проделать некоторую работу, прежде чем использовать коэффициенты членов для представления относительного количества молекул каждого соединения. Это тот случай, когда уравнения не пр оперативно сбалансирован. Мы рассмотрим следующее уравнение: Поскольку перед любым из членов нет коэффициентов, легко предположить, что один (1) моль Al и один (1) моль Fe 3 0 4 реагируют с образованием одного (1) моля Al 2 0 3 . Уравновешивание химического уравнения в основном делается методом проб и ошибок. Для этого существует множество различных способов и систем, но для всех методов важно знать, как подсчитать количество атомов в уравнении. Например, мы рассмотрим следующий срок. Этот термин выражает две (2) молекулы Fe 3 O 4 . В каждой молекуле этого вещества есть три (3) атома Fe. Теперь давайте попробуем сбалансировать уравнение, упомянутое ранее: Разработка стратегии может быть трудной, но вот один из способов решения такой проблемы.
Пример: у химика есть только 6,0 грамм C 2 H 2 и неограниченный запас кислорода и желание производить как можно больше CO 2 . Если она использует приведенное ниже уравнение, сколько кислорода она должна добавить в реакцию? Для решения этой задачи необходимо определить, сколько кислорода должно
добавлять, если все реагенты были израсходованы (это способ получения максимального количества CO 2 ). Затем, поскольку на каждые две (2) молекулы C 2 H 2 приходится пять (5) молекул кислорода, нам нужно умножить количество молей C 2 H 2 на 5/2, чтобы получить общее количество молей кислорода, которое будет использовано для реакции со всеми C 2 H 2 . Затем мы переводим моли кислорода в граммы, чтобы найти количество кислорода, которое необходимо добавить:  В задачах процентного состава существует множество возможных решений. Всегда можно удвоить ответ. Например, CH и C 2 H 2 имеют одинаковые пропорции, но представляют собой разные соединения. Стандартно давать соединения в их простейшей форме, где соотношение между элементами равно
уменьшена настолько, насколько это возможно, — так называемая эмпирическая формула. При расчете эмпирической формулы из процентного состава можно перевести проценты в граммы. Например, это обычно проще всего предположить, что у вас есть 100 граммов, поэтому 54,3% станут 54,3 граммами. Затем мы можем преобразовать массы в моли, что даст нам молярные отношения.
Необходимо привести к целым числам. Пример: если соединение состоит из 47,3 % C (углерода), 10,6 % H (водорода) и 42,0 % S (серы), какова его эмпирическая формула? Теперь мы пытаемся получить равномерное соотношение между элементами, поэтому мы делим на количество молей серы, потому что это наименьшее число: Итак имеем: C 3 H 8 S Пример: Рассчитайте процентное содержание гидросульфата по массе, H 2 SO 4 . Теперь мы можем проверить, что сумма процентов составляет 100% Таким образом, ответ состоит в том, что H 2 SO 4 состоит из 2,06 % H, 32,7 % S и 65,2 % O по массе. Хотя эмпирическая формула является простейшей формой соединения, молекулярная формула — это форма термина, которая могла бы появиться в химическом уравнение. Эмпирическая формула и молекулярная формула могут быть то же самое, или молекулярная формула может быть любой кратной эмпирической формула. Примеры эмпирических формул: AgBr, Na 2 S, C 6 H 10 O 5 . Примеры молекулярных формул: P 2 , C 2 O 4 , C 6 H 14 S 2 , ч 2 , C 3 3 , ч 2 , C 3 3 3 H .  Можно рассчитать эмпирическую формулу по массе или процентному составу любого соединения. Мы уже обсуждали процентный состав в разделе выше. Если у нас есть только масса, все, что мы делаем, — это, по сути, исключаем этап преобразования от процентов к массе. Пример. Рассчитайте эмпирическую формулу соединения, содержащего 43,7 г фосфора и 56,3 г кислорода. Сначала мы конвертируем в моли: Затем мы делим родинки, чтобы попытаться получить равное соотношение. Когда мы делим, мы не получаем целых чисел, поэтому мы должны умножить на два (2). Ответ=P 2 O 5 Рассчитать молекулярную формулу, когда у нас есть эмпирическая формула, несложно.
Если мы знаем эмпирическую формулу соединения, все, что нам нужно сделать, это разделить
молекулярная масса соединения по массе эмпирической формулы.
Также можно сделать это с одним из элементов в формуле;
просто разделите массу этого элемента в одном моле соединения на массу
этого элемента в эмпирической формуле. Пример: если мы знаем, что эмпирическая формула соединения — HCN, и нам говорят, что для получения соединения необходимо 2,016 грамма водорода, какова его молекулярная формула? В эмпирической формуле водород весит 1,008 грамма. Разделив 2,016 на 1.008 мы видим, что количество необходимого водорода в два раза больше. Поэтому эмпирическую формулу необходимо увеличить в два раза (2). Ответ: Концентрация раствора — это «сила» раствора. Под раствором обычно понимается растворение некоторого твердого вещества в жидкости, например растворение соли в воде. Также часто необходимо выяснить, сколько воды нужно добавить в раствор, чтобы изменить его концентрацию до определенной. Концентрация раствора обычно указывается в молярности.
Молярность определяется как количество молей растворенного вещества (что
фактически растворенных в растворе) разделить на литры раствора (суммарный объем того, что растворено и в чем растворено). Пример: если 5,00 г NaOH растворить в 5000 мл воды, какова молярность раствора? Таким образом, молярность (М) раствора составляет 0,025 моль/л. Моляльность — еще одно распространенное измерение концентрации. Моляльность определяется как количество молей растворенного вещества, деленное на килограммы растворителя. (вещество, в котором он растворен, как вода). Пример: Если моляльность раствора C 2 H 5 OH, растворенного в воде, равна 1,5, а вес воды равен 11,7 кг, определите, сколько C 2 H 5 OH должен быть добавлен в раствор в граммах? Пример: Если молярность раствора равна 0,30 М, рассчитайте моляльность
раствора, зная, что плотность составляет 3,25 г/мл. 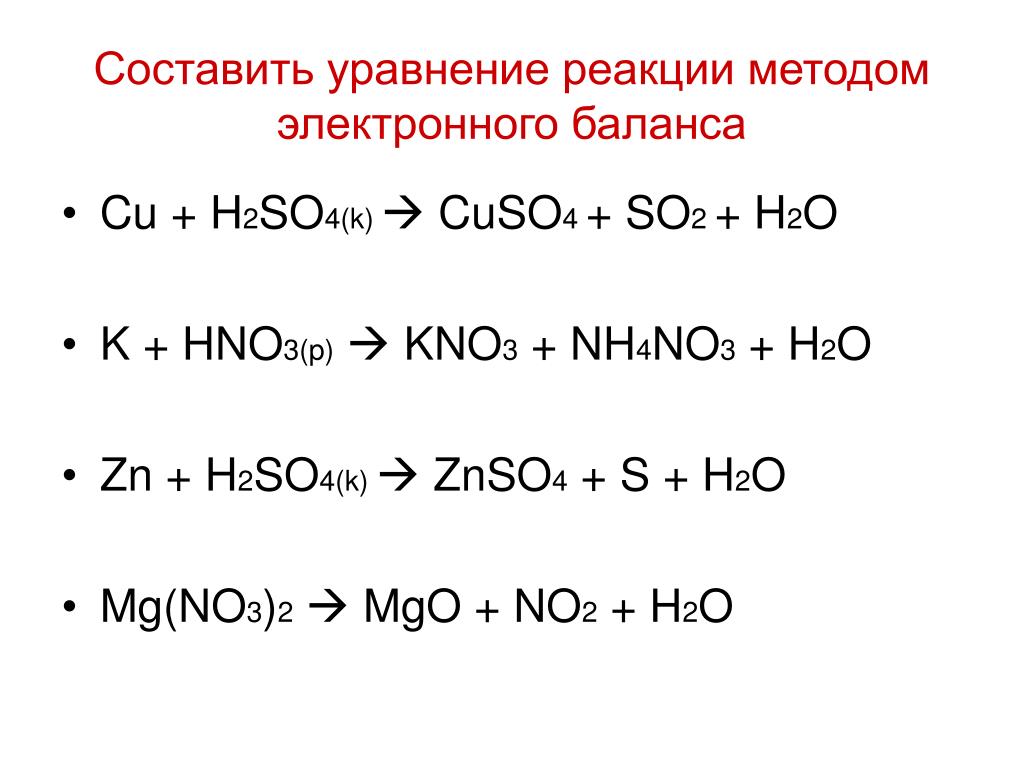 0078 Изменение T= K * m 0078 Изменение T= K * m Где:
T – депрессия температуры (для точки замерзания) или температурное расширение (для точки кипения) (°C) Пример: если точка замерзания соленой воды, налитой на дороги, составляет -5,2°С, какова моляльность раствора? (K f для воды составляет 1,86 C/м.) Т=К * м Практические задачи2. Если 2,0 моля сахарозы весом 684 грамма поместить в 1000 граммов воды и затем растворить, какова будет моляльность раствора?  |



 Обратите внимание, что V — это конечный или общий объем раствора после добавления растворенного вещества в растворитель.
Обратите внимание, что V — это конечный или общий объем раствора после добавления растворенного вещества в растворитель. Например:
Например: Если коэффициент не указан, предполагается единица (1).
Если коэффициент не указан, предполагается единица (1). Если бы это было так, реакция была бы весьма зрелищной: атом алюминия появился бы из ниоткуда, а два (2) атома железа и один (1) атом кислорода волшебным образом исчезли бы. Мы знаем из Закон сохранения массы (в котором говорится, что материя не может быть ни создана, ни уничтожена)
что этого просто не может быть. Мы должны убедиться, что число атомов каждого конкретного элемента в реагентах равно числу атомов того же элемента в продуктах. К
для этого мы должны выяснить относительное количество молекул каждого термина, выраженное коэффициентом термина.
Если бы это было так, реакция была бы весьма зрелищной: атом алюминия появился бы из ниоткуда, а два (2) атома железа и один (1) атом кислорода волшебным образом исчезли бы. Мы знаем из Закон сохранения массы (в котором говорится, что материя не может быть ни создана, ни уничтожена)
что этого просто не может быть. Мы должны убедиться, что число атомов каждого конкретного элемента в реагентах равно числу атомов того же элемента в продуктах. К
для этого мы должны выяснить относительное количество молекул каждого термина, выраженное коэффициентом термина. Следовательно, в двух (2) молекулах вещества должно быть шесть (6) атомов Fe. Точно так же в одной (1) молекуле вещества содержится четыре (4) атома кислорода, поэтому в двух (2) молекулах должно быть восемь (8) атомов кислорода.
Следовательно, в двух (2) молекулах вещества должно быть шесть (6) атомов Fe. Точно так же в одной (1) молекуле вещества содержится четыре (4) атома кислорода, поэтому в двух (2) молекулах должно быть восемь (8) атомов кислорода. Изменяйте коэффициент только при балансировке уравнения. Кроме того, обязательно обратите внимание, что индекс, умноженный на коэффициент, даст количество атомов этого элемента. Что касается реагента, у нас есть коэффициент три (3), умноженный на индекс четыре (4), что дает 12 атомов кислорода. Со стороны продукта у нас есть коэффициент четыре (4), умноженный на нижний индекс три (3), что дает 12 атомов кислорода. Теперь кислород сбалансирован.
Изменяйте коэффициент только при балансировке уравнения. Кроме того, обязательно обратите внимание, что индекс, умноженный на коэффициент, даст количество атомов этого элемента. Что касается реагента, у нас есть коэффициент три (3), умноженный на индекс четыре (4), что дает 12 атомов кислорода. Со стороны продукта у нас есть коэффициент четыре (4), умноженный на нижний индекс три (3), что дает 12 атомов кислорода. Теперь кислород сбалансирован.
 Чтобы иметь возможность вычислить количество молей, нам нужно посмотреть в периодическую таблицу и увидеть, что 1 моль C весит 12,0 грамм, а H весит 1,0 грамм. Следовательно, мы знаем, что 1 моль C 2 H 2 весит 26 грамм (2*12 грамм + 2*1 грамм). Поскольку у нас есть только 6,0 грамм C 2 H 2 , мы должны выяснить, какой доле моля соответствует 6,0 грамм. Для этого воспользуемся следующим уравнением.
Чтобы иметь возможность вычислить количество молей, нам нужно посмотреть в периодическую таблицу и увидеть, что 1 моль C весит 12,0 грамм, а H весит 1,0 грамм. Следовательно, мы знаем, что 1 моль C 2 H 2 весит 26 грамм (2*12 грамм + 2*1 грамм). Поскольку у нас есть только 6,0 грамм C 2 H 2 , мы должны выяснить, какой доле моля соответствует 6,0 грамм. Для этого воспользуемся следующим уравнением. Хороший метод — разделить все члены на наименьшее число молей. Затем соотношение молей можно перевести в эмпирическую формулу.
Хороший метод — разделить все члены на наименьшее число молей. Затем соотношение молей можно перевести в эмпирическую формулу.
 Результат всегда должен быть
целое число.
Результат всегда должен быть
целое число.
 Затем мы пытаемся решить то, чего мы не знаем: моли растворенного вещества. Как только мы узнаем количество молей растворенного вещества, мы можем посмотреть в периодическую таблицу и вычислить преобразование молей в граммы.
Затем мы пытаемся решить то, чего мы не знаем: моли растворенного вещества. Как только мы узнаем количество молей растворенного вещества, мы можем посмотреть в периодическую таблицу и вычислить преобразование молей в граммы.