Расчет опорных реакций балки на двух опорах онлайн
Расчет выполняется по следующей методике:
1. Заменяем распределенную нагрузку ее равнодействующей, которая является сосредоточенной силой. Для равномерно распределенной нагрузки равнодействующая равна произведению интенсивности нагрузки q на длину участка L, на котором она действует: Fq = q*L.
2. Обозначаем опоры. Общепринято их обозначать буквами А и В. Простая балка имеет одну шарнирно-неподвижную и одну шарнирно-подвижную опоры.
3. Освобождаемся от опор и заменяем их действие на балку реакциями.
Реакции опор при такой нагрузке будут только вертикальными.
4. Составляем уравнения равновесия вида:
MA = 0; MB = 0,
Моментом силы относительно точки называется произведение этой силы на плечо — кратчайшее расстояние от этой точки приложения силы (в общем случае — до линии действия силы).
5. Выполним проверку решения. Для этого составим уравнение равновесия:
Y = 0,
Если оно удовлетворено, то реакции найдены правильно, а если нет, но в решении допущена ошибка.
6. Строим эпюру поперечных сил Qx. Для этого определяем значения поперечных сил в характерных точках. Напомним, что поперечная сила в сечении равна сумме проекций всех сил, расположенных только слева или только справа от рассматриваемого сечения, на ось, перпендикулярную оси элемента. Силу, расположенную слева от рассматриваемого сечения и направленную вверх, считают положительной (со знаком «плюс»), а направленную вниз — отрицательной (со знаком «минус»). Для правой части балки — наоборот.
В сечениях, соответствующих точкам приложения сосредоточенных сил, в том числе в точках приложения опорных реакций, необходимо определить два значения поперечной силы: чуть левее рассматриваемой точки и чуть правее ее. Поперечные силы в этих сечениях обозначаются соответственно Qлев и Qправ.
Найденные значения поперечных сил в характерных точках откладываются в некотором масштабе от нулевой линии. Эти значения соединяются прямыми линиями по следующим правилам:
б) если на участке балки приложена распределенная нагрузка, то под этим участком значения поперечных сил соединяются прямой, наклонной к нулевой линии.
 Она может пересекать или не пересекать нулевую линию.
Она может пересекать или не пересекать нулевую линию.Соединив все значения поперечных сил по указанным правилам, получим график изменения поперечных сил по длине балки. Такой график называется эпюрой Qx.
7. Строим эпюру изгибающих моментов Мx. Для этого определяем изгибающие моменты в характерных сечениях. Напомним, что изгибающий момент в рассматриваемом сечении равен сумме моментов всех сил (распределенных, сосредоточенных, в том числе и опорных реакций, а также внешних сосредоточенных моментов), расположенных только слева или только справа от этого сечения. Если любое из перечисленных силовых воздействий стремится повернуть левую часть балки по часовой стрелке, то оно считается положительным (со знаком «плюс»), если против — отрицательным (со знаком «минус»), а для правой части наоборот.
 Изгибающие моменты в этих точках обозначаются соответственно Млев и Мправ. В точках приложения сил определяется одно значение изгибающего момента.
Изгибающие моменты в этих точках обозначаются соответственно Млев и Мправ. В точках приложения сил определяется одно значение изгибающего момента.Полученные значения откладываются в некотором масштабе от нулевой линии. Эти значения соединяются в соответствии со следующими правилами:
а) если на участке балки нет распределенной нагрузки, то под этим участком балки два соседних значения изгибающих моментов соединяются прямой линией;
б) если к участку балки приложена распределенная нагрузка, то под этим участком значения изгибающих моментов для двух соседних точек соединяются по параболе.
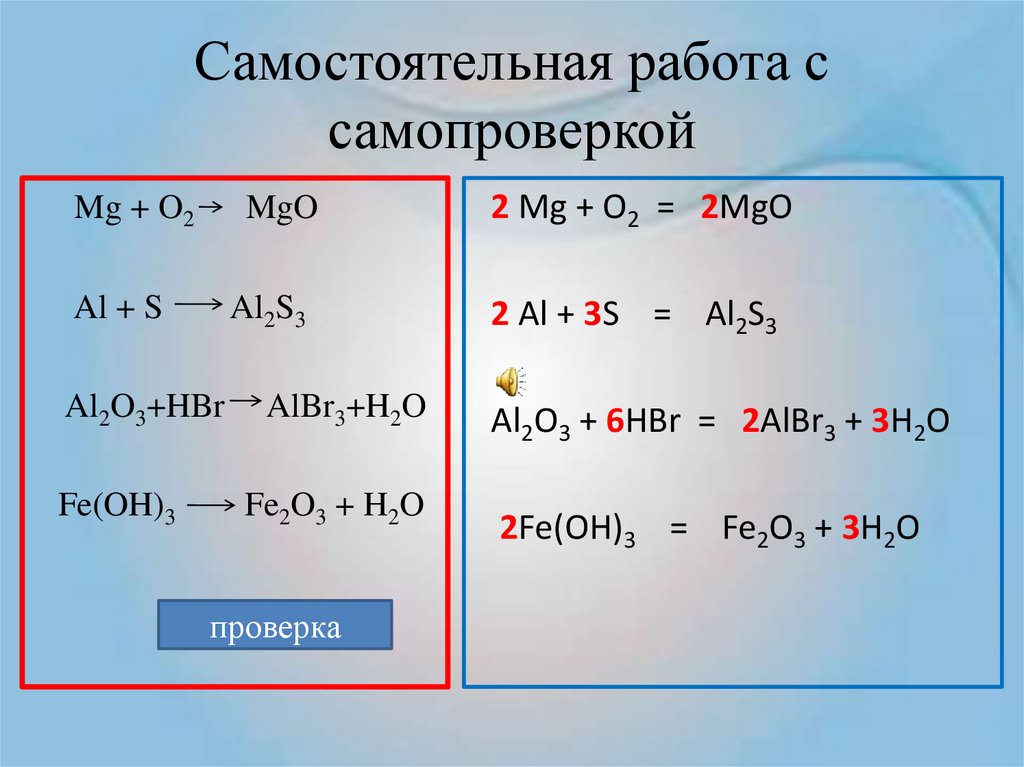
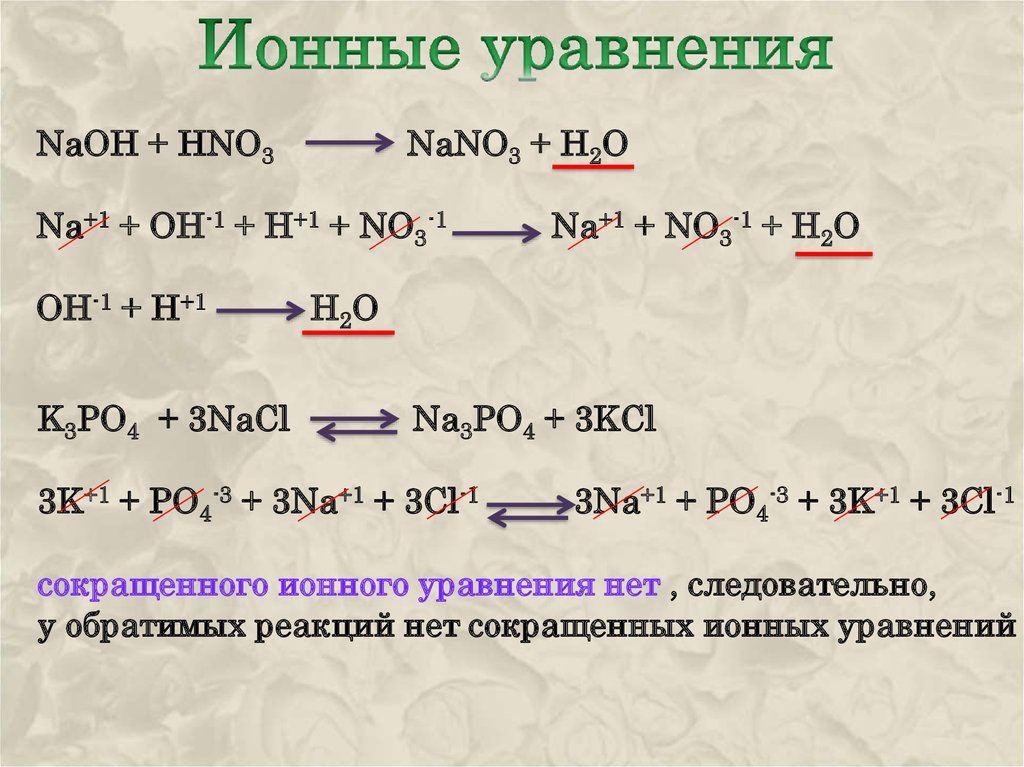
Пример решения балки:
Химическая кинетика Калькулятор | Химическая кинетика Расчет
Химическая кинетика
Сложные реакции
Последовательные реакции
Обратимые реакции
- Константа скорости обратной реакции первого порядка, противостоящая реакции первого порядка
- Равновесная концентрация реагента первого порядка, которой противостоит реакция первого порядка в данный момент времени t
- Скорость прямой реакции Const 1-го порядка, противостоящая 1-му порядку Rxn при заданной начальной концентрации реагента
- Константа скорости прямой реакции для первого порядка, противостоящая реакции второго порядка
- Константа скорости прямой реакции первого порядка, противостоящая реакции первого порядка
- Вперед Rxn.
 Постоянная скорость для 1-го порядка Опп. по 1-му заказу Rxn. когда начальная конц. B больше 0
Постоянная скорость для 1-го порядка Опп. по 1-му заказу Rxn. когда начальная конц. B больше 0 - Вперед Rxn. Постоянная скорость для 2-го порядка, которому противостоит 1-й порядок Rxn. дал Ини. Конц. реагента А
- Вперед Rxn. Постоянная скорость для 2-го порядка, которому противостоит 1-й порядок Rxn. дал Ини. Конц. реагента B
- Вперед Rxn. Постоянная скорость для 2-го порядка, которому противостоит 2-й порядок Rxn. дал Ини. Конц. реагента А
- Ини. Конц. из A для 1-го порядка, которому противостоит 1-й порядок Rxn. когда Ини. Конц. из B больше 0
- Исходная конц. реагента для 1-го порядка, противостоящего 1-му порядку Rxn. данный конц. продукта
- Начальная концентрация реагента для первого порядка, противостоящая реакции первого порядка
- Конц. продукта для 1-го порядка, противостоящего 1-му порядку Rxn. учитывая начальную конц. из B больше 0
- Конц. продукта 1-го порядка, противостоящего 1-му порядку Rxn. учитывая начальную конц. Реагента
- Конц.
 продукта реакции первого порядка, противостоящей реакции первого порядка при исходной концентрации. Реагента
продукта реакции первого порядка, противостоящей реакции первого порядка при исходной концентрации. Реагента - Концентрация продукта первого порядка, которой противостоит реакция первого порядка в данный момент времени t
- Концентрация реагента для реакции первого порядка, которой противостоит реакция первого порядка, в данный момент времени t
- Время, необходимое для 1-го приказа, противостоящего 1-му приказу Rxn. заданная концентрация продукта
- Время, необходимое для 1-го приказа, противостоящего 1-му приказу Rxn. когда начальная конц. Реагента B больше 0
- Время, необходимое для реакции 2-го порядка, противостоящей реакции 2-го порядка при исходной концентрации. реагента А
- Время, необходимое для реакции 2-го порядка, противостоящей реакции 2-го порядка при исходной концентрации. реагента B
- Время, затрачиваемое на противодействие первого порядка реакцией первого порядка
- Время, необходимое для реакции первого порядка, противодействующей реакции первого порядка, при заданной начальной концентрации реагента
- Время, затрачиваемое на реакцию первого порядка, противостоящую реакции второго порядка
- Время, затрачиваемое на реакцию второго порядка, противостоящую реакции первого порядка при исходной концентрации.
 реагента А
реагента А - Время, затрачиваемое на реакцию второго порядка, противостоящую реакции первого порядка при исходной концентрации. реагента B
Кинетика ферментов
- Начальная скорость системы с заданной константой скорости и концентрацией комплекса фермента-субстрата
- Начальная скорость реакции при низкой концентрации субстрата
- Начальная скорость реакции при низкой концентрации субстрата в терминах максимальной скорости
- Начальная скорость реакции при заданной константе каталитической скорости и константе скорости диссоциации
- Начальная скорость реакции при заданной константе каталитической скорости и начальной концентрации фермента
- Начальная скорость реакции при заданной константе скорости диссоциации
- Начальная скорость реакции в уравнении кинетики Михаэлиса Ментена
- Максимальная скорость, заданная константой скорости диссоциации
- Максимальная скорость при заданной константе скорости и начальной концентрации фермента
- Максимальная скорость системы при низкой концентрации субстрата
- Модифицирующий фактор ферментно-субстратного комплекса
- Общее изменение концентрации реакции
- Общее время, затраченное на реакцию
Уравнение кинетики Михаэлиса Ментена
- Каталитическая константа скорости из уравнения кинетики Михаэлиса Ментена
- Константа каталитической скорости при заданной константе Михаэлиса
- Каталитическая константа скорости, если концентрация субстрата выше, чем константа Михаэлиса
- Константа скорости диссоциации из уравнения кинетики Михаэлиса Ментена
- Концентрация фермента по уравнению кинетики Михаэлиса Ментена
- Константа форвардного курса при заданной константе Михаэлиса
- Указанная концентрация ингибитора Постоянная Михаэлиса Ментен
- Константа диссоциации ингибитора, заданная константой Михаэлиса Ментена
- Начальная концентрация фермента, если концентрация субстрата выше константы Михаэлиса
- Начальная ставка при заданном кажущемся значении константы Михаэлиса-Ментен
- Начальная скорость реакции фермента с учетом модифицирующего фактора в уравнении Михаэлиса Ментена
- Максимальная скорость при заданном кажущемся значении константы Михаэлиса-Ментен
- Максимальная ставка с учетом модифицирующего фактора в уравнении Михаэлиса Ментена
- Максимальная скорость, если концентрация субстрата выше константы Михаэлиса
- Максимальная скорость системы из уравнения кинетики Михаэлиса Ментена
- Константа Михаэлиса при низкой концентрации субстрата
- Константа Михаэлиса из уравнения кинетики Михаэлиса Ментена
- Константа Михаэлиса при заданной константе каталитической скорости и начальной концентрации фермента
- Константа Михаэлиса, заданная прямой, обратной и каталитической константами скорости
- Постоянная Михаэлиса при заданной максимальной скорости при низкой концентрации субстрата
- Константа Михаэлиса с учетом модифицирующего фактора в уравнении Михаэлиса Ментена
- Константа Михаэлиса Ментена с учетом кажущейся константы Михаэлиса Ментена
- Модифицирующий фактор фермента в уравнении Михаэлиса Ментена
- Модифицирующий фактор фермент-субстратного комплекса в уравнении Михаэлиса-Ментен
- Концентрация субстрата по кинетическому уравнению Михаэлиса Ментена
Share
Copied!Калькулятор постоянной скорости
Создано Луцией Заборовской, доктором медицинских наук, кандидатом наук
Отзыв от Bogna Szyk и Jack Bowater
Последнее обновление: 17 января 2023 г.
- Как использовать калькулятор постоянной скорости?
- Как рассчитать константу скорости?
- Теория калькулятора закона скорости
- Часто задаваемые вопросы
Наш калькулятор констант скорости вычисляет скорость и период полураспада реакции . Это также позволяет вам узнать константу скорости и концентрацию данного вещества, если ваш запрос основан на скорость законы , т.е.
Помните, что наши калькуляторы работают в обе стороны . Что бы вы ни пытались рассчитать, мы здесь, чтобы помочь. 🙋
В статье ниже мы сосредоточимся на поиске константы скорости и теоретических основах калькулятора порядка реакции.
Как пользоваться калькулятором постоянной скорости?
Вначале подумайте о том, что вы пытаетесь найти — найдите все полезные данные, представленные в вашем запросе.
Выберите сколько молекул взаимодействует на элементарном шаге.

Выберите порядок реакции для каждой молекулы :
Зеро — скорость реакции не зависит от концентрации реагента, например, 2NH₃(г) → N₂(г) + 3H₂(г) , фотохимические реакции. Обратите внимание, что вы не можете установить ноль для любого из реагентов на бимолекулярной или тримолекулярной стадии. В этих случаях считайте реагент нулевого порядка несуществующим.
Первый — скорость реакции зависит от концентрации одного реагента , например, C₂H₆(г) → 2CH3(г) , реакции радиоактивного распада.
Вторая — Может быть описана как реакция, где скорость зависит от двух молекул . Это может быть либо два разных реагента , либо молекула, реагирующая сама с собой, например, H₂(г) + I₂(г) → 2HI(г) или 2NO₂(г) → 2NO(г) + O₂(г) .

🙋 Знакомы ли вы с константой равновесия приведенных выше реакций? Если нет, попробуйте наш калькулятор константы равновесия!
Введите концентрацию вещества.
Выберите нужный результат:
- Вы пытаетесь рассчитать значение константы скорости k? Если да, оставьте этот раздел калькулятора пустым .
- Играйте с калькулятором сколько хотите, чтобы узнать, как различные значения влияют на конечный результат .
Что такое период полураспада (T½)?
Период полураспада – это период, в течение которого половина субстрата подвергается химическому превращению. Давайте изобразим это на быстром примере. Наша начальная концентрация [S] составляет 20 М, а Т½ = 2 мин.
Введите концентрацию вещества.
Выберите нужный результат:
- Вы пытаетесь рассчитать значение константы скорости k? Если да, оставьте этот раздел калькулятора пустым .

- Играйте с калькулятором сколько хотите, чтобы узнать, как различные значения влияют на конечный результат .
- Вы пытаетесь рассчитать значение константы скорости k? Если да, оставьте этот раздел калькулятора пустым .
Что такое период полураспада (T½)?
Период полураспада – это период, в течение которого половина субстрата подвергается химическому превращению. Давайте изобразим это на быстром примере. Наша начальная концентрация [S] составляет 20 М, а Т½ = 2 мин.
[S] | 20 | 10 | 5 | 2.5 | 1.25 | … |
|---|---|---|---|---|---|---|
Time (min) | 0 | 2 | 4 | 6 | 8 | … |
Какова скорость реакции?
Скорость реакции характеризует скорость реакции, выраженную в М/сек , М/мин , или моль/(сек·л) , то есть сколько молей реагирует на литр вещества в секунду. (Молярная концентрация [M] = моль/л.)
(Молярная концентрация [M] = моль/л.)
Какова константа скорости реакции?
Константа скорости – это просто коэффициент пропорциональности, характерный для данной температуры и типа реакции. Он описывается многими различными уравнениями и обычно находится экспериментально (см. раздел ниже).
📚 Готовишься к экзамену? Попробуйте наши полезные инструменты для других типов реакций:
- Калькулятор нейтрализации 🧯
- Реакции, катализируемые ферментами: калькулятор уравнения Михаэлиса-Ментен 🔐
- Калькулятор процентного выхода — для всех типов реакций!
Как рассчитать константу скорости?
Самый очевидный ответ на вопрос «Как найти константу скорости?» состоит в том, чтобы изменить уравнения скорости реакции или ее периода полураспада . Если вы знаете порядок реакции, концентрацию вещества или скорость/период полураспада реакции, этот метод может подойти вам.
 (Это также самый простой метод для реакций нулевого порядка, поскольку скорость реакции равна константе скорости! )
(Это также самый простой метод для реакций нулевого порядка, поскольку скорость реакции равна константе скорости! )Зависимость константы скорости от температуры хорошо определяется уравнением Аррениуса :
k = A × exp (-E / (R × T)) .
Если вам интересно, как определить константу скорости обратимых реакций, вот простое уравнение, которое подходит для большинства случаев: K = k₁ / k₋₁ , где K = константа равновесия реакции, k₁ и k₋₁ = константы скорости прямой и обратной реакций соответственно.
Теория расчета закона скорости
Ниже вы найдете все необходимые уравнения для расчета скорости реакции нулевого, первого и второго порядка. Посмотрите на формулы ниже и сравните их с наклонами на графиках ниже. Имейте в виду, что все эти формулы могут служить уравнениями констант скорости.
Будьте осторожны с наклоном реакции первого порядка: он может выглядеть похожим на нулевой, но на самом деле он содержит натуральный логарифм от [A] по оси Y !
- Нулевой порядок
- Период полураспада = A / (2 × k)
- Скорость реакции = k
- Первый заказ
- Период полураспада = 0,693/к
- Скорость реакции = k × A
- Второй заказ
- Период полураспада = 1 / (k × A)
- Одно вещество: Скорость реакции = k × A × A
- Два вещества: Скорость реакции = k × A × B
Часто задаваемые вопросы
Как найти константу скорости?
Чтобы найти константу скорости:
Определить сколько атомов участвует в элементарной стадии реакции.

Найдите порядок реакции для каждого атома, участвующего в реакции.
Увеличьте начальную концентрацию каждого реагента до его порядка реакции, затем умножьте их всех вместе.
Разделить скорость на результат предыдущего шага.
Единицы вашей константы скорости будут зависеть от общего порядка реакции.
Какие факторы влияют на константу скорости?
Только температура влияет на константу скорости. Вы можете подумать, что изменение начальной концентрации повлияет на константу скорости, но это изменит только скорость. Вы можете ввести катализатор , чтобы обеспечить другой путь реакции с более низкой энергией активации, но на самом деле это будет другая реакция.
Как найти энергию активации из константы скорости?
Чтобы найти энергию активации из константы скорости:
Найдите константу Аррениуса для реакции.

Вычтите натуральный логарифм константы скорости из натурального логарифма константы Аррениуса.
Умножьте результат предыдущего шага на температуру реакции в Кельвинах и постоянную идеального газа.
Результатом является ваша энергия активации в тех же единицах энергии, что и постоянная идеального газа.
Какая ситуация показывает постоянную скорость изменения?
Реакции первого порядка демонстрируют постоянную скорость изменения, пока температура остается неизменной. Это связано с тем, что скорость реакции изменяется пропорционально оставшимся реагентам. Это лучше всего видно, если вы построите график скорости изменения и продифференцируете его по времени; он должен показывать прямую линию.
Люция Заборовска, доктор медицинских наук, кандидат наук
Элементарный шаг
Молекула A
Порядок реакции
Концентрация [A]
Половина срока службы (T½)
Результаты
Общий порядок реакции
1
Константа реакции (K)
M⁽⁽⁽ ⁾/
Скорость реакции
М с⁻¹
Посмотреть 9 похожих калькуляторов химических реакций0003
Отзыв Стивена Вудинга
Последнее обновление: 31 января 2023 г.
- Что такое энтальпия?
- Эндотермическая или экзотермическая реакция?
- Формула энтальпии
- Стандартная энтальпия образования таблица и определение
- Как рассчитать энтальпию реакции?
- Часто задаваемые вопросы
Этот калькулятор энтальпии поможет вам рассчитать изменение энтальпии реакции . Читайте дальше, чтобы узнать, как рассчитать энтальпию и ее определение. Мы также объясним разницу между эндотермическими и экзотермическими реакциями, а также предоставим вам пример расчетов.
Что такое энтальпия?
Энтальпия измеряет полную энергию термодинамической системы — либо в виде теплоты, либо в виде объема, умноженного на давление. Это функция состояния, зависящая только от равновесного состояния системы.
Более интересной величиной является изменение энтальпии — полной энергии, которая была обменена внутри системы. Это упрощенное описание передачи энергии (энергия выражается в виде тепла или работы, совершаемой при расширении).
Эндотермическая или экзотермическая реакция?
Существует два основных типа термодинамических реакций: эндотермические и экзотермические . Эндотермическая реакция вызывает поглощение тепла из окружающей среды. Экзотермический выделяет тепло в окружающую среду.
Оба эти типа реакции вызывают разницу в уровне энергии и, следовательно, разницу в энтальпии. Все, что вам нужно запомнить для целей этого калькулятора, это:
- Если реакция равна эндотермический , изменение энтальпии положительное , так как тепло приобретается (поглощается из окружающей среды).
- Если реакция экзотермическая , изменение энтальпии отрицательное , так как тепло теряется (выделяется в окружающую среду).
Формула энтальпии
Энтальпия, по определению, представляет собой сумму теплоты, поглощаемой системой, и работы, выполненной при расширении:
H=Q+pV\footnotesize H = Q+pVH=Q+pV
где QQQ обозначает для внутренней энергии, ppp для давления и VVV для объема. Обратите внимание, что вторая часть очень хорошо напоминает уравнения, с которыми мы встречались на калькуляторе комбинированного газового закона: связь между давлением и объемом позволяет нам найти аналогичную связь между количеством вещества и температурой.
Обратите внимание, что вторая часть очень хорошо напоминает уравнения, с которыми мы встречались на калькуляторе комбинированного газового закона: связь между давлением и объемом позволяет нам найти аналогичную связь между количеством вещества и температурой.
Однако, если вы хотите рассчитать изменение энтальпии, вам нужно рассмотреть два состояния — начальное и конечное. Будем считать, что давление постоянно, пока идет реакция. Тогда изменение энтальпии на самом деле: Q1)+p⋅(V2−V1)
или, упрощенно:
ΔH=ΔQ+p⋅ΔV\размер примечания ΔH = ΔQ+ p\cdot ΔVΔH=ΔQ+p⋅ΔV
где:
 5\ \mathrm{Pa} = 1\ \mathrm{бар}105 Па=1 бар и температура 25 °C=298,15 К25 \градус \mathrm{C} = 298,15\ \mathrm{K}25 °C=298,15 К), из его чистых элементов, f_\mathrm{f}f.
5\ \mathrm{Pa} = 1\ \mathrm{бар}105 Па=1 бар и температура 25 °C=298,15 К25 \градус \mathrm{C} = 298,15\ \mathrm{K}25 °C=298,15 К), из его чистых элементов, f_\mathrm{f}f.Стандартная формула энтальпии образования для реакции выглядит следующим образом:
\начать{разделить} ΔH\степень_\mathrm{реакция}& = \сумма ΔH_\mathrm{f}\степень(\mathrm{продукты})\\ &- ΔH_\mathrm{f}\степень(\mathrm{реагенты}) \end{split}ΔH°реакция=∑ΔHf°(продукты)−ΔHf°(реагенты)
где:
- ΔH°реакция ΔH\степень_\mathrm{реакция}ΔH°реакция — стандартное изменение энтальпии образования, выраженное в кДж;
- ΔHf°(продукты)ΔH_\mathrm{f}\степень(\mathrm{продукты})ΔHf°(продукты) — сумма стандартных энтальпий образования продуктов, выраженная в кДж/моль; и
- ΔHf°(реагенты)ΔH_\mathrm{f}\степень(\mathrm{реагенты})ΔHf°(реагенты) — сумма стандартных энтальпий образования реагентов, выраженная в кДж/моль.
Если вы были внимательны, то могли заметить, что ΔHf°(продукты)ΔH_\mathrm{f}\степень(\mathrm{продукты})ΔHf°(продукты) и ΔHf°(реагенты)ΔH_\mathrm{ f}\степень(\mathrm{реагенты})ΔHf°(реагенты) имеют другие единицы, чем ΔH°реакция ΔH\степень_\mathrm{реакция}ΔH°реакция.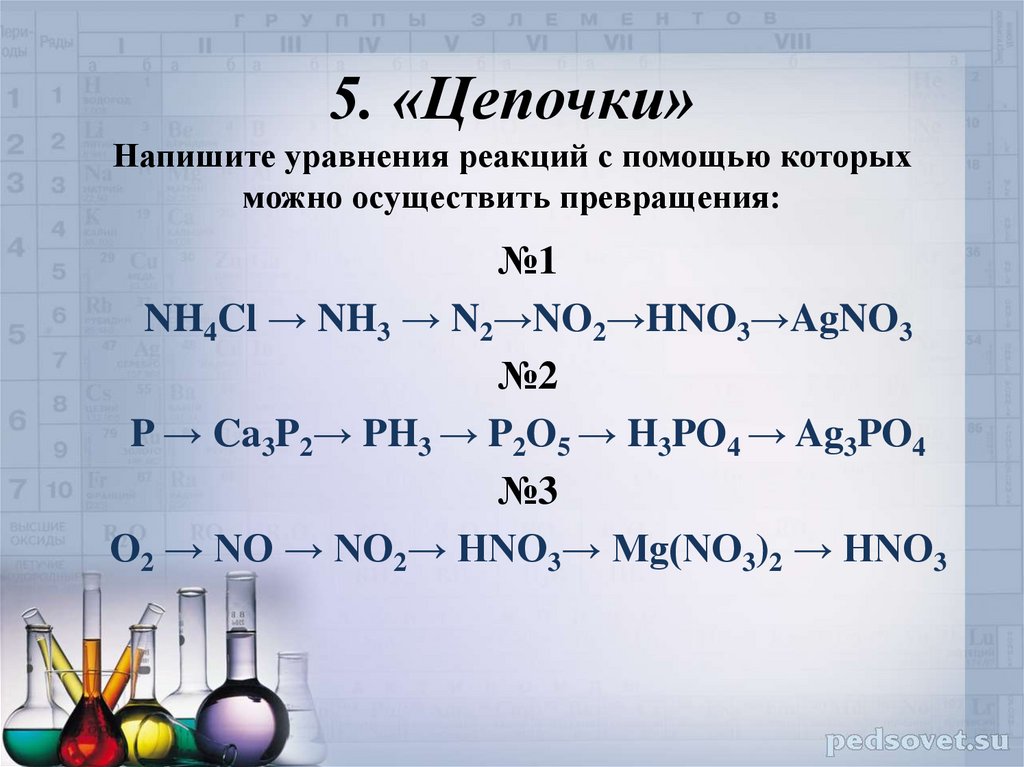 Это потому, что вам нужно умножить их на количество молей, т. е. коэффициент перед соединением в реакции. Позже мы покажем вам пример, который должен все объяснить.
Это потому, что вам нужно умножить их на количество молей, т. е. коэффициент перед соединением в реакции. Позже мы покажем вам пример, который должен все объяснить.
Но перед этим вы можете спросить: » Как рассчитать стандартную энтальпию образования для каждого соединения? » Самый простой ответ — использовать таблицу стандартной энтальпии образования! Вот пример один:
Суть | ΔHf ° ΔH_ \ mathrm {F} \ DelectorΔHF ° (KJ/MOTHRM {KJ/MOL} KJ/MOL) | 4444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444н.000 |
|---|---|---|
SO2(г)\mathrm{SO}_{2\mathrm{(г)}}SO2(г) | −296,83-296,83−296,83 | −395,72-395,72−395,72 |
h3O(l)\mathrm{H}_2\mathrm O}_\mathrm{(l)}h3O(l) | −285,8-285,8−285,8 | |
Cu2O(s)\mathrm{Cu}_2\mathrm{O}_{ \mathrm{(s)}}Cu2O(s) | 9{2+}_\mathrm{(aq)}Mg(aq)2+−466,85-466,85−466,85 |
Символы в скобках указывают на состояние: s\mathrm{s} s — твердое, l\mathrm{l}l — жидкое, g\mathrm{g}g — газообразное, aq\mathrm{aq}aq — растворенное в воде.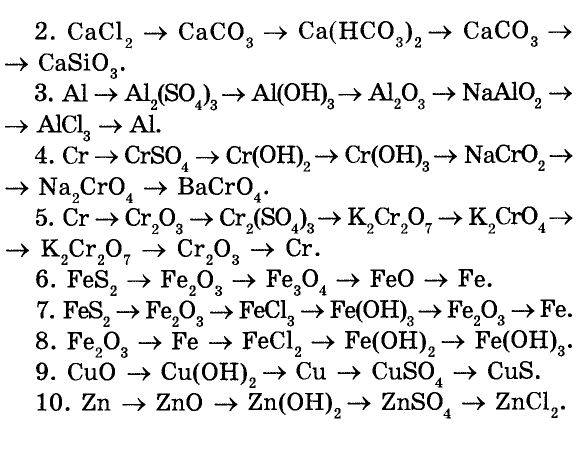 Если вам нужна стандартная энтальпия образования для других веществ, выберите соответствующее соединение в раскрывающемся списке калькулятора энтальпии . Мы включили все самые распространенные соединения!
Если вам нужна стандартная энтальпия образования для других веществ, выберите соответствующее соединение в раскрывающемся списке калькулятора энтальпии . Мы включили все самые распространенные соединения!
Давайте попрактикуем наши новые знания, используя приведенную выше таблицу стандартной энтальпии образования. Например, у нас есть следующая реакция:
2SO3(г)→2SO2(г)+O2(г)2\mathrm{SO}_{3\mathrm{(g)}}\rightarrow 2\mathrm{SO}_{2\mathrm{(g) }} + \mathrm{O}_{2\mathrm{(г)}}2SO3(г)→2SO2(г)+O2(г)
Как изменится энтальпия в этом случае? Суммируем ΔHf°ΔH_\mathrm{f}\степень ΔHf° для SO2(g)\mathrm{SO}_{2\mathrm{(g)}}SO2(g) и O2,(g)O_{2, \mathrm{(g)}}O2,(g) и вычесть ΔHf°ΔH_\mathrm{f}\степень ΔHf° для SO3(g)\mathrm{SO}_{3\mathrm{(g)}} SO3(г). Не забудьте умножить значения на соответствующие коэффициенты!
ΔH°реакция=2 моль⋅(−296,83 кДж/моль)+1 моль⋅0 кДж/моль−2 моль⋅(-395,72 кДж/моль)\footnotesize \начать{разделить} ΔH\степень_\mathrm{реакция} \!&=\! 2\ \mathrm{моль}\!\cdot\!(-296,83\ \mathrm{кДж/моль})\\ &\!\!\!\!+1\ \mathrm{моль} \cdot 0\ \mathrm{кДж/моль}\\ &\!\!\!\!-2\ \mathrm{моль}\cdot(-395,72\ \mathrm{кДж/моль}) \end{split}ΔH°реакция=2 моль⋅(−296,83 кДж/моль)+1 моль⋅0 кДж/моль−2 моль⋅(-395,72 кДж/моль)
Обратите внимание, что единицы коэффициента моль\ mathrm{mol}mol исключает mol\mathrm{mol}mol в знаменателе, поэтому окончательный ответ будет в кДж\mathrm{кДж}кДж:
ΔH°реакция=197,78 кДж ΔH\градус_\mathrm{реакция} = 197,78\ \mathrm{кДж} ΔH°реакция=197,78 кДж
Вот и все! Тем не менее, разве наш калькулятор энтальпии не на быстрее, чем на , чем все эти утомительные вычисления?
🙋 Наш инструмент для преобразования давления поможет вам без труда изменить единицы измерения давления!
Как рассчитать энтальпию реакции?
Вычислитель энтальпии имеет два режима . Вы можете рассчитать изменение энтальпии от схема реакции или по формуле энтальпии. Если вы выберете первое:
Вы можете рассчитать изменение энтальпии от схема реакции или по формуле энтальпии. Если вы выберете первое:
- Посмотрите на схему реакции, появившуюся в верхней части калькулятора . Вам нужен дополнительный реагент/продукт (C или F)? Если это так, нажмите кнопку расширенного режима
- Заполните поля раздела Реактивы . Вам необходимо указать коэффициент перед соединением и выбрать свое вещество из выпадающего списка ( они упорядочены по алфавиту ). Если вы не можете найти подходящую, выберите опцию Custom и введите стандартную энтальпию образования в кДж/моль (если у вас ее нет под рукой, проверьте некоторые справочные онлайн-таблицы, такие как эта в Chemistry LibreTexts). ).
- Проделайте то же самое для продуктов .
- Проверьте приведенную ниже схему реакции и прочтите результат. Это стандартное изменение энтальпии образования для вашей реакции!
- При желании проверьте таблицу стандартной энтальпии образования (для выбранных вами соединений), которую мы указали в самом низу.

Если вы хотите рассчитать изменение энтальпии по формуле энтальпии :
- Начните с определения изменения объема вашего вещества . Предположим, ваша жидкость расширилась на 555 литров.
- Найти изменение внутренней энергии вещества . Допустим, энергия вашего вещества увеличилась на 2000 Дж2000\ \mathrm{Дж}2000 Дж.
- Измерить давление окружающей среды. Возьмем 1 атмосферу. 93}\\
&=2506,63\\mathrm{J}
\end{split}ΔH=2000 Дж+1 атм⋅5 л=2000 Дж+101 325 Па⋅0,005 м3=2506,63 Дж
- Вы также можете открыть расширенный режим
🙋 С Omni вы можете изучить другие интересные концепции термодинамики, связанные с энтальпией: попробуйте наш калькулятор энтропии и наш калькулятор свободной энергии Гиббса!
Часто задаваемые вопросы
Что такое энтальпия в химии?
Энтальпия в химии определяет теплосодержание системы .
 Грубо говоря, изменение энтальпии в химической реакции равно количеству энергии, потерянной или полученной в ходе реакции . Система часто стремится к состоянию, когда ее энтальпия уменьшается в течение всей реакции .
Грубо говоря, изменение энтальпии в химической реакции равно количеству энергии, потерянной или полученной в ходе реакции . Система часто стремится к состоянию, когда ее энтальпия уменьшается в течение всей реакции .Является ли отрицательная энтальпия экзотермической?
Да . Химическая реакция с отрицательной энтальпией называется экзотермической . Это означает, что система теряет энергию , поэтому продукты имеют меньше энергии, чем реагенты . Следовательно, термин «экзотермический» означает, что система теряет или отдает энергию.
Как найти изменение энтальпии?
Вы можете рассчитать изменение энтальпии базовым способом, используя энтальпии продуктов и реагентов: ΔH ° =∑ΔH продуктов — ΔH реагентов . Например, давайте посмотрим на реакцию Na + + Cl — → NaCl .
 Чтобы найти изменение энтальпии:
Чтобы найти изменение энтальпии:- Используйте энтальпию продукта NaCl ( -411,15 кДж ).
- Найти энтальпию Na + ( -240,12 кДж ) и Cl — ( -167,16 кДж ).
- Рассчитать изменение энтальпии:
ΔH ° = 1 × -411,15 кДж — (1 × -240,12 кДж — 1 × 167,16 кДж) = -3,87 кДж . Запомните соответствующие коэффициенты!
Какие вещества имеют нулевую стандартную энтальпию образования?
Все чистые элементы в их стандартном состоянии (например, газообразный кислород, углерод во всех формах и т. д.) имеют стандартную энтальпию образования, равную нулю . Под энтальпией образования понимается изменение теплоты при образовании одного моля вещества. Но элемент, образовавшийся из самого себя, означает отсутствие теплового превращения, поэтому энтальпия его образования будет равна нулю .

Что такое энтальпия образования воды?
-571,7 кДж . Предположим образование воды H 2 O из газообразного водорода H 2 и газообразного кислорода O 2 . Чтобы найти энтальпию:
- Напишите реакцию образования: 2H 2 + O 2 → 2H 2 O .
- Обратите внимание, что энтальпия H 2 и O 2 в их элементарном состоянии равна ноль .
- Рассчитать энтальпию как
∑ΔH продуктов — ΔH реагента = 2 × -285,83 кДж — (2 × 0 кДж + 0 кДж) = -571,7 кДж .
Bogna Szyk и Dominik Czernia, PhD
Рассчитайте изменение энтальпии с
A N A + B N B + C N C → D N 7777777777777777777777777777777777777777777777777777777777777777777777777. n F
По умолчанию можно рассчитывать только для двух реагентов/продуктов.
- Вы также можете открыть расширенный режим

 Постоянная скорость для 1-го порядка Опп. по 1-му заказу Rxn. когда начальная конц. B больше 0
Постоянная скорость для 1-го порядка Опп. по 1-му заказу Rxn. когда начальная конц. B больше 0 продукта реакции первого порядка, противостоящей реакции первого порядка при исходной концентрации. Реагента
продукта реакции первого порядка, противостоящей реакции первого порядка при исходной концентрации. Реагента реагента А
реагента А


 (Это также самый простой метод для реакций нулевого порядка, поскольку скорость реакции равна константе скорости! )
(Это также самый простой метод для реакций нулевого порядка, поскольку скорость реакции равна константе скорости! )

 Грубо говоря, изменение энтальпии в химической реакции равно количеству энергии, потерянной или полученной в ходе реакции . Система часто стремится к состоянию, когда ее энтальпия уменьшается в течение всей реакции .
Грубо говоря, изменение энтальпии в химической реакции равно количеству энергии, потерянной или полученной в ходе реакции . Система часто стремится к состоянию, когда ее энтальпия уменьшается в течение всей реакции . Чтобы найти изменение энтальпии:
Чтобы найти изменение энтальпии:
