Реакция магния с водяным паром | Выставочная химия
Посмотреть это
Посмотреть видео и загрузить технические заметки с веб-сайта Education in Chemistry: rsc.li/3oBNyqC
При обучении серии реактивности учащиеся обычно проводят практические занятия, чтобы изучить закономерности в химии. реакции кислот с менее активными металлами. Точно так же они могут увидеть демонстрацию более реакционноспособных металлов с водой или даже сами исследовать их на практике. Такой подход создает у некоторых учеников впечатление, что эти два типа реакций несопоставимы. Как металл средней реактивности, магний можно использовать, чтобы помочь учащимся провести ментальный мост между этими типами реакции. Лента магния удовлетворительно реагирует с сильными кислотами и практически не реагирует с водой комнатной температуры. Однако он будет быстро реагировать с паром.
Комплект
- Защитные экраны
- Лента магниевая (легковоспламеняющаяся) – примерно 10 см
- Минеральная вата
- Боросиликатная кипящая трубка
- Зажим и подставка
- Резиновая пробка со стеклянной трубкой
- Защита глаз для публики
- Брызгозащитные очки для демонстратора
- Горелка Бунзена
- Шина
Подготовка
Установка защитных экранов для защиты зрителей и демонстрантов. Сверните магниевую ленту в спираль примерно 0,5 см в диаметре и 3 см в длину. Загрузите минеральную вату в кипящую трубку и смочите ее водой, прежде чем зажать трубку горизонтально и вставить магниевый змеевик. Наконец, добавьте пробку со стеклянной трубкой. Конец трубки должен выступать из резины не менее чем на 2 см, чтобы можно было зажечь выделившийся водород из демонстрации.
Сверните магниевую ленту в спираль примерно 0,5 см в диаметре и 3 см в длину. Загрузите минеральную вату в кипящую трубку и смочите ее водой, прежде чем зажать трубку горизонтально и вставить магниевый змеевик. Наконец, добавьте пробку со стеклянной трубкой. Конец трубки должен выступать из резины не менее чем на 2 см, чтобы можно было зажечь выделившийся водород из демонстрации.
Рисунок 1: Установка, готовая к реакции магниевой ленты с паром
Перед классом
Зрители должны находиться на расстоянии не менее 2 метров, в защитных очках. Демонстратор должен носить защитные очки. Нагрейте трубку горелкой Бунзена прямо под магнием, пока лента не загорится. Затем переместите горелку Бунзена на пропитанную водой минеральную вату, чтобы начать испарение воды. Магний светится ярче, когда над ним проходит пар, и можно использовать лучину, чтобы зажечь выделившийся водород на конце стеклянной трубки.
Безопасность
- Носите брызгозащитные очки и используйте защитные экраны для защиты зрителей и демонстрантов.
 Учащиеся должны оставаться на расстоянии 2 м и носить защитные очки.
Учащиеся должны оставаться на расстоянии 2 м и носить защитные очки. - Никогда не смотрите прямо на горящий магний.
- Не используйте порошок магния.
- Никогда не пытайтесь реагировать с паром на кальций или щелочные металлы.
- Примите меры для предотвращения кражи; никогда не оставляйте катушки с магнием в лаборатории. Членам
Учебная цель
Учащиеся, вероятно, уже видели реакцию магния с кислотами с образованием газообразного водорода и соли (уравнение 1). Они также могли наблюдать реакцию лития с водой с образованием газообразного водорода и гидроксида, о чем свидетельствует использование универсального индикатора или фенолфталеина (уравнение 2).
Уравнение 1: Mg(т) + 2HCl(водн.) → MgCl 2 (водн.) + H с) + 2Н 2 O(ж) → 2LiOH(водн.) + H 2 (г) Эта демонстрация показывает, как можно резко ускорить реакцию металлов с водой за счет повышения температуры.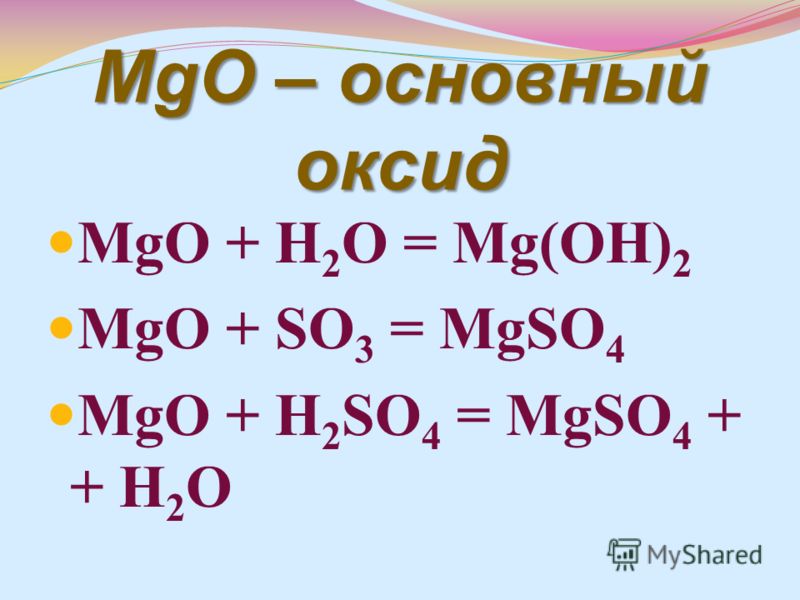 Учащиеся могут увидеть образование газообразного водорода и провести мысленную связь между реакциями, показанными в уравнении 1 и уравнении 2.
Учащиеся могут увидеть образование газообразного водорода и провести мысленную связь между реакциями, показанными в уравнении 1 и уравнении 2.
Здесь реакция первоначально дает оксид магния (уравнение 3), который может продолжать производить гидроксид при реакции с жидкая вода (уравнение 4).
Уравнение 3: Mg(s) + H 2 O(g) → MgO(aq) + H 2 (g) Уравнение 4: MgO(s) + H 2 О( l) → Mg(OH) 2 (водн.)Затем учащимся можно предложить сделать предположения о том, какие реагенты и продукты образуются в реакции магния и воды при комнатной температуре, и какие данные мы можем собрать для проведения реакции. место (уравнение 5), если у них было несколько дней, чтобы ждать результатов.
Уравнение 5: Mg(s) + 2H 2 O(g) → Mg(OH) 2 (водн.) + H 2 (g) Увидев использование индикатора в реакциях металл-вода и производстве газообразного водорода в реакциях металл-кислота, учащиеся могут предположить, что это возможные признаки того, что реакции связаны.
Вы можете проверить это, оставив перевернутую воронку и сборную трубку над магниевой лентой, погруженной в воду с несколькими каплями фенолфталеина. Индикатор начнет менять цвет в течение нескольких минут (Рисунок 2), но может потребоваться несколько дней, чтобы собрать значительный объем газа, который можно будет протестировать на следующем уроке.
Рисунок 2: Испытания на производство водорода
Утилизация
Там, где горящий магний контактировал со стеклом, мог образовываться силицид магния. Пробирку для кипячения нельзя использовать повторно, но ее можно промыть в 500 см 3 воды для преобразования любых силицидов в силаны. Могут быть видны небольшие хлопки или вспышки от пирофорных силанов. Промытую стеклянную посуду можно выбросить в контейнер для битого стекла.
Деклан ФлемингДеклан Флеминг — учитель химии и автор рубрики «Химия на выставке».
Темы
- Covid-19
- Практические навыки и безопасность
- Реактивность
Бурная реакция между оксидом магния и водой
оксид магния 90 142
(Источник: Wikimedia Commons)
Что вы наблюдаете, когда к твердому оксиду магния MgO добавляют воду? Я часто спрашиваю об этом своих студентов, и обычно они отвечают, что они ожидают, что часть, если не весь, твердый MgO растворится с образованием прозрачного щелочного раствора.
Правда, они сделали правильный выбор только со щелочным раствором. Я должен отметить, что при добавлении воды к белому твердому образцу MgO видимых изменений не наблюдается. Реакция, без сомнения, ЕСТЬ, но ее нельзя «наблюдать» невооруженным глазом; вы узнаете, что реакция произошла, только если вы проверите рН смеси с помощью лакмусовой или рН-бумаги.
1 ——
Перед добавлением воды в пробирке находится белый твердый образец MgO.
2 ——
После добавления воды наблюдается суспензия белого твердого вещества.
Объяснение :
Твердый оксид магния реагирует с водой с образованием гидроксида магния, Mg(OH) 2 , который также представляет собой белое твердое вещество. Поскольку Mg(OH) 2 мало растворим в воде, видимых изменений не наблюдается.
MgO(s) + H 2 O( l ) → Mg(OH) 2 (s)
3 ——
При стоянии белое твердое вещество Mg(OH) 2 оседает. Надосадочная жидкость над твердым веществом считается щелочной, когда красная лакмусовая бумажка становится синей.
Надосадочная жидкость над твердым веществом считается щелочной, когда красная лакмусовая бумажка становится синей.
(Обратите внимание, что также нет заметного изменения количества белого твердого вещества после «реакции».)
Пояснение вода. Таким образом, количество твердого вещества не уменьшается значительно, чтобы можно было наблюдать изменение.Mg(OH) 2 (т) ⇌ Mg 2+ (водн.) + 2OH – (водн.)
Раствор над белым твердым веществом оказался щелочным из-за присутствия очень низкой концентрации ионов OH – , образующихся при растворении небольшого количества Mg(OH) 2 .
Несмотря на то, что кальций находится чуть ниже магния в группе 2, что интересно, существует ОГРОМНЫЙ скачок в «наблюдаемой реакционной способности» от MgO до оксида кальция, CaO. В то время как нет видимых изменений, когда MgO реагирует с водой, CaO настолько энергично реагирует с водой, что количества выделяемого тепла достаточно, чтобы довести смесь до кипения, как демонстрирует следующее домашнее видео ниже!

 Учащиеся должны оставаться на расстоянии 2 м и носить защитные очки.
Учащиеся должны оставаться на расстоянии 2 м и носить защитные очки.