Идеальный газ — определение, свойства, условия
Покажем, как применять знание физики в жизни
Начать учиться
Говорят, что нет предела совершенству — но газ бывает идеальным. Сегодня мы узнаем, что эта физическая модель из себя представляет и как ее использовать.
Газ: агрегатное состояние
У веществ есть три агрегатных состояния — твердое, жидкое и газообразное.
Их характеристики — в таблице:
Агрегатные состояния | Свойства | Расположение молекул | Расстояние между молекулами | Движение молекулы |
|---|---|---|---|---|
Твердое | в кристаллической решетке | соотносится с размером молекул | колеблется около положения равновесия в кристаллической решетке | |
Жидкое | сохраняет объем и текучесть | хаотичное | близко друг к другу | молекулы малоподвижны, при нагревании скорость движения увеличивается |
Газообразное | занимает весь предоставленный объем | хаотичное | больше размеров молекул | хаотичное и непрерывное |
В жизни мы встречаем вещества в газообразном состоянии, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (занимает весь предоставленный объем) и состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (занимает весь предоставленный объем) и состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатных состояний точно три?
На самом деле есть еще четвертое — плазма. Звучит как что-то из научной фантастики, но это просто ионизированный газ — газ, в котором, помимо нейтральных частиц, есть еще и заряженные. Ионизаторы воздуха как раз строятся на принципе перехода из газообразного вещества в плазму.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Модель идеального газа
В физике есть такое понятие, как модель. Модель — это что-то идеализированное, она нужна в случаях, когда можно пренебречь некоторыми параметрами объекта или процесса.
Идеальный газ — это модель реального газа. Молекулы идеального газа представляют собой материальные точки, которые не взаимодействуют друг с другом на расстоянии, но взаимодействуют при столкновениях друг с другом или со стенками сосуда. При работе с идеальным газом можно пренебречь потенциальной энергией молекул (но не кинетической).
Важно знать
Модель идеального газа не может описать ситуацию, когда газ сжимают так сильно, что он конденсируется — переходит в жидкое состояние.
В повседневной жизни идеальный газ, конечно, не встречается. Но реальный газ может вести себя почти как идеальный. Такое случается, если среднее расстояние между молекулами во много раз больше их размеров, то есть если газ очень разреженный.
Свойства идеального газа
Расстояние между молекулами значительно больше размеров молекул.
Молекулы газа очень малы и представляют собой упругие шары.

Силы притяжения между молекулами пренебрежимо малы.
Молекулы взаимодействуют только при соударениях.
Молекулы движутся по законам Ньютона.
Среднеквадратичная скорость
Потенциальной энергией молекул газа пренебречь можно, а вот кинетической — никак нельзя. Потому что кинетическая энергия — это энергия движения, а мы не можем пренебрегать скоростью движения молекул.
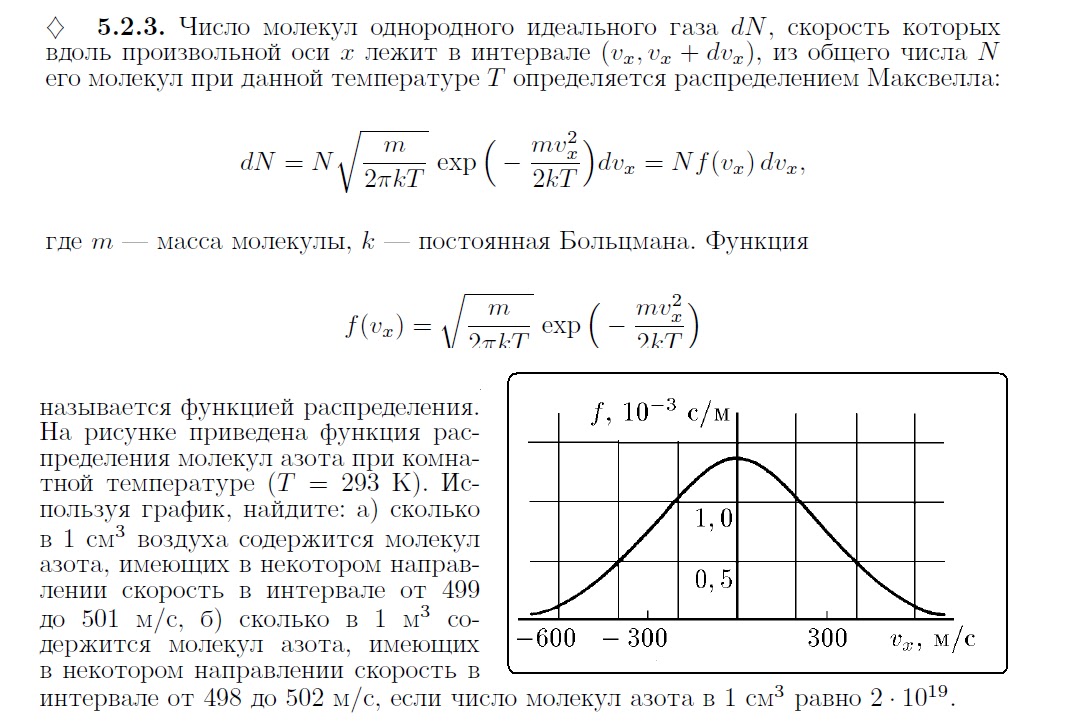
На графике показано распределение Максвелла — то, как молекулы распределяются по скоростям. Судя по графику, большинство молекул движутся со средним значением скорости. Хотя есть и быстрые, и медленные молекулы, просто их значительно меньше.
Но наш газ идеальный, а в идеальном газе случаются чудеса. Одно из таких чудес — то, что все молекулы идеального газа двигаются с одинаковой скоростью. Эта скорость называется средней квадратичной.
Одно из таких чудес — то, что все молекулы идеального газа двигаются с одинаковой скоростью. Эта скорость называется средней квадратичной.
Средняя квадратичная скорость vср. кв. — средняя квадратичная скорость [м/с] v1, v2, vn — скорости разных молекул [м/с] N — количество молекул [—] |
Попробуйте курсы подготовки к ЕГЭ по физике с опытным преподавателем в онлайн-школе Skysmart!
Давление идеального газа
Молекулы газа беспорядочно движутся.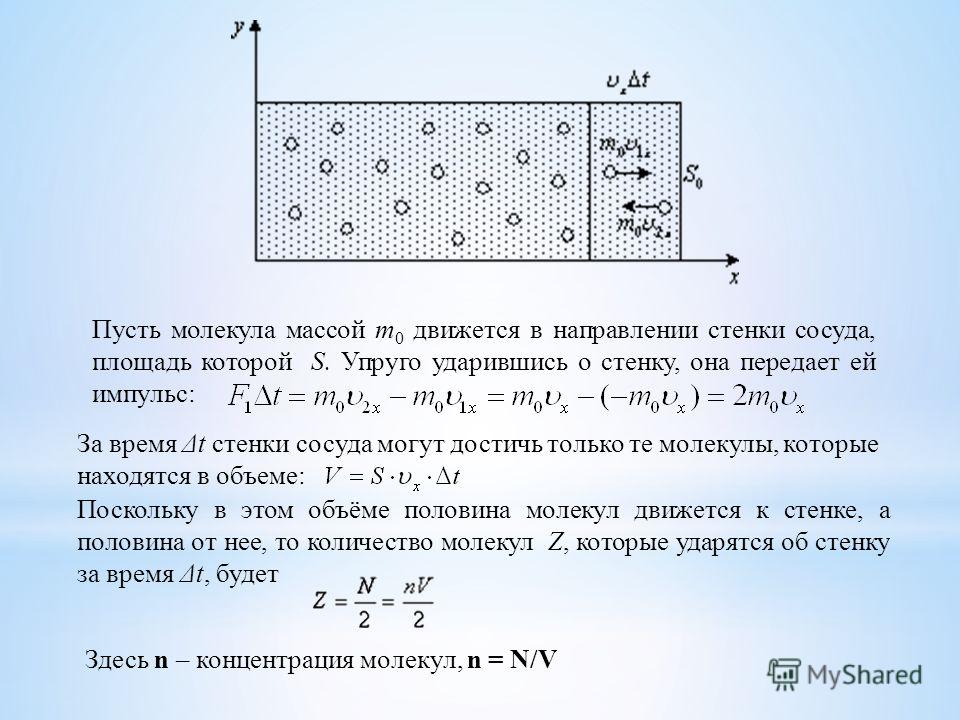
Например, в комнате, в которой вы сейчас находитесь, за одну секунду на каждый квадратный сантиметр молекулы воздуха наносят столько ударов, что их количество выражается двадцатитрехзначным числом.
Хотя сила удара отдельной молекулы мала, действие всех молекул на стенки сосуда приводит к значительному давлению. Представьте, что комар пытается толкать машину — она не сдвинется с места. Но если за работу возьмется пара сотен миллионов комаров, то машину получится сдвинуть.
Эксперимент
Чтобы смоделировать давление газа, возьмите песок и лист бумаги, зажатый между двумя книгами. Песчинки будут выступать в роли молекул газа, а лист — в роли сосуда, в котором этот газ находится. Когда вы начинаете сыпать песок на лист бумаги, бумага отклоняется под воздействием множества песчинок.
Зависимость давления от других величин
Зависимость давления от объема
В механике есть формула давления, которая показывает, что давление прямо пропорционально силе и обратно пропорционально площади, на которую эта сила оказывается.
Давление p = F/S F — сила [Н] S — площадь [м |
То есть если наши двести миллионов комаров будут толкать легковую машину, они распределятся по меньшей площади, чем если бы толкали грузовой автомобиль, — просто потому, что легковушка меньше грузовика. Из формулы давления следует, что давление на легковой автомобиль будет больше из-за его меньшей площади.
Из формулы давления следует, что давление на легковой автомобиль будет больше из-за его меньшей площади.
Рассмотрим аналогичный пример с двумя сосудами разной площади.
Давление в левом сосуде будет больше, чем во втором, потому что его площадь меньше. А раз меньше площадь сосуда, то меньше и его объем. Значит, давление зависит от объема следующим образом: чем больше объем, тем меньше давление, и наоборот.
При этом зависимость будет не линейная, а примет вот такой вид (при условии, что температура постоянна):
Зависимость давления от объема называется законом Бойля-Мариотта. Она экспериментально проверяется с помощью такой установки:
Объем шприца увеличивают с помощью насоса, а манометр измеряет давление. Эксперимент показывает, что при увеличении объема давление действительно уменьшается.
Зависимость давления от температуры
Рассмотрим зависимость давления газа от температуры при условии неизменного объема определенной массы газа. Исследования в этой области впервые провел французский изобретатель Жак Шарль в XVIII веке.
Исследования в этой области впервые провел французский изобретатель Жак Шарль в XVIII веке.
В ходе эксперимента газ нагревали в большой колбе, соединенной с ртутным манометром в виде узкой изогнутой трубки. Незначительным увеличением объема колбы при нагревании можно пренебречь, как и столь же незначительным изменением объема при смещении ртути в узкой манометрической трубке. Таким образом, объем газа можно считать неизменным.
Подогревая воду в сосуде, окружающем колбу, ученый измерял температуру газа термометром, а давление — манометром.
Эксперимент показал, что давление газа увеличивается с увеличением температуры. Это связано с тем, что при нагревании молекулы газа движутся быстрее, из-за чего чаще ударяются о стенки сосуда.
С температурой все проще. Зависимость давления от температуры при постоянных объеме и массе будет линейной:
Эта зависимость называется законом Шарля в честь ученого, открывшего ее.
Основное уравнение МКТ
Основная задача молекулярно-кинетической теории газа заключается в том, чтобы установить соотношение между давлением газа и его микроскопическими параметрами: массой молекул, их средней скоростью и концентрацией. Это соотношение называется основным уравнением молекулярно-кинетической теории газа или кратко — основным уравнением МКТ.
В основе молекулярно-кинетической теории лежат три положения.
Все вещества образованы из мельчайших частиц — молекул, которые состоят из атомов.
Молекулы химического вещества могут быть простыми и сложными, то есть состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.

Атомы и молекулы находятся в непрерывном хаотическом движении.
Частицы взаимодействуют друг с другом силами, которые имеют электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Мы уже выяснили, что причина давления газа на стенки — это удары молекул. Давление напрямую зависит от количества молекул — чем их больше, тем больше ударов о стенки и тем больше давление. А количество молекул в единице объема — это концентрация. Значит, давление газа зависит от концентрации.
Также давление пропорционально квадрату скорости, так как чем больше скорость молекулы, тем чаще она бьется о стенку сосуда. Расчеты показывают, что основное уравнение молекулярно-кинетической теории для идеального газа имеет следующий вид.
Основное уравнение МКТ p = nkT или p — давление газа [Па] n — концентрация [м−3] T — температура газа [К] m0 — масса одной молекулы [кг] v — средняя квадратичная скорость [м/с] |
Коэффициент 1/3 обусловлен трехмерностью пространства: во время хаотического движения молекул все три направления равноправны.
Важный нюанс: средняя квадратичная скорость сама по себе не в квадрате! Ее формула указана выше, а в основном уравнении МКТ (да и не только в нем) она возведена в квадрат. Это значит, что формулу средней квадратичной скорости нужно подставлять не вместо v2, а вместо v — и потом уже возводить эту формулу в квадрат. Это часто провоцирует путаницу.
Мы знаем, что кинетическая энергия вычисляется по следующей формуле:
Кинетическая энергия Ек = mv2/2 Ек — кинетическая энергия [Дж] m — масса тела [кг] v — скорость [м/с] |
Для молекулы газа формула примет вид:
Средняя кинетическая энергия поступательного движения молекулы Ек = m0v2/2 Ек — средняя кинетическая энергия поступательного движения молекулы [Дж] m0 — масса молекулы [кг] v — скорость молекулы [м/с] |
Из этой формулы можно выразить m0v2 и подставить в основное уравнение МКТ. Подставим и получим, что давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Подставим и получим, что давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Основное уравнение МКТ p — давление газа [Па] n — концентрация [м−3] E — средняя кинетическая энергия поступательного движения молекулы [Дж] |
Хранение и транспортировка газов
Если нужно перевезти значительное количество газа из одного места в другое или если газ необходимо длительно хранить, его помещают в специальные прочные металлические сосуды. Из-за того, что при уменьшении объема увеличивается давление, газ можно закачать в небольшой баллон, но он должен быть очень прочным.
Из-за того, что при уменьшении объема увеличивается давление, газ можно закачать в небольшой баллон, но он должен быть очень прочным.
Сосуды, предназначенные для транспортировки газов, выдерживают высокие давления. Поэтому с помощью специальных насосов (компрессоров) туда можно закачать значительные массы газа, которые в обычных условиях занимали бы в сотни раз больший объем.
Поскольку давление газов в баллонах даже при комнатной температуре очень велико, их ни в коем случае нельзя нагревать. Например, держать под прямыми лучами солнца или пытаться сделать в них отверстие — даже после использования.
Карина Хачатурян
К предыдущей статье
111.1K
Механическая работа
К следующей статье
Электроемкость конденсатора
Получите индивидуальный план обучения физике на бесплатном вводном уроке
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Молекулярно-кинетическая теория газов — примеры, решения
Пример 1:
Каково давление азота, если его плотность равна 1,35 кг/м3, а средняя квадратичная скорость молекул 500 м/с?
Решение от преподавателя:
Запишем для начала уравнение Клапейрона-Менделеева:
Поделим обе части уравнения на объем V, в правой части получившееся отношение m\V заменим на плотность газа ρ:
Среднюю квадратичную скорость молекул υкв определяют по такой формуле:
Выразим из выражения температуру газа T:
Это выражение подставим в формулу (1), тогда получим:
Задача решена в общем виде. Все величины, входящие в формулу, даны в единицах системы СИ, поэтому можно сразу посчитать ответ:
Все величины, входящие в формулу, даны в единицах системы СИ, поэтому можно сразу посчитать ответ:
Ответ: 0,1 МПа.
Пример 2:
В баллоне находится 20 моль газа. Сколько молекул газа находится в баллоне?
Решение от преподавателя:
Известно, что в 1 моль любого вещества содержится число молекул, равное числу Авогадро NА. Тогда понятно, что в ν молях вещества содержится в ν раз больше, чем число Авогадро. Запишем сказанное в виде формулы:
Число Авогадро NА равно 6,022·1023 1/моль. Посчитаем численный ответ к задаче:
Поскольку в физике нет единицы измерения “штук”, то так и оставляем полученную величину безразмерной.
Ответ: 1,2·1025.
Пример 3:
Сколько молекул кислорода находится в сосуде объемом 1 л, если температура кислорода 150° C, а давление равно 0,132 нПа?
Решение от преподавателя:
Запишем формулу связи давления идеального газа p с концентрацией его молекул n и абсолютной температурой T:
В этой формуле k – постоянная Больцмана, она равна 1,38·10-23 Дж/К. Также запишем формулу определения концентрации n (по смыслу это количество молекул в единице объема):
Также запишем формулу определения концентрации n (по смыслу это количество молекул в единице объема):
Подставим последнее выражение в первую формулу, получим:
Осталось только выразить количество молекул N:
Переведем объем V в кубические метры, а температуру t – в Кельвины:
Считаем ответ:
Количество молекул в физике – безразмерная величина.
Ответ: 2,26·107.
Пример 4:
Определить массу молекулы кислорода.
Решение от преподавателя:
Рассмотрим ν (произвольное количество) моль кислорода. Напомним, что формула кислорода такая: O2.
Чтобы найти массу m некоторого количества кислорода, нужно молярную массу кислорода M умножить на число молей ν.
Используя таблицу Менделеева, легко определить, что молярная масса кислорода M равна 32 г/моль или 0,032 кг/моль. В одном моле содержится число Авогадро молекул NА, а в ν моль – в ν раз больше, то есть:
Чтобы найти массу одной молекулы m0, нужно всю массу m поделить на число молекул N.
Число Авогадро NА – это табличная величина, равна 6,022·1023 моль-1. Произведем вычисления:
Ответ: 5,3·10-23 г.
Пример 5:
Определить плотность воздуха при 27° C и давлении 0,1 МПа.
Решение от преподавателя:
Запишем уравнение Клапейрона-Менделеева:
Плотность ρ – это масса единицы объема вещества, её находят как отношение массы вещества m к объему V:
Давайте разделим обе части уравнения Клапейрона-Менделеева на объем V:
Учитывая (1), имеем:
Из полученной формулы выразим плотность ρ:
Молярная масса воздуха M равна 0,029 кг/моль, универсальная газовая постоянная R – 8,31 Дж/(моль·К). Перед тем, как считать ответ, переведем температуру в шкалу абсолютных температур:
Ответ: 1,16 мг/см3.
Пример 6:
Сколько молекул содержится в 5 кг кислорода?
Решение от преподавателя:
Число молекул N находят как произведение количества вещества νν на число Авогадро NА (равное 6,022·1023 моль-1).
Количество вещества νν найдем как отношение массы mm к молярной массе вещества M (у кислорода O2 она равна 0,032 кг/моль).
В итоге имеем такую окончательную формулу:
Посчитаем численный ответ к задаче:
Помните, что число молекул в физике – это безразмерная величина, не нужно писать никаких “штук”.
Ответ: 9,41·1025.
Пример 7:
Какое давление на стенки сосуда производят молекулы газа, если масса газа 3 г, объем 0,5 л, а средняя квадратичная скорость его молекул 500 м/с?
Решение от преподавателя:
Основное уравнение молекулярно-кинетической теории (МКТ) идеального газа:
Концентрацию молекул газа nn находят как отношение числа молекул N к объему газа V:
Тогда имеем:
Интересно, но произведение массы одной молекулы m0 на количество молекул N по смыслу есть масса газа m, поэтому:
Переведем массу m и объем V газа в систему СИ:
Произведем вычисления:
Ответ: 0,5 МПа.
Пример 8:
При температуре 320 К средняя квадратичная скорость молекулы кислорода 500 м/с. Определить массу молекулы кислорода.
Решение от преподавателя:
Решение:
Как и в механике, среднюю кинетическую энергию молекул кислорода можно определить по формуле:
С другой стороны, есть формула связи средней кинетической энергии с абсолютной температурой:
Приравняем правые части этих двух формул:
Выразим из этого равенства массу одной молекулы m0:
Напомним, что здесь k – это постоянная Больцмана, равная 1,38·10-23 Дж/К.
Посчитаем ответ:
Ответ: 5,3·10-23 г.
Пример 9:
Вычислить среднюю квадратичную скорость молекул углекислого газа при температуре 223 К.
Решение от преподавателя:
Среднюю квадратичную скорость молекул идеального газа υквυкв определяют по такой формуле:
В этой формуле R – универсальная газовая постоянная (R=8,31 Дж/(моль·К)), M – молярная масса газа, у углекислого газа CO2 равная 0,044 кг/моль. Все величины, входящие в формулу известны, посчитаем ответ:
Все величины, входящие в формулу известны, посчитаем ответ:
Ответ: 0,36 км/с.
Пример 10:
Определить давление водорода, если средняя квадратичная скорость его молекул равна 2550 м/с, а концентрация молекул 3,6·1025 м-3.
Решение от преподавателя:
Воспользуемся основным уравнением молекулярно-кинетической теории (МКТ) идеального газа:
Как вы и сами можете видеть, нам неизвестна только масса одной молекулы m0, входящее в это уравнение. Её можно найти, поделив молярную массу газа M (а она у водорода равна 0,002 кг/моль) на число Авогадро NА (оно равно 6,022·1023 1/моль).
В итоге получается такая формула:
Произведем расчет ответа:
Ответ: 259 кПа.
Пример 11:
Определить среднеквадратичную скорость молекул газа при давлении 100 кПа и плотности 1,25 кг/м3.
Решение от преподавателя:
Запишем основное уравнение молекулярно-кинетической теории (МКТ) идеального газа:
Вспомним формулу определения концентрации молекул n идеального газа:
Подставим это выражение в формулу (1), получим:
Произведение массы одной молекулы m0 на количество молекул N равно массе газа m, поэтому:
Отношение массы m к объему V – это физическая величина, называемая плотностью газа ρ, поэтому:
Осталось сделать последнее действие – выразить искомую скорость υкв:
Посчитаем численный ответ задачи:
Ответ: 0,49 км/с.
Пример 12:
Какова средняя кинетическая энергия поступательного движения молекул газа, если при концентрации молекул 2,65·1025 м-3 давление равно 98,8 кПа?
Решение от преподавателя:
Запишем основное уравнение МКТ идеального газа:
Среднюю кинетическую энергию молекул газа можно определить по формуле:
С учетом этой формулы, формула (1) примет такой вид:
Откуда искомая величина Eк равна:
Задача решена в общем виде, теперь посчитаем численный ответ:
В задачнике ответ дан не в Джоулях, а в электрон-Вольтах. Известно, что:
Поэтому:
Ответ: 0,035 эВ.
Пример 13:
В баллоне емкостью 40 л находится 10 кг кислорода под давлением 20 МПа. Найти среднюю квадратичную скорость молекул кислорода.
Решение от преподавателя:
Применим основное уравнение молекулярно-кинетической теории (МКТ) идеального газа:
Распишем концентрацию молекул газа nn как отношение количества молекул N к объему газа V:
Произведение массы одной молекулы m0 на количество молекул N есть масса газа mm, поэтому:
Выразим искомую среднеквадратичную скорость υкв:
Переведем объем баллона в систему СИ и посчитаем ответ:
Ответ: 1763,6 км/ч.
Пример 14:
Определить давление, при котором 1 м3 газа, имеющий температуру 60° C, содержит 2,4·1026 молекул.
Решение от преподавателя:
Запишем формулу связи давления идеального газа с концентрацией молекул и абсолютной температурой:
В этой формуле n – концентрация молекул, которую легко определить по формуле:
Также в условии температура дана в Цельсиях. Чтобы перевести температуру в Кельвины, то есть в абсолютную шкалу, нужно воспользоваться формулой:
учетом всего записанного, формула (1) станет такой:
Здесь k – это постоянная Больцмана, равна 1,38·10-23 Дж/К. Посчитаем ответ:
Ответ: 1103 кПа.
Пример 15:
Энергия поступательного движения, которой обладают все молекулы газа, находящегося в объеме 0,02 м3 при 17° C, составляет 0,66 Дж. Найти концентрацию молекул этого газа.
Решение от преподавателя:
Кинетическая энергия поступательного движения одной молекулы идеального газа находят по формуле:
Постоянная Больцмана k равна 1,38·10-23 Дж/К. Умножим обе части этого равенства на число молекул газа N, тогда:
Умножим обе части этого равенства на число молекул газа N, тогда:
Произведение NEк по смыслу равна данной в условии энергии поступательного движения всех молекул газа E, поэтому:
Теперь поделим обе части равенства на объем V:
Отношение N\V в правой части есть концентрация молекул n:
Температуру t переведем в шкалу абсолютных температур:
Посчитаем ответ:
Ответ: 5,5·1021 м-3.
Пример 16:
Сколько молекул содержится в 1 л воды?
Решение от преподавателя:
Чтобы определить число молекул N, нужно количество вещества ν (число моль) умножить на число Авогадро NА:
Число Авогадро NА – это физическая постоянная, равная 6,022·1023 1/моль. Количества вещества ν можно найти, разделив массу m на молярную массу вещества M.
Молярная масса воды (H2O) равна 0,018 кг/моль. Ну и массу m можно найти как произведение плотности ρ на объем V:
Плотность воды ρ составляет 1000 кг/м3. В итоге Вы должны получить такую формулу:
В итоге Вы должны получить такую формулу:
Обязательно перед подстановкой в формулу переведем объем в единицы системы СИ:
Посчитаем ответ:
Ответ: 3,35·1025.
Пример 17:
Найти концентрацию молекул газа, у которого средняя квадратичная скорость молекул равна 500 м/с при температуре 300 К. Плотность газа 0,27 кг/м3.
Решение от преподавателя:
Запишем основное уравнение молекулярно-кинетической теории идеального газа:
Распишем в этой формуле концентрацию n как отношение числа молекул N к объему газа V:
По смыслу произведение m0N равно массе газа m, тогда:
Отношение массы газа m к объему газа V – это плотность газа ρ, поэтому:
Также запишем формулу связи давления идеального газа p с концентрацией молекул газа n и абсолютной температурой T:
Приравняем формулы (1) и (2), далее выразим искомую концентрацию n:
Произведем вычисления:
Ответ: 5,43·1024 м-3.
Пример 18:
Какое значение температуры по шкале Кельвина соответствует температуре 100° C?
Решение от преподавателя:
Чтобы перевести температуру из шкалы Цельсия в шкалу Кельвина (то есть в абсолютную шкалу температур), нужно воспользоваться следующей формулой:
T=t+273
Учитывая это, мы получим такой ответ:
T=100+273=373К
Ответ: 373 К.
Пример 19:
В первом сосуде находится азот, во втором – водород. Чему равно отношение давления p1 азота к давлению p2 водорода при одинаковых значениях концентрации молекул и температуре?
Решение от преподавателя:
Применим формулу связи давления газа p с концентрацией молекул n и абсолютной температурой T:
Тогда искомое отношение давлений азота p1 и водорода p2 можно найти так:
Поскольку в условии сказано, что концентрация и температура газов равны, то есть
значит:
Ответ: 1.
Пример 20:
Какой объем при нормальных условиях занимают 5 г углекислого газа?
Решение от преподавателя:
Эту задачу проще всего решить, если воспользоваться уравнением Клапейрона-Менделеева:
Выразим из уравнения искомый объем V:
Здесь R – универсальная газовая постоянная, равная 8,31 Дж/(моль·К). Нормальным условиям соответствует давление p, равное 100 кПа, и температура T, равная 0° C или 273 К. Молярная масса углекислого газа (CO2) равна 0,044 кг/моль. Переведем массу в систему СИ и посчитаем ответ:
Нормальным условиям соответствует давление p, равное 100 кПа, и температура T, равная 0° C или 273 К. Молярная масса углекислого газа (CO2) равна 0,044 кг/моль. Переведем массу в систему СИ и посчитаем ответ:
Интереса ради представим формулу (1) в следующем виде, где ν – это количество вещества:
Из формулы видно, что равные количества вещества любых газов при нормальных условиях занимают один и тот же объем.
Ответ: 0,0026 м3.
Пример 21:
В сосуде вместимостью 2 м3 находится 2,4 кг газа. Под каким давлением находится газ, если средняя квадратичная скорость его молекул равна 500 м/с?
Решение от преподавателя:
Запишем основное уравнение молекулярно-кинетической теории (МКТ) идеального газа:
Также запишем формулу определения концентрации молекул газа n (это отношение количества молекул N к объему газа V):
Полученное подставим в формулу (1), тогда:
Заметьте, что произведение массы одной молекулы m0 на число молекул N равно массе газа m:
Посчитаем ответ:
Ответ: 0,1 МПа.
Пример 22:
Чему равна температура газа, если при концентрации 2,65·1025 м-3 он создает давление 98,8 кПа?
Решение от преподавателя:
Воспользуемся формулой связи давления p с концентрацией молекул n и абсолютной температурой газа T:
В этой формуле k – это постоянная Больцмана, равная 1,38·10-23 Дж/К. Из этой формулы выразим искомую температуру T:
Посчитаем численный ответ задачи:
Ответ: -3°C.
Пример 23:
Плотность газа в баллоне электрической лампы 0,9 кг/м3, давление при горении 110 кПа. Вычислить среднюю квадратичную скорость молекул газа.
Решение от преподавателя:
Основное уравнение молекулярно-кинетической теории (МКТ) идеального газа записывается так:
Распишем в этой формуле концентрацию nn как отношение количества молекул N к объему газа V:
Произведение массы одной молекулы m0 на число молекул N дает массу газа m, поэтому:
Отношение массы газа m к объему газа V – это плотность газа ρ, значит:
Выразим искомую среднеквадратичную скорость υкв:
Посчитаем численный ответ к задаче:
Ответ: 2180 км/ч.
Пример 24:
Определить число молекул, содержащихся в 1 г воды.
Решение от преподавателя:
В одном моле любого вещества содержится одинаковое число молекул, равное числу Авогадро NА. Поэтому, чтобы определить число молекул N, нужно количество вещества νν умножить на число Авогадро NА, т.е. применить такую формулу:
Число Авогадро NА равно 6,022·1023 1/моль (это физическая постоянная). Количество вещества легко определить по формуле:
Здесь M – это молярная масса воды, равная 0,018 кг/моль. Итоговая формула примет вид:
Переведем массу воды mm в систему СИ:
Произведем вычисления:
Ответ: 3,35·1022.
Пример 25:
При какой температуре находится одноатомный газ, если средняя кинетическая энергия его молекулы равна 8·10-20 Дж?
Решение от преподавателя:
Среднюю кинетическую энергию поступательного движения молекулы одноатомного газа Eк можно определить по такой формуле:
В этой формуле k – постоянная Больцмана, равная 1,38·10-23 Дж/К. Выразим из формулы искомую температуру T:
Выразим из формулы искомую температуру T:
Произведем вычисления:
Ответ: 3865 К.
Пример 26:
Определить количество вещества, содержащегося в медной отливке массой 96 кг.
Решение от преподавателя:
Чтобы определить количество вещества ν, нужно найти отношение массы вещества m к молярной массе вещества M.
Молярная масса меди (Cu) равна 0,064 кг/моль. Посчитаем ответ:
Ответ: 1500 моль.
Пример 27:
Под каким давлением находится кислород в баллоне, если при температуре 27° C его плотность 6,44 кг/м3?
Решение от преподавателя:
Запишем уравнение Клапейрона-Менделеева:
Поделим обе части уравнения на объем газа V, получим:
Тогда в правой части имеем отношение массы газа m к его объему V, что равно плотности ρ:
Молярная масса кислорода O2 M равна 0,032 кг/моль, универсальная газовая постоянная R – 8,31 Дж/(моль·К). Переведем температуру t в Кельвины и посчитаем ответ:
Ответ: 500 кПа.
Пример 28:
В комнате размером 4x5x2,7 м3 испарился кристаллик йода массой 20 мг. Сколько молекул йода оказалось в 1 см3 воздуха комнаты при условии их равномерного распределения? Молярная масса йода равна 127 г/моль.
Решение от преподавателя:
В случае равномерного распределения молекул йода по объему комнаты число его молекул N0 в объеме V0 можно определить через концентрацию nn по формуле:
Концентрация молекул nn равна отношению количества всех молекул йода N к объему комнаты V:
Объем комнаты V легко найти как объем прямоугольного параллелепипеда:
V=abc
Число всех молекул N найдем как произведение количества вещества ν на число Авогадро NА:
Количество вещества νν равно отношению массу всего йода mm к молярной массе йода M. Учитывая, что молярная масса M молекулярного йода I2 в два раза больше молярной массы M0 атомарного йода I, указанной в условии, имеем:
В итоге, если подставить все приведенные формулы в формулу (1), получим:
Число Авогадро равно 6,022·1023 моль-1. Переведем некоторые величины в систему СИ:
Переведем некоторые величины в систему СИ:
Посчитаем численный ответ:
Ответ: 8,8·1011.
Пример 29:
Найдите отношение средних скоростей молекул O2 и H2 при одинаковой температуре.
Решение от преподавателя:
Вообще, среднюю квадратичную скорость молекул газа можно определить по формуле:
В этой формуле R – универсальная газовая постоянная, T – абсолютная температура газа, M – молярная масса газа. Из формулы видно, что скорость молекул газа тем больше, чем меньше его молярная масса. Тогда отношение скоростей молекул водорода к молекулам кислорода равно:
Так как по условию T1=T2, то:
Молярная масса водорода H2 M1 равна 0,002 кг/моль, кислорода O2 M2 равна 0,032 кг/моль. Посчитаем ответ:
Ответ: 4.
Пример 30:
В лабораторных условиях создан высокий вакуум, то есть очень малое давление, равное 1,33 нПа. Сколько молекул остается при этом в 1 м3 газа? Температуру принять равной 293 К.
Сколько молекул остается при этом в 1 м3 газа? Температуру принять равной 293 К.
Решение от преподавателя:
Вспомним формулу связи давления идеального газа pp с концентрацией его молекул nn и абсолютной температурой T:
Присутствующая в формуле постоянная Больцмана k равна 1,38·10-23 Дж/К. Концентрация nn равна отношению количества всех молекул газа N на объем V, который газ занимает:
Тогда формула (1) станет такой:
Откуда искомое число молекул N равно:
Число молекул газа N – это безразмерная величина.
Ответ: 3,3·1011.
Пример 31:
Какова плотность сжатого воздуха при 0° C в камере шины автомобиля “Волга”? Давление 0,17 МПа.
Решение от преподавателя:
Применим уравнение Клапейрона-Менделеева:
Поделим обе части уравнения на объем V, тогда получим:
Отношение массы m к объему V есть плотность газа ρ, заменив в правой части равенства это отношение на плотность, получим:
Теперь выразим искомую величину, в итоге имеем такую формулу:
Молярная масса воздуха MM равна 0,029 кг/моль. Заметьте, что её нельзя определить с помощью таблицы Менделеева, так как воздух – это смесь газов. Переведем температуру tt в шкалу Кельвина:
Заметьте, что её нельзя определить с помощью таблицы Менделеева, так как воздух – это смесь газов. Переведем температуру tt в шкалу Кельвина:
Посчитаем ответ:
Ответ: 2,17 мг/см3.
Пример 32:
Определить молярную массу газа, если его плотность при нормальных условиях равна 0,09 кг/м3.
Решение от преподавателя:
Запишем уравнение Клапейрона-Менделеева:
Плотность газа ρ, как и любого другого вещества, находят по формуле:
Тогда формула (1) примет следующий вид:
Выразим отсюда искомую молярную массу газа M:
Напомним, что при нормальных условиях давление pp равно 100 кПа, а температура T – 0° C или 273 К. Универсальная газовая постоянная равна 8,31 Дж/(моль·К). Считаем ответ:
По полученной молярной массе легко догадаться, что это водород H2.
Ответ: 2 г/моль.
Пример 33:
Определить среднюю квадратичную скорость молекул азота при температуре 27° C?
Решение от преподавателя:
Среднюю квадратичную скорость молекул идеального газа υквυкв определяют по такой формуле:
В этой формуле R – универсальная газовая постоянная, равная 8,31 Дж/(моль·К), M – молярная масса газа, равная у азота 0,028 кг/моль. Переведем данную в условии температуру из шкалы Цельсия в шкалу Кельвина:
Переведем данную в условии температуру из шкалы Цельсия в шкалу Кельвина:
Посчитаем ответ:
Ответ: 0,5 км/с.
Пример 34:
Найти число молекул в 2 кг углекислого газа.
Решение от преподавателя:
Число молекул N находят по следующей формуле:
В этой формуле ν – количество вещества, а NА – число Авогадро, равное 6,022·1023 моль-1. Количество вещества ν найдем по следующей известной формуле:
Молярная масса M углекислого газа (CO2) равна 0,044 кг/моль. В итоге Вы должны получить такую формулу:
Посчитаем численный ответ:
Ответ: 2,74·1025.
Пример 35:
Определить плотность воздуха при нормальных условиях. Молярную массу принять равной 29 г/моль.
Решение от преподавателя:
Нормальные условия (н.у) – это:
давление p, равное приближенно атмосферному, т.е. 100 кПа;
температура T, равная 0° C или 273 К.
Запишем уравнение Клапейрона-Менделеева:
В уравнении M – это молярная масса газа, в данном случае воздух. Поделим обе части уравнения на объем газа V:
Поделим обе части уравнения на объем газа V:
Отношение m\V в правой части есть плотность газа ρ, поэтому:
Откуда плотность воздуха ρ равна:
Переведем молярную массу газа в систему СИ:
Посчитаем ответ:
Ответ: 1,28 мг/см3.
Пример 36:
Во сколько раз масса молекулы углекислого газа CO2 больше массы молекулы аммиака NH3?
Решение от преподавателя:
В общем случае массу одной молекулы m можно найти по такой формуле:
В этой формуле M – молярная масса вещества (т.е. масса 1 моля вещества), а NА – число Авогадро (количество молекул в 1 моле любого вещества). Тогда отношение масс молекул углекислого газа и аммиака равно:
Молярная масса углекислого газа CO2 M1 равно 0,044 кг/моль, а аммиака NH3 M2 – 0,017 кг/моль. Таким образом, отношение масс молекул равно:
Ответ: 2,59.
Пример 37:
За 20 суток из стакана полностью испарилась 0,2 кг воды. Сколько в среднем молекул вылетало с поверхности воды за 1 с?
Сколько в среднем молекул вылетало с поверхности воды за 1 с?
Решение от преподавателя:
Если скорость испарения, то есть количество молекул, вылетающее с поверхности воды за единицу времени, всегда постоянна, тогда справедливо следующее равенство:
Откуда получим:
Общее количество молекул воды N в массе m найдем по формуле:
Здесь NА – число Авогадро (оно равно 6,022·1023 моль-1), а ν – количество вещества, которое определяют по следующему выражению:
В этой формуле M – молярная масса воды, её легко определить по таблице Менделеева, зная химическую формулу вещества. Для воды (H2O) молярная масса равна 0,018 кг/моль. В итоге мы получим такую формулу:
Переведем время T, данное в сутках, в секунды:
Посчитаем ответ:
Ответ: 3,87·1018.
Пример 38:
Считая, что диаметр молекул водорода составляет около 0,23 нм, подсчитать, какой длины получилась бы нить, если бы все молекулы, содержащиеся в 1 мг этого газа, были расположены в один ряд вплотную друг к другу.
Решение от преподавателя:
Длину получившейся нити L можно найти, перемножив количество молекул водорода N на диаметр одной молекулы d:
Количество молекул N найдем по такой формуле:
Из последней формулы видно, что нам знать, какое количество вещества ν содержится в массе m. Это можно определить по формуле:
Молярная масса водорода (H2) M равна 0,002 кг/моль. Подставляя поочерёдно одно выражение в другое, Вы получите такую окончательную формулу:
Переведем массу m в систему СИ и посчитаем ответ:
Ответ: 69,25 Гм.
Пример 39:
В сосуде находится газ под давлением 150 кПа при температуре 23° C. Найти концентрацию молекул.
Решение от преподавателя:
Запишем формулу связи давления pp идеального газа с концентрацией молекул nn и абсолютной температурой T:
В этой формуле k – постоянная Больцмана, равная 1,38·10-23 Дж/К. Выразим из этой формулы искомую концентрацию n:
Обратите свое внимание, что в формуле фигурирует абсолютная температура, поэтому переведем данную в условии температуру в шкалу Кельвина:
23∘C=296К
Произведем вычисления:
Ответ: 3,67·1025 м-3.
Пример 40:
Определить среднюю квадратичную скорость молекул водорода при нормальных условиях.
Решение от преподавателя:
Решение задачи: Кинетическую энергию поступательного движения молекул газа можно определять по двум формулам:
Приравняем эти два выражения и выразим среднюю квадратичную скорость υкв:
Массу одной молекулы m0m0 можно узнать, если разделить молярную массу M на число Авогадро NА:
Молярная масса водорода (H2) равна 0,002 кг/моль. В таком случае формула (1) примет такой вид: э
Известно, что произведение двух постоянных – постоянной Больцмана k и числа Авогадро NА – дают в результате универсальную газовую постоянную R, равную 8,31 Дж/(моль·К). Таким образом, получим:
Нормальным условиям соответствует давление p, равное (приближенно) атмосферному, то есть 100 кПа, и температура T, равная 0° C или 273 К. Считаем ответ:
Ответ: 1,8 км/с.
Пример 41:
Под каким давлением находится кислород в баллоне, если при температуре 27° C его плотность 6,24 кг/м3?
Решение от преподавателя:
Применим уравнение Клапейрона-Менделеева:
Молярная масса кислорода (O2) MM равна 0,032 кг/моль. Разделим обе части уравнения на объем V:
Отношение массы m к объему V равно плотности газа ρ, поэтому:
Переведем температуру в абсолютную шкалу температур и посчитаем ответ:
27∘C=300К
Ответ: 0,49 МПа.
Пример 42:
При какой температуре средняя квадратичная скорость молекул кислорода достигнет 600 м/с?
Решение от преподавателя:
Среднюю квадратичную скорость молекул идеального газа υквυкв можно найти по такой формуле:
В этой формуле R – это универсальная газовая постоянная, равная 8,31 Дж/(моль·К), M – молярная масса газа, равная у кислорода 0,032 кг/моль. Выразим из формулы искомую температуру кислорода T:
Численно эта температура равна:
Ответ: 462,1 К.
Решение OpenStax College Physics для курсов AP®, глава 13, задача 3 (подготовка к экзамену для курсов AP®)
Chapter 13 question:
1PE2PE3PE4PE5PE6PE7PE8PE9PE10PE11PE12PE13PE14PE15PE16PE17PE18PE19PE20PE21PE22PE23PE24PE25PE26PE27PE28PE29PE30PE31PE32PE33PE34PE35PE36PE37PE38PE39PE40PE41PE42PE43PE44PE45PE46PE47PE48PE49PE50PE51PE52PE53PE54PE55PE56PE57PE58PE59PE60PE61PE62PE63PE64PE65PE66PE67PE68PE69PE70PE71PE72PE1AP2AP3AP4AP5AP6AP7AP8AP
Изменить главуРасширенный поиск
Вопрос
Два образца идеального газа в разных сосудах имеют одинаковое количество молекул и одинаковую температуру, но молекулярная масса газа X больше, чем у газа Y. Что из следующего верно сравнивает среднюю скорость молекул газов и среднюю силу, с которой газы действуют на соответствующие сосуды?
| Средняя скорость молекул | Средняя сила на контейнере | |
|---|---|---|
| (а) | Больше для газа X | Больше для газа X |
| (б) | Больше для газа X | Силы нельзя сравнивать, не зная объемов газов. |
| (с) | Больше для газа Y | Больше для газа Y |
| (г) | Больше для газа Y | Силы нельзя сравнивать, не зная объемов газов. |
Вопрос от OpenStax находится под лицензией СС BY 4.0.
Окончательный ответ
Видеорешение
Зарегистрируйтесь, чтобы просмотреть это видеорешение!
Начать бесплатную неделю
Trustpilot
Рейтинг
ПлохоНе так уж плохоСреднеХорошоОчень хорошо
0 голосов со средним рейтингом .
Стенограмма видео
Это ответы по физике в колледже с Шоном Дычко. Итак, у нас есть два образца идеальных газов, что означает, что эти формулы закона идеального газа применимы. В двух сосудах одинаковое количество молекул, значит, 9.0077 и то же самое, то же количество молей. Теперь та же температура, но молекулярная масса газа X больше, чем у газа Y . Это означает, что масса одной молекулы X больше массы одной молекулы газа Y . Таким образом, с большей массой для X у него будет меньше Vrms , потому что, увеличивая этот знаменатель, вы собираетесь уменьшать частное. Таким образом, газ Y будет иметь более высокое значение Vrms 9.0078, потому что он имеет более низкую молекулярную массу. Итак, это сужает наши варианты до c или d. И следующая часть вопроса заключается в том, как сравнить среднюю силу газа в соответствующем контейнере. Таким образом, средняя сила в контейнере — это еще один способ сказать давление. Итак, мы нашли здесь давление, разделив обе стороны на V в нашей формуле pV равно nRT . Итак, у нас одинаковое количество молей, одинаковое количество молекул, одна и та же газовая постоянная, одна и та же температура, но мы не знаем, каковы объемы контейнеров. Нам не говорят, что контейнеры имеют одинаковый объем. И поэтому мы не можем сравнивать давления. И поэтому ответ д.
Это означает, что масса одной молекулы X больше массы одной молекулы газа Y . Таким образом, с большей массой для X у него будет меньше Vrms , потому что, увеличивая этот знаменатель, вы собираетесь уменьшать частное. Таким образом, газ Y будет иметь более высокое значение Vrms 9.0078, потому что он имеет более низкую молекулярную массу. Итак, это сужает наши варианты до c или d. И следующая часть вопроса заключается в том, как сравнить среднюю силу газа в соответствующем контейнере. Таким образом, средняя сила в контейнере — это еще один способ сказать давление. Итак, мы нашли здесь давление, разделив обе стороны на V в нашей формуле pV равно nRT . Итак, у нас одинаковое количество молей, одинаковое количество молекул, одна и та же газовая постоянная, одна и та же температура, но мы не знаем, каковы объемы контейнеров. Нам не говорят, что контейнеры имеют одинаковый объем. И поэтому мы не можем сравнивать давления. И поэтому ответ д. Силы нельзя сравнивать, не зная объемов газов.
Силы нельзя сравнивать, не зная объемов газов.
1PE2PE3PE4PE5PE6PE7PE8PE9PE10PE11PE12PE13PE14PE15PE16PE17PE18PE19PE20PE21PE22PE23PE24PE25PE26PE27PE28PE29PE30PE31PE32PE33PE34PE35PE36PE37PE38PE39PE40PE41PE42PE43PE44PE45PE46PE47PE48PE49PE50PE51PE52PE53PE54PE55PE56PE57PE58PE59PE60PE61PE62PE63PE64PE65PE66PE67PE68PE69PE70PE71PE72PE1AP2AP3AP4AP5AP6AP7AP8AP
Два сосуда А и В содержат один и тот же идеальный газ. Объем B вдвое больше объема A, давление в B вдвое больше, чем в A, а температура B вдвое больше, чем в A. Отношение числа молекул газа в A и B равно 9.0001
Вопрос
Вопрос
Полные отметки и термодинамика-аддициониционные вопросы решены (I. Выберите правильный ответ из следующего)
20 видеоРеклама
Ab Padhai Karo Bina Ads Ke
Kareedo DN Pro and Dekho De и Dekho dkho ke
DN Pro and Dekho d сари видео бина kisi ad ki rukaavat ke!
Обновлено: 27-06-2022
Текст Решение
Ответ
Правильный ответ
Решение
Число родинок в A равно, nA=PVRT
Количество молей в B is, nB=(2P)(2V)R(2T)=2nA
nA:nB=1:2
Ответ
Пошаговое решение, разработанное экспертами, чтобы помочь вам сомневаться в чистоте и оценке отлично оценки на экзаменах.
Видео по теме
Объем сосуда А в два раза больше объема сосуда В. Оба заполнены одним и тем же газом. Если газ в А имеет вдвое большую температуру и вдвое большее давление, чем газ в В, каково соотношение молекул газа в А и В?
12009091
Объем сосуда А в два раза больше объема другого сосуда В, и оба они заполнены одним и тем же газом. Если газ в А имеет удвоенную температуру и удвоенное давление по сравнению с газом в В, каково отношение числа молекул газа в А и В?
12009155
Контейнеры A и B содержат одинаковые газы. Давление, объем и температура газа А в два раза больше, чем у В, тогда отношение количества молекул А и В равно
12225693
Плотность газа А в два раза больше плотности газа В при той же температуре молекулярный вес газа B в два раза больше, чем A. Отношение давлений газа A и B будет:
14624195
Контейнеры A и B содержат одинаковые газы. Давление, объем и температура А в два раза больше, чем у В, тогда отношение количества молекул А и В равно 9. 0003
0003
23584541
Контейнеры A и B содержат одинаковый газ. Давление, объем и температура A в два раза больше, чем у B., тогда соотношение количества молекул A и B составляет
744446226
एक ब ब ब क आयतन दूस दूस ब ब ब से गुन एक तथ तथ दोनों एक ही गैस गैस गैस ही गैस ही ही गैस गैस ही गैस गैस गैस गैस गैस दूस दूस दूस दूस दूस दूस दूस दूस गैस दूस दूस दूस दूस दूस ही दूस ही दूस एक एक एक में आयतन आयतन आयतन आयतन आयतन आयतन भरी है। यदि बर्तन a की ब बर्तन b की गैस के स स स स स स दोगुने त त व दोगुने द द प है तो a व b में के अणुओं क क काब अनुप है तो व व में के अणुओं क क काब अनुप है तो व व में के अणुओं क क क क अनुप अनुप है व व में के अणुओं क क क क क अनुप अनुप है तो व व गैस अणुओं अणुओं क क क क क क क क क क क क क क क क क क क क क क क क अणुओं
76226664
Контейнеры A и B содержат одинаковые газы. Давление, объем и температура А в два раза больше, чем у В, тогда отношение количества молекул А и В равно 9.0003
127322530
Контейнеры A и B содержат одинаковый газ.