Молярность | Задача 1 — 3
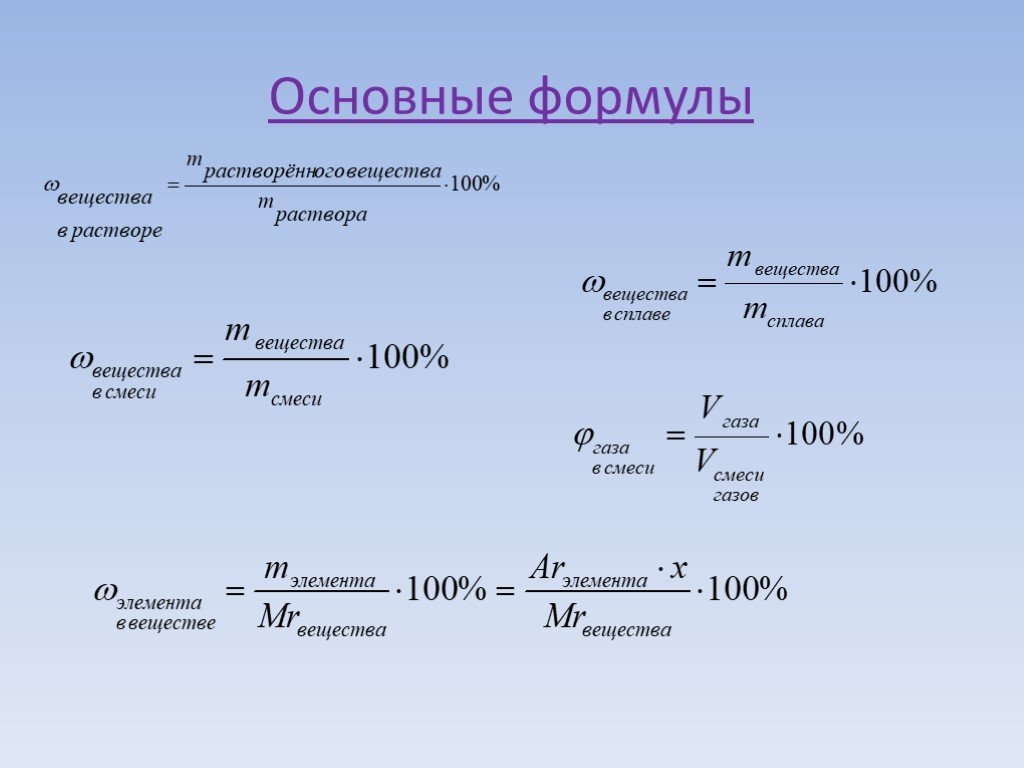
Молярность (molarity) — способ выражения концентрации, показывающей количество растворенного вещества (n, моль) в единице объема раствора (1 литр). В отличие от массовой и мольной доли, молярность имеет единицы измерения. В случае использования в качестве меры объема литров, молярность измеряется в «моль/литр»1. Обозначается молярность — «См».
Для вычисления молярной концентрации раствора (молярности) используется формула:
Задача 1.
24 г чистой серной кислоты растворили в 85 г воды. Определить молярную концентрацию серной кислоты в полученном растворе, если его плотность составляет 1,155 г/мл.
Дано:
масса серной кислоты: m(Н2SО4) = 24 г;
масса воды: m(Н2О) = 85 г;
плотность раствора: рр-ра = 1,155 г/мл.
Найти:
молярную концентрацию серной кислоты в растворе.
Решение:
Для определения молярной концентрации необходимо вычислить количество (п, моль) растворенного вещества (Н2SО4) и объем раствора.
Схематично алгоритм решения можно представить следующим образом:
1. Определим количество вещества серной кислоты:
2. Определим объем раствора:
Объем, выраженный в других единицах, для определения молярной концентрации всегда необходимо переводить в литры.
Подставим в формулу для вычисления молярной концентрации полученные данные:
CМ = n(H2SO4)/V(p-pa) = 0,245/0,09437 = 2,6 моль/л.
Ответ: СМ(Н2SO4) = 2,6 моль/л.
Задача 2.
Определить массу гидроксида натрия в 700 г 14,ЗМ раствора NаОН в воде (рр-ра = 1,43 г/мл).
Дано:
масса раствора гидроксида натрия в воде : mр-ра = 700 г;
молярная концентрация гидроксида натрия в растворе: См(NаОН) = 14,3 моль/л,
плотность раствора: рр-ра= 1,43 г/мл.

Найти:
массу гидроксида натрия.
Решение:
Схематично алгоритм решения можно представить так:
1. Определим объем 700 г раствора
Обращайте, пожалуйста, внимание на согласованность единиц измерения величин, подставляемых в формулу. Если плотность выражена в г/мл или г/см3, то объем необходимо использовать в миллилитрах, а массу в граммах. Для использования молярной концентрации объем необходимо переводить в литры.
2. Используя соотношение для молярной концентрации, определим количество вещества NаОН в 0,4895 л раствора.
3. Определим массу 7 моль NаОН:
m(NaOH) = n(NaOH) . M(NaOH) = 7 .40 =280 г.
Ответ: m(NaOH) = 280 г.
Задача 3.
3 г поваренной соли (NаС1) растворили в 200 г воды. Определить молярную концентрацию полученного раствора.
Дано:
масса поваренной соли: m(NаС1) = 3 г;
масса воды: m(Н2О) = 200 г.
Найти:
молярную концентрацию поваренной соли в растворе.
Решение:
Схематично алгоритм решения можно представить следующим образом:
1 . Определяем количество вещества NаС1:
2. Для вычисления молярной концентрации необходимо знать объем раствора. Но по данным из условия задачи, возможно определить только его массу:
mр-ра = m(NаС1) + mН2
О) = 3 + 200 = 203 г.3. Для нахождения объема раствора требуется плотность. При необходимости очень точного расчета можно воспользоваться справочником физико-химических величин. В случае решения обычной задачи разумно принять плотность разбавленного водного раствора равной плотности воды2.
Определим молярную концентрацию NаС1 в растворе:
Ответ: 0,24моль/л.
Комментарии:
1Иногда для сокращения записи после значения молярной концентрации вместо размерности записывают заглавную букву (М). Например, запись « 0.03М раствор NаОН в воде» следует понимать так: молярная концентрация NаОН в воде равна 0,03 моль/л.
Например, запись « 0.03М раствор NаОН в воде» следует понимать так: молярная концентрация NаОН в воде равна 0,03 моль/л.
2Справочное значение плотности данного раствора равно 1,009 г/мл.
Способы выражения концентрации растворов. Решение простейших задач — NovaInfo 135
- Зачиняев Я.В.
Петрозаводский государственный университет
доктор химических наук, доктор биологических наук, профессор, академик Петровской академии наук и искусств
Опубликовано
Раздел: Химические науки
Язык: Русский
Просмотров за месяц: 6
CC BY-NC
Аннотация
Важнейшей характеристикой любого раствора (жидкого, твёрдого или газового) является его концентрация. Концентрация раствора показывает, в каком соотношении находятся растворенное вещество и растворитель. Это соотношение может быть показано разными способами. Очевидно, что изучение данной темы (способы выражения концентрации растворов) следует начинать с решения простейших задач (после изложения теории).
Концентрация раствора показывает, в каком соотношении находятся растворенное вещество и растворитель. Это соотношение может быть показано разными способами. Очевидно, что изучение данной темы (способы выражения концентрации растворов) следует начинать с решения простейших задач (после изложения теории).
Ключевые слова
РАСТВОРЁННОЕ ВЕЩЕСТВО, КОНЦЕНТРАЦИИ РАСТВОРОВ, РЕШЕНИЕ ЗАДАЧ, ЗАДАЧИ ПО ХИМИИ, РАСТВОРИТЕЛЬ
Аудиоверсия
Текст научной работы
Ранее была опубликована наша статья, посвящённая решению задач по химии [1].
Ниже приведены решения простейших пяти задач на данную тему курса «Общая химия».
Задача 1
Определить массу соли, содержащейся в растворе объёмом 0,5 л, если массовая доля (процентная концентрация) соли в этом растворе 20%, а плотность раствора 1,2 г/мл.
Решение
Рисунок 1. Решение задачи 1Ответ
m (соли) = 120 г.
Задача 2
Определить молярную концентрацию раствора, в 500 мл которого содержится 0,5 г серной кислоты.
Решение
Рисунок 2. Решение задачи 2Ответ
С = 0,01 моль/л.
Задача 3
Определить моляльную концентрацию раствора, приготовленного из 4 г гидроксида калия и 200 г воды.
Решение
M(KOH)=39+17=56 (г/моль).
b=\frac{m_0}{M\cdot m_1}, где m_1 — m вещества; M — M вещества, m_2 — m растворителя.
Следовательно, b=\frac{m(KOH)}{M(KOH)\cdot m(H_2O)}=\frac{4}{56\cdot0,2}=\frac{4}{11,2}=0,36 (моль/кг).
Ответ
b=0,36 моль/кг.
Задача 4
Определить титр раствора, в 150 мл которого содержится 7,5 г вещества.
Решение
Т=\frac{m}{V}=\frac{7,5}{150}=0,05 г/мл, где m — m вещества; V — V раствора.
Ответ
Т=0,05 г/мл.
Задача 5
К воде массой 200 г прилили 2М раствор хлорида калия объёмом 40 мл и плотностью 1,09 г/мл. Определить молярную концентрацию и массовую долю соли в полученном растворе, если его плотность оказалась равна 1,015 г/мл.
Решение
m=\rho\cdot V=1,09\cdot 40=43,6 г раствора.
2 моля KCl — 1000 мл раствора
x моль KCl — 40 мл раствора
x=\frac{80}{1000}=0,08 (моль) KCl
M(KCl)=39+35,5=74,5 (г/моль).
1 моль KCl — 74,5 г
0,08 моль KCl — x г
x=74,5\cdot 0,08=5,96 (г) KCl.
m=200 H_2О+43,6 г раствора г. нового раствора
В 243,6 г раствора содержится 5,96 г KCl,
а в 100 г раствора x=\frac{596}{243,6}=2,45\% (ответ).
V=\frac{m}{\rho}=\frac{243,6}{1,015}=240 мл раствора.
0,08 моль KCl — 240 мл раствора
x моль KCl — 1000 мл раствора
x=\frac{0,08\cdot 1000}{240}=0,33 моль/л (ответ).
Ответ
0,33 моль/л и 2,45%.
Читайте также
Решение задач по химии
- Зачиняев Я.В.
- Ковалёва Л.И.
- Зачиняева А.В.
Методика обучения решению задач на нахождение четвертого пропорционального в начальной школе
- Мазлова С.
 А.
А.
- Мазлова С.
Алгоритм обучения детей младшего школьного возраста решению составных текстовых задач на цену, количество, стоимость
- Воронкова А.А.
Особенности обучения детей младшего школьного возраста решению составных текстовых задач на определение цены, количества, стоимости
- Войтенкова Ю.М.
Основы использования и содержания рабочих лошадей в конехозяйствах. Некоторые эколого-гигиенические аспекты.
- Зачиняев Я.В.
- Матвеев О.Ю.
- Сергиенко С.С.
Список литературы
- Зачиняев Я.
 В., Ковалёва Л.И., Зачиняева А.В. Решение задач по химии // NovaInfo. — 2021. — № 129. — С. 74-76.
В., Ковалёва Л.И., Зачиняева А.В. Решение задач по химии // NovaInfo. — 2021. — № 129. — С. 74-76.
Цитировать
Зачиняев, Я.В. Способы выражения концентрации растворов. Решение простейших задач / Я.В. Зачиняев. — Текст : электронный // NovaInfo, 2022. — № 135. — С. 1. — URL: https://novainfo.ru/article/19487 (дата обращения: 01.03.2023).
Поделиться
ChemTeam: задачи с молярностью №1–10
ChemTeam: задачи с молярностью №1–10#1 — 10
Вернуться в меню решений
Перейти к молярности
Перейти к задачам на молярность #11-25
Перейти к задачам на молярность #26-35
Уравнения, которые я буду использовать:
M = моль растворенного вещества / литры раствора
и
MV = граммы / молярная массаКак правило, решение для молярности (M). Однако иногда это не так, так что имейте в виду. Учитель может преподавать задачи, в которых вычисляется молярность, но спрашивать объем в тестовом вопросе.
Примечание. Убедитесь, что внимательно следите за операциями умножения и деления. Например, посмотрите на ответ №8. Обратите внимание, что 58,443 находится в знаменателе справа, и вы получите окончательный ответ, выполнив 0,200 умножить на 0,100 умножить на 58,443.
Проблема №1: Морская вода содержит примерно 28,0 г NaCl на литр. Какова молярность хлорида натрия в морской воде?
Решение:
MV = граммы / молярная масса(x) (1,00 л) = 28,0 г / 58,443 г моль¯ 1
х = 0,4790993 М
до трех значащих цифр, 0,479 M
Задача № 2: Какова молярность 245,0 г H 2 SO 4 , растворенного в 1 000 л раствора?
Решение:
MV = граммы / молярная масса(x) (1,000 л) = 245,0 г / 98,0768 г моль¯ 1
x = 2,49804235 M
до четырех знаков, 2,498 М
Если бы объем был указан как 1,00 л (как это часто бывает в подобных задачах), ответ был бы 2,50 М, а НЕ 2,5 М.
Вам нужно три сиг фиги в ответе, а 2,5 — это всего два SF.
Задача №3: Какова молярность 5,30 г Na 2 CO 3 , растворенного в 400,0 мл раствора?
Решение:
MV = граммы / молярная масса(x) (0,4000 л) = 5,30 г / 105,988 г моль¯ 1
0,12501415 M
x = 0,125 M (до трех цифр)
Задача №4: Какова молярность 5,00 г NaOH в 750,0 мл раствора?
Решение:
MV = граммы / молярная масса(x) (0,7500 л) = 5,00 г / 39,9969 г моль¯ 1
(x) (0,7500 л) = 0,1250097 моль x = 0,1666796 M
х = 0,167 М (до трех SF)
Задача №5: Сколько молей Na 2 CO 3 содержится в 10,0 л 2,00 М раствора?
Решение:
M = моль растворенного вещества / литры раствора2,00 М = х / 10,0 л
х = 20,0 моль
Предположим, что молярность была указана как 2,0 M (две цифры).
Как отобразить ответ? Так:20 моль
Задача №6: Сколько молей Na 2 CO 3 содержится в 10,0 мл 2,0 М раствора?
Решение:
M = моль растворенного вещества / литры раствора2,0 М = х / 0,0100 л х = 0,020 моль
Задача №7: Сколько молей NaCl содержится в 100,0 мл 0,200 М раствора?
Решение:
0,200 М = х / 0,1000 лх = 0,0200 моль
Задача №8: Какой вес (в граммах) NaCl будет содержаться в задаче №7?
Решение:
(0,200 моль л¯ 1 ) (0,100 л) = х / 58,443 г моль¯ 1 х = 1,17 г (до трех SF)Вы могли бы сделать и это:
58,443 г/моль умножить на 0,0200 моль
Задача №9: Какой вес (в граммах) H 2 SO 4 потребуется для приготовления 750,0 мл 2,00 М раствора?
Решение:
(2,00 моль L¯ 1 ) (0,7500 л) = x / 98,0768 г Mol¯ 1x = (2,00 моль L¯ 1 ) (0,7500 л) (98,0768 г мол 1 )
х = 147,1152 г
инжир до трех знаков, 147 г
Задача №10: Какой объем (в мл) 18,0 M H 2 SO 4 необходим для содержания 2,45 г H 2 СО 4 ?
Решение:
(18,0 моль л¯ 1 ) (x) = 2,45 г / 98,0768 г моль¯ 1(18,0 моль л¯ 1 ) (x) = 0,0249804235 моль
х = 0,0013878 л
Выше приведен ответ в литрах.
Умножение ответа на 1000 дает требуемое значение мл:
0,0013878 л раз (1000 мл / л) = 1,39 мл (приведено к трем цифрам)
Перейти к задачам на молярность #11-25
Перейти к задачам на молярность #26-35
Перейти к молярности
Вернуться в меню решений
Наборы задач на молярность и решения
Наборы задач || Обзор Molarity and Solutions
У нас есть 14 готовых наборов задач на тему Молярность и Решения. Эти наборы задач сосредоточены на использовании концепции концентрации (в частности, молярности) при анализе ситуаций, связанных с образованием раствора, разбавлением и стехиометрией раствора. Проблемы будут варьироваться от очень простого «подключи и пей» до более сложного анализа реакций, связанных с решениями.
Щелкните ссылку, чтобы открыть общедоступный набор задач. Если вы являетесь студентом системы отслеживания задач, откройте задание по ссылке на доске заданий системы отслеживания задач.
Набор задач MS1: Кривые растворимости 1
Используйте кривую растворимости различных веществ, растворяющихся в воде при различных температурах, чтобы ответить на вопросы, касающиеся ненасыщенных, насыщенных и перенасыщенных растворов. Включает в себя 5 задач, состоящих из нескольких частей.
Набор задач MS2: Кривые растворимости 2
Используйте кривую растворимости для трех вымышленных растворенных веществ, растворяющихся в воде при различных температурах, чтобы ответить на вопросы, относящиеся к ненасыщенным, насыщенным и перенасыщенным растворам. Включает в себя 5 задач, состоящих из нескольких частей.
Набор задач MS3: Концентрация – Массовые проценты
Используйте информацию о массе, молях, объеме и плотности растворенного вещества для выполнения расчетов, связанных с массовым процентом этого растворенного вещества в водных растворах. Включает 6 задач.
Включает 6 задач.
Набор задач MS4: Концентрация – Введение в молярность
Используйте понятие молярности, чтобы связать число молей растворенного вещества, объем раствора и молярность растворенного вещества. Номера нежные номера. Включает в себя 5 задач, состоящих из нескольких частей.
Набор задач MS5: Расчет молярности 1
Соотнесите массу растворенного вещества, количество молей растворенного вещества и объем раствора с молярностью раствора. Включает в себя 4 задачи, состоящие из нескольких частей.
Набор задач MS6: Расчет молярности 2
Используйте информацию о массе растворенного вещества, количестве молей растворенного вещества и объеме раствора для расчета молярной концентрации. Включает 6 задач.
Набор задач MS7: Расчеты молярности 3
Выполните расчеты, касающиеся массы растворенного вещества, числа молей растворенного вещества, объема раствора и молярной концентрации. Включает 6 задач.
Включает 6 задач.
Набор задач MS8: Концентрация ионов 1
Используйте информацию о концентрации ионного растворенного вещества, чтобы определить концентрацию его диссоциированных ионов в растворе. В большинстве случаев приводится уравнение диссоциации. Включает 6 задач.
Набор задач MS9: Концентрация ионов 2
Используйте информацию о молярности ионного растворенного вещества (например, массу растворенного вещества, моли растворенного вещества и объем раствора) для определения концентрации его диссоциированных ионов в растворе. Включает 7 задач.
Набор задач MS10: Задачи на разбавление 1
Проанализируйте ситуацию, связанную с разбавлением раствора, чтобы связать число молей, объем и молярность исходного и разбавленного раствора. Большинство проблем надуманы.

 А.
А. В., Ковалёва Л.И., Зачиняева А.В. Решение задач по химии // NovaInfo. — 2021. — № 129. — С. 74-76.
В., Ковалёва Л.И., Зачиняева А.В. Решение задач по химии // NovaInfo. — 2021. — № 129. — С. 74-76.
 Вам нужно три сиг фиги в ответе, а 2,5 — это всего два SF.
Вам нужно три сиг фиги в ответе, а 2,5 — это всего два SF.
 Умножение ответа на 1000 дает требуемое значение мл:
Умножение ответа на 1000 дает требуемое значение мл: