Zinc metal reacts with hydrochloric acid according to the balance…
Recent Channels
- General Chemistry
Chemistry
- General Chemistry
- Organic Chemistry
- Analytical Chemistry
- GOB Chemistry
- Biochemistry
Биология
- Общая биология
- Микробиология
- Анатомия и физиология
- Генетика
- Cell Biology
Math
- College Algebra
- Trigonometry
- Precalculus
Physics
- Physics
Business
- Microeconomics
- Macroeconomics
- Financial Accounting
Social Sciences
- Psychology
Начните вводить текст, затем используйте стрелки вверх и вниз, чтобы выбрать вариант из списка.
- 8. Термохимия
- Энтальпия образования
Проблема
Соответствующее решение
2 м
Воспроизвести видео:
Всем привет. Итак, у нас есть реакция меди с разбавленной азотной кислотой с образованием нитрата меди. Модный диоксид и вода. Может быть 0,215 г куска металлической меди, смешанной с разбавленной азотной кислотой. Это 100 мл раствора. А температуру увеличенную с 23°С до 25,5°С добавляют для расчета значения энтропии реакции. Эта реакция у нас плотность одного основания. Главный лидер В определенном ключе 4,18 Дж на грамм, умноженный на градусы Цельсия. Это уравнение Q M C дельта T. Действуйте так, как будто тепло, поглощаемое раствором, — это то, что мы ожидаем. Нам тоже нужно их найти. Получение удельной теплоемкости 4.18. Эти программы измеряют градусы Цельсия и изменение температуры. Сейчас 25,5°C минус 23. Ребята, по Цельсию. Всего 2,5°С. Теперь нам нужно найти маску. У меня 100 мл. Они имеют плотность один г на одного самца.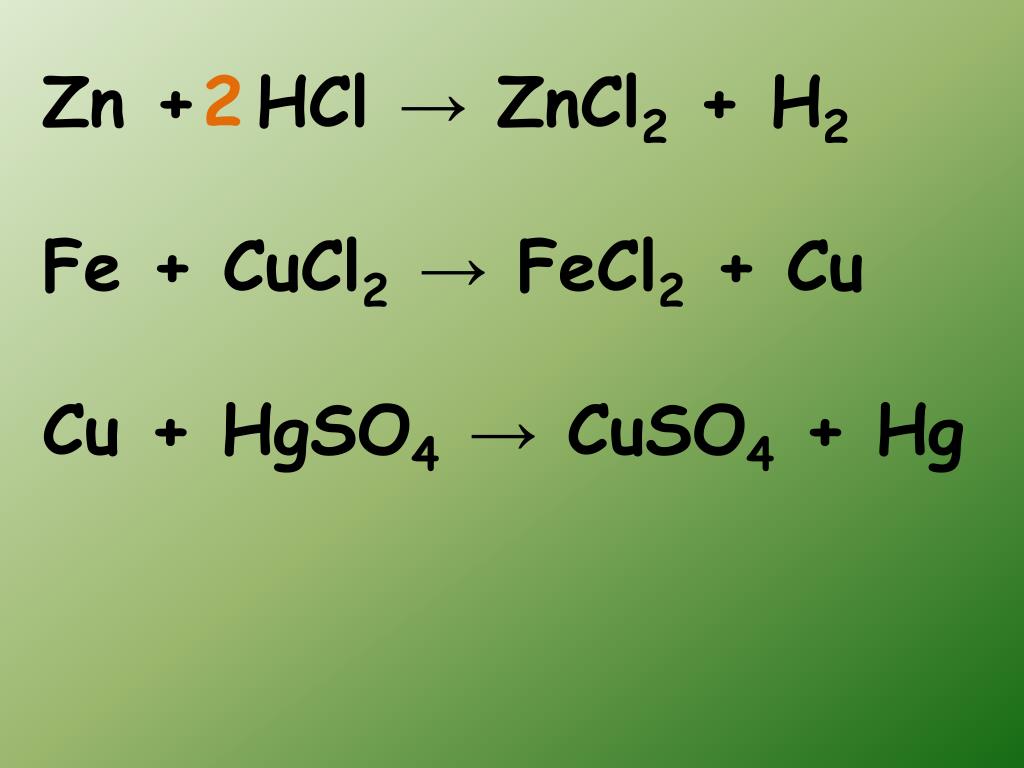 Позже мы получаем 100 оснований. Теперь мы можем найти теплоту, поглощаемую верхним раствором. Que Получить 100 г 4.18. Эти программы градусы Цельсия, это 2,5°C. Очень мило. Получите плюс 1045 камней Раствор впитается. 1045 голов тепла Реакция не менее. 1045 голов Из -1045 голов. У меня 0,215 грамма меди В одной миске меди При Молярной массе 0,55 грамма меди. У тебя 1000 голов в одной убийственной работе. Сделайте это 308 0,9. Спасибо за просмотр моего видео. И я надеюсь, что это было для.
Позже мы получаем 100 оснований. Теперь мы можем найти теплоту, поглощаемую верхним раствором. Que Получить 100 г 4.18. Эти программы градусы Цельсия, это 2,5°C. Очень мило. Получите плюс 1045 камней Раствор впитается. 1045 голов тепла Реакция не менее. 1045 голов Из -1045 голов. У меня 0,215 грамма меди В одной миске меди При Молярной массе 0,55 грамма меди. У тебя 1000 голов в одной убийственной работе. Сделайте это 308 0,9. Спасибо за просмотр моего видео. И я надеюсь, что это было для.
Похожие видео
Связанные практики
Энтальпия реакции
от Bozeman Science
103views
Что такое энтальпия?
от Ben’s Chem Video
108Views
Энтальпия Стоихиометрия Часть 1: Поиск тепла и массы
от Melissa Maribel
78Views
Entalpy of Formation
By Jules Bruno
. 0070 Энтальпия образования Пример 1
0070 Энтальпия образования Пример 1
по Жюлю Бруно
225views
Баланс между энтальпией и энтропией
Pearson
74views
Zn(s)2HCl(s)+2HCl(s)aq + h3 (г) 22,0 г Zn реагирует с 14,0 г HCl. На основании этой информации ответьте на следующие вопросы. Молярная масса (г/моль) цинк 65,38 HCl 36,46 ZnCl2 136,32 h3 2.02 1) Предельный реагент = 3) Максимальное количество водорода (в граммах), которое будет произведено из этой реакции = 4) Количество избыточного реагента (в граммах), оставшегося неиспользованным =
Вопрос
Пошаговый ответ
Рассмотрим следующую сбалансированную реакцию: Zn (т) + 2 HCl (водн.) ⟶ ZnCl2 (водн.) + h3 (г) 22,0 г Zn реагирует с 14,0 г HCl. Основываясь на этой информации, ответьте на следующие вопросы…
Рассмотрим следующую сбалансированную реакцию:
Zn (т) + 2 HCl (водн.) ⟶ ZnCl2 (водн.)
+ h3 (г)
22,0 г Zn реагирует с 14,0
г HCl. На основании этой информации ответьте на следующие
вопросы. Молярная масса (г/моль)
цинк
65,38
HCl
36,46
ZnCl2
136,32
h3
2.02
1) Предельный реагент =
3) Максимальное количество водорода (в граммах), которое будет произведено
от этой реакции =
4) Количество неиспользованного избыточного реагента (в граммах).
=
Молярная масса (г/моль)
цинк
65,38
HCl
36,46
ZnCl2
136,32
h3
2.02
1) Предельный реагент =
3) Максимальное количество водорода (в граммах), которое будет произведено
от этой реакции =
4) Количество неиспользованного избыточного реагента (в граммах).
=
Рекомендуемый AI ответ:
1) Рассчитайте молярную массу Zn и HCl. Zn: 65,38 г/моль HCl: 36,46 г/моль 2) Рассчитайте количество молей HCl.
Рекомендация видео с лучшим совпадением:
Решено проверенным экспертом
У нас нет заданного вами вопроса, но вот рекомендуемое видео, которое может помочь.
Вопрос о лучшем совпадении:
Когда 1,69 грамма Zn и 1,10 грамма HCl реагируют в соответствии с приведенной ниже реакцией, [«хлорид цинка», «цинк», «водород», «соляная кислота»] является ограничивающим реагентом, а возможное количество хлорида цинка составляет [» 2,06 г», «2,45 г», «2,30 г», «2,27 г», «4,11 г»].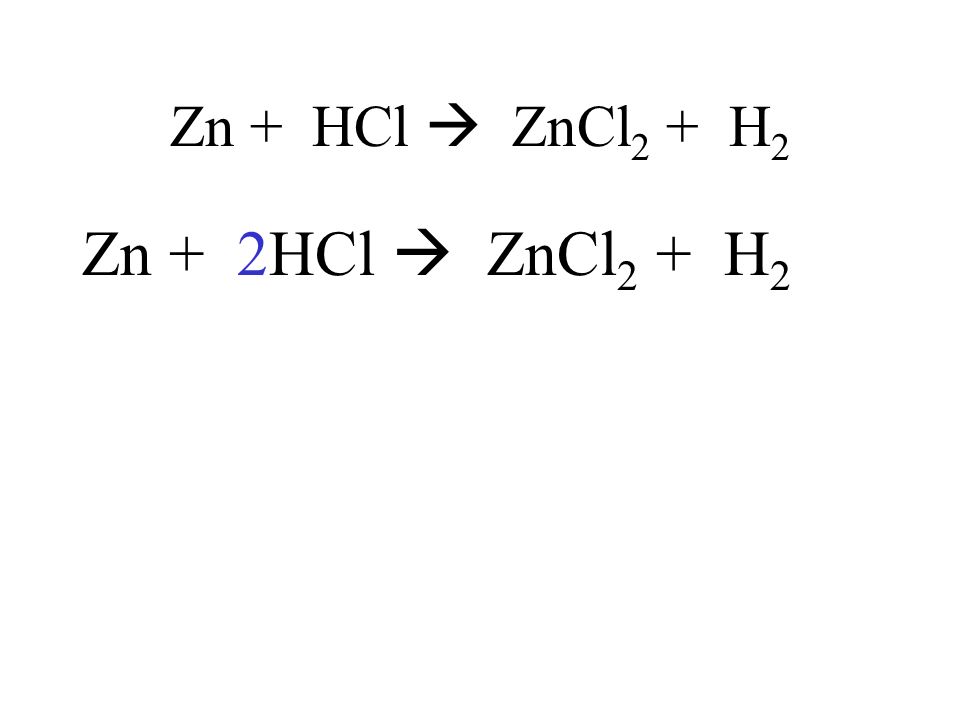
Рекомендуемые видеоролики
Расшифровка
Сбалансированная химическая реакция, которую мы рассматриваем для ответа на этот вопрос, — это цинк: твердое вещество реагирует с h, cl с образованием хлорида цинка и газообразного водорода. У нас есть 2 c и 2 водорода, потому что нам нужна 2 перед hc. Реакция содержит цинк и н ц л. Нам нужно знать, сколько хлорида цинка может быть получено из каждого реагента, который производит наименьшее количество. Количество продукта, которое он производит, будет ограничивающим реагентом. Граммы цинка будут преобразованы в моли цинка, чтобы произвести максимальное количество продукта. Один моль цинка из таблицы Менделеева имеет массу 65,38 грамма, что означает преобразование молей цинка в моли хлорида цинка. Масса 1 моля хлорида цинка равна массе 1 моля цинка и 2 молей хлорида, и это дает нам массу 136,29.грамм. Если израсходовать весь цинк, можно получить 3,52 грамма хлорида цинка. А как насчет h cl? Масса 1 моля водорода и 1 моля хлора составляет 36,46 г в 1 и будет переведена в моли с помощью граммов ч.
