что, как сбалансировать и часто задаваемые вопросы —
By Адити Рой
Оксид цинка является амфотерный оксид, и он реагирует с HCl. Давайте подробно рассмотрим продукты этой реакции с некоторыми соответствующими темами, связанными с этой реакцией.
Оксид цинка нерастворим в воде, но растворяется в кислотах (HCl, H2SO4, так далее). Когда он реагирует с сильной кислотой, HCl, хлоридом цинка (ZnCl2), а в качестве продукта получают воду.
В данной статье опишем изменение энтальпии, типа, метода балансировки и ионного уравнения реакции между ZnO и HCl.
Что является продуктом HCl и ZnO?Когда оксид цинка (ZnO) реагирует с соляной кислотой (HCl), водород заменяется из HCl на ZnO и образует хлорид цинка (ZnCl2) и вода (H2O).
ZnO (водн.) + 2HCl (водн.) = ZnCl2 (вод) + H2О (л)
Какой тип реакции HCl + ZnO?Реакция между HCl + ZnO является примером нейтрализации. Это также считается реакцией двойного вытеснения и экзотермической реакцией (изменение энтальпии отрицательно).
Это также считается реакцией двойного вытеснения и экзотермической реакцией (изменение энтальпии отрицательно).
Следующие шаги должны быть выполнены, чтобы сбалансировать любую химическую реакцию:
- Запишите неуравновешенное уравнение реакции со стрелкой вправо, так как оно еще не уравновешено. ZnO (водн.) + HCl (водн.) → ZnCl2 (вод) + H2О (л)
- Определите количество молей каждого химического соединения как со стороны реагента, так и со стороны продукта.
| Elements | Сторона реагента | Сторона продукта |
| Zn | 1 | 1 |
| H | 1 | 2 |
| Cl | 1 | 2 |
| O | 1 | 1 |
- Чтобы сбалансировать обе стороны (реагент и продукт), целое число 2 умножается на HCl на стороне реагента, чтобы сбалансировать количество молей водорода и хлора.

- Следовательно, окончательное сбалансированное уравнение будет – ZnO (т) + 2HCl (водн.) = ZnCl2 (вод) + H2О (л).
Комплексонометрическое титрование выполняется между HCl и ZnO для определения количества ZnO и Zn2+ в любом растворе.
АппаратыМерная колба (100 мл), пипетка (10 мл), бюретка и коническая колба.
ИндикаторныеКомпания Эриохром черный Т (EBT) индикатор используется в этом комплексонометрическом титровании.
Процедура- В мерную колбу вместимостью 0.163 мл отбирают 100 г ZnO, в бюретку отбирают ЭДТА крепостью 1/50.
- В мерную колбу приливают 25 мл деионизированной воды вместе с HCl по каплям до полного растворения ZnO и заполнения мерной колбы дистиллированной водой до метки.

- 10 мл вышеуказанного раствора отбирают пипеткой и хранят в конической колбе. Добавьте 2 мл раствора Nh4-Nh5Cl и 1 каплю индикатора EBT. Цвет раствора становится винно-красным.
- Этот раствор титруют стандартизированным раствором ЭДТА, и красный цвет становится синим. Для получения точного значения необходимо провести три титрования.
Чистое ионное уравнение химическая реакция ZnO+HCl является-
Zn2+ (с) + О2-+ 2H+ (водн.) + 2Cl– (водн.) = Zn2+ (водн.) + 2Cl– (вод) + H2О (л)
Сопряженные пары HCL + ZnOКомпания сопряженная пара уравнение химическая реакция ZnO+HCl HCl + ZnO = Cl– + HZnO+. Сопряженная пара кислот есть не что иное, как анион без H+ ион, а для основания ион, образовавшийся после принятия H+ ион.
Компания межмолекулярные силы действуют на HCl и Fe:
- HCl является ковалентным соединением. Следовательно, между HCl действуют диполь-дипольная сила, лондонская дисперсионная сила и сила притяжения Ван-дер-Ваальса.
- ZnO представляет собой ионный оксид металла. Следовательно, сила электростатического притяжения или сила Колумба действует между Zn2+ И O2-.
Изменение энтальпии химическая реакция ZnO+HCl составляет -169.1 кДж/моль, и это получено из энтальпия расчет следующих трех химических реакций.
- Уравнение-1: 2Zn(s) + O2 (г) = 2ZnO ∆H = -696.0 кДж/моль
- Уравнение-2: О2 (г) + 2Н2О (г) = 2Н2O (ж) ∆H = -571.6 кДж/моль.
- Уравнение-3: Zn (т) + 2HCl (г) = ZnCl2 (с) + Н2 (ж) ∆H = -231.
 29 кДж/моль.
29 кДж/моль. - Уравнение-4: ZnO (т) + 2HCl (водн.) = ZnCl2 (вод) + H2О (л)
- Из уравнений 1 и 2 и 3 рассчитывается изменение энтальпии уравнения 4. Следовательно, изменение энтальпии уравнения 3 равно {(+696.0/2) + (-571.6/2) + (-231.29)} кДж/моль = -169.1 кДж/моль
HCl + ZnO не является буферный раствор поскольку это раствор, содержащий твердый оксид металла (ZnO) и сильную кислоту (HCl).
Является ли HCl + ZnO полной реакцией?HCl + ZnO представляет собой полную реакцию, так как она выражается желаемыми продуктами, такими как хлорид цинка и вода.
ZnO (т) + 2HCl (водн.) = ZnCl2 (вод) + H2О (л)
HCl + ZnO — экзотермическая или эндотермическая реакция?HCl + ZnO представляет собой экзотермическая реакция поскольку изменение энтальпии этой реакции является отрицательным и составляет -169. 1 кДж/моль, а на стороне продукта выделяется тепло. Это указывает на то, что продукты имеют больше факторов стабилизации, чем реагенты.
1 кДж/моль, а на стороне продукта выделяется тепло. Это указывает на то, что продукты имеют больше факторов стабилизации, чем реагенты.
HCl + ZnO не является окислительно-восстановительная реакция потому что реакция нейтрализации не может быть окислительно-восстановительной реакцией. Цинк, водород, кислород и хлор не изменяют свои степени окисления со стороны реагента на сторону продукта. Следовательно, в этой реакции между ZnO и HCl переноса электрона не происходит.
Является ли HCl + ZnO реакцией осаждения?HCl + ZnO не является реакцией осаждения, поскольку в реакционной среде не происходит осаждения каких-либо продуктов. Хлорид цинка (ZnCl2) полностью растворяется в воде.
Является ли реакция HCl + ZnO обратимой или необратимой?HCl + ZnO представляет собой необратимая реакция потому что продукты более стабильны, чем реагенты. Кроме того, реакции нейтрализации всегда необратимы, так как продукты не могут быть превращены в реагенты.
Кроме того, реакции нейтрализации всегда необратимы, так как продукты не могут быть превращены в реагенты.
HCl + ZnO представляет собой реакцию двойного замещения, поскольку в этой реакции Zn вытесняет водород из HCl, а водород также вытесняет цинк из ZnO и образует хлорид цинка (ZnCl2) и вода. Следовательно, в этой реакции одновременно происходят два смещения.
Двойное смещение РеакцияЗаключениеБудучи амфотерным оксидом, ZnO реагирует как с сильной кислотой, так и с сильным основанием (NaOH) и образует цинкат натрия (Na2ZnO2) и вода, которая также является примером реакции нейтрализации.
Hcl zn ионное уравнение. Уравнение реакции HCl Zn, ОВР, сокращенное-ионное уравнение
Пора двигаться дальше. Как мы уже знаем, полное ионное уравнение нуждается в «чистке». Необходимо удалить те частицы, которые присутствуют и в правой, и в левой частях уравнения. Эти частицы иногда называют «ионами-наблюдателями»; они не принимают участия в реакции.
Эти частицы иногда называют «ионами-наблюдателями»; они не принимают участия в реакции.
В принципе, ничего сложного в этой части нет. Нужно лишь быть внимательным и осознавать, что в некоторых случаях полное и краткое уравнения могут совпадать (подробнее — см. пример 9).
Пример 5 . Составьте полное и краткое ионные уравнения, описывающие взаимодействие кремниевой кислоты и гидроксида калия в водном растворе.
Решение . Начнем, естественно, с молекулярного уравнения:
H 2 SiO 3 + 2KOH = K 2 SiO 3 + 2H 2 O.
Кремниевая кислота — один из редких примеров нерастворимых кислот; записываем в молекулярной форме. KOH и K 2 SiO 3 пишем в ионной форме. H 2 O, естественно, записываем в молекулярной форме:
H 2 SiO 3 + 2K + + 2OH — = 2K + + SiO 3 2- + 2H 2 O.
Видим, что ионы калия не изменяются в ходе реакции. Данные частицы не принимают участия в процессе, мы должны убрать их из уравнения. Получаем искомое краткое ионное уравнение:
H 2 SiO 3 + 2OH — = SiO 3 2- + 2H 2 O.
Как видите, процесс сводится к взаимодействию кремниевой кислоты с ионами OH — . Ионы калия в данном случае не играют никакой роли: мы могли заменить КОН гидроксидом натрия или гидроксидом цезия, при этом в реакционной колбе протекал бы тот же самый процесс.
Пример 6 . Оксид меди (II) растворили в серной кислоте. Напишите полное и краткое ионные уравнения данной реакции.
Решение . Основные оксиды реагируют с кислотами с образованием соли и воды:
H 2 SO 4 + CuO = CuSO 4 + H 2 O.
Соответствующие ионные уравнения приведены ниже. Думаю, комментировать что-либо в данном случае излишне.
2H + + SO 4 2- + CuO = Cu 2+ + SO 4 2- + H 2 O
2H + + CuO = Cu 2+ + H 2 O
Пример 7 . C помощью ионных уравнений опишите взаимодействие цинка с соляной кислотой.
Решение . Металлы, стоящие в ряду напряжений левее водорода, реагируют с кислотами с выделением водорода (специфические свойства кислот-окислителей мы сейчас не обсуждаем):
Zn + 2HCl = ZnCl 2 + H 2 .
Полное ионное уравнение записывается без труда:
Zn + 2H + + 2Cl — = Zn 2+ + 2Cl — + H 2 .
К сожалению, при переходе к краткому уравнению в заданиях такого типа школьники часто делают ошибки. Например, убирают цинк из двух частей уравнения. Это грубая ошибка! В левой части присутствует простое вещество, незаряженные атомы цинка. В правой части мы видим ионы цинка. Это совершенно разные объекты! Попадаются и еще более фантастические варианты. Например, в левой части зачеркиваются ионы H+, а в правой — молекулы H 2 . Мотивируют это тем, что и то, и другое является водородом. Но тогда, следуя этой логике, можно, например, считать, что H 2 , HCOH и CH 4 — это «одно и тоже», т. к. во всех этих веществах содержится водород. Видите, до какого абсурда можно дойти!
Естественно, в данном примере мы можем (и должны!) стереть только ионы хлора. Получаем окончательный ответ:
Zn + 2H + = Zn 2+ + H 2 .
В отличие от всех разобранных выше примеров, данная реакция является окислительно-восстановительной (в ходе данного процесса происходит изменение степеней окисления). Для нас, однако, это совершенно непринципиально: общий алгоритм написания ионных уравнений продолжает работать и здесь.
Для нас, однако, это совершенно непринципиально: общий алгоритм написания ионных уравнений продолжает работать и здесь.
Пример 8 . Медь поместили в водный раствор нитрата серебра. Опишите происходящие в растворе процессы.
Решение . Более активные металлы (стоящие левее в ряду напряжений) вытесняют менее активные из растворов их солей. Медь находится в ряду напряжений левее серебра, следовательно, вытесняет Ag из раствора соли:
Сu + 2AgNO 3 = Cu(NO 3) 2 + 2Ag↓.
Полное и краткое ионные уравнения приведены ниже:
Cu 0 + 2Ag + + 2NO 3 — = Cu 2+ + 2NO 3 — + 2Ag↓ 0 ,
Cu 0 + 2Ag + = Cu 2+ + 2Ag↓ 0 .
Пример 9 . Напишите ионные уравнения, описывающие взаимодействие водных растворов гидроксида бария и серной кислоты.
Решение . Речь идет о хорошо знакомой всем реакции нейтрализации, молекулярное уравнение записывается без труда:
Ba(OH) 2 + H 2 SO 4 = BaSO 4 ↓ + 2H 2 O.
Полное ионное уравнение:
Ba 2+ + 2OH — + 2H + + SO 4 2- = BaSO 4 ↓ + 2H 2 O.
Пришло время составлять краткое уравнение, и тут выясняется интересная деталь: сокращать, собственно, нечего. Мы не наблюдаем одинаковых частиц в правой и левой частях уравнения. Что делать? Искать ошибку? Да нет, никакой ошибки здесь нет. Встретившаяся нам ситуация нетипична, но вполне допустима. Здесь нет ионов-наблюдателей; все частицы участвуют в реакции: при соединении ионов бария и сульфат-аниона образуется осадок сульфата бария, а при взаимодействии ионов H + и OH — — слабый электролит (вода).
«Но, позвольте!» — воскликните вы. — «Как же нам составлять краткое ионное уравнение?»
Никак! Вы можете сказать, что краткое уравнение совпадает с полным, вы можете еще раз переписать предыдущее уравнение, но смысл реакции от этого не изменится. Будем надеяться, что составители вариантов ЕГЭ избавят вас от подобных «скользких» вопросов, но, в принципе, вы должны быть готовы к любому варианту развития событий.
Пора начинать работать самостоятельно. Предлагаю вам выполнить следующие задания:
Упражнение 6 .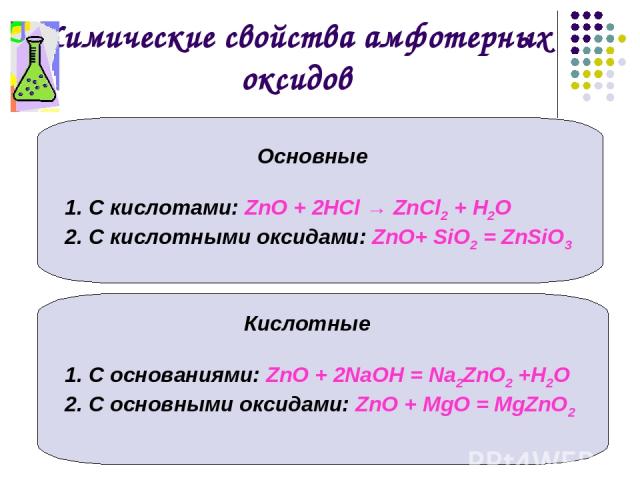 Составьте молекулярные и ионные уравнения (полное и краткое) следующих реакций:
Составьте молекулярные и ионные уравнения (полное и краткое) следующих реакций:
- Ba(OH) 2 + HNO 3 =
- Fe + HBr =
- Zn + CuSO 4 =
- SO 2 + KOH =
Как решать задание 31 на ЕГЭ по химии
В принципе, алгоритм решения данной задачи мы уже разобрали. Единственная проблема заключается в том, что на ЕГЭ задание формулируется несколько… непривычно. Вам будет предложен список из нескольких веществ. Вы должны будете выбрать два соединения, между которыми возможна реакция, составить молекулярное и ионные уравнения. Например, задание может формулироваться следующим образом:
Пример 10 . В вашем распоряжении имеются водные растворы гидроксида натрия, гидроксида бария, сульфата калия, хлорида натрия и нитрата калия. Выберите два вещества, которые могут реагировать друг с другом; напишите молекулярное уравнение реакции, а также полное и краткое ионные уравнения.
Решение . Вспоминая свойства основных классов неорганических соединений , приходим к выводу, что единственная возможная реакция — это взаимодействие водных растворов гидроксида бария и сульфата калия:
Ba(OH) 2 + K 2 SO 4 = BaSO 4 ↓ + 2KOH.
Полное ионное уравнение:
Ba 2+ + 2OH — + 2K + + SO 4 2- = BaSO 4 ↓ + 2K + + 2OH — .
Краткое ионное уравнение:
Ba 2+ + SO 4 2- = BaSO 4 ↓.
Кстати, обратите внимание на интересный момент: краткие ионные уравнения получились идентичными в данном примере и в примере 1 из первой части данной статьи. На первый взгляд, это кажется странным: реагируют совершенно разные вещества, а результат одинаковый. В действительности, ничего странного здесь нет: ионные уравнения помогают увидеть суть реакции, которая может скрываться под разными оболочками.
И еще один момент. Давайте попробуем взять другие вещества из предложенного списка и составить ионные уравнения. Ну, например, рассмотрим взаимодействие нитрата калия и хлорида натрия. Запишем молекулярное уравнение:
KNO 3 + NaCl = NaNO 3 + KCl.
Пока все выглядит достаточно правдоподобно, и мы переходим к полному ионному уравнению:
K + + NO 3 — + Na + + Cl — = Na + + NO 3 — + K + + Cl — .
Начинаем убирать лишнее и обнаруживаем неприятную деталь: ВСЕ в этом уравнении является «лишним». Все частица, присутствующие в левой части, мы находим и в правой. Что это означает? Возможно ли такое? Да, возможно, просто никакой реакции в данном случае не происходит; частицы, изначально присутствовавшие в растворе, так и останутся в нем. Реакции нет!
Видите, в молекулярном уравнении мы спокойно написали чепуху, но «обмануть» краткое ионное уравнение не удалось. Это тот самый случай, когда формулы оказываются умнее нас! Запомните: если при написании краткого ионного уравнения, вы приходите к необходимости убрать все вещества, это означает, что либо вы ошиблись и пытаетесь «сократить» что-то лишнее, либо данная реакция вообще невозможна.
Пример 11 . Карбонат натрия, сульфат калия, бромид цезия, соляная кислота, нитрат натрия. Из предложенного перечня выберите два вещества, которые способны прореагировать друг с другом, напишите молекулярное уравнение реакции, а также полное и краткое ионные уравнения.
Решение . В приведенном списке присутствуют 4 соли и одна кислота. Соли способны реагировать друг с другом только в том случае, если в ходе реакции образуется осадок, но ни одна из перечисленных солей не способна образовать осадок в реакции с другой солью из этого списка (проверьте этот факт, пользуясь таблицей растворимости !) Кислота способна прореагировать с солью лишь в том случае, когда соль образована более слабой кислотой. Серная, азотная и бромоводородная кислоты не могут быть вытеснены действием HCl. Единственный разумный вариант — взаимодействие соляной кислоты с карбонатом натрия.
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2
Обратите внимание: вместо формулы H 2 CO 3 , которая, по идее, должна была образоваться в ходе реакции, мы пишем H 2 O и CO 2 . Это правильно, т. к. угольная кислота крайне неустойчива даже при комнатной температуре и легко разлагается на воду и углекислый газ.
При записи полного ионного уравнения учитываем, что диоксид углерода не является электролитом:
2Na + + CO 3 2- + 2H + + 2Cl — = 2Na + + 2Cl — + H 2 O + CO 2 .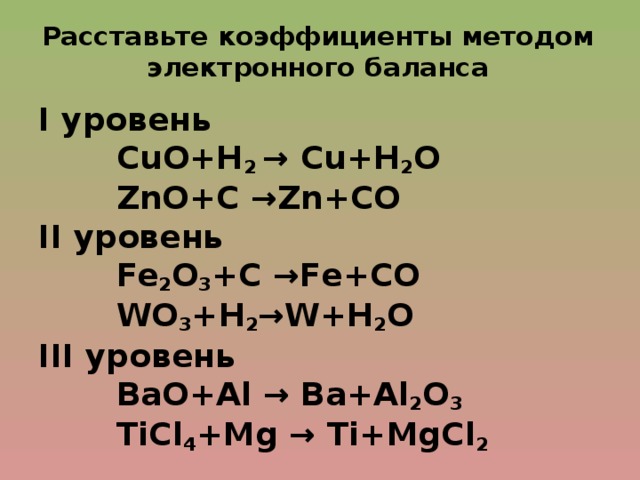
Убираем лишнее, получаем краткое ионное уравнение:
CO 3 2- + 2H + = H 2 O + CO 2 .
А теперь поэкспериментируйте немного! Попробуйте, как мы это сделали в предыдущей задаче, составить ионные уравнения неосуществимых реакций. Возьмите, например, карбонат натрия и сульфат калия или бромид цезия и нитрат натрия. Убедитесь, что краткое ионное уравнение вновь окажется «пустым».
- рассмотрим еще 6 примеров решения заданий ЕГЭ-31,
- обсудим, как составлять ионные уравнения в случае сложных окислительно-восстановительных реакций,
- приведем примеры ионных уравнений с участием органических соединений,
- затронем реакции ионного обмена, протекающие в неводной среде.
Цинк (Zn) — химический элемент, принадлежащий к группе щелочноземельных металлов. В периодической таблице Менделеева располагается под номером 30, что означает, что заряд ядра атома, число электронов и протонов тоже равно 30. Цинк находится в побочной II группе IV периода. По номеру группы можно определить количество атомов, которые находятся на его валентном или внешнем энергетическом уровне — соответственно, 2.
Цинк как типичный щелочной металл
Цинк — это типичный представитель металлов, в нормальном состоянии имеет голубовато-серый цвет, легко окисляется на воздухе, приобретая на поверхности оксидную пленку (ZnO).
Как типичный амфотерный металл цинк взаимодействует с кислородом воздуха: 2Zn+O2=2ZnO — без температуры, с образованием оксидной пленки. При нагревании образуется белый порошок.
Сам оксид реагирует с кислотами с образованием соли и воды:
2ZnO+2HCl=ZnCl2+h3O.
С растворами кислот. Если цинк обычной чистоты, то уравнение реакции HCl Zn ниже.
Zn+2HCl= ZnCl2+h3 — молекулярное уравнение реакции.
Zn (заряд 0) + 2H (заряд +) + 2Cl (заряд -) = Zn (заряд +2) + 2Cl (заряд -)+ 2H (заряд 0) — полное Zn HCl ионное уравнение реакции.
Zn + 2H(+) = Zn(2+) +h3 — С.И.У. (сокращенное ионное уравнение реакции).
Реакция цинка с соляной кислотой
Данное уравнение реакции HCl Zn относится к типу окислительно-восстановительных. Это можно доказать тем, что у Zn и h3 в ходе реакции изменился заряд, наблюдалось качественное проявление реакции, а также наблюдалось присутствие окислителя и восстановителя.
В данном случае h3 является окислителем, так как с. о. водорода до начала реакции была «+», а после стала «0». Он участвовал в процессе восстановления, отдавая 2 электрона.
Zn является восстановителем, он участвует в окислении, принимая 2 электрона, повышая с.о. (степень окисления).
Также это реакция замещения. В ходе нее участвовало 2 вещества, простое Zn и сложное — HCl. В результате реакции образовалось 2 новых вещества, а также одно простое — h3 и одно сложное — ZnCl2. Так как Zn расположен в ряду активности металлов до h3, он вытеснил его из вещества, которое реагировала с ним.
Цинк (Zn) — химический элемент, принадлежащий к группе щелочноземельных металлов. В периодической таблице Менделеева располагается под номером 30, что означает, что заряд ядра атома, число электронов и протонов тоже равно 30. Цинк находится в побочной II группе IV периода. По номеру группы можно определить количество атомов, которые находятся на его валентном или внешнем энергетическом уровне — соответственно, 2.
Цинк как типичный щелочной металл
Цинк — это типичный представитель металлов, в нормальном состоянии имеет голубовато-серый цвет, легко окисляется на воздухе, приобретая на поверхности оксидную пленку (ZnO).
Как типичный амфотерный металл цинк взаимодействует с кислородом воздуха: 2Zn+O2=2ZnO — без температуры, с образованием оксидной пленки. При нагревании образуется белый порошок.
Сам оксид реагирует с кислотами с образованием соли и воды:
2ZnO+2HCl=ZnCl2+h3O.
С растворами кислот. Если цинк обычной чистоты, то уравнение реакции HCl Zn ниже.
Zn+2HCl= ZnCl2+h3 — молекулярное уравнение реакции.
Zn (заряд 0) + 2H (заряд +) + 2Cl (заряд -) = Zn (заряд +2) + 2Cl (заряд -)+ 2H (заряд 0) — полное Zn HCl ионное уравнение реакции.
Zn + 2H(+) = Zn(2+) +h3 — С.И.У. (сокращенное ионное уравнение реакции).
Реакция цинка с соляной кислотой
Данное уравнение реакции HCl Zn относится к типу окислительно-восстановительных. Это можно доказать тем, что у Zn и h3 в ходе реакции изменился заряд, наблюдалось качественное проявление реакции, а также наблюдалось присутствие окислителя и восстановителя.
В данном случае h3 является окислителем, так как с. о. водорода до начала реакции была «+», а после стала «0». Он участвовал в процессе восстановления, отдавая 2 электрона.
Zn является восстановителем, он участвует в окислении, принимая 2 электрона, повышая с.о. (степень окисления).
Также это реакция замещения. В ходе нее участвовало 2 вещества, простое Zn и сложное — HCl. В результате реакции образовалось 2 новых вещества, а также одно простое — h3 и одно сложное — ZnCl2. Так как Zn расположен в ряду активности металлов до h3, он вытеснил его из вещества, которое реагировала с ним.
Реакция соляной кислоты с оксидом цинка с образованием хлорида цинка и воды является реакцией нейтрализации. Укажите, является ли утверждение истинным или FALSEA.TRUEB.FALSEC.EITHERD.NE
Последняя обновленная Дата: 22 -й февраль 2023 г.
•
Общее представление: 254,1K
•
Просмотры сегодня: 6,40K
Проверено
254,1 тыс. + просмотров
+ просмотров
Подсказка: При взаимодействии оксидов металлов с кислотами образуются соль и вода. Все оксиды металлов нейтрализуют кислоту, поэтому все они являются основными по своей природе. \[Кислота + металл\,\,оксид \в соль + вода\]
Итак, реакция кислоты и основания называется реакцией нейтрализации.
\[ZnO(s) + 2HCl(водн.) \to ZnC{l_2}(водн.) + {H_2}O(I)\]
Полный пошаговый ответ:
Нейтрализация – это реакция, в которой обе кислоты и основание количественно реагируют друг с другом. Проще говоря, нейтрализация — это химический процесс, при котором кислота реагирует с основанием с образованием соли и воды.
Обычно соль и вода образуются при взаимодействии кислот с оксидами металлов. Все оксиды металлов являются щелочными, потому что они нейтрализуют кислоту.
\[Кислота + металл\,\,оксид \в соль + вода\]
Соляная кислота (HCl) является сильной кислотой, а оксид цинка (ZnO), напротив, проявляет как кислотное, так и щелочное поведение. Это амфотерный оксид. Такие оксиды металлов, как цинк, реагируют как с кислотой, так и с основанием с образованием солей и воды, и эта реакция называется амфотерной реакцией.
Это амфотерный оксид. Такие оксиды металлов, как цинк, реагируют как с кислотой, так и с основанием с образованием солей и воды, и эта реакция называется амфотерной реакцией.
Поэтому, когда соляная кислота реагирует с оксидом цинка, образуется хлорид цинка, который представляет собой соль и воду, и поэтому эта реакция называется нейтрализацией.
\[ZnO + 2HCl \to ZnC{l_2} + \;{H_2}O\]
\[\left( {Цинк\,Оксид} \right) + \left( {Соляная кислота\,Кислота} \right)\ ; \to \left( {Цинк\,Хлорид} \right) + \;\left( {Вода} \right)\]
Следовательно, правильный ответ — Вариант (A)
Примечание: Оксид алюминия \[(A{l_2}{O_3})\], оксид олова (SnO) и оксид свинца (PbO) являются некоторыми другими примерами амфотерного оксида. Префикс слова «амфотерный» взят от греческого префикса am phi, что означает и то, и другое. Амфотерное вещество — это вещество, которое может действовать как кислота или основание.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим радиусом атомов Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из перечисленного является истинным пероксидом A rmSrmOrm2 12 класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А класса 11 химии JEE_Main
Фосфин получают из следующей руды A Класс кальция 12 химический JEE_Main
Тенденции сомнения
What, How To Balance & FAQs —
By Aditi Roy с HCl. Давайте подробно рассмотрим продукты этой реакции с некоторыми соответствующими темами, связанными с этой реакцией.
Давайте подробно рассмотрим продукты этой реакции с некоторыми соответствующими темами, связанными с этой реакцией.
Оксид цинка нерастворим в воде, но растворяется в кислотах (HCl, H 2 SO 4 и т. д.). При взаимодействии с сильной кислотой в качестве продукта получают HCl, хлорид цинка (ZnCl 2 ) и воду.
В данной статье опишем изменение энтальпии, типа, способа балансировки и ионного уравнения реакции между ZnO и HCl.
Что является продуктом HCl и ZnO ?Когда оксид цинка (ZnO) реагирует с соляной кислотой (HCl), водород замещается из HCl на ZnO и образуется хлорид цинка (ZnCl 2 ) и вода (H 2 O).
ZnO (водн.) + 2HCl (водн.) = ZnCl 2 (водн.) + H 2 O (ж)
Какой тип реакции HCl + ZnO? Примером нейтрализации является реакция между HCl + ZnO. Это также считается реакцией двойного вытеснения и экзотермической реакцией (изменение энтальпии отрицательно).
Это также считается реакцией двойного вытеснения и экзотермической реакцией (изменение энтальпии отрицательно).
Чтобы сбалансировать любую химическую реакцию, необходимо выполнить следующие шаги:
- Напишите уравнение несбалансированной реакции со стрелкой вправо, так как оно еще не уравновешено. ZnO (водн.) + HCl (водн.) → ZnCl 2 (водн.) + H 2 O (л.) стороны.
| Элементы | Reactant side | Product side |
| Zn | 1 | 1 |
| H | 1 | 2 |
| Cl | 1 | 2 |
| O | 1 | 1 |
- Чтобы сбалансировать обе стороны (реагент и продукт), целое число 2 умножается на HCl на стороне реагента, чтобы сбалансировать количество молей водорода и хлора.

- Следовательно, окончательное сбалансированное уравнение будет – ZnO (т) + 2HCl (водн.) = ZnCl 2 (водн.) + H 2 O (л).
Комплексонометрическое титрование проводят между HCl и ZnO для определения количества ZnO и Zn 2+ в любом растворе.
ПриборМерная колба (100 мл), пипетка (10 мл), бюретка и коническая колба.
ИндикаторВ данном комплексометрическом титровании используется индикатор Eriochrome black T (EBT).
Процедура- 0,163 г ZnO отбирают в мерную колбу вместимостью 100 мл, а ЭДТА крепостью 1/50 отбирают в бюретку.
- 25 мл деионизированной воды приливают в мерную колбу вместе с HCl по каплям до полного растворения ZnO и заполнения мерной колбы дистиллированной водой до метки.

- 10 мл вышеуказанного раствора отбирают пипеткой и хранят в конической колбе. Добавьте 2 мл раствора Nh4-Nh5Cl и 1 каплю индикатора EBT. Цвет раствора становится винно-красным.
- Этот раствор титруют стандартизированным раствором ЭДТА, и красный цвет становится синим. Для получения точного значения необходимо провести три титрования.
Суммарное ионное уравнение химическая реакция ZnO+HCl is-
Zn 2+ (s) + O 2- + 2H + (aq) + 2Cl – = Zn 2+ (AQ) + 2CL — (AQ) + H 2 O (L)
HCl + ZNO -конъюгат пары3 3 СОЗДАНИЕ ПАСАЦИИ
СОЗДАНИЕ ПАТЫ ПЕРСОНА
3 СОЗДАНИЕ ПАТИ СОЗДАНИЕ
Пала сопряжения 333 Пала.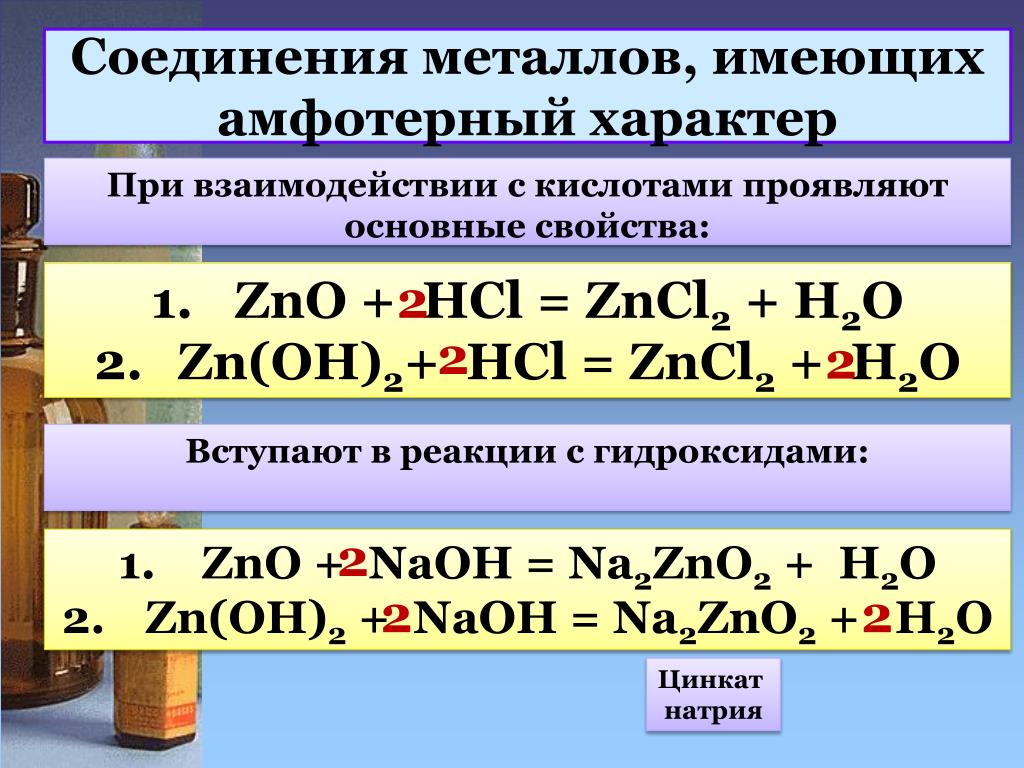 ZnO+HCl – это HCl + ZnO = Cl – + HZnO + . Сопряженная пара кислот есть не что иное, как анион без H + , а для основания ион образовался после принятия иона H + .
ZnO+HCl – это HCl + ZnO = Cl – + HZnO + . Сопряженная пара кислот есть не что иное, как анион без H + , а для основания ион образовался после принятия иона H + .
Межмолекулярные силы, действующие на HCl и Fe, равны
- HCl является ковалентным соединением. Следовательно, между HCl действуют диполь-дипольная сила, лондонская дисперсионная сила и сила притяжения Ван-дер-Ваальса.
- ZnO представляет собой ионный оксид металла. Следовательно, между Zn 9 и Zn 9 действует сила электростатического притяжения или сила Колумба.0238 2+ и О 2-.
Изменение энтальпии химической реакции ZnO+HCl составляет -169,1 кДж/моль, и это получено из следующих трех химических расчетов энтальпии.
- Уравнение-1: 2Zn (тв) + O 2 (г) = 2ZnO ∆H = -696,0 кДж/моль
- Уравнение-2: O 4 (2)900 О (г) = 2Н 2 O (ж) ∆H = -571,6 кДж/моль.
- Уравнение-3: Zn (т) + 2HCl (г) = ZnCl 2 (т) + H 2 (г) ∆H = -231,29 кДж/моль.
- Уравнение-4: ZnO (т) + 2HCl (водн.) = ZnCl 2 (водн.) + H 2 O (л)
- Из уравнений 1 и 3 энтальпии уравнения 4. Следовательно, изменение энтальпии уравнения 3 равно {(+696,0/2) + (-571,6/2) + (-231,29)} кДж/моль = -169.1 кДж/моль
HCl + ZnO не является буферным раствором, поскольку представляет собой раствор, содержащий твердый оксид металла (ZnO) и сильную кислоту (HCl).
Является ли HCl + ZnO полной реакцией? HCl +ZnO является полной реакцией, поскольку она выражается в желаемых продуктах, таких как хлорид цинка и вода.
ZnO (т) + 2HCl (водн.) = ZnCl 2 (водный) + H 2 O (ж)
Является ли реакция HCl + ZnO экзотермической или эндотермической?HCl + ZnO является экзотермической реакцией, поскольку изменение энтальпии этой реакции является отрицательным и составляет -169,1 кДж/моль, а на стороне продукта выделяется тепло. Это указывает на то, что продукты имеют больше факторов стабилизации, чем реагенты.
Является ли HCl + ZnO окислительно-восстановительной реакцией?HCl + ZnO не является окислительно-восстановительной реакцией, потому что реакция нейтрализации не может быть окислительно-восстановительной реакцией. Цинк, водород, кислород и хлор не изменяют свои степени окисления со стороны реагента на сторону продукта. Следовательно, в этой реакции между ZnO и HCl переноса электрона не происходит.
Является ли HCl + ZnO реакцией осаждения? HCl + ZnO не является реакцией осаждения, поскольку в реакционной среде не происходит осаждения каких-либо продуктов.



 29 кДж/моль.
29 кДж/моль.
