Оксид азота (V) — это… Что такое Оксид азота (V)?
- Оксид азота (V)
Окси́д азо́та(V) (пентаоксид диазота, азотный ангидрид) N2O5 — бесцветные, очень летучие кристаллы. Крайне неустойчив.Газообразный азотный ангидрид состоит из отдельных молекул, строение которых отвечает формуле O2N–О–NO2 и имеет неплоскую структуру. Кристаллы образованы ионами NO2+ и NO3— (нитрат нитроила).
Получение
1) Путём дегидратации азотной кислоты HNO3 посредством P2O5:
- 2HNO3 + P2O5 → 2HPO3 + N2O5;
- 12HNO3 + P4O10 → 4H3PO4 + 6N2O5;
2) Пропуская сухой хлор над сухим нитратом серебра:
3) Путём взаимодействием оксида азота(IV) с озоном:
- 2NO2 + O3 → N2O5 + O2↑.
Свойства
Типичный кислотный оксид. N2O5 легко летуч и крайне неустойчив. Разложение происходит со взрывом, чаще всего — без видимых причин:
- 2N2O5 → 4NO2↑ + O2↑ + Q.
Растворяется в воде с образованием азотной кислоты (обратимая реакция):
- N2O5 + H2O ↔ 2HNO3.
Растворяется в щелочах с образованием нитратов:
- N2O5 + 2NaOH → 2NaNO3 + H2O.
Физиологическое действие
Как и все оксиды азота (за исключением оксида азота(I) N2O), N2O5 токсичен. Работа с N2O5 требует осторожности, поскольку реакция его разложения сильно экзотермическая. Кроме того, при разложении он даёт ядовитый NO 2.
Wikimedia Foundation. 2010.
- Оксид азота (I)
- Оксид азота (IV)
Смотреть что такое «Оксид азота (V)» в других словарях:
Оксид азота(II) — Оксид азота(II) … Википедия
Оксид азота(I) — Газ без цвета, со сладким вкусом и запахом Общие Систематическое наименование Оксонитрид азота(I) Химическая формула N2O Физические свойства … Википедия
Оксид азота(IV) — Оксид азота(IV) … Википедия
Оксид азота (II) — Оксид азота(II) Общие Систематическое наименование Оксид азота(II) Химическая формула … Википедия
Оксид азота(V) — Оксид азота(V) … Википедия
Оксид азота (IV) — Оксид азота(IV) Общие … Википедия
Оксид азота (I) — Оксид азота(I) Общие Систематическое наименование Оксид азота(I) Химическая формула N2O Отн. молек. масса 44 а. е. м … Википедия
оксид азота — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN nitrogen monoxide A colourless gas, soluble in water, ethanol and ether. It is formed in many reactions involving the reduction of nitric acid, but more convenient reactions… … Справочник технического переводчика
Оксид азота — Оксиды азота соединения азота с кислородом. Содержание 1 Список оксидов 2 N2O 3 NO 4 N2O3(III) 5 NО2, N2O4 … Википедия
оксид азота (NO) — 3.5.3 оксид азота (NO): Продукт, относящийся к классу опасности 3. Источник: ГОСТ Р 51206 20 … Словарь-справочник терминов нормативно-технической документации
dic.academic.ru
N2O5 какой это оксид
Азотный ангидрид (N2O5 какой это оксид?) образуется в виде летучих бесцветных гигроскопичных кристаллов при пропускании паров азотной кислоты через колонку с оксидом фосфора (V):
Твердый построен из ионов и , а в газовой фазе и растворах состоит из молекул . Это вещество очень неустойчиво и в течение нескольких часов распадается (период полураспада 10 ч), при нагревании – со взрывом:
При растворении в воде образуется азотная кислота.
Высший оксид азота является сильным окислителем, например:
В безводных кислотах (серной, азотной, ортофосфорной, хлорной) распадается, образуя катион нитрония :
ru.solverbook.com
Оксид азота (I, II, III, IV, V): свойства, получение, применение
Введение
Если внимательно взглянуть на азот в периодической системе химических элементов Д. И. Менделеева, то можно заметить, что он имеет переменную валентность. Это значит, что азот образует сразу несколько бинарных соединений с кислородом. Некоторые из них были открыты недавно, а некоторые — изучены вдоль и поперек. Существуют малостабильные и устойчивые оксиды азота. Химические свойства каждого из этих веществ совершенно разные, поэтому при их изучении нужно рассматривать как минимум пять оксидов азота. Вот о них и пойдет речь в сегодняшней статье.
Оксид азота (I)
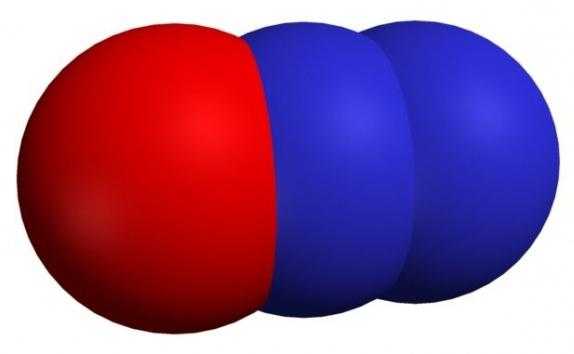 Формула — N2O. Иногда его могут называть оксонитридом азота, оксидом диазота, закисью азота или веселящим газом.
Формула — N2O. Иногда его могут называть оксонитридом азота, оксидом диазота, закисью азота или веселящим газом.Свойства
В обычных условиях представлен бесцветным газом, имеющим сладковатый запах. Его могут растворять вода, этанол, эфир и серная кислота. Если газобразный оксид одновалентного азота нагреть до комнатной температуры под давлением 40 атмосфер, то он сгущается до бесцветной жидкости. Это несолеобразующий оксид, разлагающийся во время нагревания и показывающий себя в реакциях как восстановитель.
Получение
Этот оксид образуется, когда нагревают сухой нитрат аммония. Другой способ его получения — термическое разложение смеси «сульфаминовая + азотная кислота».
Применение
Используется в качестве средства для ингаляционного наркоза, пищевая промышленность знает этот оксид как добавку E942. С его помощью также улучшают технические характеристики двигателей внутреннего сгорания.
Оксид азота (II)
 Формула — NO. Встречается под названиями монооксида азота, окиси азота и нитрозил-радикала
Формула — NO. Встречается под названиями монооксида азота, окиси азота и нитрозил-радикалаСвойства
При нормальных условиях имеет вид бесцветного газа, который плохо растворяется в воде. Его трудно сжижить, однако в твердом и жидком состояниях это вещество имеет голубой цвет. Данный оксид может окисляться кислородом воздуха
Получение
Его довольно просто получить, для этого нужно нагреть до 1200-1300оС смесь азота и кислорода. В лабораторных условиях он образуется сразу при нескольким опытах:
- Реакция меди и 30%-ного раствора азотной кислоты.
- Взаимодействие хлорида железа, нитрита натрия и соляной кислоты.
- Реакция азотистой и иодоводородной кислот.
Применение
Это одно из веществ, из которых получают азотную кислоту.
Оксид азота (III)
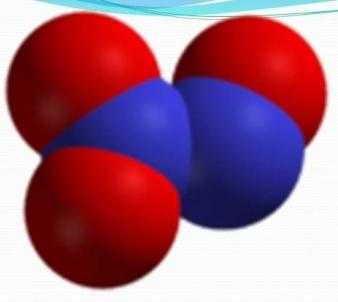 Формула — N2O3. Также его могут называть азотистым ангидридом и сесквиоксидом азота.
Формула — N2O3. Также его могут называть азотистым ангидридом и сесквиоксидом азота.Свойства
В нормальных условиях является жидкостью, которая имеет синий цвет, а в стандартных — бесцветным газом. Чистый оксид существует только в твердом агрегатном состоянии.
Получение
Образуется при взаимодействии 50%-ной азотной кислоты и твердого оксида трехвалентного мышьяка (его также можно заменить крахмалом).
Применение
С помощью этого вещества в лабораториях получают азотистую кислоту и ее соли.
Оксид азота (IV)
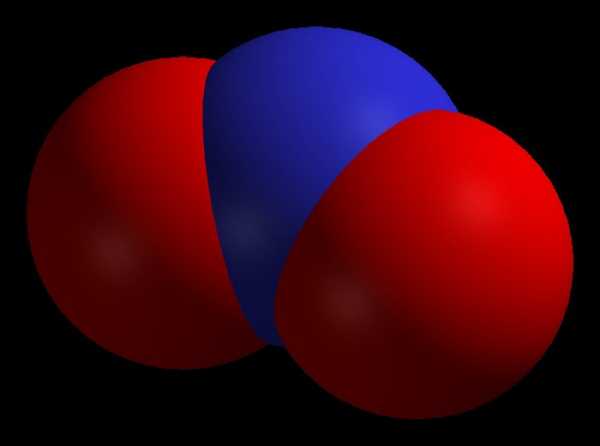 Формула — NO2. Также его могут называть диоксидом азота или бурым газом.
Формула — NO2. Также его могут называть диоксидом азота или бурым газом.Свойства
Последнее название соответствует одному из его свойств. Ведь этот оксид имеет вид или красно-бурого газа или желтоватой жидкости. Ему присуща высокая химическая активность.
Получение
Данный оксид получают при взаимодействии азотной кислоты и меди, а также во время термического разложения нитрата свинца.
Применение
С помощью него производят серную и азотную кислоты, окисляют жидкое ракетное топливо и смесевые взрывчатые вещества.
Оксид азота (V)
Формула — N2O5. Может встречаться под названиями пентаоксида диазота, нитрата нитроила или азотного ангидрида.Свойства
Имеет вид бецветных и очень летучих кристаллов. Они могут плавиться при температуре 32,3оС.
Получение
Этот оксид образуется при нескольких реакциях:
- Дегидрация азотной кислоты оксидом пятивалентного фосфора.
- Пропускание сухого хлора над нитратом серебра.
- Взаимодействие озона с оксидом четырехвалентного азота.
Применение
Из-за своей крайней неустойчивости в чистом виде нигде не используется.
Заключение
В химии существует девять оксидов азота, приведенные выше являются только классическими соединениями этого элемента. Остальные четыре — это, как уже было сказано, нестабильные вещества. Однако их все объединяет одно свойство — высокая токсичность. Выбросы оксидов азота в атмосферу приводят к ухудшению состояния здоровья живущих поблизости от промышленных химических предприятий людей. Симптомы отравления каким-либо из этих веществ — токсический отек легких, нарушение работы центральной нервной системы и поражение крови, причина которого — связывание гемоглобина. Поэтому с оксидами азота необходимо осторожно обращаться и в большинстве случаев использовать средства защиты.
fb.ru
Формула азота в химии
Атомная масса: 14,008.а.е.м.
Электронная и графическая формула азота
Электронная формула: 1s
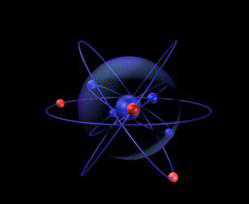
Электронно-графическая формула внешнего электронного слоя атома азота:
Азот является одним из самых распространенных элементов на Земле, а также одним из основных биогенных элементов, входит в состав белков и нуклеиновых кислот.
Азот – простое вещество, состоящее из двух атомов азота.
Формула: N2.
Структурная формула азота
Структурная формула:
Молярная масса: 28,016 г/моль.
При нормальных условиях азот – бесцветный газ, не имеет запаха, цвета и вкуса, плохо растворим в воде. В жидком состоянии – бесцветная, подвижная жидкость. При контакте с воздухом жидкий азот поглощает из него кислород. В твердом состоянии (−209,86°C) существует в виде снегоподобной массы или больших белоснежных кристаллов.
Молекула азота очень прочная, поскольку между атомами азота в молекуле N2 образуется тройная связь N≡N. Вследствие этого многие соединения азота имеют положительную энтальпию образования (галогениды, азиды, оксиды), а соединения азота термически неустойчивы и довольно легко разлагают ся при нагревании. Химически азот довольно инертен, поэтому в природе находится главным образом в свободном состоянии.
Азот при обычных условиях реагирует только с литием:
при нагревании может вступить в реакцию с некоторыми другими металлами и неметаллами, также с образованием нитридов:
Наибольшее практическое значение имеет аммиак (нитрид водорода) NH3, который получается при взаимодействии водорода с азотом:
В электрическом разряде азот реагирует с кислородом, образуя оксид азота(II) NO:
Азот также может образовывать комплексные соединения с переходными металлами.
Примеры решения задач
ru.solverbook.com
Оксиды азота
Оксиды азота
N2O — оксид азота (I), «веселящий газ»
При обычной температуре N2O — бесцветный газ со слабым приятным запахом и сладковатым вкусом; обладает наркотическим действием, вызывая сначала судорожный смех, затем — потерю сознания.
Способы получения
1. Разложение нитрата аммония при небольшом нагревании:
NH4NO3 = N2O↑ + 2Н2О
2. Действие HNO3 на активные металлы
10HNO3(конц.) + 4Са = N2O↑ + 4Ca(NO3)2 + 5Н2О
Химические свойства
N2O не проявляет ни кислотных, ни основных свойств, т. е. не взаимодействует с основаниями, с кислотами, с водой (несолеобразующий оксид).
При Т > 500’С разлагается на простые вещества. N 2O — очень сильный окислитель. Например, способен в водном растворе окислить диоксид серы до серной кислоты:
N2O + SO2 + Н2О = N2↑ + H2SO4
NO — оксид азота (II), монооксид азота.
При обычной температуре NO — бесцветный газ без запаха, малорастворимый в воде, очень токсичный (в больших концентрациях изменяет структуру гемоглобина).
Способы получения
1. Прямой синтез из простых веществ может быть осуществлен только при очень высокой Т:
N2 + O2 = 2NО — Q
2. Получение в промышленности (1-я стадия производства HNO3).
4NH3 + 5O2 = 4NО + 6Н2О
3. Лабораторный способ — действие разб. HNO3 на тяжелые металлы:
8HNO3 + 3Cu = 2NO + 3Cu(NO3)2 + 4Н2О
Химические свойства
NO — несолеобразующий оксид (подобно N2О). Обладает окислительно-восстановительной двойственностью.
2NO + SO2 + Н2О = N2O↑ + H2SO4
2NO + 2H2 = N2 + 2Н2О (со взрывом)
2NO + O2 = 2NO2
10NO + 6KMnO4 + 9H2SO4 = 10HNO3 + 3K2SO4 + 6MnSO4 + 4Н2О
NO2 — оксид азота (IV), диоксид азота
При обычной температуре NO2 — красно-бурый ядовитый газ с резким запахом. Представляет собой смесь NO2 и его димера N2O4 в соотношении -1:4. Диоксид азота хорошо растворяется в воде.
Способы получения
I. Промышленный — окисление NO: 2NO + O2 = 2NO2
II. Лабораторные:
действие конц. HNO3 на тяжелые металлы: 4HNO3 + Сu = 2NO2↑ + Cu(NO3)2 + 2Н2О
разложение нитратов: 2Pb(NO3)2 = 4NO2↑ + O2↑ + 2РbО
Химические свойства
NO2 взаимодействует с водой, основными оксидами и щелочами. Но реакции протекают не так, как с обычными оксидами — они всегда окислительно — восстановительные. Объясняется это тем, что не существует кислоты со С.О. (N) = +4, поэтому NO2 при растворении в воде диспропорционирует с образованием 2-х кислот — азотной и азотистой:
2NO2 + Н2О = HNO3 + HNO2
Если растворение происходит в присутствии O2, то образуется одна кислота — азотная:
4NO2 + 2Н2О + O2 = 4HNO3
Аналогичным образом происходит взаимодействие NO2 со щелочами:
в отсутствие O2: 2NO2 + 2NaOH = NaNO3 + NaNO2 + Н2О
в присутствии O2: 4NO2 + 4NaOH + O2 = 4NaNO3 + 2Н2О
По окислительной способности NO2 превосходит азотную кислоту. В его атмосфере горят С, S, Р, металлы и некоторые органические вещества. При этом NO
10NO2 + 8P = 5N2 + 4P2O5
2NO2 + 8HI = N2 + 4I2 + 4Н2О (возникает фиолетовое пламя)
В присутствии Pt или Ni диоксид азота восстанавливается водородом до аммиака:
2NO2 + 7Н2 = 2NH3 + 4Н2О
Как окислитель NO2 используется в ракетных топливах. При его взаимодействии с гидразином и его производными выделяется большое количество энергии:
2NO2 + 2N2H4 = 3N2 + 4Н2О + Q
N2O3 и N2O5 — неустойчивые вещества
Оба оксида имеют ярко выраженный кислотный характер, являются соответственно ангидридами азотистой и азотной кислот.
N2O3 как индивидуальное вещество существует только в твердом состоянии ниже Т пл. (-100С).
С повышением температуры разлагается: N2O3 → NO + NO2
N2O5 при комнатной температуре и особенно на свету разлагается так энергично, что иногда самопроизвольно взрывается:
2N2O5 = 4NO2 + O2
examchemistry.com
Оксиды азота | Химическая энциклопедия
Для азота известны оксиды, отвечающие всем его положительным степеням окисления (+1, +2, +3, +4, +5). Оксид азота(І) N20 и оксид азота (II) NO — несолеобразующие оксиды, остальные — солеобразующие кислотные оксиды. Все оксиды азота, за исключением оксида азота(І), ядовиты.
Еще в XVIII в. было замечено, что вдыхание небольших количеств оксида азота(І) N2O приводит к безудержному веселью. Отсюда и название этого соединения — «веселящий газ». Длительное время его использовали в медицине для наркоза.
Оксиды азота
| Название | Формула | Окраска, агрегатное состояние | Кислотно-основные свойства | Продукт взаимодействия с водой |
|---|---|---|---|---|
| Оксид азота(I) | N2O | Бесцветный газ | Несолеобразующий | — |
| Оксид азота(II) | NO | Бесцветный газ | Несолеобразующий | — |
| Оксид азота(III) | N2O3 | Темно-синяя жидкость | Кислотный | Азотистая кислота HNO2 |
| Оксид азота(IV) | NO2 | Бурый газ, ниже 21,2 °С — бурая жидкость | Кислотный | Смесь азотистой HNO2 и азотной HNO3 кислот |
| Оксид азота(V) | N2O5 | Бесцветные кристаллы | Кислотный | Азотная кислота HNO3 |
Все оксиды азота проявляют окислительные свойства, которые наиболее сильно выражены у N2O5:
2N2O5 + С = 4NO2 + СO2.
Наибольшее практическое значение имеют оксид азота(П) и оксид азота(ІУ). Только оксид азота(II) NO можно получить при непосредственном взаимодействии азота и кислорода:
N2 + O2 =t 2NO — Q.
Эта реакция протекает при температуре порядка 3000 °С в электрическом разряде. В природе она осуществляется во время грозы. При взаимодействии бесцветного оксида азота(II) с кислородом воздуха образуется оксид азота(ІV), имеющий бурую окраску:
2NO + O2 → 2NO2 + Q.
Поэтому говорят, что оксид азота(П) «буреет» на воздухе. Рассматриваемая реакция является экзотермической и обратимой. При повышении температуры и понижении давления равновесие в системе в соответствии с принципом Ле Шателье смещается влево. Поэтому в атмосфере могут одновременно присутствовать как оксид азота(II), так и оксид азота(IV).
При растворении оксида азота(IV) в охлажденной воде одновременно образуются две кислоты – азотистая HNO2 и азотная HNO3:
2NO2 + H2O = HNO2 + HNO3.
В присутствии кислорода образуется только азотная кислота:
4NO2 + 2H2O + O2 = 4HNO3. Вам необходимо включить JavaScript, чтобы проголосовать
abouthist.net
Оксид азота(I) — это… Что такое Оксид азота(I)?
Оксонитри́д азо́та(I) (оксид диазота, закись азота, окись азота, веселящий газ) — соединение с химической формулой N2O. Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта. При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом.
Закись азота является озоноразрушающим веществом, а также парниковым газом.
Получение
Закись азота получают нагреванием сухого нитрата аммония. Разложение начинается при 170 °C и сопровождается выделением тепла. Поэтому, чтобы не дать протекать ему слишком бурно, следует вовремя прекратить нагревание, так как при температурах более 300 °C нитрат аммония разлагается со взрывом:
Более удобным способом является нагревание сульфаминовой кислоты с 73%-й азотной кислотой:
В химической промышленности закись азота является побочным продуктом и для её разрушения используют каталитические конвертеры, так как выделение в виде товарного продукта, как правило, экономически нецелесообразно.
История
Впервые был получен в 1772 году Джозефом Пристли, который назвал его «флогистированным нитрозным воздухом»[1].
Физические свойства
Бесцветный газ, тяжелее воздуха (относительная плотность 1,527), с характерным сладковатым запахом. Растворим в воде (0,6 объёма N2O в 1 объёме воды при 25 °C, или 0,15 г/100 мл воды при 15 °C), растворим также в этиловом спирте, эфире, серной кислоте. При 0 °C и давлении 30 атм, а также при комнатной температуре и давлении 40 атм сгущается в бесцветную жидкость. Из 1 кг жидкой закиси азота образуется 500 л газа. Молекула закиси азота имеет дипольный момент 0,166 Д, коэффициент преломления в жидком виде равен 1,330 (для жёлтого света с длиной волны 589 нм). Давление паров жидкого N2O при 20 °C равно 5150 кПа.
Химические свойства
Относится к несолеобразующим оксидам, с водой, с растворами щелочей и кислот не взаимодействует. Не воспламеняется, но поддерживает горение. Смеси с эфиром, циклопропаном, хлорэтилом в определённых концентрациях взрывоопасны. В нормальных условиях N2O химически инертен, при нагревании проявляет свойства окислителя:
При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя:
При нагревании N2O разлагается:
Применение
Существует два вида закиси азота — пищевая или медицинская для медицинского применения (высокой степени очистки) и техническая — технический оксид диазота, в котором есть примеси, количество которых указывается в соответствующих техусловиях (ТУ) на данный газ. Медицинская закись азота используется в основном как средство для ингаляционного наркоза, в основном в сочетании с другими препаратами (из-за недостаточно сильного обезболивающего действия), находит применение и в пищевой промышленности, например при производстве взбитых сливок в качестве пропеллента. Как пищевой продукт, имеет индекс E942. Также иногда используется для улучшения технических характеристик двигателей внутреннего сгорания, В промышленности применяется как пропеллент и упаковочный газ. Может использоваться в ракетных двигателях в качестве окислителя, а также как единственное топливо в монокомпонентных ракетных двигателях.
Средство для ингаляционного наркоза
Малые концентрации закиси азота вызывают чувство опьянения (отсюда название — «веселящий газ») и лёгкую сонливость. При вдыхании чистого газа быстро развиваются состояние наркотического опьянения, а затем асфиксия. В смеси с кислородом при правильном дозировании кислорода и закиси азота вызывает наркоз. Закись азота обладает слабой наркотической активностью, в связи с чем её необходимо применять в больших концентрациях. В большинстве случаев применяют комбинированный наркоз, при котором закись азота сочетают с другими, более мощными, средствами для наркоза, а также с миорелаксантами.
Закись азота, предназначенная для медицинских нужд (высокой степени очистки от примесей), не вызывает раздражения дыхательных путей. Будучи, в процессе вдыхания, растворенной в плазме крови, практически не изменяется и не метаболизируется, с гемоглобином не связывается. После прекращения вдыхания выделяется (в течение 10—15 мин) через дыхательные пути в неизменном виде. Период полувыведения — 5 минут.
Наркоз с применением закиси азота используется в хирургической практике, оперативной гинекологии, хирургической стоматологии, а также для обезболивания родов. «Лечебный анальгетический наркоз» (Б. В. Петровский, С. Н. Ефуни) с использованием смеси закиси азота и кислорода иногда применяют в послеоперационном периоде для профилактики травматического шока, а также для купирования болевых приступов при острой коронарной недостаточности, инфаркте миокарда, остром панкреатите и других патологических состояниях, сопровождающихся болями, не купирующимися обычными средствами.
Применяют закись азота в смеси с кислородом при помощи специальных аппаратов для газового наркоза. Обычно начинают со смеси, содержащей 70—80 % закиси азота и 30—20 % кислорода, затем количество кислорода увеличивают до 40—50 %. Если не удается получить необходимую глубину наркоза, при концентрации закиси азота 70—75 %, добавляют более мощные наркотические средства: фторотан, диэтиловый эфир, барбитураты.
Для более полного расслабления мускулатуры применяют миорелаксанты, при этом не только усиливается расслабление мышц, но также улучшается течение наркоза.
После прекращения подачи закиси азота следует во избежание гипоксии продолжать давать кислород в течение 4—5 мин.
Применять закись азота, как и любое средство для наркоза, необходимо с осторожностью, особенно при выраженных явлениях гипоксии и нарушении диффузии газов в лёгких.
Для обезболивания родов пользуются методом прерывистой аутоанальгезии с применением, при помощи специальных наркозных аппаратов, смеси закиси азота (40—75 %) и кислорода. Роженица начинает вдыхать смесь при появлении предвестников схватки и заканчивает вдыхание на высоте схватки или по её окончании.
Для уменьшения эмоционального возбуждения, предупреждения тошноты и рвоты и потенцирования действия закиси азота возможна премедикация внутримышечным введением 0,5%-го раствора диазепама (седуксена, сибазона) в количестве 1—2 мл (5—10 мг), 2—3 мл 0,25%-го раствора дроперидола (5,0—7,5 мг).
Лечебный наркоз закисью азота (при стенокардии и инфаркте миокарда) противопоказан при тяжёлых заболеваниях нервной системы, хроническом алкоголизме, состоянии алкогольного опьянения (возможны возбуждение, галлюцинации).
Форма выпуска: в металлических баллонах вместимостью 10 л под давлением 50 атм в сжиженном состоянии. Баллоны окрашены в серый цвет и имеют надпись «Для медицинского применения».
В двигателях внутреннего сгорания
Закись азота иногда используется для улучшения технических характеристик двигателей внутреннего сгорания. В случае автомобильных применений вещество, содержащее закись азота, и горючее впрыскиваются во впускной (всасывающий) коллектор двигателя, что приводит к следующим результатам:
- снижает температуру всасываемого в двигатель воздуха, обеспечивая плотный поступающий заряд смеси.
- увеличивает содержание кислорода в поступающем заряде (воздух содержит лишь ~21 масс. % кислорода).
- повышает скорость (интенсивность) сгорания в цилиндрах двигателя.
См. подробнее: Системы закиси азота.
В пищевой промышленности
В пищевой промышленности соединение зарегистрировано в качестве пищевой добавки E942, как пропеллент и упаковочный газ.
Хранение
Хранение: при комнатной температуре в закрытом помещении, вдали от огня.
См. также
Литература
Навигация
Примечания
dic.academic.ru
