HI + h3SO4 = ? уравнение реакции
В результате взаимодействия иодоводорода с серной кислотой (HI + h3SO4 = ?) происходит образование свободного йода, воды и выделение газа – сероводорода. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что простые вещества, газы и вода на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Сероводород в обычных условиях представляет собой бесцветный газ с характерным запахом гниющего белка. Он немного тяжелее воздуха и горит голубоватым пламенем, образуя диоксид серы и воду:
Сероводород легко воспламеняется; смесь его с воздухом взрывает. Очень ядовит. При один объем воды растворяет 2,5 объема сероводорода. Раствор сероводорода в воде называется сероводородной водой.
Сероводород – сильный восстановитель. При действии сильных окислителей он окисляется до диоксида серы или до серной кислоты; глубина окисления зависит от условий: температуры, рН раствора, концентрации окислителя. Например, реакция с хлором обычно протекает до образования серной кислоты:
Средние соли сероводорода называют сульфидами.
При высокой температуре сера взаимодействует с водородом, образуя газ сероводород.
Практически сероводород обычно получают действием разбавленных кислот на сернистые металлы, например на сульфид железа:
ru.solverbook.com
Серная кислота h3SO4 — Знаешь как
Чистая серная кислота представляет Особой бесцветную маслянистую жидкость, превращающуюся при 10,5° в твердую кристаллическую массу. При нагревании безводная серная кислота (так называемый «моногидрат») отщепляет SO3. Отщепление идет до тех пор, пока не получится раствор, содержащий 98,3% H2SO4 и кипящий без изменения своего состава при 338°.
Продажная концентрированная кислота содержит обыкновенно 96,5% H 2SO4 и имеет уд. вес 1,84. Благодаря маслянистому виду серную кислоту иногда называют купоросным маслом. Это название сохранилось еще с тех пор, когда серную кислоту получали, подвергая накаливанию железный купорос.
Серная кислота может растворять значительные количества серного ангидрида. Такие растворы носят название олеумов. Из них можно выделить твердое соединение серной кислоты с серным ангидридом, называемое пиросерной кислотой, H2S2O7.
При растворении серной кислоты в воде выделяется большое количество тепла (19 ккал на 1 моль кислоты) вследствие образования гидратов. Последние при низких температурах могут быть выделены из раствора в твердом виде. Гидрат состава H2SО4 • 2Н2О плавится при —38°, гидрат состава H2SО4 • 4Н2О при —27°.
Серная кислота обладает способностью жадно поглощать пары воды и поэтому часто применяется для осушения газов. Способностью поглощать воду объясняется и обугливание многих органических веществ, особенно относящихся к классу углеводов (клетчатка, сахар и др.), при действии на них концентрированной серной кислоты. В состав углеводов водород и кислород входят в таком же весовом отношении, в каком они находятся в воде. Серная кислота отнимает от углеводов элементы воды, а углерод выделяется в виде угля. Вследствие малой летучести серной кислоты ею постоянно пользуются для вытеснения других, более летучих кислот из их солей.
Серная кислота является довольно энергичным окислителем; ее окислительные свойства проявляются при взаимодействии со многими веществами.
Строго говоря, всякая кислота может проявлять окислительные свойства, поскольку в состав ее обязательно входят ионы водорода, способные отнимать электроны от других веществ. Так, например, при действии соляной кислоты на цинк ионы водорода отнимают электроны от нейтральных атомов цинка, превращая их в положительно заряженные ионы, т. е. производя окисление:
Zn + 2НСl = ZnCl2 + Н2
или в ионной форме
Zn + 2H• = Zn•• + Н2
В этом случае соляная кислота играет роль окислителя.
Однако когда говорят об окислительных свойствах какой-либо кислоты, имеют в виду не ионы водорода, а атомы того из входящих в состав кислоты элементов, от которого кислота обычно получает свое название (например: атомы серы в серной кислоте, атомы азота в азотной кислоте и т. д.).
В серной кислоте сера находится в максимально окисленном
состоянии, проявляя валентность +6. Но она может быть восстановлена до состояния S(+IV)(H2SО3или ионе SО3«), или до S (в свободной сере), или даже до S (-II)(в сероводороде).
Нужно заметить, что окислительные свойства шестивалентной серы проявляются только в том случае, когда взята концентрированная серная кислота. Например, при нагревании концентрированной серной кислоты с углем последний окисляется в углекислый газ, а серная кислота восстанавливается до SO
2H2SО4 + С = СО2 + 2SО2 + 2Н2О
с разбавленной кислотой эта реакция не идет.
Рассмотрим действие серной кислоты на металлы. При действии на металлы разбавленной серной кислоты окислителем является ион водорода. Но этот ион может окислять только металлы, стоящие в вытеснительном ряду перед водородом, как, например, магний, цинк, железо и др. На металлы, стоящие после водорода, например на медь, серебро, ртуть, разбавленная серная кислота не действует. Концентрированная серная кислота окисляет при нагревании почти все металлы, но водород при этом не выделяется, так как окисление производится недиссоци’ированньши молекулами серной кислоты.
В зависимости от активности металла молекулы серной кислоты могут восстанавливаться до SО2, свободной серы или до H 2S. Чаще всего серная кислота восстанавливается до SО2. Например:
Сu + 2H2SO4 = CuSO4 + SO2 + 2Н2O Zn + 2H2SO4 = ZnSO4 + SO2 + 2H2O
В последнем случае, вследствие активности цинка, одновременно протекают и следующие реакции:
3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O
4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
Серная кислота является одной из наиболее сильных кислот. В водных растворах она диссоциирует главным образом на ионы
H•и HSO4‘
Как кислота двухосновная, серная кислота образует два ряда солей: нормальные и кислые соли. Нормальные соли серной кислоты называются сульфатами, а кислые — гидросульфатами.
Большинство, солей серной кислоты довольно хорошо растворяется в воде. Из солей более известных металлов практически нерастворимыми являются сульфат бария BaSO4 и сульфат свинца PbSO
Сульфат бария нерастворим не только в воде, но и в разбавленных кислотах. А так как другие соли бария растворимы или в воде или в кислотах, то образование белого нерастворимого в кислотах осадка при действии на какой-нибудь раствор бариевой солью служит указанием на присутствие в растворе серной кислоты или ее солей, т. е. ионов SO4»:
Ва•• + SO4» = BaSO4
Таким образом, растворимые соли бария являются реактивом на ион SO4«.
Большое практическое применение имеют следующие соли серной кислоты:
1. Сульфат натрия, или сернокислый натрий Na2SO4. Из водных растворов кристаллизуется с десятью молекулами воды (Na2SO4• 10Н2О) и в таком виде называется глауберовой солью по имени врача и химика Глаубера, который первый получил ее действием серной кисловы на поваренную соль и стал применять как лекарство. Безводная соль применяется при получении соды сульфатным способом и при изготовлении стекла.
2. Сульфат магния MgSO4. Содержится в морской воде. Из растворов кристаллизуется -в виде гидрата MgSO4•Н2O. Под названием горькой с о л и применяется как слабительное.
3. Сульфат кальция CaSO4. Встречается в природе в больших количествах в виде минерала гипса CaSO4 • 2Н2O. При нагревании до 150—170° гипс теряет3/4 содержащейся в нем кристаллизационной воды и переходит в так называемый жженый гипс, или алебастр (2CaSO4• Н2O). Будучи замешан с водой в жидкое тесто, жженый гипс довольно быстро затвердевает, снова превращаясь в CaSO4 • 2Н2O. Благодаря этому свойству гипс применяется для изготовления отливочных форм и слепков с различных предметов, а также в качестве вяжущего материала для штукатурки стен и потолков. В хирургии гипсом пользуются для накладывания гипсовых повязок при переломах костей.
4. Купоросы. Так называются сульфаты меди, железа, цинка и некоторых других металлов, содержащие кристаллизационную воду.
Медный купорос CuSO4• 5Н2O образует синие кристаллы, содержащие пять молекул кристаллизационной воды. Применяется для покрытия металлов медью, для приготовления некоторых минеральных красок, а также в качестве исходного вещества при получении других соединений меди. В сельском хозяйстве разбавленным раствором медного купороса пользуются для опрыскивания растений и протравливания зерна перед посевом, чтобы уничтожить споры вредных грибков.
Железный купорос FeSО4 • 7Н2О кристаллизуется в виде светлозеленых кристаллов, содержащих семь молекул кристаллизационной воды. Имеет обширное техническое применение. Применяется для консервирования дерева, для приготовления чернил, берлинской лазури, для очистки светильного газа от сероводорода и циансодержащих соединений, в красильном деле, в сельском хозяйстве для борьбы с вредителями растений и в фотографии.
5. Квасцы. Если к раствору сульфата алюминия Al2(SО4)3 прибавить раствор сульфата калия K2SО4 и оставить жидкость кристаллизоваться, то из нее выделяются красивые бесцветные кристаллы, состав которых может быть выражен формулой K2SО4 • Al2(SО4)3•24H2О или КАl (SО4)2 • 12Н2О. Это и есть обыкновенные или алюминиевые квасцы, являющиеся двойной солью серной кислоты и металлов калия и алюминия.
Двойные соли могут существовать только в твердом виде. При растворении квасцов в воде получается раствор, содержащий ионы К•, Аl••• и SO4»
Квасцы бывают различного состава. Вместо алюминия в их состав могут входить другие трехвалентные металлы — железо, хром, вместо калия — натрий или аммоний. Например, хромовые квасцы имеют состав K
125 126 127
Вы читаете, статья на тему Серная кислота h3SO4
znaesh-kak.com
Серная кислота химические свойства | Дистанционные уроки
23-Окт-2012 | Нет комментариев | Лолита Окольнова
Формула серной кислоты — H2SO4
Очень сильная кислота, к тому же это кислота-окислительь.
Тяжелая, маслянистая жидкость.
Чтобы лучше понять строение и свойства кислоты, почитайте про серу — именно из-за ее способности распаривать электроны и переносить их на d-подуровень степень окисления +6 стала возможной. Это максимальная степень окисления (максимальная с.о. соответствует номеру группы), поэтому для серной кислоты характерны окислительные свойства.
Давайте разберем все по подробнее…
Свойства кислоты
Почему серная кислота считается сильной? Потому что в растворе она практически полностью диссоциирует на ионы: H2SO4 = 2H(+) + SO4(2-)
Разбавленная серная кислота реагирует именно как кислота — с отщеплением водорода:
Качественная реакция на сульфат-ион:
Ba(2+) + SO4(-2) = BaSO4↓ (осадок белого цвета)
Окислительные свойства серной кислоты
Концентрированная серная кислота — довольно сильный окислитель:
- С металлами — окисляет металл, сама восстанавливается до SO2:
Сu + 2H2SO4 (конц) = CuSO4 + SO2 + 2H2O
Zn + 2H2SO4 (конц) = ZnSO4 + SO2 + 2H2O - C неметаллами:
S + 2H2SO4(конц) = 3SO2 + 2H2O; - С оксидами неметаллов:
СO + H2SO4 = CO2 + SO2 + H2O - C кислотами — неокислителями:
2HBr + H2SO4 = Br2 + SO2 + 2H2O
Серная кислота и вода
C серной кислотой надо ОЧЕНЬ АККУРАТНО обращаться: при ее разбавлении надо приливать именно кислоту к воде.
Дело в том, что растворение кислоты сопровождается выделением большого количества тепла (стакан, пробирка или колба могут нагреться до 90 градусов!) , вода сильно нагревается и может произойти выброс ее из посуды (пробирка «плюнет» кислотой). Ожог от кислоты (тем более горячей) — очень страшный. Рубцы от ожога кислотой убрать нельзя никаким хирургическим путем.
Соли серной кислоты
- Средние: все атомы водорода замещены на металл: Na2SO4
- Кислые: от кислоты остался один водород: NaHSO4 — гидросульфат натрия.
Переход средняя соль —-> кислая соль:
Na2SO4 + H2SO4 = 2NaHSO4
Переход кислая соль —->средняя соль:
2NaHSO4 = (t) = Na2SO4 + H2SO4
Как видите, серная кислота не обладает большим разнообразием продуктов реакции, но по химическим свойствам — очень активна и как кислота, и как кислота-окислитель.
Еще на эту тему:
Обсуждение: «Серная кислота химические свойства»
(Правила комментирования)distant-lessons.ru
Экзамен — ХТС производства h3SO4 — 2008 / h3SO4
h3SO4.Хим и функц. схемы.
Получение серной кислоты включает несколько этапов. Первым этапом является получение диоксида серы окислением (обжигом) серосодержащего сырья . Следующий этап — превращение оксида серы (IV) в оксид серы (VI). Этот окислительный процесс характеризуется очень высоким значением энергии активации, для понижения которой необходимо, как правило, применение катализаторов. В зависимости от того, как осуществляется процесс окисления SO2 в SO3, различают два основных метода получения серной кислоты.
В контактном методе получения серной кислоты процесс окисления SO2 и SO3 проводят на твердых катализаторах.
Триоксид серы переводят в серную кислоту на последней стадии процесса — абсорбции триоксида серы, которую упрощенно можно представить уравнением реакции
SO3+H2O -> H2SO4
При проведении процесса по нитрозному методу в качестве переносчика кислорода используют оксиды азота.
Окисление диоксида серы осуществляется в жидкой фазе и конечным продуктом является серная кислота:
SO2 + N2O3 + H2O —> H2SO4 + 2NO

CSO2, max = 8 / (8 + 41.4) * 100 = 16.2 %
Обычно воздух берется в избытке к стехиометрическому количеству, тогда концентрация SO2 в обжиговом газе будет тем меньше, чем больше коэффициент избытка. Теоретическую концентрацию SO2 в газе (при условии 100%-ного использования серы колчедана) можно рассчитать по уравнению
CSO2 = 8 / (52.4m – 3) * 100 % где т — коэффициент избытка воздуха по отношению к стехиометрическому.
Колчедан, применяемый для обжига, предварительно обогащают флотацией. Флотационный колчедан кроме пирита FeS2 содержит ряд примесей, которые при обжиге переходят в состав обжигового газа в виде оксидов As2O3, SeO2, TeO2 и фторсодержащих газообразных соединений HF, SiF4. Наличие этих соединений обусловливает необходимость последующей очистки газа.
В состав обжигового газа входит также небольшое количество триоксида серы SO3, так как оксид железа при высоких температурах является катализатором окисления SO2 в SO3.
Для увеличения скорости процесса стремятся прежде всего уменьшить сопротивление диффузионных стадий, т. е. не проводить обжиг колчедана в диффузионной области.
Это может быть достигнуто измельчением твердой фазы и интенсивной турбулизацией потока. Наиболее удобным аппаратом для этой цели является печь печь «кипящего слоя» .
Температура процесса должна быть достаточно большой для обеспечения высокой скорости реакции. При низких температурах (ниже 500 °С) не сможет протекать эндотермическая реакция термического разложения дисульфида железа. Однако проведение обжига при очень высоких температурах может вызвать нежелательный физический процесс спекания частиц горящего материала, приводящий к увеличению их размеров. Следствием этого явится увеличение времени полного превращения твердых частиц и понижение производительности печи. Температура спекания колеблется в зависимости от состава колчедана в пределах от 800 до 900 °С.
В настоящее время в сернокислотной промышленности для обжи га колчедана применяют в основном печи кипящего слоя с псевдоожиженным слоем твердого материала. В псевдоожиженном слое обеспечивается высокая скорость диффузионных и теплообменных процессов (подвод кислорода к поверхности колчедана, отвод диоксида серы в газовый поток, отвод теплоты от поверхности сырья к газовому потоку). Отсутствие тормозящего влияния массо- и теплообмена позволяет проводить обжиг колчедана в таких печах с высокой скоростью. Печи КС характеризуются максимальной интенсивностью в сравнении с другими конструкциями.
Контактное окисление диоксида серы. Реакция (III) окисления диоксида серы характеризуется очень высоким значением энергии активации и поэтому практическое ее осуществление возможно лишь в присутствии катализатора.
В промышленности основным катализатором окисления SO2 является катализатор на основе оксида ванадия V2O5 (ванадиевая контактная масса).
Реакция окисления диоксида серы — обратимая экзотермическая. Тепловой эффект реакции составляет при 500 °С 94,23 кДж/моль; в зависимости от температуры он описывается уравнением ΔН = -101420 + 9,26Т Дж/моль. Константа равновесия
Может быть рассчитана по уравнению Lg KP = 4905.5/T – 4.6455где р — общее давление; а и b — молярные доли SO2 и О2 в исходной реакционной смеси.
Скорость реакции и вид кинетического уравнения зависят от типа применяемого катализатора.
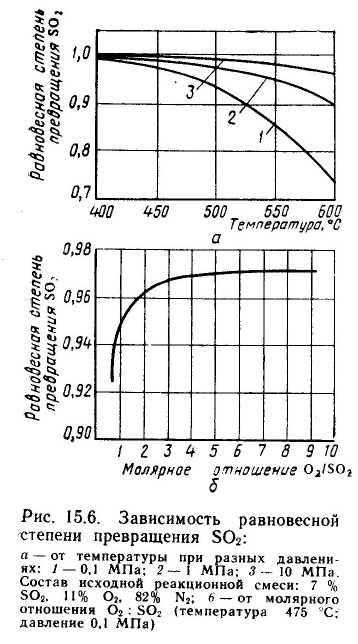
Скорость реакции зависит от степени приближения к равновесию и как функция температуры проходит через максимум (с ростом температуры растет константа скорости прямой реакции и уменьшаются константа равновесия и равновесная степень превращения).
Скорость реакции повышается с ростом концентрации кислорода, поэтому процесс в промышленности проводят при его избытке. Для этого более концентрированный обжиговый газ (14—15% SO2) разбавляют воздухом перед стадией контактного окисления.
Так как реакция окисления SO2 относится к типу экзотермических, температурный режим ее проведения должен приближаться к линии оптимальных температур. На выбор температурного режима дополнительно накладываются два ограничения, связанные со свойствами катализатора. Нижним температурным пределом является температура зажигания ванадиевых катализаторов, составляющая в зависимости от конкретного вида катализатора и состава газа 400— 440 °С. Верхний температурный предел составляет 600—650 °С и определяется тем, что выше этих температур происходит перестройка структуры катализатора и он теряет свою активность.
В диапазоне 400—600 °С процесс стремятся провести так, чтобы по мере увеличения степени превращения температура уменьшалась.
Чаще всего в промышленности используют полочные контактные аппараты с наружным теплообменом. Схема теплообмена предполагает максимальное использование теплоты реакции для подогрева исходного газа и одновременное охлаждение газа между полками.
Одна из важнейших задач, стоящих перед сернокислотной промышленностью, — увеличение степени превращения диоксида серы и снижение его выбросов в атмосферу. Эта задача может быть решена несколькими методами.
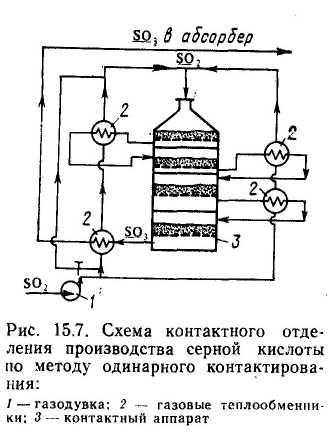
Один из наиболее рациональных методов решения этой задачи, повсеместно применяемый в сернокислотной промышленности,— метод двойного контактирования и двойной абсорбции (ДКДА). Его сущность состоит в том, что реакционную смесь, в которой степень превращения SO2 составляет 90—95%, охлаждают и направляют в промежуточный абсорбер для выделения SO3. В оставшемся реакционном газе соотношение О2 : SO2 существенно повышается, что приводит к смещению равновесия реакции вправо (равновесная кривая 2 на рис. 15.8). Вновь нагретый реакционный газ снова подают в контактный аппарат, где на одном — двух слоях катализатора достигают 95% степени превращения оставшегося SO2. Суммарная степень превращения SO2 составляет в таком процессе 99,5— 99,8%. Схема контактного отделения, соответствующая методу ДКДА (три слоя на первой стадии контактирования плюс один слой на второй стадии контактирования), изображена на рис. 15.9, а ход процесса изображен на рис. 15.8. Рабочая линия первых трех слоев на этом рисунке совпадает с рабочей линией аналогичного реактора с одинарным контактированием, описанного выше. Адиабата четвертого слоя 4 проходит уже по-другому — заканчивается вблизи новой равновесной кривой 2.


Абсорбция триоксида серы. Последней стадией процесса производства серной кислоты контактным способом является абсорбция триоксида серы из газовой смеси и превращение его в серную кислоту. При выборе абсорбента и условий проведения стадии абсорбции необходимо обеспечить почти 100%-ное извлечение SO3 из газовой фазы.
Для полного извлечения SO3 необходимо, чтобы равновесное парциальное давление SO3 над растворителем было ничтожно малым, так как при этом будет велика движущая сила процесса абсорбции. Однако в качестве абсорбента нельзя использовать и такие растворы, над поверхностью которых велико равновесное парциальное давление паров воды. В этом случае еще не растворенные молекулы SO3 будут реагировать с молекулами воды в газовой фазе с образованием паров серной кислоты и быстро конденсироваться в объеме с образованием мельчайших капель серной кислоты, диспергированных в инертной газовой среде — азоте, т. е. с образованием сернокислотного тумана:
SO3(r) + H2O(r) H2SO4(r) H2SO4
Туман плохо улавливается в обычной абсорбционной аппаратуре и в основном уносится с отходящими газами в атмосферу, при этом загрязняется окружающая среда и возрастают потери серной кислоты.
Диаграмма фазового равновесия пар — жидкость для системы Н2О—H2SO4—SO3 (см. рис. 15.2) показывает, что оптимальным абсорбентом является 98,3%-ная серная кислота, соответствующая азеотропному составу. Действительно, над этой кислотой практически нет ни паров воды, ни паров SO3. Протекающий при этом процесс можно условно описать уравнением реакции
Использование в качестве поглотителя менее концентрированной серной кислоты может привести к образованию сернокислотного тумана, а над 100%-ной серной кислотой или олеумом в паровой фазе довольно велико равновесное парциальное давление SO3, поэтому он будет абсорбироваться не полностью. Однако если в качестве одного из продуктов процесса необходимо получить олеум, можно совместить абсорбцию олеумом (1-й абсорбер) и абсорбцию 98,3%-ной кислотой (2-й абсорбер).
Для обеспечения высокой степени поглощения следует поддерживать в абсорбере концентрацию серной кислоты, близкую к 98,3%, а температуру ниже 100 °С. Однако в процессе абсорбции SO3 происходит закрепление кислоты (повышение ее концентрации) и в силу экзотермичности реакции увеличивается температура. Для уменьшения тормозящего влияния этих явлений абсорбцию ведут так, чтобы концентрация H2SO4 при однократном прохождении абсорбера повышалась только на

1—1,5%, закрепившуюся серную кислоту разбавляют в сборнике до концентрации 98,3%, охлаждают в наружном холодильнике и вновь подают на абсорбцию, обеспечивая высокую кратность циркуляции.
studfiles.net
С + h3SO4 (конц) = ? уравнение реакции
В результате взаимодействия углерода с концентрированным горячим раствором серной кислоты (С + h3SO4 (конц) = ?) происходит выделение газов – диоксидов серы и углерода, а также воды. Молекулярное уравнение реакции имеет вид:
Сернистый газ (оксид серы (IV), диоксид серы) в обычных условиях представляет собой бесцветный газ с характерным резким запахом (температура плавления равна (), кипения – (). Растворимость оксида серы (IV) в воде весьма велика (при обычных условиях около 40 объемов на один объем воды). Водный раствор диоксида серы называется сернистой кислотой.
Сернистый газ химически активен; в растворе медленно окисляется. Типичный восстановитель, слабый окислитель. В жидком состоянии — неводный растворитель для азота, хлоридов металлов, галогенидов фосфора.
В промышленности оксид серы (IV) получают обжигом сульфида железа:
В лабораторных условиях этот газ получается при действии сильных кислот на сульфиты или гидросульфиты, а также при растворении меди в концентрированной серной кислоте.
ru.solverbook.com
Окислительные свойства серной кислоты | Дистанционные уроки
29-Дек-2014 | комментариев 5 | Лолита Окольнова
ОВР в статье специально выделены цветом. Обратите на них особое внимание. Эти уравнения могут попасться в ЕГЭ.
Разбавленная серная ведет себя, как и остальные кислоты, окислительные свои возможности прячет:
Zn + h3SO4 → ZnSO4 + h3↑
Автор статьи — Саид Лутфуллин
И еще, что надо помнить про разбавленную серную кислоту: она не реагирует со свинцом. Кусок свинца, брошенный в разбавленную h3SO4 покрывается слоем нерастворимого (см. таблицу растворимости) сульфата свинца и реакция моментально прекращается.
Pb + h3SO4 ≠
Концентрированная серная кислота – тяжелая маслянистая жидкость, не летучая, не имеет вкуса и запаха
За счет серы в степени окисления +6(высшей) серная кислота приобретает сильные окислительные свойства.
Правило для задания 24 (по-старому А24) при приготовлении растворов серной кислоты никогда нельзя в нее лить воду. Концентрированую серную кислоту нужно тонкой струйкой вливать в воду, постоянно помешивая.
Взаимодействие концентрированной серной кислоты с металлами
Эти реакции строго стандартизированны и идут по схеме:
h3SO4(конц.) + металл → сульфат металла + h3O + продукт восстановленной серы.
Есть два нюанса:
1) Алюминий, железо и хром с h3SO4 (конц) в нормальных условиях не реагируют, из-за пассивации. Нужно нагреть.
2) С платиной и золотом h3SO4 (конц) не реагирует вообще.
Сера в концентрированной серной кислоте – окислитель
- значит, сама будет восстанавливаться;
- то, до какой степени окисления будет восстанавливаться сера, зависит от металла.
Рассмотрим диаграмму степеней окисления серы:
- До -2 серу могут восстановить только очень активные металлы — в ряду напряжений до алюминия включительно.
Реакции будут идти вот так:
8Li + 5H2SO4(конц.) → 4Li2SO4 + 4H2O + H2S↑
4Mg + 5H2SO4(конц.) → 4MgSO4 + 4H2O + H2S↑
8Al + 15H2SO4(конц.) (t)→ 4Al2(SO4)3 + 12H2O + 3H2S↑
- при взаимодействии h3SO4 (конц) с металлами в ряду напряжений после алюминия, но до железа, то есть с металлами со средней активностью сера восстанавливается до 0:
3Mn + 4H2SO4(конц.) → 3MnSO4 + 4H2O + S↓
2Cr + 4H2SO4(конц.) (t)→ Cr2(SO4)3 + 4H2O + S↓
3Zn + 4H2SO4(конц.) → 3ZnSO4 + 4H2O + S↓
- все остальные металлы, начиная с железа в ряду напряжений (включая те, что после водорода, кроме золота и платины, конечно), могут восстановить серу только до +4. Так как это малоактивные металлы:
2Fe + 6H2SO4(конц.) (t)→ Fe2(SO4)3 + 6H2O + 3SO2↑
(обратите внимание, что железо окисляется до +3, до максимально возможной, высшей степени окисления, так как оно имеет дело с сильным окислителем)
Cu + 2H2SO4(конц.) → CuSO4 + 2H2O + SO2↑
2Ag + 2H2SO4(конц.) → Ag2SO4 + 2H2O + SO2↑
Конечно, все относительно. Глубина восстановления будет зависеть от многих факторов: концентрации кислоты (90%, 80%, 60%), температуры и т.д. Поэтому совсем уж точно предсказать продукты нельзя. Приведенная выше таблица тоже имеет свой процент приблизительности, но пользоваться ей можно. Еще необходимо помнить, что в ЕГЭ, когда продукт восстановленной серы не указан, и металл не отличается особой активностью, то, скорее всего, составители имеют в виду SO2. Нужно смотреть по ситуации и искать зацепки в условиях.
SO2 – это вообще частый продукт ОВР с участием конц. серной кислоты.
h3SO4 (конц) окисляет некоторые неметаллы (которые проявляют восстановительные свойства), как правило, до максимальной — высшей степени окисления (образуется оксид этого неметалла). Сера при этом тоже восстанавливается до SO2:
C + 2H2SO4(конц.) → CO2↑ + 2H2O + 2SO2↑
2P + 5H2SO4(конц.) → P2O5 + 5H2O + 5SO2↑
Свежеобразованный оксид фосфора (V) реагирует с водой, получается ортофосфорная кислота. Поэтому реакцию записывают сразу:
2P + 5H2SO4(конц) → 2H3PO4 + 2H2O + 5SO2↑
То же самое с бором, он превращается в ортоборную кислоту:
2B + 3H2SO4(конц) → 2H3BO3 + 3SO2↑
Очень интересны взаимодействие серы со степенью окисления +6 (в серной кислоте) с «другой» серой (находящейся в другом соединении). В рамках ЕГЭ рассматривается взаимодействиеh3SO4 (конц) с серой (простым веществом) и сероводородом.
Начнем с взаимодействия серы (простого вещества) с концентрированной серной кислотой. В простом веществе степень окисления 0, в кислоте +6. В этой ОВР сера +6 будет окислять серу 0. Посмотрим на диаграмму степеней окисления серы:
Сера 0 будет окисляться, а сера +6 будет восстанавливаться, то есть понижать степень окисления. Будет выделяться сернистый газ:
2H2SO4(конц.) + S → 3SO2↑ + 2H2O
Но в случае с сероводородом:
Образуется и сера (простое вещество), и сернистый газ:
H2SO4(конц.) + H2S → S↓ + SO2↑ + 2H2O
Этот принцип часто может помочь в определении продукта ОВР, где окислитель и восстановитель – один и тот же элемент, в разных степенях окисления. Окислитель и восстановитель «идут навстречу друг другу» по диаграмме степеней окисления.
h3SO4 (конц) , так или иначе, взаимодействует с галогенидами. Только вот тут надо понимать, что фтор и хлор – «сами с усами» и с фторидами и хлоридами ОВР не протекает, проходит обычный ионно-обменный процесс, в ходе которого образуется газообразный галогеноводород:
CaCl2 + H2SO4(конц.) → CaSO4 + 2HCl↑
CaF2 + H2SO4(конц.) → CaSO4 + 2HF↑
А вот галогены в составе бромидов и иодидов (как и в составе соответствующих галогеноводородов) окисляются ей до свободных галогенов. Только вот сера восстанавливается по-разному: иодид является более cильным восстановителем, чем бромид. Поэтому иодид восстанавливает серу до сероводорода, а бромид до сернистого газа:
2H2SO4(конц.) + 2NaBr → Na2SO4 + 2H2O + SO2↑ + Br2
H2SO4(конц.) + 2HBr → 2H2O + SO2↑ + Br2
5H2SO4(конц.) + 8NaI → 4Na2SO4 + 4H2O + H2S↑ + 4I2↓
H2SO4(конц.) + 8HI → 4H2O + H2S↑ + 4I2↓
Хлороводород и фтороводород (как и их соли) устойчивы к окисляющему действию h3SO4 (конц).
И наконец, последнее: для концентрированной серной кислоты это уникально, больше никто так не может. Она обладает водоотнимающим свойством.
Это позволяет использовать концентрированную серную кислоту самым разным образом:
Во-первых, осушение веществ. Концентрированная серная кислота забирает воду от вещества и оно «становится сухим».
Во-вторых, катализатор в реакциях, в которых отщепляется вода (например, дегидратация и этерификация):
H3C–COOH + HO–CH3 (H2SO4(конц.))→ H3C–C(O)–O–CH3 + H2O
H3C–CH2–OH (H2SO4(конц.))→ H2C=CH2 + H2O
Еще на эту тему:
Обсуждение: «Окислительные свойства серной кислоты»
(Правила комментирования)distant-lessons.ru
Напишите все реакции h3So4 Конц и Разб
Все — это слишком много.. . Но вот кое-что: С основными окисидами и гидроксидами и разбавленная и концентрированная серная кислота дает соль и воду h3SO4 + CuO => CuSO4 + h3O h3SO4 + 2NaOH => Na2SO4 + 2h3O Взаимодействие серной кислоты с металлами проходит различно в зависимости от её концентрации. Разбавленная серная кислота окисляет своим ионом водорода. Из-за этого она взаимодействует только с теми металлами, которые стоят в ряду напряжений до водорода, например: Zn + h3SO4 => ZnSO4 + h3. Но свинец не растворяется в разбавленной кислоте, поскольку образующаяся соль PbSO4 нерастворима. Концентрированная серная кислота является окислителем за счёт S(6+). Она окисляет металлы, стоящие в ряду напряжений до серебра включительно. Продукты её восстановления могут быть различными в зависимости от активности металла и от условий (концентрация кислоты, температура) . При взаимодействии с малоактивными металлами, например, с медью, кислота восстанавливается до SO2: Cu + 2h3SO4 => CuSO4 + SO2 + 2h3O. При взаимодействии с более активными металлами продуктами восстановления могут быть как SO2, так и свободная сера и сероводород. Так, при взаимодействии с цинком, в зависимости от условий, могут протекать реакции: Zn + 2h3SO4 => ZnSO4 + SO2 + 2h3O 3Zn + 4h3SO4 => 3ZnSO4 + S + 4h3O 4Zn + 5h3SO4 => 4ZnSO4 + h3S + 4h3O. 2h3SO4(конц. ) + 2Ag => SO2↑ + Ag2SO4↓ + 2h3O 2h3SO4(конц. ) + C(графит) => 2SO2↑ + СO2↑ + 2h3O h3SO4(конц. ) + h3S => SO2↑ + S↓ + 2h3O (не реагирует с Pt и Au, а также из-за пассивации с Be, Bi, Co, Fe и Mg). Серная кислота образует два ряда солей — средние, сульфаты (Na2SO4) и кислые, гидросульфаты (NaHSО4). Нерастворимые соли — PbSO4, CaSO4, BaSO4 и др. ; все кислые соли хорошо растворимы в воде. Безводная серная кислота хорошо растворяет SO3 и реагирует с ним, образуя тяжелую маслообразную жидкость — олеум (смесь h3SO4, h3S2O7 и SO3). Качественная реакция на серную кислоту: h3SO4 + BaCl2 = BaSO4↓ + 2HCl (выпадает белый осадок, не реагирующий с HCl и HNO3, в отличие от BaSO3 или ВаСО3).
touch.otvet.mail.ru
