Урок 15. Моляльность и молярность – HIMI4KA
В уроке 15 «Моляльность и молярность» из курса «Химия для чайников» рассмотрим понятия растворитель и растворенное вещество научимся выполнять расчет молярной и моляльной концентрации, а также разбавлять растворы. Невозможно объяснить что такое моляльность и молярность, если вы не знакомы с понятием моль вещества, поэтому не поленитесь и прочитайте предыдущие уроки. Кстати, в прошлом уроке мы разбирали задачи на выход реакции, посмотрите если вам интересно.

Химикам нередко приходится работать с жидкими растворами, так как это благоприятная среда для протекания химических реакций. Жидкости легко смешивать, в отличие от кристаллических тел, а также жидкость занимает меньший объем, по сравнению с газом. Благодаря этим достоинствам, химические реакции могут осуществляться гораздо быстрее, так как исходные реагенты в жидкой среде часто сближаются и сталкиваются друг с другом. В прошлых уроках мы отмечали, что вода относится к полярным жидкостям, и потому является неплохим растворителем для проведения химических реакций. Молекулы H2O, а также ионы H+ и OH—, на которых вода диссоциирована в небольшой степени, могут способствовать запуску химические реакций, благодаря поляризации связей в других молекулах или ослаблению связи между атомами. Вот почему жизнь на Земле зародилась не на суше или в атмосфере, а именно в воде.
Растворитель и растворенное вещество
Раствор может быть образован путем растворения газа в жидкости или твердого тела в жидкости. В обоих случаях жидкость является растворителем, а другой компонент — растворенное вещество. Когда раствор образован путем смешивания двух жидкостей, растворителем считается та жидкость, которая находится в большем количестве, иначе говоря имеет бОльшую концентрацию.
Расчет концентрации раствора
Молярная концентрация
Концентрацию можно выражать по разному, но наиболее распространенный способ — указание его молярности. Молярная концентрация (молярность) — это число молей растворенного вещества в 1 литре раствора. Единица молярности обозначается символом M. Например два моля соляной кислоты на 1 литр раствора обозначается 2 М HCl. Кстати, если на 1 литр раствора приходится 1 моль растворенного вещества, тогда раствор называется одномолярным. Молярная концентрация раствора обозначается различными символами:
- cx, Смx, [x], где x — растворенное вещество
Формула для вычисления молярной концентрации (молярности):
где n — количество растворенного вещества в молях, V — объем раствора в литрах.
Пару слов о технике приготовления растворов нужной молярности. Очевидно, что если добавить к одному литру растворителя 1 моль вещества, общий объем раствора будет чуть больше одного литра, и потому будет ошибкой считать полученный раствор одномолярным. Чтобы этого избежать, первым делом добавляем вещество, а только потом доливаем воду, пока суммарный объем раствора не будет равным 1 л. Полезно будет запомнить приближенное правило аддитивности объемов, которое гласит, что объем раствора приближенно равен сумме объемов растворителя и растворенного вещества. Растворы многих солей приближенно подчиняются данному правилу.
Пример 1. Химичка дала задание растворить в литре воды 264 г сульфата аммония (NH4)2SO4, а затем вычислить молярность полученного раствора и его объем, основываясь на предположении об аддитивности объемов. Плотность сульфата аммония равна 1,76 г/мл.
Решение:
Определим объем (NH4)2SO4 до растворения:
- 264 г / 1,76 г/мл = 150 мл = 0,150 л
Пользуясь правилом аддитивности объемов, найдем окончательный объем раствора:
- 1,000 л + 0,150 л = 1,150 л
Число молей растворенного сульфата аммония равно:
- 264 г / 132 г/моль = 2,00 моля (Nh5)2SO4
Завершающий шаг! Молярность раствора равна:
- 2,000 / 1,150 л = 1,74 моль/л, т.е 1,74 М (NH4)2SO4
Приближенным правилом аддитивности объемов можно пользоваться только для грубой предварительной оценки молярности раствора. Например, в примере 1, объем полученного раствора на самом деле имеет молярную концентрацию равную 1,8 М, т.е погрешность наших расчетов составляет 3,3%.
Моляльная концентрация
Наряду с молярностью, химики используют моляльность, или моляльную концентрацию, в основе которой учитывается количество использованного растворителя, а не количество образующегося раствора. Моляльная концентрация — это число молей растворенного вещества в 1 кг растворителя (а не раствора!). Моляльность выражается в моль/кг и обозначается маленькой буквой m. Формула для вычисления моляльной концентрации:
где n — количество растворенного вещества в молях, m — масса растворителя в кг
Для справки отметим, что 1 л воды = 1 кг воды, и еще, 1 г/мл = 1 кг/л.
Пример 2. Химичка попросила определить моляльность раствора, полученного при растворении 5 г уксусной кислоты C2H4O2 в 1 л этанола. Плотность этанола равна 0,789 г/мл.
Решение:
Число молей уксусной кислоты в 5 г равно:
- 5,00 г / 60,05 г/моль = 0,833 моля C2H4O2
Масса 1 л этанола равна:
- 1,000 л × 0,789 кг/л = 0,789 кг этанола
Последний этап. Найдем моляльность полученного раствора:
- 0,833 моля / 0,789 кг растворителя = 0,106 моль/кг
Единица моляльности обозначается Мл, поэтому ответ также можно записать 0,106 Мл.
Разбавление растворов
В химической практике часто занимаются разбавлением растворов, т.е добавлением растворителя. Просто нужно запомнить, что число молей растворенного вещества при разбавлении раствора остается неизменным. И еще запомните формулу правильного разбавления раствора:
- Число молей растворенного вещества = c1V1 = c2V2
где с1 и V1 — молярная концентрация и объем раствора до разбавления, с2 и V2 — молярная концентрация и объем раствора после разбавления. Рассмотрите задачи на разбавление растворов:
Пример 3. Определите молярность раствора, полученного разбавлением 175 мл 2,00 М раствора до 1,00 л.
Решение:
В условие задача указаны значения с1, V1 и V2, поэтому пользуясь формулой разбавления растворов, выразим молярную концентрацию полученного раствора с2
- с2 = c1V1 / V2 = (2,00 М × 175 мл) / 1000 мл = 0,350 М
Пример 4 самостоятельно. До какого объема следует разбавить 5,00 мл 6,00 М раствора HCl, чтобы его молярность стала 0,1 М?
Ответ: V2 = 300 мл
Без сомнения, вы и сами догадались, что урок 15 «Моляльность и молярность» очень важный, ведь 90% все лабораторных по химии связаны с приготовлением растворов нужной концентрации. Поэтому проштудируйте материал от корки до корки. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
| | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Концентрация. Доля. / / Концентрации растворов. Массовая и молярная концентрация, Титр, Моляльность, Мольная, массовая, объемная доли. Нормальная (эквивалентная) концентрация, Фактор эквивалентности, Молярная масса эквивалента вещества
|
dpva.ru
Моляльность (молярная весовая концентрация)
Моляльность — количество растворённого вещества (число молей) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/ кгназывают0,5-моляльным.
,
где:
ν — количество растворённого вещества,моль;
m2— масса растворителя, кг.
Hесмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массурастворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Нормальная концентрация (мольная концентрация эквивалента)
Нормальная концентрация — количество эквивалентовданного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л. Для записи концентрации таких растворов используют сокращения «н». Например, раствор содержащий 0,1 моль/л, называют децинормальным и записывают как0,1 н.
,
где:
ν — количество растворённого вещества, моль;
V — общий объём раствора, л;
z — фактор эквивалентности.
Так как нормальность может быть определена только для данной реакции, то в разных реакциях величина нормальности одного и того же раствора может оказаться неодинаковой. Например, одномолярный раствор H 2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4 (один атом водорода замещаемый в реакции), и двухнормальным в реакции с образованием Na2SO4 (два атома водорода замещаются в реакции).
Пример: Рассчитайте молярность и нормальность 70%-ного раствора H2SO4 (r = 1,615 г/мл).
Решение: Для вычисления молярности и нормальности надо знать число граммов H2SO4в 1 л раствора. 70% -ный раствор H2SO4 содержит 70 г H2SO4 в 100 г раствора. Это весовое количество раствора занимает объём
V = 100 / 1,615 = 61,92 мл
Следовательно,
в 1 л раствора содержится 70 · 1000 / 61,92 =
1130,49 г H2SO4 Отсюда молярность данного раствора
равна: 1130,49 / М (H
Титр раствора
Титр раствора — масса растворённого вещества в 1 мл раствора.
,
где:
m1— масса растворённого вещества, г;
V — общий объём раствора, мл;
В аналитической химииобычно концентрациютитрантапересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора.
Мольная (молярная) доля
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
,
где:
ν i— количествоi-го компонента, моль;
n — число компонентов;
Другие способы выражения концентрации растворов
Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации. Например, в фотометрии часто используют массовую концентрацию, равную массе растворённого вещества в 1 л раствора. При приготовлении растворов кислот часто указывают, сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты (например, 1:3). Иногда используют также отношение масс (отношение массы растворённого вещества к массе растворителя) и отношение объёмов (аналогично, отношение объёма растворяемого вещества к объёму растворителя.
studfiles.net
Способы выражения концентраций
Среди окружающих нас веществ, лишь немногие представляют собой чистые вещества. Большинство являются смесями, состоящими из нескольких компонентов, которые могут находиться в одном или различных фазовых состояниях. Смеси, имеющие однородный состав являются гомогенными, неоднородный состав – гетерогенными. Иначе, гомогенные смеси, называют растворами, в которых одно вещество полностью растворяется в другом (растворителе). Растворитель – это тот компонент раствора, который при образовании раствора сохраняет свое фазовое состояние. Он обычно находится в наибольшем количестве. Существуют растворы газовые, жидкие и твердые. Но более всего распространены жидкие растворы, поэтому, в данном разделе, именно на них мы сосредоточим свое внимание.
Существует множество способов измерить количество вещества, находящегося в единице объема или массы раствора, это так называемые способы выражения концентрации раствора. Каждый их методов занимает важное место в количественном и качественном анализе и находит в химии свое применение, поэтому при изучении химии, необходимы знания о том, каким образом можно выразить концентрацию растворов. Итак, приступим к рассмотрению каждого из методов.
Концентрацию раствора можно охарактеризовать как качественную и количественную.
Качественная концентрация характеризуется такими понятиями, как разбавленный и концентрированный раствор.
С этой точки зрения растворы можно классифицировать на:
- Насыщенные – растворы с максимально возможным количеством растворенного вещества. Количество растворяемого вещества, необходимое для получения насыщенного раствора определяет растворимость этого вещества.
- Ненасыщенные – любые растворы, которые все еще могут растворять введенное вещество.
- Пересыщенные – растворы, в которых растворено больше вещества, чем максимально возможное. Такие растворы очень нестабильны и в определенных условиях растворенное вещество будет выкристаллизовываться из него, до тех пор, пока не образуется насыщенный раствор.
Количественная концентрация выражается через молярную, нормальную (молярную концентрацию эквивалента), процентную, моляльную концентрации, титр и мольную долю.
- Наиболее распространенный способ выражения концентрации растворов – молярная концентрация растворов или молярность. Она определяется как количество молей n растворенного вещества в одном литре раствора V:
См = n/V, моль/л (моль ·л-1 )
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным — растворено 0,01 моля вещества, миллимолярным — растворено 0,001 моля вещества.
Термин «молярная концентрация» распространяется на любой вид частиц. Вместо обозначения единицы измерения — моль/л, возможно такое ее обозначение – М, например, 0,2 М HCl.
- Молярная концентрация эквивалента или нормальная концентрация растворов (нормальность).
Понятие эквивалентности мы уже вводили здесь. Напомним, что эквивалент – это условная частица, которая равноценна по химическому действию одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях. Например, эквивалент KMnO4 в окислительно – восстановительной реакции в кислой среде представляет собой 1/5 (KMnO4).
Введем понятие фактор эквивалентности – число, обозначающее, какая доля условной частицы реагирует с 1 ионом водорода в данной кислотоно-основной реакции или с одним электроном в данной окислительно – восстановительной реакции. Он может быть равен 1 или быть меньше 1. Фактор эквивалентности для предыдущего примера fэкв(KMnO4) = 1/5.
Следующее понятие – молярная масса эквивалента вещества х. Это масса 1 моля эквивалента этого вещества, равная произведению фактора эквивалентности на молярную массу вещества х:
Мэ = fэкв· М(х)
Молярная концентрация эквивалента определяется числом молярных масс эквивалентов на 1 литр раствора. Эквивалент определяется в соответствии с типом рассматриваемой реакции.
Сн = nэ/V, моль/л (моль ·л-1)
Для обозначения нормальной концентрации допускается сокращение «н» вместо «моль/л».
- Процентная концентрация раствора или массовая доля показывает сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора. Это отношение массы m (х) вещества x к общей массе m раствора или смеси веществ:
ω (х) = m (х)/m,
Массовую долю выражают в долях от единицы или процентах.
- Моляльная концентрация раствора b (x) показывает количество молей n растворенного вещества х в 1 кг. растворителя m:
b (x) = n(x)/m, моль/кг
- Титр раствора показывает массу растворенного вещества х, содержащуюся в 1 мл. раствора:
Т (х) = m (х)/V, г/мл
- Мольная или молярная доля α (х) вещества х в растворе равна отношению количества данного вещества n(х) к общему количеству всех веществ, содержащихся в растворе Σn:
α (х) = n(х)/ Σn.
Между приведенными способами выражения концентраций существует взаимосвязь, которая позволяет, зная одну единицу измерения концентрации найти (пересчитать) ее в другие единицы. Существуют формулы, позволяющие провести такой пересчет, которые, в случае необходимости, вы сможете найти в сети. В разделе задач показано, как произвести такой пересчет, не зная формул.
zadachi-po-khimii.ru
Как правильно пересчитать концентрации растворов из одних единц в другие — 27 Ноября 2012 — Примеры решений задач
Пересчет концентраций растворов из одних единиц в другие
При пересчете процентной концентрации в молярную и наоборот, необходимо помнить, что процентная концентрация рассчитывается на определенную массу раствора, а молярная и нормальная — на объем, поэтому для пересчета необходимо знать плотность раствора. Если мы обозначим: с — процентная концентрация; M — молярная концентрация; N — нормальная концентрация; э — эквивалентная масса, p — плотность раствора; m — мольная масса, то формулы для пересчета из процентной концентрации будут следующими:
M = (c · p · 10) / m
N = (c · p · 10) / э
Этими же формулами можно воспользоваться, если нужно пересчитать нормальную или молярную концентрацию на процентную.
Пример
Какова молярная и нормальная концентрация 12%-ного
раствора серной кислоты, плотность которого р = 1,08 г/см3?
Решение
Мольная масса серной кислоты равна 98. Следовательно,
m(H2SO4) = 98 и э(H2SO4) = 98 : 2 = 49.
Подставляя необходимые значения в формулы, получим:
M = (12 · 1,08 · 10) / 98 = 1,32 M
б) Нормальная концентрация 12% раствора серной кислоты равна
N = (12 ·1,08 ·10) / 49 = 2,64 H.
Иногда в лабораторной практике приходится
пересчитывать молярную концентрацию в нормальную и наоборот. Если
эквивалентная масса вещества равна мольной массе (Например, для HCl,
KCl, KOH), то нормальная концентрация равна молярной концентрации. Так,
1 н. раствор соляной кислоты будет одновременно 1 M раствором. Однако
для большинства соединений эквивалентная масса не равна мольной и,
следовательно, нормальная концентрация растворов этих веществ не равна
молярной концентрации.
Для пересчета из одной концентрации в другую можно использовать формулы:
M = (N · Э) / m
N = (M · m) / Э
Пример
Нормальная концентрация 1 М раствора серной кислоты
N = (1 · 98) / 49 = 2 H.
Пример
Молярная концентрация 0,5 н. Na2CO3
M = (0,5· 53) / 106 = 0,25 M.
Упаривание, разбавление, концентрирование, смешивание растворов
Имеется mг исходного раствора с массовой долей растворенного вещества w1 и плотностью ρ1.
Упаривание раствора
В результате упаривания исходного раствора его масса уменьшилась на Dm г. Определить массовую долю раствора после упаривания w2
Решение
Исходя из определения массовой доли, получим выражения для w1 и w2 (w2 > w1):
w1 = m1 / m
(где m1 – масса растворенного вещества в исходном растворе)
m1 = w1·m
w1 = m1 / (m – Dm) = (w1· m) / (m – Dm)
Пример
Упарили 60 г 5%-ного раствора сульфата меди до 50 г. Определите массовую долю соли в полученном растворе.
m = 60 г; Dm = 60 – 50 = 10 г; w1 = 5% (или 0,05)
w2 = (0,05 · 60) / (60 – 10) = 3 / 50 = 0,06 (или 6%-ный)
Концентрирование раствора
Какую массу вещества (X г) надо дополнительно растворить в исходном растворе, чтобы приготовить раствор с массовой долей растворенного вещества w2?
Решение
Исходя из определения массовой доли, составим выражение для w1 и w2:
w1 = m1 / m2,
(где m1 – масса вещества в исходном растворе).
m1 = w1 · m
w2 = (m1+x) / (m + x) = (w1 · m + x) / (m+x)
Решая полученное уравнение относительно х получаем:
w2 · m + w2 · x = w1 · m + x
w2 · m – w1 · m = x – w2 · x
(w2– w1 ) · m = (1 – w2 ) · x
x = ((w2 – w1) · m) / (1 – w2 )
Пример
Сколько граммов хлористого калия надо растворить в
90 г 8%-ного раствора этой соли, чтобы полученный раствор стал
10%-ным?
m = 90 г
w1 = 8% (или 0,08), w2 = 10% (или 0,1)
x = ((0,1 – 0,08) ·90) / (1 – 0,1) = (0,02 · 90) / 0,9 = 2 г
Онлайн сервис решения задач по химии
www.reshim.su
Молярность раствора переход к моляльной концентрации
Для перехода от молярных концентраций М (г-моль на 1 л раствора) к моляльным т (г-моль на 1000 г Н2О), следует пользоваться следующим уравнением [c.226]Так как- процентная и моляльная концентрации относятся к весовым количествам раствора, а молярная, нормальная и титр — к объемным, то для перехода от одного вида выражения-концентраций к другому нужно знать относительную плотность-раствора. [c.85]
Концентрация раствора и различные способы ее выражения. Процентная, молярная, моляльная и нормальная концентрации. Титр. Расчеты при переходе от одной концентрации к другой. Приготовление раствора по навеске вещества и разбавлением концентрированного раствора. [c.84]
Пример 7. Вычисления, связанные с взаимным переходом одних форм выражения концентрации в другие. Вычислите нормальность, молярность И моляльность 10%-ного раствора USO4, плотность которого р = 1107 кг/м . [c.70]
Количество каждого компонента раствора может быть выражено в различных единицах, в связи с чем состав раствора выражают несколькими способами — молярными долями, моляльностью, молярностью и т. д. В табл. 1 приводятся формулы, позволяющие проводить необходимые пересчеты при переходе от одной системы выражения концентраций к другой. [c.51]
Л. На практике часто осуществляют переход от одного выражения концентрации к другому. Так как процентная н моляльная концентрации относятся к определенной массе раствора, а молярная и нормальная к его объему, то для перехода от одного способа выражения концентрации к другому нужно знать плотность раствора. [c.129]
Значения функций для перехода от моляльных концентраций т к молярным концентрациям с для водных растворов 1,1-электролитов [c.517]
Раствором называется однофазная система, образованная не менее чем двумя компонентами и способная в известных пределах к непрерывному изменению состава. Состав раствора или его концентрацию чаще всего выражают в молях растворенного вещества на один литр раствора (молярная концентрация), в молях растворенного вещества на 1000 г растворителя (моляльная концентрация), в молярных долях или в весовых процентах. Для перехода от одного способа выражения концентрации раствора к другому необходимо знать молекулярные веса компонентов и, в некоторых случаях, плотность раствора (при переходе от весовой концентрации к объемной и обратно). [c.180]
На основании (1.54) или (1.55) приходим к тому же уравнению Нернста (1.44), но выраженному через моляльные или рациональные активности, либо моляльные концентрации или мольные доли и соответствующие моляльные и рациональные-коэффициенты активности. При этом значение стандартного ОВ потенциала изменяется на постоянное слагаемое, содержащее плотность чистого растворителя [переход к ( °Ox/Red)m] либо плотность и молярную массу растворителя [переход к ( °ох/кеа) я]. Для водных растворов, поскольку для воды ро 1, активности йс йт и, следовательно, стандартные потенциалы ( °0х/Ееа)с и (Е°ох/пед)т практически одинаковы. Поэтому, хотя экспериментально чаще определяют с помощью уравнений, содержащих моляльные активности, второй потенциал, мы будем , пользоваться последним (без индексов т или с ) и для уравнений типа (1.44), содержащих молярные активности. При этом нужно помнить, что речь идет только о водных растворах. Переход же к ( °ox/Red)з и для водных, и других растворов, требует внесения определенной поправки. Проиллюстрируем это, используя практически важное соотнощение для ОВ потенциа- ч ла амальгамы металла, хотя в нем и не все активности выраже- ны через [c.17]
Разность химических потенциалов в соответствии с (VI. ) равна разности парциальных молярных энергий Гиббса и, следовательно, равна максимальной работе. Таким образом, соотношения ( 1.17) показывают, что коэффициент активности характеризует работу перенесения моля растворенного вещества из идеального раствора в реальный при постоянных температуре, давлении и концентрации. Левые части уравнений ( 1.17) неодинаковы (и правые, естественно, тоже), так как изменение химического потенциала, выражаемое этими уравнениями, относится к процессам перехода от идеального раствора к реальному при разных условиях при постоянной моляльности, постоянной молярности или постоянной молярной доле. В разбавленных растворах концентрации, выраженные в различных единицах, пропорциональны друг другу так же, как активности, и поэтому [c.103]
Коэффициент активности зависит от температуры и давления и, в свою очередь, является функцией концентрации раствора. Как коэффициент активности, так и сама активность зависят также от используемой шкалы концентраций. Справочные данные по коэффициентам активности для растворов электролитов почти всегда приводятся по шкале моляльностей (число молей растворенного вещества на килограмм растворителя). Используют также шкалу молярностей (число молей растворенного вещества на литр раствора) или мольных долей. Формулы перехода между коэффициентами активности разных шкал см. в [1, С. 49-52]. [c.755]
Растворимость. Обычно в технике растворимость выражают в процентах (содержание вещества в 100 г раствора—р). Мы будем однако пользоваться для характеристики растворимости концентрацией насыщенного раствора, выраженной в молях на литр раствора (молярность L), или в молях на 1000 г растворителя (моляльность /). Последняя величина имеет ряд преимуществ легкость ее определения весовым путем (которы всегда точнее объемного), большее соответствие теоретическим формулам и т. д. К сожалению, более старые данные больше частью относятся к величине L, переход от которой к / возмо жен, лишь когда известен удельный вес d. [c.224]
www.chem21.info
массовая доля, молярная концентрация, молярная концентрация эквивалента, моляльная концентрация, молярная доля, объёмная доля, титр.
Молярная концентрация равна количеству вещества (в молях), содержащегося в одном литре раствора. Она обозначается СМ и рассчитывается как отношение химического количества растворенного вещества (моль) Х к объему V раствора в литрах:
где m (Х) – масса растворенного вещества, г
М (Х) – молярная масса, г/моль
V – объем раствора, л.
Если объем V раствора измеряют в миллилитрах, то формула для расчета молярной концентрации имеет вид:
Молярная концентрация эквивалента (нормальность или нормальная концентрация) равна количеству вещества эквивалента (моль), содержащегося в одном литре раствора. Она обозначается Сн рассчитывается как отношение химического количества эквивалента растворенного вещества Х к объему раствора в литрах:
или, выразив в знаменателе молярную массу эквивалента через молярную массу вещества и фактор эквивалентности его в реакции по уравнению, получим:
В современных методах анализа широко используется разновидность массовой концентрации – титр.
Титр равен массе вещества (г), содержащейся в 1 мл раствора. Титр обозначается Т (Х) и рассчитывается, как отношение массы вещества Х к объему раствора V (мл):
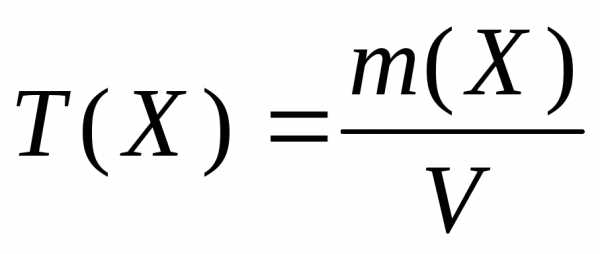
Можно установить связь между молярной концентрацией и титром:
Взаимосвязь молярной концентрацией раствора и его массовой долей описывается уравнением: ,
где ρ – плотность раствора, г/мл;
w (Х) – массовая доля растворенного вещества, %
Удобно использовать формулу, связывающую между собой молярную и нормальную концентрации:
В тех случаях, когда речь идет об отношении массы (или объема, или химического количества вещества) компонента к массе (или объему, или количеству вещества) всей системы, термин «концентрация» не употребляют. А говорят о «доле» – массовой, объемной или молярной. И выражают эту долю либо дробью, либо в процентах, принимая систему за 1 или за 100%.
Для обозначения доли компонента приняты следующие греческие буквы: массовая доля – ω (омега), объемная доля – φ (фи), молярная доля – χ (хи).
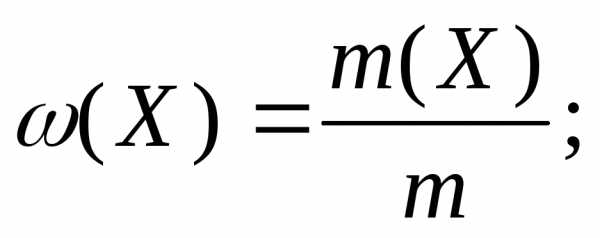
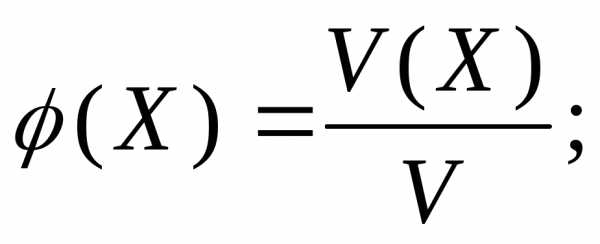
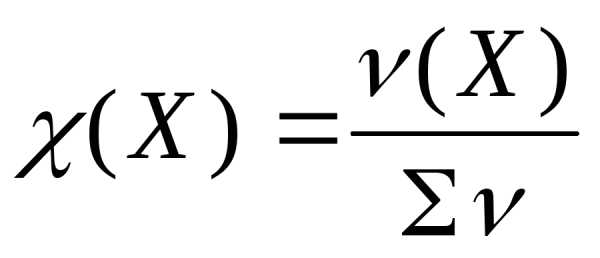
где m (Х) и m – массы компонента и масса всей системы
V (Х) и V – объемы компонента и объем всей системы
ν (Х) и Σ ν – количества вещества компонента и сумма всех количеств веществ всей системы.
Моляльность раствора – равна количеству вещества (моль) растворенного в 1 кг растворителя. Она обозначается Сm и рассчитывается по формуле:
42. Закон эквивалентов и его применение в количественном анализе. Способы определения точки эквивалентности. Способы приготовления рабочих растворов. Способы титрования: прямое, обратное, косвенное.
Химическим эквивалентом называется некая реальная или условная частица, которая может присоединять или высвобождать один ион водорода в кислотно-основных реакциях или один электрон в окислительно-восстановительных реакциях.
Важнейшей характеристикой химического эквивалента является молярная масса эквивалента вещества, выраженная в г/моль.
Молярная масса эквивалента вещества (г/моль) – это масса 1 моль эквивалента вещества, рассчитываемая по формуле:
,
где fэ − фактор эквивалентности, определяемый из уравнения химической реакции.
Фактор эквивалентности fэ(Х) – число, показывающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
Фактор эквивалентности рассчитывается по уравнению:
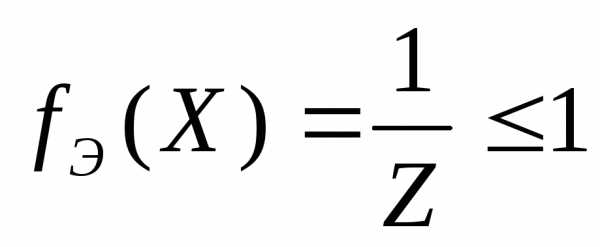 ,
где Z
– суммарный заряд обменивающихся ионов
для кислотно-основных реакций или число
принятых или отданных электронов для
окислительно-восстановительных реакций.
,
где Z
– суммарный заряд обменивающихся ионов
для кислотно-основных реакций или число
принятых или отданных электронов для
окислительно-восстановительных реакций.
Закон эквивалентов: вещества взаимодействуют друг с другом и образуются в результате химических реакций в количествах, пропорциональных их эквивалентам.
Для условной химической реакции аА + bВ → сС + dD:
νЭ (A) = νЭ (B) = νЭ (C) = νЭ (D),
где νЭ – химическое количество эквивалента вещества, моль
νЭ = 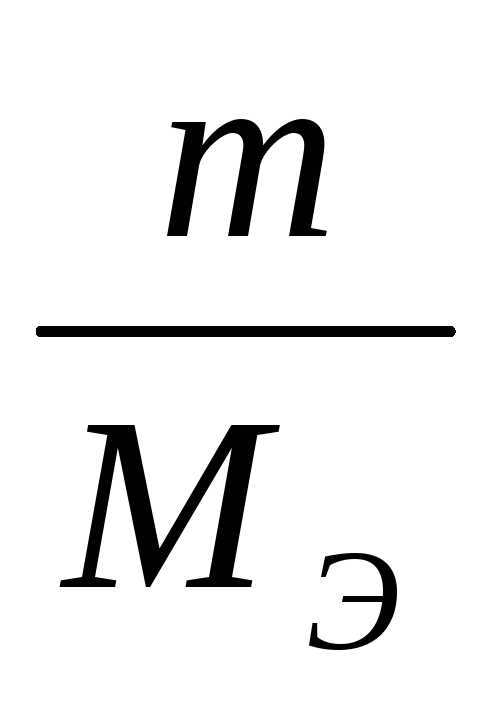 =>
=>
Титрование – это процесс постепенного добавления титранта к анализируемой пробе, продолжающийся до точки эквивалентности.
Точка эквивалентности (момент эквивалентности) – это момент, когда количество вещества эквивалента в добавленном растворе титранта становится равным количеству анализируемого вещества.
Титрант – это раствор точно известной концентрации, применяемый для титрования.
Существует два способа приготовления титрантов:
1. Взвешенную на аналитических весах точную навеску вещества растворяют в мерной колбе и доводят объем раствора водой до метки. Зная массу растворенного вещества (m) и объем полученного раствора (V), можно вычислить его титр: Т = m/V.
Титранты, приготовленные таким образом, называются стандартными растворами и для их получения применимы только те вещества, которые удовлетворяют следующим требованиям:
а) вещество должно быть химически чистым, т.е. должно содержать посторонних примесей не более 0,05-0,1%;
б) состав вещества должен строго соответствовать формуле;
в) вещество должно быть устойчивым при хранении и в твердом виде и в растворе;
2. Если вещества не удовлетворяют этим требованиям, то сначала готовят раствор приблизительно нужной концентрации, а затем устанавливают его точную концентрацию, титруя стандартным раствором. Такие титранты называются стандартизированными или рабочими растворами.
Разнообразные методы титриметрического анализа можно классифицировать по типу используемых реакций и по способу проведения анализа.
studfiles.net
