Критична точка / Телеканал Україна
07:59
Корупційні чиновники
07:57
Реальні сценарії гостросюжетних пограбувань
06:39
Шкільна жорстокість
05:35
Як можна попередити дитячу жорстокість?
09:53
В які пастки потрапляють тварини
03:57
Як убезпечити вашу дитину в квартирі?
{$ e.futureEpisodeTitle $}
{$ e.name $}
tochka.kanalukraina.tv
КРИТИЧЕСКАЯ ТОЧКА — это… Что такое КРИТИЧЕСКАЯ ТОЧКА?
-точка на диаграмме состояния веществ, соответствующая критическому состоянию, в к-ром две (или более) фазы, находящиеся в термодинамич. равновесии, становятся тождественными по своим свойствам. В частности, с приближением к критическому состоянию различия в плотности, составе и др. свойствах сосуществующих фаз, а также теплота фазового перехода и межфазное поверхностное натяжение уменьшаются, а в К. т. равны нулю.
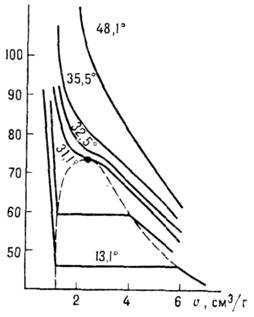
Рис. 1. Изотермы двуокиси углерода для нескольких температур, р — давление, — удельный объём, К — критическая точка. Сплошные линии-изотермы, штриховые — кривые сосуществования жидкости и газа.
На диаграмме состояния однокомпонентной системы существует лишь одна К. т. равновесия жидкость — газ, характеризующаяся значениями критич. темп-ры Т с, критич. давления р с, критич. удельного объёма (см. табл. и рис. 1).
Критические параметры некоторых веществ
Оксид углерода СО | |||||
Диоксид углерода СО 2 | |||||
Гексафторид серы SF6 | |||||
Сероводород H2S | |||||
Диоксид серы SO2 | |||||
Триоксид серы SO3 | |||||
При темп-pax выше Т с возможен непрерывный (без фазового превращения) переход вещества из газообразного состояния в жидкое, поэтому К. т. является конечной точкой линии двухфазного равновесия.
В К. т. соприкасаются линия двухфазного равновесия (бинодаль) и граница термодинамич. устойчивости (спинодаль), поэтому К. т. характеризуется условием В бинарных (двухкомпонентных) растворах существуют линии К. т. (критич. кривые), при этом возможны не только К. т. равновесия жидкость — газ (рис. 2), но и К. т. равновесия двух жидких фаз (К. т. растворимости, рис. 3), двух газовых фаз (рис. 4) или двух твёрдых фаз. Линии К. т. равновесия жидкость — газ начинаются и оканчиваются в К. т. индивидуальных веществ. Чаще всего (в однокомпонентной системе всегда) расслоение на две фазы происходит при понижении темп-ры. Однако в растворах возможно существование нижних К. т. или даже одновременно нижних и верхних К. т. (рис. 5). К. т. растворов дополнительно характеризуются критической концентрацией х с. К. т. любого типа в бинарных растворах определяется условием где — разность хим. потенциалов компонентов раствора, х — концентрация одного из компонентов. Линии К. т. равновесия жидкость — жидкость и газ — газ обычно пересекаются с линиями др. фазовых равновесий. При этом К. т. равновесия двух фаз в присутствии третьей (некритич. фазы) наз. конечной критич. точкой. В многокомпонентных растворах (3 и более компонентов) существуют линии конечных К. т. В точке, где сливаются линии конечных К. т. равновесия жидкость — жидкость (в присутствии некритич. газовой фазы) и равновесия жидкость — газ (в присутствии некритич. жидкой фазы), становятся тождественными 3 фазы. Такая точка наз. трикритической. Возможно существование точек высш. порядка (поликритических), в к-рых становятся тождественными 4 фазы и более.

Рис. 2. Кривые равновесия жидкость -пар и критическая кривая системы пропан- изопентан; 1, 2 — кривые жидкости (сплошные) и пара (пунктирные) для смесей с мольной долей изопентана 0,206 и 0,607; К п, К И — критические точки пропана и изопентана, K1,2 — критические точки этих смесей.
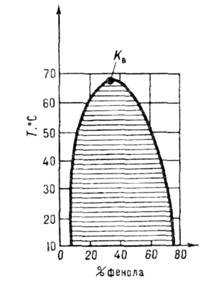
Рис. 3. Кривая расслоения на две фазы жидкого раствора вода — фенол при р = const, KB — верхняя критическая точка. Заштрихована область двухфазного равновесия.
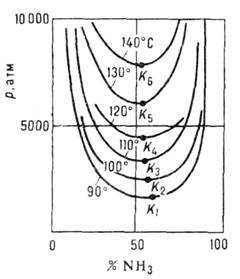
Рис. 4. Кривые фазового равновесия газ — газ в системе азот — аммиак при высоких давлениях, К i — критические точки
Переход системы из однофазного состояния в двухфазное вне К. т. и изменение состояния в самой К. т. существенно различаются. В первом случае при расслаивании на две фазы переход начинается с появлением небольшого кол-ва (зародыша) 2-й фазы, свойства к-рой отличаются от свойств 1-й фазы, что сопровождается выделением или поглощением теплоты фазового перехода. Поскольку возникновение зародыша новой фазы приводит к появлению поверхности раздела фаз и поверхностной энергии, для его рождения требуется определ. энергия. Это означает, что такой фазовый переход (1-го рода) может начаться лишь при нек-ром переохлаждении (перегреве) вещества, способствующем появлению устойчивых зародышей новой фазы (см. Кинетика фазовых переходов).
Рис. 5. В двухкомпонентной жидкой системе никотин — вода имеются верхняя критическая точка растворения К в и нижняя К н; заштрихована область двухфазного равновесия.
К. т. обнаруживает глубокую аналогию с точками фазовых переходов 2-го рода: в К. т. фазовый переход происходит в масштабах всей системы, а свойства флуктуационно возникающей новой фазы бесконечно мало отличаются от свойств исходной фазы. Поэтому возникновение новой фазы не связано с поверхностной энергией, т. е. исключается перегрев (переохлаждение), и фазовый переход не сопровождается выделением или поглощением теплоты, что характерно для фазовых переходов 2-го рода. Как и вблизи фазовых переходов 2-го рода, вблизи К. т. наблюдается ряд особенностей в поведении физ. свойств, обусловленных аномальным ростом флуктуации.
Лит. см. в ст. Критические явления. М. А. Анисимов.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
dic.academic.ru
КРИТИЧЕСКАЯ ТОЧКА • Большая российская энциклопедия
В книжной версии
Том 16. Москва, 2010, стр. 68
Скопировать библиографическую ссылку:
Авторы: И. К. Камилов
КРИТИ́ЧЕСКАЯ ТО́ЧКА, конечная точка кривой сосуществования фаз (фазовой границы), описывающей на фазовой диаграмме термодинамич. равновесие двух фаз вещества. К. т. соответствует критическое состояние вещества; в окрестности К. т. наблюдаются критические явления.
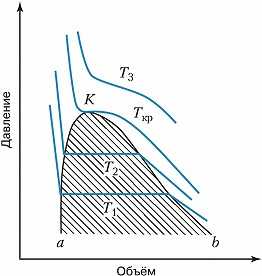
Диаграмма равновесия жидкость – газ для чистого вещества; T1, T2, Tкр, T3 – изотермы, K – критическая точка, aKb – пограничная кривая (бинодаль).
Для системы жидкость – газ эксперим. зависимость давления $p$ от объёма $V$ при разных темп-рах $T$ (изотермы) имеет вид, представленный на рис. Точки перехода изотерм на горизонтальные участки образуют пограничную кривую (бинодаль) $аKb$, ниже которой система жидкость – газ находится в двухфазном состоянии, а выше – в однофазном. Горизонтальные участки изотерм с ростом $T$ непрерывно стягиваются в точку $K$, в которой удельные объёмы (или плотности) жидкости и газа становятся равными. В этой точке исчезает двухфазное состояние, образуется новое состояние (фаза). Оно называется критическим, а сама точка $K$ – критич. точкой. Этой точке соответствуют т. н. критические параметры: $T_{кр}$ (критич. темп-ра), $p_{кр}$ (критич. давление), $V_{кр}$ (критич. объём). Каждое вещество имеет свою К. т. В однокомпонентной системе существует только одна К. т. В многокомпонентных системах существуют кривые или поверхности К. т. В растворах (смесях) при изменении содержания одного из компонентов наблюдается кривая критич. точек, т. к. при этом добавляется новый параметр – критич. концентрация $x_{кр}$.
К. т. является в математич. отношении особой точкой для термодинамич. функций системы, которые в этой точке принимают экстремальные значения – либо бесконечность, либо нуль. В частности, теплоёмкость, сжимаемость, коэф. термич. расширения, коэф. поглощения звука обращаются в бесконечность, а теплота перехода, скорость звука, коэф. диффузии, разность плотностей жидкости и пара, поверхностное натяжение обращаются в нуль.
В соответствии с числом фаз, которые становятся тождественными в К. т., введены понятия трикритической, тетракритической и др. поликритических (мультикритических) точек. Критические и поликритические точки обнаружены на фазовых диаграммах спонтанно упорядоченных сред. В магнетиках эти точки получили назв. магнитных К. т., в сегнетоэлектриках – сегнетоэлектрических К. т., и т. д.
bigenc.ru
Критическая точка
Как следует из фазовой P–Vдиаграммы (рис.3.3) по мере роста давления различие между удельными объемами кипящей жидкости (V’) и сухого насыщенного пара (V») постепенно уменьшается и в точке К становится равным нулю. Такое состояние называется критическим, а точка К – критической точкой вещества.
Pк,Tк, Vк ,Sк – критические термодинамические параметры вещества.
Например, для воды:
Pк = 22,129 МПа;
Tк = 374, 140С;
Vк= 0, 00326 м3/кг
В критической точке свойства жидкой и газообразной фаз одинаковы.
Как следует из фазовой Т – Sдиаграммы (рис 3.4) в критической точке теплота парообразования, изображаемая как площадь под горизонтальной линией фазового перехода (С’ — С»), от кипящей жидкости к сухому насыщенному пару , равна нулю.
Точка К для изотермы Тк в фазовойP–Vдиаграмме (рис.3.3) является точкой перегиба.
Изотерма Тк , проходящая через точку К, являетсяпредельной изотермой двухфазной области, т.е. отделяет область жидкой фазы от области газообразной.
При температуре выше Тк изотермы уже не имеют ни прямолинейных участков, свидетельствующих о фазовых переходах, ни точки перегиба, характерной для изотермы Тк , а постепенно принимают вид плавных кривых, близких по форме к изотермам идеального газа.
Понятия «жидкость» и «газ» (пар) в известной степени условны, т.к. взаимодействия молекул в жидкости и газе имеют общие закономерности, отличаясь лишь количественно. Этот тезис можно проиллюстрировать рисунком3.6, где переход из точки Е газообразной фазы в точку L жидкой фазы произведен в обход критической точки К по траектории EFL.
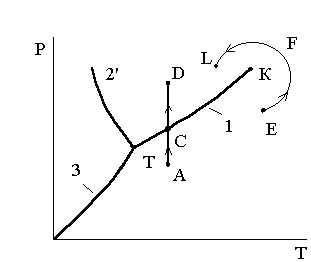
Рис.3.6. Два варианта фазового перехода
из газообразной в жидкую фазу
При переходе по линии ADв точке С происходит разделение вещества на две фазы и затем вещество постепенно переходит из газообразной (парообразной) фазы в жидкую.
В точке С свойства вещества изменяются скачком (в фазовой P–Vдиаграмме точка С фазового перехода превращается в линию фазового перехода (С’ — С»)).
При переходе по линии EFLпревращение газа в жидкость происходит непрерывно, так как линияEFLнигде не пересекает кривую парообразования ТК, где вещество одновременно существует в виде двух фаз: жидкой и газообразной. Следовательно, при переходе по линииEFLвещество не будет распадаться на две фазы и останется однофазным.
Критическая температура Тк– это предельная температура равновесного сосуществования двух фаз.
Применительно к термодинамическим процессам в сложных системах это классическое лаконичное определение Ткможет быть развернуто следующим образом:
Критическая температура Тк — это нижняя температурная граница области термодинамических процессов, в которых невозможно появление двухфазного состояния вещества «газ — жидкость» ни при каких изменениях давления и температуры. Это определение иллюстрируются рис.3.7 и 3.8. Из этих рисунков следует, что эта область ограниченная критической температурой, охватывает только газообразное состояние вещества (газовую фазу). Газообразное состояние вещества, именуемое паром в эту область не входит.

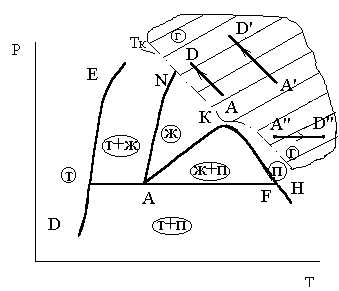
Рис. 3.7. К определению критической Рис.3.8.К определению критиче-
температуры ской температуры
Из этих рисунков следует, что эта заштрихованная область, ограниченная критической температурой, охватывает только газообразное состояние вещества (газовую фазу). Газообразное состояние вещества, именуемое паром в эту область не входит.
Используя понятие критической точки, можно из общего понятия «газообразное состояние вещества» выделить понятие «пар».
Пар– это газообразная фаза вещества в области температур ниже критической.
В термодинамических процессах, когда линия процесса пересекает или кривую парообразования ТК, или кривую сублимации 3, газообразная фаза всегда сначала является паром.
Критическое давление Рк – это давление, выше которого разделение вещества на две одновременно и равновесно сосуществующие фазы: жидкость и газ невозможно при любой температуре.
Это классическое определение Рк, применительно к термодинамическим процессам в сложных системах можно сформулировать более подробно:
Критическое давление Рк – это нижняя по давлению граница области термодинамических процессов, в которых невозможно появление двухфазного состояния вещества «газ — жидкость» ни при каких изменениях давления и температуры. Это определение критического давления иллюстрируется рис.3.9. и 3.10. Из этих рисунков следует, что эта область, ограниченная критическим давлением, охватывает не только часть газообразной фазы, расположенную выше изобары Рк, но и часть жидкой фазы, расположенную ниже изотермы Тк.
Для сверхкритической области за вероятную (условную) границу «жидкость-газ» условно принимают критическую изотерму.
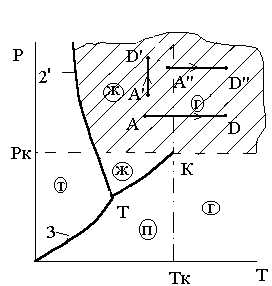
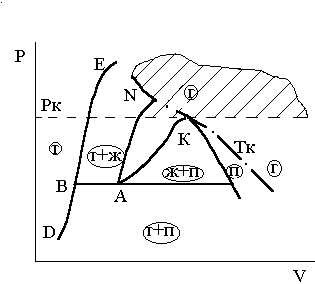
Рис.3.9.К определению критичес — Рис.3.10. К определению критического
кого давления давления
Если давление перехода много больше давления в критической точке, то вещество из твердого (кристаллического) состояния будет переходить прямо в газообразное состояние, минуя жидкое состояние.
Из фазовых Р-Т диаграмм аномального вещества (рис 3.6, 3.7, 3.9) это не очевидно, т.к. на них не показана та часть диаграммы, где вещество, имеющее при больших давлениях несколько кристаллических модификаций (и, соответственно, несколько тройных точек), снова приобретает нормальные свойства.
На фазовой Р – Т диаграмме нормального вещества рис. 3.11 этот переход из твердой фазы сразу в газообразную показан в виде процесса А’D’.

Рис. 3.11. Переход нормального
вещества из твердой фазы сразу в
газообразную при Р>Ртр
Переход вещества из твердой фазы в паровую, минуя жидкую, возложен лишь при Р<Ртр. Примером такого перехода, называемого сублимацией, является процесс АDна рис 3.11.
Критическая температура имеет весьма простое молекулярно – кинетическое истолкование.
Объединение свободно движущихся молекул в каплю жидкости при сжижении газа происходит исключительно под действием сил взаимного притяжения. При Т>Тккинетическая энергия относительного движения двух молекул больше энергии притяжения этих молекул, поэтому образование капель жидкости (т.е. сосуществование двух фаз) невозможно.
Критические точки имеют только кривые парообразования, так как они соответствуют равновесному сосуществованию двух изотропных фаз: жидкой и газообразной. Линии плавления и сублимации не имеют критических точек, т.к. они соответствуют таким двухфазным состояниям вещества, когда одна из фаз (твердая) являетсяанизотропной.

studfiles.net
Критическая точка — это… Что такое Критическая точка?
- Критическая точка
Критическая точка — многозначный термин:
Категория:- Многозначные термины
Wikimedia Foundation. 2010.
- Шабельников, Юрий Леонидович
- Убить Билла. Фильм 1
Смотреть что такое «Критическая точка» в других словарях:
КРИТИЧЕСКАЯ ТОЧКА — точка на диаграмме состояния, соответствующая критическому состоянию. К. т. двухфазного равновесия жидкость пар явл. конечной точкой на кривой испарения и характеризуется критич. значениями темп ры Tк, давления рк и объёма Vк (табл.). ПАРАМЕТРЫ… … Физическая энциклопедия
КРИТИЧЕСКАЯ ТОЧКА — изображает на диаграммах состояния критическое состояние вещества. Критическая точка заканчивается, напр., кривая фазового равновесия жидкость пар в системе координат: температура T, давление p … Большой Энциклопедический словарь
КРИТИЧЕСКАЯ ТОЧКА — предельная точка на кривой (см.) равновесия фаз системы, напр. жидкость пар, в которой исчезает различие между жидкостью и паром, а точка соответствует (см.) … Большая политехническая энциклопедия
критическая точка — Точка на термодинамической диаграмме, соответствующая критическому состоянию вещества. [Сборник рекомендуемых терминов. Выпуск 103. Термодинамика. Академия наук СССР. Комитет научно технической терминологии. 1984 г.] Тематики термодинамика… … Справочник технического переводчика
КРИТИЧЕСКАЯ ТОЧКА — КРИТИЧЕСКАЯ ТОЧКА, температура и давление, при превышении которых становится невозможным дальнейшее совместное существование жидкости и ее пара (или газа). Если газ медленно сжимать при температурах, превышающих критическую, или охлаждать при… … Научно-технический энциклопедический словарь
критическая точка — [critical point] критическая точка A1 [A1 critical point] температура превращения перлита ↔ аустенит в равновесной системе Fe Fe3C; критическая точка A2 [А2 critical point] температура, соответствующая точке Кюри феррита; критическая точка A3 [A3 … Энциклопедический словарь по металлургии
критическая точка — 3.2 критическая точка (critical point): Точка на кривой зависимости деформации образца от силы, в которой прямая, касательная к этой кривой, расходится с ней (см. рисунок 4а). Источник … Словарь-справочник терминов нормативно-технической документации
критическая точка — изображает на диаграммах состояния критическое состояние вещества; ею заканчивается, например, кривая фазового равновесия жидкость пар в системе координат: температура давление. * * * КРИТИЧЕСКАЯ ТОЧКА КРИТИЧЕСКАЯ ТОЧКА, изображает на… … Энциклопедический словарь
Критическая точка — Critical point Критическая точка. (1) Температура или давление, при которых возникают изменения в кристаллической структуре, фазе, физических свойствах. Также называемая температу рой превращения. (2) В диаграмном равновесии сочетание состава… … Словарь металлургических терминов
критическая точка — kritinis taškas statusas T sritis automatika atitikmenys: angl. critical point vok. kritischer Punkt, m rus. критическая точка, f pranc. point critique, m … Automatikos terminų žodynas
Книги
- Ресторанные ведомости № 11/2018, РИК Ресторанофф. В новом номере (ноябрь 2018) журнала «Ресторанные ведомости»: Cover story Ростислав Ордовский-Танаевский Бланко был одним из первых, кто начал развивать ресторанный бизнес в России. Он… Подробнее Купить за 250 руб электронная книга
dic.academic.ru
51. Критические точки.
Критические точки – точки, подозрительные на экстремум.
Если
производная функции 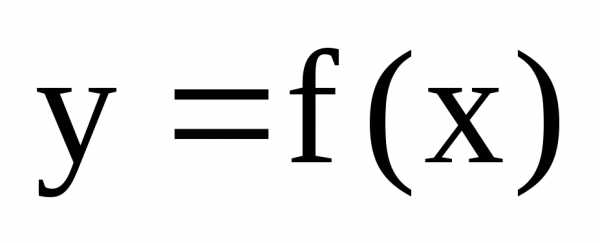 в точке
в точке равна нулю или не существует, то эта
точка – подозрительная на экстремум
(критическая точка).
равна нулю или не существует, то эта
точка – подозрительная на экстремум
(критическая точка).
Каждая точка экстремума – критическая (но не наоборот).
52. Достаточные условия экстремума.
Достаточное
условие экстремума.
Если непрерывная функция 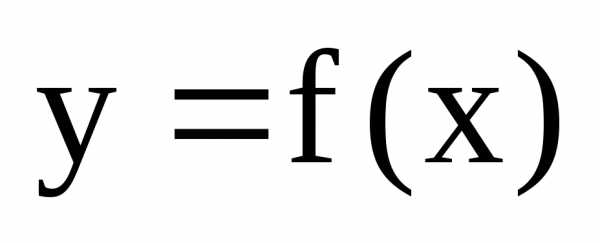 ,
дифференцируема в некоторой окрестности
точки
,
дифференцируема в некоторой окрестности
точки и при переходе через нее производная
меняет свой знак, то
и при переходе через нее производная
меняет свой знак, то — точка экстремума.
— точка экстремума.
Если при переходе через точку экстремума производная меняет свой знак с плюса на минус, то эта точка – точка максимума, если с минуса на плюс – точка минимума.
53. Исследование функций с помощью производных высших порядков.
Если
функция  во всех точках (a;b)
имеет положительную (отрицательную)
вторую производную, то график функции
на этом интервале выпуклый вниз (вверх).
во всех точках (a;b)
имеет положительную (отрицательную)
вторую производную, то график функции
на этом интервале выпуклый вниз (вверх).
54. Выпуклость и вогнутость кривой.
График
дифференцируемой функции  называетсявыпуклым
вниз на
интервале (a;b),
если он расположен выше любой касательной
на этом интервале, выпуклым
вверх,
если он расположен ниже.
называетсявыпуклым
вниз на
интервале (a;b),
если он расположен выше любой касательной
на этом интервале, выпуклым
вверх,
если он расположен ниже.
55. Точки перегиба.
Точка, при переходе через которую график функции переходит с одной стороны касательной на другую (вторая производная меняет свой знак) называется точкой перегиба.
56. Асимптоты.
Асимптота кривой – прямая, расстояние от которой до точки, лежащей на кривой, стремится к нулю при неограниченном удалении от начала координат от этой точки по кривой.
Асимптоты могут быть вертикальными, наклонными и горизонтальными
Прямая  являетсявертикальной асимптотой графика функции
являетсявертикальной асимптотой графика функции  ,
если
,
если ,
или,
или
,
или,
или
Уравнение наклонной асимптоты будем искать в виде y
= kx
+ b. 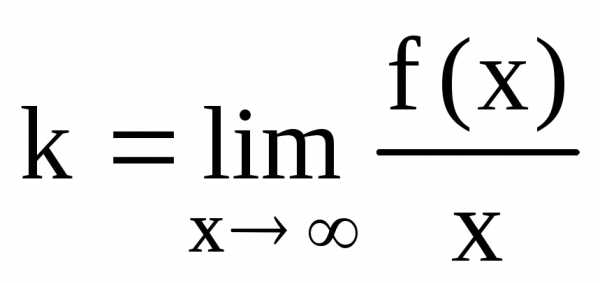 ,.
,.
Горизонтальная
асимптота – частный случай наклонной
(когда  ),
),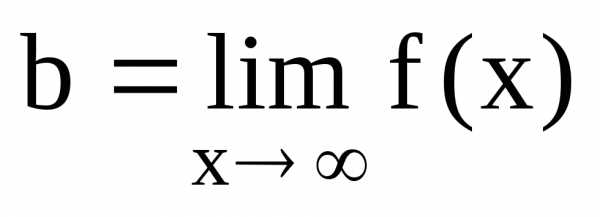
57. Схема исследования функций.
Область определения функции (D(y))
Точки пересечения графика с осями координат
Интервалы знакопостоянства
Четность\нечетность (- нечетная,- четная)
Асимптоты
Интервалы монотонности (возрастание\убывание)
Экстремумы (минимумы\макимумы)
Интервалы выпуклости\вогнутости и точки перегиба
58. Неопределенный интеграл.
Функция
F(x)
называется первообразной функции f(x)
на интервале (a;b),
если для любого 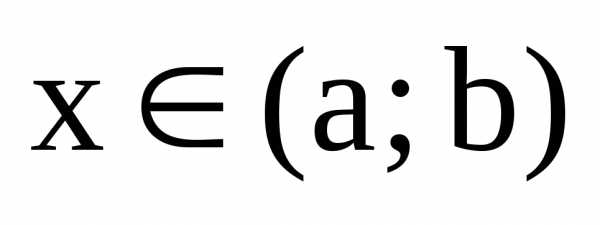 выполняется равенство(или)
выполняется равенство(или)
Если функция F(x) является первообразной функции f(x) на (a;b), то множество всех первообразных для f(x) задается формулой F(x) + C, где C – постоянное число.
Множество
всех первообразных функций F(x)+C
для f(x)
называется неопределенным интегралом
от функции f(x)
и обозначается символом 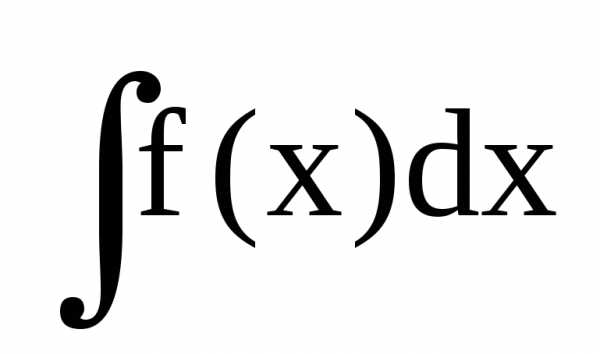
,
f(x)
– подынтегральная функция, f(x)dx
– подынтегральное выражение,
х –
переменная интегрирования,  —
знак неопределенного интеграла.
—
знак неопределенного интеграла.
59. Свойства неопределенного интеграла.
1) Дифференциал от неопределенного интеграла равен подынтегральному выражению, а производная неопределенного интеграла равна подынтегральной функции .
2) Неопределенный интеграл от дифференциала некоторой функции равен сумме этой функции и произвольной постоянной
3) Постоянный множитель можно вынести за знак интеграла
4) Неопределенный интеграл от алгебраической суммы конечного числа непрерывных функций равен алгебраической сумме интегралов от слагаемых.
5) (Инвариантность
формулы интегрирования). Если
,
то и,
где — произвольная функция, имеющая постоянную
производную
— произвольная функция, имеющая постоянную
производную
studfiles.net
КРИТИЧЕСКАЯ ТОЧКА — это… Что такое КРИТИЧЕСКАЯ ТОЧКА?
- КРИТИЧЕСКАЯ ТОЧКА
КРИТИЧЕСКАЯ ТОЧКА, температура и давление, при превышении которых становится невозможным дальнейшее совместное существование жидкости и ее пара (или газа). Если газ медленно сжимать при температурах, превышающих критическую, или охлаждать при давлении, превышающем критическое, он не разделяется внезапно на две ФАЗЫ, а постепенно превращается из газа в жидкость.
Научно-технический энциклопедический словарь.
- КРИТИЧЕСКАЯ МАССА
- КРИТИЧЕСКИЙ УГОЛ
Смотреть что такое «КРИТИЧЕСКАЯ ТОЧКА» в других словарях:
КРИТИЧЕСКАЯ ТОЧКА — точка на диаграмме состояния, соответствующая критическому состоянию. К. т. двухфазного равновесия жидкость пар явл. конечной точкой на кривой испарения и характеризуется критич. значениями темп ры Tк, давления рк и объёма Vк (табл.). ПАРАМЕТРЫ… … Физическая энциклопедия
Критическая точка — Критическая точка многозначный термин: Критическая точка (математика) точка, где производная равна нулю, либо неопределена. Критическая точка (термодинамика) температура, при которой две фазы находятся в равновесии. Критическая… … Википедия
КРИТИЧЕСКАЯ ТОЧКА — изображает на диаграммах состояния критическое состояние вещества. Критическая точка заканчивается, напр., кривая фазового равновесия жидкость пар в системе координат: температура T, давление p … Большой Энциклопедический словарь
КРИТИЧЕСКАЯ ТОЧКА — предельная точка на кривой (см.) равновесия фаз системы, напр. жидкость пар, в которой исчезает различие между жидкостью и паром, а точка соответствует (см.) … Большая политехническая энциклопедия
критическая точка — Точка на термодинамической диаграмме, соответствующая критическому состоянию вещества. [Сборник рекомендуемых терминов. Выпуск 103. Термодинамика. Академия наук СССР. Комитет научно технической терминологии. 1984 г.] Тематики термодинамика… … Справочник технического переводчика
критическая точка — [critical point] критическая точка A1 [A1 critical point] температура превращения перлита ↔ аустенит в равновесной системе Fe Fe3C; критическая точка A2 [А2 critical point] температура, соответствующая точке Кюри феррита; критическая точка A3 [A3 … Энциклопедический словарь по металлургии
критическая точка — 3.2 критическая точка (critical point): Точка на кривой зависимости деформации образца от силы, в которой прямая, касательная к этой кривой, расходится с ней (см. рисунок 4а). Источник … Словарь-справочник терминов нормативно-технической документации
критическая точка — изображает на диаграммах состояния критическое состояние вещества; ею заканчивается, например, кривая фазового равновесия жидкость пар в системе координат: температура давление. * * * КРИТИЧЕСКАЯ ТОЧКА КРИТИЧЕСКАЯ ТОЧКА, изображает на… … Энциклопедический словарь
Критическая точка — Critical point Критическая точка. (1) Температура или давление, при которых возникают изменения в кристаллической структуре, фазе, физических свойствах. Также называемая температу рой превращения. (2) В диаграмном равновесии сочетание состава… … Словарь металлургических терминов
критическая точка — kritinis taškas statusas T sritis automatika atitikmenys: angl. critical point vok. kritischer Punkt, m rus. критическая точка, f pranc. point critique, m … Automatikos terminų žodynas
Книги
- Ресторанные ведомости № 11/2018, РИК Ресторанофф. В новом номере (ноябрь 2018) журнала «Ресторанные ведомости»: Cover story Ростислав Ордовский-Танаевский Бланко был одним из первых, кто начал развивать ресторанный бизнес в России. Он… Подробнее Купить за 250 руб электронная книга
dic.academic.ru
