Простейшая формула — Большая Энциклопедия Нефти и Газа, статья, страница 1
Простейшая формула
Cтраница 1
Простейшая формула показывает соотношение между числами атомов различных элементов в молекуле вещества. [1]
Простейшая формула показывает соотношение количества атомов элементов в молекуле, выраженное наименьшими целыми числами. [2]
Простейшая формула показывает отношение чисел атомов, выраженное минимальными целыми числами. Химическая формула, показывающая, сколько атомов каждого элемента содержится в молекуле данного вещества, называется истинной, или молекулярной, формулой. [3]
Простейшие формулы ( атомные, эмпирические) показывают соотношение между количеством атомов элементов, входящих в состав молекулы. [4]
Простейшая формула такого бесконечного в пределе радикала Si rO рассчитывается по числу атомов, приходящихся на одно повторяющееся в постройке звено: SiO -, Si4Ou, SiaO5 и др. В зависимости от типа оксосиликатных комплексов силикаты имеют волокнистую ( типа асбеста), слоистую ( типа слюды) и координационную ( типа SiCb) структуру. [5]
Простейшая формула не всегда совпадает с молекулярной формулой. Для установления молекулярной формулы ( из простейшей) нужно знать молекулярную массу соединения. [6]
Простейшая формула выражает наиболее простой возможный атомный состав молекул вещества, соответствующий весовым отношениям между образующими вещество элементами. [7]
Простейшая формула не всегда совпадает с молекулярной формулой. [8]
Простейшая формула показывает соотношение числа атомов элементов в молекуле, выраженное наименьшими целыми числами. [9]
Простейшая формула основана на определении интеграла. [10]
Простейшая формула основана на определении интеграла. [11]
Простейшая формула совпадает с истинной. [12]
Простейшие формулы, используемые при расчетах. [13]
Простейшие формулы катиона и аниона А13 и АЮ2 — используются в уравнениях реакции для простоты и облегчения расчетов концентраций частиц в растворах. В действительности такие ионы не существуют в водном растворе. [14]
Простейшие формулы катиона и аниона А13 и А1О2 — используются в урав-реакции для простоты и облегчения расчетов концентраций частиц н растворах. В действительности такие ионы не существуют в водном растворе. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Занятие 4 Использование простых формул и функций
Search for: s
f g w t y e sm
Skip to content- Главная
- Центр обучения
- Справочник
- Форум поддержки
- Услуги
- Войти
Sections
- Курсы
- MS Word
- Курс MS Word от новичка до профессионала
- Занятие 1. Представление MS Word 2013/2016
- Занятие 2. Базовые возможности по редактированию
- Занятие 3. Базовые возможности форматирования текста
- Занятие 4. Форматирование абзацев в MS Word
- Занятие 5. Управление потоком текста в MS Word
- Занятие 6. Углубленное изучение стилей, и многоуровневых списков
- Занятие 7. Создание автоматической нумерации в документах
- Занятие 8. Работа с таблицами
- Занятие 9. Работа с графикой и рисунками
- Занятие 10. Работа с темами, фоном, экспресс-блоками и полями
- Занятие 11. Рецензирование документа
- Занятие 12. Организация представления документа и слияние документов
- Занятие 13. Защита документа и общий доступ. Работа с макросами
- Занятие 14. Список литературы, сноски, гиперссылки, закладки
- Занятие 15. Дополнительные возможности настройки параметров MS Word. Нештатные ситуации
- Программа для новичка
- Программа для студента, соискателя
- Программа для офис-менеджера
- Практикум по Word
- Оформление однотипных документов или понимание работы стилей
- Оформление юридических документов (договоров)
- Курс MS Word от новичка до профессионала
- MS Excel
- Курс MS Excel от новичка до профессионала
- Занятие 1 Представление Excel
- Занятие 2 Работа с книгами и листами
- Занятие 3 Основы ввода и вывода данных
- Занятие 4 Использование простых формул и функций
- Занятие 5 Форматирование ячеек и диапазонов
- Занятие 6 Создание диаграмм
- Занятие 7 Использование более сложных функций и формул
- Занятие 8 Работа с текстовыми и финансовыми функциями
- Занятие 9 Тонкая настройка рабочей книги, листа. Персонализация Excel
- Занятие 10 Работа с данными и основы макрокоманд
- Занятие 11 Безопасность книг и предоставление общего доступа
- Занятие 12 Добавление рисунков и фигур в книгу
- Программа MS Excel для новичка
- Практикум по Excel
- Как сравнить два файла Excel V2
- Создание автоматически заполняемых списков в Excel
- Транспонирование диапазона с изменяемым количеством элементов
- Курс MS Excel от новичка до профессионала
- MS PowerPoint
- Курс MS PowerPoint от новичка до профессионала
- Занятие 1 Основы PowerPoint
- Занятие 2 Создание презентаций в PowerPoint
- Занятие 3 Работа с текстом в презентациях PowerPoint
- Занятие 4 Таблицы в PowerPoint
- Занятие 5 Диаграммы в PowerPoint
- Занятие 6 Проектирование шаблона PowerPoint
- Занятие 7 Работа с рисунками, графикой WordArt и SmartArt в PowerPoint
- Занятие 8 Анимация и мультимедиа в PowerPoint
- Занятие 9 Защита и предоставление общего доступа
- Занятие 10 Последние штрихи завершения презентации PowerPoint
- Курс MS PowerPoint от новичка до профессионала
- MS Word
- Поддержка
- Как зарегистрироваться на сайте
- Чем отличается курс от программы
- Глоссарий (что такое занятие, вопрос, урок и т.д.)
- Как получить доступ к курсам бесплатно
- Поддержка клиентов на форуме
- Shop
msoffice-prowork.com
Простые формулы — Хитрости работы с Excel – таблицы, функции, формулы, списки, рабочие книги, макросы
Создавая формулу, вы можете вводить значения или вставлять ссылки на любые ячейки книги.
Выполните следующие действия:
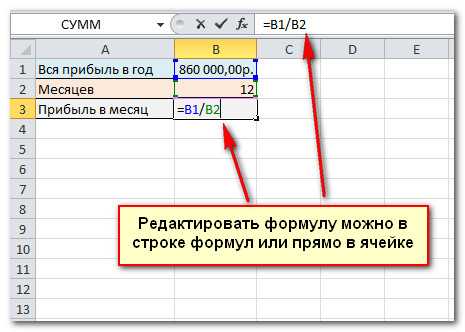
1. Выделите ячейку, куда следует поместить формулу, и поставьте знак равенства (рис. 12.20).
2. Щелкните по первой ячейке, адрес которой необходимо записать в начале формулы.
3. Введите знак арифметического действия. В табл. 12.2 перечислены такие знаки и соответствующие им операции.
4. Щелкните по следующей ячейке, адрес которой необходимо внести в формулу (рис. 12.21).
5. Продолжайте построение формулы, записывая знаки арифметических действий и адреса ячеек;
Нажмите клавишу Enter, чтобы завершить ввод формулы и вывести результат вычисления (рис. 12.22).
Если необходимо поместить ту же самую формулу в смежные ячейки, скопируйте ее и вставьте в новое место.
Можно вводить в формулы комбинации чисел и адресов ячеек, например =С22, 5 (содержимое ячейки С2 умножается на 2,5).
Суммирование данных в столбцах и строках
В программе Excel предусмотрен способ быстрого суммирования чисел в столбцах или строках:
1. Щелкните по пустой ячейке, расположенной под последней записью в столбце или справа от последней записи в строке (рис. 12.23).
2. Нажмите кнопку Автосумма (Auto-Sum) на Стандартной панели инструментов (рис. 12.24).
3. После нажатия клавиши Enter в ячейке появится результат суммирования, (рис. 12.25).

Сначала Excel ведет поиск чисел, которые следует суммировать, в ячейках, расположенных выше активной. Если программа не находит заполненных ячеек или находит в них только текст, поиск производится в ячейках, расположенных слева от выделенной.
Если среди ячеек, которые заполнены числами, присутствует пустая, программа суммирует только данные, расположенные ниже (или правее) пустой ячейки, а не все числа в столбце или строке.
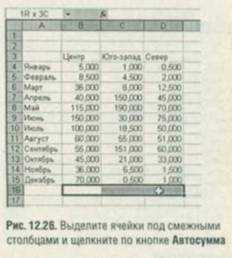
Чтобы суммировать по каждому столбцу содержимое нескольких смежных столбцов, выделите пустые ячейки под каждым из них и щелкните по кнопке Авто сумма. В каждую выделенную ячейку Excel запишет соответствующий результат (рис. 12.26).
Newer news items:
Older news items:
www.teachexcel.ru
Формулы в Excel — создание простых формул в Exel 2010
Excel может быть использован для вычисления числовой информации. В этом уроке вы узнаете, как создать простые формулы в Excel, чтобы складывать, вычитывать, перемножать и делить величины в книге. Также вы узнаете разные способы использования ссылок на ячейки, чтобы сделать работу с формулами легче и эффективнее.
Простые формулы
Формула – это равенство, которое выполняет вычисления. Как калькулятор, Excel может вычислять формулы, содержащие сложение, вычитание, умножение и деление.
Одной из самых полезных особенностей Excel является возможность производить вычисления с использованием адреса ячейки для представления значения в ней. Такой способ называется использованием ссылок на ячейки. Для максимального использования возможностей Excel важно понимать, как создавать простые формулы и использовать ссылки на ячейки.
Создание простых формул
Excel использует стандартные операторы для уравнений, такие как знак плюс для сложения (+), знак минус для вычитания (-), звездочка для умножения (*), a косая черта для деления (/), и знак вставки (^) для возведения в степень. Ключевым моментом, который следует помнить при создании формул в Excel, является то, что все формулы должны начинаться со знака равенства (=). Так происходит потому, что ячейка содержит или равна формуле и ее значению.

Чтобы создать простую формулу в Excel:
- Выделите ячейку, где должно появиться значение формулы (B4, например).
- Введите знак равно (=).
- Введите формулу, которую должен вычислить Excel. Например, «120х900».
- Нажмите Enter. Формула будет вычислена и результат отобразится в ячейке.
Результат формулы может не поместиться в ячейке, и вместо значения могут отображаться знаки (#######). Это означает, что столбец недостаточно широк для отображения содержимого ячейки. Просто увеличьте ширину столбца, чтобы отобразить содержимое ячейки.
Создание формул со ссылками на ячейки
Когда формула содержит адрес ячейки, его называют ссылкой на ячейку. Создание формул со ссылками на ячейки является очень полезной штукой. Это дает вам возможность изменить данные на листе без необходимости переписывать значения в формулах.
Чтобы создать формулу со ссылками на ячейки:
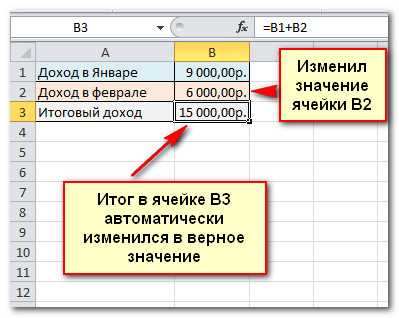
- Выделите ячейку, где должно появиться значение формулы (B3, например).
- Введите знак равно (=).
- Введите адрес ячейки, которая содержит первое число уравнения (B1, например).
- Введите нужный оператор. Например, знак плюс (+).
- Введите адрес ячейки, которая содержит второе число уравнения (в моей таблице это B2).
- Нажмите Enter. Формула будет вычислена и результат отобразится в ячейке.
Если вы измените значение в ячейке B1 или B2, итог будет автоматически пересчитан.
Более легкий и быстрый способ создания формул «Наведи и кликни»
- Выделите ячейку, где должно появиться значение (B3, например).
- Введите знак равно (=).
- Кликните по первой ячейке, которую нужно включить в формулу (B1, например).
- Введите нужный оператор. Например, знак деления (*).
- Кликните по следующей ячейке в формуле (B2, например).
- Нажмите Enter. Формула будет вычислена и результат отобразится в ячейке.
Чтобы изменить формулу:
- Кликните по ячейке, которую нужно изменить.
- Поместите курсор мыши в строку формул и отредактируйте формулу. Также вы можете просматривать и редактировать формулу прямо в ячейке, дважды щелкнув по ней мышью.

- Когда закончите, нажмите Enter на клавиатуре или нажмите на команду Ввод в строке формул.
Если вы передумаете, используйте команду Отмена в строке формул, чтобы избежать внесения изменений в формулу.
Читайте также:
composs.ru
Формулы химические простейшие — Справочник химика 21
Формульная единица Группа атомов или ионов, представленных химической формулой вещества. Простейшая единица ионного соединения [c.548]Вывод простейшей (эмпирической) формулы химического соединения [c.16]
Формулы химических соедине пгй подразделяют на простейшие, или эмпирические, и истинные, или молекулярные. Для вывода простейшей формулы достаточно определить экспериментально качественный и количественный состав вещества и знать атомные массы входящих в него элементов. Для вывода истинной формулы кроме состава вещества необходимо знать и его молекулярную массу. [c.23]
В учении о составе химических соединений основное понятие — формула химического соединения. Какие атомы составляют молекулу соединения, показывает простейшая формула. Ее можно получить из данных химического анали- [c.7]
Химические формулы расположены в порядке латинского алфавита. Рядом с формулами указаны порядковые номера рубрик. Приведены формулы веществ, простых и комплексных анионов. Формулы распространенных анионов Вг , С -, СО , СГ, Г, Н, Г, N , N05. О , 0 , ОН, PO . S , SO не представлены из-за многочисленности их соединений.) [c.467]
Химическая формула выражает качественный и количественный состав вещества и показывает соотношение между атомами этого вещества. Для определения формулы необходимо проанализировать соединение, установить, какие элементы и в каком количестве входят в его состав. Зная атомные массы этих элементов, можно найти соотношение атомов в молекуле и определить формулу. Такую формулу называют простейшей, или эмпирической, а соответствующую ей молекулярную массу — формульной. Она не отражает истинного состава молекулы. [c.51]
Установите простейшую формулу химического соединения, зная массовые доли составляющих его элементов 8 — 40%, О — 60%. [c.13]
Простые вещества. Химические формулы простых веществ записываются символом соответствующего химического элемента с указанием числа атомов с помощью подстрочных индексов (индекс 1 в формулах одноатомных простых веществ не ставится). Систематические названия простых веществ строятся из названий химических элементов с указанием числа их атомов с помощью латинских приставок (приставка моно- иногда опускается), например [c.188]
В учении о с о с т а в е. химических соединений основное понятие формула химического соединения. Какие атомы составляют молекулу соединения, показывает простейшая формула. Ее можно получить из данных химического Анализа. Истинная формула отражает численное соотношение этих атомов и следует из данных о молекулярной массе соединения. [c.7]
Установление простейших и истинных формул химических соединений [c.14]
ФОРМУЛА ХИМИЧЕСКАЯ — условная запись буквами латинского алфавита и числовыми индексами состава химического соединения или простого вещества. Ф. X. показывает, как и в каком количестве атомы входят в состав соединения. [c.264]
Формулы. Химическая формула сложного вещества включает в себя катион (условно электроположительную составляющую) и анион (условно электроотрицательную составляющую). Катион всегда ставится в формуле на первое место (слева), ашон — на второе. Катионы и анионы могут быть простыми и сложными и содержать металлические и неметаллические элементы. [c.7]
Формула химического соединения показывает его состав и количественное соотношение между атомами. Формулы, в которых соотношения между количествами атомов выражаются наименьшими целыми числами, называются простейшими формулами. Атомные массы элементов и молекулярные массы химического соединения выражаются в углеродных единицах (у. е.). Углеродной единицей условно названа V12 массы атома изотопа углерода С. [c.9]
Несмотря иа то что у атома кремния строеипе внешней электронной оболочки такое же, как у атома углерода, в химии этих двух элементов мало сходства. Действительно, хотя структура элементного кремния такая же, как одной из модификаций углерода— алмаза, а также соблюдается соответствие формул некоторых простейших соединений кремния и углерода, однако в химических и физических свойствах соединений этих элементов редко наблюдается большое сходство. Поскольку кремний бо-. (ее электроположителен, чем углерод, со многими металлами он образует соединения, которые имеют строение, типичное длл сплавов (разд. 23.4), и некоторые из них имеют ту же структуру, что и соответствующие бориды. Фактически кремний во-многом больше напоминает бор, чем углерод, хотя формулы соединений кремния и бора обычно совершенно различны. Некоторые из таких параллелей в химии кремния и бора рассмотрены в начале следующей главы. Силициды ио своему строению мало ио.хожи па карбиды, по весьма сходны с боридами например, -)то проявляется в образовании каркасов из атомов 51 (В), хотя немногие силициды н бориды действительно пзоструктурны. [c.88]
Структурная формула, которой мы пользуемся, определяет расположение и характер химических схзязей. Допустим, функция отображает расположение и характер химических связей и определяет структурную формулу но просто суммировать, складывать квадраты ф-функций мы пе можем, так же х ак не можем производить арифметические действия (например, сложение) со структурными формулами. Чтобы второе равенство было справедливым, нужно добавить к нему третий член, который пе соответствует никакой структурной формуле. [c.130]
Таким образом, метод полностью параметризован все входящие в расчет величины (а, р, и др.) суть параметры, определяемые по экспериментальным данным. Интегралы перекрывания базисных орбиталей либо считаются одними и теми же для соответствующих эквивалентных пар атомов, например 5 для всех пар соседних атомов углерода, либо просто полагаются равными нулю. Подобная параметризация автоматически учитывает симметрию задачи (для эквивалентных по симметрии атомов и пар атомов, очевидно, вводятся одинаковые матричные элементы) и учитывает последовательность расположения атомов сопряженного фрагмента, поскольку понятие соседние атомы либо целиком опирается на классическую формулу химического строения молекулы, либо использует структурные данные о равновесной геометрической конфигурации молекулы. [c.368]
По определению грамм-эквивалентом называется весовое количество вещества, химически эквивалентное 1 г Н , 8 г кислорода, 35,45 г хлора или просто одному молю (6,023 10 ) электронов в зависимости от того, в реакции какого типа участвует данное вещество. Нам придется сталкиваться с двумя понятиями, одним из которых является грамм-эквивалент, а другим число эквивалентов. Это совершенно аналогично тому, как пользуются понятиями молекулярный вес и число молей. Однако с молекулярными весами путаницы не возникает, поскольку налицо имеется формула химического вещества. В отличие от этого грамм-эквиваленты определяются
www.chem21.info
Установление простейшей формулы — Справочник химика 21
Формула, составленная по валентности, является эмпирической. Для установления молекулярной формулы вещества, кроме того, необходимо знать его молекулярный вес (см. гл. III, 4). Во многих случаях простейшие эмпирические формулы совпадают с молекулярными. [c.98]Установление химических формул Простейшие эмпирические и молекулярные формулы [c.11]
Установление простейшей формулы (брутто-фор-мулы). Предположим, что нам известно содержание (в %) элементов в данном соединении, содержащем С, Н и О Например, С — 79,19%, Н — 5,74%, О — 15,07% (содержание кислорода находят по разности 100 — 79,19 — 5,74 = 15,07) Следовательно, в молекуле этого соединения С, Н, О находятся в соотношении 79,19 5,74 15,07 [c.21]
Установление простейшей эмпирической формулы вещества на основании данных количественного элементарного анализа. По данным количественного элементарного анализа вычисляют процентный состав вещества, а по процентному составу — простейшую эмпирическую формулу соединения. [c.41]
Установление формулы сульфида меди. Для установления простейшей формулы сульфида меди необходимо знать его весовой состав. [c.23]
Установление простейшей формулы (брутто-формулы). Предположим, что нам известно процентное содержание элементов в данном соединении, содержащем С, Н иО. Например, С— 79,19%, Н—-5,74%, [c.18]
Все эти затруднения отпали с принятием единых атомных весов. Химики, наконец, нашли общий язык. Действительно, установление простейшей формулы какого-либо соединения уже не представляло трудностей нужно было только знать его процентный состав (определявшийся путем химического анализа) и атомные веса содержащихся в нем элементов. [c.27]
Установление простейшей формулы 31 [c.31]
Установление простейшей формулы. Количественный анализ показывает состав вещества в процентах. Как же, зная процентное содержание различных элементов в веществе, выразить состав вещества не в процентах, а в атомных единицах, т. е. каким образом установить его химическую формулу [c.31]
Установление простейших и истинных формул химических соединений [c.14]
С органическими соединениями, молекулы которых отличались внушительными размерами, дело обстояло сложнее. Используя методы начала XIX в., было очень тяжело, вероятно и невозможно, установить точную эмпирическую формулу даже такого довольно простого по сравнению, например, с белками органического соединения, как морфин. В настоящее время известно, что в молекуле морфина содержатся 17 атомов углерода, 19 атомов водорода, 3 атома кислорода и 1 атом азота ( ijHisNOa). Эмпирическая формула уксусной кислоты (С2Н4О2) намного проще, чем формула морфина, но и относительно этой формулы в первой половине XIX в. не было единога мнения. Однако, поскольку химики собирались изучать строение молекул органических веществ, начинать им необходимо было с установления эмпирических формул. [c.74]
Это соотношение, установленное первоначально /34/ дня линии насыщения, затем было распространено и на область плотной сжатой жидкости, Для этой цели использовались определения комплекса лТ/Срр, полученные методом, описанным в гл, I, 8 3 вместе с данными по теплоемкости. Соотношение (111,3.28) интересно тем, что его непосредственным следствием является простая формула для отношения теплоемкостей [c.47]
ПО) В то время как нахождение общей формулы какого-либо вещества производится просто на основании его химического анализа и определения молекулярного веса (что в большинстве случаев пе представляет трудностей), установление структурной формулы часто требует долгой и кропотливой работы. При этом приходится базироваться на способе получения рассматриваемого соединения, его химических и физических свойствах и т. д. [c.568]
Установление формулы оксида меди. По данным опыта вычислите процентное содержание меди и кислорода в данном случае и затем определите простейшую формулу оксида меди Си 0 у. [c.35]
Как видно из данных таблицы, определение молекулярной массы подтверждают формулы четыреххлористого углерода и глицерина, а для этана правильной оказывается удвоенная формула — СгНе. Следовательно, простейшие формулы только тогда действительно выражают атомный состав соединения, когда они подтверждаются определением его молекулярной массы. Иными словами, для установления истинной формулы соединения, кроме процентного состава и атомных масс, необходимо знать и молекулярную массу. [c.26]
Установление химической формулы соединения часто упрощается, если известны валентности соответствующих элементов. Рассмотрим сначала соединение, состоящее из атомов только двух элементов, например алюминия и кислорода. Алюминий трехвалентен, кислород двухвалентен. Из самого понятия валентности вытекает, что входящие в состав химического соединения атомы не должны иметь свободных валентностей. Следовательно, общее число валентностей у атомов алюминия должно быть равно общему их числу у атомов кислорода. Наименьшее число, делящееся без остатка и на 3 и на 2 (наименьшее кратное), будет 6. Значит, общее число валентностей как у алюминия, так и у кислорода должно быть равно шести. Но каждый атом алюминия трехвалентен, следовательно, в молекуле должно содержаться два атома алюминия. Подобным же образом заключаем, что число атомов кислорода равно трем. Итак, простейшая формула соединения алюминия с кислородом будет АЬОз. [c.26]
Различают простейшие и истинные (молекулярные) формулы. Простейшая формула выражает наименьшее отношение между числами атомов элементов, входящих в молекулу. Истинная формула показывает действительное число атомов в молекуле, отвечающее наименьшему соотношению. Для установления истинной формулы нужно знать не только массовый состав вещества, но и его молекулярную массу. [c.16]
В предлагаемой книге даны условия задач и их решения. На первый взгляд может показаться странным, что наиболее подробные и полные решения даны для задач относительно простых и среднего уровня. Однако авторы исходили из тех соображений, что читатель, который берется за решение задач, например, по установлению механизма реакций с использованием методов химической кинетики и физико-химических методов исследования, обычно не нуждается в пояснениях, как определяется простейшая формула вещества по результатам его химического анализа. Более того, изложение базисных понятий только отвлекает подготовленного читателя от логики и техники решения сложной задачи. С этой точки зрения предлагаемые решения представляются полезными как для участников школьной и районной о
www.chem21.info
Простейшие и молекулярные формулы веществ
Формулы веществ показывают, какие элементы и в каком количестве входят в состав вещества. Различают формулы простейшие и молекулярные. Простейшая формула выражает наиболее простой возможный атомный состав молекул вещества, соответствующий отношениям масс между элементами, [c.23]
Формула, составленная по валентности, является эмпирической. Для установления молекулярной формулы вещества, кроме того, необходимо знать его молекулярный вес (см. гл. III, 4). Во многих случаях простейшие эмпирические формулы совпадают с молекулярными. [c.98]
Для нахождения истинной формулы вещества надо относительную молекулярную массу простейшей формулы сопоставить с относительной молекулярной массой данного вещества. Для этого сначала [c.179]
Простейшая формула соединения Nh3. Этой формуле отвечает молекулярная масса, равная 16. Истинную молекулярную массу вещества находим, исходя нз его плотности по водороду [c.25]
Что такое простейшая и истинная (молекулярная) формулы вещества, чем они отличаются [c.12]
Если ДО Проведения анализа молекулярная формула вещества неизвестна, то по данным анализа можно рассчитать простейшую [c.109]
ПРОСТЕЙШИЕ И МОЛЕКУЛЯРНЫЕ ФОРМУЛЫ ВЕЩЕСТВ [c.26]
Определение процентного состава неизвестного вещества проводится с целью выяснения его эмпирической, а в конце концов и молекулярной формулы. Эмпирическая формула выражает в простейшей форме относительное количество атомов каждого из элементов, входящих в состав одной молекулы вещества. Молекулярная формула вещества указывает на истинное число атомов каждого из элементов, входящих в состав одной молекулы вещества. Для данного вещества эти две формулы могут совпадать или не совпадать, что зависит от свойства вещества, называемого молекулярным весом. Его легко определить с помощью одного из стандартных физических методов — измерением плотности пара, депрессии температуры плавления, вязкости раствора, скорости седиментации и т. д. [c.15]
В разделе 1 Основные понятия и законы химии приводится уравнение Менделеева—Клапейрона рассматриваются различные типы задач по выводу простейших и молекулярных формул веществ. [c.5]
Стехиометрические отношения в формулах соединений должны выражаться простыми целыми числами. Молекулярные формулы используются только тогда, когда речь идет о молекулах вещества, степень ассоциации которых принимается не зависящей от температуры. Если же степень ассоциации зависит от температуры, то в общем случае следует пользоваться [c.26]
Таким образом, истинная. молекулярная масса вещества вдвое больше вычисленной ио его простейшей формуле. Следовательно, молекулярная формула соединения N2h5. [c.25]
В рассмотренном случае изомеры принадлежат к одному классу органических соединений — алканам, но часто бывает, что изомерами с одной молекулярной формулой являются вещества из разных классов. Например, одной молекулярной формуле С Н 0 соответствуют семь разных соединений из классов спиртов и простых эфиров. Они изображены ниже, а Вы назовите их по правилам систематической номенклатуры. [c.203]
Относительной молекулярной массой, или просто молекулярной массой, вещества называется масса его молекулы, выраженная в атомных единицах массы, и обозначается М . Зная формулу химического вещества, его относительную молекулярную массу можно определить как сумму относительных атомных масс элементов, входящих в состав молекулы данного вещества. Например A1ai,(soj, = = 2, 27 + 3 32 + 12 16 = 342. [c.16]
Простейшая формула вещества СНз так как его молекулярный вес равен 30 у.е., то формула газообразного вещества — СгНе. [c.128]
Понятие о молекулярной формуле применимо к веществам, состоящим из
www.chem21.info