Молярная масса некоторых газов значения (Таблица)
Молярная масса газа (или вещества) — это отношение массы газа к количеству молей этого газа, то есть масса одного моля газа (вещества).
В системе СИ молярная масса выражается в кг/моль (или г/моль), обозначают обычно буквой M.
Название газа и его химическая формула | Молярная масса, г/моль |
Азот (N2) | 28,016 |
Аммиак (NH3) | 17,031 |
Аргон (Ar) | 39,944 |
Ацетилен (C2H2) | 26,04 |
Ацетон (C3H6O) | 58,08 |
Н-бутан (C4h20) | 58,12 |
Изо-бутан ( C4 | 58,12 |
Н-бутиловый спирт ( C4HJ0O) | 74,12 |
Вода (H2O) | 18,016 |
Водород (h3) | 2,0156 |
Воздух (сухой) | 28,96 |
Н-гексан (C6HJ4) | 86,17 |
Гелий (He) | 4,003 |
Н-гептан (C7HJ6) | 100,19 |
Двуокись углерода (CO2) | 44,01 |
Н-декан ( C10h32) | 142,30 |
Дифенил ( C12h20) | 154,08 |
Дифениловый эфир ( CJ2H10O) | 168,8 |
Дихлорметан ( CH2Cl2) | 84,94 |
Диэтиловый эфир (C4H10O) | 74,12 |
Закись азота (N2O) | 44,016 |
Йодистый водород (HJ) | 127,93 |
Кислород (O2) | 32,00 |
Криптон (Kr) | 83,7 |
Ксенон (Xe) | 131,3 |
Метан (CH4) | 16,04 |
Метиламин (CH5N) | 31,06 |
Метиловый спирт (CH4O) | 32,04 |
Неон (Ne) | 20,183 |
Нитрозилхлорид (NOCl) | 65,465 |
Озон (O3) | 48,00 |
Окись азота (NO) | 30,008 |
Окись углерода (CO) | 28,01 |
Н-октан ( C8H18) | 114,22 |
Н-пентан ( C5H12) | 72,14 |
Изо-пентан ( C5H12) | 72,14 |
Пропан ( C3H8) | 44,09 |
Пропилен ( C3H6) | 42,08 |
Селеновая кислота (H2Se) | 80,968 |
Сернистый газ (SO2) | 64,06 |
Сернистый ангидрид (SO3) | 80,06 |
Сероводород (H2S) | 34,08 |
Фосфористый водород (PH3) | 34,04 |
Фреон 11 (CF3CI) | 137,40 |
Фреон-12 (CF2CI2) | 120,92 |
Фреон-13 (CFCI3) | 114,47 |
Фтор (F2) | 38,00 |
Фтористый кремний (SiF4) | 104,06 |
Фтористый метил (CH3F) | 34,03 |
Хлор (Cl2) | 70,914 |
Хлористый водород (HCl) | 36,465 |
Хлористый метил (CH3Cl) | 50,49 |
Хлороформ (CHCl3) | 119,39 |
Циан (C2N2) | 52,04 |
Цианистая кислота (HCN) | 27,026 |
Этан (C2H6) | 30,07 |
Этиламин (C2H7N) | 45,08 |
Этилен (C2h5) | 28,05 |
Этиловый спирт (C2H6O) | 46,07 |
Хлористый этил (C2H5Cl) | 64,52 |
infotables.ru
Молекулярные веса газов — Справочник химика 21
Молекулярный вес газа можно вычислить, применяя уравнение Клапейрона —-Менделеева [c.8]Теперь необходимо установить зависимость между х н у. В соответствии с примечанием в 2.2 у — концентрация N02, выраженная в грам.м-молях на единицу массы. Пусть М — средний молекулярный вес газа на входе в реактор (он легко находится и равен 28,7 правда, эту цифру знать не обязательно). Отсюда следует, что на каждые М г газа, проходящего через реактор в заданном поперечном сечении, приходится 0,01+ с молей N02. Откуда [c.75]
Молекулярные веса газа — 45, бензина (н. к.— 180 °С) — 130, дизельного топлива (180-350 С) — 215, остатка — 380. [c.204]
Это соотношение дает возможность определить среднюю квадратичную скорость молекул при данной температуре, если известен молекулярный вес газа. Оно показывает, что для каждого данного газа средние квадратичные скорости молекул прямо пропориио-нальны корню квадратному из абсолютной температуры, а для различных газов при одинаковой температуре они обратно пропорциональны корню квадратному из молекулярных весов газов, т. е. чем меньше масса. молекул, тем большей скоростью они обладают. [c.100]
Чтобы применить эти уравнения для определения молекулярного веса газа, надо установить опытным путем массу данного объема газа, измеренного при заданных физических условиях, а затем рассчитать его плотность по формуле (2).
М—молекулярные веса газов Л п В V — их молекулярные объемы. [c.30]
При известных д, р, и а Т из ур. (111,5) можно определить молекулярный вес газа. Это сыграло большую роль при первоначальном накоплении экспериментальных данных о молекулярных весах и при изучении процессов диссоциации газов. - [c.95]
Мг—молекулярный вес газов (обычно принимается равным молекулярному весу воздуха). [c.571]
Р е ш е н и е. Определим средний молекулярный вес газа. Так как для газообразных смесей объемные и мольные доли совпадают, найдем число киломолей компонентов газа [c.98]
О — количество газа в данной системе, выраженное в г М — молекулярный вес газа. [c.69]
Мер — средний молекулярный вес газа [c.92]
В ходе некоторых химических процессов, например при получении азотной кислоты окислением аммиака, использовании азотной кислоты как окисляющего агента и т.д., образуются окислы азота. Перед выбрюсом этих газов в атмосферу содержание вредных примесей в них должно быть доведено до допустимого уровня. С этой целью сбросовые газы обрабатывают в присутствии нанесенных платиновых или палладиевых катализаторов восстановительными агентами Н , СНд, углеводородами с большими молекулярными весами, газом коксовых печей и т.д. Вследствие экзотермического характера реакции подъем температуры в адиабатическом реакторе зависит от общего содержания кислорода в исходном газе (в том числе и кислорода в окислах азота). Так, увеличение содержания кислорода в исходном газе на 1% приводит к возрастанию температуры на 130-140°С при использовании СН в качестве восстановительного агента и на 150-160°С при использовании Hj. [c.187]
Таким образом, молекулярный вес газа (пара) равен его плотности по отношению к другому газу, умноженной на молекулярный вес последнего. Плотность газа можно выразить по отношению к любому газу, например к водороду или воздуху. Тогда формула для определения молекулярного веса принимает соответственно вид
Решение. Чтобы узнать объем, занимаемый одним граммом газа при нормальных условиях, следует 22,4 разделить на молекулярный вес газа. [c.8]
Для пересчета находят на графике отрезок радиальной прямой, соответствующий данному газу (или радиальную прямую, соответствующую молекулярному весу газа М). и при помощи линейки соединяют его с нулевой точкой. Ордината каждой точки полученной прямой выражает концентрацию газа в объемн. %, а абсцисса — соответствующую величину в г/м . [c.574]
Близкое значение получается при расчете с учетом того, что коэффициент диффузии в общем случае обратно пропорционален молекулярному весу газа в степени 0,5. [c.72]
Молекулярный вес газа или пара можно определить, исходя, например, из закона Авогадро в равных объемах различных газов, взятых при одинаковой температуре и одинаковом давлении, содержится одно и то же число молекул. Из закона следует, что массы равных объемов газов, находящихся при одинаковых физических условиях, относятся друг к другу как их молекулярные веса [c.7]
Мт — средний молекулярный вес газа. [c.440]
М—молекулярный вес газа, а для газовой смеси — средний молекулярный вес [c.80]
М н Мв — средние молекулярные веса газа и воздуха [c.127]
V — объем газа, в условиях опыта т — масса газа в этом объеме М — молекулярный вес газа — универсальная газовая постоянная, величина которой зависит от размерности объема и давления [c.8]
Нахождение плотности газа по водороду Оц, если известен молекулярный вес газа. [c.7]
Решение. Чтобы узнать массу 1 л любого газа (или пара), измеренного при нормальных условиях, следует число, выражающее молекулярный вес газа, разделить на 22,4.
В это уравнение входит только одна молекулярная константа — молекулярный вес газа М,. так что эффузию газа через отверстие можно использовать для определениям, если площадь отверстия S известна. Эта формула была впервые выведена Кнудсепом [3] и применялась для определения молекулярного веса стие S неизвестных газов. тверстие НСоу. [c.147]
Течение газа при этих условиях детально исследовано Кнуд-сеном, поэтому и получило название кнудсеновского потока. Задолго до развития кинетической теории газов Грэм, исследуя прохождение газов через пористые пластинки из гипса (в настоящее время известно, что поры таких пластинок малы по сравнению со средним свободным пробегом молекул газа), установил, что количество прошедшего газа прямо пропорционально разнице давлений и обратно пропорционально корню квадратному из молекулярного веса газа и температуры. [c.80]
Пример 6. Молекулярный вес газа равен 64. Масса одного моля равна 64. Какова масса 1 л этого газа, измеренного при нормальных условиях [c.8]
Чему равен молекулярный вес газа, если масса 1 л его, измеренного при нормальных условиях, равна а) 1,96 (округл.) б) 2,9 (округл.) [c.9]
При давлении Р ат, температуре Г К и молекулярном весе газаМ&en
www.chem21.info
Таблица молярных масс
Таблица молярных масс| H+ | Li+ | K+ | Na+ | NH4+ | Ba2+ | Ca2+ | Mg2+ | Al3+ | Fe2+ | Fe3+ | Zn2+ | Ag+ | Pb2+ | Cu2+ | |
| OH— | 18 | 24 | 56 | 40 | 35 | 171 | 74 | 58 | 78 | 90 | 107 | 99 | 125 | 241 | 98 |
| F— | 20 | 26 | 58 | 42 | 37 | 175 | 78 | 62 | 84 | 94 | 113 | 103 | 127 | 245 | 102 |
| Cl— | 36,5 | 42,5 | 74,5 | 58,5 | 53,5 | 208 | 111 | 95 | 133,5 | 127 | 162,5 | 136 | 143,5 | 278 | 135 |
| Br— | 81 | 87 | 119 | 103 | 98 | 297 | 200 | 184 | 267 | 216 | 296 | 225 | 188 | 367 | 223 |
| I— | 128 | 134 | 166 | 150 | 145 | 391 | 294 | 278 | 408 | 310 | — | 319 | 235 | 461 | 317 |
| S2- | 34 | 46 | 110 | 78 | 68 | 169 | 72 | 56 | 150 | 88 | 208 | 97 | 248 | 239 | 96 |
| SO32- | 82 | 94 | 158 | 126 | 116 | 217 | 120 | 104 | 294 | 136 | — | 145 | 296 | 287 | 144 |
| SO42- | 98 | 110 | 174 | 142 | 132 | 233 | 136 | 120 | 342 | 152 | 400 | 161 | 312 | 303 | 160 |
| NO3— | 63 | 69 | 101 | 85 | 80 | 261 | 164 | 148 | 213 | 180 | 242 | 189 | 170 | 331 | 188 |
| PO43- | 98 | 116 | 212 | 164 | 149 | 602 | 310 | 263 | 122 | 357 | 151 | 386 | 419 | 812 | 381 |
| CO32- | 62 | 74 | 138 | 106 | 96 | 197 | 100 | 84 | — | 116 | — | 125 | 276 | 267 | 142 |
| SiO32- | 78 | 90 | 154 | 122 | — | 213 | 116 | 100 | — | 132 | — | 141 | 292 | 283 | — |


Примеры решения задач по электротехнике
Типовые задания
dx-dy.ru
Молярная масса азота (N), формула и примеры
Молярная масса азота
Молярную массу обычно выражают в г/моль, реже в кг/кмоль. Поскольку в одном моле любого вещества содержится одинаковое число структурных единиц, то молярная масса вещества пропорциональная массе соответствующей структурной единицы, т.е. относительной атомной массе данного вещества (Mr):
M = κ × Mr,
где κ – коэффициент пропорциональности, одинаковый для всех веществ. Относительная молекулярная масса – величина безразмерная. Её вычисляют, используя относительные атомные массы химических элементов, указанных в Периодической системе Д.И. Менделеева.
Относительная атомная масса атомарного азота равна 14,0067 а.е.м. Его относительная молекулярная масса будет равна 14,0064, а молярная масса:
M(N) = Mr (N) × 1 моль = 14,0067 г/моль.
Известно, что молекула азота двухатомна – N2, тогда, относительная атомная масса молекулы азота будет равна:
Ar(N2) = 14,0067 × 2 = 28,0134 а.е.м.
Относительная молекулярная масса молекулы азота будет равна 28,0134, а молярная масса:
M(N2) = Mr (N2) × 1 моль = 28,0134 г/моль или просто 28 г/моль.
Азот представляет собой бесцветный газ, не обладающий ни запахом, ни вкусом (схема строения атома представлена на рис. 1), плохо растворимый в воде и других растворителях с очень низкими значениями температур плавления (-210oC) и кипения (-195,8oC).
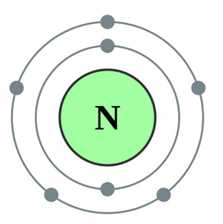
Рис. 1. Строение атома азота.
Известно, что в природе азот может находиться в виде двух изотопов 14N (99,635%) и 15N (0,365%). Эти изотопы характеризуются различным содержанием нейтронов в ядре атома, а значит и молярной массой. В первом случае она будет равна 14 г/моль, а во втором – 15 г/моль.
Молекулярную массу вещества в газообразном состоянии можно определить, используя понятие о его молярном объеме. Для этого находят объем, занимаемый при нормальных условиях определенной массой данного вещества, а затем вычисляют массу 22,4 л этого вещества при тех же условиях.
Для достижения данной цели (вычисление молярной массы) возможно использование уравнения состояния идеального газа (уравнение Менделеева-Клапейрона):
pV = mRT / M,
где p – давление газа (Па), V – объем газа (м3), m – масса вещества (г), M – молярная масса вещества (г/моль), Т – абсолютная температура (К), R – универсальная газовая постоянная равная 8,314 Дж/(моль×К).
Примеры решения задач
ru.solverbook.com
Газы — Вес молекулярный Таблицы
Газы молекулярные — Образование из атомов — Тепловой эффект — Таблицы 1 (1-я) —371 Газы на выходе из топки — Номограммы [c.44]Газы — Вес молекулярный — Таблицы 184 [c.975]
Лазерные переходы в двухатомных молекулярных газах [5 Таблица 33.4 [c.719]
Лазерные переходы в трехатомных молекулярных газах [4] Таблица 33.5 [c.730]
Определить удельный вес 7 природного газа Туймазинского месторождения при нормальных условиях, а также его средний молекулярный вес М. Состав газа приведен в таблице. [c.8]
Переход к высоким и сверхвысоким параметрам пара требовал дальнейших глубоких теоретических обоснований и выводов. В 1951 г. начаты работы по установлению закона молекулярного переноса энергии и раскрытию принципиальных особенностей процессов тепло- и массообмена. В том же году вышла монография Топочные процессы [7]. Результатом коллективной работы авторов Московского энергетического института явилась публикация таблиц термодинамических свойств газов. [c.46]
Молекулярные газы — Образование из атомов — Тепловой эф( кт — Таблицы I (1-я) —371 Молибден 1 (1-я) —361 [c.158]
Атомность технических газов, наиболее часто встречающихся в практике паросиловых установок, дана в табл. 4 в таблице, кроме того, указаны молекулярные веса этих газов и приведены некоторые другие данные. [c.43]
Таблицы термодинамических функций воздуха для температур от 200 до 6000 К и давлений от 0,00001 до 100 ати являются частью работ, посвященных исследованию свойств газов при высоких температурах, которые проводятся под общим руководством члена-корреспондента АН СССР профессора А. С. Предводителева в Лаборатории физики горения Энергетического института АН СССР и на кафедре молекулярной физики физического факультета Московского государственного университета. [c.273]
Теплофизические свойства газов уточняют по таблицам [14], после чего определяют значения параметра состава газов 3 и молекулярной массы продуктов сгорания Цр. Для воздуха имеет место 3 = = 1,0 молекулярная масса воздуха = 28,97 кг/кмоль. [c.82]
Энтальпию сжатого воздуха за компрессором определяют с помощью таблиц теплофизических свойств воздуха и газов по температуре параметру состава газа (воздуха) 3 = Р = 1,0 и молекулярной массе ц = 28,97. [c.193]
| Таблица 2.5. Теплоемкости н показатель адиабаты (изоэнтропы) газов по молекулярно-кинетической теории |  |
| Таблица 2.5 Молекулярная концентрация газа внутри цилиндрического трубопровода [39] при плотности входящего потока v | 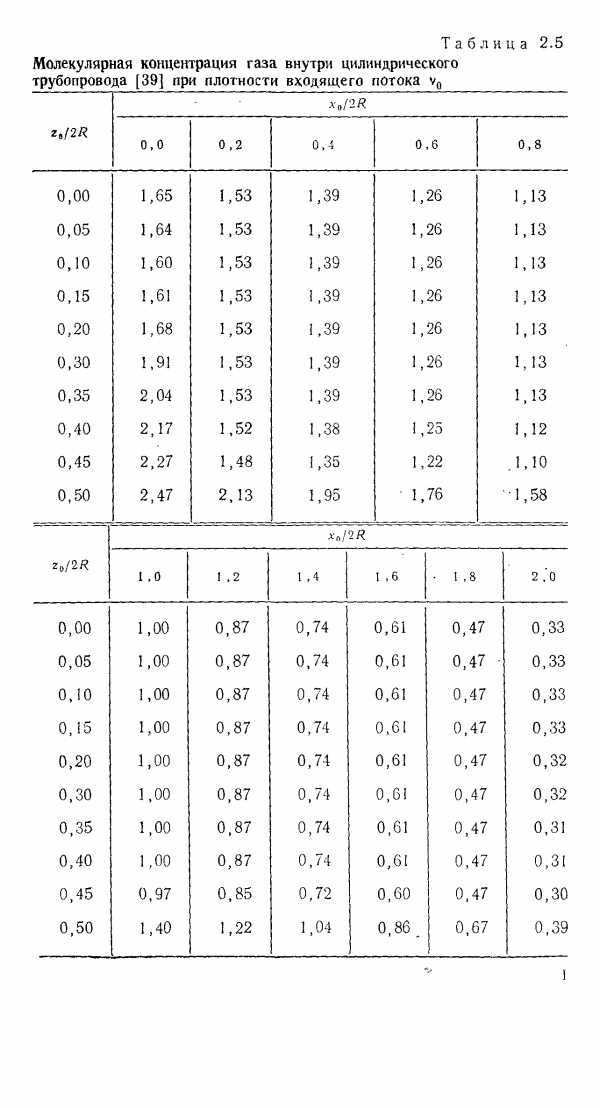 |
Как видно из таблицы 2, азот, кислород и аргон составляют более чем 99,9% земной атмосферы. Согласно последним данным, весьма существенное значение в потеплении климата на Земле имеет содержание в атмосфере углекислого газа. Средний молекулярный вес атмосферного воздуха на уровне моря равен [c.379]
Равновесные термодинамические величины для воздуха и углекислого газа (основная компонента в составе атмосферы Венеры и Марса) приведены в таблицах [23, 35, 45] Некоторые концентрации, энтальпия и молекулярный вес для воздуха приведены на рис. 1.5—1.6. Энтальпия растет с увеличением температуры и падает с увеличением давления, а молекулярный вес имеет обратные зависимости. [c.32]
Указание. Рассчитать 1 и Гг непосредственно по таблицам, не пользуясь значением молекулярной массы для подсчета газовой постоянной R. Для этого следует использовать справедливое для газа в идеальном состоянии соотношение [c.35]
Эти расчеты проводятся более просто, чем с помощью уравнения Клапейрона, и не требуют знаний молекулярной массы газа, так как переход от мольных величин к удельным уже выполнен в таблицах. Не следует, однако, забывать, что все сказанное справедливо только для газов, подчиняющихся уравнению ри=ЯТ. [c.36]
При расчетах значение газовой постоянной Н можно взять из соответствующих справочных таблиц или вычислить по удельному весу газа у или по его молекулярному весу ц. [c.22]
Теплоемкость рабочих газов. Для расчета теплоемкости рабочих газов необходимо знать состав отдельных компонентов свежего заряда смеси и продуктов сгорания. В газожидкостном двигателе состав свежего заряда в процессе сжатия зависит от состава горючего газа, от общего количества воздуха к от наличия остаточных газов, относительное количество которых характеризуется коэффициентом остаточных газов. Для решения нижеследующих уравнений значения средних теплоемкостей воздуха и газа берутся из таблицы И. Имея в виду небольшое содержание многоатомных газов в газовоздушной смеси, можно пользоваться значениями средних молекулярных теплоемкостей газа. Средняя молекулярная теплоемкость свежего заряда при постоянном объеме в интервале температур О—С [c.56]
Молекулярный вес паров серы для различных точек кривой насыщения. Высота столба паров серы в кипятильнике была равна примерно 35 см, что соответствовало величине статического давления около 0,1 мм. Для того чтобы определить соответствующую поправку с точностью до 0,001 мм, необходимо в области давлений от 660 до 860 мм рт. ст. знать плотность насыщенных паров серы с точностью около 1%. Удельный объем (л/г) паров серы при различных температурах и давлениях приведен в таблицах физико-химических величин [11]. Для каждого из приведенных значений по уравнению идеального газа вычислялся молекулярный вес М [c.300]
Приводимые в таблицах данного тома коэффициенты переноса рассчитаны по формулам молекулярно-кинетической теории разреженных газов. Признано целесообразным влияние плотности не учитывать, эффект внутренних степеней свободы (за исключением некоторых веществ) учитывать на основе диффузионного механизма переноса. Это приводит к погрешностям расчета коэффициентов переноса, не превышающим, как показано в первом томе Справочника, нескольких процентов. Также невелика погрешность, возникающая вследствие использования для возбужденных. молекул и атомов тех же потенциалов взаимодействия, что и для молекул и атомов в основном состоянии. [c.21]
| Таблица 2 Молекулярные данные для некоторых газов Г40 |  |
Требование возможно меньшего молекулярного веса продуктов сгорания заставляет химиков искать ракетные топлива, состоящие из химических элементов с небольшим атомным весом (занимающих 10 первых мест в таблице Менделеева, за исключением инертных газов) [1.6]. Теоретические расчеты показывают, что самые выгодные комбинации горючих и окислителей, характеризующиеся сравнительно малым молекулярным весом продуктов сгорания и высокой теплотворностью, при высоких давлениях (до сотен атмосфер) в камере сгорания не смогут дать скорость истечения газов во всяком случае более 4,5—5 км/с, причем предел уже фактически почти достигнут. [c.36]
Расчетные таблицы, приведенные в раЛотс, составлены для показателя адиабаты метаиа у. = 1..31. В них ие входит молекулярный вес газа. Этими таблицами можио пользоваться для расчетов иперегретым водяным паром, для которого показатель адиабаты равен 1,3. Эжекторы для других газов, в том числе п для воздуха, можно рассчитывать по формулам и методам, изложенным в данной рабо1е, принимая соответствующие показатели адиабаты и молекулярного веса. [c.5]
Развивая идеи Бойля, А. Лавуазье устанавливает, что воздух — один из основных первичных элементов — не является простым телом, а представляет собой смесь газов. Стремление считать все тела природы состоящими из трех или четырех элементов происходит от предрассудка, перешедгпего к нам от греческих философов ,— пишет он [45]. В трудах английского химика Д. Дальтона атомистическая теория получила значительное развитие. Дальтон дал четкое определение атомного веса элемента как отношения массы атома данного элемента к массе атома водорода, как наиболее легкого элемента. (В настоящее время относительной молекулярной или атомной массой вещества называют отношение массы молекулы или атома данного вещества к /12 массы атома уг лерода С.) Высоко оценивал это предложение Дальтона Д. И. Менделеев Благодаря геиию Лавуазье и Дальтона человечество узнало в невидимом планетном мире химических сочетаний простые законы того же порядка, каков указан Коперником и Кеплером в видимом планетном мире [46]. В 1803 г. Дальтон открыл закон простых кратных отношений, согласно которому различные элементы могут соединяться друг с другом в соотношениях 1 1, 1 2 и т. п. На основании этого он составил первую в истории науки таблицу относительных атомных масс элементов. Ошибочно считая все газы одноатомными, Дальтон приписывал, цапример, воде химическую формулу ОН, аммиаку — NH. [c.64]
Примерами веществ, которые можно отнести к одному иа указанных типов, являются легкие щелочные металлы (Li, Na) для металлов, элементы IV группы таблицы Менделеева С, Sil. Ge для ковалентных кристаллов, соединение iNa l для ионных кристаллов, твердые инертные газы для молекулярных кристаллов. В большинстве кристаллов реализуется комбинация указанных типов пространственного распределения электронов и межатомных связей. Однако и для них выделение соответствующей доли, например, ионности , ковалентности и т. д. полезно при проведении физико-химического анализа вещества. [c.98]
В качестве возможных катализаторов для очистки выхлопных газов автомобилей испробованы практически все элементы периодической таблицы. В типовых устройствах катализатор состоит из пористых гранул опорного материала, которые покрыты тонким слоем активного вещества. В качестве опорного материала используются термостойкие неорганические окислы, например окись алюминия, двуокись кремния или кальцинированная глина. Активное вещество, как правило, металл или окисел металла, наносится на гранулы опорного материала в виде пленки толщиной в несколько молекулярных слоев. Столь малая толщина покрытия необходима для того, чтобы исключить забивание пор поверхности опорного материала. Высокая пористость играет полезную роль, поскольку она увеличивает контактную поверхность катализатора, однако необходимо найти оптимум между яористостью и механической прочностью. У каталитической засыпки массой 20 кг эффективная площадь составляет около 10 м (около 100 га). [c.66]
Тепловой эффект аллотропических превращений— Таблицы 1 (1-я) — 374 — образования интерметаллических соединений— Таблицы 1 (1-я) — 374 -образования молекулярных газов из атомов 1 (1-я) —371 — образования неметаллических соединений— Таблицы 1 (1-я) — 372 —— образования соединений металлически элеме)1тов — Таблицы 1 (1-я) — 372 [c.297]
Вся работа по созданию таблиц настоящего тома, включающая общий анализ вопроса, решение ряда теоретических задач термодинамики газов при высоких температурах, разработку методики расчета и расчетных формул, составление программ для электронной счетной машины и проведение счета на мащине, выполнена группой сотрудников Лаборатории физики горения и Кафедры молекулярной физики физического факультета в составе профессора Е.В. Ступоченко (руководитель группы), И. Б. Рождественского, Е. В. Самуйлова, А. С. Плешанова [З]. [c.273]
В табл. 4-1 содержатся значения критерия Шмидта для разбавленных смесей различных газов с воздухом. Они заимствованы из работ Шервуда и Пигфорда и основаны на данных, полученных в нормальных атмосферных условиях. Их, однако, можно считать независимыми от этих условий. Вещества приведены в таблице в порядке возрастания молекулярных масс. Обнаруживается тенденция S j к возрастанию с ростом Mj. Эта тенденция подтверждается логарифмическим графиком рис. 4-4, построенным по данным табл. 4-1. Видно, что с погрешностью 30 7о значения числа Шмидта для газа i в разбавленной смеси с воздухом можно подсчитывать по формуле [c.128]
Поскольку такие числа нам неизвестны, то более удобно выражать этот закон для относительных величин. Если через М мы обозначим так называемый молекулярный вес газа, т. е. число, взятое из таблицы чисел, пропорциональных весам раз-,личных молекул и атомов, причем одна из величин, нацример, атомный вес водорода, произвольно принята равной единице, то закон Бойля, Шарля и Авогадро можно написать в болео удобной форме [c.184]
Более подробные таблицы можно найти в монографиях Г иршфель-д е р Дж Кертис Ч.. Берд Р., Молекулярная теория газов и жидкостей, ИЛ, 1961 Чепмен С. и Каулинг Т., Математическая теория неоднородных газов, ИЛ, 1960. [c.19]
Молекулярная масса состаапяющих смесь газов определяется по соответствующим справочным таблицам [c.26]
Как видно из этой таблицы, коэффициент вязкости воды сильно уменьшается с ростом температуры. Напротив, для газов значение коэффициента (а растет с повышением температуры. Происхождение сил вязкости так же, как процесса теплопроводности в газе следует искать в молекулярной природе строения материи. Молекулы газа при своих собственных движениях переносят вместе с собой из одного места в другое определенное количество материи, энергии и количества движения. Результатом изменения количества движения за счет этого процесса и являются силы вязкости. Те параметры газа, с которыми мы имеем дело при исследовании газа как сплошной среды, являются средними величи- [c.113]
Для трехатомных газов ( Oj и HjO) зависимость средней молекулярной теплоемкости от темп-ры у Шюле дана в форме таблицы. Если эти данные нанести на график, по абсциссам к-рого отложены темп-ры (г°С), а по ординатам вначения средних молекулярных теплоемкостей, то для СО2 и Н, 0 получаются две кривые с выпуклостью в разные стороны (фиг. 7), что м. б. использовано для подбора закона прямой линии (а + bt) для продукта полного сгорания топлива при а = 1 с хорошей точностью. Для моторной нефти (С + Н + О = 0.86 + 0,13 + 0,01 = 1 кг) получим СО2 Н2О N2 = 13,6% 12,3% 74,1%, [c.152]
Если двигаться по периодической таблице вправо от элементов, расположенных в верхней части IV группы, то диэлектрические свойства становятся все более резко выраженными ), а силы связи убывают (температура плавления понижается). Крайнее правое положение в таблице занимают элементы VIII группы, которые представляют собой наилучший пример молекулярных твердых тел. Все твердые инертные газы (кроме гелия) образуют кристаллы с моноатомной г. ц. к. решеткой Бравэ. Электронная конфигурация каждого атома относится к устойчивому типу с заполненными оболочками в твердом теле она испытывает лишь незначительное искажение. Твердое тело скрепляется воедино очень слабыми (так называемыми еандереаалъсовскими или флуктуационно-диполъными) силами. Физическое происхождение этих сил допускает простое качественное объяснение ). [c.21]
Болезнь и кончина Г. С. Ландсберга вфеврале 1957 г. разрушила наш замысел написать книгу вместе. Монографию пришлось писать мне, опираясь на помощь моих друзей. В этой монографии излагаются исследования, выполненные главным образом в оптических лабораториях, руководимых Г. С. Ландсбергом, и особенно те из них, в которых принимал участие автор. Однако автор стремился к тому, чтобы читатель получил представление о современном состоянии вопроса о молекулярном рассеянии света вообще и располагал основными фактическими данными. С этой целью в монографию включены параграфы, посвященные изложению теории и некоторых результатов исследования молекулярного рассеяния света в газах и парах, в растворах полимеров и белков и некоторые другие вопросы. В основном тексте книги и в Приложении И1 приводятся обширные таблицы и многочисленные графики. [c.9]
Из изложенного выше следует, что экспериментальные данные по теплопроводности многих классов органических жидкостей и ряда многоатомных сжатых газов могут содержать заметный вклад лучистой составляющей при комнатной и особенно при высоких температурах. Поэтому в большинстве случаев выделение радиационной составляющей необходимо. Однако сведения, которыми мы раотолагаем для этого, невелики. Оптимальная информация, которая при этом может быть доступна из экспериментов, включает Хм — кондуктивную (молекулярную) теплопроводность, Хэф — эффективную теплопроводность для определенной толщины слоя. К сожалению, в большинстве случаев значение Хм не известно. Приходится иметь дело непосредственно с экспериментальными данными как таковыми, без выделения лучистой составляющей. Поэтому во всех случаях в справочнике приводятся значения эффективной теплопроводности, относящиеся к некоторой средней толщине слоя 0,5-0,7 мм, В тех же случаях, когда есть данные по молекулярной теплопроводности, приводятся и эти сведения с соответствующей надписью над таблицей. [c.8]
Параводород. Таблиць теплопроводности жидкого н газообразного параводорода естественного изотопного состава с молекулярной массой Л/ = 2,01594 охва-тьшают область температур 14-1500 К при давлениях от состояния разреженного газа до 100 МПа. Из рассмотрения исключена область в непосредственной близости к критической точке 32 плотности вещества интервале 21,9 [c.30]
Этот Параметр является показателем несферичности поля молекулярных сил например, значение оз = О соответствует сферической симметрии в разреженном газе. Отклонения от поведения, характерного для простого вещества, очевидны, если со > 0. Не выходя за рамки настоящего изложения, можно считать, что все молекулы с одинаковыми факторами ацентричности имеют одинаковые функции 2 = / (Тг, Рг) по уравнению (3.2.2). В данном случае вместо подготовки отдельных таблиц 2, Тг, Рг для различных значений ш, авторы предположили, что можно воспользоваться линейным разложением [c.34]
mash-xxl.info
Молярные объемы газов — Справочник химика 21
Распространенной ошибкой абитуриентов является использование молярного объема газов при нормальных условиях (22,4 л/моль) для решения задач, в условиях которых не говорится, что объемы газов измерены при н.у. [c.213]Один моль любого газа при данных условиях занимает один и тот же объем. Этот объем называется молярным объемом газа. Он равен отношению объема газа к его количеству вещества [c.90]
Объем, занимаемый данной массой газа. Если газ находится при 0°С и нормальном атмосферном давлении, то расчет можно произвести, исходя из молярного объема газа (22,4 л/моль). Если же газ находится при иных давлении и температуре, то вычисление объема производят по уравнению Клапейрона— Менделеева [c.35]
Этот объем часто называют молярным объемом газа. [c.132]
По мере уменьшения молярного объема газа оба допущения, положенные в основу представления об идеальном газе, становятся все менее верными. Для описания газа в более щироком диапазоне давлений Ван-дер-Ваальсом было предложено уравнение, носящее его имя. В уравнении Ван-дер-Ваальса учитывается, во-первых, что молекулы газа занимают некоторый конечный объем и в уравнение (8.1) вместо молярного объема вводится свободный от молекул [c.123]
Из гипотезы Авогадро следует, что если равные объемы газов содержат равные числа молекул, то объемы, занимаемые 1 моль газа, должны быть одинаковыми для всех газов. Этот объем, называемый молярным объемом газа, равен 22,414 дм при СТД , i i i (О °С и 1 атм) или 24,056 дм при КТД (20 °С и [c.154]
В частности, при нормальных условиях (и.у.)-при температуре Т= 273,15 К (0°С) и давлении /7 = 1,01325 10 Па (1 атм, 760 мм рт. ст.)-любой газ (близкий по свойствам к идеальному газу), количество которого равно 1 моль, занимает объем 22,4 л. Эта физическая постоянная называется молярным объемом газа при нормальных условиях. [c.13]
Молярный объем эквивалента газа X связан с молярным объемом газа X соотношением [c.11]
Следовательно, при нормальных условиях 1 моль любого газа занимает объем, разный 22,4 л. Этот объем называется молярным объемом газа и обозначается V,,,. [c.12]
Следовательно, при нормальных условиях моль любого газа занимает объем, равный 22,4 л. Этот объем называют молярным объемом газа (обозначают Ут) - [c.23]
При нормальных условиях (и. у.), т. е. давлении р, равном 101 325 Па, и температуре 7 = 273,15 К (О °С), I моль различных газов занимает объем 22,4 л (точнее, 22,41383 л). Такой объем называется молярным объемом газа и имеет размерность литр на моль (л/моль). По аналогии эквивалентный объем — объем, который занимает при данных условиях 1 моль эквивалента газооб разного вещества. Например, эквивалентный объем молекулярного водорода при нормальных условиях раве 22,4/2= 11,2 л/моль молекулярного кислорода — 22,4/4 = = 5,6 л/моль. [c.12]
При этом содержании в пределах достигаемой обычно точности наблюдается постоянство кажущегося молярного объема газа в воде, и он принимается за парциальный молярный объем при бесконечном разведении. Очевидно, что это утверждение имеет условный характер и определяется точностью эксперимента. В ряде случаев измерения объемов растворов проводились при таких содержаниях растворенных газов, при которых кажущиеся молярные объемы могут заметно отличаться от парциальных молярных объемов при предельном разведении. Тогда кажущиеся молярные объемы соответствуют изменению объема растворителя при растворении в нем веществ в области тех концентраций, при которых эти объемы были определены. Учитывая низкую относительную точность определений кажущихся молярных объемов малорастворимых веществ эти величины в качестве более или менее точного приближения могут быть приняты за парциальные молярные объемы при предельном разведении. [c.93]
Кажущиеся молярные объемы газов, растворенных в воде [c.94]
Анализ данных, приведённых в табл. 55, показал, что парциальные молярные объемы газов, растворенных в воде, полученные различными исследователями и различными методами как правило расходятся на 3—10 . Это объясняется прежде всего значительными трудностями при проведении экспериментов. Большинство исследований проводилось при 25 °С и в условиях насыщения воды газом при атмосферном давлении. Из сопоставления результатов, полученных по методам определения плотности [47] и измерения приращения давления газа, находящегося в равновесии с водным раствором газа, который подвергнут гидростатическому давлению [35], можно заключить, что погрешность обоих методов не более 3 %. [c.95]
ПАРЦИАЛЬНЫЕ МОЛЯРНЫЕ ОБЪЕМЫ ГАЗОВ (ЖИДКОСТЕЙ) [c.98]
Так как Л/ > Л/ , а парциальные молярные объемы газов в неводных жидкостях больше, чем в воде (см. табл. 56), 2 (ЪМ»/Ър) растворимость воды в неводной жидкости уменьшается с ростом давления. Так как в критической точке двойной системы (Ъц.»/ЪМ») = О, то при приближении к конечной критической точке (см. гл. О значение (ЪЫ»/Ър) резко возрастает, оставаясь отрицательным по знаку. Эту особенность подтверждают данные, приведенные на рис. 55 [11]. [c.160]
При нормальных условиях — давлении 101,325 кПа и температуре О или 273 К 1 моль любого газа занимает объем, примерно равный 22,4 л. Он называется молярным объемом газа при нормальных условиях и обозначается V». Единицы измерения — л/моль или мкмоль. [c.17]
При нормальных условиях 1 моль различных газов занимает объем, равный 22,4 л. Этот объем называется молярным объемом газа = 22,4 л). [c.48]
Значение молярного объема газа при нормальных условиях является коэффициентом пропорциональности между постоянными Авогадро и Лошмидта Нд (см. 2.5) [c.47]
Из закона Авогадро вытекают два важных следствия 1) моль любого газа при одинаковых условиях занимает один и тот же объем 2) при нормальных условиях (н. у.), т. е. при температуре 0°С и давлении 1,013-105 -[з ахм), моль любого газа занимает объем около 22,4 л. Этот объем называют молярным объемом газа (Ум), единица измерения его — л/.моль. Таким образом, молярный объем представляет собой частное от деления объема газа в литрах на его количество в молях Ум=У1п. Молярная масса и молярный объем данного газа связаны соотношением М=Умр, где р — плотность газа, г/л. [c.24]
E jui в реакции участвуют газы, то мой.но использовать молярные объемы газов. Прежде чем разбирагь дальнейшие примеры, приведем общий алгоритм расчетов по уравнению химической реакции. [c.250]
В блоке Состав вещества отражена и количественная сторона. Ее объем различен в разных учебниках. Кроме обязательного понятия об относительной атомной массе и относительной молекулярной массе многими авторами вводятся понятия о количестве вещества и о единице количества вещества — моле, о молярной массе
www.chem21.info
Молярная масса воздуха. А ?
Считается, что средняя молярная масса воздуха M=29 г/моль. Средняя — потому что воздух — это смесь газов, поэтому молярная масса воздуха представляет собой средневзвененное значение молярных масс газов, входящих в состав воздуха (сложить молярные массы газов умноженные на объёмные доли этих газов в воздухе) . Кстати, состав воздуха зависит от его происхождения, а уровне моря и в пределах тропосферы газовый состав воздуха (в об. %) таков: азот — 78,08%, кислород -20,95%, аргон — 0,93%, углекислый газ (диоксид углерода) — 0,034%, водород — 5 10-5 %; кроме того, имеются «следовые» количества так называемых благородных (или инертных, редких) газов: неона, гелия, криптона и ксенона. В среднем считается, что состав воздуха 78% азота, 21% кислорода, 1% — остальные газы. Кроме того можно определить молярную массу воздуха экспрементально по массе определённого объёма воздуха по уравнению Менделеева-Клапейрона: PV = (m/M)RT, M = mRT/(PV) = ρRT/P = 0,029 кг/моль.
Состав воздуха КомпонентОбъемное содержание % Массовое содержание % N2 78,09 75,50 O2 20,95 23,15 Ar 0,933 1,292 CO2 0,03 0,046 Ne 1,8 10-3 1,4 10-3 He 4,6 10-4 6,4 10-5 Ch5 1,52 10-4 8,4 10-5 Kr 1,14 10-4 3 10-4 h3 5 10-5 8 10-5 N2O 5 10-5 8 10-5 Xe 8,6 10-6 4 10-5 O3 3 10-7 — 3 10-6 5 10-7 — 5 10-6 Rn 6 10-18 4,5 10-17 далее по таблице менделеева вычисляем молярную массу =))))))))))))))
Молярная масса чистого сухого воздуха составляет 28,966
понятно напишите пожалуйстаааа
touch.otvet.mail.ru
