Учение о растворах — Стр 4
растворѐнного вещества, тем больше и моляльная концентрация этого вещества в растворе
сm(Х) = | 1000 |
| |
|
| ||
(100 ω) M (X) . | |||
| |||
Таким образом, самую высокую температуру кипения будет иметь раствор с массовой долей сахарозы, равной 10%, следовательно, этим раствром можно получить более сильный термический ожог.
Ответ: 4
2.Осмотическое давление сантимолярного раствора АlCl3 по сравнению с сантимолярным раствором NaCl будет ____________.
Решение:
NaCl и АlCl3 – электролиты, поэтому осмотическое давление растворов этих веществ рассчитывается по формуле
Росм = i с(Х) R T.
Между изотоническим коэффициентом i и степенью диссоциации существует математическая взаимосвязь: i = 1+ (n–1),
где n-число ионов, образующихся при диссоциации электролита.
Для АlCl3 n = 4, для NaCl n = 2, а т.к. эти вещества – сильные электролиты, то для них можно условно принять, что величина равна 100%.
С учѐтом этого очевидно, что i(АlCl3) > i(NaCl), следовательно,
Росм(АlCl3) > Росм (NaCl).
Ответ: больше.
3.В закрытом сосуде находятся 2 стакана: с чистой водой (1) и с водным раствором сахара (2). Через некоторое время:
1)уровень жидкости в стакане (1) понизится, в стакане (2) повысится
2)уровень жидкости в стакане (1) повысится, в стакане (2) понизится
3)уровень жидкости в обоих стаканах не изменится
4)уровень жидкости в обоих стаканах понизится
Решение:
Так как давление насыщенного пара растворителя над водным раствором сахара согласно I закону Рауля ниже, чем над чистой водой, то в закрытом сосуде будет происходить диффузия молекул паров воды от стакана с чистой водой к стакану с водным раствором сахара. В результате этого:
а) давление пара растворителя над стаканом с чистой водой уменьшится, равновесие нарушится, поэтому в соответствии с принципом Ле Шателье скорость испарения станет больше скорости конденсации, что приведѐт к уменьшению уровня жидкости в стакане с чистой водой; б) давление пара растворителя над стаканом с водным раствором сахара
увеличится, равновесие нарушится, поэтому в соответствии с принципом
studfiles.net
10.5.2. Давление насыщенного пара растворов. Тонометрический закон Рауля.
Пример 1. Вычислите давление пара над раствором, содержащим 34,23 г сахара C12H22O11 в 45,05 г воды при 65 ºС, если давление паров воды при этой температуре равно 2,5·104 Па.
Решение: Давление пара над раствором нелетучего вещества в растворителе всегда ниже давления пара над чистым растворителем при той же температуре. Относительное понижение давления пара растворителя над раствором согласно закону Рауля выражается соотношением
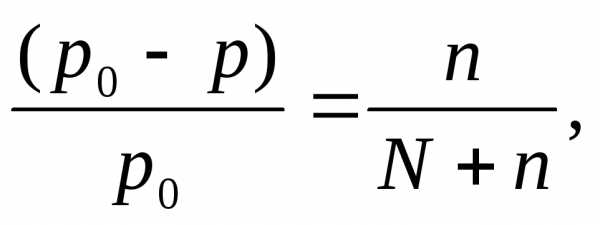
где p0 – давление пара над чистым растворителем;
p – давление пара растворителя над раствором;
n – количество растворенного вещества, моль;
N – количество растворителя, моль.
M (C12H22O11) = 342,30 г/моль;
M (H2O) = 18,02 г/моль.
Количество растворенного вещества и растворителя: n=34,23/342,30=0,1 моль; N = 45,05/18,02= 2,5моль.
Давление пара над раствором:
Пример 2. Рассчитайте молекулярную массу неэлектролита, если 28,5 г этого вещества, растворенного в 785 г воды, вызывают понижение давления пара воды над раствором на 52,37 Па при 40 °С. Давление водяного пара при этой температуре равно 7375,9 Па.
Решение: Относительное понижение давления пара растворителя над раствором равно
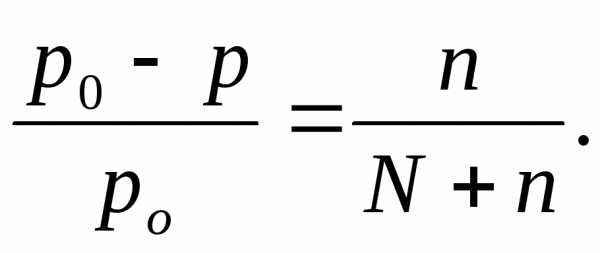
Находим:
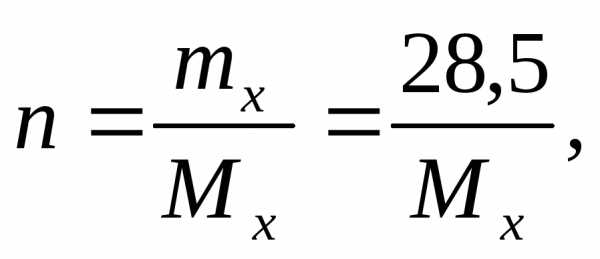 здесьmx– масса
нэлектролита, молярная масса которого
Mx г/моль.
здесьmx– масса
нэлектролита, молярная масса которого
Mx г/моль.
0,309Mx+ 0,202=28,5;
0,309Mx =28,298;
Молекулярная масса неэлектролита равна ~ 92 г/моль.
1 Давление пара эфира при 300С равно 8, 64∙104 Па. Сколько молей неэлектролита надо растворить в 50 молях эфира, чтобы понизить давление пара при данной температуре на 2666 Па? Ответ: 1,6 моля.
2 Понижение давления пара над раствором, содержащим 0,4 моля анилина в 3,04 кг сероуглерода, при некоторой температуре, равно 1003,7 Па. Давление пара сероуглерода при той же температуре 1,0133∙105 Па. Вычислите молекулярную массу сероуглерода. Ответ: 76,0.
3 При некоторой температуре давление пара над раствором, содержащим 62 г фенола С6H5ОН в 60 молях эфира, равно 0,507∙105 Па. Найдите давление пара эфира при этой температуре. Ответ: 0,513∙105 Па.
4 Давление пара воды при 50 0С равно 12334 Па. Вычислите давление пара раствора, содержащего 50 г этиленгликоля С2Н4(ОН)2 в 900 г воды. Ответ: 12140 Па.
5 Определите давление пара над раствором, содержащим 1,212∙1023 молекул неэлектролита в 100 г воды при 1000С. Давление пара воды при 100 °С равно 1,0133∙105 Па. Ответ: 0,98∙105 Па.
6 Давление водяного пара при 650С равно 25003 Па. Определите давление пара над раствором, содержащим 34,2 г сахара С12H22O11 в 90 г воды при этой температуре. Ответ: 24512 Па.
7 Вычислите молекулярную массу глюкозы, если давление водяного пара над раствором 27 г глюкозы в 108 г воды при 1000С равно 98775,3 Па. Ответ: 180.
8 Давление пара
воды при 1000С
равно 1,0133∙105 Па. Вычислите
давление водяного пара над 10%-ным
раствором мочевины СО(NН
9 Давление пара над раствором 10,5 г неэлектролита в 200 г ацетона (СН3)2CO равно 21854,4 Па. Давление пара ацетона при этой температуре равно 23939,35 Па. Найдите молекулярную массу неэлектролита. Ответ:32,0.
10 Рассчитайте молекулярную массу неэлектролита, если при 200С давление водяного пара над 63%-ным водным раствором этого неэлектролита равно 1399,40 Па. Давление паров воды при этой температуре равно 2335,42Па. Ответ: 46, 0.
11 Давление пара воды при 250С составляет 3167 Па. Вычислить для этой температуры давление пара раствора, в 450 г которого содержится 90 г глюкозы С6Н1206. Ответ: 3090 Па.
12 Давление пара воды при 200С составляет 2338 Па. Сколько граммов сахара C12H 22O11 следует растворить в 720 г воды для получения раствора, давление пара которого на 18,7 Па меньше давления пара воды? Вычислить процентное содержание сахара в растворе. Oтвет: 109 г; 13,5%.
13 При 00С давление пара эфира (C2H5)2O составляет 2465 Па. Найдите для той же температуры: а) давление пара 5%-ного раствора анилина С6Н5NH2 в эфире; б) давление пара 10%-ного раствора бензойной кислоты С6Н5СООН в эфире. Ответ: а) 23,65 кПа; б) 23,09 Па.
14При 320С давление пара водного раствора некоторого неэлектролита составляет 4721 Па, а давление пара воды при той же температуре 4753 Па. Вычислить осмотическое давление при той же температуре, приняв плотность раствора равной единице. Ответ: 622 кПа.
15 Осмотическое давление водного раствора глицерина С3Н8
16 Чему равно давление пара раствора, содержащего 46 г глицерина С3Н803 в 900 г воды при 400С, если давление пара воды при той же температуре 55,32 мм рт. ст. Ответ: 55,1 мм рт.ст.
17 Давление пара раствора 27 г неэлектролита в 108 г воды при 750С равно 270,1 мм рт.ст. Вычислить молекулярную массу неэлектролита, если давление пара воды при 750С равно 289,1 мм рт.ст. Ответ: 68,5.
18 Давление пара раствора 8,89 г неэлектролита в 100 г воды при 00С равно 4,54 мм рт.ст. Вычислить молекулярную массу неэлектролита, если давление пара воды при 00С равно 4,58 мм рт.ст. Ответ: 183,2.
19 Давление пара водного раствора глюкозы С6Н12О6 при 750С равно 250 мм рт.ст. Вычислить процентную концентрацию раствора, если давление пара воды при 75 °С равно 289,1 мм рт.ст. Ответ: 58,3%.20 Давление пара чистого ацетона (СН3)2СO при 200С равно 179,6 мм рт.ст. Вычислить давление пара раствора 2,5 г камфоры С10Н16О в 100 г ацетона при той же температуре. Ответ: 177,9 мм рт.ст.
21 Давление пара раствора глицерина С3Н8О3 в воде при 400С равно 50мм рт.ст. Сколько приблизительно молекул воды приходится на одну молекулу глицерина в указанном растворе? Давление пара воды при 400С равно 55,32 мм рт.ст. Ответ: ~11.
22 Давление пара эфира (С2Н5)2 O при 300С равно 647,9 мм рт.ст.; давление пара раствора 3,1 г анилина в 370 г эфира при той же температуре равно 643,58 мм рт.ст. Вычислить молекулярную массу анилина. Ответ: 93.
23 Давление пара воды при 400С равно 55,32 мм рт.ст. Вычислить понижение давления пара при растворении 0,2 моль вещества в 540 г воды. Ответ: 334 мм рт.ст.
24 Давление пара эфира при 300С равно 648 мм рт.ст. Сколько молей вещества надо растворить в 40 моль эфира, чтобы понизить давление пара при данной температуре на 10 мм рт.ст.? Ответ: 0,627 моль.
25 Давление пара воды при 750С равно 289,1 мм рт. ст. В скольких молях воды нужно растворить 0,4 моль вещества, чтобы при данной температуре понизить давление пара на 9 мм рт.ст.? Ответ: 12,45 моль.
26 Давление пара воды при 550С равно 633,9 мм рт.ст. Вычислить давление пара раствора, содержащего 29 г фенола С6Н5ОH в 900 г воды. Ответ: 630,7 мм рт.ст.
27 Давление пара воды при 100 °С равно 760 мм рт.ст. Вычислить давление пара над 4%-ным раствором мочевины СО(NН2)2 при этой температуре. Ответ: 750,6 мм рт.ст.
28 При некоторой температуре давление пара над раствором, содержащим 31 г анилина С6H5NH2 в 30 моль эфира, равно 540,8 мм рт.ст. Вычислить давление пара эфира при этой температуре. Ответ: 546,8 мм рт.ст.
29 Над раствором, содержащим 5,59 маннозы в 180 г воды, давление пара при 800С равно 354 мм рт.ст., а давление пара воды при этой температуре 355,1 мм рт.ст. Вычислить молекулярную массу маннозы. Ответ: 180.
30 При некоторой температуре давление пара над раствором, содержащим 2,44 г бензойной кислоты в 370,0 г эфира С4Н10О, равно 917,5 мм рт.ст. Давление пара эфира при этой температуре 921,2 мм рт.ст. Вычислить молекулярную массу бензойной кислоты. Ответ: 122.
studfiles.net
10.5.2. Давление насыщенного пара растворов. Тонометрический закон Рауля.
Пример 1. Вычислите давление пара над раствором, содержащим 34,23 г сахара C12H22O11 в 45,05 г воды при 65 ºС, если давление паров воды при этой температуре равно 2,5·104 Па.
Решение: Давление пара над раствором нелетучего вещества в растворителе всегда ниже давления пара над чистым растворителем при той же температуре. Относительное понижение давления пара растворителя над раствором согласно закону Рауля выражается соотношением
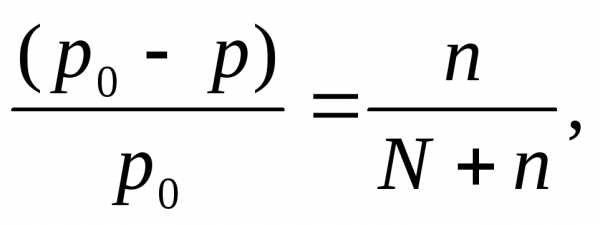
где p0 – давление пара над чистым растворителем;
p – давление пара растворителя над раствором;
n – количество растворенного вещества, моль;
N – количество растворителя, моль.
M (C12H22O11) = 342,30 г/моль;
M (H2O) = 18,02 г/моль.
Количество растворенного вещества и растворителя: n=34,23/342,30=0,1 моль; N = 45,05/18,02= 2,5моль.
Давление пара над раствором:
Пример 2. Рассчитайте молекулярную массу неэлектролита, если 28,5 г этого вещества, растворенного в 785 г воды, вызывают понижение давления пара воды над раствором на 52,37 Па при 40 °С. Давление водяного пара при этой температуре равно 7375,9 Па.
Решение: Относительное понижение давления пара растворителя над раствором равно
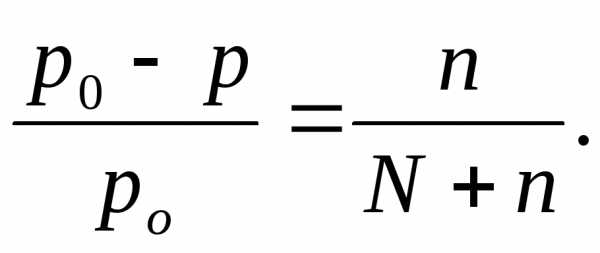
Находим:
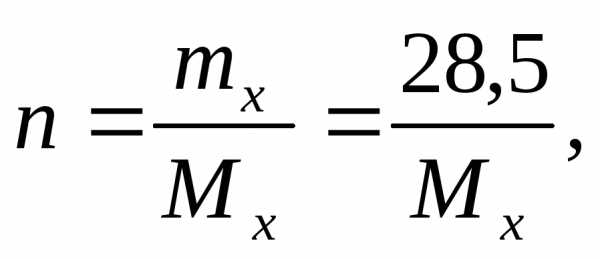 здесь mx– масса
нэлектролита, молярная масса которого
Mx г/моль.
здесь mx– масса
нэлектролита, молярная масса которого
Mx г/моль.
0,309Mx+ 0,202=28,5;
0,309Mx =28,298;
Mx=91,58 г/моль.
Молекулярная масса неэлектролита равна ~ 92 г/моль.
1 Давление пара эфира при 300С равно 8, 64∙104 Па. Сколько молей неэлектролита надо растворить в 50 молях эфира, чтобы понизить давление пара при данной температуре на 2666 Па? Ответ: 1,6 моля.
2 Понижение давления пара над раствором, содержащим 0,4 моля анилина в 3,04 кг сероуглерода, при некоторой температуре, равно 1003,7 Па. Давление пара сероуглерода при той же температуре 1,0133∙105 Па. Вычислите молекулярную массу сероуглерода. Ответ: 76,0.
3 При некоторой температуре давление пара над раствором, содержащим 62 г фенола С6H5ОН в 60 молях эфира, равно 0,507∙105 Па. Найдите давление пара эфира при этой температуре. Ответ: 0,513∙105 Па.
4 Давление пара воды при 500С равно 12334 Па. Вычислите давление пара раствора, содержащего 50 г этиленгликоля С2Н4(ОН)2 в 900 г воды. Ответ: 12140 Па.
5 Определите давление пара над раствором, содержащим 1,212∙1023 молекул неэлектролита в 100 г воды при 1000С. Давление пара воды при 100 °С равно 1,0133∙105 Па. Ответ: 0,98∙105 Па.
6 Давление водяного пара при 650С равно 25003 Па. Определите давление пара над раствором, содержащим 34,2 г сахара С12H22O11 в 90 г воды при этой температуре. Ответ: 24512 Па.
7 Вычислите молекулярную массу глюкозы, если давление водяного пара над раствором 27 г глюкозы в 108 г воды при 1000С равно 98775,3 Па. Ответ: 180.
8 Давление пара воды при 1000С равно 1,0133∙105 Па. Вычислите давление водяного пара над 10%-ным раствором мочевины СО(NН2)2 при этой температуре. Ответ: 0,98∙105 Па.
9 Давление пара над раствором 10,5 г неэлектролита в 200 г ацетона (СН3)2CO равно 21854,4 Па. Давление пара ацетона при этой температуре равно 23939,35 Па. Найдите молекулярную массу неэлектролита. Ответ:32,0.
10 Рассчитайте молекулярную массу неэлектролита, если при 200С давление водяного пара над 63%-ным водным раствором этого неэлектролита равно 1399,40 Па. Давление паров воды при этой температуре равно 2335,42Па. Ответ: 46, 0.
11 Давление пара воды при 250С составляет 3167 Па. Вычислить для этой температуры давление пара раствора, в 450 г которого содержится 90 г глюкозы С6Н1206. Ответ: 3090 Па.
12 Давление пара воды при 200С составляет 2338 Па. Сколько граммов сахара C12H22O11 следует растворить в 720 г воды для получения раствора, давление пара которого на 18,7 Па меньше давления пара воды? Вычислить процентное содержание сахара в растворе. Oтвет: 109 г; 13,5%.
13 При 00С давление пара эфира (C2H5)2O составляет 2465 Па. Найдите для той же температуры: а) давление пара 5%-ного раствора анилина С6Н5NH2 в эфире; б) давление пара 10%-ного раствора бензойной кислоты С6Н5СООН в эфире. Ответ: а) 23,65 кПа; б) 23,09 Па.
14При 320С давление пара водного раствора некоторого неэлектролита составляет 4721 Па, а давление пара воды при той же температуре 4753 Па. Вычислить осмотическое давление при той же температуре, приняв плотность раствора равной единице. Ответ: 622 кПа.
15 Осмотическое давление водного раствора глицерина С3Н8О3 составляет при 00С 567,3 кПа. Приняв плотность раствора равной единице, вычислить давление пара раствора при 00С, если давление пара воды при той же температуре составляет 610,5 Па. Ответ: 608 Па.
16 Чему равно давление пара раствора, содержащего 46 г глицерина С3Н803 в 900 г воды при 400С, если давление пара воды при той же температуре 55,32 мм рт. ст. Ответ: 55,1 мм рт.ст.
17 Давление пара раствора 27 г неэлектролита в 108 г воды при 750С равно 270,1 мм рт.ст. Вычислить молекулярную массу неэлектролита, если давление пара воды при 750С равно 289,1 мм рт.ст. Ответ: 68,5.
18 Давление пара раствора 8,89 г неэлектролита в 100 г воды при 00С равно 4,54 мм рт.ст. Вычислить молекулярную массу неэлектролита, если давление пара воды при 00С равно 4,58 мм рт.ст. Ответ: 183,2.
19 Давление пара водного раствора глюкозы С6Н12О6 при 750С равно 250 мм рт.ст. Вычислить процентную концентрацию раствора, если давление пара воды при 75 °С равно 289,1 мм рт.ст. Ответ: 58,3%.
20 Давление пара чистого ацетона (СН3)2СO при 200С равно 179,6 мм рт.ст. Вычислить давление пара раствора 2,5 г камфоры С10Н16О в 100 г ацетона при той же температуре. Ответ: 177,9 мм рт.ст.
21 Давление пара раствора глицерина С3Н8О3 в воде при 400С равно 50мм рт.ст. Сколько приблизительно молекул воды приходится на одну молекулу глицерина в указанном растворе? Давление пара воды при 400С равно 55,32 мм рт.ст. Ответ: ~11.
22 Давление пара эфира (С2Н5)2 O при 300С равно 647,9 мм рт.ст.; давление пара раствора 3,1 г анилина в 370 г эфира при той же температуре равно 643,58 мм рт.ст. Вычислить молекулярную массу анилина. Ответ: 93.
23 Давление пара воды при 400С равно 55,32 мм рт.ст. Вычислить понижение давления пара при растворении 0,2 моль вещества в 540 г воды. Ответ: 334 мм рт.ст.
24 Давление пара эфира при 300С равно 648 мм рт.ст. Сколько молей вещества надо растворить в 40 моль эфира, чтобы понизить давление пара при данной температуре на 10 мм рт.ст.? Ответ: 0,627 моль.
25 Давление пара воды при 750С равно 289,1 мм рт. ст. В скольких молях воды нужно растворить 0,4 моль вещества, чтобы при данной температуре понизить давление пара на 9 мм рт.ст.? Ответ: 12,45 моль.
26 Давление пара воды при 550С равно 633,9 мм рт.ст. Вычислить давление пара раствора, содержащего 29 г фенола С6Н5ОH в 900 г воды. Ответ: 630,7 мм рт.ст.
27 Давление пара воды при 100 °С равно 760 мм рт.ст. Вычислить давление пара над 4%-ным раствором мочевины СО(NН2)2 при этой температуре. Ответ: 750,6 мм рт.ст.
28 При некоторой температуре давление пара над раствором, содержащим 31 г анилина С6H5NH2 в 30 моль эфира, равно 540,8 мм рт.ст. Вычислить давление пара эфира при этой температуре. Ответ: 546,8 мм рт.ст.
29 Над раствором, содержащим 5,59 маннозы в 180 г воды, давление пара при 800С равно 354 мм рт.ст., а давление пара воды при этой температуре 355,1 мм рт.ст. Вычислить молекулярную массу маннозы. Ответ: 180.
30 При некоторой температуре давление пара над раствором, содержащим 2,44 г бензойной кислоты в 370,0 г эфира С4Н10О, равно 917,5 мм рт.ст. Давление пара эфира при этой температуре 921,2 мм рт.ст. Вычислить молекулярную массу бензойной кислоты. Ответ: 122.
studfiles.net
Давление насыщенного пара над раствором. Закон рауля.
Растворы нелетучих веществ в летучих растворителях.
рA0– давление насыщенного пара над чистым растворителем.
рA–давление насыщенного пара над раствором.
Давление насыщенного пара рA0 над растворителем или жидкостью определяется межмолекулярным взаимодействием внутри жидкости. Чем больше сила взаимодействия fA—A между молекулами, тем меньше пара над жидкостью, и соответственно, тем меньше давление этого парарA0 <<<.
Давление насыщенного пора над раствором рAпри нелетучем растворенном веществе В отличается от давления насыщенного пара над чистым растворителемрA0. Для нахождения этого отличия в зависимости от состава идеального раствора рассмотрим условия равновесияi-го компонента в растворе и в парообразном состоянии. Это равновесие определяется равенством химических потенциалов:
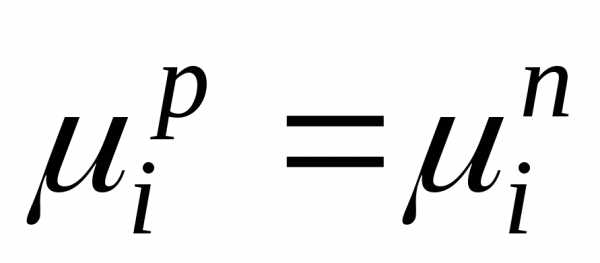 , где
, где
 –
химические потенциалыi-го
компонента в растворе и в парообразном
состоянии.
–
химические потенциалыi-го
компонента в растворе и в парообразном
состоянии.
Химический потенциал можно выразить через парциальное давление:
Если i-й компонент подчиняется законом идеальных газов, то дифференцируя это уравнение, получим:
(*)
Теперь из уравнений и (*) выразим изменения мольной доли растворенного вещества следующим образом:
Проведем интегрирование этого уравнения от рA0дорAи отNA=1 доNA, изменяющегося в пределах 0<NA<1, гдеNA– мольная доля растворителя в растворе; для чистого растворителяNA=1,
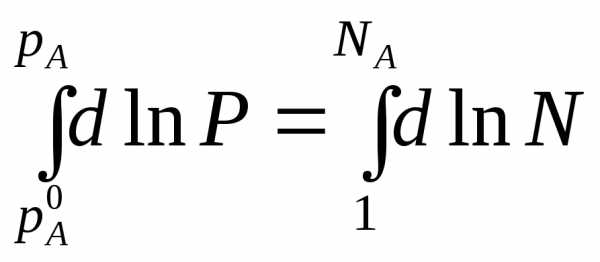
После интегрирования получаем:
(1) (*)
Давление насыщенного пара над растворомрAравно произведению его давления над чистым растворителем рA0 на его мольную долюNA.
Если раствор состоит из двух компонентов А(р-ль) и В(в-во), то мольная доля растворенного вещества равна NB=1-NA. Тогда уравнение (*) трансформируется:
Если NВ – мольная доля растворенного вещества, то
(2) (**)
Формулы (*) и (**) отражают различные способы выражениязакона Рауля.
Разность (рA0— рA) характеризует понижение давления насыщенного пара над раствором, а отношение (рA0— рA)/ рA0 – относительное понижение давления насыщенного пара.
Тогда закон Рауля формулируется следующим образом:относительное понижение давления пара над раствором равно мольной доле растворенного вещества в растворе.
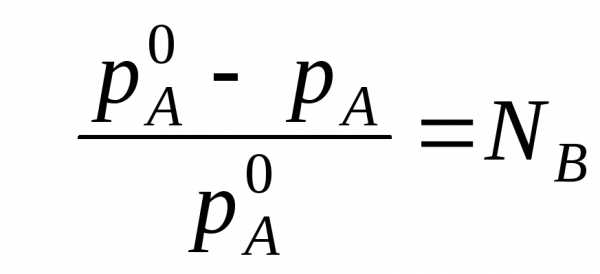
Закон Рауля применим к идеальным и сильно разбавленным растворам.
Максимальноедавление пара, создаваемое жидкостью – давление её насыщенного пара при данной температуре.
ДНП растет с температурой.
Когда ДНП становится равным внешнему давлению, жидкость закипает.
Пример.Вычислим давление пара при 373 К (1000С) над водным раствором сахарозы, мольная доля которой составляетNB=1,01∙10-3, для воды рA0=1,013∙105 Па.
Согласно уравнению (**)
Как следует из полученных данных, над раствором сахарозы происходит весьма незначительное снижение давления насыщенного пара воды по сравнению с чистой водой.
Идеальные растворы из двух летучих компонентов.
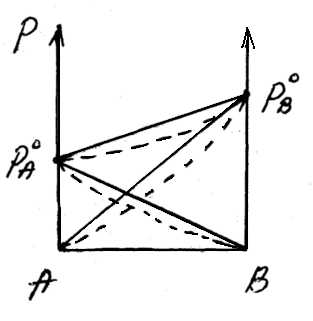
А
В
А+В
рA0 рВ0 рA+ рВОбщее давление пара над раствором рбудет равно сумме парциальных давлений его компонентов; для раствора, содержащего компоненты А и В, общее давление р=рА+рВ.
На основании уравнения (*), как для компонента А, так и для компонента В, можно считать, аNА=1-NВ.
Общее давление будет равно:
(3) (***)
Это уравнение характеризует линейную зависимость давления от мольной доли компонента В, что можно отобразить графически.
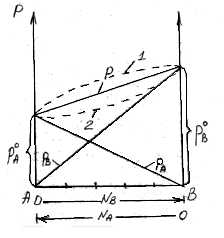
На рисунке по оси ординат слева отложены парциальные давления компонента А, которые изменяются от 0 до рA0, а справа – изменения парциального давления компонента В. Общее давлениеризменяется отрA0 дорВ0.Линейная зависимостьобщего и парциальных давлений от состава растворахарактерна для идеальных и разбавленных растворов(ΔV=0; ΔH=0; ΔS=ΔSи.г).
Практически, идеальными свойствами обладает раствор бензола в толуоле, что объясняется незначительностью сия межмолекулярного взаимодействия между молекулами всех компонентов раствора. Поэтому общее давление над раствором бензола в толуоле равно сумме парциальных давлений каждого из компонентов.
В случае предельно разбавленных растворов, концентрация растворенного вещества в которых бесконечно мала, давление пара (газа) растворителя выражается в соответствии сзаконом Рауля:
Давление паров растворенного вещества, которого в предельно разбавленном растворе ничтожно мало, не подчиняется закону Рауля. В этом случае давление пара над раствором описывается законом Генри, который формулируется так:при постоянной температуре парциальное давление растворенного вещества рГ пропорционально его мольной доле:
,
где КГ – коэффициент пропорциональности, называемыйконстантой Генри(справочная величина), которая зависит от температуры и природы компонентов раствора, но не зависит от давления.
Для неидеальных растворов линейная зависимость общего давления от состава раствора нарушается: наблюдается положительное и отрицательное отклонения. Причем, как правило, эти отклонения одного знака как для общего давления р, так и для парциальных давленийрAирВкомпонентов раствора.
Положительное отклонение от закона Рауля наблюдается в том случае, когда в растворе идет диссоциация молекул компонентов в растворе. Такие растворы образуются с поглощением теплоты (ΔH>0), т.е. процесс растворения будет эндотермическим.
ΔH>0, fA-A > fA-В
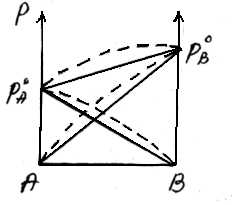
Отрицательное отклонение от закона Рауля наблюдается в случае ассоциации (укрупнения) частиц, формирующих раствор, и образования более прочных связей. При этом растворение идет с выделением теплоты (ΔH<0), т.е. процесс экзотермический.
ΔH<0, fA-A < fA-В
studfiles.net
Давление насыщенного пара растворителя над раствором. Закон Рауля
Если в замкнутый сосуд, из которого предварительно удалили воздух, поместить чистый растворитель, например, воду (рис. 27), то в результате естественного процесса испарения над жидкостью образуется пар. Он будет состоять из молекул жидкости, оторвавшихся от ее верхнего слоя в результате своего хаотического теплового движения и перешедших в газовую фазу. На совершение данного процесса необходимо затратить определенное количество энергии, чтобы преодолеть силы притяжения между молекулами жидкой фазы. Эндотермический процесс испарения обратим. По мере накопления молекул в газовой фазе над поверхностью жидкости одновременно начнет протекать и обратный процесс – конденсация пара, т.е. переход молекул растворителя обратно в жидкость. Причем конденсация является экзотермическим процессом и сопровождается выделением теплоты.
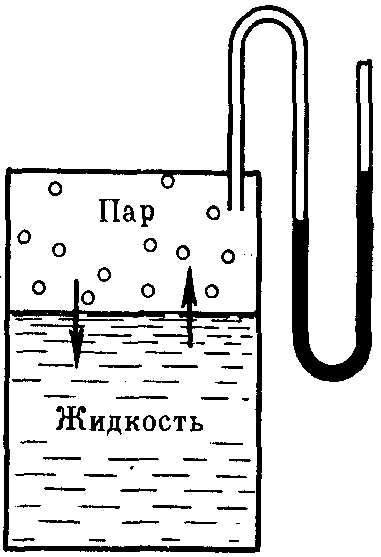
Рис. 27.Равновесие жидкость — пар (схема)
Со временем скорости обоих процессов уравняются и в системе установится динамическое равновесие, при котором число молекул растворителя, испарившихся с поверхности жидкости за единицу времени, будет равно числу молекул, перешедших в жидкость из газообразной среды. Но при этом какое-то постоянное и не меняющееся во времени число молекул растворителя будет находиться над его поверхностью, образуя насыщенный пар. Давление этого пара на жидкость называютдавлением насыщенного пара чистого растворителя (р0).Его можно измерить с помощью манометра (рис. 27).
При неизменной температуре и внешнем давлении р0 остается постоянным и зависит только от природы жидкости и поэтому является одной из ее физических характеристик.
Так, при 293 K(20оС) давление насыщенного пара Н2О равно 2,319 кПа; этилового спирта – 5,85 кПа; диэтилового эфира – 58,93 кПа.
При повышении температуры согласно принципа Ле-Шателье равновесие смещается в сторону эндотермического процесса испарения. В результате чего количество молекул жидкости над ее поверхностью начнет увеличиваться. Это приведет к возрастанию давления насыщенного пара, когда система снова придет в равновесие.
Если растворить небольшое количество какого-нибудь нелетучего вещества1(молекулы которого не могут переходить в газовую фазу) концентрация свободных молекул растворителя в верхнем слое жидкости уменьшится, т.к. часть мест там займут частицы растворенного вещества. Они к тому же будут удерживать вокруг себя (связывать) ближайшие молекулы растворителя, формируя из них сольватные оболочки.
В этом случае равновесие между жидкостью и ее насыщенным паром устанавливается при более низком давлении (р) по сравнению с давлением насыщенного пара над чистым растворителем (р0).
Опытным путем было установлено, что для растворов понижение давления насыщенного пара растворителя (р0 – р = р) не зависит от природы растворенного вещества, а определяется только его концентрацией.
Французский физик Франсуа Рауль установил математическую зависимость между р и мольной долей растворителя, которая называется законом Рауля:
р = р02,
где 2 – мольная доля растворителя в раствор.

Франсуа Мари Рауль (1830 – 1901) – французский химик и физик, член-корреспондент Парижской АН (1890). С 1867 работал в Гренобльском университете (профессор с 1870). Член-корреспондент Петербургской АН (1899). Исследуя в 1882–1888 понижение температуры кристаллизации, а также понижение давления пара (или повышение температуры кипения) растворителя при введении в него растворённого вещества, открыл закон Рауля, применяемый для определения молекулярных масс веществ в растворённом состоянии.
Таким образом, согласно закону Рауля давление насыщенного пара растворителя над раствором прямо пропорционально мольной доле растворителя.
Часто закон Рауля математически записывают по-другому:
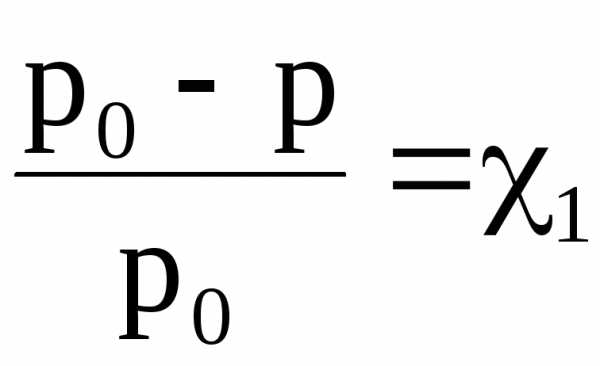 или
или 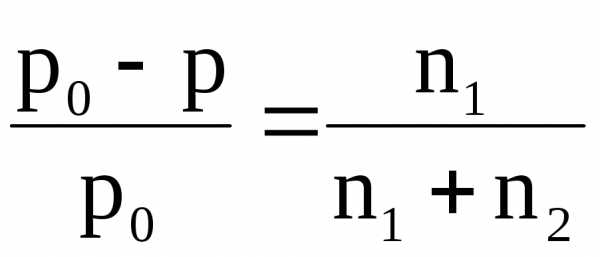 ,
,
где 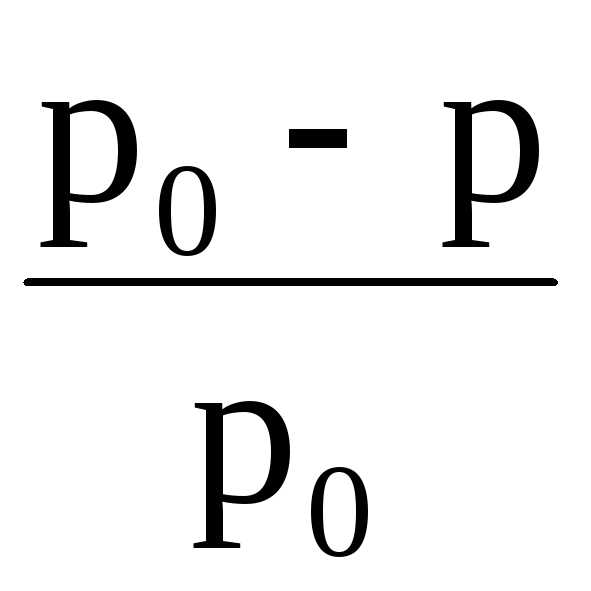 – относительное понижение
давления насыщенного пара растворителя
над раствором; 1 – мольная доля растворенного вещества; n1 –
химическое количество (моль) растворенного
вещества; n2 – химическое количество растворителя.
– относительное понижение
давления насыщенного пара растворителя
над раствором; 1 – мольная доля растворенного вещества; n1 –
химическое количество (моль) растворенного
вещества; n2 – химическое количество растворителя.
В этом случае его формулировка звучит несколько иначе:
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
Растворы, которые строго подчиняются закону Рауля, являются идеальными. Для реальных растворов неэлектролитов закон Рауля соблюдается тем точнее, чем более разбавленным является этот раствор. По мере повышения концентрации растворенного вещества для большинства растворов наблюдаются отклонения от закона Рауля.
Не подчиняются закону Рауля растворы электролитов (кислот, оснований, солей). Причем, даже в тех случаях, когда они являются разбавленными. Причина этого явления будет нами рассмотрена позже.
studfiles.net
Понижение давления насыщенного пара над раствором — Мегаобучалка
Давлением насыщенного пара называется давление пара над жидкостью, установившееся при достижении равновесия испарения жидкости и конденсации её пара. Если в растворителе растворено нелетучее вещество, переход которого в паровую фазу исключен, наличие его в растворе будет затруднять испарение растворителя. Поэтому равновесие жидкость-пар установится при меньшем давлении
пара растворителя над раствором, чем его давление над чистым
растворителем. Таким образом, давление насыщенного пара растворителя над раствором (Р) всегда будет меньше давления насыщенного пара над чистым растворителем (Р0).
В 1886 году французский ученый Ф.Рауль сформулировал закон: при постоянной температуре давление насыщенного пара растворителя над раствором равно молярной доле растворенного вещества: Р0 — Р n
——— = -—— ,
P0 n + N
где n — число молей растворенного вещества, N — число молей растворителя в растворе.
Или n
∆Р = Р0 ———— , где ∆Р = Р0 — Р.
n + N
Закон Рауля применим для идеальных растворов. Для реальных растворов в это уравнение необходимо ввести изотонический коэффициент: Р0 — Р n
——— = i ——
P0 n + N
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
1. Вычислите давление пара раствора, содержащего 34,2 г сахара С12Н22О11 в 180 г воды при 300 С, если давление пара над водой при этой температуре равно 0,42·105 Па.
| Дано: m(С12Н22О11)= 34,2 m(H2O) = 180 г Р0 = 0,42·105 Па М(С12Н22О11) = 342 г/моль М(Н2О) = 18 г/моль | Решение: 1.n=n(С12Н22О11)= m(С12Н22О11)/M(С12Н22О11) n = 34,2/342 = 0,1 моль 2. N = ν(H2O) = m(H O)/M(H O) = 180/18 = 10 моль 3. Р = Р0 – (Р0 × n)/(N+n) = (0,42×105×0,1)/(10 + 0,1) = 0,416×105 Па |
| Р1 = ? | Ответ: 0,416×105 Па |
2. Определите молярную массу вещества, если над раствором 21 г этого вещества в 400 г ацетона давление пара равно 21854,4 Па. Давление пара ацетона (СН3)2СО при данной температуре равно 23939,35 Па.
| Дано: m(в-ва) = 21 г m((СН3)2О) = 400г Р1 = 21854,4 Па Р0 = 23939,35 Па М((СН3)2О) = 58 г/моль | Решение: N = ν((СН3)2СО) = 400/ 58 = 6,9 (моль) Р0 — Р1/ Р0 = n/ (N + n) (23939,35 — 21854,4)/23939,35 = n/ (6,9 + n) n = (0,087 ´ 6,9) + 0,087n = 0,6/0,913 = 0,658 М(в-ва) = m/n = 21/0,658 = 32 (г/моль) |
| М(в-ва) = ? | Ответ: 32 г/моль |
3.3. Повышение температуры кипения и понижение температуры замерзания растворов
Переходы жидкости в другие фазовые состояния — парообразное и твердое — характеризуются температурами кипения и плавления. Температуры кипения и замерзания растворов зависят от давления пара над растворами. При температуре кипения в равновесии находятся две фазы — жидкость и пар. Жидкость начинает кипеть тогда, когда давление насыщенного пара ее оказывается равным давлению газа над нею. Так, вода закипает при 1000 С при атмосферном давлении 760 мм рт.ст. (1 атм, 101,3 кПа), так как при этом давление насыщенного пара её становится равным 760 мм рт.ст. При растворении в воде нелетучего вещества давление насыщенного пара понижается. По этой причине для достижения внешнего давления необходимо нагреть раствор выше 1000 С. Таким образом, температура кипения раствора всегда выше температуры кипения чистого растворителя. Разность между температурами кипения раствора и растворителя называется повышением температуры кипения (∆tкип = ∆Ткип).
При температуре замерзания в равновесии находятся три фазы:
твердая, жидкая и газообразная (пар). Жидкость затвердевает (замерзает, кристаллизуется) тогда, когда давление ее пара становится равным давлению насыщенного пара соответствующей твердой фазы. Лед и жидкая вода могут существовать совместно при атмосферном давлении при 00 С, так как при этой температуре давление насыщенного пара надо льдом (4,85 мм рт.ст.) равно давлению насыщенного пара над водой. При растворении в воде нелетучего вещества давление пара над раствором при 00 С будет меньше 4,85 мм рт.ст. и лед, помещенный в этот раствор, будет таять. Одновременное существование льда и раствора станет возможным при температуре ниже 00 С, когда давление насыщенного пара над льдом снизится настолько, что станет равным давлению пара над раствором. Таким образом, температура замерзания раствора всегда ниже температуры замерзания чистого растворителя. Разность между температурами замерзания чистого растворителя и раствора называется понижением температуры замерзания (кристаллизации) (∆tзам = ∆Тзам).
Зависимость между повышением температуры кипения и понижением температуры кристаллизации раствора от его молярной концентрации определяется вторым законом Рауля (следствия из закона Рауля): «Повышение температуры кипения и понижение температуры замерзания раствора прямо пропорциональны моляльной концентрации растворенного вещества»:
∆Ткип = Е × B(X) или ∆Ткип = Е × Сm
∆Тзам = К × B(X) или ∆Тзам = К × Сm,
где В(X) или Сm — моляльная концентрация, Е – эбулиоскопическая константа, К — криоскопическая константа.
Эбулиоскопическая и криоскопическая константы зависят только от химической природы растворителя и не зависят от природы растворенного вещества. Значение эбулиоскопической (криоскопической) константы показывает повышение температуры кипения (понижение температуры замерзания) раствора при его моляльной концентрации, равной единице, то есть если В(X) = 1 моль/кг, то ∆tкип = Е или ∆tзам = К. В этом физический смысл данных величин. Таким образом, независимо от природы растворенного вещества одномоляльные растворы кипят при температуре равной Ткип
(растворителя) + Е, а замерзают при температуре Тзам(растворителя) — К.
В отличие от идеальных растворов для реальных растворов необходимо учитывать межмолекулярные взаимодействия. Поэтому для реальных растворов в приведенные формулы вводится изотоноческий коэффициент:
∆tкип = iЕВ(X)
∆tзам = iКВ(X)
Законы Рауля лежат в основе экспериментальных методов изучения поведения веществ в растворах — эбулиометрии и криометрии. Измерение температуры кипения (эбулиометрия) и температуры замерзания (криометрия) растворов используют для определения изотонических коэффициентов, степени электролитической диссоциации электролитов, молекулярной массы веществ.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
1. Определите температуру кипения и замерзания раствора, содержащего 1 г нитробензола в 10 г бензола. Е(С6Н6) = 2,57, К(С6Н6) = 5,1. Температура кипения чистого бензола равна 80,20 С , температура замерзания равна 5,40 С.
| Дано: m(С6Н6NO2) = 1г m (С6Н6) = 10 г Е(С6Н6) = 2,57 К(С6Н6) = 5,1 tкип = 80,20 C tзам =5,40 C M(С6Н6NO2) = 123 г/моль | Решение: В(X) = m(X) × 1000 / (M(X) × m (р-ля)) В(С6Н6NO2) = 1 × 1000/(123 ´ 10) = 0,813 (моль/кг) Δ Ткип = Е· В(X) Δ Тзам = K· В(X) Δ Ткип = 2,57· 0,813 = 2,09 К Δ Тзам = 5,1· 0,813 = 4,15 К tкип = 80,2 + 2,09 = 82,290 С tзам = 5,4 – 4,15 = 1,250 С |
| tкип (р-ра) = ? tзам (р-ра) = ? | Ответ: 82,29о С; 1,25о С |
2. Температура кипения раствора, содержащего 4 г вещества в 110 г
этанола (С2Н5ОН), равна 78, 620 С. Определите молярную массу растворенного вещества. Е(С2Н5ОН) = 1,22, температура кипения этанола 78,30 С.
| Дано: m(в-ва) = 4 г m(С2Н5ОН)=110 г Е(С2Н5ОН) = 1,22 tкип = 78,30 C | Решение: Δ Ткип = 78, 62 — 78,3 = 0,32 Δ Ткип = Е · В(X) = Е ´ m(X) ´ 1000/(M(X) ´ m(р-ля)) M(в-ва) = Е ´ m(в-ва) × 1000/(ΔТкип × m(С2Н5ОН)) = 1,22 ´ 4 ´ 1000/(0,32 × 110) = 138,64 ( г/моль) |
| М(в-ва) = ? | Ответ: 138,64 г/моль |
ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОПОДГОТОВКИ
1. Какие физико-химические свойства называют коллигативными? Назовите их. От чего зависит количественное выражение этих свойств?
2. Какие мембраны называют полупроницаемыми? Приведите примеры материалов, обладающих свойством избирательной проницаемости.
3. Какое давление называют осмотическим? Какие факторы определяют величину осмотического давления, и каким уравнением оно выражается?
4. В каких случаях растворы электролитов при одной и той же температуре имеют одинаковое осмотическое давление? Как называют такие растворы?
5. Какой раствор по отношению к другому называют: а) гипертоническим; б) гипотоническим? В сторону какого из них должен быть направлен осмос?
6. Дайте формулировку и приведите математическое выражение закона Рауля.
7. Какие два следствия вытекают из закона Рауля?
8. Когда жидкости затвердевают (кристаллизуются), закипают?
9. Какие характеристики называют эбулиоскопической и криоскопической константами? Зависят ли они от природы растворённого вещества и растворителя?
10. Верно ли утверждение, что все одномоляльные водные растворы неэлектролитов: а) закипают при 100,52°С, б) кристаллизуются при -1,86°С? Ответ мотивируйте.
11. Что называют изотоническим коэффициентом? Каков физический смысл изотонического коэффициента? Какие методы используют для экспериментального определения его?
12. Как связаны между собой степень электролитической диссоциации и изотонический коэффициент?
13. Как определяют молекулярные массы растворённых веществ по коллигативным свойствам? Приведите формулы для расчёта.
14. Вычислите осмотическое давление при 25° С раствора, в 5 л которого содержится 171 г сахара (С12Н22О11). Ответ:2,477×105 Па.
15. 400 мл раствора содержит 2 г растворённого вещества. Осмотическое давление раствора при 27° С 1,216×105 Па. Определите молярную массу растворённого вещества. Ответ: 102,5 г/моль.
16. Раствор сахарозы (C12H22O11) при 0° С имеет осмотическое давление 7,1 ×105 Па. Сколько (г) сахарозы содержится в 250 мл такого раствора? Ответ: 25,76 г.
17. Сколько (г) этанола (С2Н5ОН) надо растворить в 500 мл воды, чтобы осмотическое давление раствора при 20° С составляло 4,052 ×105 Па. Объём раствора принять равным объёму воды. Ответ: 3,83 г.
18. 200 мл раствора содержит 1 г растворённого вещества. При 20° С раствор имеет осмотическое давление 4,3×105 Па. Определите молярную массу растворённого вещества. Ответ: 28,3 г/моль.
19. Определите, будут ли при одной и той же температуре изотоническими 3%-ные водные растворы сахарозы (С12Н22О11) и глицерина (С3Н803). Плотности растворов принять равными 1 г/мл. Ответ подтвердить расчетами. Ответ:Растворы не изотоничны.
20. Рассчитайте осмотическое давление при 3100 К 20%-ного водного раствора глюкозы (r = 1,08 г/мл), применяемого для внутривенного введения при отёке лёгкого. Какова тоничность этого раствора (гипер-, гипо-, изотонический) по отношению к крови, если учесть, что Росм крови равно 740 — 780 кПа? Ответ:3091,3 кПа; гипертонический.
21. Вычислите давление пара 30%-ного водного раствора мочевины (CO(NH2)2) при 50° С. Давление пара воды при этой температуре равно 12,33 кПа. Ответ: 10,93 кПа.
22. Давление пара раствора, содержащего 20 г растворённого вещества в 180 г воды, равно 3,64 кПа. Определите молярную массу растворённого вещества, если давление пара воды при этой температуре равно 3,78 кПа. Ответ: 52 г/моль.
23. Рассчитайте молярную массу неэлектролита, если при 20° С давление пара над 63%-ным водным раствором его равно 1399,4 Па. Давление паров воды при этой температуре равно 2335,42 Па. Ответ: 47,096 г/моль.
24. Водный раствор сахарозы (C12H22O11) замерзает при -1,1°С. Определите массовую долю (в %) сахарозы в растворе. К(Н20) = 1,86. Ответ: 16,8%.
25. Вычислите температуру замерзания 20%-ного раствора глицерина (С3Н803) в воде. К(Н20) = 1,86. Ответ: -5,05С.
26. При какой температуре замерзает 4%-ный раствор этанола С2Н5ОН в воде? К(Н20) = 1,86. Ответ: -1,7° С.
27. Раствор, содержащий 27 г вещества в 1000 г воды, кипит при 100,078°С. Определить молярную массу растворённого вещества. Е(Н20) = 0,52. Ответ: 180 г/моль.
28. Какой из растворов будет замерзать при более низкой температуре: 10%-ны раствор глюкозы (С6Н12О6) или 10%-ный раствор сахарозы (С12Н22О11)? Ответ подтвердить расчетами. Ответ:Раствор глюкозы.
Образец билета тестированного контроля по теме:
«Коллигативные свойства растворов»
1. Укажите математическое выражение закона Вант-Гоффа:
а) Росм =C(X)RT б) Росм= C(X)Rt в) Росм= С(Х) Т
2. Понижение давления насыщенного пара равно:
а)∆Р/Р б) Р0n/(n+N) в) n/n+N
3. Одномоляльные водные растворы неэлектролитов кипят при одинаковой температуре, равной (К(Н20) = 1,86; Е(Н20) = 0,52):
а) 100,52° С б) 99,48° С в) 101,86° С
4. При растворении 5 г вещества в 200 г воды получается раствор, кристаллизующийся при -1,45° С. Молярная масса растворённого вещества равна:
а) 28 б) 32 в) 136
5. Осмотическое давление (в кПа) 0,01 N раствора сахарозы С12Н22О11 при 25° С равно:
а) 24,76 б) 2,48 в) 1,24
Ответы на задания образца билета ТК:
| Номер вопроса | |||||
| Код ответа | а | б | а | б | а |
Оценка задания.Число правильных ответов:
1, 2. 6 баллов (неудовлетворительно)
3. 7 баллов (удовлетворительно)
4. 8 баллов (хорошо)
5. 9 баллов (отлично)
Лабораторная работа:Определение значения осмотического давления для состояния клеток по сохранностиэритроцитов в растворе
Цель работы: Освоить приготовление растворов с различной массовой долей растворенного вещества методом разведения. Продемонстрировать значение концентрации растворенных веществ для нормального состояния клеточных элементов.
Ход работы:Приготовить раствор хлорида натрия с массовой долей NаС1 3,4%. Подготовить 5 пробирок, в пробирки со 2-й по 5-ю пипеткой приливают по 2 мл воды. Далее в 1-ю и 2-ю пробирки приливают по 2 мл приготовленного раствора хлористого натрия. Раствор во 2-й пробирке перемешивают и 2 мл его переносят в следующую 3-ю пробирку. Раствор в 3-й пробирке также перемешивают и 2 мл его переносят в 4-ю пробирку. Перемешивают раствор в 4-й пробирке и 2 мл его переносят в 5 пробирку. Из последней 5-й пробирки отбирают 2 мл раствора и выливают. В каждой пробирке оказывается по 2 мл растворов электролитов, разведенных по сравнению с исходным раствором в следующее число раз: 1-я — 1, 2-я — 2, 3-я — 4, 4-я — 8 и 5-я – 16 раз. Таким образом, получаются растворы с массовой долей хлористого натрия 3,4%, 1,7%, 0,85%, 0,425%, 0,2125%. Затем в каждую пробирку аптечной пипеткой вносят по 1 капле раствора, содержащего эритроциты. Растворы перемешивают, выдерживают 10 минут. Одну каплю раствора из каждой пробирки стеклянной палочкой наносят на предметное стекло и рассматривают под микроскопом при увеличении (40 ×15).
Порядок оформления работы: Привести расчет массовой доли NаС1 для получения исходного раствора. Записать изменения окраски растворов в пробирках после добавления эритроцитов и зарисовать картины, наблюдаемые в микроскопе. Объяснить полученные результаты и сделать выводы об осмотическом давлении в используемых растворах хлористого натрия.
4. ЭЛЕКТРОХИМИЯ
Электрохимия изучает химические процессы, протекающие на границе проводников электрического тока с участием ионов и электронов. В организме возникают различные биоэлектрические потенциалы, которые обуславливают возникновение электрического тока. Электрический ток как составная часть импульса возбуждения в нервной, мышечной и железистой тканях является обязательным компонентом инициирования различных физиологических процессов. Изучение механизмов возникновения потенциалов позволяет разобраться в закономерностях многих биохимических процессов в организме. Например, возникновение клеточного потенциала необходимо для проникновения в клетки ионов солей, различных органических соединений, а также для выделения из клеток секреторных веществ и продуктов обмена.
Различные потенциалы на клеточных мембранах множества клеток тканей суммируются и приводят к возникновению тканевых и органных разностей потенциалов. Запись суммарных изменений органных потенциалов имеет большое диагностическое значение и используется в клинике в ряде функциональных методов исследования – электроэнцефалографии, электрокардиографии, электромиографии и т.д.
Пропускание тока через ткани и органы используют в практической медицине для лечения и диагностики заболеваний. В физиотерапии применяют катодную и анодную гальванизацию тканей, электрофорез лекарственных веществ, различные виды диатермии.
Кроме того, в медицинской практике широко используется эндопротезирование костных тканей, зубов с использованием материалов, включающие различные металлы. При этом необходимо учитывать возможность развития электрохимических процессов, которые определяют долговечность применяемых материалов и их влияние на состояние окружающих тканей.
Поэтому использование электрохимических методов анализа и различных способов электрохимического воздействия имеет
существенное значение, как для медико-биологических исследований, так и для практической медицины.
Цель изучения: понять основные механизмы электрохимических процессов и их значение для жизнедеятельности организма.
Студент должен знать:
-механизм возникновения скачка потенциала на границе проводников электрического тока;
— значение биопотенциалов для процессов жизнедеятельности;
— устройство и применение электродов;
— устройство и работу гальванического элемента;
— основы потенциометрии и ее практическое использование.
Студент должен уметь:
— определять знак и величину редокс-потенциалов и по их значениям прогнозировать направление и возможность осуществления окислительно-восстановительных реакций;
-подбирать необходимые электроды и гальванические элементы в зависимости от целей исследования;
-пользоваться ионометрами.
4.1. Электродные процессы
Под электродными процессами понимают возникновение потенциалов и электрического тока вследствие химических реакций на электродах, а также обратную группу явлений — химические реакции в растворе, вызываемые электрическим током (электролиз).Энергия электрического поля любого заряда характеризуется его потенциалом. Он равен работе, которую надо совершить, чтобы нейтрализовать этот заряд. Потенциал измеряется в вольтах. Проводник c электронной проводимостью, на котором при помещении его в раствор возникает свободный заряд, называется электродом. При создании замкнутой системы из электродов с разными по величине зарядами, состоящей из внешней и внутренней цепей, в ней возникает электродвижущая сила (ЭДС). ЭДС обеспечивает направленное перемещение заряженных частиц от меньшего потенциала к большему, т.е. появление электрического тока.
Потенциалы электродов зависят от концентрации в растворе ионов, участвующих в электрохимическом процессе на границе электрода и раствора. Поэтому измерив, потенциал электрода, можно найти различные физико-химические параметры — концентрацию, рН растворов, константы химических процессов. Соответствующие методы анализа широко используются в медико-биологических и клинических исследованиях. Созданы специальные ионоселективные электроды, позволяющие проводить непосредственные измерения концентрации кислорода, углекислоты, различных ионов (Na+, К+, Са2+ и др.) и органических соединений (глюкозы, этилового спирта и др.) в биологических жидкостях.
Изменение физико-химических свойств слюны имеет принципиальное значение для развития тех или иных патологических процессов в ротовой полости человека (кариеса зубной эмали, стоматитов различной природы). Ионы водорода органических кислот (пировиноградной, молочной и др.), находящихся в слюне, реагируют на поверхности эмали с гидроксофосфатом кальция:
2Са5(РО4)3ОН + 2Н+↔3Са3(РО4)2 + Са2+ + 2Н2О
Если концентрация ионов водорода повысится более значительно, то ионы кальция полностью перейдут в раствор (слюну) и произойдет растворение зубной эмали, способствующее возникновению кариеса:
2Са5(РО4)3ОН + 8Н+↔ 10Са2+ + 6НРО42¯ + 2Н2О
Для борьбы с кариесом применяют соединения фтора. Ионы фторы по-разному, в зависимости от их местной концентрации, реагируют с гидроксофосфатом кальция зубной эмали. Если их мало (в пределах 1,5 мг/мл), они частично замещают гидроксид-ионы в кристаллической решетке гидроксофосфата кальция:
Са5(РО4)3ОН + F¯ ↔Са5(РО4)3F + ОН¯
Повышенная по сравнению с гидроксофосфатом кальция прочность фторидфосфата кальция объясняется более прочной связью ионов фтора по сравнению с гидроксид-ионами.
Если фтора больше (более 1,5 мг/мл), образуется не слишком прочный покровный слой фторида кальция (СаF2), что приводит к развитию флюороза – разрушению зубной эмали из-за нарушения
функционирования амелобластов и развития остеосклероза и остеопороза тканей зубов.
Поэтому своевременная оценка электролитного состава слюны позволит своевременно проводить профилактические мероприятия, направленные на коррекцию наступивших изменений. Для этого в клинико-биохимических лабораториях используют потенциометрический метод исследования, позволяющий быстро и с высокой точностью определить количество различных ионов в слюне и в других биологических жидкостях.
4.2. Потенциометрическое измерение рН растворов
Сущность потенциометрического измерения рН состоит в определении электродного потенциала специального ионоселективного электрода, называемого электродом определения. Потенциал такого электрода зависит от концентрации ионов водорода в исследуемом растворе и поэтому рН раствора может быть рассчитан по уравнению электродного потенциала Нернста.
Потенциал электрода определения находят путем сравнения его с известным потенциалом электрода сравнения, то есть фактически измеряют ЭДС гальванического элемента из этих двух электродов, погруженных в исследуемый раствор.
Электродами сравнения могут служить только электроды, потенциал которых постоянен и не зависит от присутствия ионов водорода в исследуемом растворе. В основном используют хлорсеребряный электрод сравнения. Он представляет стеклянную трубку, в которую помещены серебряная проволока, покрытая хлористым серебром, и насыщенный раствор хлористого калия. Последний, через небольшое отверстие в стекле, закрытое асбестовым фитилем, медленно просачивается в исследуемый раствор. Ионы серебра из раствора переходят на серебряную проволоку и поэтому хлорсеребряный электрод имеет положительный заряд. Хлористое серебро слаборастворимо и раствор хлористого калия по отношению к нему будет всегда насыщенным. Концентрация ионов серебра будет зависеть от концентрации анионов хлора. Следовательно, при
постоянной концентрации хлористого калия потенциал электрода будет постоянным в любой гальванической цепи. Обычно используют электрод с насыщенным раствором хлористого калия, так как отпадает необходимость следить за постоянством его концентрации. Потенциал хлорсеребряного электрода с насыщенным раствором хлористого калия при 20 °С равен +0,201 В.
В качестве электродов определения применяют в основном стеклянный индикаторный электрод. Он представляет стеклянную трубку с полым шариком на одном конце. Стенка шарика не толще 0,01 мм и сделана из специального токопроводящего электродного стекла. Электрод заполнен 0,1 М раствором соляной кислоты, предохраняемым от выливания парафиновой пробкой. В раствор помещены кристаллы хлористого серебра и серебряная проволока, которой электрод соединяется с внешней цепью.
Теория ионного обмена академика Б.П. Никольского объясняет механизм возникновения потенциала у стеклянного электрода. Ионы калия, натрия и лития, входящие в состав стеклянной стенки шарика, обмениваются на ионы водорода исследуемого раствора. Отрицательно заряженные группы ковалентно связаны с силикатной полимерной цепью стекла и не могут обмениваться на анионы раствора. В результате катионного обмена в стекле образуются сложные кремниевые кислоты, способные к диссоциации с отщеплением ионов водорода. При работе электрода в измерительной гальванической цепи прохождение тока через стекло обеспечивается передачей протонов по гидроксильным группам кремниевых кислот. Диссоциация их приводит к возникновению потенциала, зависящего от рН исследуемого раствора. Чтобы не повлиять на этот потенциал с внутренней стороны стеклянной стенки шарика для контакта помещают только такой электрод, собственный потенциал которого постоянен при работе в любой гальванической цепи. Поэтому его называют внутренним электродом сравнения, в отличие от внешнего электрода сравнения, составляющего гальваническую пару с индикаторным стеклянным электродом. Чаще всего в качестве внутреннего электрода сравнения также используют хлорсеребряный электрод (Ag, AgC1 в 0,1 N растворе соляной кислоты).
Общий потенциал стеклянного электрода Ест. равен алгебраической сумме скачков потенциалов: на серебряной проволоке внутри электрода E1, на внутренней стороне стеклянной стенки электрода Е2 и на наружной поверхности его Ex. Потенциалы E1 и Е2 внутреннего электрода сравнения возникают в неизменной среде и поэтому постоянны. Их сумма может считаться стандартным потенциалом стеклянного электрода Е°ст. Потенциал Ех непостоянен, так как возникает на наружной поверхности электрода, граничащей с исследуемыми растворами различной кислотности. Таким образом, общий потенциал стеклянного электрода Ест. зависит только от концентрации ионов водорода в исследуемом растворе. Поэтому в соответствии с уравнением Нернста он будет определяться выражением:
Ест.= Е°ст. + 0,0001983 Т lgCн+
ЭДС (Еизм.) рассматриваемой цепи определяется уравнением:
Еизм. = Ехс. — Ест.
Данная ЭДС будет связана с рН исследуемого раствора следующим образом: Еизм. = Ехс. — Е°ст. — 0,0001983 Т lgCН+
рН = (Еизм. — Ехс. + Е°ст.) / 0,0001983 Т
Стандартный потенциал стеклянного электрода Е°ст. является величиной постоянной только для данного электрода, так как зависит от сорта стекла, толщины стенки шарика и других факторов. Поэтому каждый электрод калибруют. Для этого его погружают с электродом сравнения в разные буферные растворы с точно известными рН и настраивают прибор, регистрирующей ЭДС цепи, по этим значениям рН. Внутреннее сопротивление стеклянного электрода из-за малой электропроводности стекла очень велико и поэтому ток, даваемый электродной системой с таким электродом, очень незначителен. Его приходится предварительно усиливать и для достижения максимальной точности проводить измерения компенсационным методом. С этой целью используют специальные высокочувствительные электронные потенциометры. Шкала таких приборов проградуирована непосредственно в единицах рН и они называются рН-метрами.
Устройство лабораторного рН-метра
В настоящее время выпускают различные приборы под общим названием ионометры. В клинико-биохимических исследованиях их используют для определения рН растворов, газового и электролитного состава крови.
Ионометр состоит из датчика и регистрирующего прибора. Датчик представляет штатив, на котором смонтирована электродная система. В верхней части его укреплен полиэтиленовый сосуд с насыщенным раствором хлористого калия. В сосуд вставлен хлорсеребряный электрод сравнения. Раствор из сосуда через резиновую трубку поступает в стеклянный наконечник и оттуда через асбестовый фитиль в резиновой пробке медленно просачивается в исследуемый раствор. Тем самым создается электролитический контакт между хлорсеребряным электродом и исследуемым раствором. В то же время предупреждается поступление в хлорсеребряный электрод посторонних ионов из раствора, способных изменить его потенциал. Рядом с наконечником укреплен стеклянный электрод и термометр. Ниже находится круглый поворотный столик для стаканчика с исследуемым раствором. В нерабочем состоянии электроды должны быть постоянно погружены в дистиллированную воду или 0,1N раствор соляной кислоты. От датчика к регистрирующему устройству идут выводы электродов в коаксиальном кабеле и провод заземления.
Регистрирующий прибор представляет электронный потенциометр с предварительным усилением тока электродной системы. На передней панели прибора установлен микроамперметр и выведены ручки управления. У рН-метра шкала проградуирована в единицах рН сверху от 0 до 3, а снизу — от -1 до 14. Измеряемые прибором область рН -1-14 разделена на диапазоны — 1-2, 2-5, 5-8, 8-11, 11-14. Это сделано для увеличения цены деления микроамперметра и повышения точности измерений. Переход на нужный диапазон производится специальным переключателем. В дополнение к этому отдельным переключателем «Размах» осуществляется переход с измерений в широкой области рН -I -14 на измерения в пределах трех единиц одного из упомянутых диапазонов. Например, стрелка показывает по шкале узких диапазонов
1,55, переключатель пределов измерения стоит в положении 5-8, следовательно, прибор показывает рН 5+1,55=6,55. На панели есть переключатель вида работ, он может быть поставлен на измерение рН или на измерение ЭДС в мв. Имеется также ручной температурный компенсатор со шкалой от 0 до 100 °С. Он нужен для настройки прибора по температуре исследуемого раствора. Прибор снабжен и автоматической системой температурной компенсации. На панели имеются еще выводы переменных резисторов для настройки прибора по стандартным буферным растворам при периодической проверке его работы. Выводы резисторов закрыты крышками. При включении прибора в специальном светофильтре появляется свет контрольной лампы. Измерения проводят через 5-10 минут после включения прибора, когда он войдет в рабочий режим.
Лабораторная работа: измерение рН растворов.
Цель работы. Получить практические навыки использования ионометра для определения рН растворов.
Приборы и реактивы:
4) рН-метр;
5)буферные растворы с различными значениями рН
Ход работы:
1. Включить прибор. Должен появиться свет сигнальной лампы. Измерения проводить через 5-10 минут.
2. Переключатель вида работ установить на рН, а переключатель «Размах» на общий диапазон «15 рН».
3. Стаканчик с исследуемым раствором поставить на поворотный столик датчика. Электроды должны быть погружены в раствор не менее чем на 1, 5 см.
4. Температурный компенсатор установить в соответствии с температурой раствора, определенной по термометру в датчике.
5. Определить примерное значение рН раствора по общей шкале микроамперметра. В соответствии с этим установить переключатель диапазонов на нужный интервал. Переключатель „Размах» поставить на „3 рН» для точного измерения рН по шкале
6. узких диапазонов микроамперметра. Обычно в течение 15-20 секунд после включения нужного диапазона происходит установление показаний, после чего производят их отсчет.
7. После отсчета переключатель „Размах» возвратить в положение „15 рН». Повернув столик датчика, снять стаканчик с исследуемым раствором. Тщательно ополоснуть электроды дистиллированной водой, пользуясь специально прилагаемым к прибору дополнительным стаканчиком. После ополаскивания электроды оставить погруженными в стаканчик с дистиллированной водой.
8. Выключить прибор.
Порядок оформления работы: в отчете описать принцип потенциометрического измерения рН, общую схему рН-метра и порядок работы с ним. Соблюдая вышеприведенную последовательность определить рН пяти неизвестных растворов (задачи 1, 2, 3, 4, 5). Результаты работы записать в журнал в виде следующей таблицы:
| Задача | рН |
| 1. | |
| 2. | |
| 3. | |
| 4. | |
| 5. |
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача 1.Определите электродный потенциал цинка, опущенного в раствор его соли с концентрацией ионов цинка 0,001 моль/л.
Решение: Вычисление электродного потенциала Е производят по уравнению Нернста:
Е = Е0 + (0,059/n) ·lgC,
где Е0 – стандартный электродный потенциал; n – число электронов, участвующих в единичном акте окислительно-восстановительного
процесса; С – концентрация катионов металла в растворе, моль/л. Е0(Zn|Zn2+) = — 0,76 в.
Е(Zn|Zn2+)= — 0,76 в+ (0,059/2)·lg10-3 =- 0,76 + 0,0295 ·(-3)= — 0,85 в.
Задача 2. Вычислите ЭДС гальванического элемента:
Рt,H2|0,008 N NaOH||0,006 N HC1|H2,Pt,
если коэффициент активности ионов: f(H+) = 0,944; f(OH—) = 0,916. Степень диссоциации приведенных электролитов принять равной 100%.
Решение: Сначала определяем концентрацию ионов Н+ и ОН— в растворах НС1 и NаОН, моль/л: С(H+) = 6·10-3; С(OH—) = 8·10-3. Находим активность ионов по уравнению: а = fC. Следовательно,
а(H+) = 6·10-3·0,944 = 5,664·10-3 моль/л;
а(OH—) = 8·10-3·0,916 = 7,328·10-3 моль/л
По активности ионов ОН— определяем активность ионов Н+ в растворе NaOH:
а(H+) = 10-14/7,328·10-3 = 0,136·10-11 моль/л;
По уравнению Нернста вычисляем потенциалы водородных электродов раствора NaOH:
Е = 0,059lg0,136·10-11 = 0,059(1,1335 – 11) = -0,7 в;
раствора НС1:
Е = 0,059lg5,664·10-3 = 0,059(0,7531 – 3) = -0,133 в
Следовательно, ЭДС этого элемента равна:
ЭДС = -0,133 – (-0,7) = 0,567 в.
Задача 3. Можно ли в качестве окислителя в кислой среде использовать К2Сr2O7 в следующих процессах при стандартных условиях:
а) 2F—— 2e=F2, E0 = 2,85в б) 2C1— — 2e = C12, E0 = 1,36 в
в) 2 Br—— 2e=Br2, E0 = 1,06 в г) 2 I— — 2e = I2, E0 = 0,54 в
Стандартный окислительно-восстановительный потенциал системы
Сr2O72 — + 14 Н+ + 6е— = 2Сr3+ + 7Н2О равен 1,33 в.
Решение:Для определения направления окислительно-восстановительной реакции необходимо найти ЭДС гальванического
элемента. ЭДС окислительно-восстановительного гальванического элемента равна
ЭДС = Е0окисл. — Е0восст.
Если ЭДС > 0, то данная реакция возможна.
Рассчитываем ЭДС для каждой системы:
а) ЭДС=1,33 – 2,85=-1,52 в б) ЭДС=1,33–1,36 = -0,03 в
в) ЭДС=1,33 – 1,06= 0,27 в г) ЭДС = 1,33 – 0,54 = 0,79 в
Ответ: Дихромат калия может быть использован в качестве окислителя только для процессов с участием ионов брома и йода.
Задача 4. Хром находится в контакте с медью. Какой из металлов будет разрушаться, если эта пара металлов попадет в кислую среду (НС1)?
Решение: В ряде напряжения металлов хром расположен левее меди, т.е. является более активным металлом (Е0 = -0,744 в) и в гальванической паре будет катодом; медь – анодом (Е
megaobuchalka.ru
Давление насыщенного пара растворителя над раствором. Закон Рауля
Если в замкнутый сосуд, из которого предварительно удалили воздух, поместить чистый растворитель, например, воду (рис. 27), то в результате естественного процесса испарения над жидкостью образуется пар. Он будет состоять из молекул жидкости, оторвавшихся от ее верхнего слоя в результате своего хаотического теплового движения и перешедших в газовую фазу. На совершение данного процесса необходимо затратить определенное количество энергии, чтобы преодолеть силы притяжения между молекулами жидкой фазы. Эндотермический процесс испарения обратим. По мере накопления молекул в газовой фазе над поверхностью жидкости одновременно начнет протекать и обратный процесс – конденсация пара, т.е. переход молекул растворителя обратно в жидкость. Причем конденсация является экзотермическим процессом и сопровождается выделением теплоты.
Рис. 27. Равновесие жидкость – пар (схема)
Со временем скорости обоих процессов уравняются и в системе установится динамическое равновесие, при котором число молекул растворителя, испарившихся с поверхности жидкости за единицу времени, будет равно числу молекул, перешедших в жидкость из газообразной среды. Но при этом какое-то постоянное и не меняющееся во времени число молекул растворителя будет находиться над его поверхностью, образуя насыщенный пар. Давление этого пара на жидкость называютдавлением насыщенного пара чистого растворителя (р0).Его можно измерить с помощью манометра (рис. 27).
При неизменной температуре и внешнем давлении р0 остается постоянным, зависит только от природы жидкости и поэтому является одной из ее физических характеристик.
Так, при 293 K(20оС) давление насыщенного пара Н2О равно 2,319 кПа; этилового спирта – 5,85 кПа; диэтилового эфира – 58,93 кПа.
При повышении температуры согласно принципу Ле-Шателье равновесие смещается в сторону эндотермического процесса испарения. В результате чего количество молекул жидкости над ее поверхностью начнет увеличиваться. Это приведет к возрастанию давления насыщенного пара, когда система снова придет в равновесие.
Если растворить небольшое количество какого-нибудь нелетучего вещества1(молекулы которого не могут переходить в газовую фазу), концентрация свободных молекул растворителя в верхнем слое жидкости уменьшится, т.к. часть мест там займут частицы растворенного вещества. Они к тому же будут удерживать вокруг себя (связывать) ближайшие молекулы растворителя, формируя из них сольватные оболочки.
В этом случае равновесие между жидкостью и ее насыщенным паром устанавливается при более низком давлении (р) по сравнению с давлением насыщенного пара над чистым растворителем (р0).
Опытным путем было установлено, что для растворов понижение давления насыщенного пара растворителя (р0 – р = р) не зависит от природы растворенного вещества, а определяется только его концентрацией.
Французский физик Франсуа Рауль установил математическую зависимость между р и мольной долей растворителя, которая называется законом Рауля:
р = р02,
где 2 – мольная доля растворителя в растворе.
Франсуа Мари Рауль (1830 – 1901) – французский химик и физик, член-корреспондент Парижской АН (1890). С 1867 работал в Гренобльском университете (профессор с 1870). Член-корреспондент Петербургской АН (1899). Исследуя в 1882–1888 понижение температуры кристаллизации, а также понижение давления пара (или повышение температуры кипения) растворителя при введении в него растворённого вещества, открыл закон, применяемый для определения молекулярных масс веществ в растворённом состоянии (закон Рауля).
Таким образом, согласно закону Рауля давление насыщенного пара растворителя над раствором прямо пропорционально мольной доле растворителя.
Часто закон Рауля математически записывают по-другому:
или ,
где – относительное понижение давления насыщенного пара растворителя над раствором; 1 – мольная доля растворенного вещества; n1 – химическое количество (моль) растворенного вещества; n2 – химическое количество растворителя.
В этом случае его формулировка звучит несколько иначе:
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
Растворы, которые строго подчиняются закону Рауля, являются идеальными. Для реальных растворов неэлектролитов закон Рауля соблюдается тем точнее, чем более разбавленным является этот раствор. По мере повышения концентрации растворенного вещества для большинства растворов наблюдаются отклонения от закона Рауля.
Не подчиняются закону Рауля растворы электролитов (кислот, оснований, солей). Причем, даже в тех случаях, когда они являются разбавленными. Причина этого явления будет нами рассмотрена ниже.
studfiles.net
