Свойства нитрата серебра (AgNO3) (25 фактов, которые вы должны знать)
AgNO3 или нитрат серебра — неорганическая ионная соль серебра. Давайте кратко рассмотрим нитрат серебра в этой статье.
Нитрат серебра можно получить реакцией металлического серебра с азотной кислотой в разных условиях: один разбавленный и холодный, другой горячий и концентрированный, оба дают нитрат серебра. Согласно правилу Фаяна, катион серебра имеет более высокий ионный потенциал и может поляризовать нитрат-ионы, поэтому это ионное соединение.
Нитрат серебра представляет собой трехкоординированную тригональную плоскую молекулу. В структуре решетки каждый катион серебра присоединен к шести кислородным центрам и нитратному бидентатному лиганду. Теперь мы обсудим некоторые основные свойства закиси азота наряду с его молярной плотностью, реакционной способностью в следующей части статьи.
1. AgNO
3 ИЮПАККомпания IUPAC (Международный союз чистой и прикладной химии) название AgNO3 представляет собой азотнокислую соль серебра (I), так как ее получают из азотной кислоты, а серебро находится в состоянии +1. Общее название — нитрат серебра, где нитрат — анионная часть.
Общее название — нитрат серебра, где нитрат — анионная часть.
2. AgNO
3 химическая формулаХимическая формула нитрата серебра: AgNO.3 так как катионная часть представляет собой Ag, а анионная радикальная часть представляет собой нитрат, и обе они присутствуют в соотношении 1: 1. В нитрат-ионе будет присутствовать три кислорода вместе с одним азотом.
Структура нитрата серебра3. AgNO
3 CAS номерКомпания CAS номер (числовое значение до 10 цифр, данное Chemistry Abstracts Service) нитрата серебра: 7761-88-8.
4. AgNO
3 Идентификатор химического паукаКомпания идентификатор химического паука нитрата серебра составляет 22878, что дано Королевским химическим обществом.
5. AgNO
3 химическая классификацияНитрат серебра классифицируется в химии на следующие категории:
- AgNO3 электролит
- AgNO3 электрод
- AgNO3 неорганическая соль
- AgNO3 является осаждающим агентом
- AgNO3 является титрантом в окислительно-восстановительном титровании
6.
 AgNO3 молярная масса
AgNO3 молярная массаМолярная масса нитрата серебра составляет 169.87 г/моль, что исходит из атомной массы серебра, равной 107.8682, а для нитратного радикала это один атом азота и три атома кислорода, общая молярная масса которых составляет 14.0067 + (15.999*3) = 62.0037, а общая молярная масса нитрата серебра равна 107.8682 + 62.0037 = 169.87 г/моль.
7. AgNO
3 цветНитрат серебра представляет собой бесцветное или белое кристаллическое твердое соединение, но когда он вступает в реакцию с органической молекулой или подвергается воздействию света, он меняет свой цвет на черный для образования другой молекулы.
8. AgNO
3 вязкостьТвердый нитрат серебра не имеет вязкости, потому что это свойство жидкости, но расплавленный нитрат серебра имеет вязкость, зависящую от температуры.
| Температура (oC) | Вязкость (уравновешенность) |
256. 8 8 | 3.606 |
| 258.5 | 3.571 |
| 258.9 | 3.556 |
| 259.5 | 3.541 |
| 261.8 | 3.494 |
| 262.1 | 3.487 |
| 279.0 | 3.128 |
| 280.3 | 3.123 |
| 299.8 | 2.784 |
| 300.0 | 2.782 |
| 300.2 | 2.775 |
| 320.2 | 2.503 |
9. AgNO
3 молярная плотностьМолярная плотность нитрата серебра высока, поскольку это твердая молекула, и ее значение составляет около 4. 35 смXNUMX.3/ л, потому что он имеет молярную массу 169.87 г / моль, а объем молекулы составляет 22.4 л для катиона и аниона согласно расчету Авагаорда.
35 смXNUMX.3/ л, потому что он имеет молярную массу 169.87 г / моль, а объем молекулы составляет 22.4 л для катиона и аниона согласно расчету Авагаорда.
10. AgNO
3 температура плавленияНитрат серебра имеет более высокую температуру плавления, как 212.0C или 485K, потому что это ионное соединение, а кристалл нитрата серебра очень прочный, поэтому требуется больше энергии, чтобы разрушить кристалл и перевести его в жидкое состояние.
11. AgNO
3 точка кипенияНитрат серебра также имеет высокую температуру кипения 4400C или 713K, потому что для неорганической соли, такой как AgNO3 нужно больше энергии, чтобы выкипеть. У него сильное притяжение Ван-дер-Ваальса, а также ионная сила, поэтому его температура кипения очень высока.
12. AgNO
3 состояние при комнатной температуреНитрат серебра существует в виде кристаллического твердого соединения при комнатной температуре из-за сильного ионного взаимодействия между составляющими атомами.
13. AgNO
3 ионная связьСвязь серебра(I) с нитратным радикалом в молекуле нитрата серебра чисто ионная. Поскольку серебро обладает положительным зарядом, тогда как нитрат-ион содержит отрицательный заряд, и они связаны ионным взаимодействием, а нитрат имеет дополнительный электрон, который отдается катиону серебра.
14. AgNO
3 ионный радиусБудучи ионной молекулой, нитрат серебра имеет ионный радиус, а ионный радиус для серебра составляет 156 пм, тогда как для иона нитрата — 177 пм.
15. AgNO
3 электронные конфигурацииЭлектронная конфигурация — это расположение электронов в определенной оболочке, имеющей определенное квантовое число элемента. Мы пытаемся найти электронную конфигурацию AgNO3.
Электронная конфигурация Ag, N и O: [Kr]4d.105s1, [Он]2с22p3, и [He]2s22p4 соответственно, поскольку мы не можем предсказать электронную конфигурацию самого комплекса, поэтому мы должны определять электронную конфигурацию составляющих его атомов индивидуально.
16. AgNO
3 степень окисленияВ целом степень окисления нитрата серебра является нейтральной из-за катионной и анионной части, поскольку серебро имеет степень окисления +1, где для нитрат-иона N имеет степень окисления +5, поскольку каждый O находится в степени окисления -2.
17. AgNO
3 кислотность/щелочнойНитрат серебра не является ни кислым, ни основным, а представляет собой неорганическую соль, которая образуется при реакции с кислотой, поэтому именно она является кислой солью и обладает меньшими кислотными свойствами.
Ag + HNO3 = AgNO3
18. AgNO
3 без запаха?Нитрат серебра представляет собой белое кристаллическое твердое вещество без запаха.
19. AgNO
3 парамагнитный?Парамагнетизм — это тенденция элемента в направлении приложенного магнитного поля. Посмотрим, будет ли AgNO3 парамагнетик или нет.
Нитрат серебра не парамагнитен, а диамагнитен из-за наличия пяти спаренных электронов на самой внешней орбитали катиона серебра. Опять же, в случае нитратного радикала все электроны N, а также O находятся в спаренной форме, он имеет магнитная восприимчивость значение −45.7·10-6 cm3/ Моль.
20. AgNO
3 гидратыКатион серебра может притягивать молекулы воды, окружающие его, и образовывать гидратированную соль, которая называется водным нитратом серебра и формулируется как AgH.2НЕТ4, где одна молекула воды добавлена в виде гидратированной части с кристаллом нитрата серебра.
21. AgNO
3 Кристальная структураИз кристаллография Установлено, что нитрат серебра имеет орторомбическую кристаллическую структуру в форме решетки, где значения a, b и c равны 699, 732 и 1011 пм соответственно, а значения α, β, γ равны 900где координационное число равно 8.
Закись азота является полярной и проводящей по своей природе, потому что,
- Нитрат серебра может быть ионизирован на серебро и нитрат-ион.
- Ион серебра имеет более проводящую природу, чем ион нитрата.
- Подвижность ионов серебра высока, поэтому они легко переносят электричество.
- Форма молекулы асимметрична.
- Из-за плоской тригональной структуры он имеет дипольный момент
- Направление и величина дипольного момента не равны нулю.
- Возникают потоки дипольного момента от серебра к нитрат-иону.
23. AgNO
3 реакция с кислотойНитрат серебра растворим в кислоте, но не реагирует с ней, поэтому мы не можем предсказать механизм реакции нитрата серебра с молекулой кислоты. Но при взаимодействии с соляной кислотой дает нерастворимую соль хлорида серебра.
AgNO3 + HCl = AgCl (осадок)+ HNO3
24. AgNO
3 реакция с основаниемКогда сильная щелочь, такая как гидроксид натрия, реагирует с нитратом серебра, она дает оксид серебра темно-серого цвета.
- 2AgNO3 + 2NaOH → Ag2О + 2NaNO3 + H2O
Реакция азотнокислого серебра с оксидом не обнаружена, но при диссоциации азотнокислого серебра в расплавленном состоянии он дает диоксид азота.
2AgNO3(л) → 2 Ag(s) + O2(г) + 2НО2(Г)
26. AgNO
3 реакция с металломКогда медный стержень подвешивают в растворе нитрата серебра, мы получаем кристаллы серебра вместе с раствором нитрата меди синего цвета, нитрат серебра реагирует только с переходными металлами. Это замещающая реакция.
Это замещающая реакция.
2AgNO3 + Cu → Cu(НЕТ3)2 + 2Аг
Заключение
Нитрат серебра древние химики называли лунным едким веществом, его использовали в фотографии. Он может использоваться во многих органических синтезах, таких как Ag+ может защищать множество функциональных групп или присоединяться к ним для участия в желаемой реакции. Он может использоваться для приготовления долговечных чернил.
Argenti nitras – нитрат серебра – AgNo3
Описание: бесцв. прозрачн. кристаллы в виде пластинок или белых цилиндрич. палочек, без запаха. Под действием света темнеет.
Растворимость: очень легко растворим в воде, труднорастворим в спирте.
Подлинность:
1) С хлоридами выпадает белый творожистый осадок, нер-мый в HNO3, р-мый в NH4OH.
Ag+ + Cl— AgCl
2)
Реакция серебряного зеркала.
2[Ag(MH3)2]OH + H-COH 2Ag + HCOONH4 + 3NH3 + H2O
3) Реакция с дифениламином.
реакцию см. примесь нитратов в воде
Недопустимые примеси: Висмут, медь, свинец
AgNO3 + NH4CNS AgCNS + NH4NO3
Fe3+ + 6CNS— [Fe(CNS)6]3- красный
f(AgNO3) = 1;
Хранение: список А. В банках с притертой пробкой в защищенном от света месте.
Применение: Антисептическое и прижигающее. Применяется наружно, иногда внутренне
Органические лекарственные вещества Классификация
По происхождению:
природные
— алкалоиды, гормоны и т. д.
д.
синтетические.
По строению:
алифатические
циклические гетероциклические
карбоциклические алициклические
ароматические
Отличия анализа органических препаратов
1. Высокие молекулярные массы и сложное строение.
2. Термолабильность.
3. Способность гореть и обугливаться при прокаливании.
4. Неэлектролиты – неприменимы ионные реакции.
5. Реакции идут медленно, постадийно и могут быть остановлены на промеж. стадиях.
6. Иные Ткип, Тпл, наличие удельного вращения у ОАВ.
7. Большая применимость физических и физико-химических методов анализа.
8. Минерализация для подтверждения элементарной структуры и подлинности.
9.
Функциональный и элементный анализ при
определение подлинности, доброкачественности
и количественном определении.
Методы, используемые для определения подлинности, структуры и количественного определения.
I. Химические
II. Физико–химические.
1. Абсорбционные методы – основаны на измерении поглощения излучения: ИК, УФ, видимая – спектроскопия.
2. Исследование магнитного поля — спектроскопия ЯМР , ПМР, масс – спектроскопия.
3. Хроматография — бумажная, ТСХ, ГЖХ, ВЖХ, ГХ.
4. Поглощение рентгеновского излучения (рентгено-структурный) – изучение новых ЛП — дифракционный анализ.
Связь между структурой и фармакологическим действием
1. Ненасыщенные соединения более активны, чем насыщенные.
2. Алифатические влияют на нервные окончания, ароматические – на двигательные.
3. Введение галогенов и их расположение обуславливают токсичность препарата и направленность его фармакологического эффекта.
4. Введение гидроксильной группы увеличивает
всасываемость, растворимость.
Введение гидроксильной группы увеличивает
всасываемость, растворимость.
5. Введение карбоксильной группы уменьшает токсичность.
6. Азотсодержащие молекулы увеличивают влияние препарата на различные отделы ЦНС (III – раздражает нервные центры и гладкую мускулатуру, IV – ганглиоблокаторы).
7. На активность препарата также оказывают влияние кристаллическая структура, растворимость, пространственная структура: цис- и транс- изомеры, оптическая активность (D- и L-изомерия), направление вращения (d- и l-изомерия).
Препараты галогенпроизводных углеводородов
Производные
предельных и непредельных УВ, в молекуле
которых один или несколько атомов
замещены на галоген. Наличие галогена
определяет химические свойства вещества.
Вещества различны по агрегатному
состоянию. Введение галогена сообщает
препарату наркотические свойства ( от
F к I
уменьшающиеся), противомикробную,
противопаразитическую активность.
Связь углерод-галоген – ковалентная, при этом полярность и легкость разрыва ум. от F к I; это связано с ЭО (ум. от F к I), размерами атома (C-F-короткая, С-J – длинная рвется легче).
Методы минерализации
Для серосодержащих препаратов
1. Восстановительный (метод Файгля) — спекание с твердым HCOONa (формиат натрия).
S Na2S+ H+ H2S (запах).
Na2S + Pb2+ PbS + 2Na+ (черный осадок)
2. Окислительный: Нагревание со смесью концентрированных азотной и соляной кислот. Иногда с одной из них. Это метод «мокрой» минерализации.
“S” + конц. HNO3, HCl SO42-
Ba2+ + SO 42- BaSO4
Для азотсодержащих препаратов
1. Спекание с K2CO3,
Na2CO3 или их смесью (безводные):
Спекание с K2CO3,
Na2CO3 или их смесью (безводные):
“N” CN— [Fe(CN)6]4- Fe[Fe(CN)6] — – берлинская лазурь.
2. Спекание с безводным Na2S2O3 и K2CO3:
“N” SCN— Fe(SCN)3 красного цвета.
Для галогенсодержащих препаратов
Предварительная проба Бельштейна:
При
нагревании галогенсодержащих препаратов
в сухом виде на медной проволоке пламя
окрашивается: для хлора – в желтый, для
брома и йода – в синевато-зеленый цвет,
т.к. при увеличении температуры образуются
летучие галогениды меди. Не обнаруживается
F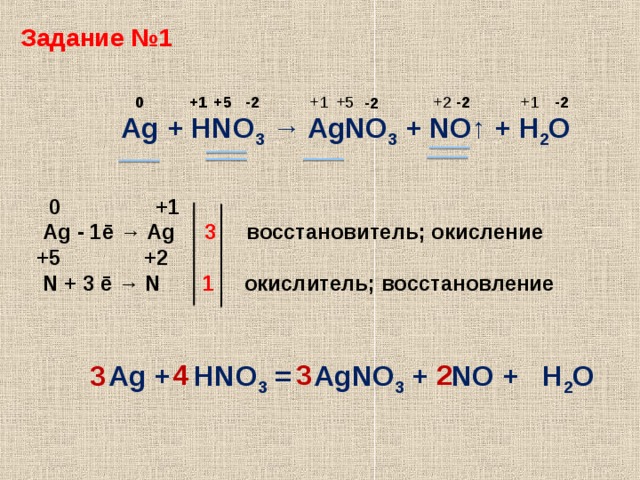
(AgNO3) (25 фактов, которые вы должны знать) Давайте кратко рассмотрим нитрат серебра в этой статье.
Нитрат серебра можно получить реакцией металлического серебра с азотной кислотой в различных условиях, один разбавленный и холодный, другой горячий и концентрированный, оба дают нитрат серебра. Согласно правилу Фаяна, катион серебра имеет более высокий ионный потенциал и может поляризовать нитрат-ионы, поэтому это ионное соединение.
Нитрат серебра представляет собой трехкоординированную тригональную плоскую молекулу. В структуре решетки каждый катион серебра присоединен к шести кислородным центрам и нитратному бидентатному лиганду. Теперь мы обсудим некоторые основные свойства закиси азота наряду с его молярной плотностью, реакционной способностью в следующей части статьи.
1. AgNO
3 Название IUPAC Название IUPAC (Международный союз теоретической и прикладной химии) AgNO 3 представляет собой азотнокислую соль серебра(I), так как ее получают из азотной кислоты, а серебро находится в + 1 состояние. Общее название — нитрат серебра, где нитрат — анионная часть.
Общее название — нитрат серебра, где нитрат — анионная часть.
2. AgNO
3 химическая формулаХимическая формула, представляющая нитрат серебра, представляет собой AgNO 3 , поскольку катионная часть представляет собой Ag, а анионная радикальная часть представляет собой нитрат, и обе они представлены в соотношении 1:1. В нитрат-ионе будет присутствовать три кислорода вместе с одним азотом.
Структура нитрата серебра3. AgNO
3 Номер CASНомер CAS (числовое значение до 10 цифр, данное Chemistry Abstracts Service) нитрата серебра: 7761-88-8.
4. AgNO
3 Идентификатор химического паукаИдентификатор химического паука нитрата серебра – 22878, присвоенный Королевским химическим обществом.
5. Agno
3 Химическая классификацияНитрат серебра классифицируется в химии по следующим категориям,
- Agno 3 — Электролит
- Agno 3 .
 AGROLYTE 99 Agno 3 . Agrolyte
AGROLYTE 99 Agno 3 . Agrolyte - Agno 3 3 3 3 .
- AgNO 3 — это неорганическая соль
- Agno 3 — это осаждающий агент
- Agno 3 — титрант в окислительно -восстановительном титровании
6. Agno
3 MARSLEN9999999999996. Agno
3 MAROLAR 9000.6. масса нитрата серебра составляет 169,87 г/моль, что исходит из атомной массы серебра, равной 107,8682, а для нитратного радикала это один атом азота и три атома кислорода, общая молярная масса которых составляет 14,0067 + (15,999*3) = 62,0037, а общая молярная масса нитрата серебра равна 107,8682 + 62,0037 = 169.0,87 г/моль.
7.
 AgNO 3 цвет
AgNO 3 цветНитрат серебра представляет собой бесцветное или белое кристаллическое твердое соединение, но когда он реагирует с органическими молекулами или подвергается воздействию света, он меняет свой цвет на черный, образуя другую молекулу.
8. AgNO
3 вязкостьТвердый нитрат серебра не имеет вязкости, поскольку он является свойством жидкости, но расплавленный нитрат серебра имеет вязкость, зависящую от температуры,
| Temperature ( o C) | Viscosity (poise) |
| 256.8 | 3.606 |
| 258.5 | 3.571 |
| 258.9 | 3,556 |
| 259,5 | 3,541 |
| 261,8 | 3,494 |
262. 1 4 1 4 | |
| 262.1 | |
262,1 111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111119н.0124| 3.128 | |
| 280.3 | 3.123 |
| 299.8 | 2.784 |
| 300.0 | 2.782 |
| 300.2 | 2.775 |
| 320.2 | 2.503 |
9. AgNO
3 молярная плотность Молярная плотность нитрата серебра высока, так как это твердая молекула, и значение близко к 4,35 см 3 /л, потому что он имеет молярную массу 169,87 г/моль, а объем молекулы составляет 22,4 л для катиона и аниона согласно расчету Авагаорда.
10. AgNO
3 температура плавленияНитрат серебра имеет более высокую температуру плавления, как 212 0 C или 485K, потому что это ионное соединение, а кристалл нитрата серебра очень прочный, поэтому требуется больше энергии для разрушения кристалла. и перевести его в жидкое состояние.
11. AgNO
3 температура кипенияНитрат серебра также имеет высокую температуру кипения 440 0 C или 713K, потому что для выкипания неорганической соли, такой как AgNO 3 , требуется больше энергии. У него сильное притяжение Ван-дер-Ваальса, а также ионная сила, поэтому его температура кипения очень высока.
12. AgNO
3 состояние при комнатной температуреНитрат серебра существует в виде кристаллического твердого соединения при комнатной температуре из-за сильного ионного взаимодействия между составляющими атомами.
13.
 AgNO 3 ионная связь
AgNO 3 ионная связьСвязь между радикалом серебра(I) и нитратным радикалом в молекуле нитрата серебра чисто ионная. Поскольку серебро обладает положительным зарядом, тогда как нитрат-ион содержит отрицательный заряд, и они связаны ионным взаимодействием, а нитрат имеет дополнительный электрон, который отдается катиону серебра.
14. AgNO
3 ионный радиусПоскольку нитрат серебра представляет собой ионную молекулу, его ионный радиус составляет 156 пм, тогда как у нитрат-иона 177 пм.
15. AgNO
3 электронные конфигурацииЭлектронная конфигурация – это расположение электронов в определенной оболочке, имеющей определенное квантовое число элемента. Пытаемся найти электронную конфигурацию AgNO 3 .
Электронная конфигурация Ag, N и O: соответственно, поскольку мы не можем предсказать электронную конфигурацию самого комплекса, поэтому мы должны определять электронную конфигурацию составляющих его атомов индивидуально.
16. AgNO
3 степень окисленияВ целом степень окисления нитрата серебра нейтральная из-за катионной и анионной части, поскольку серебро имеет степень окисления +1, где для нитрат-иона N имеет степень окисления +5, потому что каждый О находятся в степени окисления -2.
17. AgNO
3 кислотность/щелочностьНитрат серебра не является ни кислотным, ни основным, а является неорганической солью, которая образуется при реакции с кислотой, поэтому это именно кислая соль и она обладает меньшими кислотными свойствами .
Ag + HNO 3 = AgNO 3
18. Имеет ли AgNO
3 запах?Нитрат серебра представляет собой белые кристаллические твердые молекулы без запаха.
19. Является ли AgNO
3 парамагнитным? Парамагнетизм – это тенденция элемента в направлении приложенного магнитного поля. Посмотрим, является ли AgNO 3 парамагнитным или нет.
Посмотрим, является ли AgNO 3 парамагнитным или нет.
Нитрат серебра не парамагнетик, а диамагнетик из-за наличия пяти спаренных электронов на внешней орбитали катиона серебра. Опять же, в случае нитратного радикала все электроны N, как и O, находятся в спаренной форме, он имеет значение магнитной восприимчивости -45,7·10 −6 см 3 /моль.
20. AgNO
3 гидратыКатион серебра может притягивать окружающую его молекулу воды и образовывать гидратированную соль, которая называется водным нитратом серебра и формулируется как AgH 2 NO 4 , где одна молекула воды добавляют в виде гидратированной части с кристаллом нитрата серебра.
21. AgNO
3 кристаллическая структура Из кристаллографического исследования установлено, что нитрат серебра имеет орторомбическую кристаллическую структуру в форме решетки, где значения a, b и c равны 699, 732 и 1011 пм соответственно, а значения α,β,γ равны 90 0 , где координационное число равно 8.
закись азота полярная в природе, потому что
- Нитрат серебра может ионизироваться в серебро и нитрат-ион
- Ион серебра имеет более проводящую природу, как и нитрат-ион
- Подвижность иона серебра высока, поэтому он легко переносит электричество0008
- Форма молекулы асимметричная.
- Благодаря плоской тригональной структуре имеет дипольный момент
- Направление и величина дипольного момента не равны нулю.
- Существуют потоки дипольного момента от серебра к нитрат-иону.
23. AgNO
3 реакция с кислотой Нитрат серебра растворим в кислоте, но не реагирует с ней, поэтому мы не можем предсказать механизм реакции нитрата серебра с кислой молекулой. Но при взаимодействии с соляной кислотой дает нерастворимую соль хлорида серебра.
Но при взаимодействии с соляной кислотой дает нерастворимую соль хлорида серебра.
AgNO 3 + HCl = AgCl (осадок)+ HNO 3
24. AgNO
3 реакция с основаниемреакция с основанием, образующая сильные щелочи, как нитрид натрия имеет темно-серый цвет.
- 2AGNO 3 + 2NAOH → AG 2 O+ 2NANO 3 + H 2 O
Реакция нитрата серебра с оксидом не обнаружена, но при диссоциации нитрата серебра в расплавленном состоянии дает диоксид азота.
2AGNO 3 (L) → 2 Ag (S) + O 2 (G) + 2NO 2 (G)
26. Agno
3 Реакция с металлом 9007 медный стержень подвешивают в растворе нитрата серебра, мы получаем кристалл серебра вместе с раствором нитрата меди синего цвета, нитрат серебра реагирует только с переходными металлами. Это замещающая реакция.
Это замещающая реакция.
2AgNO 3 + Cu → Cu(NO 3 ) 2 + 2Ag
Заключение
Нитрат серебра используется древними химиками. Его можно использовать во многих органических синтезах, например, Ag + может защищать многие функциональные группы или присоединяться к ним для участия в желаемой реакции. Он может использоваться для приготовления долговечных чернил.
Нитрат серебра | Свойства и структура нитрата серебра и его применение
Химические соединения бывают двух типов. Их делят на органические и неорганические соединения. Нитрат серебра является неорганическим соединением. Его химическая формула — AgNO3. Когда серебро (Ag) реагирует с азотной кислотой (HNO3), химическая реакция приводит к образованию нитрата серебра.
Свойства и структура нитрата серебра и его применения
Символ Ag, используемый для обозначения серебра, происходит от латинского слова «Argentum». Эта реакция проводится в строго контролируемых условиях, потому что это приводит к выбросу токсичных паров оксидов азота. Нитрат серебра также называют лунным каустиком. Он убивает микроорганизмы, а также вступает в реакцию с соединениями в человеческой плоти. Именно поэтому его используют в медицинской промышленности. Слово «едкий» означает, что может разъедать. Неправильное применение Лунной каустики на теле человека может привести к серьезным повреждениям. Алхимики считали, что химическое серебро всегда ассоциировалось с Луной. Луна на латыни — Luna, поэтому ее назвали Lunar Caustic.
Эта реакция проводится в строго контролируемых условиях, потому что это приводит к выбросу токсичных паров оксидов азота. Нитрат серебра также называют лунным каустиком. Он убивает микроорганизмы, а также вступает в реакцию с соединениями в человеческой плоти. Именно поэтому его используют в медицинской промышленности. Слово «едкий» означает, что может разъедать. Неправильное применение Лунной каустики на теле человека может привести к серьезным повреждениям. Алхимики считали, что химическое серебро всегда ассоциировалось с Луной. Луна на латыни — Luna, поэтому ее назвали Lunar Caustic.
Химическая реакция представлена следующим образом:
3 Ag + 4 HNO3 → 3 AgNO3 + 2 h3O + NO
В этом случае азотная кислота обычно холодная и разбавленная. Когда серебро реагирует с горячей и концентрированной азотной кислотой, оно выделяет диоксид азота.
Свойства и структура
Нитрат серебра представляет собой бесцветную или белую кристаллическую соль.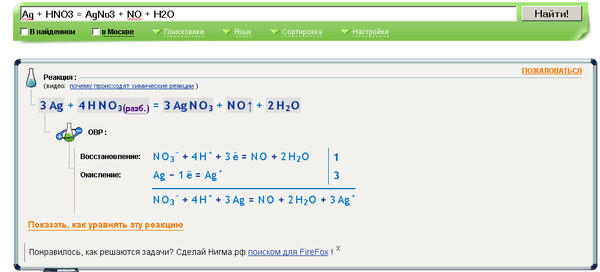 Когда он подвергается воздействию света или любого органического материала, он становится черным. Нитрат серебра при нагревании разлагается с образованием серебра, двуокиси азота и кислорода.
Когда он подвергается воздействию света или любого органического материала, он становится черным. Нитрат серебра при нагревании разлагается с образованием серебра, двуокиси азота и кислорода.
2 AgNO3 → 2 Ag + 2 NO2 + O2
Молярная масса нитрата серебра составляет 169,87 г/моль. Он имеет температуру плавления 212 ℃. Он хорошо растворим в воде, а также растворим в этаноле и ацетоне.
Применение нитрата серебра
Нитрат серебра широко используется в двух областях: в медицине и промышленности. Нитрат серебра является предшественником многих других используемых соединений серебра. Следовательно, одно из применений нитрата серебра заключается в получении других соединений серебра. Нитрат серебра является очень едким химическим веществом. Это используется при получении других солей серебра. Коллоидные соединения серебра, применяемые в медицине, также получают с использованием азотнокислого серебра. В фотографических эмульсиях используются галогениды серебра, а они, в свою очередь, готовятся из нитрата серебра. Это также используется в лабораториях для объемного анализа для определения галогенидов, тиоцианатов и т. д.:
В фотографических эмульсиях используются галогениды серебра, а они, в свою очередь, готовятся из нитрата серебра. Это также используется в лабораториях для объемного анализа для определения галогенидов, тиоцианатов и т. д.:
Некоторые медицинские применения нитрата серебра:
Глазные капли для детей. В 1881 году он впервые был использован для производства глазных капель. Это использовалось для лечения или предотвращения любых наследственных инфекций глаз, передающихся ребенку от матери. Однако в наши дни его не используют в качестве профилактического средства. Было доказано, что бактерии, гонококковые бактерии, которые являются основной причиной глазных инфекций, уничтожаются этим химическим веществом.
У некоторых людей есть родинки на руках или теле. Нитрат серебра применяют для прижигания и удаления таких родинок.

В стоматологии используется для лечения язв во рту.
Однако, хотя известно, что он используется в лечении некоторых проблем, как указано выше, нитрат серебра не следует употреблять или использовать без совета или консультации врача.
Некоторые промышленные применения нитрата серебра
Гальваническое покрытие: Такое покрытие выполняется на ювелирных изделиях и часах, чтобы придать изысканный вид и изысканный вид. Нитрат серебра используется, когда серебро должно быть покрыто никелем.
Все мы пользуемся зеркалами в повседневной жизни. Зеркала отражают все, что находится перед ними. Для создания такой отражающей поверхности используется нитрат серебра. Покрытие из нитрата серебра используется на стекле, что делает возможным преобразование обычного стекла в зеркало.

Он также используется в производстве многих красителей, таких как красители и чернила. Некоторые используют краски для волос с добавлением нитрата серебра. В текстильной промышленности для разметки ткани используют маркеры. В таких маркерах также используется нитрат серебра. Есть звенья, которые невозможно удалить никогда, они называются несмываемыми чернилами, в которых тоже используется это химическое вещество.
Взрывчатые вещества используются для разрушения камней при прокладке дорог и т. д. При производстве таких взрывчатых веществ также используется нитрат серебра, а также другие соли серебра, такие как ацетилид серебра, азид серебра и т. д.
Современный мир использует цифровую фотографию. Ранее фотографии делались на пленку, которую мыли и обрабатывали (так называемая проявка фотографий).
 В процессе изготовления фотопленок использовалось небольшое количество галогенидов серебра (например, бромид серебра, хлорид серебра). При попадании света во время фотографирования произойдет разложение на элементарное серебро, которое оставит изображение. Затем это можно превратить в фотографию с помощью других химических веществ.
В процессе изготовления фотопленок использовалось небольшое количество галогенидов серебра (например, бромид серебра, хлорид серебра). При попадании света во время фотографирования произойдет разложение на элементарное серебро, которое оставит изображение. Затем это можно превратить в фотографию с помощью других химических веществ.Мы все видим керамическую посуду разных цветов. Нитрат серебра используется для добавления таких красок в керамические изделия.
Пестициды, содержащие нитрат серебра в качестве активного ингредиента, используются в производстве срезанных цветов. Они используются для предотвращения раннего или преждевременного увядания растений и опадения бутонов и цветов. Срезанные стебли производят этилен, который помогает ускорить процесс созревания плодов и старения растений. Когда эти стебли помещают в очень разбавленный раствор нитрата серебра, этот процесс замедляется.

Таким образом, нитрат серебра находит применение в различных областях. Однако важно быть очень осторожным при использовании этого химического вещества, поскольку при неправильном обращении оно может нанести вред.
Воздействие света на нитрат серебра
При хранении нитрата серебра в лабораториях всегда рекомендуется хранить его в темных бутылках. Для этого есть конкретная причина. Нитрат серебра очень чувствителен к свету. Это означает, что химическое вещество будет реагировать при воздействии света. Таким образом, когда его оставят под воздействием солнечного света или любого яркого света, он начнет гидролизоваться. Это приведет к образованию оксида серебра черного или коричневого цвета и азотной кислоты. Если его хранить в темных бутылях и держать вдали от прямого света, эта реакция может быть сведена к минимуму и, следовательно, может храниться в течение более длительного времени.
Хранение нитрата серебра и обращение с ним
Нитрат серебра является окислителем, что означает, что он легко выделяет кислород. Кислород поддерживает горение или огонь. Следовательно, при хранении этих химических веществ следует позаботиться о том, чтобы они хранились вдали от каких-либо горючих или легковоспламеняющихся химических веществ. Причина в том, что в случае пожара нитрат серебра разлагается, может усилить огонь, выделяя кислород. Поэтому следует позаботиться о том, чтобы хранить их отдельно.
Кислород поддерживает горение или огонь. Следовательно, при хранении этих химических веществ следует позаботиться о том, чтобы они хранились вдали от каких-либо горючих или легковоспламеняющихся химических веществ. Причина в том, что в случае пожара нитрат серебра разлагается, может усилить огонь, выделяя кислород. Поэтому следует позаботиться о том, чтобы хранить их отдельно.
Неблагоприятное воздействие нитрата серебра на здоровье
На основании данных, доступных на данный момент, нитрат серебра вызывает следующие эффекты;
Они относятся к категории острых эффектов.
Нитрат серебра является едким химическим веществом. Следовательно, это вызовет раздражение. Когда он впитывается в кожу в течение длительного периода времени, он вызывает сероватое обесцвечивание тканей. Это явление называется аргирией.
При вдыхании вызывает раздражение и повреждение слизистых оболочек.
При пероральном приеме нитрата серебра это может иметь опасные последствия, а иногда и смерть. Это также может вызвать рвоту, кровавый понос, головокружение и судороги.
Это также может вызвать рвоту, кровавый понос, головокружение и судороги.
Некоторые из хронических последствий длительного воздействия нитрата серебра:
Может вызывать общую депрессию, головную боль и потерю умственных способностей. В некоторых случаях у людей, подвергшихся воздействию нитрата серебра, также наблюдался рак.
При контакте с нитратом серебра контактную часть необходимо промыть большим количеством пресной воды. Им следует немедленно оказать медицинскую помощь.
Нитрат серебра также очень токсичен для рыб и других водных форм жизни. Следовательно, утилизация этого химического вещества также должна осуществляться в полном соответствии с местными законами и правилами.
Нитрат серебра также используется в уголовных расследованиях. Как правило, отпечатки пальцев находят на месте преступления. Один тип отпечатка пальца, называемый скрытым отпечатком, не виден человеческому глазу. Такие отпечатки остаются, когда пот или натуральные масла тела вступают в контакт с другими поверхностями. Следователи используют метод, называемый развитием скрытых отпечатков, чтобы решить или идентифицировать такие отпечатки. В таких процессах проявления скрытого отпечатка используется нитрат серебра. В наших кожных выделениях есть элемент хлоридов. Нитрат серебра вступает в реакцию с этими выделениями и образует хлорид серебра. Они приобретают серый цвет под воздействием УФ-излучения. Таким образом, это химическое вещество помогает и в области уголовных расследований.
Следователи используют метод, называемый развитием скрытых отпечатков, чтобы решить или идентифицировать такие отпечатки. В таких процессах проявления скрытого отпечатка используется нитрат серебра. В наших кожных выделениях есть элемент хлоридов. Нитрат серебра вступает в реакцию с этими выделениями и образует хлорид серебра. Они приобретают серый цвет под воздействием УФ-излучения. Таким образом, это химическое вещество помогает и в области уголовных расследований.
Как начать изучение концепции нитрата серебра | Свойства и структура нитрата серебра и его применение?
Чтобы начать изучение концепции нитрата серебра | Свойства и структура нитрата серебра и его применения, вам понадобятся лучшие учебные ресурсы. Vedantu — лучшее место для вас, чтобы найти эти ресурсы. Наша образовательная платформа предоставляет вам надежные учебные материалы, подготовленные одними из лучших экспертов отрасли. С Vedantu вы можете изучить концепцию нитрата серебра | Свойства и структура нитрата серебра и его применения простым языком и улучшить ваше понимание концепции.
Вот еще несколько советов, которые помогут вам выучить нитрат серебра | Свойства и структура нитрата серебра и его применение:
Прежде чем вы начнете изучать нитрат серебра | Свойства и структура нитрата серебра и его применения, обязательно соберите все учебные материалы и предметы первой необходимости, чтобы сделать процесс обучения плавным и устойчивым.
Постарайтесь уделить достаточно времени этому понятию, так как это одна из самых важных тем химии.
Вы должны тщательно просмотреть объяснения каждой темы, затронутой в примечаниях к Silver Nitrate | Свойства и структура нитрата серебра и его применения и не пропустите ни одну из тем.
После прочтения о нитрате серебра | Свойства и структура нитрата серебра и его применение, вы должны попытаться ответить на вопросы, заданные в упражнениях из учебников и справочниках, чтобы проверить свои знания и увидеть, где вы находитесь.


 AGROLYTE
AGROLYTE

 В процессе изготовления фотопленок использовалось небольшое количество галогенидов серебра (например, бромид серебра, хлорид серебра). При попадании света во время фотографирования произойдет разложение на элементарное серебро, которое оставит изображение. Затем это можно превратить в фотографию с помощью других химических веществ.
В процессе изготовления фотопленок использовалось небольшое количество галогенидов серебра (например, бромид серебра, хлорид серебра). При попадании света во время фотографирования произойдет разложение на элементарное серебро, которое оставит изображение. Затем это можно превратить в фотографию с помощью других химических веществ.