Net Ionic Equations 2 — ответы
Net Ionic Equations 2 — ответыОтдел Химии и Физика |
| Ответы | Сводные ионные уравнения |
Для каждого из следующих наборов реагентов
1. Напишите сбалансированное молекулярное уравнение:
2. Напишите ионное уравнение:
3. Список ионов зрителей:
4. Напишите суммарное ионное уравнение:
Набор 1: Al (NO 3 ) 3 (водный) + 3 NaOH (водн.) ——-> Al(OH) 3 (т) + 3 NaNO 3 (водн.)
ионное уравнение:
Ал +3 (водный) + 3 NO 3
 ) + 3 Na + (водн.) + 3 OH — (водный) ——->
Al(OH) 3 (т) + 3 Na + (водн.) + 3 NO 3 — (водн.)
) + 3 Na + (водн.) + 3 OH — (водный) ——->
Al(OH) 3 (т) + 3 Na + (водн.) + 3 NO 3 — (водн.) результирующее ионное уравнение:
Ал +3 (водный) + 3 ОН — (водный) ——-> Al(OH) 3 (т)
зрителей ионов:
3 Na + (водный) , 3 NO 3 — (водный)
Комплект 2: 2 Li 3 Заказ на покупку 4 (водн.) + 3 Sr(OH) 2 (водн.) ——-> 6 LiOH (водный) + Sr 3 (PO 4 ) 2 (s)
ионное уравнение:
6 литов + (водный) + 2 PO 4 3- (водный) + 3 Sr +2 (водн. ) + 6 OH — (водн.) ——->
6 Li + (водн.) + 6 OH — (водн.) + Sr 3 (PO 4 ) 2 (s)
) + 6 OH — (водн.) ——->
6 Li + (водн.) + 6 OH — (водн.) + Sr 3 (PO 4 ) 2 (s)
результирующее ионное уравнение:
3 Старший +2 (водн.) + 2 PO 4 3- (водн.) ——-> Ср 3 (ПО 4 ) 2 (с)
зрителей ионов:
6 литов + (водный) , 6 OH — (водный)
Набор 3: 2 CuClO 4 (водн.) + Sr(OH) 2 (водн.) ——-> 2 CuOH (с) + Sr(ClO 4 ) 2 (водный)
ионное уравнение:
2 Cu + (водный) + 2 ClO 4 — (водный) +
Sr +2 (водн.) + 2 OH — (водн. ) ——->
2 CuOH (т) + Sr +2 (водн.) + 2 ClO 4 — (водн.)
) ——->
2 CuOH (т) + Sr +2 (водн.) + 2 ClO 4 — (водн.)
результирующее ионное уравнение:
2 Медь + (водный) + 2 OH — (водный) ——-> 2 CuOH (с)
зрителей ионов:
Старший +2 (водный) , 2 ClO 4 — (водн.)
Набор 4: Na 2 CO 3 (водный) + FeSO 4 (водн.) ——-> Na 2 SO 4 (водн.) + FeCO 3 (т)
ионное уравнение:
2 Na + (водный) + CO 3 2- (водный) +
Fe +2 (водный) + SO 4 2- (водный) ——-> 2
Na + (водн. ) + SO 4 2- (водн.) + FeCO 3 (т)
) + SO 4 2- (водн.) + FeCO 3 (т)
результирующее ионное уравнение:
Fe +2 (водный) + CO 3 2- (водный) ——-> FeCO 3 (с)
зрителей ионов:
2 Na + (водный) , SO 4 2- (водный)
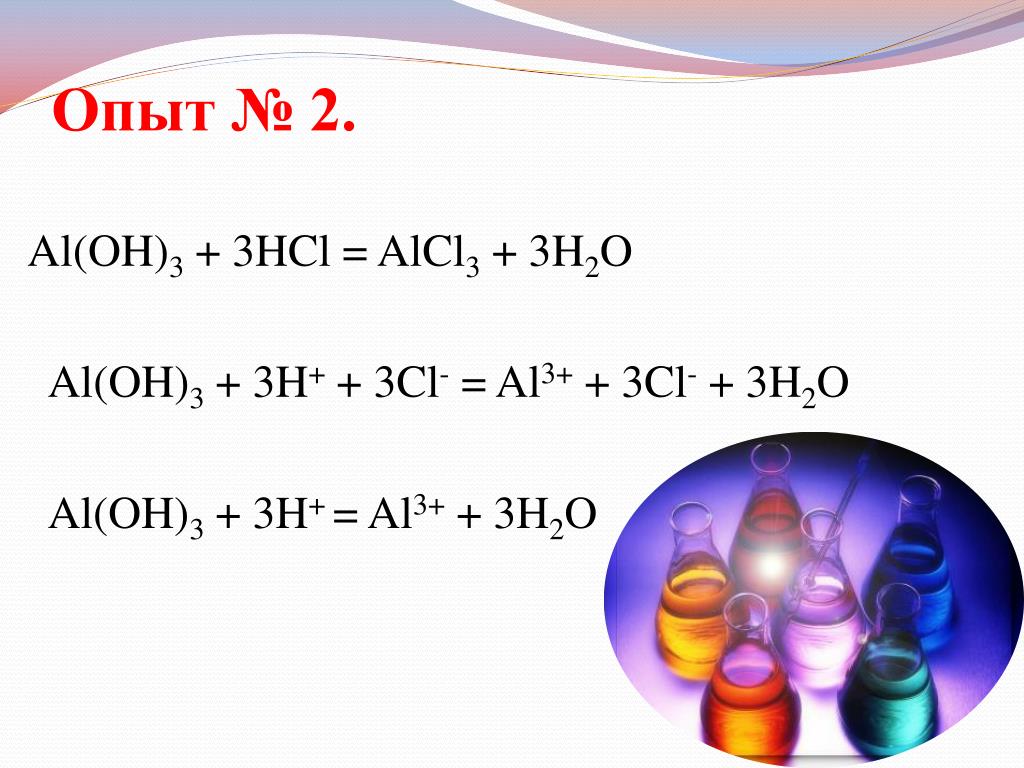
(в) Al + NO3 – в основном растворе Al(OH), т Nh4 ?
1 ответ
Арья Анил12 класс |
Баланс в основной среде.
Al + NO3- ———- [Al(OH)4]- + Nh4
Шаг 1: Запишите половину реакции окисления и восстановления.
Превращение Al в Al(OH)4]- изменяет степень окисления Al с 0 на +3, так что это полуреакция окисления.
Превращение NO3- в Nh4, изменение степени окисления N от +5 до +3, так что это реакция восстановления.
Половина реакции окисления: Al → [Al(OH)4]- + e-
Половина реакции восстановления: NO3- + e- → Nh4
2-й этап: Сбалансируйте все атомы с обеих сторон для двух реакций. Добавьте воду и H+, чтобы сбалансировать H и O.
Половина реакции окисления: Al + 4h3O → [Al(OH)4]- + 4H+ + e-
Половина реакции восстановления: NO3- + 9H+ + e- → Nh4 + 3h3O
3-я стадия: Уравновешивание зарядов с обеих сторон
Половина реакции окисления: Al + 4h3O → [Al(OH)4]- + 4H+ + 3 e-
( Общий заряд в левой части равен 0. В правой части 2+, увеличение коэффициента для электрона до 3 делает заряд правой стороны равным 0)
Половина реакции окисления: Al + 4h3O + 4OH- → [Al(OH)4]- + 4h3O + 3 e- или
Al + 4OH- → [Al(OH)4]- + 3 e-
Половина реакции восстановления: NO3- + 9h3O + 8e- → Nh4 + 3h3O + 9OH- или
NO3- + 6h3O + 8e- → Nh4 + 9OH-
Шаг 4: Умножьте две полуреакции с коэффициентами так, чтобы количество электронов было одинаковым для обеих.
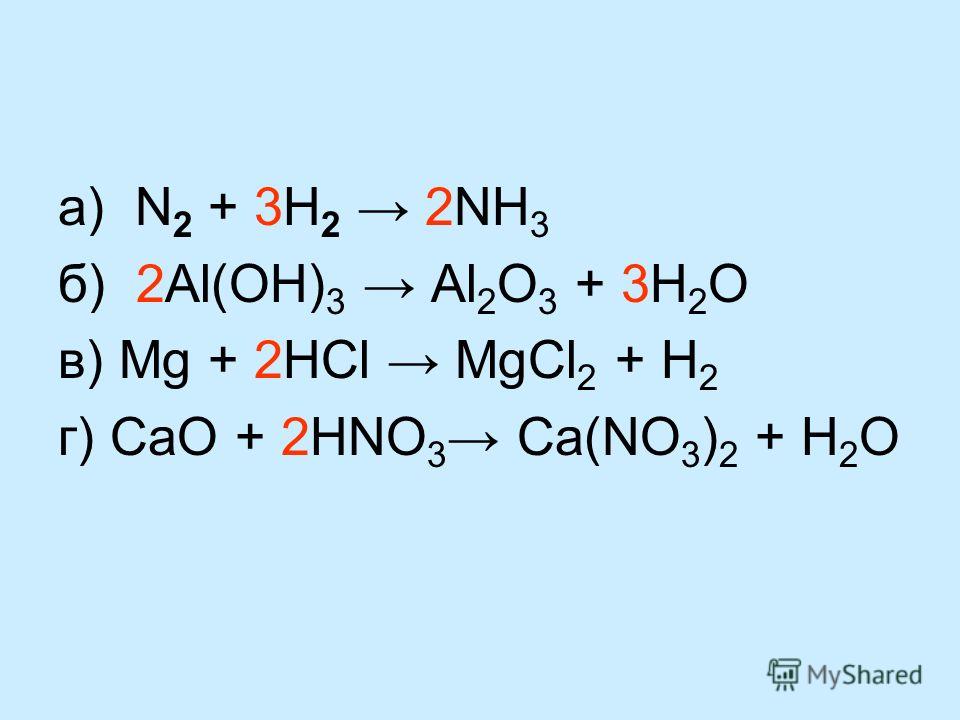
Уравнение окисления × 8 8Al + 32 OH- → 8[Al(OH)4]- + 24e-
Половина реакции восстановления × 3 3 NO3- + 18h3O + 24e- → 3Nh4 + 27 OH-
Этап 5: Добавьте два полуреакции и вычесть члены, общие для обеих сторон (электроны и ОН- )
8Al + 5OH- + 3 NO3- + 18h3O → 8[Al(OH)4]- + 3Nh4
Приведенное выше уравнение сбалансировано.
| 1 | Поделитесь этим ответом |
Похожие вопросы
6. Составьте баланс следующих химических уравнений.
HNO, + Ca(OH)2-Ca(NO3)2 С20
… Составьте баланс следующих химических уравнений.
HNO, + Ca(OH)2-Ca(NO3)2 С20
… |
16. Сбалансируйте следующую химическую реакцию а) HNO3 + Ca(OH)2 ÷ Ca(NO3)2 +h3O б) Бах +h3SO … |
â | б вз . .. .. |
@ 3 2 _ … |
С â бт UXTAT . .. .. |
10 | 00 ˘ |< | &3 ... |
ЧАС ~~ ~~ о~ 0 .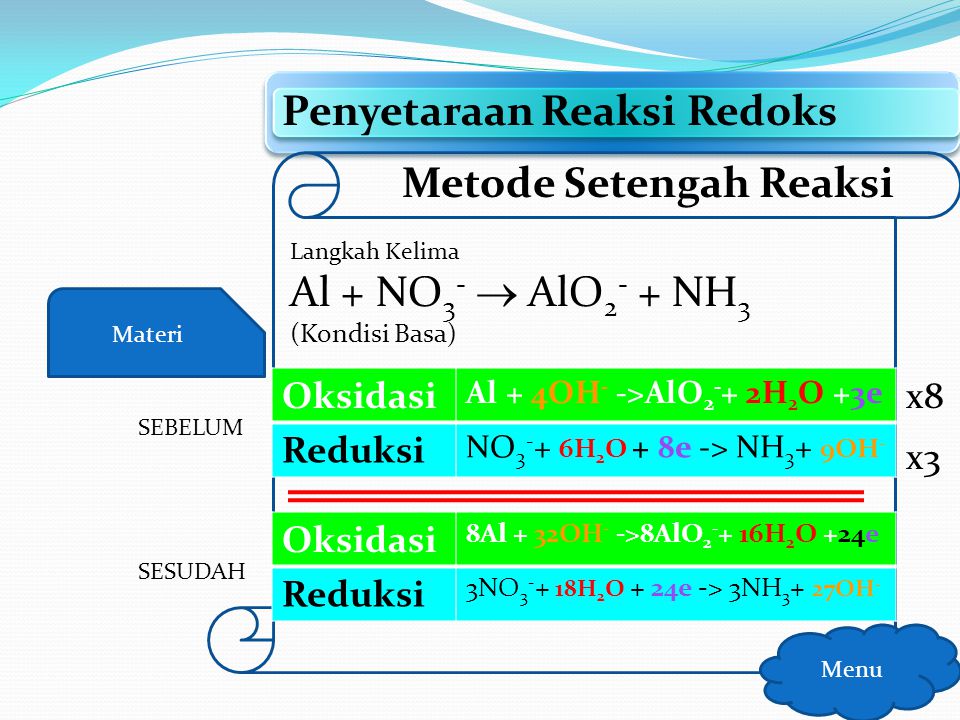 .. .. |
@ Спид 3 е ‘: «‘. . … |
23 I \[ââe *~1dx . |
