Простые и сложные вещества
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: h3, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: h3O, Nh4, OF2, h3SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Пример:
- С — алмаз, графит, карбин, фуллерен.
- O — кислород, озон.
- S — ромбическая, моноклинная, пластическая.
- P — белый, красный, чёрный.
Явление аллотропии вызывается двумя причинами:
- Различным числом атомов в молекуле, например кислород O2 и озон O3.
- Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).

Основные классы неорганических веществ
Бинарные соединения
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
Bh4 — боран
B2H6 — диборан
Ch5 — метан
Sih5 — силан
Nh4 — аммиак
Ph4 — фосфин
Ash4 — арсин
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.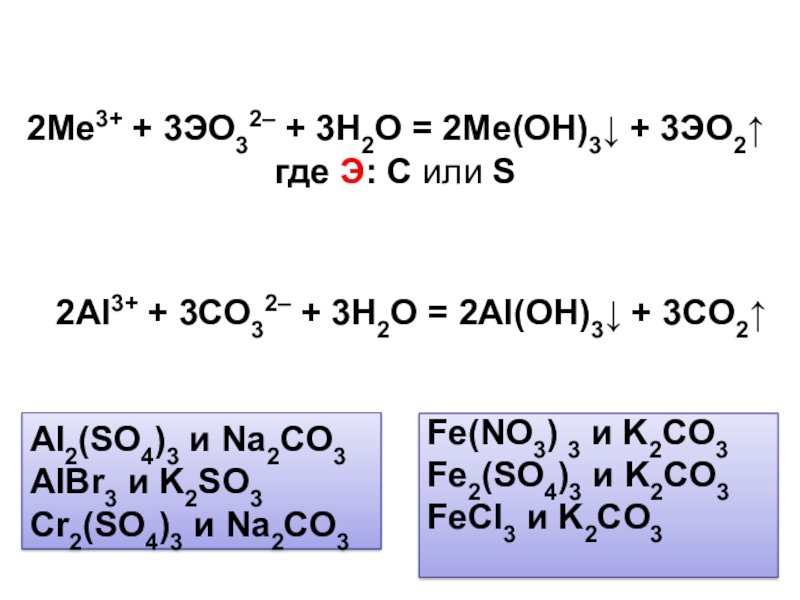
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
- Na2O — Na2(+1)O(-2) — NaOH
- MgO — Mg(+2)O(-2) — Mg(OH)2
- FeO — Fe(+2)O(-2) — Fe(OH)2
- MnO — Mn(+2)O(-2) — Mn(OH)2
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Al2(+3)O3(-2), Fe2(+3)O3(-2), Mn(+4)O2(-2), Zn(+2)O(-2), Be(+2)O(-2)
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример
Соответствие кислотных оксидов и кислот
- SO3 — S(+6)O3(-2) — h3SO4
- N2O5 — N2(+5)O5(-2) — HNO3
- CrO3 — Cr(+6)O3(-2) — h3CrO4
- Mn2O7 — Mn2(+7)O7(-2) — HMnO4
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.
Общая формула гидроксидов: ЭхОуНz
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония Nh5+
Пример
NaOH, Nh5OH, Ca(OH)2
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
h3SO4, HNO3, h3Cr2O7, HMnO4
Соли
Соли- соединения, состоящие из катионов металлов (или Nh5+) и кислотных остатков.
Общая формула солей: MexAcy
- Me — металл
- Ac — кислотный остаток
Пример
KNO3 — нитрат калия
(Nh5)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
| Соляная (хлороводородная) | HCl | Хлорид | Cl(-) |
| Плавиковая (фтороводородная) | HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | h3S | Сульфид Гидросульфид | S(2-) HS(-) |
| Сернистая | h3SO3 | Сульфит Гидросульфит | SO3(2-) HSO3(-) |
| Серная | h3SO4 | Сульфат Гидросульфат | SO4(2-) HSO4(-) |
| Угольная | h3CO3 | Карбонат Гидрокарбонат | СО3(2-) НСО3(-) |
| Кремниевая | h3SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | h4PO4 | Ортофосфат Гидроортофосфат Дигидроортофосфат | РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Полезные ссылки
Источник материала
Классификация неорганических веществ (видео)
Классификация неорганических веществ. Сложные вопросы (видео)
Сложные вопросы (видео)
Кислотные оксиды (видео)
Основные оксиды (видео)
Основания (видео)
Характеристика солей (видео)
Дополнительные материалы
Классификация и номенклатура неорганических веществ (видео)
Классификация соединений (видео)
Аллотропные формы углерода (видео)
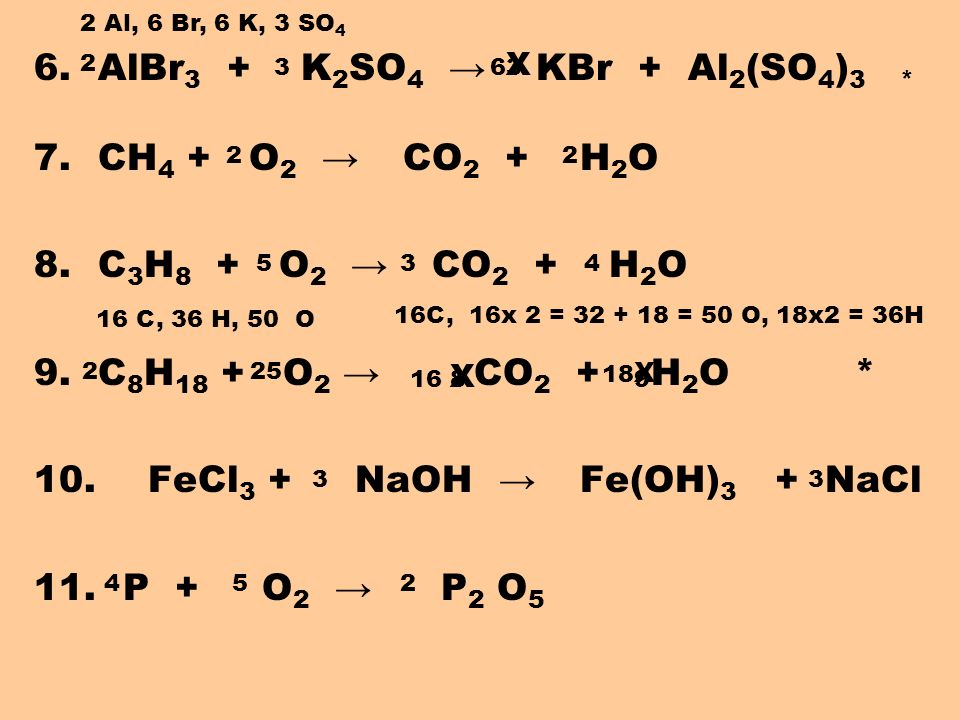
Реакции алюминия
Химические свойства алюминия
Химические свойства алюминия определяются его положением в периодической системе химических элементов.
Ниже представлены основные химические реакции алюминия с другими химическими элементами. Эти реакции определяют основные химические свойства алюминия.
С чем реагирует алюминий
Простые вещества:
- галогены (фтор, хлор, бром и иодин)
- сера
- фосфор
- азот
- углерод
- кислород (горение)
Сложные вещества:
- вода
- минеральные кислоты (соляная, фосфорная)
- серная кислота
- азотная кислота
- щелочи
- окислители
- оксиды менее активных металлов (алюмотермия)
С чем не реагирует алюминий
Алюминий не реагирует:
- с водородом
- в обычных условиях – с концентрированной серной кислотой (из-за пассивации – образования плотной оксидной пленки)
- в обычных условиях – с концентрированной азотной кислотой (также из-за пассивации)
См. подробнее по химии алюминия
подробнее по химии алюминия
Алюминий и воздух
Обычно поверхность алюминия всегда покрыта тонким слоем оксида алюминия, который защищает ее от воздействия воздуха, точнее, кислорода. Поэтому считается, что алюминий не вступает в реакцию с воздухом. Если же этот оксидный слой повреждается или удаляется, то свежая поверхность алюминия реагирует с кислородом воздуха. Алюминий может гореть в кислороде ослепительно белым пламенем с образованием оксида алюминия Al2O3.
Реакция алюминия с кислородом:
- 4Al + 3O2 —> 2Al2O3
Алюминий и вода
Алюминий реагирует с водой по следующим реакциям [2]:
- 2Al + 6H2O = 2Al(OH)3 + 3H2 (1)
- 2Al + 4H2O = 2AlO(OH) + 3H2 (2)
- 2Al + 3H2O = Al2O3 + 3H2 (3)
В результате этих реакций образуются, соответственно, следующие соединения алюминия:
- модификация гидроксида алюминия байерит и водород (1)
- модификация гидроксида алюминия богемит и водород (2)
- оксид алюминия и водород (3)
Эти реакции, кстати, представляют большой интерес при разработке компактных установок для получения водорода для транспортных средств, которые работают на водороде [2].
Все эти реакции являются термодинамически возможными при температуре от комнатной до температуры плавления алюминия 660 ºС. Все они являются также экзотермическими, то есть происходят с выделением тепла [2]:
- При температуре от комнатной до 280 ºС наиболее устойчивым продуктом реакции является Al(OH)3.
- При температуре от 280 до 480 ºС наиболее устойчивым продуктом реакции является AlO(OH).
- При температуре выше 480 ºС наиболее устойчивым продуктом реакции является Al2O3.
Таким образом, оксид алюминия Al2
Реакция (1) показывает, что алюминий должен самопроизвольно реагировать с водой при комнатной температуре. Однако на практике кусок алюминия, опущенный в воду, не реагирует с водой в условиях комнатной температуры и даже в кипящей воде. Дело в том, что алюминий имеет на поверхности тонкий когерентный слой оксида алюминия Al2O3. Эта оксидная пленка прочно удерживается на поверхности алюминия и предотвращает его реакцию с водой. Поэтому, чтобы начать и поддерживать реакцию алюминия с водой при комнатной температуре необходимо постоянно удалять или разрушать этот оксидный слой [2].
Дело в том, что алюминий имеет на поверхности тонкий когерентный слой оксида алюминия Al2O3. Эта оксидная пленка прочно удерживается на поверхности алюминия и предотвращает его реакцию с водой. Поэтому, чтобы начать и поддерживать реакцию алюминия с водой при комнатной температуре необходимо постоянно удалять или разрушать этот оксидный слой [2].
Алюминий и галогены
Алюминий бурно реагирует со всем галогенами – это:
- фтор F
- хлор Cl
- бром Br и
- иодин (йод) I,
с образованием соответственно:
- фторида AlF3
- хлорида AlCl3
- бромида Al2Br6 и
- иодида Al2Br6.
Реакции водорода со фтором, хлором, бромом и иодином:
- 2Al + 3F2 → 2AlF3
- 2Al + 3Cl2 → 2AlCl3
- 2Al + 3Br2 → Al2Br6
- 2Al + 3l2 → Al2I6
Алюминий и кислоты
Алюминий активно вступает в реакцию с разбавленными кислотами: серной, соляной и азотной, с образованием соответствующих солей: сернокислого алюминия Al2SO4, хлорида алюминия AlCl3 и нитрата алюминия Al(NО3)3.
Реакции алюминия с разбавленными кислотами:
- 2Al + 3H2SO4 —> Al2(SO4)3 + 3H2
- 2Al + 6HCl —> 2AlCl3 + 3H2
- 2Al + 6HNO3 —> 2Al(NO3)3 + 3H2
С концентрированными серной и соляной кислотами при комнатной температуре не взаимодействует, при нагревании реагирует с образованием соли, окислов и воды.
Алюминий и щелочи
Алюминий в водном растворе щелочи – гидроксида натрия – реагирует с образованием алюмината натрия.
Реакция алюминия с гидроксидом натрия имеет вид:
- 2Al + 2NaOH + 10H2O —> 2Na[Al(H2O)2(OH)4] + 3H2
Все важнейшие реакции с алюминием
Для полноты информации приводим перечень основных реакций с участием алюминия из фундаментальной книги про алюминий [3]:
Важнейшие реакции с участием алюминия [3]
Источники:
1. Chemical Elements. The first 118 elements, ordered alphabetically / ed. Wikipedians – 2018
Chemical Elements. The first 118 elements, ordered alphabetically / ed. Wikipedians – 2018
2. Reaction of Aluminum with Water to Produce Hydrogen /John Petrovic and George Thomas, U.S. Department of Energy, 2008
3. Тринадцатый элемент: Энциклопедия / А. Дроздов – Библиотека РУСАЛа, 2007.
= | Сбалансированное уравнение химической реакции
| Поиск |
Результаты поиска по химическому уравнению
Реклама
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1 — Пожалуйста, прокрутите до конца, чтобы увидеть больше результатов
Уравнение Результат #1
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
| png» substance-weight=»44.0095″> CO 2 | + | РекламаДополнительная информация об уравнении CO2 + NaAl(OH) 4 → Al(OH) 3 + NaHCO 3Условия реакции CO2 (двуокись углерода) реагирует с NaAl(OH)4 () ?Не найдено информации для этого химического уравнения Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Как могут происходить реакции с образованием Al(OH)3 (гидроксид алюминия) и NaHCO3 (бикарбонат натрия)?Явление после реакции CO2 (углекислого газа) с NaAl(OH)4 ()Это уравнение не несет никакой конкретной информации о явлении. В этом случае вам просто нужно наблюдать, чтобы убедиться, что вещество продукта NaHCO3 (бикарбонат натрия), появляющийся в конце реакции. Или если какое-либо из следующих реагентов NaAl(OH)4 , исчезает Какую другую важную информацию вы должны знать о реакцииУ нас нет дополнительной информации об этой химической реакции. Категории уравненийНажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >> Другие вопросы, связанные с химическими реакциями CO2 + NaAl(OH) 4 → Al(OH) 3 + NaHCO 3Вопросы, связанные с реагентом CO2 (двуокись углерода)9 0018 Какие химические и физические характеристики CO2 (углекислого газа)? В каких химических реакциях используется CO2 (углекислый газ) в качестве реагента?Вопросы, связанные с реагентом NaAl(OH)4 ()Каковы химические и физические характеристики NaAl(OH)4 ()? В каких химических реакциях используется NaAl(OH)4 () в качестве реагента? Вопросы, связанные с продуктом Al(OH)3 (гидроксид алюминия)Каковы химические и физические характеристики Al(OH)3 ()? Каковы химические реакции, в которых Al(OH)3 (гидроксид алюминия) используется в качестве продукт? Вопросы, связанные с продуктом NaHCO3 (бикарбонат натрия)Каковы химические и физические характеристики NaHCO3 ()? Какие химические реакции имеют NaHCO3 (бикарбонат натрия) в качестве продукта? 1 результатов найдено Дополнительная информация о веществах, которые используют уравнениеРеакция CO2 (Cacbon dioxit) взаимодействие с NaAl(OH)4 (тетрагидроксиалюминат натрия) с образованием Al(OH)3 (Nhom hiroxit) Реакция с образованием вещества CO2 (Cacbon dioxit) (двуокись углерода)C + O 2 → CO 2 2CO + O 2 → 2CO 2 Fe 2 (CO 3 ) 3 + 3Н 2 O → 3CO 2 + 2Fe(OH) 3 Реакция с образованием вещества NaAl(OH)4 (тетрагидроксиалюминат натрия) ()Al 2 O 3 + 3H 2 O + 2NaOH → 2NaAl(OH) 4 Al(OH) 3 + NaOH → NaAl(OH) 4 2H 2 O + NaAlO 2 → NaAl(OH) 4 Реакция с образованием вещества Al(OH)3 (Nhom hiroxit) (гидроксид алюминия)AlCl 3 + 3NaOH → Al(OH) 3 + 3NaCl 3NaOH + Al(NO 3 ) 3 → Ал(ОН) 3 + 3NaNO 3 2Al + 6H 2 O → 2Al(OH) 3 + 3H 2 Реакция с образованием вещества NaHCO3 (гидрокакабонат натрия) (бикарбонат натрия)H 2 O + CO 2 + C 2 H 5 ONa → C 2 H 5 OH + NaHCO 3 Ca(HCO 3 ) 2 + NaOH → CaCO 3 + H 2 O + NaHCO 3 2H 2 O + NaCrO 2 + CO 2 → NaHCO 3 + Cr(OH) 3 Essentt — Подобранные продукты Подобранные вручную продукты необходимы при работе из дома! Cho khí CO2 vào một binh kin chứa Al(OH)3. A. Có phản ứng xảy ra và A. Có phản ứng xảy ra vàКау Хой:24.02.2020 15 086 Cho khí CO 2 vào một bình kin chứa Al(OH) 3 A. Có phản ứng xảy ra và tạo ra muối Al 2 (CO 3 ) 3 . B. Có tạo Al 2 (CO 3 ) 3 lúc đầu, sau đó với CO 2 có dư sẽ thu được Al (HCO 3 ) 3 . C. D. Khong có phản ứng xảy ra. Đáp án chính xác Xem lời giải Câu hỏi trong đề: Đề thi thử THPTQG Hóa Học chuẩn cấu trúc bộ giáo dục có lời giải !! Куанг Као Chọn đáp án D NHÀ SÁCH VIETJACKXem Thêm Kho Sach » Сач Тонг Он нгу пхап Тионг ань ко Транг Ань бан мой нхот (Чинь ханг)№ бан 0 ₫250. Ханой Sách Tiếng anh cho người mất gốc — người mới bắt đầu cô Trang Anh (Chính hãng)№ бан 0 ₫200.000
₫159. Ханой Sách Bộ đề minh họa môa môn toán n thi THPT quốc gia bản 2023 (Chính hang)№ бан 0 ₫200.000 ₫159.000 Ханой Bộ đề minh họa 2023 môn Tiếng Anh cô Trang Anh (Chính hãng)№ бан 0 ₫200. Ханой Sách tiếng anh cô Trang Anh: 500 bài đọc hiểu đọc điền thi THPT Quốc Gia 2023 (Chính hãng)№ бан 0 ₫200.000
₫189. Ханой Sách tổng ôn toán học lớp 12 ôn thi THPT quốc gia và luyện thi đánh giá năng lực bản mới nhất (Chính hang)№ бан 0 ₫200.000 ₫149.000 Ханой Sách — 200 công thức giải nhanh Toán 12 (Chính hang)Да бан 56 100000 59000 Ханой Tổng ôn cấp tốc luyện thi Đánh giá năng lực (Theo cấu trúc đề thi của ĐHQGHN)№ бан 0 ₫225. Ханой Combo 2 tập Bí quyết chinh phục điểm cao kì thi THPT Quốc gia môn Toán (Tập 1, tập 2) — Chính hang№ бан 0 ₫336.000
₫252. Ханой Tăng tốc luyện thi Đánh giá năng lực ĐHQG TP.HCM№ бан 0 ₫225.000 ₫185.000 Ханой CÂU HỎI HOT CÙNG CHỦ ĐỀCâu 1:Tiến hành 4 thí nghiệm sau: Thí nghiệm 1: Nhung thanh Fe vào dung dịch FeCl 3 Thí nghim 2: Nhúng thanh Fe vào dung dịch CuSO 4 . Thí nghiệm 3: Nhúng thanh Cu vào dung dịch FeCl 3 Thí nghiệm 4: Cho thanh Fe tiếp xúc với thanh Cu rồi nhung và или навозный душ HCl. Số trường hợp xuất hiện ăn mòn điện hóa la: А. 3. Б. 4. С. 3. Д. 2 Ксем Джап »
24. Кау 2:Cho các phát biểu sau: (a). Mantozơ có Khả năng tham gia phản ứng táng bạc (b).Glucozơ có Khả năng tham gia phản ứng táng bạc (c). Saccarozơ được cấu tạo từ hai gốc β-glucozơ và α-fructozơ (d). Sự chuyển hóa tinh bột trong cơ thể người co sinh ra mantozơ Số phát biểu đúng là: А. 4. Б. 2 К. Д. 1 Ксем Джап » 26.02.2020 8 278 Кау 3:Khi cho 0,56 л (đktc) khí hidro clorua hấp thụ vào 50ml dung dịch AgNO 3 8% (d= 1,1 г/мл). Nồng độ % của HNO 3 чт được là : А. 3,01% Б. С. 1,575% Д. 3,587% Ксем Джап » 24.02.2020 7 460 Кау 4:Dung dịch HCl có thể tac dụng được với bao nhiêu chất trong số cac chất sau: NaHCO 3 , NaHSO 4 90 041, NaClO, AgCl, Fe(NO 3 ) 2 , C 2 H 5 ONa, CaC 2 А. Б. 6. К. 3. Д. 4 Ксем Джап » 24.02.2020 5 359 Кау 5: Hòa tan hết 1,62 gam Ag bằng axit HNO 3 nồng độ 21% (1,2 г/мл), chỉ thu được khí NO. А. 7,5 мл B. 6 мл. С. 4 мл. Д. 5 мл Ксем Джап »
25. Кау 6:X là este của một axit hữu cơ đơn chức và rượu đơn chức. Thủy phân hoàn toàn 6,6 gam chất X đã dung 90 мл dung dịch NaOH 1M, lượng NaOH này dư 20% so với lượng NaOH cần dung cho phản ung. Dung dịch sau phản ứng cô cạn thu được chất rắn nặng 5,7 gam. Công thức cấu tạo X la А. СН 3 -COOC 2 Н 5 . B. H-COOC 3 H 7 . C. |


 Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации. Lúc đầu tạo Al 2 (CO 3 ) 3 nhưng không bền nó tự phân hủy t или Al(OH) 3 và CO 2 .
Lúc đầu tạo Al 2 (CO 3 ) 3 nhưng không bền nó tự phân hủy t или Al(OH) 3 và CO 2 . 000
₫189.000
000
₫189.000 000
000 000
₫159.000
000
₫159.000 000
000 000
₫185.000
000
₫185.000 000
000
 02.2020
35 116
02.2020
35 116 3
3 6,3%
6,3% 5.
5. thể tích dung dịch axit nitric tối thiểu cần phản ung là:
thể tích dung dịch axit nitric tối thiểu cần phản ung là: 02.2020
4 943
02.2020
4 943