что, как сбалансировать и часто задаваемые вопросы
Написано Манси шармаin Химия
H2SO4 относится к категории сильных кислот. Ал (ОН)3, представляет собой основание Льюиса, которое можно найти в природе. Давайте рассмотрим больше информации об этой реакции.
H2SO4, также известная как серная кислота, имеет молекулярную массу 98 г/моль и представляет собой бесцветную жидкость без запаха, смешивающуюся с водой. Другие названия гидроксида алюминия включают алюминиевую кислоту и гидроксид алюминия. Имея молекулярную массу 78 г/моль, он является амфотерным по своей природе..
В этой статье мы узнаем больше подробностей об этой реакции.
Что является произведением H
2SO4 и Al (ОН)3Серная кислота реагирует с гидроксидом алюминия с образованием сульфата алюминия и воды.
H2SO4 + Al (OH)3 = Аль2(ТАК4)3 + H2O
Какой тип реакции Н
2SO4 + Al (OH)3H2SO4 + Al (OH)3 — это смещение а также осадки реакция.
Как сбалансировать H
2SO4 + Al (OH)3При балансировке химического уравнения необходимо выполнить следующие шаги.
- Шаг 1 : Записывается как несбалансированная химическая реакция
H2SO4 + Al (OH)3 = Аль2(ТАК4)3 + H2O
- Шаг 2: Запишите количество молей каждого элемента со стороны реагента и продукта.
| Элемент | реагент | Продукт |
|---|---|---|
| H | 5 | 2 |
| S | 1 | 3 |
| O | 7 | 13 |
| Al | 1 | 2 |
Количество молей в реагенте и продукте
- Шаг 3: Теперь количество молей, присутствующих на каждой стороне реагента и продукта, должно быть равным, чтобы сбалансировать химическое уравнение.
 При этом количество молей в каждом элементе варьируется.
При этом количество молей в каждом элементе варьируется.
- Шаг 4: Необходимо сбалансировать химическое уравнение, выполнив следующие действия.
- Al (OH)3 необходимо, чтобы сторона реагента умножалась на 2.
- Со стороны реагента H2SO4 нужно умножить на 3.
- Со стороны продукта H2O нужно умножить на 6.
- Шаг 5: Наконец, сбалансированное химическое уравнение
3H2SO4 + 2Al (ОН)3 = Аль2(SO4)3 + 6H2O
H
2SO4 + Al (OH)3 чистое ионное уравнениеСеть ионное уравнение для этой реакции будет:
2Al (ОН)3 + 6H+ = 2Al3+ + 6H2O
H
2SO4 + Al (OH)3 сопряженные парыКомпания сопряженные кислотно-основные пары Он:
- H2SO4 (Сопряженное основание) = HSO4–
- H2O (сопряженное основание) = OH–
Н
2SO4 + Al (OH)3 буферный растворH2SO4 + Al (OH)3 не является буферным раствором из-за присутствия сильной кислоты H2SO4.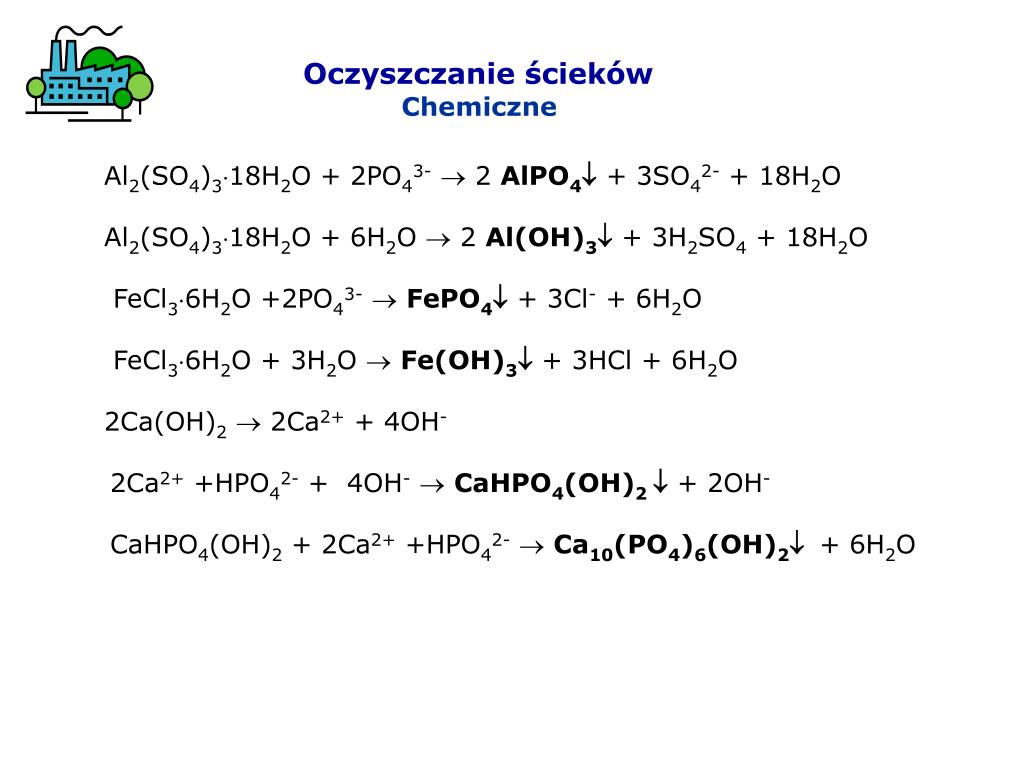
Н
2SO4 + Al (OH)3 полная реакцияРеакция между H2SO4 и Al (ОН)3 завершено. Поскольку все моли реагента полностью превращаются и потребляются продуктом при равновесии.
Н
2SO4 + Al (OH)3 экзотермическая или эндотермическая реакцияH2SO4 + Al (OH)3 есть эндотермический реакция потому что на стороне продукта выделяется тепло.
Н
2SO4 + Al (OH)3 окислительно-восстановительная реакцияH2SO4 + Al (OH)3 не окислительно-восстановительная реакция поскольку степень окисления центрального атома металла как в реагенте, так и в продукте не меняется.
Н
2SO4 + Al (OH)3 реакция осажденияH2SO4 + Al (OH)3 реакция включает образование соли, следовательно, это осадки реакция.
Н
2SO4 + Al (OH)3 обратимая или необратимая реакцияH2SO4 + Al (OH)3 является необратимой реакцией, так как однажды образовавшиеся продукты не могут быть превращены в реагенты.
Н
2SO4 + Al (OH)3 реакция смещенияH2SO4 + Al (OH)3 является реакцией замещения, потому что Al превращается в Al2(SO4)3 со стороны продукта, а водород в H2SO4 в реагенте вытесняется.
Заключение
Минеральная кислота, состоящая из элементов водорода, кислорода и серы, называется серной кислотой. Гидроксид алюминия представляет собой аморфный белый порошок.
Узнайте больше фактов о h3SO4:
Последние посты
ссылка на 17 фактов о HCl + FeCl2: реакция с несколькими элементами17 фактов о HCl + FeCl2: реакция с несколькими элементами
HCl + FeCl2 — это обозначение химической реакции, происходящей между HCl и FeCl2, которая также дает некоторые специфические продукты. Давайте сосредоточимся на фактах о реакции здесь. Самый главный факт…
Давайте сосредоточимся на фактах о реакции здесь. Самый главный факт…
Продолжить чтение
ссылка на 7 фактов о Naoh + h3so4: реакция с несколькими элементами7 фактов о Naoh + h3so4: реакция нескольких элементов
Эта статья о naoh + h3so4 (реакционная смесь) и объясняет, как происходит реакция, образование продукта, уравновешивание и как проводить титрование данных смесей. Гидроксид натрия…
Продолжить чтение
Реакции ионного обмена — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
«Реакции ионного обмена»
2.
 Цели презентации:научить школьников составлять ионные уравнения
Цели презентации:научить школьников составлять ионные уравненияреакций;
рассмотреть условия протекания реакций ионного
обмена до конца;
формировать системный подход и способность
предсказывать результат реакций на основе полученных
знаний;
раскрыть значение реакций ионного обмена.
Презентация может быть использована для дистанционного обучения.
3. Методические рекомендации
В презентации используются гиперссылки, триггеры.Слайд 6. Определение условий прохождения реакций «до конца»
(курсор наводим на стаканы –клик).
Уравнение
реакции
Выпадение осадка –записываем уравнение реакции
-клик.
Слайд 7. При определении растворимости веществ используем
таблицу
. После записи реакции в ионном виде возвращаемся на
слайд 6.
Выделение газа, образование слабого электролита (действия
аналогичны).
В слайдах 15-20 используются триггеры. На слайде 19 проверка
ответов – клик на цифры
. Правильный ответ
,
неправильный ответ
.

4. Реакции ионного обмена
Реакцииионного обмена
Необратимые
Обратимые
(протекают до
конца)
(протекают в двух
направлениях)
6. Реакции ионного обмена
Идут до конца:CuSO4 + NaOH
2-
SO4 OH
2+
Cu
Na
—
h3S
Na2S + HCl
Na
Сu(OH)2
H+
+
+
K+
H+
h3O
Cl-
NO3- OH-
2-
S
HNO3 + KOH
Выпадает
осадок
Выделяется газ
Образуется
слабый
электролит
Уравнение
реакции
Уравнение
реакции
Уравнение реакции
7. Алгоритм составления уравнений
3.Составитьионное ионы
уравнение
(записать
4.Найти полное
одинаковые
в левой
и
1.Записать
уравнение
реакции
в
диссоциацию
растворимых
исходных
веществ
2.По
таблице
растворимости
определить
правой
частях,
сократить
их
и
записать
молекулярном
виде
и продуктов реакции)
растворимость
каждого
вещества
сокращенное ионное
уравнение
Молекулярное уравнение
CuSO4+2NaOH = Cu(OH)2 + Na2SO4
Полное ионное уравнение
2+
+
2-
—
+
Т1
2-
Cu + SO4 +2Na+2OH =Cu(OH)2 +2Na +SO4
Сокращенное ионное уравнение
2+
—
Cu + 2OH = Cu(OH)2
8.
 Не расписываются на ионы:Вода h3O.
Не расписываются на ионы:Вода h3O.Слабые
кислоты
(HNO2,
h3CO3,
h3SO3,
Ch4COOH и др.).
Слабые основания (Nh5OH, Fe(OH)2, Cu(OH)2, и
др.).
Нерастворимые соли(↓): (AgCl , BaSO4, CaCO3,
FeS и др.).
Амфотерные
гидрооксиды
(↓):
Al(OH)3,
Zn(OH)2, Cr(OH)3 и др.
Газообразные вещества( CO2, SO2, h3, h3S,
Nh4 и др.).
Оксиды металлов и неметаллов (Li2O, MgO,
P2O5, SiO2, и т.д).
9. Таблица растворимости
Баженов А.А.Б
а
ж
е
н
о
в
А
.
А
.
Баженов А.А.
1
2
3
4.
10. Составление уравнений
Молекулярное уравнениеNa2S+2HCl = h3S + 2NaCl
Полное ионное уравнение
+
—
+
2-
Т2
+
—
2Na + S +2H +2 Cl = h3S + 2Na + 2 Cl
Сокращенное ионное уравнение
2-
S
+
+ 2H
= h3S
11. Составление уравнений
Молекулярное уравнениеHNO3+KOH = KNO3 + h3O
Полное ионное уравнение
+
—
+
—
+
—
Т3
H + NO3 + K + OH = K + NO3 + h3O
Сокращенное ионное уравнение
+
H + OH
—
= h3O
12.
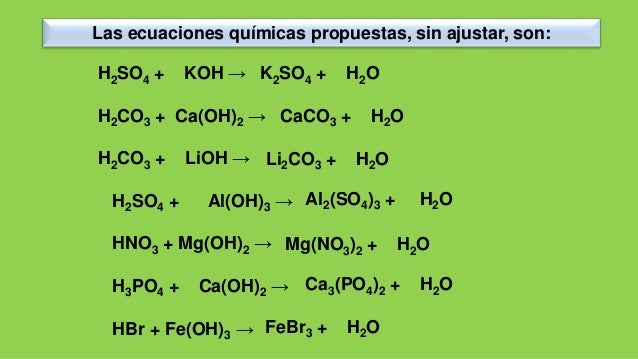 Не расписываются на ионы:Вода h3O.
Не расписываются на ионы:Вода h3O.Слабые
кислоты
(HNO2,
h3CO3,
h3SO3,
Ch4COOH и др.).
Слабые и нерастворимые основания (Nh5OH,
Fe(OH)2, Cu(OH)2, и др.).
Нерастворимые соли(↓): (AgCl , BaSO4, CaCO3,
FeS и др.).
Амфотерные
гидрооксиды
(↓):
(Al(OH)3,
Zn(OH)2, Cr(OH)3 и др.).
Газообразные вещества( CO2, SO2, h3, h3S,
Nh4 и др.).
Оксиды металлов и неметаллов (Li2O, MgO,
P2O5, SiO2, и др.).
13. Обратимые реакции
Na2SO4 + KNO31.Нет осадка
2.Не выделяется газ
3.Не образуется
слабый электролит
Na+
NO3-
SO42K+
14. Составление уравнений
Молекулярное уравнениеNa2SO4+2KNO3 2NaNO3 + K2SO4
Полное ионное уравнение
+
2-
+
—
+
—
+
Т4
2-
2Na+SO4 +2K +2NO3 2Na+2NO3+2K + SO4
Обратимые реакции – реакции, идущие
во взаимно
противоположных направлениях
15. Укажите ряд, в котором ионы каждой пары взаимодействуют в растворах с образованием осадка:
21.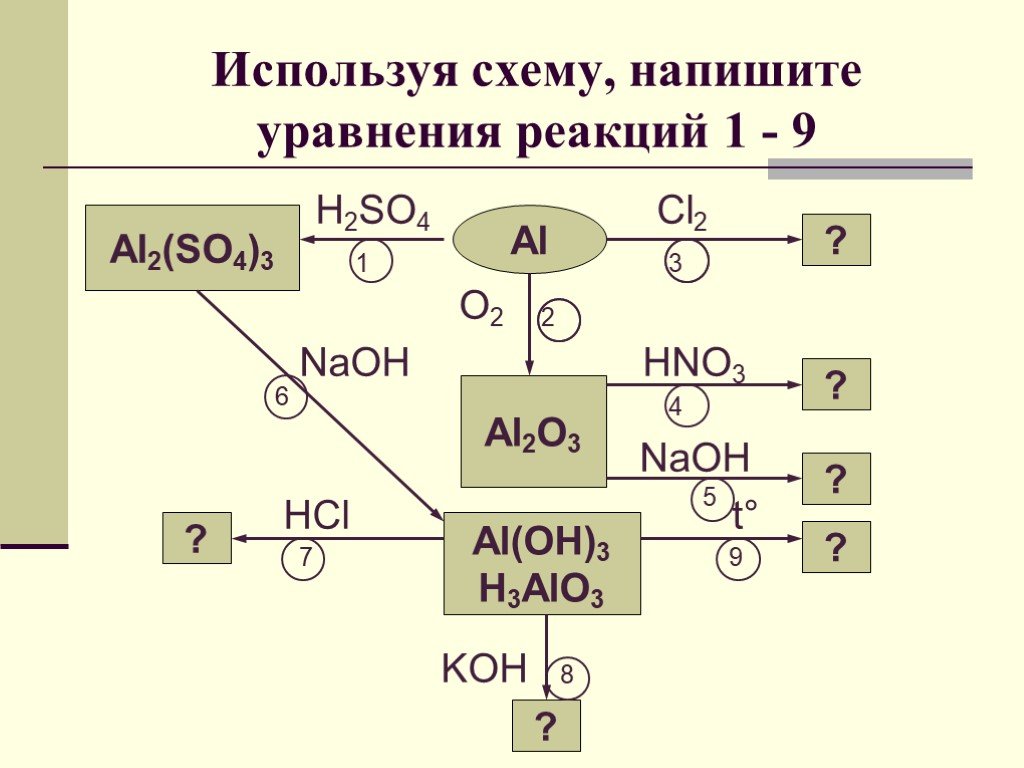 SO4 и
SO4 и+
+
2.Cl и Fe
2+
2+
—
2+
—
H ; Ag и Cl
; Fe
3.OH и Cu
2+
4.Ba
; Na и
2-
и SO4
и OH
+
2+
; Cu
AgCl
—
Fe(OH)2
—
2SiO3
—
и OH
Cu(OH)2
BaSO4
Cu(OH)2
16. В каких случаях РИО идут до конца
Na2МолодецCO3 + HNO3
AlCl
Молодец
3 + NaOH
NaOH
+ h3SO4
Молодец
CaCl
Ошибка
2 + HNO3
LiNO
Ошибка
3 + K2SO4
Молодец
ZnO
+ HCl
Запишите уравнения возможных реакций
в молекулярном, ионном виде.
17. Сокращенное ионное уравнение реакции соответствует взаимодействию:
+2H + CO3
2-
= CO2 + h3O
1.2HNO3 + CaCO3 = Ca(NO3)2 + CO2 + h3O
2.2HCl + MgCO3 = MgCl2 + CO2 + h3O
3.h3SO4 + CaCO3 = CaSO4 + CO2 + h3O
4.2HCL + Na2CO3 = 2NaCL + CO2 + h3O
Правильно
Ошибка
18. Сокращенное ионное уравнение реакции соответствует взаимодействию:
+3+
Al2O3 + 6H = 2Al
+ 6h3O
1.
 Al2O3 + 3CO2 = Al2(CO3)3
Al2O3 + 3CO2 = Al2(CO3)32.Al(NO3)3 + 3KOH = 3KNO3 + Al(OH)3
3.Al2O3 + 3h3SO4 = Al2(SO4)3 + 6h3O
4.AlCL3 + h3O = AlOHCl2+ + HCl
Правильно
Ошибка
19. Назовите числа правильных ответов
1.ВыберитеСуммы
всех
ряд,
коэффициентов
в Вопрос
котором
каждое
в полном
и
Выберите
Сокращенное
пары
веществ,
ионное
которые
уравнение
ввещество
водном
не
сокращенном
записывается
ионных
в виде
реакции
растворе
H+взаимодействуют
+
OH- уравнениях
= ионов
h3O при с
составлении
Fe(OH)3 +
H
SO4= равны
уравнений.
соответственно:
2ионных
соответствует
образованием
реакции:
газа.
Вопрос 1.
1
H
28
и
и3
HNO
2SO
2SO
4+Zn(OH)
3
2
34
HNa
Na
CuSO
2S,
2S,
2
KCl,
NaHS
HNO
Ca(HCO
283 и
+
и NaOH
18
NaOH
3)2, HI
NaHS
H
h32CO
CO
1433и
,и+
K10
H
KOH
CO
2
2SO
3,4
Cu(OH)2
Вопрос 2.

Вопрос 3.
Вопрос 4.
3
HCl
KHCO
CO22
Al(OH)
и
2,+H
32SiO
3, 3
и
16HCl
h3SO3
4
20. Применение
Ионитами называют вещества или материалы,способные к обмену ионов при соприкосновении
с растворами электролитов
Иониты
Ионообменные смолы
Природные
Искусственные
Синтетические
Цеолит
21. Применение ионитов
Очистка воды1. Для уменьшения жёсткости воды
путём замены обусловливающих её
ионов кальция и магния на другие,
например, натрия.
2. Для обессоливания воды, при этом
удаляются и катионы, и анионы
путём
последовательного
прохождения воды через катионит и
анионит.
3. Для обезжелезивания воды особую
роль играет возможность катионов
удалять двухвалентное железо.
4. Очистка
сточных
вод
промышленных предприятий.
22. Применение ионитов
В пищевой промышленности:1.Очистка соков в производстве сахара.
2.
 В производстве дрожжей, фруктовых соков,
В производстве дрожжей, фруктовых соков,глицерина, глюкозы, сгущенного молока, какао,
кофе со сгущенным молоком.
23. Применение ионитов
Для извлечения металловС помощью ионитов извлекаются
редкие и рассеянные элементы из
полиметаллических руд.
W
В сельском хозяйстве иониты
используются для доставки
растениям необходимых им
элементов.
Mo
24. Применение ионитов
В медицине:1.Для увеличения сроков хранения крови.
2.Для производства, выделения и очистки антибиотиков.
3.Использование ионитов, селективно извлекающих
токсические вещества из крови человека.
25. Интернет -ресурсы
http://www.openclass.ru/node/53366(таблица растворимости Баженов А.А.)http://shopfurniture.ru/?ps_category=kofeiniki-i-vse-dlya-kofe&paged=2 (стакан)
http://vsem-darom.ru/products/categories/3199/severodvinsk (шарик)
http://do.gendocs.ru/docs/index-265718.html (лестница успеха)
http://ru.123rf.com/photo_8623287_3d-human-ladder-wall-success-business-up-red.
 html (человечек с
html (человечек спортфелем)
http://krasnoyarsk.pulscen.ru/products/sulfougol_11329010 Сульфоуголь
http://promtek-k.ru/index/sulfougol/0-170 (сульфоуголь)
http://novostey.com/other/news384529.html (Сахар)
http://www.artfile.ru/b.php?i=719068(фруктовые соки)
http://жарптица24.рф/product/bakaleya/konservatsiya_molochnaya/moloko_sguschennoe_tselnoe_glavprod
ukt_8_5__380gr(сгущеное (молоко)
https://ru.wikipedia.org/wiki/Иониты (Зёрна ионита)
http://www.voda-eko.ru/ionoobmennaya-smola-dlya-filtrov.html(Ионообменная смола)
http://www.aqua-therm.ru/articles/articles_217.html(Иониты)
http://kiev.all.biz/napolniteli-dlya-tualeta-domashnih-zhivotnyh-bgc4142(цеолит)
http://biobeauty.by/sostav-i-deysavie-masok-biobeauty.html (строение цеолита)
http://visfox-oster.blogspot.ru/2012/04/blog-post_12.html (иониты)
26. Интернет -ресурсы
http://www.uefima.ru/health/xranenie-donorskoj-krovi.html(хранение крови)http://youreld.clan.su/?page2(пенициллин)
http://ogorod01.
 narod.ru/obschie_podkormka_rasteniy.html (растение)
narod.ru/obschie_podkormka_rasteniy.html (растение)http://www.tiensmed.ru/news/tetraciklinus1.html (тетрациклин)
http://www.periodictable.ru/074W/W.html (Молибден, вольфрам)
27. Литература
Неорганическая химия(в схемах, рисунках, таблицах, формулах, химических реакциях), А.П.Гаршин, «Лань» Санкт-Петербург,2000г
Книга для чтения по неорганической химии. В. А. Крицман, Москва «Просвещение»1994г.
Химия 8 класс. О.С. Габриелян, Москва «ДРОФА» 2014г.
English Русский Правила
What, How to Balance & FAQs – Lambda Geeks
Автор Mansi Sharmain Chemistry
H 2 SO 4 относится к категории сильных кислот. Al(OH) 3 представляет собой основание Льюиса, встречающееся в природе. Давайте рассмотрим больше информации об этой реакции.
H 2 SO 4 , также известная как серная кислота, имеет молекулярную массу 98 г/моль и представляет собой бесцветную жидкость без запаха, смешивающуюся с водой. Другие названия гидроксида алюминия включают алюминиевую кислоту и гидроксид алюминия. Имея молекулярную массу 78 г/моль, он является амфотерным по своей природе .
Другие названия гидроксида алюминия включают алюминиевую кислоту и гидроксид алюминия. Имея молекулярную массу 78 г/моль, он является амфотерным по своей природе .
В этой статье мы узнаем больше подробностей об этой реакции.
Что является продуктом H
2 SO 4 и Al(OH) 3Серная кислота реагирует с гидроксидом алюминия с образованием сульфата алюминия и воды.
H 2 SO 4 + AL (OH) 3 = AL 2 (SO 4 ) 3 + H 2 O
. ЧИСТЬ ПЕРЕДИТ 2
СО 4 + Al(OH) 3H 2 SO 4 + Al(OH) 3 представляет собой реакцию замещения, а также реакции осаждения 9 9.
Как сбалансировать H
2 SO 4 + Al(OH) 3 При балансировке химического уравнения необходимо выполнить следующие шаги.
- Стадия 1 : Записывается как несбалансированная химическая реакция
H 2 SO 4 + AL (OH) 3 = AL 2 (SO 4 ) 3 + H 2 O
- . моли каждого элемента на стороне реагента и продукта.
| Element | Reactant | Product |
|---|---|---|
| H | 5 | 2 |
| S | 1 | 3 |
| O | 7 | 13 |
| Al | 1 | 2 |
No. of moles in reactant and product
- Step 3: Теперь количество молей, присутствующих с каждой стороны реагента и продукта, должно быть равным, чтобы сбалансировать химическое уравнение.
 При этом количество молей в каждом элементе варьируется.
При этом количество молей в каждом элементе варьируется.
- Шаг 4: Необходимо сбалансировать химическое уравнение, выполнив следующие действия.
- AL (OH) 3 необходимо увеличить сторону реагента на 2.
- на стороне реагента, H 2 SO 4 . Со стороны продукта H 2 O необходимо умножить на 6.
- Шаг 5: Наконец, сбалансированное химическое уравнение равно 9.0019
3H 2 SO 4 + 2AL (OH) 3 = AL 2 (SO4) 3 + 6H 2 O
H
2 SO 4 9000 4 9000 49000 49000 49000 49000 49000 49000 49000 49000 4 9000 49000 49000 49000 49000 49000 49000 49000 49000 4 + +H
2 4 . AL (OH) 3 Чистое ионное уравнениеЧистое ионное уравнение для этой реакции будет:
2AL (OH) 3 + 6H + = 2AL 3+ + 6H 2 = 2AL 3+ + 6H 2 7 = 2AL 3+ + 6H 2 = 2AL 3+ + 40246 2 . O
O
H
2 SO 4 + Al(OH) 3 conjugate pairsThe conjugate acid-base pairs are :
- H 2 SO 4 (Conjugate base) = HSO 4 –
- H 2 O (Конъюгатная основа) = OH —
IS H
2 SO 4 + AL (OH) 3 ОБРАЗОВАНИЕ БЕЗНАЧЕНИЯH 2 SO 4 + AL (OH) 6. 3 не является буферным раствором из-за присутствия сильной кислоты H 2 СО 4 . Реакция завершена Так как все моли реагента полностью превращаются и поглощаются продуктом при равновесии .
Is H
2 SO 4 + Al(OH) 3 экзотермическая или эндотермическая реакция H 2 SO 4 + Al(OH) 3 является эндотермической реакцией , поскольку на стороне продукта выделяется тепло. окислительно-восстановительная реакция состояние центрального атома металла как в реагенте, так и в продукте со стороны не меняется.
окислительно-восстановительная реакция состояние центрального атома металла как в реагенте, так и в продукте со стороны не меняется.
Н
2 SO 4 + Al(OH) 3 реакция осажденияH 2 SO 4 + Al(OH) 3 реакция включает образование соли, следовательно, это реакция осаждения.
IS H
2 SO 4 + AL (OH) 3 Обратимая или необратимая реакцияH 2 SO 4 + Al (OH) 3 — нерешительная реакция, потому что продукты продукты. однажды сформированные не могут быть преобразованы в реагенты.
Is H
2 SO 4 + Al(OH) 3 реакция замещенияH 2 SO 4 + Al(OH) 9000 Al 2 (SO4) 3 со стороны продукта, а водород H 2 SO 4 в реагенте вытесняется.
Заключение
Минеральная кислота, состоящая из элементов водорода, кислорода и серы, называется серной кислотой. Гидроксид алюминия представляет собой аморфный белый порошок.
Гидроксид алюминия представляет собой аморфный белый порошок.
Подробнее о h3SO4:
Последние сообщения
ссылка на 17 фактов о HCl + FeCl2: реакция с несколькими элементами17 фактов о HCl + FeCl2: реакция с несколькими элементами
HCl + FeCl2 — это обозначение химической реакции происходит между HCl и FeCl2, что также дает некоторые специфические продукты. Давайте сосредоточимся на фактах о реакции здесь. Главный факт…
Продолжить чтение
ссылка на 7 фактов о Наох + h3so4: реакция с несколькими элементами7 Факты о Naoh + h3so4: реакция с несколькими элементами
Эта статья посвящена реакции naoh + h3so4 (реакционная смесь) и объясняет, как происходит реакция, образование продукта, уравновешивание и как действовать при титровании данных смесей. Гидроксид натрия…
Продолжить чтение
2Al(OH)3 + 3h3SO4 = Al2(SO4)3 + 6h3O
| Поиск |
гидроксид алюминия + серная кислота = сульфат алюминия + вода |
Новости Только 5% НАСЕЛЕНИЯ знают
Реклама
Содержание
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
| png» substance-weight=»78.0036″> 2Al(OH) 3 | + | |||||||
| (dung dịch) | (dung dịch) | (Dung Dịch) | (LỏNG) | |||||
| (TRắNG) | (Không Màu) | 9 | (không Màu) | 9 | . 0139 0139 | (không màu) | ||
| 2 | 3 | 1 | 6 | Hệ số | ||||
| Nguyên — Phân tử khối (g/mol) | ||||||||
| Số mol | ||||||||
| Хой лунг (г) |
Реклама
Дополнительная информация об уравнении 2AL (OH)
3 + 3H 2 SO 4 → AL 2 (SO 4 ) 3 + 6H 2 OЧто является условием реакции AL (OH)3 (гидроксид алюминия) реагирует с h3SO4 (серная кислота) ?
Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием Al2(SO4)3 (сульфат алюминия) и h3O (вода)?
h3SO4 реагирует с Al(OH)3
В полном предложении вы также можете сказать, что Al(OH)3 (гидроксид алюминия) реагирует с h3SO4 (серной кислотой) и производит Al2(SO4)3 (сульфат алюминия) и h3O (вода)
Явление после Al(OH)3 (гидроксид алюминия) реагирует с h3SO4 (серная кислота)
Это уравнение не несет никакой конкретной информации о явлении.
В этом случае вам просто нужно наблюдать, чтобы убедиться, что вещество продукта h3O (вода), появляющаяся в конце реакции.
Или если какое-либо из следующих реагентов h3SO4 (кислота серная), исчезающая
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнений
Другие вопросы, связанные с химическими реакциями 2Al(OH)
3 + 3H 2 SO 4 → AL 2 (SO 4 ) 3 + 6H 2 OВопросы, связанные с реагентом Al (OH) 3 (Aluminum Hydroxide)
Что каковы химические и физические характеристики Al(OH)3 (гидроксид алюминия)? Каковы химические реакции, в которых Al(OH)3 (гидроксид алюминия) используется в качестве реагента?
Вопросы, связанные с реагентом h3SO4 (серная кислота)
Каковы химические и физические характеристики h3SO4 (серная кислота)? В каких химических реакциях используется h3SO4 (серная кислота) в качестве реагента?
Вопросы, связанные с продуктом Al2(SO4)3 (сульфат алюминия)
Каковы химические и физические характеристики Al2(SO4)3 (серная кислота)? Каковы химические реакции, в которых Al2(SO4)3 (сульфат алюминия) ) как товар?
Вопросы, связанные с продуктом h3O (вода)
Каковы химические и физические характеристики h3O (серная кислота)? Каковы химические реакции, в результате которых образуется h3O (вода)?
Уравнения с Al(OH)3 в качестве реагента
гидроксид алюминия
2AL (OH) 3 → AL 2 O 3 + 3H 2 O AL (OH) 3 + 3HCL → ALCL 3 + 3H 2 O 2AL (OH) 3 + 3ZnSO 4 → Al 2 (SO 4 ) 3 + 3Zn(OH) 2 Просмотреть все уравнения с Al(OH)3 в качестве реагента
Уравнения с h3SO4 в качестве реагента
серная кислота
10FeO + 18H 2 SO 4 + 2KMNO 4 → 5FE 2 (Итак, 4 ) 3 + 18H 2 O + 2MNSO 4 + K 2 SO 4 H 2 + K 2 SO 4 H 2 + K 2 SO 4 H 2
+ K 2 SO 4 H 2 + K 2 SO 4 H 2 + K 2 Итак, 4 + NA 2 SO 3 → H 2 O + NA 2 SO 4 + SO 2 H 2 SO 4 + Zn → H 2 + ZNSO 4 Просмотреть все уравнения с h3SO4 в качестве реагентаРеклама
Уравнения с h3SO4 в качестве продукта
серная кислота
2H 2 O + 2KMNO 4 + 5SO 2 → 2H 2 SO 4 + 2MNSO 4 + K 2 SO 4 24HNO 3 + FECS 7 2 40007 2
27 2 7 2 2 2 2 7 2 7 2 7 2 40007 2 7 2 7 2 7 2 7 2 7 2 2 7 2 2 2 2 2 7 2 2 2 2 400067 2

 При этом количество молей в каждом элементе варьируется.
При этом количество молей в каждом элементе варьируется. При этом количество молей в каждом элементе варьируется.
При этом количество молей в каждом элементе варьируется.