Метод электронного баланса для уравнивания окислительно-восстановительных реакций
Похожие презентации:
Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (лекция 6)
Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции
Электрохимия. Окислительно-восстановительные реакции
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции. (лекция №10)
Окислительно-восстановительные реакции
1. Метод электронного баланса для уравнивания окислительно-восстановительных реакций
Метод электронногобаланса для уравнивания
окислительновосстановительных
реакций
2. Вспомним!
Степень окисления – это условныйзаряд, который приобрел бы атом в
молекуле, если бы все электронные
пары его химических связей
сместились в сторону более
электроотрицательных атомов.

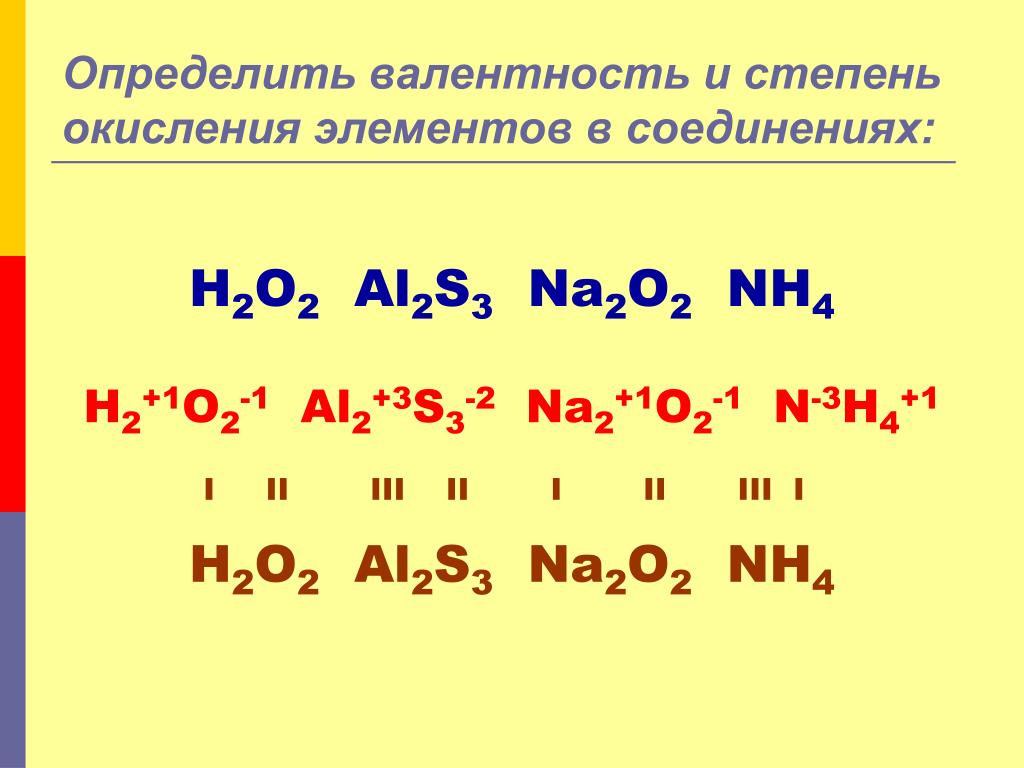
1. Степень окисления атомов в простых
веществах равна нулю:
0
0
0
h3, Cl2, Na .
2. В сложных веществах О-2.
3. В сложных веществах Н+1.
4. С.О. металлов всегда положительна,
максимальное значение С.О. металлов
главных подгрупп обычно совпадает с
номером группы, в которой расположен
металл.
Алгебраическая сумма степеней
окисления всех атомов в соединении
всегда равна нулю:
+1 -2
h3SO4
(+1)·2 + (+6)·1 + (–2)·4 = 0
В реакциях ионного обмена составные
части веществ переходили в состав других
веществ без изменений, степени
окисления элементов и заряды ионов не
менялись:
+1 +5 -2
+1 -1
+1 -1
+1 +5 -2
AgNO3 + HCl = AgCl + HNO3
Однако существует огромное
множество реакций, в ходе которых
меняются степени окисления
элементов:
0
0
+2 -2
Fe + S = FeS
Химические реакции, в результате
которых происходит изменение
степеней окисления атомов
химических элементов или ионов,
образующих реагирующие вещества,
называют окислительновосстановительными реакциями
(ОВР).

Элемент, отдающий электроны,
называется восстановителем, а
принимающий электроны окислителем.
Процесс отдачи электронов
называется окислением, а принятия восстановлением.
В процессе окисления степень
окисления повышается, в процессе
восстановления — понижается.
Эти процессы неразрывно
связаны между собой, число
принятых окислителем
электронов должно быть равно
числу отданных
восстановителем электронов. На
этом основании составляется
электронный баланс и
расставляются коэффициенты.
10. Чтобы составить схему о-в процесса, необходимо:
1. Определить степень окисления элементов.2. Определить элементы, изменившие степень
окисления.
3. Составить схему: определить элемент,
теряющий, и элемент, принимающий
электроны.
4. Составить электронный баланс (число
отданных электронов всегда должно равняться
числу электронов, принятых).
5. Расставить коэффициенты в уравнении по
электронному балансу, определить окислитель
и восстановитель.
11. 0 0 +3 -2
02
в — ль
0
-2
Al +3 S = Al2S3
окисление
Al0 — 3ē → Al+3
восстановление
ок — ль
+3
S0 + 2ē → S-2
6
2 2Al0–6ē→2Al+3
3 3S0 +6ē →3S-2
0
0
+2 -2
2 Mg + O2 = 2MgO
в — ль
окисление
Mg0 — 2ē → Mg+2
восстановление
ок — ль
O20 + 4 ē → 2 O-2
4
2 2Mg0-4ē→2Mg+2
1 O20 +4ē → 2O-2
13. Окислительно-восстановительные реакции в природе и технике:
Окислительновосстановительные реакции вприроде и технике:
14. Задание 1.
Определите степени окисления всеххимических элементов, входящих в
состав веществ:
NaOH, MgCl2, K2CO3, AlCl3, h4PO4,
K2SO4, HNO3, CuSO4, Fe, Zn(NO3)2.
15. Задание 2.
Расставьте коэффициенты методомэлектронного баланса в следующих
уравнениях реакций:
1)
2)
3)
4)
5)
HgO = Hg + O2
h3S + O2 = SO2 + h3O
KClO3 = KCl + O2
CuS + O2 = CuO + SO2
N2 + h3 = Nh4
16.
 Домашнее задание: Расставьте коэффициенты в
Домашнее задание: Расставьте коэффициенты вуравнениях методом электронного
баланса:
1)
2)
3)
4)
5)
Fe + Cl2 → FeCl3
Zn + HCl → ZnCl2
HBr + O2 → h3O + Br2
Nh4 + O2 → NO + h3O
Zn + HNO3 → Zn(NO3)2 + N2 + h3O
English Русский Правила
Урок «Окислительно-восстановительные реакции»
Окислительно-восстановительные реакции. (8 класс)
Цель: сформировать знания учащихся об окислительно-восстановительных реакциях.
Задачи:
Образовательные: показать причины, обусловливающие специфику химических процессов окисления и восстановления; научить учащихся применять понятие «степень окисления» для составления окислительно-восстановительных реакций; формировать умения составлять окислительно-восстановительные реакции методом электронного баланса.
Развивающие: развивать обогащение и усложнение словарного запаса, усложнение смысловой функции речи; способствовать развитию логического мышления, умения правильно обобщить данные и сделать вывод.
Воспитательные: воспитание ответственного отношения к учебному труду, интереса и потребности изучения предмета, самообразования.
Оборудование. Оксид меди (II), уголь.
Ход урока.
Что мы понимаем под понятием «степень окисления»?
Какой знак степени окисления приобретает элемент, который приобретает электроны?
Какой знак степени окисления приобретает элемент, который отдает электроны?
Какую степень окисления имеют простые вещества?
Запишите уравнение реакции взаимодействия алюминия с серой. Расставьте степени окисления элементов в каждом соединении.
Обсуждая данную запись, учащиеся делают вывод, что данная реакция сопровождается изменением степени окисления элементов.
Учитель указывает, что данная реакция является окислительно- восстановительной.
Учащиеся сами могут сформировать определение окислительно- восстановительных реакций.
ОВР – это реакции, идущие с изменением степеней окисления.
Упражнение. Определите, какие из реакций являются окислительно-восстановительными?
Определите, какие из реакций являются окислительно-восстановительными?
2KI + Br2 →2KBr + I2
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
SO2 + h3O → h3SO3
h3S + 2Na → Na2S + h3
2Al + 3S →Al2S3
СаСО3 → CaO + CO2
2Na + Cl2 →2NaCl
Окислительно-восстановительные реакции сопровождаются изменением степени окисления элементов и состоят из двух противоположенных процессов, непрерывно связанных друг с другом,- процессов окисления и восстановления.
Восстановитель — это элемент, который отдает электроны.
Окислитель — это элемент, который принимает электроны.
Процесс отдачи электронов молекулой, атомом, ионом называется окислением, например,
Fe0 — 3 ē → Fe+3
Процесс принятия электронов молекулой, атомом, ионом называется восстановлением, например, P0 +5 ē →P+5
Восстановитель, отдавая электроны, окисляется, а окислитель, принимая их, восстанавливается.
Упражнение. Какой процесс (окисление или восстановление) изображен следующими схемами? C0→C+4 Cu+2 → Cu0
S0→S-2 Cu0→Cu+2
S+4→S+6 S-2→S+4
S0→S+4 K0→K+1
Если в ОВР участвуют простые вещества, молекулы которых образованы несколькими атомами (N2, h3,O2, C, l2,Br2 ), то в электронном балансе число приобретенных и отданных электронов рассчитывают с учетом числа атомов в молекуле.
Cl20+2 ē →2Cl-1
2H+1+2 ē →h30
В окислительно- восстановительных реакциях число электронов, отдаваемых восстановителем, равно числу электронов, принимаемых окислителем, т.е. соблюдается электронный баланс. Метод электронного баланса применяют для записей электронных уравнений процессов окисления и восстановления.
Демонстрация опыта восстановления меди из оксида меди (II) углеродом.
Расставим коэффициенты в данной реакции, схема которой CuO+C →Cu +CO2, методом электронного баланса.
Определяют элементы, изменяющие степень окисления: Cu+2O-2 +C0 → Cu0+C+4O2-2
В данной схеме изменяют степень окисления медь и углерод, а кислород имеет одинаковую степень окисления и в левой и в правой частях.
Составляют схемы окисления и восстановления.
Cu+2 → Cu0, процесс окисления – схема 1.
C0 → C+4 , процесс восстановления – схема 2.
Уравнивают заряды. В левой части схемы I заряд равен +2, в правой — 0, следовательно, в левую часть добавляют 2 ē. В схеме II в левой части заряд равен 0, а в правой – (+4), поэтому из левой части отнимают 4 ē.
В схеме II в левой части заряд равен 0, а в правой – (+4), поэтому из левой части отнимают 4 ē.
Количество отданных и принятых электронов всегда одинаково, поэтому, чтобы сбалансировать, уравнять их, находят наименьшее общее кратное и дополнительные множители, в нашем случае НОК = 4, числа 2 и 1, называемые множителями, выносят за вертикальную черту.
Схема I: 2 Cu+2 + 2 ē → Cu0число отданных электронов: 2•2 ē =4 ē
Схема II: 1 C0 — 4 ē → C+4 число принятых электронов: 1•4 ē =4 ē
Определяют стехиометрические коэффициенты, которые будут стоять перед формулами веществ в молекулярном уравнении.
Подсчитывают число атомов Cu+2, для этого множитель 2 умножают на коэффициент, который стоит перед Cu+2, т.е. на единицу: 2 • 1 Cu+2 =2 Cu+2. Эта запись показывает, что в реакцию вступают 2 атома меди.
Теперь множитель 2 умножают на коэффициент, стоящий перед Cu0, т.е. на единицу: 2•1 Cu0= 2 Cu0. Эта запись показывает, что в результате реакции образуется 2 Cu0.
Такие же действия производятся и в схеме II: 1•1С0 = 1C0; 1•1 C+4 =1 C+4 в составе C+4O2-2
Итоговое молекулярное уравнение 2Cu+2O-2 +C0 → 2Cu0+C+4O2-2.
Таким образом, электронные уравнения позволяют определять коэффициенты перед окислителем и восстановителем.
Зная формулу вещества и определив степени окисления атомов химических элементов в нем, нетрудно предсказать, какие свойства будет проявлять каждый элемент и вещество в целом:
Если в соединении элемент находится в минимальной степени окисления – соединение (частица) выступает в роли восстановителя.
Если в соединении элемент находится в максимальной степени окисления – соединение (частица) выступает в роли окислителя.
Если в соединении элемент находится в промежуточной степени окисления – соединение (частица) может выступить и окислителем – понизить степень окисления, и восстановителем – повысить степень окисления. Все зависит от условий протекания реакции, а также от тех соединений, с которыми реагирует.
Приведем примеры важнейших восстановителей и окислителей:
1. Окислители . Неметаллы – простые вещества (Cl2, Br2, O2), кислородсодержащие кислоты и их соли (KMnO4, K2CrO4, K2Cr2O7, h3SO4, HNO3), водород в степени окисления +1(преимущественно в растворах кислот, или воды), ионы металлов, находящиеся в высшей степени окисления.
2. Восстановители. Активные металлы, некоторые неметаллы (h3, C,P,Si), бескислородные кислоты и их соли, гидриды, содержащие ион Н-1, ионы металлов в низшей степени окисления(Sn2+, Fe2+, Cu+, Hg2+).
Упражнения. Расставьте коэффициенты в схемах уравнений химических реакций с помощью электронного баланса. Назовите окислитель и восстановитель.
Al +S →Al2S3
N2+h3 →Nh4
NO+O2 → NO2
Cl2 +KI →KCl +I2
CuS + O2→ CuO +SO2
Закрепление.
Что нового вы узнали в сегодняшнем уроке?
Все ли химические реакции являются окислительно-восстановительными?
Для чего составляют электронные уравнения (электронный баланс)?
Домашнее задание. Параграф 43 упр. 1, 3 стр. 235. ( по учебнику Габриелян О.С.)
Параграф 43 упр. 1, 3 стр. 235. ( по учебнику Габриелян О.С.)
Сульфид алюминия | AMERICAN ELEMENTS®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Наименование продукта: Сульфид алюминия
Номер продукта:
Номер CAS: 1302-81-4
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
10884 Weyburn Ave.
Los Angeles, CA
Тел.: +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи: +
, Северная Америка 800-424-9300
Международный: +1 703-527-3887
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Классификация вещества или смеси в соответствии с 29 CFR 1910 (OSHA HCS)
Water-react 9GHS002 Flame. 3 h361 При контакте с водой выделяет легковоспламеняющийся газ.
3 h361 При контакте с водой выделяет легковоспламеняющийся газ.
GHS07
Раздражение кожи. 2 ч415 Вызывает раздражение кожи.
Раздражение глаз. 2A h419 Вызывает серьезное раздражение глаз.
STOT SE 3 h435 Может вызывать раздражение дыхательных путей.
Опасности, не классифицированные иначе
Данные отсутствуют
Элементы маркировки СГС
Элементы маркировки СГС, включая меры предосторожности
Пиктограммы опасности
GHS02
GHS07
Сигнальное слово
Осторожно
Краткая характеристика опасности
Выделения горючих газов.
h415 Вызывает раздражение кожи.
h419 Вызывает серьезное раздражение глаз.
h435 Может вызывать раздражение дыхательных путей.
Меры предосторожности
P231+P232 Работать в среде инертного газа. Беречь от влаги.
P261 Избегать вдыхания пыли/дыма/газа/тумана/паров/аэрозолей.
P280 Пользоваться защитными перчатками/защитной одеждой/средствами защиты глаз/лица.
P305+P351+P338 ПРИ ПОПАДАНИИ В ГЛАЗА: Осторожно промывать глаза водой в течение нескольких минут. Снимите контактные линзы, если они есть и это легко сделать. Продолжайте полоскать.
Снимите контактные линзы, если они есть и это легко сделать. Продолжайте полоскать.
P405 Магазин заперт.
P501 Утилизируйте содержимое/контейнер в соответствии с местными/региональными/национальными/международными нормами.
Классификация WHMIS
B6 — Реактивный горючий материал
D1B — Токсичный материал, вызывающий немедленные и серьезные токсические эффекты
D2B — Токсичный материал, вызывающий другие токсические эффекты
Система классификации
Рейтинги HMIS (шкала 0–4)
(Система идентификации опасных материалов)
ПОЖАР
РЕАКТИВНОСТЬ
2
2
2
Здоровье (острые последствия) = 2
Воспламеняемость = 2
Физическая опасность = 2
Другие опасности
Результаты оценки PBT и vPvB
PBT: N/A
vPvB: N/A
Название вещества: 1302-81-4 Сульфид алюминия
Идентификационный номер(а):
Номер ЕС: 215-109-0
РАЗДЕЛ 4. МЕРЫ ПЕРВОЙ ПОМОЩИ
Описание мер первой помощи
При вдыхании: свежий воздух. Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.
Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.
Немедленно обратитесь к врачу.
При попадании на кожу:
Немедленно промыть водой с мылом; тщательно промыть.
Немедленно обратитесь к врачу.
При попадании в глаза:
Промыть открытые глаза в течение нескольких минут под проточной водой. Проконсультируйтесь с врачом.
При проглатывании:
Обратиться за медицинской помощью.
Информация для врача
Наиболее важные симптомы и эффекты, как острые, так и замедленные
Данные отсутствуют
Указание на необходимость немедленной медицинской помощи и специального лечения
Данные отсутствуют
РАЗДЕЛ 5. МЕРЫ ПОЖАРОТУШЕНИЯ
Средства пожаротушения
Подходящие средства пожаротушения
В случае пожара используйте песок, двуокись углерода или порошковое средство тушения. Никогда не используйте воду.
Неподходящие по соображениям безопасности средства пожаротушения
Вода
Особые опасности, исходящие от вещества или смеси
Бурно реагирует с водой
Если этот продукт участвует в пожаре, могут выделяться следующие вещества:
Оксиды серы (SOx)
Сероводород
Оксид алюминия
Рекомендации для пожарных
Защитное снаряжение:
Надеть автономный респиратор.
Носите полностью защитный непроницаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры предосторожности для персонала, защитное снаряжение и порядок действий в чрезвычайных ситуациях
Установить респиратор.
Используйте средства индивидуальной защиты. Держите незащищенных людей подальше.
Обеспечьте достаточную вентиляцию
Меры предосторожности по защите окружающей среды:
Не допускать попадания продукта в канализацию, канализационные системы или другие водотоки.
Методы и материалы для локализации и очистки:
Обеспечьте достаточную вентиляцию.
Не смывать водой или моющими средствами на водной основе.
Предотвращение вторичных опасностей:
Никаких специальных мер не требуется.
Ссылка на другие разделы
См. Раздел 7 для информации о безопасном обращении
См. Раздел 8 для информации о средствах индивидуальной защиты.
Информацию об утилизации см. в Разделе 13.
РАЗДЕЛ 7.
 ОБРАЩЕНИЕ И ХРАНЕНИЕ
ОБРАЩЕНИЕ И ХРАНЕНИЕ Обращение
Меры предосторожности для безопасного обращения
Работать под сухим защитным газом.
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в плотно закрытой таре.
Обеспечьте хорошую вентиляцию на рабочем месте.
Информация о защите от взрывов и пожаров:
Данные отсутствуют
Условия безопасного хранения с учетом любых несовместимостей
Требования, которым должны соответствовать складские помещения и емкости:
Нет специальных требований.
Информация о хранении в одном общем хранилище:
Не хранить вместе с кислотами.
Хранить вдали от воды/влаги.
Дополнительная информация об условиях хранения:
Хранить в сухом инертном газе.
Этот продукт чувствителен к влаге.
Беречь от влаги и воды.
Держите контейнер плотно закрытым.
Хранить в прохладном сухом месте в хорошо закрытых контейнерах.
Особое конечное использование(я)
Данные отсутствуют
РАЗДЕЛ 8.
 КОНТРОЛЬ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
КОНТРОЛЬ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ Дополнительная информация о конструкции технических систем:
Правильно работающий химический вытяжной шкаф, предназначенный для опасных химических веществ и имеющий среднюю скорость не менее 100 футов в минуту.
Параметры управления
Компоненты с предельными значениями, требующими контроля на рабочем месте:
Нет.
Дополнительная информация:
Нет данных
Средства контроля воздействия
Средства индивидуальной защиты
Соблюдайте стандартные меры защиты и гигиены при обращении с химическими веществами.
Хранить вдали от пищевых продуктов, напитков и кормов.
Немедленно снимите всю испачканную и загрязненную одежду.
Мыть руки перед перерывами и по окончании работы.
Избегать попадания в глаза и на кожу.
Поддерживайте эргономически подходящую рабочую среду.
Дыхательное оборудование:
Используйте подходящий респиратор при наличии высоких концентраций.
Защита рук:
Непроницаемые перчатки
Осмотрите перчатки перед использованием.
Пригодность перчаток должна определяться как материалом, так и качеством, последнее из которых может варьироваться в зависимости от производителя.
Время проницаемости материала перчаток (в минутах)
Данные отсутствуют
Защита глаз:
Защитные очки
Полная защита лица
Защита тела:
Защитная рабочая одежда
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных химические свойства
Внешний вид:
Форма: Кусочки, порошок или твердое вещество
Цвет: Бледно-серый
Запах: Как у тухлых яиц
Порог запаха: Данные отсутствуют.
pH: неприменимо
Температура плавления/диапазон плавления: 1100 °C (2012 °F)
Точка/диапазон кипения: Данные отсутствуют
Температура сублимации/начало: Данные отсутствуют
Воспламеняемость (твердое вещество, газ): Данные отсутствуют.
Температура воспламенения: Данные отсутствуют.
Температура разложения: Данные отсутствуют.
Самовоспламенение: Данные отсутствуют.
Опасность взрыва: Данные отсутствуют.
Пределы взрываемости:
Нижний: Данные отсутствуют
Верхний: Данные отсутствуют
Давление паров: Н/Д
Плотность при 20 °C (68 °F): 2,02 г/см 3 (16,857 фунтов/галлон)
Относительная плотность: Данные отсутствуют.
Плотность паров: N/A
Скорость испарения: N/A
Растворимость в воде (H 2 O): Бурно реагирует
Коэффициент распределения (н-октанол/вода): Данные отсутствуют.
Вязкость:
Динамическая: Н/Д
Кинематика: Н/Д
Другая информация: Данные отсутствуют
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная способность
Бурно реагирует с водой.
При контакте с кислотами выделяется токсичный газ.
Химическая стабильность
Стабилен при соблюдении рекомендуемых условий хранения.
Термическое разложение / условия, которых следует избегать:
Разложение не происходит, если используется и хранится в соответствии со спецификациями.
Возможность опасных реакций
Бурно реагирует с водой
При контакте с кислотами высвобождается токсичный газ.
Условия, которых следует избегать
Данные отсутствуют
Несовместимые материалы:
Кислоты
Вода/влага
Опасные продукты разложения:
Оксиды серы (SOx)
Сероводород
Оксид алюминия
РАЗДЕЛ 11. ИНФОРМАЦИЯ О ТОКСИЧНОСТИ
Информация о токсикологическом воздействии
Острая токсичность: Эффекты неизвестны.
Значения LD/LC50, важные для классификации: Нет данных
Раздражение или коррозия кожи: Вызывает раздражение кожи.
Раздражение или коррозия глаз: Вызывает серьезное раздражение глаз.
Сенсибилизация: Сенсибилизирующие эффекты неизвестны.
Мутагенность зародышевых клеток: Эффекты неизвестны.
Канцерогенность: Данные классификации канцерогенных свойств этого материала от EPA, IARC, NTP, OSHA или ACGIH отсутствуют.
Репродуктивная токсичность: Эффекты неизвестны.
Специфическая токсичность для системы органов-мишеней — многократное воздействие: Эффекты неизвестны.
Специфическая токсичность для системы органов-мишеней — однократное воздействие: Может вызывать раздражение дыхательных путей.
Опасность при вдыхании: Эффекты неизвестны.
От подострой до хронической токсичности: Эффекты неизвестны.
Дополнительная токсикологическая информация: Насколько нам известно, острая и хроническая токсичность этого вещества полностью не известна.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность
Токсичность в водной среде: данные отсутствуют
Стойкость и способность к разложению: данные отсутствуют
Потенциал биоаккумуляции: данные отсутствуют
Подвижность в почве: данные отсутствуют водотоки или канализационные системы.
Избегайте попадания в окружающую среду.
Результаты оценки PBT и vPvB
PBT: н/д
vPvB: н/д
Другие неблагоприятные эффекты: данные отсутствуют
РАЗДЕЛ 13.
 СООБРАЖЕНИЯ ПО УТИЛИЗАЦИИ
СООБРАЖЕНИЯ ПО УТИЛИЗАЦИИ Методы обработки отходов
Рекомендация
Ознакомьтесь с официальными правилами для обеспечения надлежащей утилизации.
Неочищенная упаковка:
Рекомендация:
Утилизация должна производиться в соответствии с официальными правилами.
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
Номер ООН
DOT, IMDG, IATA
UN3134
Надлежащее отгрузочное наименование ООН
DOT
Реагирующее с водой твердое вещество, токсичное, н.у.к. (сульфид алюминия)
IMDG, IATA
ВЕЩЕСТВО ТВЕРДОЕ, РЕАГИРУЮЩЕЕ С ВОДОЙ, ТОКСИЧНОЕ, Н.У.К. (Сульфид алюминия)
Класс(ы) опасности при транспортировке
DOT
Класс
4.3 Вещества, которые при контакте с водой выделяют легковоспламеняющиеся газы.
Этикетка
4.3+6.1
Класс
4.3 (WT2) Вещества, выделяющие легковоспламеняющиеся газы при контакте с водой
Маркировка
4.3+6.1
IMDG, IATA
Класс
4.3 Вещества, выделяющие горючие газы при контакте с водой.
Этикетка
4.3+6.1
Группа упаковки
DOT, IMDG, IATA
III
Опасности для окружающей среды:
Н/Д
Особые меры предосторожности для пользователя
Предупреждение: Вещества, которые при контакте с водой выделяют легковоспламеняющиеся газы
Номер EMS:
F-G,S-N Код IBC
N/A
Транспорт/Дополнительная информация:
DOT
Загрязнитель морской среды (DOT): №
«Типовой регламент ООН»: UN3134, Реагирующее с водой твердое вещество, токсичное, н.у.к. (сульфид алюминия), 4.3 (6.1), III
РАЗДЕЛ 15. НОРМАТИВНАЯ ИНФОРМАЦИЯ
Правила техники безопасности, охраны здоровья и окружающей среды/законодательные акты, относящиеся к веществу или смеси
GHS Элементы этикетки GHS, включая меры предосторожности
Пиктограммы опасности
GHS02
GHS07
Сигнальное слово
Предупреждение
Краткая характеристика опасности
h361 При контакте с водой выделяет горючий газ.
h415 Вызывает раздражение кожи.
h419 Вызывает серьезное раздражение глаз.
h435 Может вызывать раздражение дыхательных путей.
Меры предосторожности
P231+P232 Работать в среде инертного газа. Беречь от влаги.
P261 Избегать вдыхания пыли/дыма/газа/тумана/паров/аэрозолей.
P280 Пользоваться защитными перчатками/защитной одеждой/средствами защиты глаз/лица.
P305+P351+P338 ПРИ ПОПАДАНИИ В ГЛАЗА: Осторожно промывать глаза водой в течение нескольких минут. Снимите контактные линзы, если они есть и это легко сделать. Продолжайте полоскать.
P405 Магазин заперт.
P501 Утилизируйте содержимое/контейнер в соответствии с местными/региональными/национальными/международными нормами.
Национальные правила
Все компоненты этого продукта перечислены в Реестре химических веществ Агентства по охране окружающей среды США.
Все компоненты этого продукта перечислены в Канадском списке веществ, не предназначенных для внутреннего потребления (NDSL).
Раздел 313 SARA (списки конкретных токсичных химических веществ)
Вещество не указано в списке.
Предложение 65 штата Калифорния
Предложение 65 — Химические вещества, вызывающие рак
Вещество не указано в списке.
Prop 65 — Токсичность для развития
Вещество не указано.
Prop 65 — Токсичность для развития, женщины
Вещество не указано.
Prop 65 — Токсичность для развития, мужчины
Вещество не указано.
Информация об ограничении использования:
Только для использования технически квалифицированными лицами.
Другие правила, ограничения и запретительные положения
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (ЕС) № 1907/2006.
Вещество не указано.
Необходимо соблюдать условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) для производства, размещения на рынке и использования.
Вещество не указано.
Приложение XIV Регламента REACH (требуется разрешение на использование)
Вещество не указано.
Оценка химической безопасности: Оценка химической безопасности не проводилась.
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКОЕ ПРАВО 1997-2022 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
What, How to Balance & FAQs —
By Monika Saini
Сульфид алюминия также имеет химическую формулу Al 2 S 3 . Давайте рассмотрим некоторые факты, касающиеся реакций Al 2 S 3 и HCl.
Хлористый водород представляет собой газ от бесцветного до бледно-желтого цвета с резким запахом. Сильные кислоты, такие как HCl, могут диссоциировать на ионы и реагировать с различными металлами и другими соединениями. Химическое соединение, известное как сульфид алюминия (Al 2 S 3 ) имеет молярную массу 150,158 г/моль и представляет собой твердое вещество серого цвета.
Al 2 S 3 получается путем нагревания алюминия непосредственно в присутствии серы. Изучим факты, основанные на реакции HCl + Al 2 S 3 , которая будет рассмотрена ниже.
Что является продуктом HCl и Al 2 S 3 ? При взаимодействии хлористого водорода (HCl) с сульфидом алюминия (Al 2 S 3 ), полученные продукты представляют собой хлорид алюминия (AlCl 3 ) и сероводород (H 2 S) в виде газа.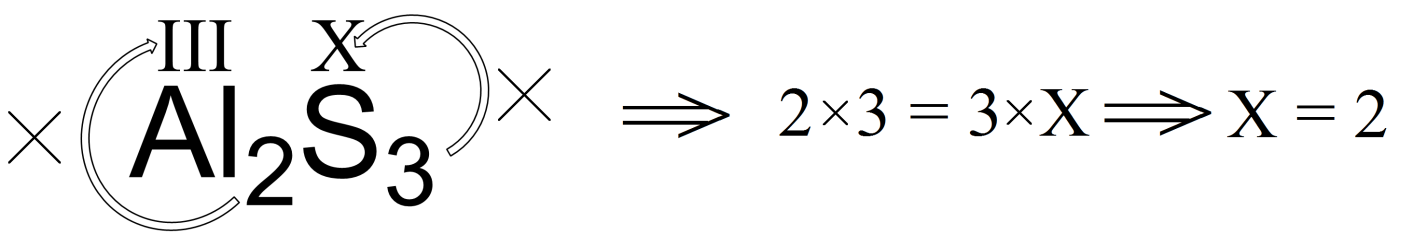 Образуется хлорид алюминия, растворимый в воде. В ходе реакции выделяется сероводород.
Образуется хлорид алюминия, растворимый в воде. В ходе реакции выделяется сероводород.
HCl + AL 2 S 3 → ALCL 3
9000 9000 2 9000 9000 9000 2 9000 9000 9000 949949949494949949494949497474947494497449494497449744949447449н.0006 Какой тип реакции HCl + Al 2 S 3 ?
HCl + Al 2 S 3 – это реакция двойного замещения, поскольку ионы замещают друг друга.
HCl (S) + AL 2 S 3 (AQ) → ALCL 3 (AQ) → ALCL 0007 3 (AQ) + H 2 S (G)
Как баланс HCL + AL94444445 96691414459459144445945954494649544459445945444544454445444444444444444459н. HCl + AL 2 S 3 можно легко сбалансировать, следуя этим этапам:  ?
?
- .0007
- Сначала подсчитайте атомы каждого типа как на стороне реагента, так и на стороне продукта. Со стороны реагента находятся атомы 1H, 1Cl, 2Al и 3S. Со стороны продукта присутствуют атомы 1Al, 2H, 1S и 3Cl.
- Несбалансированное уравнение: HCL + AL 2 S 3 = ALCL 3 + H 2 S
- Шаг 2: Балансировка Ат -Ат -Атэйт -Аут -Ат. или молекулы в HCl-Al 2 S 3 are balanced or organised by multiplying 6 by HCl, 2 by AlCl 3 , and 3 by H 2 S.

- 6HCl + Al 2 S 3 = 2AlCl 3 + 3H 2 S
- Шаг 3: Расчет коэффициента: Исключение Гаусса используется для расчета всех коэффициентов и переменных. В результате получается коэффициент 6:1::2:3.
- Этап 4: Сбалансированное химическое уравнение:
- 6HCl + Al 2 S 3 → 2AlCl 3 + 3H 2 S
Титрование между Al 2 S 3 и HCl можно использовать для измерения количества Al. Реакцию следует проводить крайне осторожно, так как в результате образуется осадок (AlCl 3 ).
Белая бумага, мерная колба и колба Эрленмейера, бюретка (50 мл), химический стакан и подставка для бюретки.
ИндикаторИндикатор фенолфталеин хорошо подходит для титрования между HCl и Al 2 S 3 , так как это тип кислотно-щелочной реакции. В кислых средах он становится бесцветным, а в основных средах приобретает бледно-розовый цвет.
Процедура- Устройство необходимо правильно очищать и промывать соответствующими химикатами с использованием минимального количества химикатов.
- Раствор Al 2 S 3 помещают в колбу Эрленмейера, а стандартизированный HCl помещают в бюретку.
- Затем к реакционной смеси добавляют фенолфталеиновый индикатор и тщательно перемешивают.

- При титровании выпускайте из бюретки по одной капле HCl до тех пор, пока не произойдет заметное изменение цвета.
- Когда появляется заметное изменение цвета, мы можем сказать, что конечная точка реакции достигнута.
- Процедуру следует использовать три раза для расчета точных показаний.
- Необходимое количество можно рассчитать по формуле N 1 V 1 =N 2 В 2 .
HCl + Al 2 S 3 reaction has следующее результирующее ионное уравнение:
6H + (aq) + 6Cl – (aq) + 3S 2- (aq) + 2Al 3+ (aq) → Al 3+ (aq) + 3 Cl – (aq) + H 2 S (g)
HCl + Al 2 S 3 conjugate pairsHCl + Al 2 S 3 reaction образовались следующие сопряженные пары:
- Сопряженная пара оснований (Cl – ) и сопряженная пара кислот (H +
7 S
+ 07
0238 2- ).
- Al 2 S 3 также служит кислотой.
- HCl представляет собой сопряженную кислоту.
HCl + Al 2 S 3 reaction has the следуя межмолекулярной силе,
- Cl более электроотрицателен, чем H, и легко отбирает электроны у водорода в молекуле HCl, что является примером диполь-дипольного и лондоновского дисперсионного взаимодействия.
- Катион Al 3+ и анион S 2- сульфида взаимодействуют ионно с образованием межмолекулярных взаимодействий в Al 2 S 3 .

HCl + Al 2 S 3 Реакция имеет типичную энтельпию реакции + 2678,6KJ/моль,
- ΔH⁰F (реакция). )= -ve
- 6HCl (s) + Al 2 S 3(aq) → 2AlCl 3(aq) + 3H 2 S (г)
- Изменение энтальпии = [3*(-20,6) + 2*(-706,25)] – [7*(-6) 1675,7)] =+2678,6 кДж/моль.
Реакция HCl + Al 2 S 3 не является буферным раствором. это так. Таким образом, создание буфера предотвращается.
это так. Таким образом, создание буфера предотвращается.
The HCl + AL 2 S 3 Реакция — это полная реакция из -за следующей причины,
- 9974974444444444444444444444444444444444444444444444444444444444444444444444444444444н. 2 S – продукт стабильной реакции.
- AlCl 3 представляет собой стабильную соль, которая не растворяется в воде и стабильна в свободном состоянии.
- H 2 S – газ, выделяющийся в ходе реакции.
HCl + Al 2 S 3 9Реакция 0245 является эндотермической, так как значение стандартной энтальпии образования имеет положительное значение. окислительно-восстановительная реакция?
окислительно-восстановительная реакция?
Реакция HCl + Al 2 S 3 не является окислительно-восстановительной реакцией, так как элементы оставались в своих первоначальных степенях окисления на протяжении всего процесса. Al находится в состоянии +3, Cl находится в состоянии -1, H находится в состоянии +1 и S находится в состоянии -2. Стабильная форма реакции
Is HCl + Al 2 S 3 реакция осаждения? Реакция HCl + Al 2 S 3 представляет собой реакцию осаждения. Поскольку результат HCl + Al 2 S 3 состоит из AlCl 3 + 3H 2 S, которые нерастворимы в воде. AlCl 3 представляет собой белый осадок, который оседает на дно контейнера. AlCl 3 нерастворим в воде.
AlCl 3 нерастворим в воде.
Реакция HCl + Al 2 S 3 является необратимой реакцией, из-за твердых нерастворимых побочных продуктов реакции. Этот продукт не выполняет обратное преобразование в раствор.
Is HCl + Al 2 S 3 реакция замещения? HCl + Al 2 S 3 представляет собой реакцию двойного замещения . Потому что металл и кислоты могут реагировать в реакциях замещения только тогда, когда кислота особенно сильная и концентрированная. Вещество чувствительно к влаге и гидролизуется с образованием гидратированных оксидов/гидроксидов алюминия.




