что, как сбалансировать и часто задаваемые вопросы —
By Авниш Рават
Химические реакции включают столкновение двух или более реагирующих частиц в правильной ориентации с образованием важных продуктов. Поговорим о химической активности H2SO4 и Ба.
Серная кислота является сильной кислотой с определенным промышленным применением. Из-за высокой смешиваемости с водой он вызывает сильную коррозию многих металлов и неметаллов. Барий — очень активный щелочноземельный металл. Этот металл используется в производстве высокотемпературных полупроводников и в производстве петардных крекеров.
Реакционная способность H2SO4 и Ba имеет значение в нефтяной промышленности, используется в красках и лаках. Кроме того, химические реакции можно исследовать по следующим критериям, обсуждаемым ниже.
Что является произведением H2SO4 и Ба?Сульфат бария и газообразный водород образуются при H2SO4 + Ба реагирует.
H2SO4 + Ва = ВаSO4 + H2
Какой тип реакции Н2SO4 + Ба?H2SO4 + Ба — это замена реакция, при которой водород в серной кислоте замещается барием с образованием сульфата бария.
Как сбалансировать H2SO4 + Ба?Следующая реакция уравновешивается указанным алгебраическим методом:
Ва + Н2SO4 = BaSO4 + H2
- Неизвестные коэффициенты представлены переменными (A, B, C и D), которые присваиваются каждому реагенту и продукту в уравнении.
- А Ба + ЧД2SO4 = С BaSO4 + ЦТ2
- Теперь уравнение решается соответствующим числом, которое считается коэффициентом реагентов и продуктов.
- Ba = A = C, H = 2B = 2D, S = B = C, O = 4B = 4C
- Используя метод исключения Гаусса, все переменные и коэффициенты рассчитываются, и результат
- А = 1, В = 1, С = 1 и D = 1
- Итак, общее сбалансированное уравнение:
- Ва + Н2SO4 = BaSO4 + H2
Система титрования Ba + H2SO4 невозможно, потому что Ba — это металл, который нельзя использовать в титровании.
Компания чистое ионное уравнение Ва + Н2SO4 is
Ва(с) + 2H+ (водн.) + SO4-2 (водн.) = BaSO4 (с) + Н2 (Г)
Чистое ионное уравнение создается с использованием процедур, описанных ниже:
- Сначала напишите сбалансированное химическое уравнение, затем проиллюстрируйте физические условия реагентов и продуктов.
- Ва(с) + Н2SO4 (водн.) = BaSO4 (с) + Н2 (Г)
- Итак, чистые твердые вещества и молекулы не диссоциируют, тогда как сильные кислоты, основания и соли диссоциируют на ионы
- Таким образом, результирующее ионное уравнение имеет вид
- Ва(с) + 2H+ (водн.
 ) + SO4-2 (водн.) = BaSO4 (с) + Н2 (Г)
) + SO4-2 (водн.) = BaSO4 (с) + Н2 (Г)
- H2SO4 образует сопряженное основание как HSO4–
- Ба не может образоваться сопряженные пары потому что он не содержит протона.
- H2SO4 молекулы связаны друг с другом посредством диполь-дипольные взаимодействия, ван-дер-ваальсовые дисперсионные силы и сильная водородная связьds.
- Ионы металла Ba взаимодействуют с помощью межмолекулярных сил.
H2SO4 + Ба сообщает энтальпия реакции -239. 02 кДж/моль.
02 кДж/моль.
H2SO4 + Ба не может работать как буферный раствор потому что ни сильная кислота ( H2SO4) ни металл (Ba) не могут образовывать буфер.
Н2SO4 + Ба полная реакция?H2SO4 + Ba является полной реакцией, так как сульфат бария и газообразный водород образуются в виде стабильных продуктов.
Н2SO4 + Ba экзотермическая или эндотермическая реакция?H2SO4 + Ба – это экзотермическая реакция так как при добавлении серной кислоты выделяется теплота.
Н2SO4 + Ба окислительно-восстановительная реакция?H2SO4 + Ба не окислительно-восстановительная реакция потому что только Ba подвергается реакции окисления.
H2SO4 + Ba является реакцией осаждения, так как нерастворимый сульфат бария выпадает в осадок в конце реакции.
Н2SO4 + Ba обратимая или необратимая реакция?H2SO4 + Ба – это необратимая реакция потому что продукты образовали BaSO4 не могут быть заменены обратно на реагенты.
Н2SO4 + Ва реакции смещения?H2SO4 + Ба — это реакция смещения так как наблюдается однократное смещение сульфатной группы от водорода к барию.
ВыводыРеакция серной кислоты с барием имеет несколько промышленных и коммерческих последствий. Барий пассивно реагирует с серной кислотой и тем самым останавливает реакцию, образуя на поверхности нерастворимое покрытие из сульфата бария. Сульфат бария из-за малой токсичности используется в рентгенографии.
Сульфат бария из-за малой токсичности используется в рентгенографии.
ГДЗ (відповіді) Хімія 8 клас Григорович §39 2021 / §41 2016 ЗАГАЛЬНІ СПОСОБИ ДОБУВАННЯ КИСЛОТ, ОСНОВ, СОЛЕЙ » Допомога учням
Інші завдання дивись тут…
Контрольні запитання
Запитання 1
Які кислоти можна добути розчиненням газуватих речовин у воді?
Безоксигенові кислоти — флуоридна HF, хлоридна НСІ, бромідна НВг, йодидна НІ та сульфідна H2S — це водні розчини газів, що мають таку саму формулу, що й відповідні кислоти, та оксигеновмісні кислоти — сульфітна Н2SO3 і карбонатна Н2СO3 кислоти є водними розчинами відповідно газів сульфур (ІV) оксиду SO2 і карбон (ІV) оксиду СO2.
Запитання 2
Чи можна добути оксигеновмісні кислоти реакцією сполучення між простими речовинами? Відповідь поясніть. Ні, не можна. Прості речовини, окрім кисню, не містять Оксигену. Реакція взаємодії простих речовин з киснем є реакцією окиснення (горіння), в результаті якої утворюються оксиди.
Ні, не можна. Прості речовини, окрім кисню, не містять Оксигену. Реакція взаємодії простих речовин з киснем є реакцією окиснення (горіння), в результаті якої утворюються оксиди.
Запитання 3
Поясніть, чому луги можна добути взаємодією металів з водою, а нерозчинні гідроксиди — ні. Бо луги утворюють лужні метали, які є найактивнішими металами.
Запитання 4
Якій умові має відповідати реакція обміну за участю розчинних солей, щоб у результаті можна було добути сіль? Обидві початкові солі розчинні у воді і хоча б один з продуктів реакції випадає в осад, тобто серед продуктів реакції принаймні одна сіль має бути нерозчинна або малорозчинна.
Запитання 5
Яким умовам мають відповідати реагенти, щоб можна було здійснити реакцію заміщення з утворенням солі? Реагентами може бути кислота і метал, розташований в ряду активності ліворуч від водню. Реагентами може бути метал і розчинна сіль, утворена менш активним металом, тобто витіснення менш активних металів із солей більш активними металами.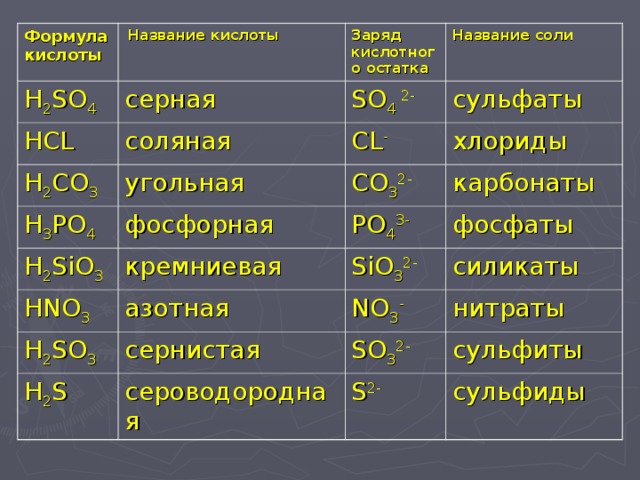
Завдання для засвоєння матеріалу
Вправа 1
Наведіть по одному прикладу рівнянь реакцій, що відтворюють такі способи добування солей:
а) сіль безоксигенової кислоти реакцією сполучення;
Mg + Cl2 = MgCl2
б) сіль оксигеновмісної кислоти реакцією сполучення;
CaO + CO2 = CaCO3
в) реакція заміщення за участю кислоти;
Mg + 2HCl = MgCl2 + H2↑
г) реакція заміщення за участю солі;
Fe + CuCl2 = FeCl2 + Cu↓
д) реакція обміну за участю кислотного оксиду;
CO2 + 2NaOH = Na2CO3 + H2O
е) реакція обміну за участю основного оксиду;
CuO + 2HCl = CuCl2 + H2O
є) реакція обміну за участю нерозчинної солі;
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
ж) реакція обміну за участю нерозчинного гідроксиду;
Cu(OH)2↓ + 2HCl = CuCl2 + 2H2O
з) реакція обміну за участю розчинної солі;
K2CO3 + 2HCl = 2KCl + H2O + CO2↑
и) реакція обміну за участю нерозчинної кислоти.
H2SiO3↓ + 2KOH = K2SiO3 + 2H2O
Вправа 2
Складіть рівняння реакцій добування кислот:
а) взаємодією двох оксидів;
SO3 + H2O = H2SO4
б) взаємодією кислоти й солі;
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
в) взаємодією двох простих речовин (з наступним розчиненням продукту реакції у воді).
H2 + S = H2S↑ із наступним розчиненням газу (сірководень) у воді,
або
H2 + Cl2 = 2HCl↑ із наступним розчиненням газу (хлороводень) у воді.
Вправа 3
Складіть рівняння реакції добування плюмбум (II) сульфіду:
а) реакцією сполучення;
Pb + S = PbS↓
б) реакцією заміщення;
Pb + HgS = PbS↓ + Hg
в) реакцією обміну.
Pb(NO3)2 + K2S = PbS↓ + 2KNO3
Вправа 4
Складіть рівняння реакції добування купрум (II) сульфату:
а) реакцією сполучення;
CuO + SO3 = CuSO4
б) реакцією заміщення;
Cu + HgSO4 = CuSO4 + Hg
в) реакцією обміну.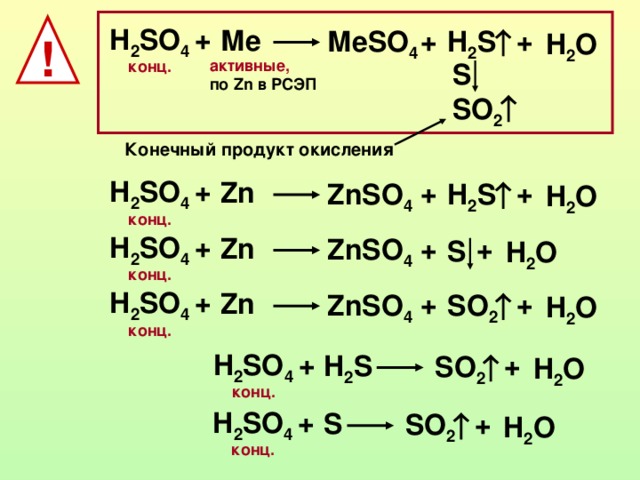
Cu(OH)2↓ + H2SO4 = CuSO4 + 2H2O
Вправа 5
Білий осад розчиняється в результаті взаємодії з нітратною кислотою і натрій гідроксидом. Яка речовина могла бути в осаді? Амфотерний оксид або гідроксид білого кольору, бо взаємодіє як з лугом, так і з кислотою. Наприклад, алюміній оксид або цинк гідроксид.
Відповідь підтвердьте рівняннями реакцій.
Al2O3 + 6HNO3 = 2Al(NO3)3+ 3H2O
Al2O3 + 2NaOH + 3H2O = 2NaAl(OH)4
або
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
Zn(OH)2 + 2NaOH = Na2Zn(OH)4
Вправа 6
Складіть рівняння можливих реакцій:
а) H2 + S = H2S
б) H2 + Br2= 2HBr
в) 2K + Br2 = 2KBr
г) 2Al + 3Cl2 = 2AlCl3
д) FeS + H2SO4 = FeSO4 + H2S
е) CuCl2 + 2HNO3 →
є) MgCO3 + H2SO4 = MgSO4 + H2O + CO2↑
ж) Na2SiO3 + 2HBr = 2NaBr + H2SiO3↓
з) 2NaCl + Cu(OH)2 →
и) Ag + H2O →;
і) BaO + H2O = Ba(OH)2
ї) Fe(OH)2 + K2CO3 →
к) Cr2(SO4)3 + 6KOH = 2Cr(OH)3↓ + 3K2SO4;
л) Ba(OH)2 + Na2SO4 = BaSO4↓ + 2NaOH;
м) SO2 + MgO = MgSO3;
н) 2Al + 6HCl = 2AlCl3 + 3H2↑;
о) 2AgNO3 + Pb = Pb(NO3)2 + 2Ag↓;
п) ZnO + 2HNO3 = Zn(NO3)2 + H2O;
р) CO2 + 2KOH = K2CO3 + H2O;
с) Sn(OH)2 + 2HNO3 = Sn(NO3)2 + 2H2O;
т) Cr(NO3)3 + K2SO4 →;
у) Pb(NO3)2 + 2KCl = 2KNO3 + PbCl2↓.
Вправа 7
Складіть рівняння реакцій, що відповідають таким перетворенням:
а) MgO → Mg(NO3)2 → Mg(OH)2;
MgO + 2HNO3 = Mg(NO3)2 + H2O
Mg(NO3)2 + 2NaOH = Mg(OH)2↓+ 2NaNO3
б) Fe → FeCl3 → Fe(OH)3 → Fe2(SO4)3 → Fe → FeCl2.
2Fe + 3Cl2 = 2FeCl3
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
2Fe(OH)3↓ + 3H2SO4 = Fe2(SO4)3 + 6H2O
Fe2(SO4)3 + 3Mg = 3MgSO4 + 2Fe
Fe + 2HCl = FeCl2 + H2↑
Вправа 8
Дано солі: аргентум (I) нітрат, магній карбонат, ферум (II) сульфід, калій сульфіт, плюмбум (II) нітрат. Які з них взаємодіятимуть з хлоридною кислотою з утворенням: а) осаду; б) газу? Складіть рівняння реакцій.
a) AgNO3 + HCl = AgCl↓ + HNO3
Pb(NO3)2 + 2HCl = PbCl2↓ + 2HNO3
б) MgCO3 + 2HCl = MgCl2 + H2O + CO2↑
FeS + 2HCl = FeCl2 + H2S↑
K2SO3 + 2HCl = 2KCl + SO2↑+ H2O
Вправа 9
Як із натрій хлориду добути натрій сульфат? Подіяти на твердий натрій хлорид концентрованою сульфатною кислотою.
Складіть рівняння реакцій.
2NaCl + H2SO4 (конц.) = Na2SO4 + 2НCl↑
Вправа 10
Як із ферум (III) сульфату добути ферум (III) оксид? Прожарюванням.
Складіть рівняння реакцій.
Fe2(SO4)3 = Fe2O3 + 3SO3
Вправа 11
Як із ферум (III) оксиду у дві стадії одержати ферум (III) гідроксид? Складіть рівняння реакцій.
1. Добути розчинну сіль.
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
2. Подіяти лугом.
FeCl3 + 3KOH = 3KCl + Fe(OH)3↓
Вправа 12
Складіть рівняння реакцій добування не менше ніж семи солей, використовуючи такі реактиви: ртуть, цинк, хлоридна кислота, фосфор (V) оксид, магній оксид, аргентум (І) нітрат, барій карбонат, ферум (III) гідроксид.
Pb + 2AgNO3 = Pb(NO3)2 + 2Ag
Zn + 2HCl = ZnCl2 + H2↑
P2O5 + 3MgO = 2Mg3PO4
AgNO3 + HCl = AgCl↓ + HNO3
3HCl + Fe(OH)3↓= FeCl3 + 3H2O
MgO + 2HCl = MgCl2 + H2O
BaCO3 + 2HCl = BaCl2 + H2O + CO2↑
Впроава 13
Хлор об’ємом 5,6 л (н. у.) змішали з достатньою кількістю водню й підірвали. Продукт реакції розчинили у воді масою 200 г. Обчисліть масову частку хлоридної кислоти в отриманому розчині.
у.) змішали з достатньою кількістю водню й підірвали. Продукт реакції розчинили у воді масою 200 г. Обчисліть масову частку хлоридної кислоти в отриманому розчині.
Відомо: V(Cl2)=5,6 л, m(H2O)=200 г
Знайти ω(HCl)-?
Розв’язування
1. Обчислюємо кількість речовини Cl2 об’ємом 5,6 л за формулою n=V:VM, де VM — постійна величина і за н.у. чисельно дорівнює 22,4 л/моль
n(Cl2)=V(Cl2):VM=5,6 л : 22,4 л/моль=0,25 моль
2. Записуємо рівняння реакції: Cl2 + H2 = 2HСl↑
За рівнянням реакції n(Cl2):n(HCl)=1:2, кількість речовини хлороводню удвічі більша від кількості речовини хлору, тому n(HCl)=2•n(Cl2)=2•0,25 моль=0,5 моль.
3. Обчислюємо масу НСl кількістю речовини 0,5 моль за формулою m=n•M.
Mr(HCl)=Ar(H)+Ar(Cl)=1+35,5=36,5, тому М(HCl)=36,5 г/моль
m(HCl)=n(HCl)•M(HCl)=0,5 моль•36,5 г/моль=18,25 г
4.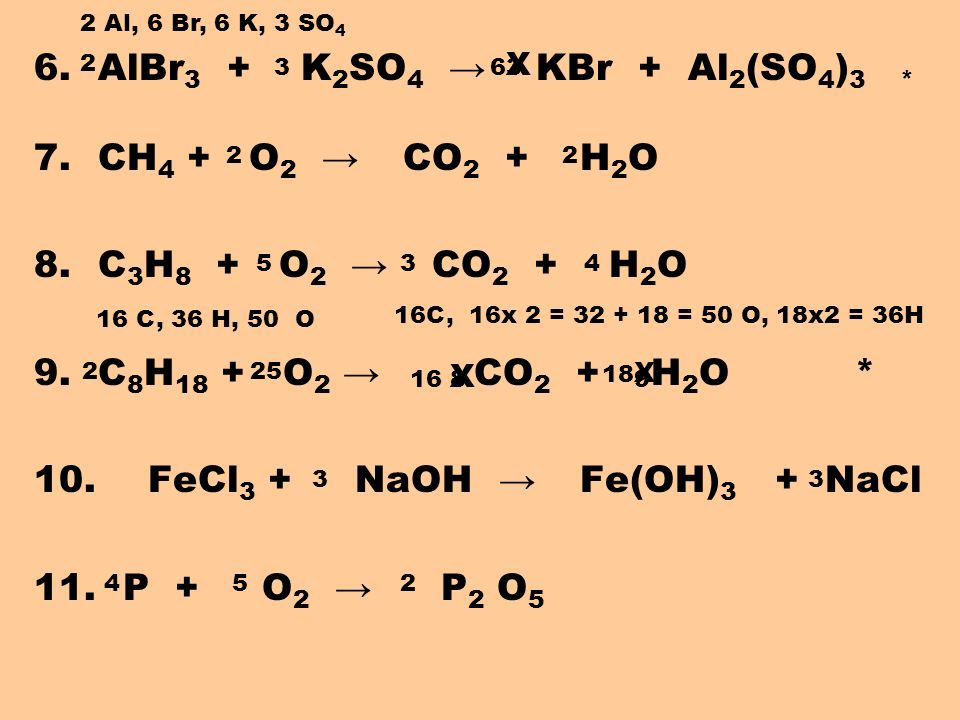 Розраховуємо масу розчину:
Розраховуємо масу розчину:
m(розчину)=m(HCl)+m(H2O)=18,25 г + 200 г=218,25 г
5. Обчислюємо масову частку кислоти в розчині за формулою:
ω(HCl)=m(HCl)/m(розчину)=18,25 г : 218,25 г=0,0836, або,
помноживши це значення на 100%, одержимо 8,36%
Відповідь: 8,36%
Вправа 14
До розчину натрій карбонату масою 200 г із масовою часткою солі 5,3% додали надлишок хлоридної кислоти. Обчисліть об’єм газу, що виділився (н.у.).
Відомо: m(розчину)=200 г, ω(Na2CO3)=5,3%
Знайти: V(CO2)-?
Розв’язування
1. З формули обчислення масової частки знаходимо масу розчиненої речовини.
m(Na2CO3)=m(розчину)•ω(Na2CO3):100%=200 г•5,3%:100%=10,6 г
2. Обчислюємо кількість речовини Na2CO3 масою 10,6 г за формулою n=m/M
Mr(Na2CO3)=2•Ar(Na)+Ar(C)+3•Ar(O)=2•23+12+3•16=106, тому М(Na2CO3)=106 г/моль
n(Na2CO3)=m(Na2CO3)/M(Na2CO3)=10,6 г : 106 г/моль=0,1 моль
3. Записуємо рівняння реакції: Na2CO3 + 2HCl=2NaCl + H2O + CO2↑
Записуємо рівняння реакції: Na2CO3 + 2HCl=2NaCl + H2O + CO2↑
За рівнянням реакції n(Na2CO3):n(CO2)=1:1, кількість речовини однакова, тому
n(CO2)=n(Na2CO3)=0,1 моль
4. Обчислюємо об’єм CO2 кількістю речовини 0,1 моль за формулою V=n•VM.
V(CO2)=n(CO2)•VM=0,1 моль•22,4 л/моль=2,24 л
Відповідь: 2,24 л
Вправа 15
Кальцій карбонат масою 0,5 кг обробили розчином нітратної кислоти. Обчисліть масу солі, що можна добути в такий спосіб.
Відомо: m(СаСО3)=0,5 кг=500 г
Знайти m(Са(NO3)2)-?
Розв’язування
І спосіб
1. Обчислюємо кількість речовини CaCO3 масою 500 г n=m/M, де M=Mr г/моль
Mr(CaCO3)=Ar(Ca)+Ar(C)+3•Ar(O)=40+12+3•16=100, тому М(CaCO3)=100 г/моль
n(CaCO3)=m(CaCO3)/M(CaCO3)=500 г : 100 г/моль=5 моль
2. Записуємо рівняння реакції:
Записуємо рівняння реакції:
CaCO3 + 2НNO3 = Ca(NO3)2 + H2O + CO2↑
За рівнянням реакції n(CaCO3):n(CO2)=1:1, кількості речовини однакові, тому
n(CO2)=n(CaCO3)=5 моль
3. Обчислюємо масу СО2 кількістю речовини 5 моль за формулою m=n•M
Mr(CO2)=Ar(C)+2•Ar(O)=12+2•16=44, тому М(CO2)=44 г/моль
m(CO2)=n(CO2)•M(CO2)=5 моль•44 г/моль=220 г
ІІ спосіб
Записуємо рівняння реакції:
CaCO3 + 2НNO3 = Ca(NO3)2 + H2O + CO2↑
За рівнянням реакції n(СaCO3)/1=n(CO2)/1
У цьому співвідношенні замінюємо кількість речовини кальцій карбонату і вуглекислого газу на співвідношення мас.
m(CaCO3)/М(CaCO3)=m(CO2)/M(CO2)
Звідси виражаємо масу вуглекислого газу:
m(СO2)•М(CaCO3)=М(CO2)•m(CaCO3), тому
m(CO2)=М(CO2)•m(CaCO3):M(CaCO3)
Обчислюємо молярні маси речовин і підставляємо значення у формулу.
Mr(CaCO3)=Ar(Ca)+Ar(C)+3•Ar(O)=40+12+3•16=100, тому М(CaCO3)=100 г/моль
Mr(CO2)=Ar(C)+2•Ar(O)=12+2•16=44, тому М(CO2)=44 г/моль
m(CO2)=44 г/моль • 500 г : 100 г/моль=220 г
Відповідь: 220 г
Вправа 16
Розчин масою 50 г з масовою часткою сульфатної кислоти 7,35 % змішали з розчином натрій гідроксиду. Отриманий розчин не змінює забарвлення лакмусу. Обчисліть масу солі в розчині.
Відомо: m(розчину)=50 г, ω(H2SO4)=7,35%
Знайти: m(Na2SO4)-?
Розв’язування:
1. З формули обчислення масової частки знаходимо масу розчиненої речовини:
m(H2SO4)=m(розчину)•ω(H2SO4):100%=50 г•7,35%:100%=3,675 г.
2. Обчислюємо кількість речовини H2SO4 масою 3,675 г за формулою n=m/M, де M=Mr г/моль
Mr(H2SO4)=2•Ar(H)+Ar(S)+4•Ar(O)=2•1+32+4•16=98, тому М(H2SO4)=98 г/моль
n(H2SO4)=m(H2SO4)/M(H2SO4)=3,675 г : 98 г/моль=0,0375 моль
3.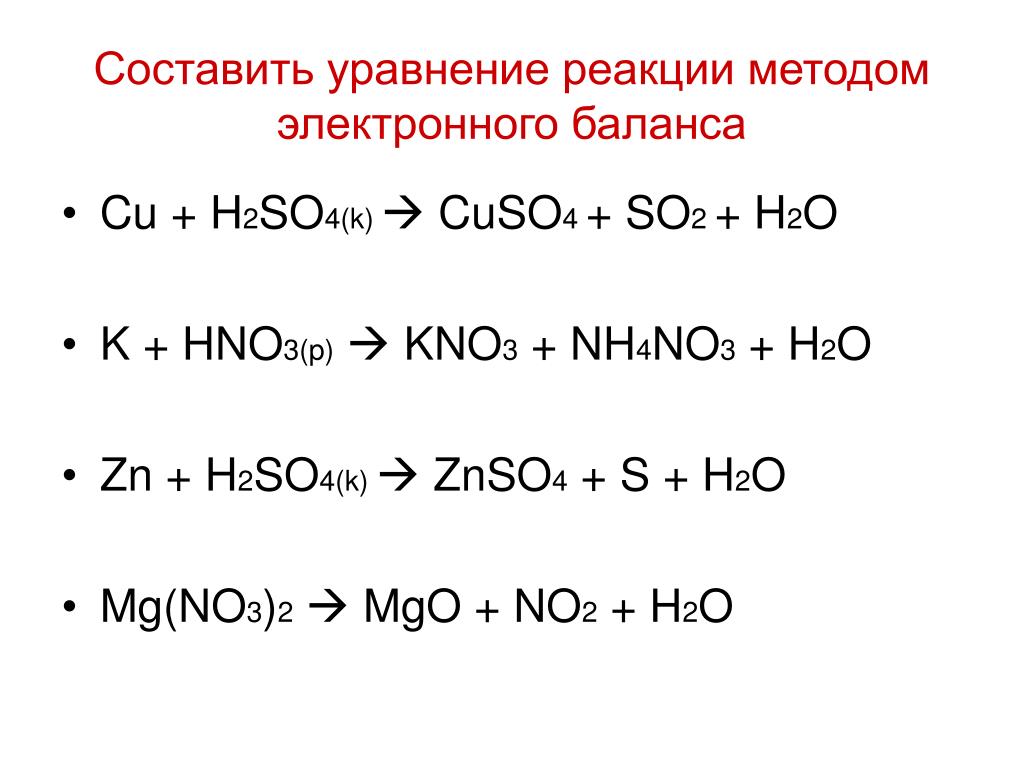 Записуємо рівняння реакції: H2SO4 + 2NaOH = Na2SO4 + 2H2O
Записуємо рівняння реакції: H2SO4 + 2NaOH = Na2SO4 + 2H2O
За рівнянням реакції n(H2SO4):n(Na2SO4)=1:1, кількості речовини однакові, тому
n(Na2SO4)=n(H2SO4)=0,0375 моль
4. Обчислюємо масу Na2SO4 кількістю речовини 0,0375 моль за формулою m=n•M
Mr(Na2SO4)=2•Ar(Na)+Ar(S)+4•Ar(O)=2•23+32+4•16=142, тому М(Na2SO4)=142 г/моль
m(Na2SO4)=n(Na2SO4)•M(Na2SO4)=0,0375 моль•142 г/моль=5,325 г
Відповідь: 5,325 г
Інші завдання дивись тут…
(+2) ионыВопрос
Вопрос
БЕЗ ОШИБОК -ИОННОЕ РАВНОВЕСИЕ-Обыкновенное мышление (Общий ионный эффект, Изогидрические растворы, Продукт растворимости, Ионный продукт гидролиза воды и соли)
20 видеоAbhaika
2 РЕКЛАМА
2 бина объявления ке Khareedo DN Pro и дехо сари видео бина киси объявление ки rukaavat ке!
Обновлено: 27 июня 2022 г.
Текстовое решение
Ответ
Правильный ответ C 9(+2) раствор запустится при добавлении H_(2)SO_(4) концентрации
261016336
Текст Раствор
Водный раствор содержит неизвестную концентрацию Ba2+. При добавлении 50 мл 1М раствора Na2SO4. BaSO4 только начинает выпадать в осадок. Конечный объем 500мл. Произведение растворимости BaSO4 равно 1×10–10. Найдите исходную концентрацию.
344167127
Text Solution
Водный раствор содержит Ba2+ неизвестной концентрации. При добавлении 50 мл 1 М раствора Na2SO4 BaSO4 сразу начинает выпадать в осадок. Конечный объем 500 мл. Произведение растворимости BaSO4 равно 1×10–10. Какова исходная концентрация Ba2+? 9(-9) . Найти растворимость BaSO_(4) в 0,1 М BaCl_(2)
644660471
Отдельные растворы Ba(OH)2 и h3SO4 оба проводят электрический ток…
Отдельные растворы Ba(OH)2 и h3SO4 оба проводят электрический ток … | Каналы для Пирсона+ Недавние каналы
- Общая химия
Химия
- Общая химия
- Органическая химия
- Аналитическая химия
- 9
- Аналитическая химия
- 9
- Аналитическая химия
- 9
- .
 0109 Biochemistry
0109 Biochemistry
Biology
- General Biology
- Microbiology
- Anatomy & Physiology
- Genetics
- Cell Biology
Math
- College Algebra
- Trigonometry
- Precalculus
Physics
- Physics
Бизнес
- Микроэкономика
- Макроэкономика
- Финансовый учет
Социальные науки
- Психология
Начните печатать, затем используйте стрелки вверх и вниз, чтобы выбрать вариант из списка.
Общая химия6. Химические количества и водные реакции Электролиты
1:39
минут
Задача 64
Вопрос из учебника
Проверенные решения
Наши преподаватели рекомендовали это видео-решение как полезное для решения указанной выше задачи.
182просмотра
Было ли это полезно?
Смотреть дальше
Мастер Категории электролитов с кратким видео-объяснением от Жюля Бруно
Начать изучение
Похожие видео
Связанные практики
Что такое электролиты?
Объяснения профессора Дэйва
183views
Оценка электролитов и неэлектролитов
Pearson
125views
ХИМИЯ 101 — Растворы электролитов и неэлектролитов
30003
174просмотра
Категории электролитов
Жюль Брюно
262просмотра
Химия 9.

 0109 Biochemistry
0109 Biochemistry


 ) + SO4-2 (водн.) = BaSO4 (с) + Н2 (Г)
) + SO4-2 (водн.) = BaSO4 (с) + Н2 (Г)